-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Atypická forma Goodpastureovy nemoci
Atypical form of Goodpasture’s disease
Goodpasture’s disease and anti-glomerular basement membrane nephritis (anti-GBM nephritis) are rare autoimmune small vessel vasculitis predominantly affecting young men. Goodpasture’s disease plays an important part in differential diagnosis of pulmonary – renal syndrome. The evidence of circulating autoantibodies, a typical histological appearance of the kidney biopsy with finding of the crescent glomerulonephritis and clinical presentation of nephritic syndrome play an important role in diagnosis. Our case report describes a case of a young male with anti-GBM nephritis that presents as rapidly progressive glomerulonephritis (RPGN) with progression to dialysis-dependent renal failure. The atypical sign of the case was development of nephrotic syndrome with volume-dependent hypertension. The case was complicated by heparin-induced thrombocytopenia. During combined immunosuppressive therapy with plasmapheresis, the condition of the patient has stabilized. However, renal function did not recover. This previously fatal disease has nowadays a very good survival rate because of immunosuppresion therapy, plasmapheresis and hemodialysis.
Keywords:
plasmapheresis – immunosuppression – anti-GBM nephritis – Goodpasture’s disease – nephritic syndrome – rapidly progressive glomerulonephritis
Autori: Michaela Habánová 1,4; Petra Divácká 2,4; Jitka Řehořová 2,4; Iva Svobodová 3,4
Pôsobisko autorov: Interní hematologická a onkologická klinika, Fakultní nemocnice Brno 1; Interní gastroenterologická klinika, Fakultní nemocnice Brno 2; I. ústav patologie, Fakultní nemocnice u sv. Anny, Brno 3; Lékařská fakulta, Masarykova univerzita, Brno 4
Vyšlo v časopise: Vnitř Lék 2023; 69(5): 316-321
Kategória: Kazuistiky
doi: https://doi.org/10.36290/vnl.2023.062Súhrn
Goodpastureova nemoc a glomerulonefritida s pozitivitou anti-GBM protilátek (protilátky proti glomerulární bazální membráně) patří mezi vzácné autoimunitní vaskulitidy malých cév postihující převážně mladé muže. Zaujímá důležité místo v rámci diferenciální diagnostiky pulmorenálního syndromu. V diagnostice hraje zásadní roli průkaz cirkulujících autoprotilátek, typický histologický obraz biopsie ledviny s nálezem srpkovité glomerulonefritidy a klinický obraz nefritického syndromu. Naše kazuistika popisuje případ mladého pacienta s anti-GBM nefritidou charakteru rychle progredující glomerulonefritidy (rapidly progressive glomerulonephritis, RPGN) s progresí do terminálního renálního selhání dependentního na dialýze. Netypicky došlo ke vzniku nefrotického syndromu s volum-dependentní hypertenzí. Případ byl komplikován rozvojem heparinem indukované trombocytopenie. Při kombinované imunosupresivní terapii s plazmaferézou se stav stabilizoval. K obnově renálních funkcí ale již nedošlo. Toto dříve fatální onemocnění má v dnešní době díky imunosupresivní terapii, plazmaferéze a hemodialyzačním metodám velmi dobrou prognózu přežití.
Klíčová slova:
imunosuprese – plazmaferéza – anti -GBM nefritida – Goodpastureova nemoc – nefritický syndrom – rychle progredující glomerulonefritida
Úvod
Glomerulonefritida (GN) s pozitivními protilátkami proti bazální membráně glomerulů (anti-GBM nefritida, antirenální nefritida) je vzácné autoimunitní onemocnění s roční incidencí 0,5–1 případů na milion obyvatel. Řadíme ji mezi RPGN, z nichž zaujímá 10–15 %. Z observačních studií vyplývá, že se anti-GBM nefritida vyskytuje dominantně u mužů ve třetí dekádě s projevy postižení plic i ledvin. Druhým vrcholem je šestá dekáda, kdy se obvykle projeví jen postižením ledvin (1). Poprvé byl syndrom renálního selhání a plicních hemoragií popsán americkým lékařem Ernestem Goodpasturem v roce 1919 (2). V případě současného postižení ledvin a plic hovoříme o Goodpastureově nemoci. Termínem Goodpastureův syndrom je označována skupina glomerulonefritid charakteru RPGN s plicními hemoragiemi jakékoli geneze např. i u systémového lupusu, Behcetovy nemoci, revmatoidní artritidy a dalších (3). Patogenetický mechanismus představují autoprotilátky proti kolagenu IV bazální membrány glomerulů (glomerular basement membrane, GBM) a alveolů plic. Spektrum projevů onemocnění je různorodé. Zahrnuje jednak minoritní a méně agresivní formu s dobrou funkcí ledvin, lehkou hematurií a proteinurií bez plicního poškození, ve většině případů se však prezentuje jako RPGN a v 50–75 % bývá doprovázená plicní hemoragií. U pacientů s typickým obrazem antirenální nefritidy nebo Goodpastureovy nemoci lze detekovat anti-GBM protilátky ve třídě IgG metodou ELISA. Nezbytný krok v diagnostice představuje biopsie ledviny. Zde světelnou mikroskopií prokážeme typický histologický obraz. Tím je v závislosti na časnosti odběru vzorků segmentální až difuzní proliferativní glomerulonefritida se srpky, nekrózami, případně až glomerulosklerózou či intersticiální fibrózou. K potvrzení definitivní diagnózy pak slouží imunofluorescence s průkazem lineární pozitivity IgG podél GBM (1, 3).
Z povahy onemocnění vyplývá, že základem terapie je imunosupresivní léčba v kombinaci s plazmaferézou. Při renálním selhání je nutné přistoupit k náhradám funkce ledvin. Cílem léčby je odstranění cirkulujících protilátek a prevence tvorby nových. V iniciální fázi jsou u všech indikovány glukokortikoidy, cyklofosfamid a provedení plazmaferézy. Léčba by měla být zahájena časně již při podezření na anti-GBM glomerulonefritidu v průběhu prvních 24 hodin bez ohledu na dostupnost výsledku biopsie. Výjimku z imunosuprese představují případy, kdy jsou již glomeruly postiženy z více než 85 % srpky anebo nad 50 % glomerulosklerózou a současně nedošlo k plicnímu poškození. Dále nemá intenzivní imunosuprese opodstatnění při plně rozvinutém selhání ledvin a probíhající hemodialýze (4).
Observační studie ukazují, že restituce renálních funkcí je méně pravděpodobná, pokud je už v počátku nemoci přítomna oligurie s nutností hemodialýzy, dále při hladině kreatininu nad 500 μmol/l a při přítomnosti velkého počtu srpků v histologickém vyšetření. U pacientů s iniciálně nezbytnou hemodialýzou byla schopnost zotavení renálních funkcí jen 8 %. U pacientů s terminálním renálním selháním lze přistoupit k transplantaci ledviny při minimálně 6 měsíců trvající séronegativitě. V opačném případě hrozí relaps s rizikem rejekce štěpu až v 50 % případů (5).
Kazuistika
Devětatřicetiletý muž byl odeslán praktickým lékařem na ambulanci urgentního příjmu Fakultní nemocnice Brno pro 10 dnů trvající otoky dolních končetin, přírůstek na váze 5 kg a námahovou dušnost. Doposud se s ničím neléčil, neužíval žádnou chronickou medikaci. Neudával také užívání analgetik ani výživových doplňků a v pracovním prostředí nebyl exponován inhalačním toxinům. Anamnesticky přiznával abúzus 20 cigaret denně po dobu více než 10 let. Při klinickém vyšetření byly patrné bilaterální otoky dolních končetin do úrovně kolen bez jiných známek kongesce. Z hodnot vitálních funkcí dominovala arteriální hypertenze 180/90 mm Hg. Ve vstupních laboratorních odběrech byla patrná elevace dusíkatých látek, urea 16 mmol/l a kreatinin 444 μmol/l, snížená celková bílkovina 56 g/l a albumin 28 g/l. V močovém sedimentu byla přítomnost bílkoviny i erytrocytů 3 arb. j., ostatní laboratorní parametry byly v normě. Pacient byl přijat k došetření na interní kliniku. Vzhledem k hodnotám dusíkatých látek byl doplněn ultrazvuk břicha včetně urotraktu a při údaji o námahové dušnosti byl proveden zadopřední rentgenový snímek hrudníku. Obě zobrazovací vyšetření neprokázala patologické nálezy. Dalším vyšetřením byla zjištěna proteinurie 14 g/24 hod., hraniční hladina cholesterolu 5 mmol/l a vyšší hodnota triacylglycerolu 2,0 mmol/l. Dle dostupných anamnestických, laboratorních i zobrazovacích vyšetření byla stanovena pracovní diagnóza neoligurického akutního renálního selhání de novo s nefrotickým syndromem. Pro arteriální hypertenzi byla zahájena kombinovaná terapie (perindopril, nitrendipin a doxazosin). Dále byla podávána diuretická terapie a profylaxe tromboembolické nemoci nadroparinem. Při terapii furosemidem byla diuréza zachována v objemu 2750 ml/24 h. Po úspěšné korekci tlaku byla bez komplikací provedena renální biopsie. Histologické vyšetření vzorku prokázalo difuzní floridní srpkovitou glomerulonefritidu (Obr. 1, 2).
Obr. 1. Kolabovaný glomerulární kapilární trs pod celulárním srpkem (stříbření, zvětšení 400×), archiv autorů 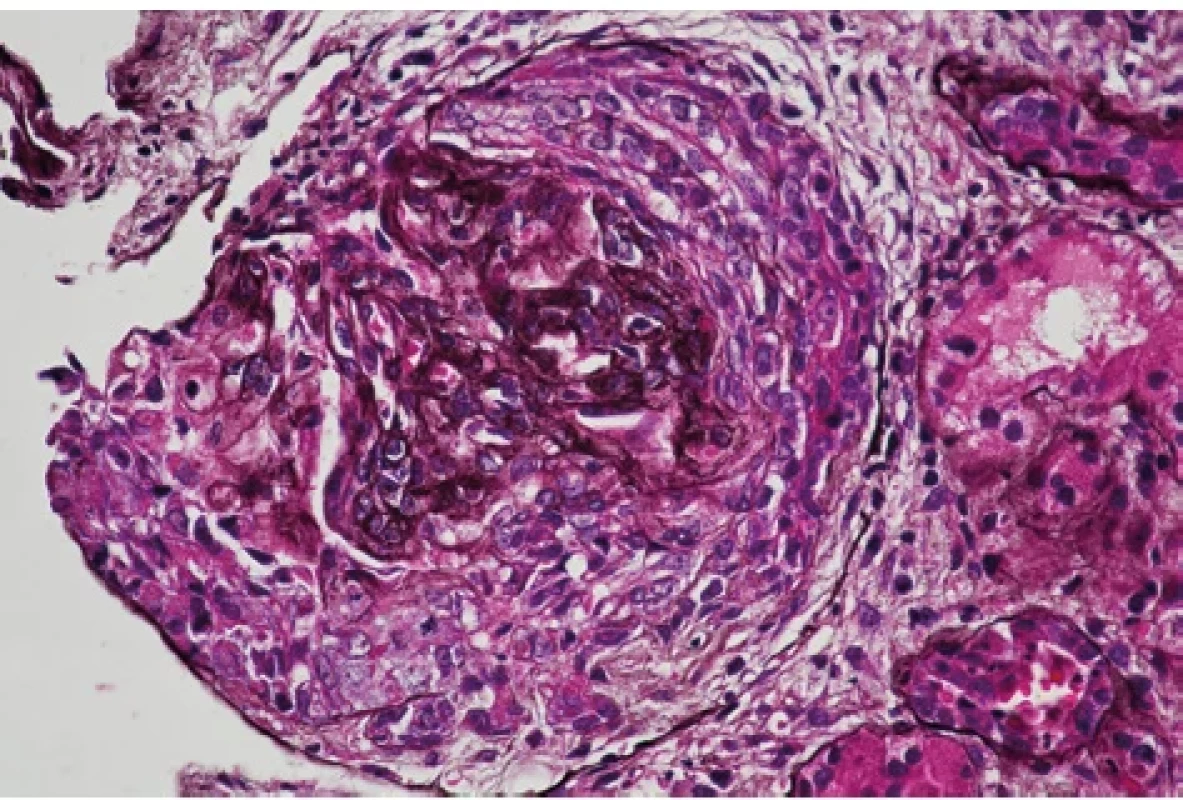
Obr. 2. Okludující srpek a pod ním zaniklý glomerulus (barvení PA, zvětšení 200×), archiv autorů 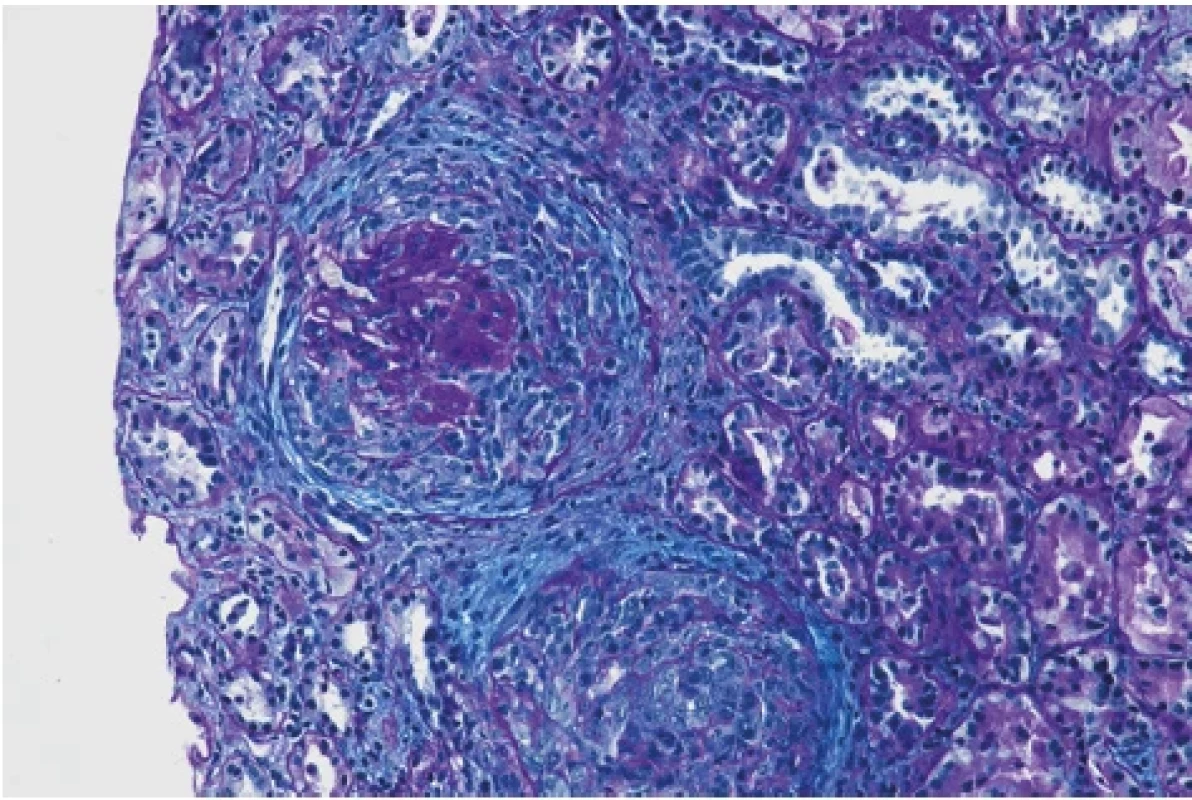
Biopsií bylo zachyceno celkem 16 glomerulů, z toho 2 globálně zaniklé. V 12 glomerulech byl přítomen okludující celulární srpek a byla zachycena fokálně segmentálně fibrinoidní nekróza kapilárních trsů. Ve vyšetřovaném vzorku byla přítomna fibróza intersticia do 20 %. Tubuly byly bez atrofie s ložisky mírné dilatace s odloupanými epiteliemi a simplifikací epitelu, tedy obrazem akutní tubulární nekrózy. Průkaz cévních změn, jakožto zesílení stěny, byl v oblasti arteriol. Imunofluorescenční vyšetření potvrdilo lineární depozita IgG podél GBM (Obr. 3). V krvi byly detekovány anti-GBM protilátky s hodnotou 28 U/ml (norma do 20), ANA screening byl pozitivní s titrem 200. Ostatní protilátky (ANCA, ENA, ACLA, APLA2R, dsDNA, anti-β2GP1) byly negativní. V rámci screeningu infekce před zahájením imunosuprese absolvoval pacient sérologické vyšetření hepatitid, HIV a CMV s negativním výsledkem. V dalších krocích byl doplněn transtorakální ultrazvuk srdce a ultrazvuk renálních tepen, které neprokázaly patologii. Oční vyšetření ukazovalo na obraz hypertenzní angiosklerózy. CT (computed tomography) vyšetření hrudníku zobrazilo bilaterální difuzní centrilobulární denzity mléčného skla (Obr. 4) jako nespecifický nález, který by mohl nasvědčovat poškození alveolu s obrazem difuzní alveolární hemoragie (DAH). Proto bylo doplněno komplexní plicní vyšetření včetně spirometrie, bodypletysmografie a CO-difuze, vše s fyziologickým výsledkem. Bronchoskopické vyšetření prokázalo fyziologický nález sliznice s lehce zvýrazněnou cévní kresbou bez makroskopického obrazu krvácení. Analýza buněk z bronchoalveolární laváže (BAL) však potvrdila přítomnost 96 % makrofágů, z toho 55 % siderofágů, tedy nález svědčící pro DAH (Obr. 5). Po rychlém stanovení definitivní diagnózy z biopsie a pozitivity protilátek byla zahájena kombinovaná imunosupresivní terapie. Celkem byly podány tři pulzy metylprednisolonu, každý v dávce 750 mg i.v., s následným převodem na per os formu 80 mg prednisonu denně a postupnem snižováním dávky v následujících týdnech. Za hospitalizace byl podán 1. pulz cyklofosfamidu v dávce 1200 mg. Nutná byla redukce dávky na 12,5 mg/kg s ohledem na hladinu kreatininu. Podávání proběhlo standardně s uroprotekcí preparátem mesna. Dále byla indikována plazmaferéza. Celkem bylo provedeno 5 výměnných plazmaferéz v denním režimu, s průměrným objemem výměny 5234 ml plazmy, tedy 1,25× TPV (total plasma volume) pacienta. Substitučním roztokem byl zvolen 5% albumin a směsná lidská plazma. Při 1. plazmaferéze byl poměr substitučních roztoků 1 : 1 vzhledem k hypoalbuminemii. Po první plazmaferéze došlo k poklesu fibrinogenu, a proto bylo nutné navýšení substitučního roztoku plazmy. V průběhu imunosupresivní léčby byla podávána antibiotická profylaxe pneumocystové pneumonie co-trimoxazolem. I přes kombinovanou léčbu s plazmaferézou dochází k progresi renálních parametrů (urea 33 mmol/l, kreatinin 670 μmol/l) a nutnosti provedení první akutní hemodialýzy. Další průběh komplikuje rozvoj heparinem indukované trombocytopenie (HIT) 2. typu při poklesu hladiny trombocytů z původních 131 × 109/l na 58 × 109/l. HIT byla stanovena screeningem protilátek IgG proti komplexu heparinu a destičkového faktoru 4 (metoda ELISA-HIT). Dále konfirmační vyšetření potvrdilo HIT excesivní agregací trombocytů v přítomnosti heparinu. Již po pozitivitě screeningu HIT byl nadroparin nahrazen pentasacharidem fondaparinuxem. Vyloučena byla žilní trombóza dolních končetin kompresní ultrasonografií jakožto častá komplikace HIT. Pro trombocytopenii bylo nutné odložit 2. pulz cyklofosfamidu a redukovat jeho dávku na 10 mg/kg, tzn. celkem bylo podáno 1000 mg. Po vysazení nízkomolekulárního heparinu a redukci cyklofosfamidu došlo k postupnému nárůstu trombocytů se stabilizací hodnot. Progredující retence dusíkatých katabolitů a známky hyperhydratace vedly k zavedení pravidelné intermitentní hemodialýzy 3× týdně. Následující dny hospitalizace již byly bez komplikací. Pacient byl propuštěn po 26 dnech s nastavenou chronickou medikací zahrnující prednison v redukčním schématu, antihypertenziva (perindopril, nitrendipin, urapidil a doxazosin), dále furosemid, antikoagulační profylaxi fondaparinuxem, co-trimoxazol, omeprazol, atorvastatin a podpůrnou terapii (vitamin D, vápník, kyselina listová, vitaminy skupiny B, esenciální aminokyseliny). Dispenzarizace pokračovala v nefrologické ambulanci s podáváním 3.–6. cyklu cyklofosfamidu v dávce 1 110 mg (redukce dávky na 12,5 mg/kg) každé 3 týdny. Postupně byly redukovány glukokortikoidy na nutnou udržovací dávku při plicním postižení 2,5 mg prednisonu denně. Pacient byl nadále dependentní na hemodialýze bez schopnosti restituce renálních parametrů a dusíkaté katabolity se po 12 měsících od diagnózy pohybovaly na hodnotách urea 22 mmol/l, kreatinin 1130 μmol/l. S ohledem na neustupující hyperhydrataci trvala nutnost vyšších ultrafiltrací v průběhu hemodialýz. Tím došlo k rychlejší ztrátě diurézy, která byla na podpoře vysokodávkovaným furosemidem pouze 600 ml/den. V pravidelných odběrech jsou patrné změny charakteristické pro chronické renální selhání, a to anémie (stabilní hodnoty 100–120 g/l), sekundární hyperparatyreóza (PTH 23 pmol/l, cut off 1,6–6) a hyperfosfatemie 1,86 mmol/l. Hladina trombocytů kolem 150 × 109/l se již stabilizovala. Dále je pacient sledován v ambulanci pro intersticiální plicní procesy. Kontrolní zobrazovací i funkční vyšetření plic byla bez zhoršení nálezu. Od stanovení diagnózy už pacient nekouřil. Pro nevratné selhání ledvin u mladého pacienta bylo zahájeno vyšetřování před zařazením na čekací listinu k transplantaci ledviny. Při trvající negativitě anti-GBM protilátek byl zařazen po 10 měsících od stanovení diagnózy na čekací listinu. Transplantaci kadaverózní ledviny následně podstoupil bez komplikací.
Obr. 3. Lineární závojovitá pozitivita IgG na GBM (imunofluorescence), archiv autorů 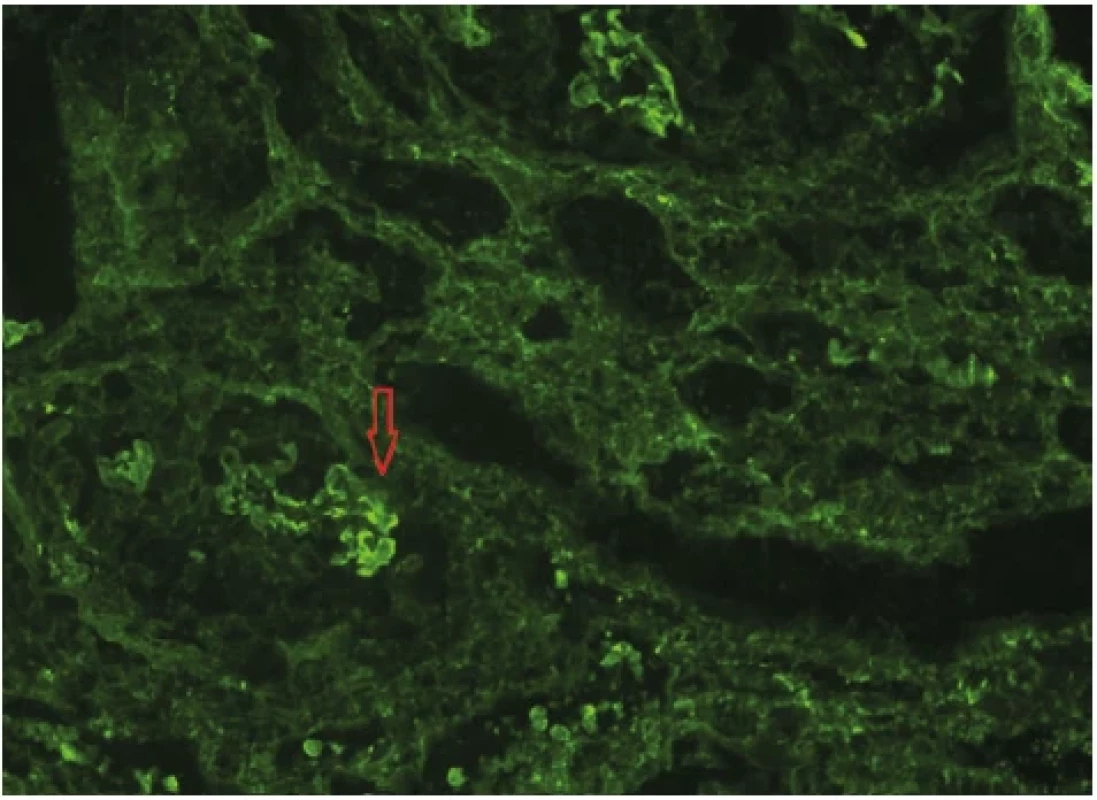
Obr. 4. CT hrudníku – bilaterálně difuzní centrilobulární denzity mléčného skla, transverzální řez – úroveň Th7 (se svolením Kliniky radiologie a nukleární medicíny, FN Brno, MUDr. R. Bárta) 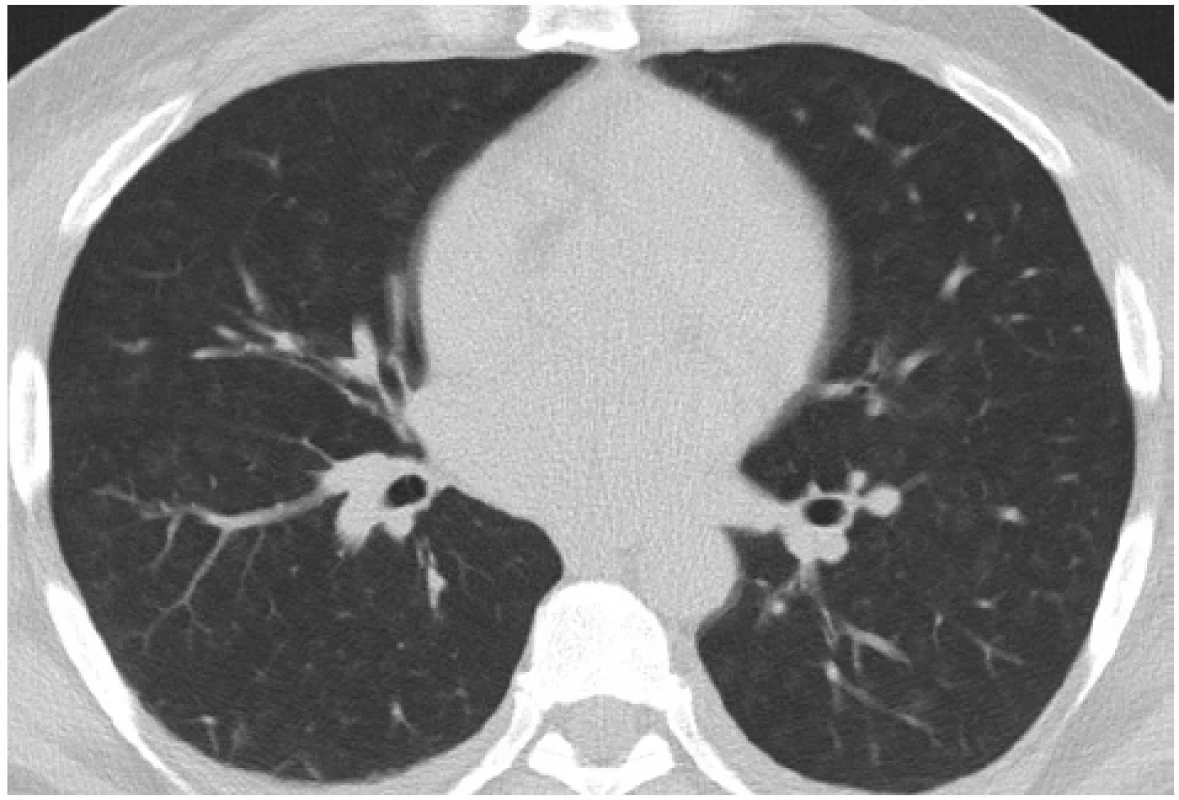
Obr. 5. Nález siderofágů v bronchoalveolární tekutině, barvení May Grünwald Giemsa, zvětšení 100× (se svolením Ústavu patologie, FN Brno, MUDr. V. Kubeš) 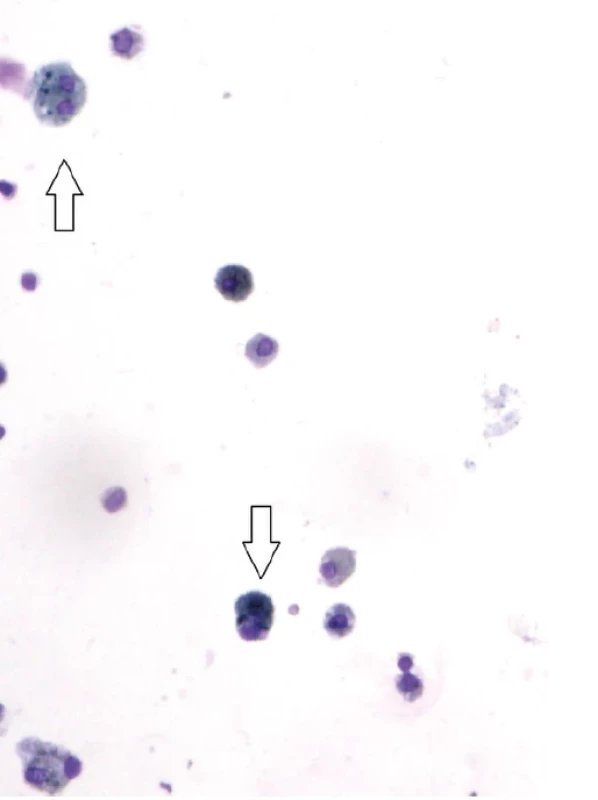
Tab. 1. Dynamika laboratorních a klinických parametrů pacienta 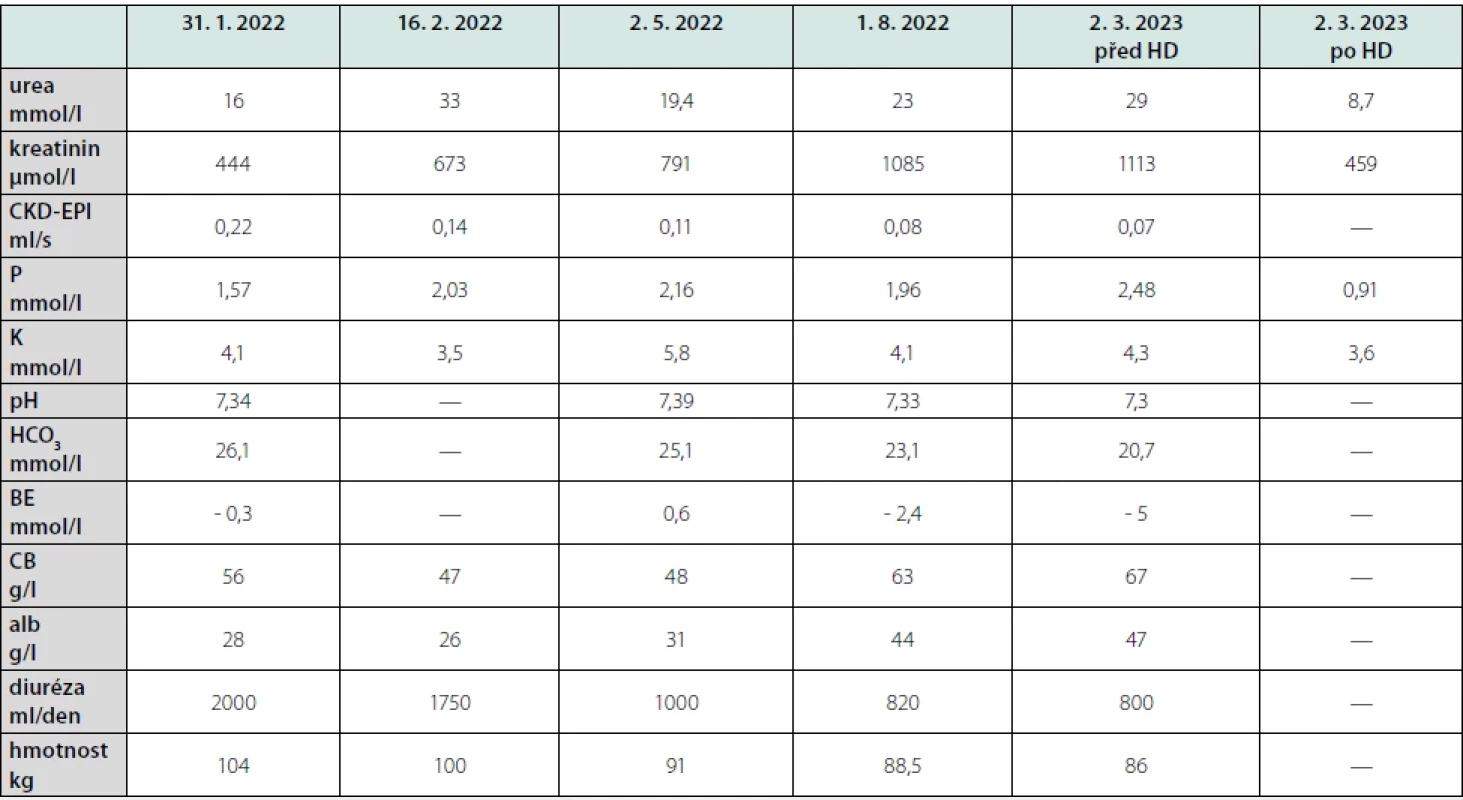
HD – hemodialýza, BE – base excess, CB – celková bílkovina, alb – albumin Diskuze
Goodpastureova nemoc se projevuje glomerulonefritidou charakteru RPGN s nefritickým syndromem a plicními hemoragiemi. Nefritický syndrom je způsobený intraglomerulárním zánětem. Ten vede k poškození GBM a následně i glomerulů. Důsledkem je hematurie a proteinurie. Popisovaná kazuistika ukazuje na atypický průběh, kdy se významnost proteinurie prezentovala nefrotickým syndromem. Ten dále zahrnuje hypoproteinemii, hyperlipidemii a otoky. Dalším atypickým příznakem onemocnění bylo jen mírné postižení plic a také hypertenze. Ta byla volum-dependentní při hyperhydrataci. Její významnost byla nepřímo závislá na míře ultrafiltrace.
Iniciálně bylo v rámci diferenciální diagnostiky dušnosti a otoků dolních končetin pomýšleno především na srdeční a renální selhání. Odlišení jednotlivých typů kardiorenálního syndromu je často nesnadné. K průkazu primárně renální etiologie nás navedou kromě anamnestických údajů především normální výsledky elektro a echokardiografie s relativně nízkými hodnotami natriuretických peptidů. Zde je nutno počítat s jejich vyšší hodnotou pro renální eliminaci. V prvním kroku vylučujeme široké spektrum reverzibilních příčin akutního renálního selhání prerenální a postrenální etiologie. Po klinickém vyšetření pokračujeme v dalších krocích ultrazvukem močových cest. Dále pak provádíme laboratorní odběry, zvláště dusíkaté katabolity, mineralogram, acidobázi, vyšetření moči biochemicky, močového sedimentu a kvantifikaci proteinurie. Po vyloučení nejčastějších příčin akutního selhání ledvin zvažujeme i možnou glomerulonefritidu. Při suspekci na RPGN cíleně pátráme po známkách plicní složky onemocnění. Rozšířenou diagnostiku v případě pulmorenálního syndromu pak tvoří vyšetření protilátek, složek komplementu, CT vyšetření plic a bronchoskopie. Úskalí v diagnostickém procesu může nastat v případě izolovaného nebo nedostatečně rozvinutého plicního nebo renálního postižení.
Z diagnostických autoprotilátek lze detekovat anti-GBM protilátky. Přítomnost protilátek je zásadní v časné diagnostice a možnosti zahájení léčby. Titr protilátek v době diagnostiky koreluje s prognózou. Také remise i případný relaps jsou detekovatelné právě na dynamice titru protilátek. Detekce nízkého titru může být u pacientů s izolovaným plicním postižením nebo v nejčasnější fázi renálního onemocnění. U 10 % pacientů bývají protilátky negativní a diagnostika je stanovena na základě klinického obrazu a imunohistologie (6). Tzv. dvojitá pozitivita protilátek, tj. anti-GBM a ANCA (anti-neutrophil cytoplasmic antibody, protilátky proti cytoplazmě neutrofilů) je přítomná u 1/3 pacientů. Zde je charakter úvodních projevů renálního selhání s plicními hemoragiemi příznačný pro anti-GBM nefritidu. Dále však nese i znaky typické pro ANCA vaskulitidy, tedy vyšší věk, delší systémové prodromy, vyšší šanci renální reparace, ale i riziko relapsu (7, 8).
Podezření na RPGN je indikací k provedení renální biopsie. Bioptickým vyšetřením vzorku prokazujeme typický histologický obraz srpkovité GN. Na základě imunofluorescenčního vyšetření poté rozlišujeme několik typů RPGN, a to anti-GBM onemocnění s lineárními depozity IgG podél GBM, pauciimunní ANCA vaskulitidy s minimem nebo zcela chybějícími depozity a imunokomplexové s granulárními depozity (postinfekční etiologie nebo při onemocnění pojiva). Při pokročilém stadiu glomerulárního zánětu může být architektonika glomerulu natolik poškozená, že světelná mikroskopie zobrazí jen nekrózu a imunofluorescenční vyšetření bioptického vzorku neprokáže žádná lineární depozita (3, 9).
Při poškození plicního parenchymu se na rentgenovém snímku hrudníku zobrazí nespecifické bilaterální retikulární opacity a jejich kompletní obraz se rozvíjí v průběhu 2–3 týdnů. Specifičtější zobrazovací metodou je CT. Zde při známkách alveolárního poškození pozorujeme tzv. opacity mléčného skla (ground glass opacity, GGO). Zánětlivé poškození plic vede k DAH s přítomností krve v alveolu prokazatelné bronchoalveolární laváží. V průběhu několika dnů dochází k akumulaci hemosiderinem naplněných makrofágů v intersticiu, tzv. siderofágů, s charakteristickým obrazem na CT hrudníku, tzv. crazy paving neboli obraz dláždění netříděným kamenem (1, 10).
Diagnostika musí být provedena časně z důvodu možné rychlé progrese nemoci, a tím ovlivnění prognózy pacienta. V léčbě představuje účinnou metodu v odstranění autoprotilátek plazmaferéza. Ta vede v průběhu několika týdnů ke kompletní eliminaci protilátek. Nevýhodou je neselektivní odstranění všech plazmatických složek s nutností jejich substituce a aktivace komplementu při kontaktu s umělým povrchem. To může při vysoké frekvenci plazmaferéz spolu s imunosupresí vést ke vzniku těžkých oportunních infekcí. Další nevýhodou je schopnost odstranit jen cirkulující protilátky, přičemž zánětlivý proces probíhá hlavně ve tkáních. Proto nemusí dojít k dostatečnému potlačení zánětu a z toho vyplývá i nutnost použití kombinované imunosupresivní terapie ke zvýšení efektu. I přes relativní nevýhody plazmaferézy je tato metoda extrémně účinná v porovnání mortality před jejím zavedením do praxe, která činila 96 %. Dle observačních studií je nyní 5leté přežití u více než 90 % pacientů, kteří jsou včas adekvátně léčeni (4, 7, 11, 12).
V případě anti-GBM nefritidy jsou indikovány denní plazmaferézy po dobu 2–3 týdnů, eventuálně do vymizení pozitivity autoprotilátek. V naší kazuistice bylo provedeno jen 5 plazmaferéz s ohledem na nepříznivý nález v renální biopsii (postižení 75 % glomerulů okludujícími srpky) a progredující renální dysfunkci s nutností zahájení dialyzační léčby při nevýznamném plicním postižení. Kontrolní vyšetření titru protilátek bylo provedeno až s odstupem 1 měsíce po ukončení plazmaferéz. Standardem je kontrola titru časněji již v průběhu plazmaferéz. Ta by však zde nevedla ke změně postupu. V současné době je doporučována kombinace vysokodávkovaných kortikosteroidů v kombinaci s p. o. cyklofosfamidem. U našeho pacienta byla zvolena pulzní léčba i. v. cyklofosfamidem z důvodu menší kumulativní dávky, a tak i nižšího rizika hematotoxicity při cytopenii.
Potenciálně novou léčbu představuje imlifidáza (IdeS = Immunoglobulin G Degrading Enzyme of Streptococcus pyogenes). Tato vysoce specifická endopeptidáza bakterie Streptococcus pyogenes štěpí všechny podtypy IgG. Mechanismem účinku je porušení vazby Fc fragmentu IgG na GBM jako kauzálního mechanismu renálního poškození. Ve studiích byla prokázána účinnost této molekuly u pacientů bez plicního postižení refrakterních na konvenční terapii a dependentních na hemodialýze i po několika plazmaferézách. Zde po aplikaci došlo k eliminaci anti-GBM protilátek z cirkulace do 2–6 hodin po podání. Právě použití imlifidázy by mohlo zefektivnit konvenční terapii a rozšířit možnosti v léčbě refrakterních onemocnění (13, 14).
U refrakterního onemocnění, s incidencí do 10 %, je záchrannou terapií rituximab. Významnou roli může sehrávat u dvojitě pozitivních pacientů, kdy svou buněčně i komplement mediovanou cytotoxicitou efektivněji suprimuje tvorbu ANCA protilátek. Rituximab je odstraňován plazmaferézou, proto je důležité podání správně načasovat ve vztahu k plazmaferéze (15, 16).
U anti-GBM nefritidy bez plicního postižení s negativitou autoprotilátek po dobu alespoň 6 měsíců již není další udržovací imunosuprese nutná. Relaps onemocnění je vzácný, avšak možný především při pokračujícím kouření či u trvající expozice inhalačním toxinům (4).
Závěr
Kazuistika představuje případ relativně vzácného onemocnění, na které je nutno pomýšlet v případě pulmorenálního syndromu nebo nejasného renálního selhání. Časná diagnostika i léčba jsou pro prognózu pacienta zcela zásadní, a proto musí být zařazeno do diferenciální diagnostiky. Z diagnostických metod je nutné provést vyšetření autoprotilátek (anti-GBM, ANCA) ve statimovém režimu, které jsou již v dnešní době běžně dostupné. Onemocnění je charakteristické rychlou progresí, prezentuje se nefritickým syndromem a v naprosté většině případů při odstranění rizikových faktorů nerelabuje. Hlavním cílem léčby je stabilizace onemocnění, odstranění již přítomných protilátek a zabránění tvorby nových. Imunosuprese není v současné době schopna vrátit nebo zlepšit již proběhlé renální poškození. Nadějí může být kombinace nového preparátu imlifidázy a dostupných metod odstraňujících protilátky spolu s konvenční imunosupresí. Tato dříve infaustní diagnóza má nyní díky dostupné léčbě dlouhodobé přežití až u 90 % pacientů a v indikovaných případech umožňuje i zařazení do transplantačního programu.
MUDr. Michaela Habánová
Interní hematologická a onkologická klinika, FN Brno
habanova.michaela@fnbrno.cz
Zdroje
- Cui Z, Turner AN, Zhao MH. Antiglomerular basement membrane disease: Overview, clinical features and diagnosis, treatment and outcomes. In: Turner AN, et al, (eds). Oxford Textbook of Nephrology. 4th ed. Oxford: Oxford University Press;2015 : 598-608.
- Goodpasture EW, The significance of certain pulmonary lesions in relation to the etiology of influenza. Am J Med Sci. 1919;158(6);863-870. Available from: DOI: <https://doi. org/10.1097/00000441-191911000-00012>.
- Feehally J, Floege J, Tonelli M, et al. Comprehensive Clinical Nephrology. In: Floege J, (eds) et al. 6th ed. Elsevier Inc: Edinburgh 2019 : 281–289. ISBN 978-0-323-47909-7.
- Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group (2021). KDIGO 2021 Clinical Practice Guideline for the Management of Glomerular Diseases. Kidney international, 100(4S), S1-S276. Available from: DOI: <https://doi.org/10.1016/j.kint.2021.05.021>.
- Levy JB, Turner AN, Rees AJ, et al. Long-term outcome of anti–glomerular basement membrane antibody disease treated with plasma exchange and immunosuppression. Ann Intern Med. 2001;134 : 1033-1042.
- McAdoo SP, Pusey CD. Anti-Glomerular Basement Membrane Disease. Clin J Am Soc Nephrol. 2017;12(7): 1162-1172.
- McAdoo SP, Tanna A, Hrušková Z, et al. Patients double-seropositive for ANCA and anti-GBM antibodies have varied renal survival, frequency of relapse, and outcomes compared to single-seropositive patients. Kidney Int. 2017; 9 (3):693-702. Available from: DOI: <http://doi: 10.1016/j.kint.2017. 03. 014>.
- Alchi B, Griffiths M, Sivalingam V, et al. Predictors of renal and patient outcomes in anti-GBM disease: clinicopathologic analysis of a two-centre cohort, Nephrology Dialysis Transplantation. 2015;30(5):814-821. Available from: doi: <http://doi: 10.1093/ndt/gfu399>.
- Sethi S, Fervenza F. Standardized classification and reporting of glomerulonephritis, Nephrology Dialysis Transplantation,2019, 34 : 193-199, Available from: DOI: <http://doi: 10.1093/ ndt/gfy220>.
- Chudáček Z. HRCT plic – technika vyšetření, CT anatomie, základní typy patologických nálezů. Med. Praxi. 2010;7 (6 a 7):299-302.
- Derksen RH, Schuurman HJ, Meyling FH, et al. The efficacy of plasma exchange in the removal of plasma components. J Lab Clin Med. 1984;104 (3):346-5.
- Lockwood CM, Boulton-Jones JM, Lowenthal RM, et al. Recovery from Goodpasture’s syndrome after immunosuppressive treatment and plasmapheresis. Br Med J. 1975;2(5965):252-4.
- Soveri I, Molne J, Uhlin F, et al. The IgGdegrading enzyme of Streptococcus pyogenes causes rapid clearance of antiglomerular basement membrane antibodies in patients with refractory antiglomerular basement membrane disease. Kidney Int. 2019;96 : 1234-1238.
- Paříková A, IgGdegradující enzym Streptococcus pyogenes (IdeS) vede k rychlému odstranění protilátek proti glomerulární bazální membráně (antiGBM) u pacientů s refrakterní antiGBM glomerulonefritidou. Postgraduální nefrologie. 2019;4 : 19-21. Available from: <https://www.postgradualninefrologie.cz/cislo-xvii-4/igg-degradujici-enzym-streptococcus-pyogenes-ides-vede-k-rychlemu-odstraneni-pro/>.
- Stone JH, Merkel PA, Spiera R, et al. Rituximab versus cyclophosphamide for ANCA-associated vasculitis. N Engl J Med. 2010;363 (3):221-32. Available from: DOI: <http://doi: 10.1056/NEJMoa0909905>.
- Touzot M, Poisson J, Faguer S, et al. Rituximab in anti-GBM disease: A retrospective study of 8 patients. J Autoimmun. 2015;60 : 74-79. d Available from: DOI: <http://doi: 10.1016/j. jaut.2015. 04. 003>.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Dyslipidemie – známá neznámá
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2023 Číslo 5- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Nech brouka žít… Ať žije astma!
- Intermitentní hladovění v prevenci a léčbě chorob
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Akutní poškození ledvin u pacientů s jaterní cirhózou - shrnutí pro praxi
- Kardiovaskulární onemocnění a transplantace ledviny
- Důsledky vysoce supresivní léčby infekce HIV
- Interní komorbidity a komplikace terapie roztroušené sklerózy – nenechte se zaskočit!
- Dyslipidemie – známá neznámá
- Diferencovaný karcinom štítné žlázy – možná rizika léčby, supresní léčby a adherence k současným doporučení
- Atypická forma Goodpastureovy nemoci
- Farmakologický profil mepolizumabu
- Co je nového v pneumologii – rok 2022
- Finerenon: další možnost léčby u pacientů s chronickým onemocněním ledvin a diabetem 2. typu
- Zemřela prof. MUDr. Marie Brodanová, DrSc.
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Akutní poškození ledvin u pacientů s jaterní cirhózou - shrnutí pro praxi
- Dyslipidemie – známá neznámá
- Co je nového v pneumologii – rok 2022
- Kardiovaskulární onemocnění a transplantace ledviny
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



