-
Články
- Časopisy
- Kurzy
- Témy
- Kongresy
- Videa
- Podcasty
Kardiovaskulární onemocnění a transplantace ledviny
Cardiovascular disease and kidney transplantation
Compared to general population, patients with chronic kidney disease (CKD) exhibit high prevalence of cardiovascular disease (CVD) that increases with a stage of CKD. Traditional and non-traditional risk factors associated with CKD contribute to accelerated atherosclerosis leading to CVD. CVD represents the main cause of morbidity and mortality in CKD population. Pretransplant examination is essential to evaluate and optimize the state of cardiovascular system prior transplantation, thus to minimize risks that could have a negative impact on transplant outcome.
Keywords:
dialysis – kidney transplantation – cardiovascular disease – chronic kidney disease – pretransplant evaluation
Autori: Silvie Rajnochová Bloudíčková
Pôsobisko autorov: Klinika nefrologie – TC IKEM, Praha
Vyšlo v časopise: Vnitř Lék 2023; 69(5): 282-288
Kategória:
doi: https://doi.org/10.36290/vnl.2023.056Súhrn
U pacientů s chronickým onemocněním ledvin (CKD) je v porovnání s běžnou populací vysoká prevalence kardiovaskulárního onemocnění (CVD), která stoupá se stupněm CKD. Na rozvoji CVD se podílejí tradiční i netradiční faktory asociované s CKD, které podmiňují akceleraci aterosklerózy. CVD představuje nejčastější příčinu morbidity a mortality CKD populace. Z tohoto důvodu jsou také nejčastějším důvodem kontraindikace k transplantaci ledviny. Předtransplantační vyšetření je klíčové ke zhodnocení a případné optimalizaci stavu kardiovaskulárního aparátu ještě před transplantací s cílem minimalizovat rizika, která by mohla mít negativní dopad na výsledek transplantace.
Klíčová slova:
kardiovaskulární onemocnění – dialýza – chronické onemocnění ledvin – transplantace ledviny – předtransplantační vyšetření
Úvod
Transplantace ledviny je nejlepší volbou léčby nezvratného renálního selhání (ESRD), neboť je spojena s jednoznačně lepším přežíváním a lepší kvalitou života pacientů v porovnání s pacienty léčených dialýzou. Nejčastějším limitem pro akceptaci pacienta jako kandidáta transplantace je kardiovaskulární onemocnění (CVD), které s prevalencí 30x vyšší v porovnání s pacienty bez chronického onemocnění ledvin (CKD) představuje hlavní příčinu morbidity a mortality (1, 2) (Obr. 1). Incidence kardiovaskulárního onemocnění stoupá s úrovní CKD a u pacientů v pravidelné dialyzační léčbě (PDL) je příčinou předčasného úmrtí v 50 % (3) (Obr. 2). V patogenezi CVD u nemocných s CKD se vedle tradičních rizikových faktorů uplatňují faktory netradiční, asociované s urémií, v jejichž důsledku dochází k akceleraci aterosklerózy a arteriosklerózy (2, 4) (Obr. 3). U pacientů s CKD je pozorován tzv. fenomén reverzní epidemiologie, kdy v časných stádiích CKD jsou tradiční rizikové faktory asociovány s kardiovaskulární mortalitou stejně jako u běžné populace, zatímco v pokročilých stádiích CKD, kdy se navíc uplatňují netradiční faktory, nikoli (5).
Vzhledem k nesporným benefitům transplantační léčby jsou v současné době jako příjemci transplantace akceptováni i dříve „marginální“ pacienti s generalizovanou aterosklerózou. Je nutno ale pamatovat, že i pacienti po transplantaci zůstávají ve vysokém riziku vzniku kardiovaskulárních komplikací (6). Vzhledem k nepoměru mezi limitovaným počtem vhodných dárců a počtem pacientů čekajících na transplantaci, je zcela nezbytné posoudit transplantabilitu každého pacienta referovaného jako kandidáta transplantace ledviny. Cílem předtransplantačního vyšetření je stanovit benefit/risk pro pacienta, a tak minimalizovat riziko potransplantačních kardiovaskulárních komplikací s negativním dopadem na výsledek transplantace.
Obr. 1. Kardiovaskulární mortalita u pacientů s CKD v porovnání s běžnou populací (upraveno podle 2) 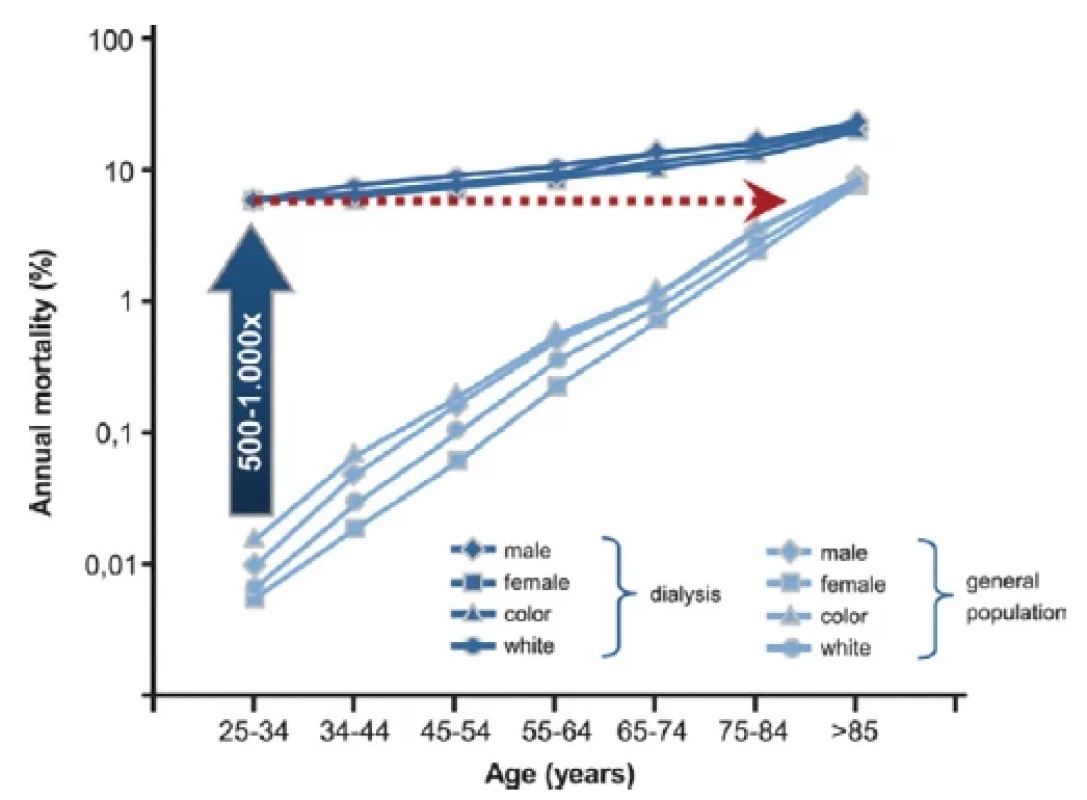
Obr. 2. Pravděpodobnost manifestace kardiovaskulárního onemocnění a jeho závažného průběhu stoupá se stupněm CKD (upraveno podle 3) 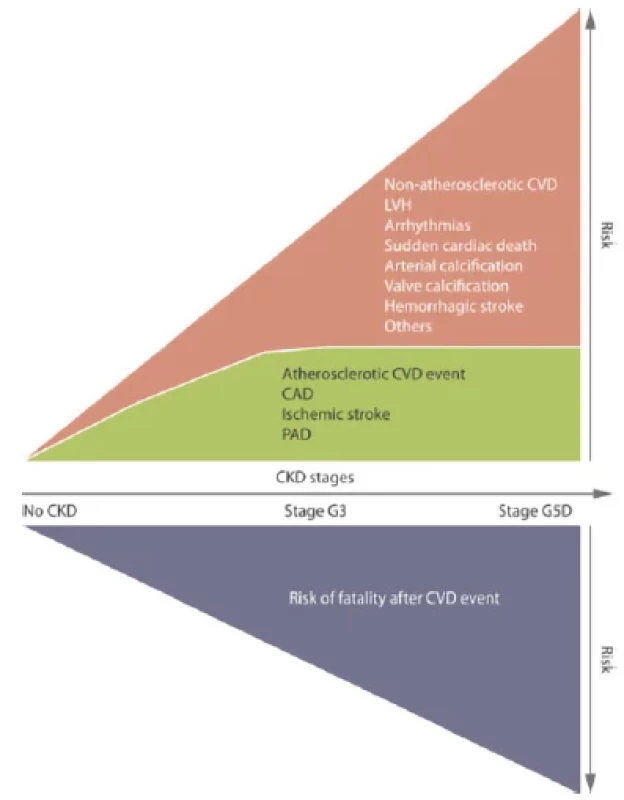
CKD – chronické onemocnění ledvin; LVH – hypertrofie levé komory srdeční; CAD – koronární onemocnění srdce; CVD – kardiovaskulární onemocnění; PAD – onemocnění periferních cév Obr. 3. Faktory ovlivňující vznik a progresi CVD u pacientů s CKD 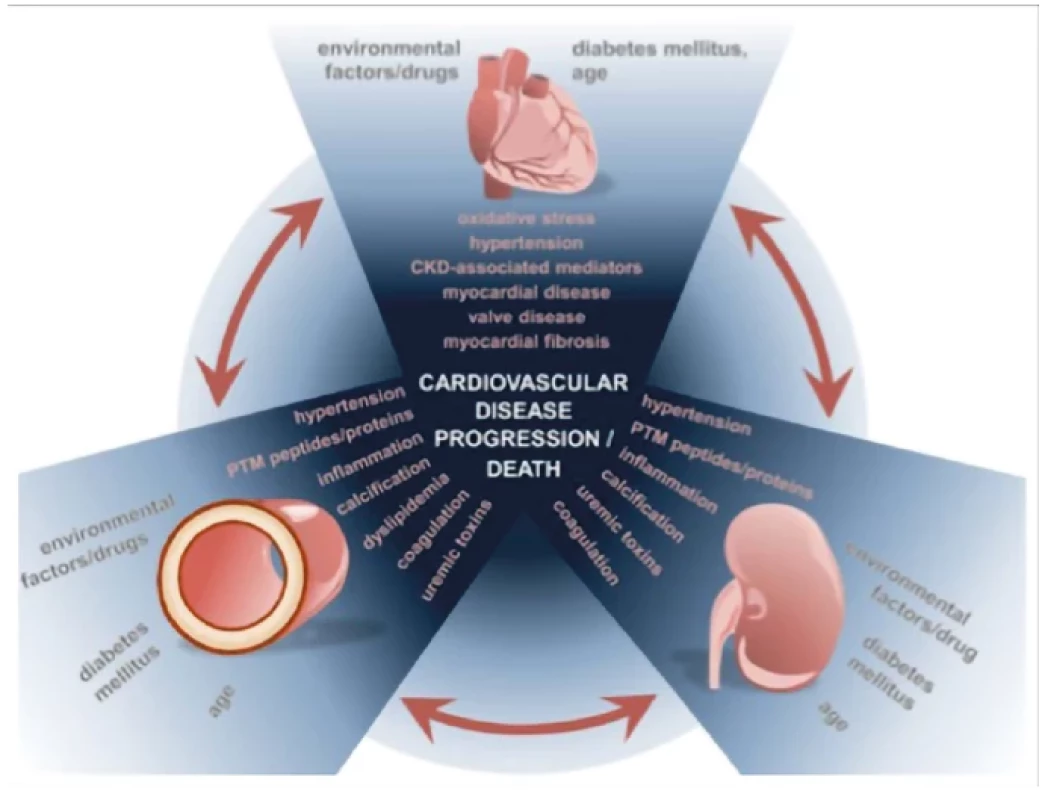
Obr. 4. Patogeneze kardiomyopatie u pacientů s CKD (upraveno podle 7) 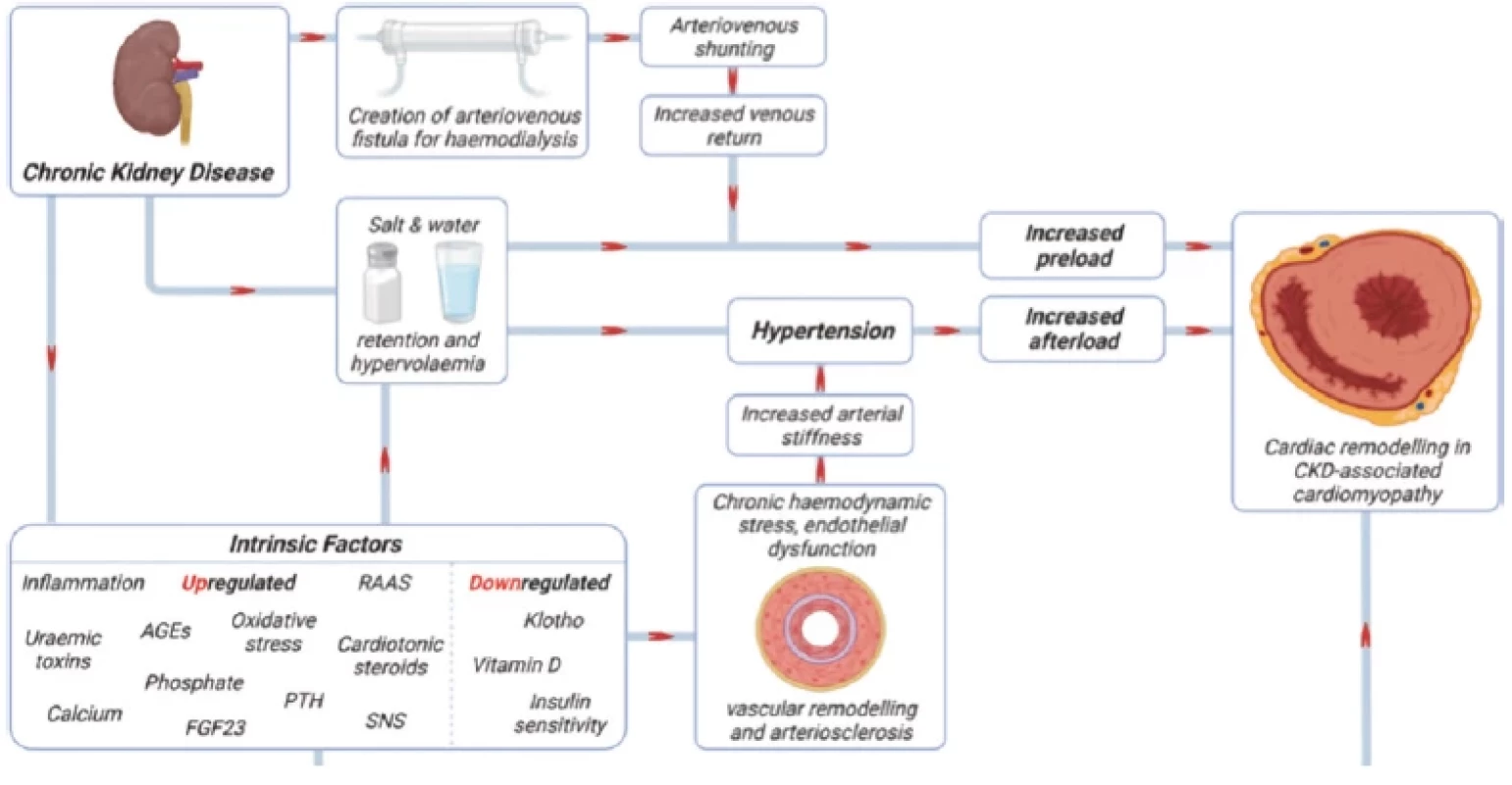
Uplatňují se faktory zvyšující afterload s preloadem a faktory vznikající v důsledku poruch vnitřního prostředí. GEs – konečné produkty pokročilé glykace; FGF23 – fibroblastový růstový faktor; PTH – parathormon, RAAS – renin-angiotenzin-aldosteron systém; SNS sympatický nervový systém Specifika patogeneze kardiovaskulárního onemocnění u pacientů s CKD
Hlavními mechanismy uplatňujícími se v patogenezi CVD je porucha cévního zásobení, fibróza a hypertrofie myokardu s jeho následnou remodelací. Pacienti s CKD vykazují významné změny cévní stěny jako ztluštění intimy a médie, vyšší výskyt pokročilých, často kalcifikovaných, aterosklerotických plátů a alteraci angiogeneze, vedoucí ke snížené toleranci ischemie myokardu. Fibróza myokardu, přítomná již v časných stádiích CKD, vede k poruše systolicko-diastolické funkce myokardu a poruchám srdečního rytmu. U téměř 75 % pacientů zahajujících PDL je přítomna hypertrofie myokardu levé komory srdeční podmíněná zvýšenou apoptózou kardiomyocytů a současnou hypertrofií reziduálních kardiomyocytů. Na vzniku hypertrofie levé komory se podílí zvýšená tuhost a snížená elasticita stěny aorty, hypertenze, hypervolémie, anémie, zvýšená aktivace sympatiku a lokálního systému renin-angiotenzin-aldosteron (RAAS) (4, 7) (Obr. 4).
Rizikové faktory kardiovaskulárního onemocnění u pacientů s CKD (2,8)
Věk, pohlaví
Samotný vyšší věk je prediktorem kardiovaskulární smrti. Nicméně nejvyšší relativní riziko úmrtí z kardiovaskulární příčiny, odpovídající pacientům věkové kategorie 70+ bez CKD, mají mladí pacienti s CKD. Incidence akutního infarktu myokardu v PDL je vyšší u mužů než u žen (2,5×), ale u žen v PDL je 3–5× vyšší v porovnání s běžnou populací.
Hypertenze
Prevalence hypertenze stoupá se stupněm CKD a u pacientů v PDL dosahuje 75–85%. Hypertenze je samostatným prediktorem mortality u pacientů s CKD. Izolovaná systolická hypertenze se zvýšeným pulzním tlakem je asociována s dlouhodobým kardiovaskulárním rizikem, nízký systolický anebo diastolický krevní tlak s časnou mortalitou. Nemalá část pacientů v PDL trpí autonomní dysfunkcí, která podmiňuje absenci nočního poklesu krevního tlaku („non-dippers“).
Diabetes, dyslipidemie, anémie
Diabetes mellitus je vedle hypertenze nejčastější příčinou ESRD (cca 50 %) a spolu s dalšími přítomnými metabolickými odchylkami je udávaná prevalence CVD 65 %. Dyslipidemie u CKD pacientů je asociována méně se vznikem CVD v porovnání s běžnou populací. Naopak hypocholesterolémie v kombinaci s malnutricí a chronickým zánětem, tzv. MIA syndrom, je negativním prediktorem mortality u pacientů v PDL. Anémie patří mezi hlavní příčiny hypertrofie a dilatace levé komory srdeční u pacientů s ESRD.
Uremie
Urémii lze charakterizovat jako chronický prozánětlivý stav spojený se zvýšeným oxidačním stresem, dysfunkcí endotelu a poruchou kalcium-fosfátového metabolismu, jehož důsledkem je akcelerovaná ateroskleróza a arterioskleróza přispívajících k progresi CKD a manifestaci CVD.
Hypervolemie
Perzistující či rekurentní hypervolémie je nejčastější příčinou hypertenze anebo srdečního selhání (kardiomyopatie) u dialyzovaných pacientů a je jednoznačně spojena se zvýšenou kardiovaskulární morbiditou a mortalitou.
Klinické projevy kardiovaskulárního onemocnění u pacientů s CKD
Ischemická choroba srdeční (ICHS)
Projevy ICHS u pacientů s CKD, zejména v PDL, bývají atypické a zahrnují anginu pectoris, akutní infarkt myokardu či náhlé úmrtí. Podobně jako u pacientů s diabetem mellitem bývají dominantními projevy ICHS námahová dušnost či srdeční selhání bez typických symptomů anginy pectoris. Odlišení akutního koronárního syndromu od plicní kongesce v terénu hyperhydratace při absenci klasických koronárních symptomů může být svízelné. Z tohoto důvodu mohou uniknout včasné diagnóze a adekvátní terapii.
Chronické srdeční selhání (CHSS)
CHSS je silným prediktorem mortality dialyzovaných pacientů. Téměř 80 % pacientů s CHSS a systolicko-diastolickou dysfunkcí umírá během 3let. CHSS často doprovází ICHS, hypertenzi a diabetes, ale může se manifestovat i samostatně, zejména v důsledku chronické hyperhydratace (9). Projevy CHSS mohou být u pacientů v PDL mitigované a diagnóza je stanovena až na základě echokardiografických parametrů provázených v pokročilém stádiu poklesem ejekční frakce levé komory.
Perikarditida
Může se manifestovat v rámci neléčeného terminálního selhání Může se manifestovat v rámci neléčeného terminálního selhání ledvin jako projev urémie (tzv. uremická perikarditida) či nedostatečné dialýzy, např. při perzistující hypervolemii, recirkulaci nebo nedostatečné funkci arterio-venózní fistule (AVF) či interkurentním infektu.
Chlopenní vady
Metabolické odchylky, chronický zánět, délka dialyzační léčby a vyšší věk jsou rizikové faktory kalcifikací a rozvoje chlopenních vad. Právě sklerodegenerací podmíněné vady mohou vést k hypervolemii s hemodynamickým přetížením či poruchám vedení rytmu až s obrazem kompletního bloku, někdy s nutností implantace pacemakeru. Chlopenní vady jsou v 5 % příčinou úmrtí pacientů s ESRD. U pacientů s CKD je signifikantně vyšší prevalence postižení mitrální a aortální chlopně. Symptomatická aortální stenóza snižuje přežití na cca 2 roky. Vzhledem k vysokému riziku perioperačních komplikací a úmrtí, jež je až o 50 % vyšší v porovnání s non-CKD pacienty, je její náhrada indikována pouze u hemodynamicky významné (symptomatické) vady anebo v případě asymptomatické dysfunkce levé komory srdeční. Symptomatická aortální vada se projevuje námahovou dušností, námahovou synkopou a anginou pectoris. V současné době lze pacientům s vysokým operačním rizikem nabídnout katetrizační řešení aortální stenózy metodou TAVI (transkatétrová implantace aortální chlopně), která se v porovnání s chirurgickou metodou jeví být vhodnější pro pacienty s CKD (10). Aortální regurgitace bývá často asymptomatická a vzhledem ke sklonům k hyperhydrataci u pacientů s CKD, resp. PDL, je její kvantifikace obtížná. Symptomy srdečního selhání bývají pozdními projevy často již pokročilé vady.
Mitrální regurgitace je často sekundární a její míra závažnosti kolísá dle stavu hydratace (preload) a hypertenze (afterload). Její plastika či náhrada je indikována pouze v případě těžké vady. U pacientů s CKD, u nichž bývá chirurgická léčba spojená s vysokým rizikem, se využívá metody katetrizační implantace MitraClipu nebo implantace mitrální chlopně z transapikálního přístupu katetrizační cestou bez nutnosti mimotělního oběhu (TMVI chlopeň Tendyne). (11) Mitrální stenóza je v současné době převážně degenerativní etiologie. Rozsáhlé kalcifikace mitrálního anulu mnohdy neumožňují chirurgické řešení pro závažné prorůstání do myokardu levé komory srdeční. Katetrizační řešení vady není v současné době k dispozici. Přechodným řešením je mitrální komisurotomie, a to pouze na vybraných pracovištích.
Arytmie
Arytmie jsou nejčastějším symptomem u pacientů v PDL s prevalencí kolem 10 %. Manifestuje se typicky během dialyzační procedury, kdy dochází k redistribuci iontů, zejména draslíku. Projevy zahrnují paroxysmy fibrilace síní až zástavu oběhu či asystolii s náhlým úmrtím. Perzistující fibrilace síní je asociována s vyšším rizikem ischemické cévní mozkové příhody (CMP), tromboembolismu a celkovou mortalitou.
Cerebrovaskulární onemocnění
Postižení karotid bývá u pacientů s CKD podobné jako postižení koronárních tepen. Ischemické CMP jsou asociované s diastolickou hypertenzí a dysrytmiemi. Hemoragické CMP jsou u pacientů v PDL častější v porovnání s běžnou populací. Cerebrovaskulární onemocnění jsou tak příčinou 5–10 % úmrtí pacientů v PDL.
Tab. 1. Modality zátěžových vyšetření u pacientů s CKD (upraveno podle (3)) 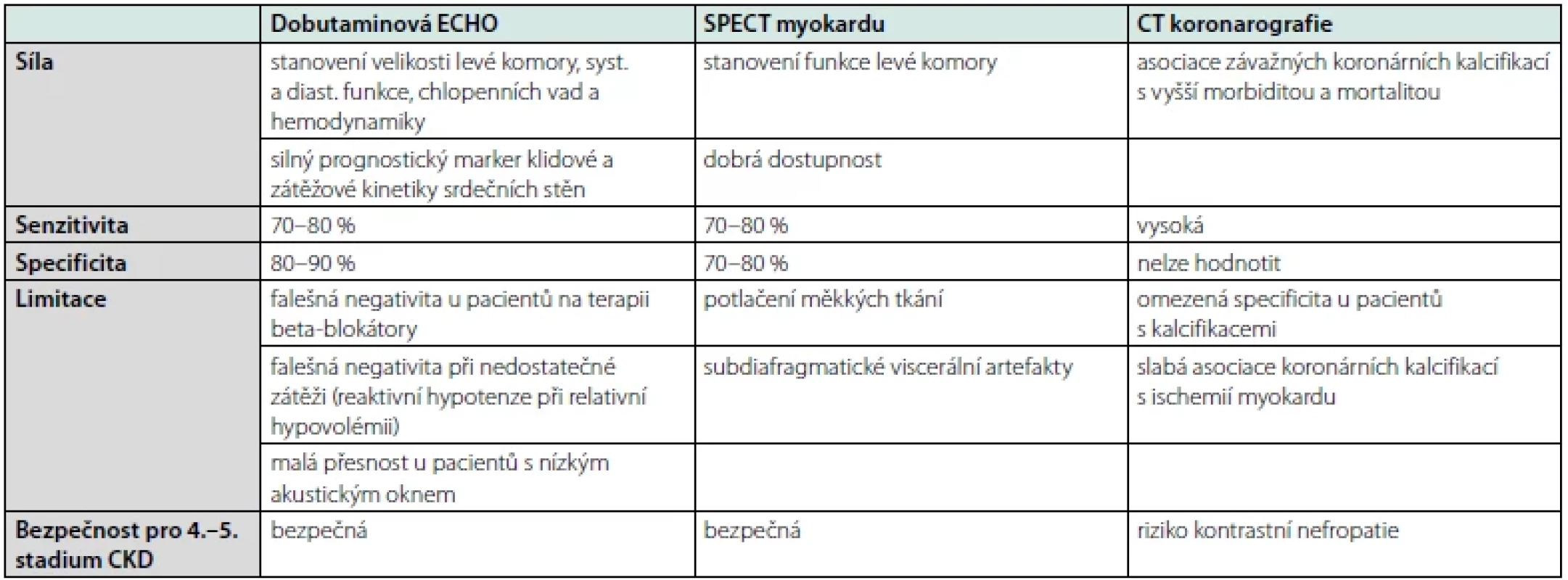
Onemocnění periferních cév (PVD)
PVD se nejčastěji vyskytuje u pacientů s diabetem a preexistující aterosklerózou. Dalšími rizikovými faktory je délka PDL, hypalbuminémie, nízké hladiny PTH a nízké predialyzační hodnoty diastolického tlaku. Manifestuje se jako okluzivní ischemická choroba dolních končetin (ICHDK) či gangréna.
Specifika diagnostiky kardiovaskulárního onemocnění u pacientů s CKD
Diagnostika se opírá klinické vyšetření, vyhodnocení účinnosti dialýzy, měření krevního tlaku, 12svodový elektrokardiogram (EKG) a zobrazovacích metod jako echokardiografie (ECHO), selektivní koronarografie (SKG) či CT koronarografie. Využití zátěžových testů (ergometrie, dobutaminová ECHO, SPECT myokardu) bývá nekonkluzivní vzhledem k jejich nízké senzitivitě a specificitě a nedostatečné fyzické výkonnosti u pacientů s CKD (12).
EKG
Je základní vyšetření, které využíváme ke stanovení základního rytmu, hypertrofie či ischemie myokardu. Změny na EKG jsou u dialyzovaných pacientů běžné, mnohdy korelují se změnami elektrolytů během anebo mezi dialyzačními procedurami.
ECHO
Základní vyšetření s vysokou diagnostickou hodnotou, které je doporučováno provádět 1x ročně u všech dialyzovaných pacientů. Pro správnou interpretaci nálezů je důležité provedení vyšetření co nejdříve (do 24 h) po provedené dialyzační proceduře za podmínek euvolemie (tzv. suchá váha), adekvátní korekce anémie a hypertenze.
Zátěžová vyšetření
Jednotlivé metodiky se liší mírou senzitivity, specificity a limitacemi. Využíváme je zejména u pacientů v predialýze, s alergií na kontrastní látku či k ověření efektu provedené chirurgické revaskularizace. Nejvyšší výpovědní hodnotu má dobutaminová ECHO a dipyridamolová scintigrafie myokardu (SPECT) (3) (Tab. 1).
SKG
SKG je zlatým standardem pro detekci ICHS i u pacientů s CKD. Vedle standardních indikačních kritérií byl měla být SKG provedena i u asymptomatických pacientů se sníženou ejekční frakcí levé komory (pod 40 %) dle ECHO anebo v případě pozitivního zátěžového testu. K minimalizaci nežádoucích účinků spojených s užitím kontrastní látky (progrese CKD do ESRD, ztráta reziduální diurézy, hypertenzní krize či plicní edém u pacientů v PDL) je možné v případě elektivního vyšetření (např. v rámci předtransplantačního vyšetření) volit co nejmenší její objem.
CT koronarografie
Toto vyšetření lze volit u asymptomatických pacientů nebo u pacientů s pokročilou CKD k vyloučení signifikantní stenózy koronárních tepen a zhodnocení významnosti vaskulárních kalcifikací. Limitací CT koronarografie je potřeba kvalitního EKG záznamu během vyšetření a nižší validita hodnocení periferních úseků koronárních tepen (3).
Vyhodnocení účinnosti dialyzační léčby
Znalost parametrů dialyzační léčby je podstatná ke zhodnocení a interpretaci kardiálních nálezů. Vedle kalkulovaných parametrů jako index Kt/V, URR (urea reduction ratio), příp. PCR (protein catabolic rate), je velmi důležitá znalost tělesného složení dle BCM (body composition monitor). Klinické parametry jako mezidialyzační přírůstky, tolerance dialyzačních procedur a přítomnosti intradialyzační hypoči hypertenze jsou nápomocné k detekci kardiálního onemocnění a compliance pacienta. Je nutno pamatovat i na pravidelné ultrazvukové (UZ) kontroly AVF, jejíž hyperfunkce může přispívat k rozvoji srdečního selhání.
Kardiovaskulární onemocnění a možnosti transplantace ledviny
Stav kardiovaskulárního aparátu je klíčový pro akceptaci pacienta k transplantaci ledviny, neboť CVD zůstávají nejčastější příčinou morbidity a mortality pacientů i po transplantaci. Algoritmus předtransplantačního vyšetření vychází z KDIGO guidelines, která definují základní vyšetření u všech kandidátů transplantace (EKG, ECHO, fyzikální vyšetření, anamnéza), nicméně rozsah vyšetření u symptomatických i asymptomatických pacientů s či bez anamnézy ICHS ponechávají v rukách kardiologů. Podobně doporučení managementu ICHS, resp. indikace a typ revaskularizace myokardu, odkazují na lokální zvyklost kardiologů. Nadále zůstávají i nejednoznačné postupy týkající se elektivní revaskularizace myokardu u asymptomatických nemocných, neboť studie jednoznačně nepotvrdily benefit ve smyslu snížení jejich morbidity či mortality. KDIGO guidelines doporučují rozšířit spektrum vyšetření u pacientů s vysokým rizikem kardiovaskulárního onemocnění (diabetes, anamnéza ICHS, patologické nálezy na EKG a ECHO) o zátěžové vyšetření a v případě jejich pozitivního výsledku doplnit SKG (13).
Problém pacientů s pokročilým CKD, zejména v PDL, tkví v tom, že ani normální nálezy na EKG a ECHO nevylučují závažnou formu ICHS. Klinicky němá ICHS je u pacientů v PDL velmi častá a vzhledem k jejich minimální pohybové aktivitě se typické anginózní obtíže nemusejí manifestovat. Konkrétní rozsah kardiologického vyšetření tedy vychází ze stratifikace rizika daného pacienta. Stratifikace vycházela z publikovaných doporučení AHA/ACC (American Heart Association/American College of Cardiology Foundation), která ovšem byla vytvořena pro non-CKD populaci. Rizikové faktory jako věk nad 60 let, hypertenze, dyslipidémie, kouření, anamnéza CVD, hypetrofie levé komory srdeční a PDL déle než 1 rok, definované AHA jsou prakticky přítomny u majority ESRD/PDL pacientů, tudíž je lze stratifikovat do nejvyššího kardiovaskulárního rizika, t.j. jako high-risk pacienty (14).
Prakticky lze říci, že každé transplantační centrum vychází ze stejného základu pro předtransplantační vyšetření jako jsou RTG srdce a plic, klidové 12svodové EKG a klidové ECHO, ale liší se v algoritmu dalších vyšetření jako zátěžové či koronarografické vyšetření. Pacienta s absencí klinických příznaků, normálními nálezy na RTG, EKG, ECHO, popř. SKG, lze z kardiologického hlediska připustit k transplantaci ledviny. V případě klinických příznaků či patologických nálezů v provedených vyšetřeních další postup závisí na etiologii.
Arytmie
Paroxysmální či permanentní fibrilace síní není kontraindikací k transplantaci, pokud je dobře kontrolovaná. Při podezření na jiný typ arytmií doplňujeme EKG-holter a kardiologické vyšetření, včetně echokardiografie. U kandidátů transplantace preferujeme antikoagulační zajištění nízkomolekulárním heparinem (LMWH) či warfarinem, které po přípravě nebrání operačnímu výkonu. Pokud je pacient léčen NOAC či clopidogrelem, je nutný převod na LMWH či warfarin.
Srdeční selhání (CHSS)
CHSS je významným prediktorem akutního koronárního syndromu a mortality u dialyzovaných, resp. transplantovaných pacientů. Nejčastější příčinou je tzv. uremická kardiomyopatie vznikající v důsledku dlouhodobého volumového přetížení, hypertenze, anémie anebo nedostatečné dialýzy. Může se manifestovat jako koncentrická hypertrofie levé komory srdeční, systolická anebo diastolická dysfunkce a dilatace levé komory srdeční.
Pacient se známkami CHSS musí podstoupit komplexní kardiologické vyšetření k vyloučení ischemické etiologie. Pokud je vyloučena, je indikována úprava dialyzační léčby (např. snížení suché váhy, zvýšení frekvence či délky dialyzačních procedur) s přehodnocením klinického a ECHO nálezu s odstupem 3 měsíců. Přes nepochybný pozitivní efekt funkční transplantované ledviny na kardiální funkci, pacient s anamnézou CHSS zůstává i po pěti letech po transplantaci ve více než dvojnásobném riziku srdečního selhání anebo úmrtí (15). Toto riziko stoupá se stupněm poklesu ejekční frakce (16).
Plicní hypertenze (PH)
Plicní hypertenze významným prognostickým faktorem kardiovaskulární morbidity a mortality u pacientů s CKD. U kandidátů transplantace se prevalence pohybuje mezi 13–50 %, ale předpokládá se vyšší, neboť nálezy echokardiografické nepřesně korelují s nálezy při pravostranné katetrizaci. Její etiologie je multifaktoriální, nicméně hlavní příčinou je chronická hypervolémie a chronická systémová hypertenze vedoucí nejprve k rozvoji diastolické a následně systolické dysfunkce levé komory srdeční.
PH na jedné straně zvyšuje mortalitu po transplantaci, na straně druhé transplantace ledviny zlepšuje PH i změny s ní spojené jako hypertrofie či systolicko-diastolická dysfunkce levé komory srdeční. Tyto změny lze očekávat především u pacientů s anamnézou chronické hypervolémie nebo u pacientů s hyperfunkční AVF. Zásadní je správné vyšetření etiologie a reverzibility PH u všech kandidátů transplantace a zhodnocení rizik související s transplantací. Základem je echokardiografické vyšetření za stavu euvolemie, tj. při dosažení „suché váhy“, správné korekce anémie a metabolických odchylek a eufunkce AVF. Echokardiografický nález PASP (systolický tlak v plicnici) nad 45 mm Hg by měl být objektivizován pravostrannou katetrizací (14). Při verifikaci PH by další kroky měly směřovat k optimalizaci hemodynamiky pacienta (např. snížení suché váhy, úprava délky či frekvence dialyzační procedury, ligace/redukce hyperfunkční AVF, korekce chlopenní vady), korekci plicního onemocnění (CHOPN, syndrom spánkové apnoe) a anémie. Pokud tato opatření nevedou ke korekci závažné plicní hypertenze (PASP ³ 60 mm Hg), pak je pacient k izolované transplantaci ledviny kontraindikován. Podrobná diagnostika a terapie patří do rukou specialistykardiologa se zkušenostmi s touto problematikou.
Chlopenní vady
Přítomnost chlopenní vady snižuje pravděpodobnost transplantace. Zejména v pokročilých stádiích, pokud není adekvátně léčena, přispívá k morbiditě i mortalitě pacientů nejen na dialýze, ale i na čekací listině a po transplantaci. Hemodynamicky závažná chlopenní vada tedy může být, zejména v kombinaci s dalšími komorbiditami anebo nízkou funkční rezervou pacienta, kontraindikací k transplantaci, pokud ji nelze před transplantací korigovat. Management vychází z AHA/ACC guidelines, které jsou standardizovány pro non-CKD populaci (14). Indikační kritéria pro řešení chlopenních vad jsou definována aktuálně platnými ESC/EACTS (European Society of Cardiology/European Association for Cardio-Thoracic Surgery) guidelines (17). Klíčové je správné zhodnocení závažnosti chlopenní vady. Echokardiografické vyšetření se má provádět za podmínek euvolémie, tzn. bezprostředně po dialýze (pacient je na „suché váze“) a korigované hypertenze. Při verifikaci hemodynamicky závažné chlopenní vady se doplňuje transezofageální ECHO a SKG. Léčebný postup je stanoven na základě vyšetření a klinických projevů pacienta. V současné době se kromě záchovných operací (plastiky) využívají biologické (povinní nebo porcinní tkáň) a mechanické chlopenní náhrady, které však vyžadují doživotní warfarinizaci. Katetrizační techniky jsou možností léčby regurgitačních vad u vysoce rizikových pacientů, vč. pacientů s CKD. V případě konzervativního postupu léčby chlopenní vady lze pacienta do čekací listiny zařadit, ale jsou nutné 6–12měsíční echokardiografické kontroly významnosti vady s příp. přehodnocením léčebného postupu.
Postižení koronárních tepen
Stenózující koronární nemoc (CAD) podmiňuje 20 % úmrtí z kardiovaskulárních příčin z celkových 50 % u pacientů s ESRD (18). Velké randomizované studie porovnávající revaskularizační (a její typ) a konzervativní léčbu stabilní anginy pectoris či asymptomatické ICHS u pacientů s CKD 5.stupně, resp. ESRD chybí, proto jsou doporučení extrapolována z doporučení evropských (ESC/EACTS) a amerických (ACCF/AHA) společností (19, 20). V případě rozsáhlého koronárního postižení anebo nemožnosti revaskularizace je pacient k transplantaci kontraindikován i v případě absence klinických obtíží, neboť dlouhodobá prognóza je nepříznivá. V případě vícečetného postižení koronárních tepen indikovaného ke konzervativní léčbě akceptace k transplantaci závisí na EKG a ECHO nálezech, funkčním stavu a komorbiditách pacienta. Pokud je pacient akceptován, obvyklým postupem je každoroční vyhodnocení nálezů kontrolních vyšetření a klinického stavu pacienta s posouzením transplantability. Pacienty, jejichž koronární nález vyžaduje revaskularizaci, je možné k transplantaci akceptovat až po provedení revaskularizace a ukončení případné duální antiagregace (DAPT). Typ revaskularizace u pacientů s pokročilou CKD, resp. v PDL, definuje kardiolog a zpravidla se neliší od nonCKD populace. Studie prokázaly, že u vícečetného obstruktivního koronárního postižení pacienti s CKD jednoznačně profitují z chirurgické revaskularizace v porovnání s PCI (perkutánní koronární intervence) ve smyslu snížení rizika infarktu myokardu, potřeby opakované revakularizace a úmrtí v dlouhodobém horizontu (21). Revaskularizace v této indikaci je navíc jednoznačně spojena s dlouhodobým benefitem pro pacienta v porovnání s konzervativním managementem. V současné době jsou k dispozici lékové stenty (DESdrug eluting stent) druhé generace, které snižují potřebu DAPT na 1-3, resp. 6 měsíců. DES druhé generace by měly být užívány právě u kandidátů transplantace nejen pro kratší dobu léčby DAPT, ale i z důvodu snížení rizika akutního infarktu myokardu a náhlé smrti (až o 26 %) v porovnání s užitím metalického stentu (BMSbare metal stent) (22, 23). Pokud je na základě předtransplantačního vyšetření realizována revaskularizace myokardu, bývá některými transplantačními centry doporučováno s odstupem 12 měsíců kromě ECHO provedení kontrolní SKG k vyloučení in-stent restenózy, progrese koronárního nálezu či ověření průchodnosti bypassů.
Ne zcela jednoznačně jsou definovány guidelines týkající se rozsahu kontrolních vyšetření u pacientů již zařazených v čekací listině k transplantaci ledviny. Je doporučeno opakovat jednou ročně vyšetření RTG srdce a plic, EKG a ECHO. Re-koronarografie (re-SKG) obvykle kardiologové doporučují provádět elektivně po 2–3 letech, i v případě asymptomatických pacientů. V případě manifestace symptomů klinických anebo echokardiografických (zejména pokles EF LK) je indikace re-SKG jasná. U pacientů s obstrukčním vícečetným postižením koronárních cév je opakovaní SKG s odstupem jednoho roku velmi nápomocné ke zhodnocení progrese koronárního postižení, které se může stát překážkou transplantace.
Při individuálním posuzování transplantability nelze opomenout i potencionální dopad imunosupresiv užívaných po transplantaci ledviny na progresi preexistujícího kardiovaskulárního onemocnění. Jejich vedlejší účinky, zejména metabolické a prokoagulační, mohou vést k významné akceleraci kardiovaskulárního onemocnění a zhoršení prognózy pacienta v případě jeho akceptace k transplantaci. Jedná se především o pacienty s manifestní generalizovanou aterosklerózou a obstrukčním koronárním postižením (24).
Závěr
Kardiovaskulární onemocnění s vysokou prevalencí u pacientů s chronickým onemocněním ledvin je hlavní příčinou jejich morbidity a mortality. Stav kardiovaskulárního aparátu je klíčovým pro akceptaci pacienta k transplantaci ledviny.
MUDr. Silvie Rajnochová Bloudíčková, Ph.D., DBA
Nefrologická a Transplantační ambulance – TC IKEM
silvie.bloudickova@ikem.cz
Zdroje
- Collins AJ, Li S, Ma JZ, Herzog C. Cardiovascular disease in end stage renal disease patients. Am J Kidney, DiS. 2001; 38:S26-9.
- Jankowski J, Floege J, Fliser D, et al. Cardiovascular disease in chronic kidney disease. Circulation. 2021; 143(11):1157-1172.
- Dilsizian V, Gewirtz H, Marwick TH, et al. Cardiac imaging for coronary heart disease JACC. 2021; 14(1):669-682.
- Matsushita K, Ballew SH, Wang AEM et al. Epidemiology and risk of cardiovascular disease in population with chronic kidney disease. Nat Rev Nephrol. 2022; 18 : 696-707.
- Kalantar-Zadeh K, Block G, Humphreys MH, Kopple JD. Reverse epidemiology of cardiovascular risk factors in maintenance dialysis patients. Kidney Int. 2003; 63 : 793-808.
- Specific-cause mortality in kidney transplant recipients. Available from: www: https:// usrds-adr.niddk.nih.gov/2022/
- Law JP, Pickup L, Pavlovic D, et al. Hypertension and cardiomyopathy associated with chronic kidney disease: epidemiology, pathogenesis and treatment consideration. J Hum Hypertens. 2023; 37(1):1-19.
- Muntner P, He J, Astor BC, et al. Traditional and nontraditional risk factors predict coronary heart disease in chronic kidney disease: results from the atherosclerosis risk in communities study. J Am Soc Nephrol. 2005;16(2):529-38.
- Trespalacios FC, Taylor AJ, Agodoa LY, et al. Heart failure as a cause for hospitalization in chronic dialysis patients. Am J Kidney, DiS. 2003;41(6):1267-77.
- Nguyen TC, Babaliaros VC, Razavi SA, et al. Impact of varying degrees of renal dysfunctionon transcatheter and surgical aortic valve replacement. J Thorac Cardiovasc Surg. 2013;146(6):1399-406.
- Himbert D, Bouleti C, Iung B, et al. Transcatheter valve replacement in patients with severe mitral valve disease and annular calcification. J Am Coll Cardiol 2014, 64(23):2557-8. 12. Viklický O, Janoušek L, Baláž P, et al. Transplantace ledviny v klinické praxi. Grada Publishing 2008. ISBN 978-80-247-2455-3.
Štítky
Diabetológia Endokrinológia Interné lekárstvo
Článek Dyslipidemie – známá neznámá
Článok vyšiel v časopiseVnitřní lékařství
Najčítanejšie tento týždeň
2023 Číslo 5- Parazitičtí červi v terapii Crohnovy choroby a dalších zánětlivých autoimunitních onemocnění
- Intermitentní hladovění v prevenci a léčbě chorob
- Rizikové období v léčbě růstovým hormonem: přechod mladých pacientů k lékařům pro dospělé
- Statinová intolerance
- Monoklonální protilátky v léčbě hyperlipidemií
-
Všetky články tohto čísla
- Akutní poškození ledvin u pacientů s jaterní cirhózou - shrnutí pro praxi
- Kardiovaskulární onemocnění a transplantace ledviny
- Důsledky vysoce supresivní léčby infekce HIV
- Interní komorbidity a komplikace terapie roztroušené sklerózy – nenechte se zaskočit!
- Dyslipidemie – známá neznámá
- Diferencovaný karcinom štítné žlázy – možná rizika léčby, supresní léčby a adherence k současným doporučení
- Atypická forma Goodpastureovy nemoci
- Farmakologický profil mepolizumabu
- Co je nového v pneumologii – rok 2022
- Finerenon: další možnost léčby u pacientů s chronickým onemocněním ledvin a diabetem 2. typu
- Zemřela prof. MUDr. Marie Brodanová, DrSc.
- Vnitřní lékařství
- Archív čísel
- Aktuálne číslo
- Iba online
- Informácie o časopise
Najčítanejšie v tomto čísle- Akutní poškození ledvin u pacientů s jaterní cirhózou - shrnutí pro praxi
- Dyslipidemie – známá neznámá
- Co je nového v pneumologii – rok 2022
- Kardiovaskulární onemocnění a transplantace ledviny
Prihlásenie#ADS_BOTTOM_SCRIPTS#Zabudnuté hesloZadajte e-mailovú adresu, s ktorou ste vytvárali účet. Budú Vám na ňu zasielané informácie k nastaveniu nového hesla.
- Časopisy



