Metody mimotělní oxygenacea eliminace CO2 určené primárně k náhradě plicních funkcí
Methods of extracorporeal oxygenation and C2 removal primarily for lung support
In severe cases of respiratory failure it may be impossible to achieve adequate gas exchange while using protective settings of mechanical ventilation, which in turn may result in further lung damage. Cardiac bypass machines for extracorporeal membrane oxygenation (cardiac bypass) have been used in the past for rescue management of patients with critical hypoxaemia, however their use was limited to centres with cardiac surgery facilities and the complication rates were high.
New technology, primarily aimed at supporting the respiratory function, has been introduced to clinical practice in the recent years – ‘pulmonary’ extracorporeal membrane oxygenation (ECMO). Improved oxygenation and CO2 elimination allows ventilator settings to be less aggressive and the term ‘ultra-protective mechanical ventilation’ has emerged. ECMO has become the default management of some conditions and in some groups of patients (such as COPD patients or lung transplant awaiting patients) it has allowed the patients to stay off mechanical ventilation. This article is aimed at the principles, indications and uses of ECMO.
Keywords:
protective mechanical ventilation – extracorporeal lung support – extracorporeal membrane oxygenation – CO2 elimination – oxygenator – pump – ultra-protective mechanical ventilation – anticoagulation
Authors:
Stibor Bronislav; Schwameis Franz
Authors‘ workplace:
ICU, Landesklinikum Baden bei Wien, Austria
Published in:
Anest. intenziv. Med., 25, 2014, č. 2, s. 98-106
Category:
Intensive Care Medicine - Review Article
Overview
U těžkých forem plicního selhání nemusí protektivní nastavení plicní ventilace zajistit dostatečnou výměnu krevních plynů. Navíc ventilace s parametry výrazně překračujícími protektivní principy dále prohlubuje plicní poškození. V minulosti se u některých pacientů s kritickou hypoxémií používaly jako rescue postup přístroje určené pro mimotělní krevní oběh – kardiální ECMO (extrakorporální membránová oxygenace). Byly však zatíženy vysokým počtem komplikací a vázány na kardiochirurgická centra.
V posledních letech se do klinické praxe zavádějí přístroje určené primárně k náhradě plicních funkcí – plicní ECMO. Zlepšením oxygenace a eliminací CO2 umožňují snížení agresivity ventilace a nastavení parametrů někdy označovaných jako ultraprotektivní plicní ventilace. V určitých indikacích se stávají etablovanými metodami mimotělní náhrady plicních funkcí. U některých skupin pacientů umožňují dokonce se intubaci a invazivní ventilaci vyhnout – CHOPN, pacienti čekající na transplantaci plic. Článek se zaměřuje především na princip, indikace a použití plicní ECMO.
Klíčová slova:
protektivní plicní ventilace – mimotělní plicní podpora – extrakorporální membránová oxygenace – eliminace CO2 – oxygenátor – krevní pumpa – ultraprotektivní plicní ventilace – antikoagulace
HISTORIE
Počátek obohacování krve kyslíkem a eliminace oxidu uhličitého mimo pacientovo tělo se klade do třicátých let minulého století, kdy se prováděly pokusy s bublinkovým oxygenátorem. V roce 1953 Gibbon poprvé použil mimotělní oběh u člověka [1]. Kardiopulmonální bypass byl zpočátku používán pouze na operačních sálech u kardiochirurgických výkonů. Koncem šedesátých let prokázal Kolobow na experimentálních zvířecích modelech, že membránové oxygenátory je možné použít i pro několikadenní oxygenaci a dekarboxylaci. Na základě těchto prací použil Hill v roce 1971 první dlouhodobější nasazení extrakorporální oxygenace u pa-cienta s plicním selháním po traumatické ruptuře aorty [2]. Následně se postupně rozšiřoval počet pacientů s těžkým plicním selháním, u nichž se ECMO nasazovalo, zpočátku zejména u pediatrických a neonatologických pacientů [3]. Přesto první studie neprokazovaly výrazný benefit této metody.
Extrakorporální oxygenace a dekarboxylace v současné podobě se etablovala v osmdesátých letech minulého století jako rescue postup u nejtěžších forem ARDS. V roce 1980 popsal Gattinoni koncept mimotělní eliminace CO2 ve spojení s quasi apnoickou ventilací o nízké frekvenci jako možnou strategii ochrany plicní tkáně během umělé plicní ventilace [4]. Použití však bylo zatíženo vysokou frekvencí, zejména technických a krvácivých komplikací, a jejich pozitivní vliv na snížení mortality nebyl prokázán.
Přelomovým z hlediska rozšíření se stal rok 2006, kdy byl do klinické praxe zaveden zcela nový arteriovenózní přístroj nazvaný iLA (interventional lung assist) [5]. Byl sestrojen primárně pro náhradu plicních funkcí – zejména k dekarboxylaci. Jednoduchý princip, prokázaná účinnost a možnost použití i na nekardiochirurgických pracovištích způsobila velké rozšíření této metody. Do současnosti bylo celosvětově, spolu s jeho novější venovenózní variantou iLA activve, (dostupnou od r. 2011), provedeno více než 7 000 aplikací. Tento komerční úspěch podnítil další výzkum a nyní je na trhu k dispozici několik přístrojů k náhradě plicních funkcí od různých výrobců. Technickým pokrokem, vývojem nových oxygenátorů, použitím heparinového filmu a zaváděním centrifugálních pump došlo v posledních letech k výraznému poklesu četnosti komplikací.
Podobně významnou událostí byla pandemie chřipky H1N1 v roce 2009, která vedla celosvětově k masivnímu rozšíření použití přístrojů mimotělní plicní podpory pro léčbu selhání plic.
TERMINOLOGIE (NOMENKLATURA)
Nomenklatura mimotělních plicních náhrad je nejednotná a nepřehledná. V české i zahraniční literatuře neexistuje jednoznačná terminologická shoda, navíc se tato oblast intenzivní medicíny velmi rychle vyvíjí. Dochází k určitým významovým posunům jednotlivých termínů, které se v některých případech prolínají. V současné době se všechny metody sloužící k náhradě funkce plic dají označit jako mimotělní plicní podpora (extracorporeal lung support, ECLS).
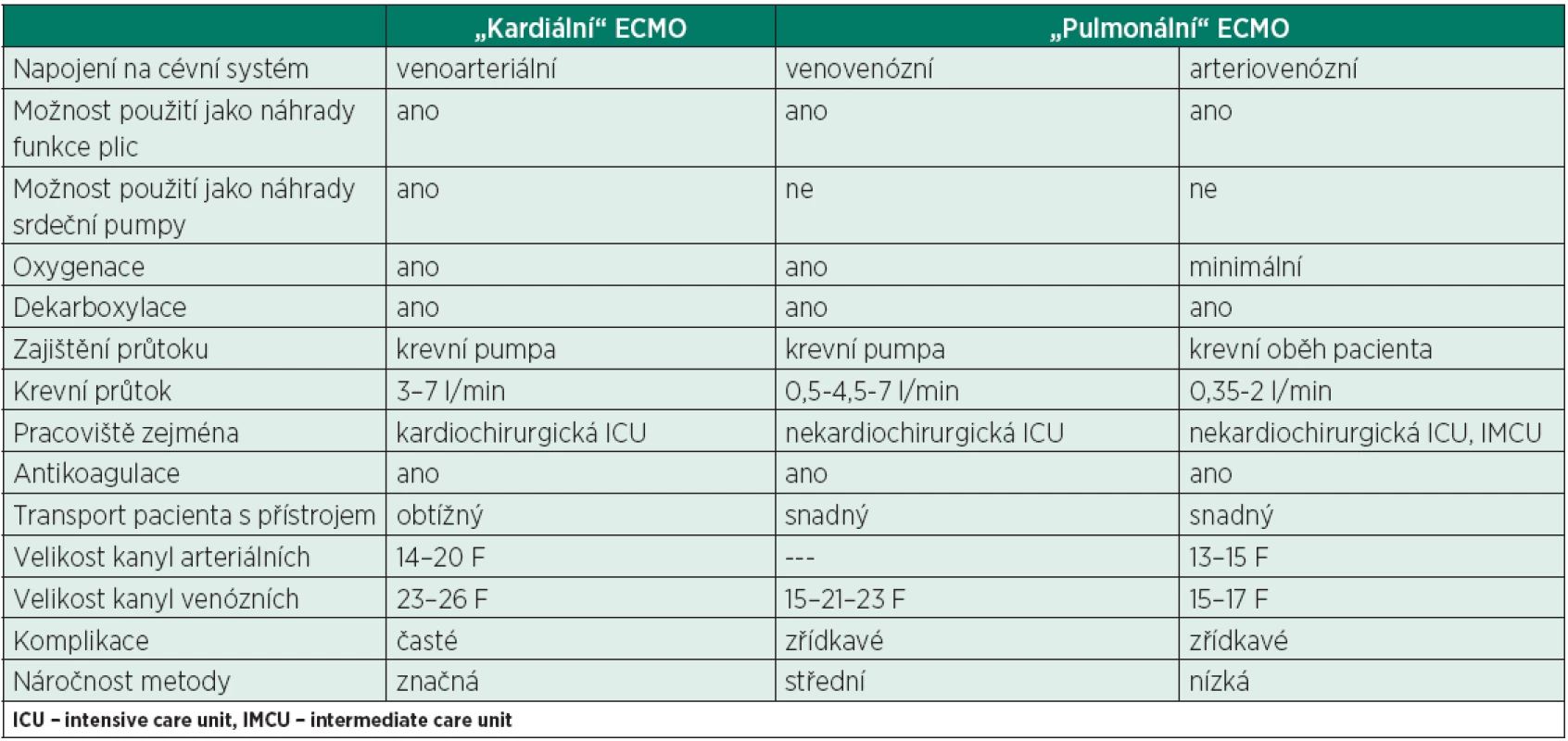
Základní rozdělení je možné podle primární indikace. Dříve byl termín extrakorporální membránové oxygenace (ECMO) vyhrazen pro tehdy jedinou klinicky používanou metodu – krátkodobé použití mimotělního oběhu během kardiochirurgických operací. Sloužila především pro náhradu funkce srdce jako krevní pumpy ve spojení s oxygenací a dekarboxylací krve. U pacientů s kritickou hypoxémií se tyto přístroje používaly pouze ve specializovaných centrech vybavených mimotělním oběhem jako rescue postup při selhání umělé plicní ventilace.
Jedná se tedy o přístroje umožňující venoarteriální (V-A ECMO) i venovenózní (V-V ECMO) po-užití. V souvislosti s rozvojem metod na obdobném principu, ale určených především k náhradě funkce plic (viz níže), je z důvodů rozlišení tento postup v současnosti někdy označován jako tzv. kardiální ECMO. Používají se přístroje dražší a složitější a jejich použití je většinou vázáno na dostupnost kardiochirurgická pracoviště. Transport pacienta s těžkým plicním selháním na tyto pracoviště však může být spojen s určitým rizikem, jak ukázala např. studie CESAR [6].
Metody používané primárně k náhradě plicních funkcí jsou někdy označovány jako tzv. pulmonální ECMO. Používané přístroje jsou jednodušší (odpadá nutnost náhrady krevního oběhu) a jejich použití není vázáno na zkušenosti s mimotělním oběhem v kardiochirurgii. To umožnilo rozšíření jejich používání i na pracoviště nekardiochirurgická a pracoviště nižšího typu.
Přístroje určené primárně k náhradě funkce plic lze ještě dále rozdělit podle schopnosti pouze dekarboxylovat nebo i oxygenovat. Přístroje vhodné převážně pro dekarboxylaci mohou být bez pumpy (arteriovenózní, A-V) nebo s pumpou, vždy však s malými průtoky. I u nich lze pozorovat částečné zlepšení oxygenace, to je však pouze marginální. Někdy používaný výraz arteriovenózní ECMO (A-V ECMO) je tedy obsahově nesprávný, jelikož schopnost oxygenace je minimální. Metody sloužící pouze k dekarboxylaci, jsou v literatuře označovány i jako extracorporeal carbon dioxide removal (ECCO2R), pumpless extracorporeal lung-assist (pECLA) nebo arterio-venous CO2 removal (AVCO2R).
Přístroje umožňující kromě eliminace CO2 i dostatečnou oxygenaci jsou vždy s pumpou (venovenózní, V-V ECMO), se středními až vysokými průtoky. Konkrétní použití každého přístroje u jednotlivého pacienta závisí i na velikosti kanyl a typu oxygenační membrány. V současné době se ze skupiny přístrojů primárně určených pro náhradu plicních funkcí do klinické praxe rozšiřují zejména přístroje s krevní pumpou, které mohou dekarboxylovat i plně oxygenovat dle potřeb pacienta.
Přístup k léčbě pacienta se selhávajícími plícemi je tedy možný ze dvou stran – pracoviště mající k dispozici přístroje pro V-A ECMO (kardiální ECMO) dokupují moduly sloužící primárně k náhradě funkce plic, zatímco ostatní pracoviště se vybavují přístroji pro plicní ECMO. Zjednodušeně se dá také říci, že kardiální ECMO lze použít i k náhradě plicních funkcí (ne vždy je to však vhodné), ovšem plicní ECMO k náhradě funkce srdeční pumpy použít nelze. V posledních letech se termíny prolínají a rozdíly mezi přístroji určenými původně pro odlišné indikace se stírají. Základní rozdíly jsou uvedeny v tabulce.
FYZIOLOGICKÉ PRINCIPY MIMOTĚLNÍ VÝMĚNY PLYNŮ
Principem metody je průtok krve přes semipermeabilní membránu, která je z jedné strany omývána krví pacienta a ze strany druhé čistým kyslíkem, eventuálně směsí kyslík + vzduch. Intenzita oxygenace a dekarboxylace je závislá na velikosti průtoku krve na krevní straně membrány a průtoku plynů na plynné straně membrány.
Kinetika difuze přes semipermeabilní membránu je rozdílná pro kyslík a oxid uhličitý. Většina kyslíku v krvi je přenášena hemoglobinem, menší část je rozpuštěna v krevní plazmě. Při jeho normálních hodnotách je koncentrace kyslíku rozpuštěného v plazmě pouze 40–60 ml/l. Pro zajištění plné oxygenace (cca 250 ml O2/min) je tedy potřebné dosáhnout vysokých průtoků krve přes membránu, většinou 5–7 l/min.
Naproti tomu většina oxidu uhličitého je transportována krví v rozpuštěné formě a přestup přes membránu je snazší a rychlejší. Odstranění 200 až 250 ml CO2 (minutová produkce oxidu uhličitého) je proto možné již u krevního průtoku menšího než 1,5 l/min [7]. Účinnost a regulace dekarboxylace je tedy primárně závislá od průtoku plynné směsi přes membránu, zatímco účinnost oxygenace od průtoku krve a koncentraci kyslíku v plynné směsi (tab. 2).
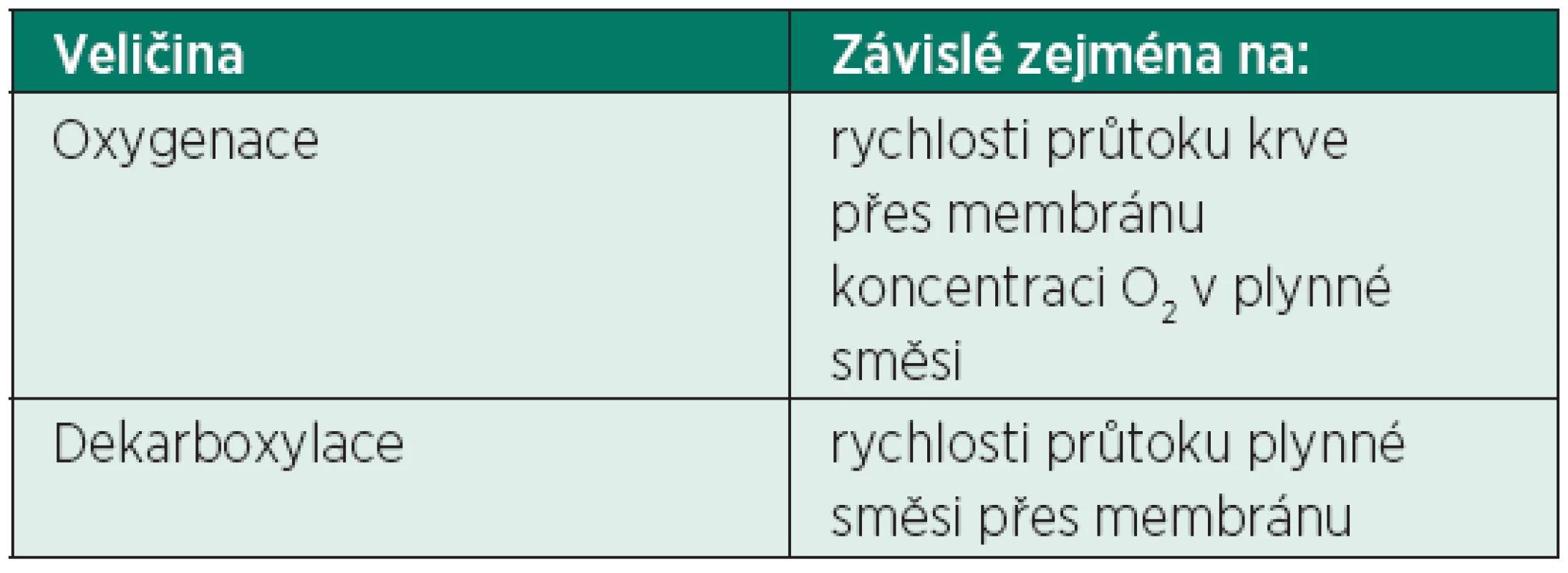
Pro klinické použití je proto důležité stanovení primární indikace mimotělní náhrady plicní funkce. Pokud je cílem především odstranění CO2 (např. pacient s těžkou CHOPN), stačí použít metodu s nižším průtokem krve (a tedy s menšími kanylami, popř. bezpumpovou metodu arteriovenózním přístupem). V případě nutnosti oxygenace (těžká forma ARDS) je vždy nutné zvolit venovenózní přístup poháněný pumpou, s kanylami o větším průměru, umožňujícími vysoké krevní průtoky.
ARTERIOVENÓZNÍ SYSTÉMY MIMOTĚLNÍ PLICNÍ PODPORY – BEZ KREVNÍ PUMPY
Dřívější generace mimotělní plicní podpory: Koncept byl poprvé popsán již v roce 1983 [8]. U arteriovenózních systémů je průtok krve přes membránový oxygenátor (viz níže) zajištěn pacientovým krevním oběhem. Vytváří se tak určitý zkrat, který je vložen mezi jeho arteriální a venózní cévní systém.
Průtok je závislý podle Ohmova zákona především na středním arteriálním tlaku (respektive rozdílu mezi ním a centrálním žilním tlakem), odporu systému (kanyly, membrána a systém hadic) a viskozitě krve. Maximální průtok, kterého je možné při dostatečném středním arteriálním tlaku – MAP (70–90 mm Hg) dosáhnout, je 1,5–1,9 l/min. Tato hodnota závisí na srdečním výdeji, tlaku krve na přívodné kanyle i na průměru kanyl. K účinnému odstraňování CO2 stačí 5–10 % srdečního výdeje a průtok plynné směsi minimálně 5 l/min.
Při těchto krevních průtocích je možná účinná dekarboxylace, oxygenace je zvýšena nevýznamně. Hlavní podmínkou je absence nekompenzovaného šokového stavu, tedy arteriální hypotenze. Ovšem nutnost aplikace katecholaminů – při následném zajištění dostatečného MAP – její použití nijak nevylučuje.
Druhou nezbytnou podmínkou je dostatečný vnitřní průměr kanylované arterie, respektive nepřítomnost těžkého stadia ischemické choroby dolních končetin. Nejčastěji se využívá a. femoralis, jejíž vnitřní průměr měřený sonograficky by měl být nejméně 5,2–5,5 mm. Ultrazvukové vyšetření tepen (ale i žil) v tříselné oblasti proto vždy předchází vlastní kanylaci. Je možná bilaterální kanylace (častější, arteriální kanyla na jedné a venózní kanyla na druhé dolní končetině) i unilaterální (stejnostranná kanylace, pouze při nemožnosti bilaterální). Pro kanylaci arterie zpravidla není nutno překračovat průměr 15F [9].
Tyto systémy mají jednoduché monitorování, které sleduje především průtok krve před venózní (návratovou) kanylou, bez možnosti tento průtok ovlivnit.
V dřívějších dobách byla nejobávanější komplikací arteriovenózních metod závažná ischémie dolní končetiny se „zakanylovanou“ arterií. Vývojem kanyl s menším průměrem a dostatečným průtokem se v současnosti tato komplikace vyskytuje zřídka. Přesto je doporučováno časté, nejlépe kontinuální monitorování perfuze dolní končetiny s umístěnou kanylou, např. čidlem pulzního oxymetru.
Výhodou této metody je jednoduchost a menší finanční náročnost. V současné době se stává doménou pneumologů u pacientů s dekompenzovanou chronickou obstrukční chorobou bronchopulmonální. Je možné ji provádět i na odděleních intermediární péče. Na trhu jsou přístroje pro odstraňování CO2 od několika výrobců: iLA-Membranventilator® (Novalung, Německo), Decap® (Hemodec, Itálie), Hemolung® (ALung, USA), PALP® (Maquet, Německo) a další.
VENOVENÓZNÍ SYSTÉMY MIMOTĚLNÍ PLICNÍ PODPORY – S KREVNÍ PUMPOU
Venovenózní systémy jsou vždy vybaveny krevní pumpou. Průtok krve není závislý na krevním oběhu pacienta. Není nutno kanylovat arteriální systém a dosahuje se výrazně vyšších průtoků. V závislosti na použité membráně a cévních kanylách je možné zajistit nejen dekarboxylaci, ale i dostatečnou oxygenaci pacienta.
Kromě membránového oxygenátoru obsahuje systém krevní pumpu, ovládací konzolu, tlaková čidla, kompletní monitorování tlaků a průtoku, ohřívač, popř. i směšovač kyslíku se vzduchem. Nevýhodou je vyšší finanční náročnost. Opět jsou k dispozici přístroje několika výrobců, např. iLA activve® (Novalung, Německo), Cardiohelp® (Maquet, Německo).
MEMBRÁNOVÝ OXYGENÁTOR
Semipermeabilní membrána je hlavní účinnou součástí celého systému. Je propustná pro molekuly CO2 a O2, ale ne pro krevní plazmu, a umožňuje tak výměnu krevních plynů. Ta probíhá především difuzí podle koncentračního gradientu. Krev a kyslík (popř. směs kyslíku se vzduchem) procházejí protisměrně.
Moderní oxygenátory se vyznačují nízkým plnícím objemem 250–300 ml, minimálním odporem, velikostí povrchu 0,5–1,5 m2, průtokem krve 0,5–7 l/min, průtokem plynu až 15 l/min a tlakovou odolností až do 750 mm Hg. Podobně jako kanyly jsou potaženy heparinem.
U některých systémů jsou k dispozici oxygenátory odstupňované dle velikosti od neonatologických až po velkoobjemové, umožňující vysoké průtoky. Bývá vřazen i výměník tepla pro zabránění ochlazování krve při mimotělním průtoku.
Krev je při průchodu přes membránu v závislosti na průtoku krve dekarboxylována a oxygenována, za oxygenátorem se dosahuje vysokých hodnot parciálního tlaku kyslíku (přes 450 mm Hg). Tato krev je po návratu do pacientova oběhu následně promíchána s jeho venózní krví neprocházející membránou a do plicního oběhu se tedy dostává smíšená již významně oxygenovaná krev.
KREVNÍ PUMPA
Dříve používané rotační okluzivní pumpy, které poháněly krev systémem stlačováním hadic, traumatizovaly krevní buněčné elementy s následnou hemolýzou a trombocytopenií. Popsány byly i ruptury systému v důsledku únavy materiálu spojené následně s velkou ztrátou krve. Okluzivní pumpy se v současnosti používají především u krátkodobého nasazení v kardiochirurgii a u neonatální ECMO.
U náhrady plicních funkcí se používá nejčastěji centrifugální pumpa. Obsahuje vnitřní, magnetem poháněné oběhové čerpadlo, které pohání odstředivou silou krev požadovaným směrem. Výhodou těchto pump je nižší traumatizace krevních buněk a minimální hemolýza. Miniaturizací těchto pump je umožněno jejich použití i v oblasti nízkých průtoků při malých plnících objemech. Výkon je závislý na přítoku krve (pacientově volémii) a počtu otáček pumpy. Moderní přístroje regulují otáčky podle přítoku krve a zajišťují automaticky požadovaný krevní průtok.
KANYLY
Používají se jedno - i dvouluminové kanyly, které jsou podobně jako zbytek mimotělního okruhu na vnitřní straně potaženy heparinem. Jejich armování minimalizuje riziko zalomení.
Pro arteriovenózní systémy (primární dekarboxylaci) se používají kanyly o menším průměru 13F-17F, jež dostačují nižším průtokům. Přívodná kanyla se zavádí zpravidla do a. femoralis, návratová do v. femoralis kontralaterální strany. Je možné požít i dvouluminové kanyly.
Pro venovenózní systémy s potřebou oxygenace jsou nejčastěji používané velikosti 21F a 23F, která umožňují střední a vyšší průtoky. Přívodná kanyla je zpravidla ve v. femoralis, návratová v pravostranné v. jugularis interna.
U dvouluminových kanyl je nebezpečí recirkulace, zvláště u vyšších průtoků, což je spojeno se snížením účinnosti, zejména oxygenace. Zvláštním typem dvouluminových kanyl jsou multistage kanyly, které se zavádí po kanylaci pravostranné v. jugularis interna přes pravou srdeční předsíň (transatriálně) až do dolní duté žíly. Krev je tedy do oxygenátoru nasávána z obou dutých žil. Návratové lumen je umístěno proti trikuspidální chlopni pro zabránění recirkulace. Zavádění těchto kanyl je pro zajištění správné polohy prováděno pod angiografickou nebo sonografickou kontrolou. Kanyly některých výrobců jsou schváleny pro ponechání i déle než 28 dnů.
INDIKACE
Pozitivní vliv protektivní plicní ventilace na snížení mortality byl opakovaně potvrzen mnoha studiemi. Avšak Brunhorst prokázal dotazníkovou a observační studií, že i na vyspělých a přístrojově dobře vybavených JIP je protektivní ventilace používána pouze u necelé poloviny pacientů s těžkým ARDS [10]. Jedním z důvodů je právě nemožnost zajištění dostatečné výměny krevních plynů při jejím správném nastavení. Metoda je tedy nasazována u pacientů s rizikem smrti v důsledku absence odpovědi na konvenční léčbu. Jejich onemocnění musí být potenciálně reverzibilní (nebo je reálná šance na změnu léčebného postupu, např. transplantaci) a pacienti nemají absolutní kontraindikace. Indikací k nasazení mimotělní náhrady plicních funkcí je též snaha minimalizovat rizika a nežádoucí účinky spojené s invazivní ventilací.
Nejčastějšími indikacemi jsou těžké formy ARDS s refrakterním oxygenačním selháním i při protektivně nastaveném ventilačním režimu. Všeobecně platná kritéria u ARDS nejsou konsenzuálně přijata. Dřívější „tvrdá“ kritéria nasazení přístrojů, primárně určených pro oběhovou podporu používaných v kardiochirurgii, vycházela z vysokého procenta komplikací spojených s použitím těchto přístrojů [6].
Klesající počet komplikací spojených s použitím přístrojů a kanyl určených pro plicní ECMO způsobilo výrazné „změkčení“ indikačních kritérií. S postupným technickým pokrokem dochází k nasazování mimotělní plicní podpory již v časných fázích plicních patologií a nikoli jako rescue postup.
Přestože některé studie prokázaly zlepšení oxygenace, snížení incidence ventilátorové pneumonie, snížení agresivity ventilace či zkrácení její doby [7, 11, 12], doposud chybí randomizovaná kontrolovaná studie prokazující signifikantní snížení mortality. I nejnověji publikované studie, týkající se přístrojů primárně určených pro náhradu funkce plic a sledující mortalitu, totiž používaly zejména dřívější (arteriovenózní) formu mimotělní podpory [13]. Přestože u těžkého ARDS je porušena i eliminace oxidu uhličitého, tak hlavní patologií zůstává porucha oxygenace. Je proto důvodné očekávat, že pozitivní vliv na outcome pacientů budou mít zejména venovenózní systémy poháněné pumpou, umožňující díky vysokým průtokům i účinnou oxygenaci. Tyto přístroje však byly do klinické praxe zavedeny až v roce 2011, studie s nimi tedy ještě probíhají.
V posledních letech se objevují zprávy o použití plné oxygenace a dekarboxylace u těžkých forem ARDS bez nutnosti intubace a invazivní ventilace. Pacienti byli před napojením na mimotělní plicní podporu i po ní neinvazivně ventilováni obličejovou maskou – „awake“ ARDS – převratný a donedávna nemyslitelný přístup [14].
Druhou nejčastější indikací mimotělní plicní podpory (po ARDS) je dekompenzovaná forma CHOPN. Po zavedení neinvazivní ventilace (NIV) v polovině devadesátých let minulého století došlo až k polovičnímu snížení její mortality [15]. NIV se stala etablovaným léčebným postupem. Recentní data ze Spojených států z let 1998–2008 udávají mortalitu akutní exacerbace CHOPN úspěšně léčenou NIV pouze 9% oproti 23% u pacientů ventilovaných invazivně [16]. Přesto je asi 15–26 % pacientů, u kterých neinvazivní ventilace selhává a je nutná intubace. U těchto pacientů je následně výrazně vyšší mortalita [23]. Zavádění mimotělní plicní podpory u mnoha pacientů se selhávající NIV umožnilo se intubaci a invazivní ventilaci vyhnout. Dostupné studie pracující s arteriovenózními systémy zatím snížení mortality neprokázaly [17, 18, 24]. Novější probíhající studie s venovenózními systémy s krevní pumpou by tento předpoklad měly potvrdit.
Další, podle četnosti menší, indikační skupinu tvoří stavy, kdy je intubace a invazivní ventilace principiálně nežádoucí. Kromě prolínajících se indikací výše uvedených (CHOPN, „awake“ ARDS) jsou to zejména pacienti čekající na transplantaci plic. Byly popsány případy úspěšného použití u pacientů na čekací listině s cystickou fibrózou či plicní hypertenzí, u kterých nasazení podpory překonalo akutní zhoršení plicních funkcí a umožnilo provedení transplantace [19]. Mimotělní plicní podpory se tak u některých indikací stávají alternativou invazivní umělé plicní ventilace.
Opakovaně byla plicní mimotělní podpora použita u pacientů s invazivní ventilací k transportu (i leteckému), kdy v důsledku plicní patologie nebylo možné pacienta bezpečně transportovat pomocí transportabilních ventilátorů [20]. Jedny z možných indikačních kritérií jsou v tabulce 3, klinické indikace v tabulce 4.


KONTRAINDIKACE
Jelikož se ve většině případů jedná o život zachraňující opatření, jsou kontraindikace relativní a individuální. Kromě infaustní prognózy či nesouhlasu pacienta (raritně) jde v podstatě pouze o nemožnost kanylace cévního systému a systémové antikoagulace. Kontraindikace podání heparinu se řeší alternativně (viz antikoagulace).
U arteriovenózních systémů bez krevní pumpy je kontraindikací nízký srdeční výdej a systémová hypotenze s MAP < 70 mm Hg, pokročilá forma ischemické choroby dolních končetin a nedostatečný průměr kanylované artérie. Založení prográdního bypassu do a. femoralis superficialis (používáno u venoarteriálních systémů) se u přístrojů určených pro primární náhradu plicních funkcí neprovádí. Zvýšené riziko ischémie dolních končetin představuje kontraindikaci arteriálního přístupu a má být nahrazeno venovenózním přístupem s pumpou.
ANTIKOAGULACE
Standardní metodou antikoagulace je použití nefrakcionovaného heparinu s cílovým aPTT (activated partial thromboplastin time) 50–60 sekund. Platí pravidlo, že čím nižší krevní průtok, zejména u arteriovenózních systémů, tím je nutná vyšší míra antikoagulace (aPTT 55–65 s). U vysokých průtoků 4–7 l/min stačí i hodnoty nižší (aPTT 45–55s). Je možné i monitorování podle hodnot ACT (activated clotting time). Míra antikoagulace je individuální a její účinnost je nutné pravidelně kontrolovat.
I při optimální antikoagulaci dochází časem k postupnému snižování funkce oxygenátoru, což se projevuje i na vzhledu membrány. Tmavé ostrůvky jsou způsobeny krevní sraženinou, bílé ostrůvky představují fibrin, nažloutlé pak vysrážené krevní tuky. Určité monitorování stavu postupného „ucpávání“ oxygenátoru poskytuje i měření rozdílu tlaků před membránou a za ní.
U pacientů s nemožností podávat heparin (např. heparinem indukovaná trombocytopenie, HIT) byla na pracovišti autorů úspěšně použita kontinuální antikoagulace argatrobanem (přímý inhibitor trombinu) nebo prostacyklinem. Také v literatuře jsou popsány případy úspěšného použití argatrobanu u pacientů s HIT, při ponechání membrány potažené heparinem [21].
VZTAH MIMOTĚLNÍ PLICNÍ PODPORY A NASTAVENÍ VENTILAČNÍHO REŽIMU
Po započetí mimotělního průtoku se postupně zvyšuje míra náhrady plicních funkcí, tedy průtok krve a průtok plynů. Rychlé změny těchto veličin na začátku terapie jsou nežádoucí, je potřebná adaptace systémové (na vzniklý shunt) i plicní cirkulace (na přívod okysličené krve do plic). Zároveň se snižuje agresivita ventilace, pravidelné kontroly krevních plynů jsou samozřejmostí. Ústup hyperkapnie a hypoxémie následně umožní úpravu ventilačních parametrů do režimu protektivní či ultraprotektivní ventilace s cílovými parametry dechové frekvence 6–8 za minutu a dechového objemu kolem 4 ml/kg.
V případě jakéhokoliv snížení funkce či poruchy oxygenátoru je nutné promptně upravit nastavení ventilátoru! Při zlepšování plicních funkcí se podpora ponechává v provozu, usnadňuje weaning a umožňuje časnější extubaci pacienta.
WEANING (ODVYKÁNÍ) OD MIMOTĚLNÍ PLICNÍ PODPORY
Podobně jako u indikací chybí jasná kritéria i pro odvykání od mimotělní plicní náhrady. Původně prosazovaný princip postupného snižování podpory až po její úplné vysazení a teprve následné odpojení od umělé plicní ventilace se v současné době opouští.
Naopak je snaha při lepšících se plicních funkcích (a snižující se mimotělní podpoře) nejdříve pacienta úplně odpojit od invazivní ventilace, extubovat a teprve následně ukončit plicní podporu. Umožní to zkrátit dobu sedace i plicní ventilace, časnější mobilizaci i perorální příjem. Použití neinvazivní ventilace je pravidlem. Případné přechodné zhoršení plicních funkcí po extubaci se překlene opětovným zvýšením mimotělní podpory ve spojení s neinvazivní ventilací.
Jednoduchou metodou zhodnocení účinnosti funkce oxygenátoru je krátkodobé nastavení gas-flow na 0 l/min. Rozdíl v hodnotách PaO2 a PaCO2 před nastavením a po něm ukáže podíl mimotělní podpory na hodnotě krevních plynů. Stejný postup se používá při ukončení metody, kdy se po dobu minimálně 30 min ponechává bez průtoku plynné směsi. Pokud nedojde k výraznému zhoršení stavu pacienta či krevních plynů, je možné podporu ukončit a pacienta dekanylovat.
Etickým problémem může být ukončení podpory u pacientů, kteří se na ní stali trvale závislými, např. pacienti se CHOPN. To se stává výjimečně u některých nemocných se správně stanovenou indikací (s předpokladem reverzibilního plicního postižení), u kterých ale nedošlo k dostatečnému zlepšení plicních funkcí. Ukončení plicní podpory se u nich řeší obecnými zásadami přechodu z intenzivní do paliativní péče. Ty jsou v jednotlivých zařízeních rozdílné, závislé i na kulturních a jiných odlišnostech. Nejdůležitějším vodítkem pro rozhodování bývají opakované rozhovory s pacientem a jeho příbuznými.
KOMPLIKACE
U arteriovenózních systémů bez krevní pumpy je nejzávažnější komplikací ischémie dolní končetiny, kde je zavedena arteriální kanyla. Použitím speciálních nízko-odporových kanyl nové konstrukce o malém průměru se však toto riziko pohybuje mezi 1–2 %. Někdy dochází k prolongovanému arteriálnímu krvácení po odstranění kanyly, které se však dá ošetřit chirurgicky.
I u venovenózních systémů s krevní pumpou je většina komplikací vztažena ke kanylaci cévního systému – zejména trombóza v místě zavedení, v kanyle, popř. v oxygenátoru. U kanyl silnějšího průměru může docházet i ke zhoršení venózního odtoku příslušné oblasti. Krvácivé stavy bývají spojené s prováděnou antikoagulací.
KOMBINACE S OSTATNÍMI LÉČEBNÝMI METODAMI V INTENZIVNÍ PÉČI
Pronační poloha se v posledních letech etablovala jako standardní postup u těžkých forem ARDS [22]. Její používání ve spojení s mimotělní podporou se nevylučuje. U bezpumpových arte-riovenózních systémů pomáhá zlepšit oxygenaci, u venovenózních systémů (plně oxygenujících) je její použití méně časté, většinou z jiných důvodů než potřeby zlepšení oxygenace (např. drenážní poloha plic či snaha o homogenizaci a znovuotevření atelektatických dorzobazálních partií plicní tkáně). Při zlepšování plicních funkcí nejdříve ukončujeme pronační polohu a teprve následně plicní podporu.
Na pracovišti autorů bylo opakovaně plicní ECMO použito i ve spojení s renální eliminační technikou. U venovenózních systémů poháněných pumpou je za membránovým oxygenátorem část krve přesměrována do přístroje renální eliminace a po očištění se vrací zpět do venózní kanyly. Nezvykle působí jen barva dialyzačního filtru, která je jasně červená díky plně oxygenované krvi po průchodu membránou oxygenátoru.
Od roku 2013 je k dispozici komerční systém vzniklý spoluprací firem Novalung a Gambro, který naopak do dialyzačního okruhu zařazuje membránový oxygenátor. Průtok krve je zajišťován dialyzačním přístrojem a je tedy významně nižší než u přístrojů pro plicní náhradu. Zařízení je proto vhodné pouze k dekarboxylaci.
Z důvodu potřeby systémové antikoagulace heparinem je i renální eliminace prováděna bez použití citrátu.
ZÁVĚR
Invazivní plicní ventilace je přes svůj nesporný benefit spojena s nežádoucími účinky, které způsobují poškození plicní tkáně. Mimotělní plicní podpora pomocí oxygenace a eliminace oxidu uhličitého významným způsobem toto poškození minimalizuje. V posledních letech především díky zavádění moderních venovenózních systémů zažívá prudký rozmach a postupně se rozšiřují indikace k jejímu nasazení. Spolu s technickým pokrokem je to pravděpodobně cesta do budoucna k dalšímu snížení mortality na akutní respirační selhání.
Do redakce došlo dne 15. 8. 2013.
Do tisku přijato dne 20. 11. 2013.
Adresa pro korespondenci:
MUDr. Bronislav Stibor
ICU
Landesklinikum Baden bei Wien
Wimmergasse 19
2500 Baden bei Wien
Austria
e-mail: b.stibor@seznam.cz
Sources
1. Gibbon, J. H. Jr. The development of the heart-lung apparatus. Am. J. Surg., 1978, 135, p. 608–619.
2. Hill, J. D., O’Brien, T. G., Murray, J. J. et al. Prolonged extracorporal oxygenation for acute post-traumatic respiratory failure (shock-lung syndrome). Use of the Bramson membrane lung.N. Engl. J. Med., 1972, 23, 286, 12, p. 629–634.
3. Lewandowski, K., Rossaint, R., Pappert, D. et al. High survival rate in 122 ARDS patients managed according to a clinical algo-rithm including extracorporeal membrane oxygenation. Intensive Care Med., 1997, 23, p. 819–835.
4. Gattinoni, L., Agostoni, A., Pesenti, A. et al. Treatment of acute respiratory failure with low-frequency positive-pressure ventilation and extracorporeal removal of CO2. Lancet, 1980, 2, 8189, p. 292–294.
5. Bein, T., Weber, F., Philipp, A. et al. A new pumpless extracorporeal interventional lung assist in critical hypoxemia/hypercapnia. Crit. Care. Med., 2006, 34, p. 1372–1377.
6. Peek, G. J., Mugford, M., Tiruvoipati, R., Wilson, A., Allen, E., Thalanany, M. M., Hibbert, C. L., Truesdale, A., Clemens, F., Cooper, N., Firmin, R. K., Elbourne, D. Efficacy and economic assessment of conventional ventilatory support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicentre randomised controlled trial. Lancet, 2009, 374, p. 1351–1363.
7. Maclaren, G., Combes, A., Bartlett, R. H. Contemporary extracorporeal membrane oxygenation for adult respiratory failure: life support in the new era. Intensive Care Med., 2011, 38, p. 210–220.
8. Ohtake, S., Kawashima, Y., Hirose, H., Matsuda, H., Nakano, S., Kaku, K. et al. Experimental evaluation of pumpless arteriovenous ECMO with polypropylene hollow fiber membrane oxygenator for partial respiratory support. Trans. Am. Soc. Artif. Intern. Organs., 1983, 29, p. 237–241.
9. Müller, T., Lubnow, M., Philipp, A. et al. Extracorporeal pump-less interventional lung assist in clinical practice: determination of efficacy. Eur. Respir. J., 2009, 33, p. 551–558.
10. Brunkhorst, F. M., Engel, C., Jaschinsky, U. et al. Treatment of severe sepsis and septic shock in Germany: the gap between perception and practice - Results from the German Prevalence Study, Infection, 2005, 33 (Suppl. 1), A112-0.
11. Terragni, P. P., Del Sorbo, L., Mascia, L., Urbino, R., Martin, E. L.,Birocco, A., Faggiano, C., Quintel, M., Gattinoni, L., Ranieri, V. M.Tidal volume lower than 6 ml/kg enhances lung protection: role of extracorporeal carbon dioxide removal. Anesthesiology, 2009, 111, p. 826–835.
12. Zimmermann, M., Bein, T., Arlt, M., Philipp, A., Rupprecht, L.,Mueller, T., Lubnow, M., Graf, B. M., Schlitt, H. J. Pumpless extracorporeal interventional lung assist in patients with acute respiratory distress syndrome: a prospective pilot study. Crit. Care, 2009, 13, 1, R10.
13. Bein, T., Weber-Carstens, S., Goldmann, A., Müller, T., Staudinger T., Brederlau, J., Muellenbach, R., Dembinski, R., Graf, B. M., Wewalka, M., Philipp, A., Wernecke, K. D., Lubnow, M., Slutsky, A. S. Lower tidal volume strategy (≈3 ml/kg) combined with extracorporeal CO2 removal versus ‚conventional‘ protective ventilation (6 ml/kg) in severe ARDS: the prospective randomized Xtravent-study. Intensive Care Med., 2013, 39, 5, p. 847–856.
14. Wiesner, O., Hadem, J., Sommer, W., Kühn, C., Welte, T., Hoeper, M. M. Extracorporeal membrane oxygenation in a non--intubated patient with acute respiratory distress syndrome (ARDS). Eur. Respir. J., 2012, 40, 5, p. 1296–1298.
15. Brochard, L., Mancebo, J., Wysocki, M. et al. Noninvasive ventilation for acute exacerbations of chronic obstructive pulmonary disease. N. Engl. J. Med., 1995, 333, p. 817–822.
16. Tabak, Y. P. Mortality and need for mechanical ventilation in acute exacerbations of chronic obstructive pulmonary disease. Arch. Intern. Med., 2009, 169, p. 1595–1602.
17. Kluge, S., Braune, S., Enge, M. et al. Avoiding invasive mechanical ventilation by extracorporeal carbon dioxide removal in patients failing noninvasive ventilation. Intensive Care Med., 2012, 38, p. 1632–1639.
18. Burki, N. K., Mani, R. K., Herth, F. J. F. et al. A novel extracorporeal CO2 removal SystemExtracorporeal CO2 removal in COPD results of a pilot study of hypercapnic respiratory failure inpatients with COPD. Chest, 2013, 143, p. 678–686.
19. Strueber, M., Hoeper, M. M., Fischer, S., Cypel, M., Warnecke, G., Gottlieb, J., Pierre, A., Welte, T., Haverich, A., Simon, A. R., Keshavjee, S. Bridge to thoracic organ transplantation in patients with pulmonary arterial hypertension using a pumpless lung assist device. Am. J. Transplant., 2009, 9, p. 853–857.
20. Zimmermann, M., Bein, T., Philipp, A., Ittner, K., Foltan, M., Drescher, J. et al. Interhospital transportation of patients with severe lung failure on pumpless extracorporeal lung assist. Br. J. Anaesth., 2006, 96, p. 63–66.
21. Dolch, M. E., Frey, L., Hatz, R. et al. Extracorporeal membrane oxygenation bridging to lung transplant complicated by heparin-induced thrombocytopenia. Exp. Clin. Transplant., 2012, 8, p. 329–332.
22. Sud, S., Friedrich, J. O., Taccone, P., Polli, F., Adhikari, N. K., Latini, R., Pesenti, A., Guerin, C., Mancebo, J., Curley, M. A., Fernandez, R., Chan, M. C., Beuret, P., Voggenreiter, G., Sud, M., Tognoni, G., Gattinoni L. Prone ventilation reduces mortality in patients with acute respiratory failure and severe hypoxemia: systematic review and meta-analysis. Intensive Care Med., 2010, 36, p. 585–599.
23. Quinnell, T. G., Pilsworth, S., Shneerson, J. M., Smith, I. E. Prolonged invasive ventilation following acute ventilatory failure in COPD: weaning results, survival, and the role of noninvasive ventilation. Chest, 2006, 129, p. 133–139.
24. Lund, L. W., Federspiel, W. J. Removing extra CO2 in COPD patients. Curr. Respir. Care. Rep., 2013, 2, p. 131–138.
25. Lojewski, C., Bein, T., Pfeifer, M., Rossaint, R. Extrakorporale Lungenersatzverfahren. DIVI, 2012, 3, 4, p. 157–165.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care MedicineArticle was published in
Anaesthesiology and Intensive Care Medicine

2014 Issue 2
-
All articles in this issue
- Metody mimotělní oxygenacea eliminace CO2 určené primárně k náhradě plicních funkcí
- Statické a dynamické testy v řízení volumoterapie
- Současné postupy v porodnické anestezii IV. – anesteziologické komplikace u císařského řezu
- Fast-track není jen fyziologická anestezie
- Hodnoty diference silných iontů (SID) u kriticky nemocných pacientů s normálními hodnotami arteriálního pH, pCO2, BE a HCO3-a jejich vliv na mortalitu
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Statické a dynamické testy v řízení volumoterapie
- Současné postupy v porodnické anestezii IV. – anesteziologické komplikace u císařského řezu
- Metody mimotělní oxygenacea eliminace CO2 určené primárně k náhradě plicních funkcí
- Fast-track není jen fyziologická anestezie
