Aktuální trendy dlouhodobé farmakologické sedace kriticky nemocných
Current trends in long-term pharmacological sedation of the critically ill
Pain and stress are very common in critically ill patients. Provision of adequate analgesia and elimination of psychological discomfort are essential components of treatment goals on the ICU care. In the past few years there has been a focus on the side-effects of long-term sedation such as the presence of delirium, cognitive dysfunction, prolongation of the time on mechanical ventilation, and ICU and hospital length of stay. The new 2013 guidelines by the American College of Critical Care Medicine and Society of Critical Care Medicine have redefined the management of sedation, analgesia and prevention and treatment of the delirium.
The traditional approach represents giving sedatives to all mechanically ventilated patients. The principle of deep level sedation in all patients has become obsolete. There is a focus on pain management firstly with intravenous analgesics, and sedation is used only if needed. Sedation with modern nonbenzodiazepine drugs (such as dexmedetomidine) is preferred while benzodiazepine-based sedation should be used only in specific situations.
Implementation of scoring systems for effective monitoring of pain, depth of sedation and delirium is also essential.
Keywords:
sedation – analgesia – RASS – CAM-ICU – guidelines – delirium – benzodiazepines – dexmedetomidine
Authors:
Stibor Bronislav; Schwameis Franz
Authors‘ workplace:
ICU, Landesklinikum Baden bei Wien, Austria
Published in:
Anest. intenziv. Med., 25, 2014, č. 4, s. 307-314
Category:
Intensive Care Medicine - Review Article
Overview
Kriticky nemocný pacient je často vystaven stresu a bolesti. Zajištění analgezie a odstranění psychického diskomfortu patří k základním léčebným cílům intenzivní medicíny. V poslední době je věnována velká pozornost nežádoucím účinkům dlouhodobé sedace, jako je vznik deliria, kognitivní poruchy, prodloužení doby umělé plicní ventilace, doby pobytu v intenzivní péči i délky hospitalizace. Recentně publikovaná doporučení American College of Critical Care Medicine a Society of Critical Care Medicine z roku 2013 definují nový management sedace, léčby bolesti a prevence a léčby deliria.
Tradiční přístup znamenal podání sedativ všem ventilovaným pacientům. V současnosti se tento princip hluboké sedace (deep level of sedation) u všech pacientů opouští a klade se důraz na odstranění bolesti podáním intravenózních analgetik (analgesia-first sedation). Teprve pokud analgezie nestačí k odstranění stresu, přidává se sedativum (sedation-as-needed). Sedace na základě benzodiazepinů zůstává vyhrazena pro specifické klinické situace, je preferována sedace moderními léky nebenzodiazepinového typu, např. dexmedetomidinem. Jako nezbytným se jeví i zavedení skórovacích systémů pro sledování stupně agitovanosti, bolesti a deliria.
Klíčová slova:
sedace – analgezie – RASS – CAM-ICU – doporučení – delirium – benzodiazepiny – dexmedetomidin
ÚVOD
Kriticky nemocný pacient v intenzivní péči trpí zpravidla psychickým i fyzickým stresem. Je vystaven strachu a úzkosti nejen v důsledku základního onemocnění, ale i v důsledku diagnostických, terapeutických i ošetřovatelských postupů. Některé tyto postupy jsou navíc spojeny s diskomfortem a bolestí různé intenzity. Negativně bývá vnímána i ztráta soukromí a nemožnost dostatečné komunikace s okolím či rodinnými příslušníky. Nejen u krajních věkových skupin je častá i dezorientace v čase a porucha pravidelného rytmu spánku a bdění.
Z těchto důvodů je jednou z priorit v péči o kriticky nemocné účinné odstranění bolesti a psychického diskomfortu pacienta. Monitorování míry bolesti, agitace a deliria a jejich adekvátní prevence a léčba patří v současnosti mezi doporučované procesní indikátory kvality intenzivní péče [1, 2].
V lednu 2013 byla publikována nová doporučení společností American College of Critical Care Medicine a Society of Critical Care Medicine [3]. Tato doporučení, revidující poslední vydání z roku 2002, vznikala po dlouhou dobu šesti let a konečné znění pochází z prosince roku 2010. Následně však trvalo více jak dva roky, než byla zveřejněna definitivní verze. Přesto jsou relevantní klinické studie, které byly publikovány v letech 2011–2012, v těchto textech zmíněny. Americká doporučení byla následně převzata a zapracována dalšími významnými společnostmi intenzivní medicíny.
CÍLE ANALGEZIE A SEDACE U PACIENTŮ V INTENZIVNÍ PÉČI
Recentní práce definovaly správně prováděnou analgezii a sedaci jako takové farmakologické i nefarmakologické ovlivnění pacienta, který je orientován, zbaven bolesti a pocitů strachu či úzkosti, zároveň je však při vědomí či lehce probuditelný a dobře spolupracující. Současně je třeba minimalizovat riziko vědomého či bezděčného sebeohrožení pacienta, např. vytažením invazivních vstupů či endotracheální kanyly [3].
Použití skórovacích systémů pro sledování agitovanosti, bolesti a deliria na JIP se z tohoto pohledu jeví nezbytné. Zavedení protokolů pro správné provádění analgezie a sedace má minimalizovat riziko její nežádoucí hloubky a excesivního používání farmak [2].
MONITOROVÁNÍ SEDACE, ANALGEZIE A VÝSKYTU DELIRIA
Dosažení uspokojivé úrovně sedace není možné bez jejího monitorování. Na rozdíl od sledování stavu a funkce jiných orgánových systémů jsou laboratorní, přístrojové a zobrazovací možnosti omezené. Důraz se klade především na sledování klinického stavu pacienta a pro potřebu kvantifikace a srovnávání se hodnotí podle různých skórovacích systémů. Tyto systémy jsou určeny pro komunikující i nekomunikující pacienty a sledují nejen slovní vyjádření pacienta, ale i jeho motorické (cílené či necílené pohyby končetin, pohyby hlavy, grimasování apod.) a vegetativní projevy (svalové napětí, pocení apod.). Součástí některých systémů je i sledování parametrů kardiovaskulární a dýchací soustavy.
Jako určitý standard slouží Richmond Agitation and Sedation Scale (RASS) [4, 5]. Tato desetistupňová škála byla vyvinuta interdisciplinární skupinou univerzity v Richmondu (Virginia, USA) [6]. Ze všech dosavadních skórovacích systémů vykazuje nejvyšší míru validity a reliability (spolehlivosti) a spolehlivě odráží i změny hloubky sedace u konkrétního pacienta. Je také součástí skórovacího systému hodnotícího úroveň deliria (Confusion Assessment Method for the Intensive Care Unit, CAM-ICU) [7]. Podle posledních doporučení by měl být klinický stav každého pacienta na JIP hodnocen pomocí RASS každých 8 hodin [3]. Hodnocení sedace podle RASS je uvedeno v tabulce 1.
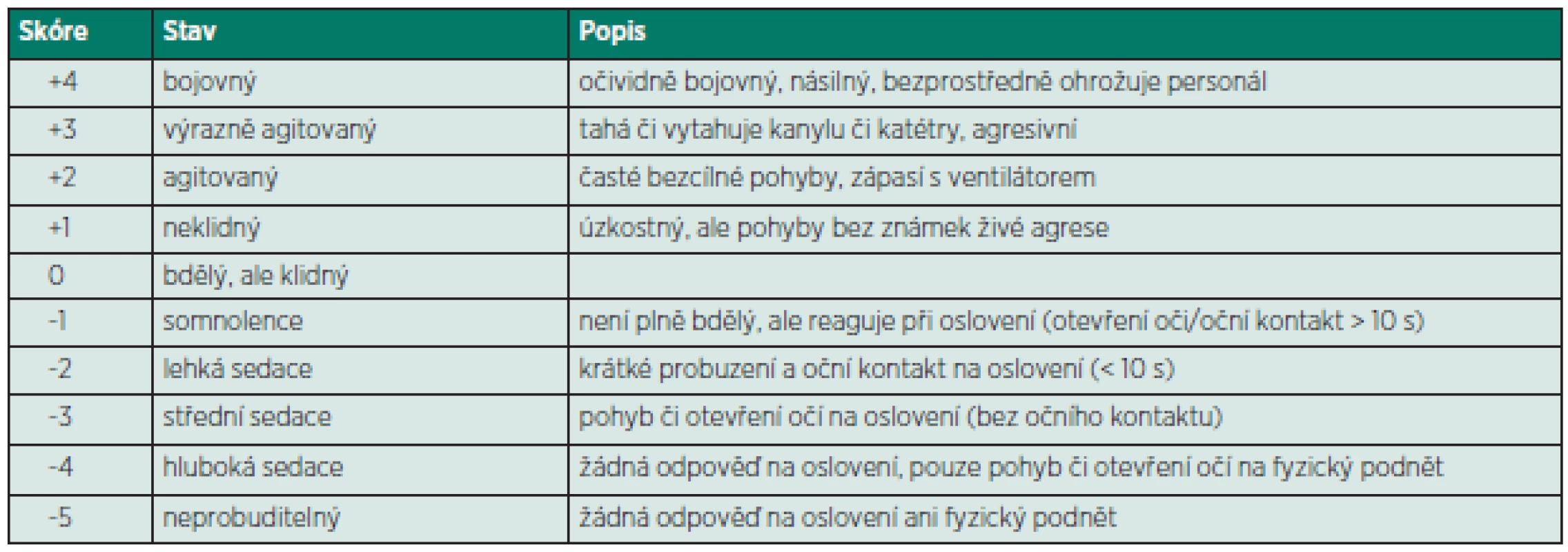
Mezi další používané skórovací systémy patří např. Sedation-Agitation Scale (SAS), pocházející z roku 1994. Původně byl určen pro potřebu hodnocení sedace pomocí kontinuální infuze haloperidolu u agitovaných nemocných [43].
NĚKTERÉ NEŽÁDOUCÍ ÚČINKY A RIZIKA SEDACE
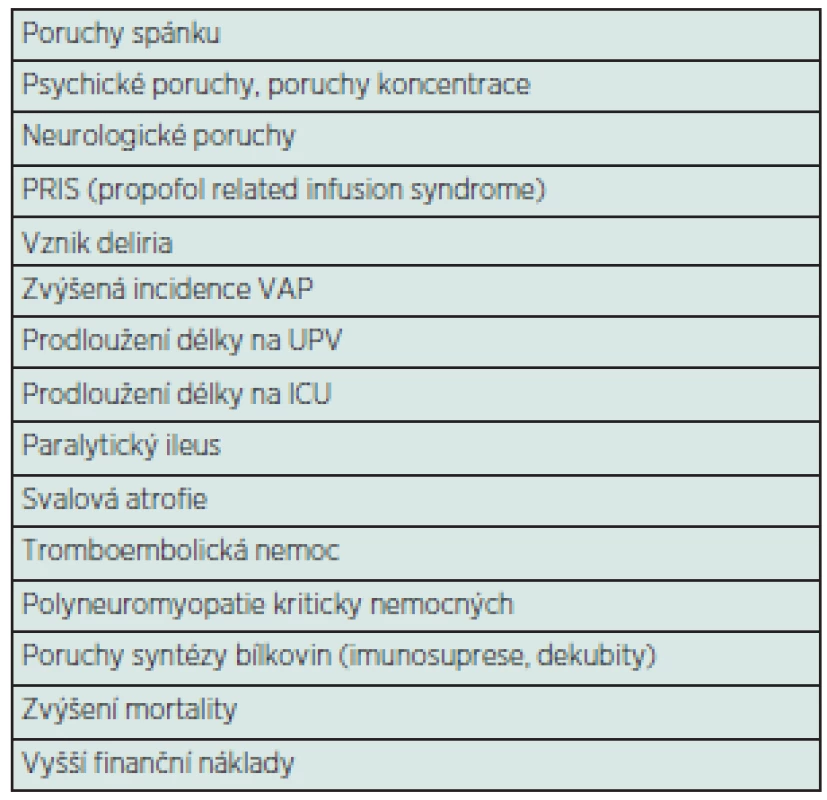
Provádění analgezie a sedace u kriticky nemocných může být spojeno s nežádoucími účinky, přičemž se nejedná pouze o vedlejší účinky jednotlivých farmak. Nesprávně prováděná či příliš hluboká sedace způsobuje prodloužení doby umělé plicní ventilace, délku pobytu na JIP, zvýšené riziko paralytického ileu, polyneuromyopatie kriticky nemocných apod.
Častým následkem u pacientů po dimisi z intenzivní péče jsou poruchy kognitivních a ostatních neurologických funkcí [8]. Zprvu byly popisovány u pacientů po kardiochirurgických operacích nebo u pacientů s ARDS. V jedné studii bylo prokázáno, že 53 % pacientů po aortokoronárním bypassu vykazovalo poruchy kognitivních funkcí při propuštění z nemocnice a u 42 % těchto pacientů tyto poruchy přetrvávaly i po pěti letech [9].
V jiné práci u pacientů s ARDS (tedy nechirurgických) byla porucha kognitivních funkcí pozorována u 100 % pacientů při dimisi, přičemž alespoň jeden ze symptomů přetrvával i jeden rok po propuštění u 78 % z nich [10]. V pozadí mozkové dysfunkce stojí především mechanismy spojené s kritickým onemocněním jako takovým: mozková hypoxie a hypoperfuze, metabolická encefalopatie, delirium, embolické příhody a jiné. V posledních letech se však do popředí dostává i problematika poruchy mozkových funkcí související s léčebnými postupy v intenzivní péči, zejména se sedací.
Nadměrná sedace je někdy zneužívána ošetřujícím personálem, který vychází z předpokladu, že péče o hluboce sedovaného pacienta je snazší a pohodlnější. Možné nežádoucí účinky a komplikace dlouhodobé sedace jsou přehledně uvedeny v tabulce 2.
Delirium
Delirium představuje častý problém u pacientů v intenzivní péči. Uvádí se, že se rozvine u 60–80 % všech ventilovaných pacientů [11]. Dělí se podle míry psychomotorické aktivity na tři základní skupiny – hyperaktivní, hypoaktivní a smíšené.
Až u 75 % pacientů v intenzivní péči není delirium adekvátně léčeno, především z důvodu absence jeho sledování pomocí skórovacích systémů. Delirium je zároveň nezávislý prediktor pro prodlouženou délku hospitalizace (v průměru o 10 dnů), vyšší mortalitu po 6 měsících a vyšší výskyt kognitivní dysfunkce v době ukončení hospitalizace [12]. Některé studie prokazují vliv použitých sedativ na výskyt četnosti deliria (viz níže).
Monitorování a hodnocení přítomnosti deliria
Vhodným systémem pro sledování rizika deliria u kriticky nemocných je Confusion Assessment Method for the Intensive Care Unit (CAM-ICU). Tento test vychází z dosud nejčastěji používaného standardizovaného nástroje pro detekci deliria odborníky mimo psychiatrii [13]. Test je jednoduchý a časově nenáročný. Jelikož nevyžaduje verbální odpovědi, je proveditelný i u intubovaných pacientů.
Hodnocení deliria tímto testem se skládá ze dvou částí. První částí je zhodnocení stupně bdělosti a agitovanosti pomocí skóre RASS. V druhé části se posuzuje přítomnost deliria podle algoritmu vycházejícího z kritérií podle Americké psychiatrické asociace. Algoritmus je čtyřstupňový – sleduje se náhle vzniklá změna stavu vědomí nebo psychického stavu, stav pozornosti, dezorganizace myšlení a úroveň psychomotorické aktivity (viz tab. 3). Její plná verze v českém jazyce je dostupná i na internetu na stránkách ICUdelirium [14]. Problematické zůstává testování pacientů s afázií, kteří nejsou schopni porozumět jednotlivým dotazům a výzvám.
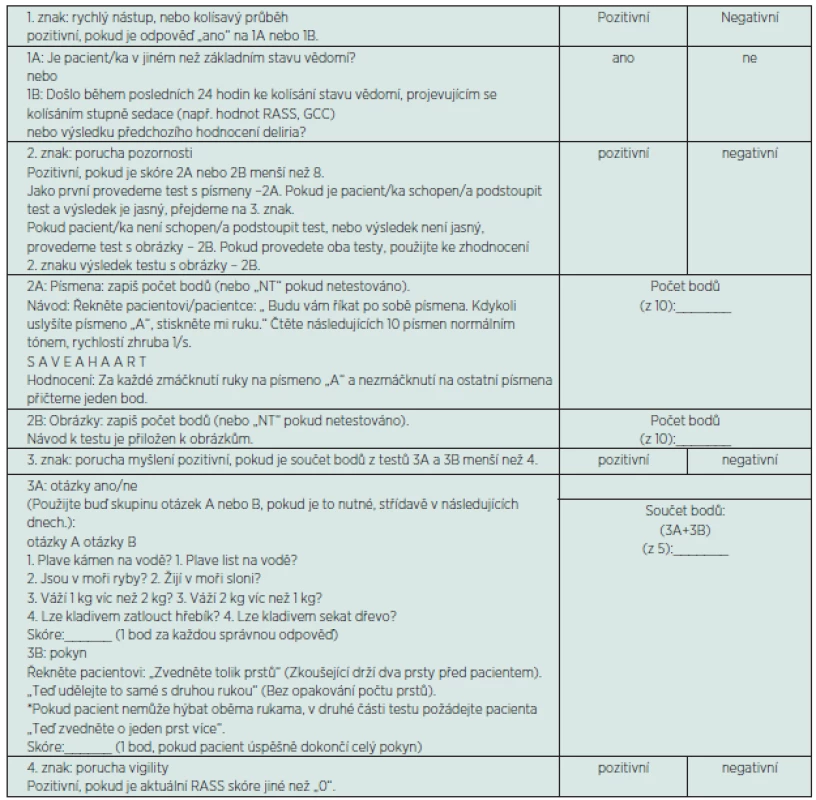
Široce se diskutuje o otázce, jak často je nutné monitorovat přítomnost deliria či riziko jeho vzniku. V literatuře neexistuje jednoznačný interval, nicméně poslední práce doporučují provádět hodnocení pacientova stavu např. pomocí CAM-ICU po 8 hodinách [44].
FARMAKA NEJČASTĚJI POUŽÍVANÁ PRO SEDACI KRITICKY NEMOCNÝCH
Benzodiazepiny
Patří doposud mezi nejčastěji používaná sedativa v intenzivní péči, v Evropě midazolam, v zámoří lorazepam [15]. Mají v závislosti na dávce anxiolytický, amnestický, sedativní, hypnotický a antikonvulzivní účinek. Analgetický účinek chybí. Působí přes GABAA receptory.
Účinek benzodiazepinů má velkou interindividuální variabilitu s možností kumulace. Midazolam má nejkratší kontext-senzitivní poločas a je tedy nejlépe řiditelný. Benzodiazepiny však mají velké riziko vzniku závislosti a zejména deliria [16]. Starší pacienti jsou prokazatelně citlivější k jejich sedativnímu účinku [17]. Nová doporučení sice nezakazují použití benzodiazepinů obecně, ale omezují jejich indikace na léčbu syndromu z jejich odnětí nebo odnětí alkoholu. Taktéž jsou doporučovány díky svým antikonvulzivním účinkům u křečových stavů [3].
Propofol
Intravenózní anestetikum mající sedativní, hypnotické, anxiolytické, amnestické a antiemetické účinky bez analgetické komponenty. Jeho amnestické účinky u lehčí sedace jsou menší ve srovnání s benzodiazepiny. Jako velmi liposolubilní látka s vysokou hepatální i extrahepatální clearance má velmi rychlý nástup i odeznění účinku. Nicméně dlouhodobé podávání může vést k saturaci periferních tkání a prolongovanému působení [18].
Způsobuje v závislosti na dávce i dechovou depresi, má hypotenzní účinek a u dlouhodobější aplikace může vzniknout vzácná komplikace PRIS (propofol related infusion syndrome) s četností cca 1%, ale vysokou mortalitou (až 33%) [19].
α2-agonisté
Jsou to látky působící na α2-receptory v locus coeruleus a míše. Mají sedativní a mírně analgetický efekt, avšak bez přítomnosti dechové deprese. Tím jsou určeny jako alternativa vůči benzodiazepinům a propofolu k sedaci kriticky nemocných.
Klonidin
Látka původně určená k léčbě hypertenze je v intenzivní péči používána přídatně k léčbě syndromu z odnětí, jelikož účinně tlumí vegetativní symptomy. Pooperační sedace klonidinem je spojena s nižším výskytem deliria, časnější extubací a kratší dobou pobytu na JIP [20].
Dexmedetomidin
V Evropě je pro dlouhodobou sedaci dostupný od roku 2011. Má 8krát vyšší afinitu k α2-receptoru než klonidin. Vykazuje sedativní, analgetický a sympatikolytický efekt. Jeho sedativní účinky vykazují v klinické praxi určité odlišnosti od ostatních sedativ. Pacienti jsou snáze probuditelní a schopni spolupráce. Účinek nastupuje cca po 15 minutách a požadovaná úroveň sedace se dosahuje asi 1 hodinu po začátku kontinuální aplikace. Nástup účinku lze urychlit bolusovou sytící dávkou, která však je, zejména u kriticky nemocných pacientů, spojena s hemodynamickou instabilitou. Dexmedetomidin je rychle redistribuován do periferních tkání a metabolizován v játrech (poločas 3 hodiny) [21].
Před mnoha lety bych schválen v USA pro krátkodobou sedaci (< 24 hod.) v nízkém dávkování do 0,7 μ/kg/min. Následně na základě nových studií byl povolen i pro dlouhodobou sedaci (až 28 dnů) a ve vyšších dávkách do 1,5 μg/kg/min [22]. Ve srovnání s midazolamem byla prokázána signifikantně nižší doba na umělé plicní ventilaci, a to i u dlouhodobě ventilovaných pacientů [23]. Studie MENDS a SEDCOM ukázaly snížení výskytu deliria ve srovnání s midazolamem, lorazepamem i propofolem [24, 25].
Jeho nejčastějšími nežádoucími účinky jsou hypotenze a bradykardie. Jelikož nezpůsobuje dechovou depresi, je ve Spojených státech jediným schváleným sedativem pro použití u neintubovaných pacientů a jeho aplikace může pokračovat i po extubaci pacienta [26]. Významnou vlastností je i jeho analgetický a opioidy šetřící efekt, který ještě nebyl dokonale vysvětlen [27]. Nevýhodou je doposud vysoká cena léku.
VYBRANÉ KLINICKÉ STUDIE A METAANALÝZY SROVNÁVAJÍCÍ NEJČASTĚJI POUŽÍVANÁ SEDATIVA
Sedativa používaná v intenzivní péči mají umožňovat mělkou sedaci, kdy je pacient snadno probuditelný, s rychlým nástupem i odezněním účinku a s minimem vedlejších efektů. Intravenózní benzodiazepiny, zvláště midazolam, byla po dlouhou dobu nejčastěji používaná sedativa v intenzivní péči dospělých pacientů. Barbituráty, diazepam a ketamin jsou používány daleko méně [28].
V poslední dekádě se v literatuře objevuje rostoucí počet prací, které ukazují na zhoršený funkční výsledek pacientů sedovaných benzodiazepiny (zejména midazolamem a lorazepamem) ve srovnání s nebenzodiazepinovými hypnotiky (zejména propofolem a dexmedetomidinem) [29, 30].
Do nových amerických doporučení je zahrnuta metaanalýza celkem 13 studií (zahrnující 1 551 pa-cientů) srovnávající sedaci benzodiazepiny (midazolam nebo lorazepam) a nebenzodiazepiny (propofol nebo dexmedetomidin) [3]. Tato práce neprokázala signifikantní rozdíl v délce pobytu na JIP. Ovšem při zahrnutí pouze studií se středně vysokou a vysokou kvalitou (6 z celkových 13) se ukázalo, že sedace benzodiazepiny prodlužuje pobyt na JIP přibližně o 0,5 dne. Čtyři studie zároveň prokázaly prodloužení doby na umělé plicní ventilaci při použití benzodiazepinů [31].
V roce 2013 Fraser provedl update této metaanalýzy. Zahrnul celkem šest studií s celkovým počtem 1 235 kriticky nemocných. Vyřadil z původní metaanalýzy tři studie týkající se kardiochirurgických pacientů, kteří setrvávají v intenzivní péči obecně kratší dobu. A naopak zařadil výsledky recentní studie MIDEX, která při vzniku amerických doporučení nebyla k dispozici (viz níže). Srovnával tedy sedaci midazolamem vs. dexmedetomidinem, lorazepamem vs. dexmedetomidinem, midazolamem vs. propofolem a lorazepamem vs. propofolem. Tato metanalýza ukázala, že sedace prováděná propofolem nebo dexmedetomidinem byla spojena s kratší dobou pobytu na JIP (o 1,6 dne, p = 0,0005) a kratší dobou umělé plicní ventilace (o 1,9 dne, p < 0,00001) než sedace prováděná benzodiazepiny. Vliv na krátkodobou mortalitu prokázán nebyl [32].
V březnu 2012 byla publikována v časopise JAMA práce zahrnující dvě studie srovnávající sedaci dexmedetomidinem oproti propofolu (PRODEX) nebo midazolamu (MIDEX). Randomizovaná, multicentrická, dvojitě slepá studie MIDEX (251 pacientů ve skupině s midazolamem, 249 pacientů ve skupině s dexmedetomidinem) byla provedena ve 44 centrech 9 evropských zemí. Studie PRODEX byla provedena v 31 centrech v 6 zemích Evropy a dvou centrech v Rusku a sledovala 247 pacientů sedovaných propofolem a 251 pacientů sedovaných dexmedetomidinem.
Dexmedetomidin byl testován na noninferioritu vůči oběma lékům, co se týká délky požadovaného stupně sedace (měřeno pomocí RASS), a na superioritu, co se týká délky invazivní ventilace. Sekundárními end-points studie byla schopnost pacienta sdělit bolest (měřeno vizuální analogovou šálou, VAS) a délka pobytu na JIP. Délka umělé plicní ventilace byla u dexmedetomidinu signifikantně kratší ve srovnání s midazolamem (123 hodin vs. 164 hodin, p = 0,03). Ve srovnání s propofolem byla rovněž kratší, ale ne signifikantně (97 hodin vs. 118 hodin, p = 0,24). Pacientova schopnost sdělit bolest byla u dexmedetomidinu vyšší ve srovnání s oběma ostatními léky, v obou případech signifikantně s p < 0,001. Nebylo překvapením, že byly při použití dexmedetomidinu častější hypotenze a bradykardie, jak ve srovnání s midazolamem(p = 0,007), tak i propofolem (p < 0,001) [33].
NEFARMAKOLOGICKÉ POSTUPY SOUVISEJÍCÍ S ANALGEZIÍ A SEDACÍ
Nefarmakologické postupy se ukazují být významnou součástí péče o kriticky nemocné. Zahrnují častou komunikaci s pacientem, opakované vysvětlování důvodů jeho pobytu v intenzivní péči a všech prováděných výkonů. Velmi důležité se ukazuje zachování pravidelného rytmu spánku a bdění, čemuž napomáhá redukce hluku a osvětlení v nočních hodinách [34, 35].
Stejně tak je předpokládán pozitivní vliv časné mobilizace na funkční zotavení pacienta. V multicentrické randomizované studii byla prokázána výrazná redukce výskytu deliria, nutnosti hluboké sedace, délky umělé plicní ventilace i délky pobytu na JIP u pacientů s intenzivně prováděnou časnou mobilizací [36]. V následné studii se ukázalo i zkrácení doby hospitalizace a pokles nemocničních nákladů [37].
Nefarmakologické ovlivnění bolesti – uklidňující hudba a relaxační techniky mohou potencovat účinek opioidů a snižovat jejich spotřebu. Přestože je jejich použití levné, snadné a bezpečné, existuje dosud jen málo studií, které by prokázaly jejich efektivitu [38, 39].
NOVÉ POSTUPY V KONCEPTU SEDACE KRITICKY NEMOCNÝCH
Podle současných doporučení je cílem sedace pacient, který je vzhůru nebo snadno probuditelný, netrpí bolestí, strachem ani úzkostí a dobře snáší diagnostické a léčebné postupy v intenzivní péči (RASS 0 nebo -1).
V nových doporučeních se zdůrazňuje především odstranění bolesti podáním analgetik, (analgesia-first sedation). U mnohých pacientů totiž odstranění bolesti vede k ústupu neklidu a psychického diskomfortu a sedativní látky nejsou potřeba. Přestože je možné analgezii zajistit i neopiodními analgetiky, nejčastěji se provádí intravenózní aplikací opioidů, např. morfinu. Teprve pokud aplikace analgetik nestačí k odstranění stresu, je nutné přidat sedativa. Tento přístup ukázal možnost snížení délky na umělé plicní ventilaci během 28denního sledování i zkrácení pobytu na JIP [40].
Bylo opakovaně prokázáno, že přílišná hloubka sedace je spojena s vyšším výskytem deliria a prodloužením doby umělé plicní ventilace. V roce 2000 představil Kress model denní přerušování sedace (daily interruption of sedative infusions, DIS) a ukázal její praktickou proveditelnost a dobrou toleranci pacientem. Použití „ABC-bundel (Awakening and Breathing Controlled trial)“ umožňuje zkrácení doby na ventilátoru i snížení mortality po 1 roce. Sedace je změlčována (eventuálně přerušována) každých 24 hodin, podmínkou je zachování účinné analgetizace pacienta. Tento model redukuje incidenci několika nejčastějších komplikací spojených s pobytem v intenzivní péči – ventilátorové pneumonie, bakteriémie, trombo-embolické nemoci, barotraumatu, sinusitidy a cholestázy [41].
Tento koncept rozšířil v roce 2011 Morandi, který k výše uvedenému přidal používání skórovacích systémů pro včasnou detekci deliria (Delir) a časnou mobilizaci pacienta (Early mobilisa-tion) – „ABCDE-bundel“. Na základě jeho zjištění dochází při důsledném provádění tohoto postupu ke zkrácení doby umělé plicní ventilace, doby na JIP, výskytu deliria a poklesu mortality i snížení nemocničních nákladů [42].
Hluboká sedace na úroveň RASS -3 až -5 by měla být prováděna pouze u indikovaných případů, které tvoří z hlediska četnosti minoritu mezi pacienty v intenzivní péči. Jedná se např. o léčbu zvýšeného intrakraniálního tlaku u pacientů s těžkým kraniocerebrálním poraněním, pacienty s těžkým respiračním selháním a nutností vysoce nastavených parametrů umělé plicní ventilace, s refrakterním status epilepticus či u pacientů, kterým jsou podávána myorelaxancia.
ZÁVĚR
Sedace je nezastupitelným léčebným postupem, je však nezbytné věnovat pozornost i rizikům s ní spojeným. Zajištění dostatečné analgezie, používání moderních sedativ s nízkým rizikem vzniku deliria a zavedení skórovacích systémů pro sledování agitovanosti, bolesti a deliria by mělo být ve světle recentních doporučení standardní součástí péče o kriticky nemocné pacienty na JIP.
Do redakce došlo dne 11. 2. 2014.
Do tisku přijato dne 12. 5. 2014.
Adresa pro korespondenci:
MUDr. Bronislav Stibor
ICU
Landesklinikum Baden bei Wien
Wimmergasse 19
2500 Baden bei Wien
Austria
e-mail: b.stibor@seznam.cz
Sources
1. Braun, J. P., Mende, H., Bause, H., Bloos, F., Geldner, G., Kastrup, M., Kuhlen, R., Markewitz, A., Martin, J., Quintel, M., Steinmeier-Bauer, K., Waydhas, C., Spies, C. Quality indicators in intensive care medicine: why? Use or burden for the intensivist. Ger. Med. Sci., 2010, 8, 22.
2. Braun, J. P., Kumpf, O., Deja, M., Brinkmann, A., Marx, G., Bloos, F., Kaltwasser, A., Dubb, R., Muhl, E., Greim, C., Bause, H., Weiler, N., Chop, I., Waydhas, C., Spies, C. The German quality indicators in intensive care medicine 2013 – second edition. Ger. Med. Sci., 2013,11, Doc09.
3. Barr, J., Fraser, G. L., Puntillo, K., et al. American College of Critical Care Medicine: Clinical practice guidelines for the management of pain, agitation, and delirium in adult patients in the intensive care unit. Crit. Care Med., 2013, 41, p. 263–306.
4. Sessler, C. N., Gosnell, M. S., Grap, M. J., Brophy, G. M., O‘Neal, P. V., Keane, K. A., Tesoro, E. P., Elswick, R. K. The Richmond Agitation-Sedation Scale: validity and reliability in adult intensive care unit patients. Am. J. Respir. Crit. Care Med., 2002, 166, 10, p. 1338–1344.
5. Ely, E. W., Truman, B., Shintani, A., Thomason, J. W. W., Wheeler, A. P., Gordon, S. et al. Monitoring sedation status over time in ICU patients: the reliability and validity of the Richmond Agitation Sedation Scale (RASS). JAMA, 2003, 289, p. 2983–2991.
6. Sessler, C. N., Grap, M. J., Brophy, G. M. Multidisciplinary management of sedation and analgesia in critical care. Semin. Respir. Crit. Care Med., 2001, 22, 2, p. 211–2126.
7. Ely, E. W., Inouye, S. K., Bernard, G. R., Gordon, S., Francis, J., May, L., Truman, B., Speroff, T., Gautam, S., Margolin, R., Hart, R. P., Dittus, R. Delirium in mechanically ventilated patients: validity and reliability of the confusion assessment method for the intensive care unit (CAM-ICU). JAMA, 2001, 286, 21, p. 2703–2710.
8. Hopkins, R. O., Brett, S. Chronic neurocognitive effects of critical illness. Curr. Opin. Crit. Care, 2005, 11, 4, p. 369–375.
9. Newman, M. F., Kirchner, J. L., Phillips-Bute, B., Gaver, V.,Grocott, H., Jones, R. H., Mark, D. B., Reves, J. G., Blumen-thal, J. A., Neurological Outcome Research Group and the Cardiothoracic Anesthesiology Research Endeavors Investigators Longitudinal assessment of neurocognitive function after coronary-artery bypass surgery. N. Engl. J. Med., 2001, 344, 6, p. 395–402.
10. Hopkins, R. O., Weaver, L. K., Pope, D., Orme, J. F., Big-ler, E. D., Larson-Lohr, V. Neuropsychological sequelae and impaired health status in survivors of severe acute respiratory distress syndrome. Am. J. Respir. Crit. Care Med., 1999,160, 1, p. 50–56.
11. Spronk, P. E., Riekerk, B., Hofhuis, J., Rommes, J. H. Occurrence of delirium is severely underestimated in the ICU during daily care. Intensive Care Med., 2009, 35, 7, p. 1276–1280.
12. Ely, E. W., Shintani, A., Truman, B., Speroff, T., Gordon, S. M.,Harrell, F. E. Jr., Inouye, S. K., Bernard, G. R., Dittus, R. S. Delirium as a predictor of mortality in mechanically ventilated patients in the intensive care unit. JAMA, 2004, 291, 14, p. 1753–1762.
13. Luetz, A., Heymann, A., Radtke, F. M., Chenitir, C., Neuhaus, U.,Nachtigall, I., von Dossow, V., Marz, S., Eggers, V., Heinz, A., Wernecke, K. D., Spies, C. D. Different assessment tools for intensive care unit delirium: which score to use? Crit. Care Med., 2010, 38, 2, p. 409–418.
14. http://www.icudelirium.org/docs/CAM_ICU_worksheet_Czech.pdf
15. Martin, J., Parsch, A., Franck, M., Wernecke, K. D., Fischer, M.,Spies, C. Practice of sedation and analgesia in German intensive care units: results of a national survey. Crit. Care, 2005, 9, 2, p. R117–R123.
16. Pisani, M. A., Murphy, T. E., Araujo, K. L., Slattum, P., Van Ness, P. H., Inouye, S. K. Benzodiazepine and opioid use and the duration of intensive care unit delirium in an older population. Crit. Care Med., 2009, 37, 1, p. 177–183.
17. Barr, J., Zomorodi, K., Bertaccini, E. J., et al. A double-blind, randomized comparison of i.v. lorazepam versus midazolam for sedation of ICU patients via a pharmacologic model. Anesthesiology, 2001, 95, p. 286–298.
18. Barr, J., Egan, T. D., Sandoval, N. F., et al. Propofol dosing regimens for ICU sedation based upon an integrated pharmacokinetic-pharmacodynamic model. Anesthesiology, 2001, 95, p. 324–333.
19. Roberts, R. J., Barletta, J. F., Fong, J. J., et al. Incidence of propofol-related infusion syndrome in critically ill adults: A prospective, multicenter study. Crit. Care, 2009, 13, p. R169.
20. Rubino, A. S., Onorati, F., Caroleo, S., Galato, E., Nucera, S., Amantea, B., Santini, F., Renzulli, A. Impact of clonidine administration on delirium and related respiratory weaning after surgical correction of acute type-A aortic dissection: results of a pilot study. Interact. Cardiovasc. Thorac. Surg., 2010, 10, 1, p. 58–62.
21. Venn, R. M., Karol, M. D., Grounds, R. M. Pharmacokinetics of dexmedetomidine infusions for sedation of postoperative patients requiring intensive caret. Br. J. Anaesth., 2002, 88, p. 669–675.
22. Shehabi, Y., Ruettimann, U., Adamson, H., et al. Dexme-detomidine infusion for more than 24 hours in critically ill patients: Sedative and cardiovascular effects. Intensive Care Med., 2004, 30, p. 2188–2196.
23. Adams, R., Brown, G. T., Davidson, M., Fisher, E., Mathisen, J.,Thomson, G., Webster, N. R. Efficacy of dexmedetomidine compared with midazolam for sedation in adult intensive care pa-tients: a systematic review. Br. J. Anaesth., 2013, 111, 5, p. 703–710.
24. Pandharipande, P. P., Pun, B. T., Herr, D. L., Maze, M., Gi-rard, T. D., Miller, R. R., Shintani, A. K., Thompson, J. L., Jackson, J. C., Deppen, S. A., Stiles, R. A., Dittus, R. S., Bernard, G. R., Ely, E. W. Effect of sedation with dexmedetomidine vs lorazepam on acute brain dysfunction in mechanically ventilated patients: the MENDS randomized controlled trial. JAMA, 2007, 298, 22, p. 2644–2653.
25. Riker, R. R., Shehabi, Y., Bokesch, P. M., Ceraso, D., Wisemandle, W., Koura, F., Whitten, P., Margolis, B. D., Byr-ne, D. W., Ely, E. W., Rocha, M. G., SEDCOM (Safety and Efficacy of Dexmedetomidine Compared With Midazolam) Study Group Dexmedetomidine vs midazolam for sedation of critically ill pa-tients: a randomized trial. JAMA, 2009, 301, 5, p. 489–499.
26. Gerlach, A. T., Murphy, C. V., Dasta, J. F. An updated focused review of dexmedetomidine in adults. Ann. Pharmacother., 2009, 43, p. 2064–2074.
27. Panzer, O., Moitra, V., Sladen, R. N. Pharmacology of sedative-analgesic agents: Dexmedetomidine, remifentanil, ketamine, volatile anesthetics, and the role of peripheral Mu antagonists. Anesthesiol. Clin., 2011, 29, p. 587–605.
28. Payen, J. F., Changues, G., Mantz, J., et al. Current Practices in Sedation and Analgesia for Mechanically Ventilated Critically Ill Patients: A Prospective Multicenter Patient-Based Study. Anesthesiology, 2007, 106, p. 687–695.
29. Martin, J., Franck, M., Sigel, S., Weiss, M., Spies, C. Changes in sedation management in German intensive care units between 2002 and 2006: a national follow-up survey. Crit. Care, 2007, 11, 6, p. R124.
30. Jackson, D. L., Proudfoot, C. W., Cann, K. F., Walsh, T. S. The incidence of sub-optimal sedation in the ICU: a systematic review. Crit. Care, 2009, 13, 6, p. R204.
31. Barr, J., Pandharipande, P. P. The pain, agitation, and delirium care bundle: synergistic benefits of implementing the 2013 Pain, Agitation, and Delirium Guidelines in an integrated and interdisciplinary fashion. Crit. Care Med., 2013, 41, 9 Suppl 1, p. 99–115.
32. Fraser, G. L., Devlin, J. W., Worby, C. P., Alhazzani, W., Barr, J., Dasta, J. F., Kress, J. P., Davidson, J. E., Spencer, F. A.Benzodiazepine versus nonbenzodiazepine-based sedation for mechanically ventilated, critically ill adults: a systematic review and meta-analysis of randomized trials. Crit. Care Med., 2013, 41, 9 Suppl 1, p. 30–38.
33. Jakob, S. M., Ruokonen, E., Grounds, R. M., Sarapohja, T., Garratt, C., Pocock, S. J., Bratty, J. R., Takala, J. Dexmedetomidine for Long-Term Sedation Investigators. Dexmedetomidine vs midazolam or propofol for sedation during prolonged mechanical ventilation: two randomized controlled trials. JAMA, 2012, 307, 11, p. 1151–1160.
34. Li, S. Y., Wang, T. J., Vivienne Wu, S. F., et al. Efficacy of controlling night-time noise and activities to improve patients’ sleep quality in a surgical intensive care unit. J. Clin. Nurs., 2011, 20, p. 396–407.
35. Dennis, C. M., Lee, R., Woodard, E. K., et al. Benefits of quiet time for neuro-intensive care patients. J. Neurosci. Nurs., 2010, 42, p. 217–224.
36. Schweickert, W. D., Pohlman, M. C., Pohlman, A. S., et al. Early physical and occupational therapy in mechanically ventilated, critically ill patients: A randomised controlled trial. Lancet, 2009, 373, p. 1874–1882.
37. Needham, D. M., Korupolu, R., Zanni, J. M., Pradhan, P., Colantuoni, E., Palmer, J. B., Brower, R. G., Fan, E. Early physical medicine and rehabilitation for patients with acute respiratory failure: A quality improvement project. Arch. Phys. Med. Rehabil., 2010, 91, 53.
38. Erstad, B. L., Puntillo, K., Gilbert, H. C., et al. Pain management principles in the critically ill. Chest, 2009, 135, p. 1075–1086.
39. Cepeda, M. S., Carr, D. B., Lau, J., et al. Music for pain relief. Cochrane Database Syst. Rev., 2006, CD004843.
40. Strøm, T., Martinussen, T., Toft, P. A protocol of no sedation for critically ill patients receiving mechanical ventilation: A randomised trial. Lancet, 2010, 375, p. 475–480.
41. Girard, T. D., Kress, J. P., Fuchs, B. D., Thomason, J. W., Schweickert, W. D., Pun, B. T., Taichman, D. B., Dunn, J. G., Pohlman, A. S., Kinniry, P. A., Jackson, J. C., Canonico, A. E., Light, R. W., Shintani, A. K., Thompson, J. L., Gordon, S. M., Hall, J. B.,Dittus, R. S., Bernard, G. R., Ely, E. W. Efficacy and safety of a paired sedation and ventilator weaning protocol for mechanically ventilated patients in intensive care (Awakening and Breathing Controlled trial): a randomised controlled trial. Lancet, 2008, 371, 9607, p. 126–134.
42. Morandi, A., Brummel, N. E., Ely, E. W. Sedation, delirium and mechanical ventilation: the ‚ABCDE‘ approach. Curr. Opin Crit. Care, 2011, 17, 1, p. 43–49.
43. Riker, R. R., Fraser, G. L., Cox, P. M. Continuous infusion of haloperidol controls agitation in critically ill patients. Crit. Care Med., 1994, 22, 3, p. 433–440.
44. Reade, M. C., Finfer, S. Sedation and Delirium in the Intensive Care Unit. N. Engl. J. Med., 2014, 370, p. 444–454.
Autoři v minulosti obdrželi honoráře za přednáškovou činnost od Orion Pharma.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care MedicineArticle was published in
Anaesthesiology and Intensive Care Medicine

2014 Issue 4
-
All articles in this issue
- Hypotermie během anestezie – (ne)kazíme si sami výsledky naší práce?
- Česká porodnická anestezie a rok 2014
- Změníme přístup ke zvládání dechové nedostatečnosti?
- Výskyt hypotermie v perioperačním období – unicentrická observační studie
- První zkušenosti s biluminální fibrooptickou kanylou Vivasight ETView ® v hrudní chirurgii
- Kazuistika nediagnostikovaného intracerebrálního krvácení u pacientky po anuloplastice trikuspidální chlopně
- Postavení remifentanilu v porodnické analgezii
- Program INKA – porodní analgezie „na míru“
- První klinické zkušenostis dárcovstvím orgánů po nevratné zástavě oběhu – kazuistika
- Odběr orgánů od dárce zemřeléhov důsledku nevratné zástavy oběhu – kazuistika a přehled problematiky
- Aktuální trendy dlouhodobé farmakologické sedace kriticky nemocných
- Ultrazvukové vyšetření ledvinv perioperační medicíně a intenzivní péči
- Sepse, těžká sepse, septický šok
- Pacient nejde odpojit od umělé plicní ventilace – fyziologický přístup (se zaměřením na kardiální příčiny)
- Klinická doporučení pro praxi – diagnostika a léčba hyponatrémie
- „Prodám ledvinu.Zn.: Potřebuji peníze!“
- Praha je již etablovaným zkušebním centrem pro Evropský diplom z intenzivní medicíny (EDIC) v novém formátu
- Nové slovenské publikace
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- About the journal
Most read in this issue
- „Prodám ledvinu.Zn.: Potřebuji peníze!“
- Pacient nejde odpojit od umělé plicní ventilace – fyziologický přístup (se zaměřením na kardiální příčiny)
- Sepse, těžká sepse, septický šok
- Klinická doporučení pro praxi – diagnostika a léčba hyponatrémie
