Fibrilace síní u kriticky nemocných
Atrial fibrillation in critically ill patients
Arrhythmias are a common problem in the critically ill and they can have significant effects on patient outcome. Their management requires a structured approach, rapid diagnosis and correct treatment. We present a framework for the appropriate management of the most frequently encountered tachyarrhythmia in critical care.
KEYWORDS:
tachyarrhythmias − atrial fibrillation − critical care
:
M. Harazím 1
; T. Karvunidis 1,2; J. Raděj 1,2; J. Horák 1,2; I. Novák 1; M. Matějovič 1,2
:
I. interní klinika, Fakultní nemocnice Plzeň, Lékařská fakulta v Plzni, Univerzita Karlova
1; Biomedicínské centrum, Lékařská fakulta v Plzni, Univerzita Karlova
2
:
Anest. intenziv. Med., 28, 2017, č. 4, s. 248-254
:
Intensive Care Medicine - Review Article
S arytmiemi se u kriticky nemocných setkáváme velmi často a jejich výskyt může mít významný dopad na jejich klinický stav. Obvykle vyžadují komplexní léčebnou rozvahu a mnohdy i rychlý terapeutický zásah. Tento článek se snaží poskytnout náhled na nejčastější tachyarytmii v prostředí intenzivní péče a nastínit terapeutické strategie a možnosti jejího ovlivnění.
Klíčová slova:
tachyarytmie − fibrilace síní − intenzivní péče
ÚVOD
Arytmie jsou v prostředí intenzivní péče častým problémem, který může mnohdy nepříznivě ovlivnit morbiditu a mortalitu kriticky nemocných a prodloužit pobyt na intenzivním lůžku. Samotný patofyziologický důsledek arytmií závisí především na frekvenci komorové odpovědi, době trvání arytmie a myokardiální výkonnosti daného jedince. Symptomatické arytmie se během pobytu na JIP vyskytnou přibližně u 20 % nemocných, přičemž převážná většina je supraventrikulárních, nejvíce zastoupená fibrilací síní (30−60 %) [1, 2]. Tato práce se věnuje problematice léčebných strategií fibrilace síní u kriticky nemocných v prostředí intenzivní péče (IP).
FIBRILACE SÍNÍ
Fibrilace síní (FiSi) je nejčastější úzkokomplexovou arytmií nejen v prostředí intenzivní péče. Její prevalence v obecné populaci exponenciálně stoupá s věkem, od 0,9 % ve věku 40 let po téměř 6% výskyt u osob nad 65 let [3]. Incidence v IP je výrazně vyšší; v rámci nechirurgických kriticky nemocných se dle dostupných dat pohybuje mezi 5−20 % a v případě septického šoku až 46 % [4]. Rovněž etiologie nově vzniklé FiSi u kriticky nemocných se od běžné populace odlišuje. Podílí se na ní vlastní onemocnění, léčba, imunitní odpověď organismu a celá řada dalších faktorů (tab. 1). Ve většině případů je možné tyto faktory a okolnosti léčebně ovlivnit či jim zcela zabránit. Studie opakovaně prokazují, že výskyt FiSi ovlivňuje morbiditu i mortalitu kriticky nemocných [5, 6]. U pacientů s FiSi byla zaznamenána větší frekvence přijetí do prostředí IP, delší pobyt v IP i v nemocnici a vyšší spotřeba katecholaminů [7, 8]. Zcela však chybí důkazy o kauzalitě této závislosti. Fibrilace síní může být tedy vnímána jako ukazatel závažnosti klinického stavu nemocného.
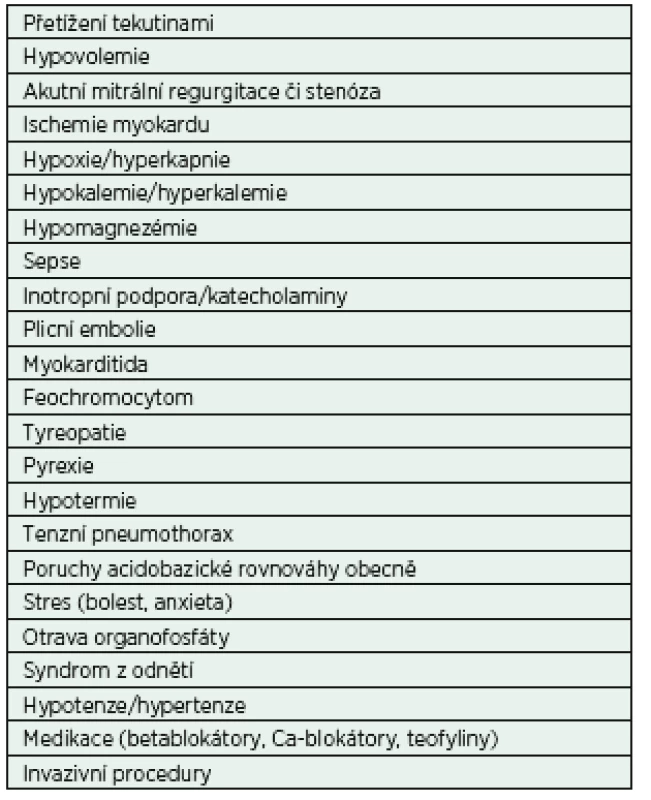
V případě záchytu FiSi je vhodné vědět, zda se jedná o první záchyt arytmie, či zda již byla dříve u pacienta diagnostikována. V klinické praxi je praktické rozdělení vlastních epizod arytmie, které reflektuje délku jejich trvání a do jisté míry i úspěch terapeutických pokusů o návrat k sinusovému rytmu (SR): a) paroxysmální fibrilace síní − opakující se arytmické příhody, které spontánně terminují do 7 dnů od vzniku, b) perzistující fibrilace síní − arytmie, která trvá více než 7 dní, nebo arytmie trvající kratší dobu, byla-li terminována pomocí elektrické nebo farmakologické kardioverze, c) permanentní fibrilace síní − arytmie, kde se verze arytmie na SR nezdařila nebo nebyl pokus o verzi iniciován a FiSi je ponechána jako základní rytmus. Tento článek se dominantně soustředí především na nově vzniklé ataky FiSi.
Náš terapeutický přístup ke kriticky nemocnému s nově vzniklou atakou FiSi vyžaduje komplexní rozvahu (tab. 2). Klíčové je zejména pojmenování 4 hlavních komponent léčebné strategie: 1. rozhodnutí o kontrole rytmu vs. kontrole frekvence, 2. management modifikovatelných spouštěcích mechanismů, 3. rozhodnutí o antikoagulační léčbě, 4. navržení strategie dlouhodobé léčby při propuštění z IP.

1. KONTROLA RYTMU VERSUS KONTROLA FREKVENCE
U nechirurgických kriticky nemocných nemáme k dispozici prakticky žádné randomizované studie pro léčbu FiSi a mnohdy spoléháme na starší data nejčastěji z kardiologického prostředí, která jsou do prostředí intenzivní péče problematicky přenosná.
Samotné klinické rozhodnutí o vhodném terapeutickém přístupu by mělo záviset na aktuální hemodynamické situaci, symptomech pacienta a posouzení, do jaké míry se sama arytmie podílí na eventuální hemodynamické nestabilitě (tachykardie při FiSi může být rovněž kompenzatorním mechanismem). Cílem terapeutických intervencí je omezit či zcela zabránit arytmií způsobené hemodynamické alteraci.
V případě nemocných s FiSi manifestujících se výraznou oběhovou nestabilitou je základním managementem provedení synchronizované elektrické kardioverze. Tento způsob léčby je vysoce efektivní u obecné populace (90 %), v populaci kriticky nemocných úspěšnost klesá k 30 % [9, 10]. Vyšší efektivity lze dosáhnout předléčením magneziem, případně amiodaronem [11]. Častý je rovněž výskyt časných relapsů. I těm můžeme částečně předejít předchozím podáním intravenózního antiarytmika [12, 13]. Úspěšnost výboje na restituci sinusového rytmu je přímo úměrná zvolené energii, proto je v praxi doporučován prvotní výboj o energii 200 J. Některé práce uvádějí jako efektivnější méně praktické předozadní naložení defibrilačních elektrod (další studie tuto teorii nepotvrzují) a užití bifázických výbojů [14, 15, 16]. Efektivita elektrické kardioverze závisí dále na impedanci hrudní stěny, rozměru levé síně a nepřímo úměrně na době trvání FiSi [17, 18]. Vektor elektrického proudu musí procházet myokardem síní, nikoli jen po povrchu těla. Důležitým faktorem je také funkční stav myokardu. U nemocných bez strukturálního postižení srdce je vyšší pravděpodobnost restituce sinusového rytmu i jeho udržení, na rozdíl od pacientů se sníženou ejekční frakcí či jiným strukturálním onemocněním myokardu. V případě klinické nejistoty, že probíhající arytmie je dominantní příčinou alterace oběhu, je vhodné provedení případné kardioverze až po dosažení základní hemodynamické resuscitace a ovlivnění dalších, snadno modifikovatelných faktorů (viz níže).
U kriticky nemocných bez významné alterace hemodynamiky se rozhodujeme mezi farmakologickou kontrolou frekvence či rytmu. Řada terapeutických doporučení odkazuje na dvě provedené studie prokazující srovnatelnou roční mortalitu kardiologických pacientů v závislosti na zvoleném režimu (kontrola rytmu vs. kontrola frekvence). Tato data jsou však velmi omezeně použitelná v případě akutních situací. Vzhledem k síňovému příspěvku na zvýšení tepového objemu, který činí v závislosti na tepové frekvenci 10−40 %, je očekávatelné, že pro hemodynamickou optimalizaci některých kriticky nemocných bude kontrola rytmu výhodná, zatímco kontrola frekvence s cílovou frekvencí pod 100/min je vhodná spíše pro oligosymptomatické nemocné. Podíl samotné arytmie však může být u řady např. septických nemocných vyžadujících katecholaminovou podporu velmi obtížně hodnotitelný. Klinických dat je však v této oblasti absolutní nedostatek.
Kontrolu rytmu lze zvážit nejen u významné hemodynamické nestability, ale i u situací, kde jsou po korekci modifikovatelných faktorů vhodné podmínky pro nastolení a udržení sinusového rytmu. To se může týkat především mladších nemocných (< 65 let) bez přítomnosti strukturálního postižení srdce a případů, kde je dosažení přijatelné kontroly frekvence obtížné. Z důvodu snížení rizika kardioembolických komplikací je vhodné farmakologickou verzi realizovat do 48 hodin od vzniku FiSi.
Kontrola frekvence může být vhodným postupem u řady nemocných s nově vzniklou atakou FiSi, protože většina pacientů s touto formou arytmie spontánně konvertuje do SR [19]. Přinejmenším u skupiny pacientů s FiSi po kardiochirurgickém výkonu se snaha o kontrolu rytmu nepromítla do lepších výsledků ve srovnání se strategií zaměřenou na kontrolu frekvence [20]. Další podstatnou otázkou je, kdy ke kontrole frekvence sáhnout a jaké cíle si stanovit. Nepřiměřená frekvence komor při FiSi a s tím spojené zvýšení enddiastolického tlaku komor zvyšují nároky myokardu na kyslík. Nekontrolovaná, několik dní trvající tachykardie je navíc spojena s rizikem rozvoje tachykardií indukované kardiomyopatie s významnou redukcí systolické funkce srdečního svalu. Přestože optimální cílová frekvence je veličinou neznámou, doporučují autoři dosáhnout frekvence do 100/min.
Ve farmakoterapii FiSi máme k dispozici široké portfolio léků, avšak jen úzká skupina léků je použitelná v prostředí intenzivní péče. Samotný výběr preparátu pak závisí na konkrétní klinické situaci, našem léčebném cíli, případném strukturálním postižení myokardu a zejména také na potenciálních nežádoucích účincích jednotlivých léků.
Propafenon, řadící se dle starší klasifikace dle Vaughana-Williamse (tab. 3) do skupiny antiarytmik Ic, patří mezi léky s malým množstvím nežádoucích účinků a relativně dobrou úspěšností opětovného nastolení sinusového rytmu [21]. Přibližně 80 % obnovení sinusového rytmu je dosaženo v první hodině od podání léku [22]. Dávkování propafenonu nebylo podobně jako u jiných antiarytmik u kriticky nemocných rigorózně testováno. Obvyklým schématem je podání2 mg/kg i. v. během 10−20 min, případně lze opakovat 1−2 mg/kg v intervalu 6−8 h. Výrazně omezené použití propafenonu je u pacientů se známou těžkou dysfunkcí levé komory srdeční či akutní koronární lézí, což je dáno absolutním nedostatkem klinických dat a špatnými výsledky použití jiných zástupců skupiny Ic v těchto indikacích [23]. Proarytmogenní účinek propafenonu nepřevyšuje konkurenty ve skupině I a většina nežádoucích účinků akutního podání souvisí především s betalytickou aktivitou.
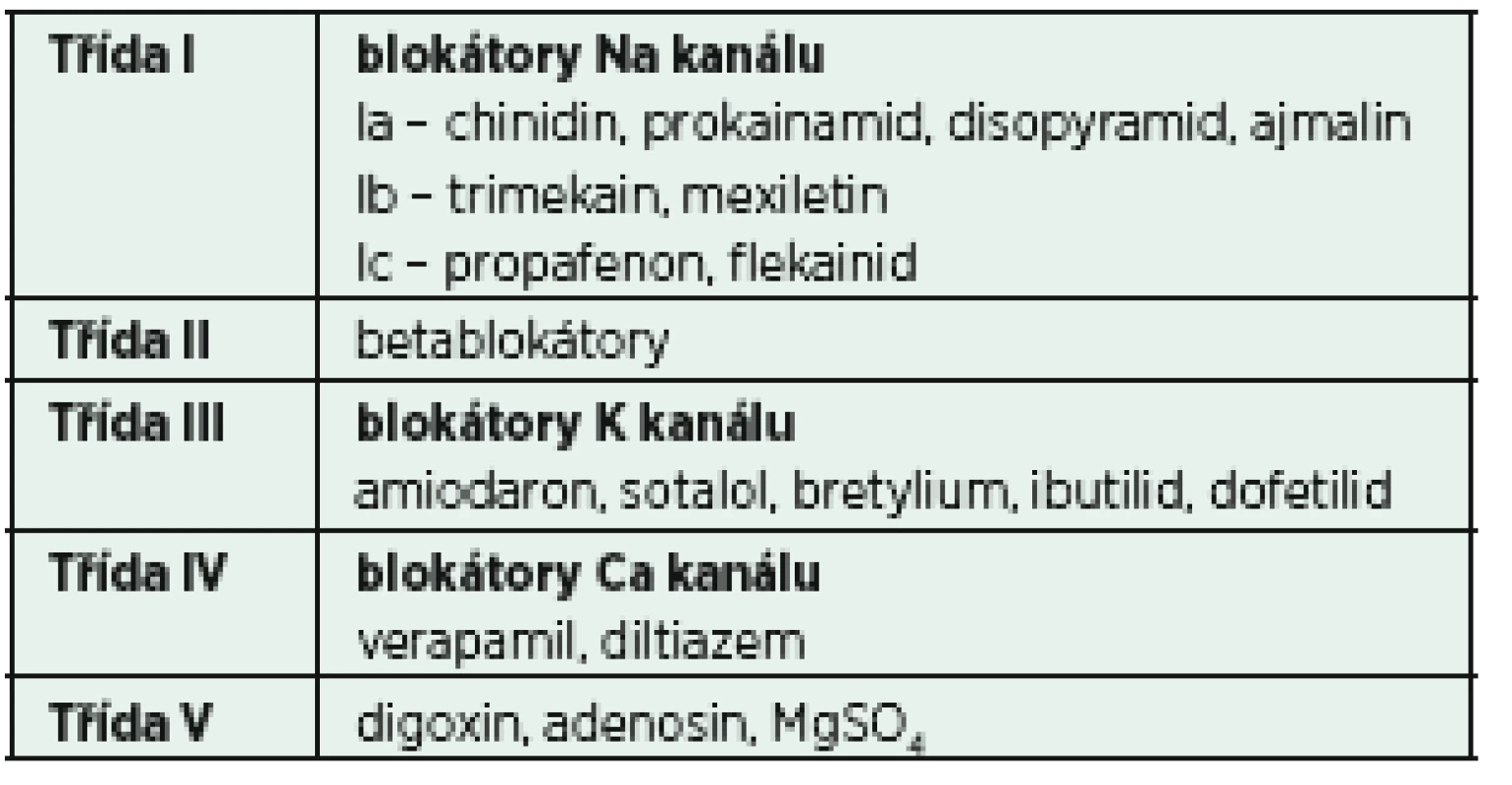
Betablokátory jsou základními léky pro kontrolu frekvence. Nežádoucí účinky jejich použití vyplývají především z negativně inotropního efektu vedoucího obvykle ke zhoršení hemodynamiky. Proto je v intenzivní péči vhodné použití preparátů s krátkým biologickým poločasem umožňujících titraci podané dávky dle klinického efektu, což v klinické praxi splňuje pouze esmolol, beta1-selektivní blokátor s velmi rychlým nástupem účinku, jehož biologický poločas je díky eliminaci nespecifickými esterázami a hydrolázami 7−10 min [24]. V mnoha klinických situacích lze úspěšně využít i významně levnější metoprolol s delším poločasem účinku.
Kalciové blokátory třídy IV (v praxi užívaný verapamil) dosahují srovnatelné efektivity v kontrole frekvence jako betablokátory, výrazněji se však projevuje jejich účinek na pokles krevního tlaku, což významně omezuje jejich použití u kriticky nemocných.
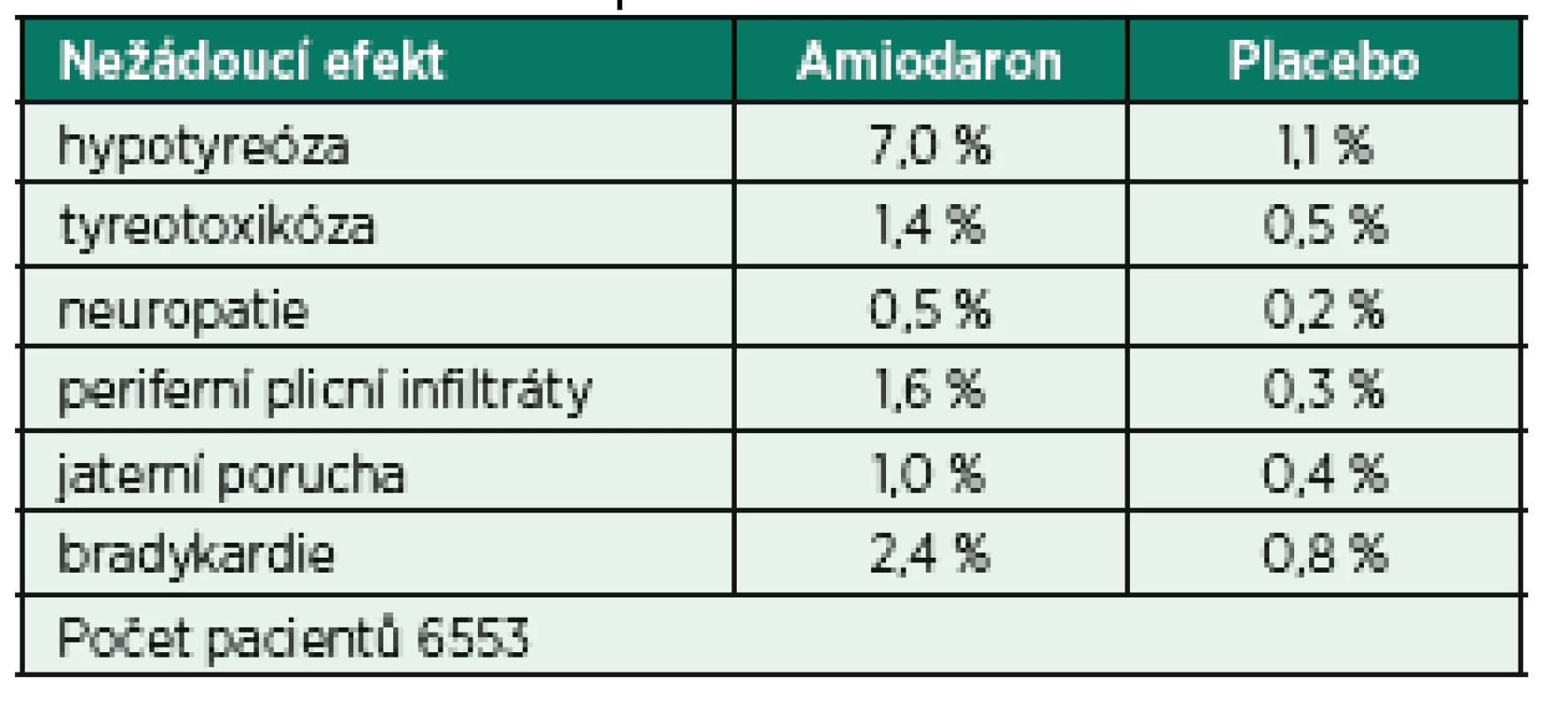
Amiodaron je komplexní antiarytmikum působící prostřednictvím účinku na Na+, K+, Ca2+ kanál s alfa - i betalytickými účinky, které se v prostředí intenzivní péče těší značné oblibě. Důvodem je především široké spektrum použití zahrnující celou řadu supraventrikulárních a především i ventrikulárních arytmií. V případě FiSi je možné jeho použití jak v kontrole rytmu tak frekvence, a to i pacientů s dokumentovanou významnou dysfunkcí levé komory srdeční. Úvodní dávka amiodaronu je v závislosti na hemodynamické toleranci 150−300 mg podaná během 10–120 minut s následným kontinuálním podáváním v dávce 50−100 mg/h. Alternativní dávkovací schéma pro udržovací infuzi je 1,0 mg/min po dobu prvních 6 hodin s další redukcí dávky na 0,5 mg/min. Nevýhodou je delší interval od podání k obnovení sinusového rytmu ve srovnání s jinými třídami antiarytmik (především skupinou Ic [25]) a celá řada potenciálních nežádoucích účinků (tab. 4) a projevů orgánové toxicity. Nejvýznamnější nežádoucí efekt souvisí především s vysokým obsahem jódu v molekule amiodaronu (37 %), který vede k jeho hromadění ve štítné žláze a vzniku tyreopatií [26].
Digoxin je i po mnoha letech užívání obestřen jistou dávkou kontroverze a svou roli v klinické praxi stále hledá. Jeho možnosti v intenzivní péči jsou nadále velmi omezené. Nevýhodou je velmi pomalý nástup účinku na kontrolu frekvence komor (přibližně za 30 min od podání) a výrazně snížený účinek u kriticky nemocných [27]. U kriticky nemocných podáváme digoxin v úvodní dávce 0,5 mg i. v. Jeho podání lze po 30 minutách opakovat v dávce 0,25 mg (kumulativní dávka v prvních 24 hodinách může být až 1 mg). Standardní udržovací dávka je 0,25 mg jednou denně. U nemocných s renální dysfunkcí je nutná příslušná redukce dávky a prodloužení dávkovacího intervalu. Hladiny je vhodné měřit nejdříve 6 hodin po podání poslední dávky.
Vernakalant (selektivní síňový blokátor draslíkových kanálů) patří mezi novější léky ke kontrole rytmu fibrilace síní. V klinických studiích dosahuje úspěšnosti kolem 50 %, což nikterak výrazně nepřevyšuje další užívaná antiarytmika z této oblasti. Vzhledem k velké ekonomické náročnosti léčby, kontraindikaci jeho použití u pacientů s hypotenzí či pokročilým srdečním selháním (NYHA III a výše) je jeho význam v klinické praxi zatím omezený [28].
Magnezium není klasifikováno jako antiarytmikum, přesto jsou jeho antiarytmogenní účinky nezanedbatelné. Výrazná hypomagnezémie je asociována s vyšším rizikem incidence srdečních arytmií (úzko - i širokokomplexových), symptomy srdečního selhání i rizikem náhlého úmrtí. Jeho podávání v intenzivní péči je dlouhodobě spojeno s léčbou eklampsie a polymorfní komorové tachykardie charakteru torsade de pointes. Existují však práce, které naznačují nižší incidenci fibrilace síní při profylaktickém podávání magnezia zejména u kardiochirurgických pacientů [29]. Velmi zajímavá je dokumentovaná vyšší efektivita magnezia v kontrole srdeční frekvence v porovnání s amiodaronem [30]. Magnezium je levný, efektivní a bezpečný lék, který je na jednotkách intenzivní péči dobře dostupný (cíl Mg++ > 1 mmol/l).
Racionální léčebný protokol by tedy dle autorů měl obsahovat několik základních kroků. Snahu o identifikaci a následnou korekci potenciálně reverzibilního faktoru predisponujícího pro vznik fibrilace síní (tab. 1). Dále dle parametrů hemodynamiky zvážit potřebu akutní elektrické kardioverze či rozhodnout o ovlivnění arytmie farmakologicky. U většiny nemocných je akceptovatelná jak kontrola rytmu, tak kontrola frekvence. Pro bližší určení konkrétního terapeutického cíle nám mohou pomoci znalosti morfologické a funkční charakteristiky myokardu, době trvání FiSi atd. (tab. 2). Při snaze o provedení časné farmakologické kardioverze je možné využít propafenon, i když jeho postavení v IP není stále zcela jednoznačné. Alternativní variantu, vhodnou i ke kontrole frekvence, představuje amiodaron. Použití jiných antiarytmik pro ovlivnění FiSi je v prostředí IP nadále velmi omezené.
2. MANAGEMENT MODIFIKOVATELNÝCH SPOUŠTĚCÍCH MECHANISMŮ
Současně s případnou specifickou terapií tachyarytmie je nezbytné zahájit léčbu základního onemocnění a dalších potenciálně vyvolávajících faktorů a okolností. Naším cílem by měla být časná úprava případné iontové dysbalance (zejména normalizace hladin draslíku, hořčíku), optimalizace volemie, korekce poruch acidobazické rovnováhy a ventilačních poruch, které signifikantně zvyšují riziko a případnou perzistenci FiSi [31, 32]. Ataka FiSi u nemocných především ve vyšším věku může být první manifestací hypertyreózy. Kauzálně lze postihnout i případy FiSi vzniklé v důsledku akutní koronární léze, infekčního i neinfekčního onemocnění. Ve specifických případech může být vznik arytmie vázán na některou z intervenčních procedur na ICU (kanylace centrálního žilního řečiště, zavedení Swanova-Ganzova katétru, bronchoskopická vyšetření aj.).
3. ROZHODNUTÍ O ANTIKOAGULAČNÍ LÉČBĚ
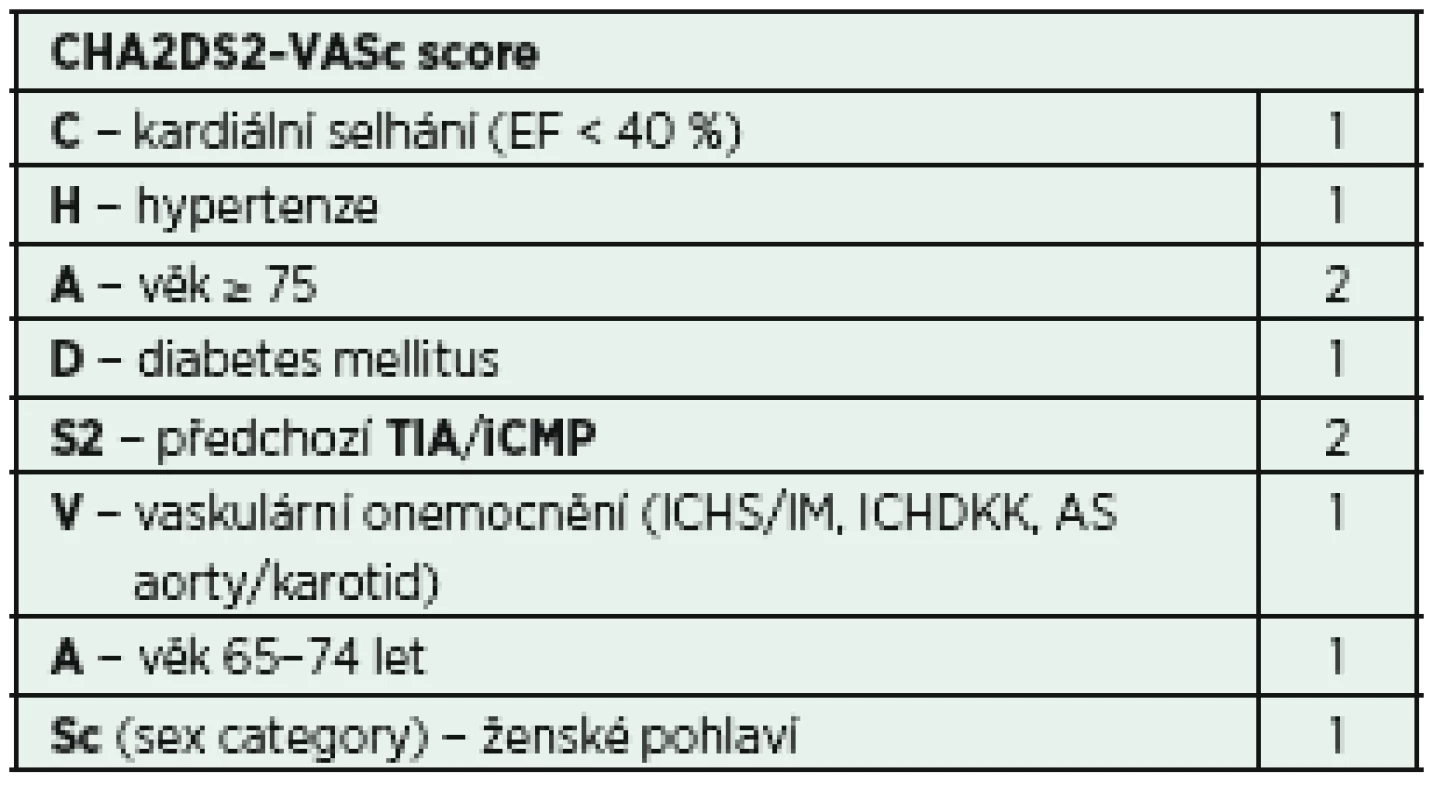
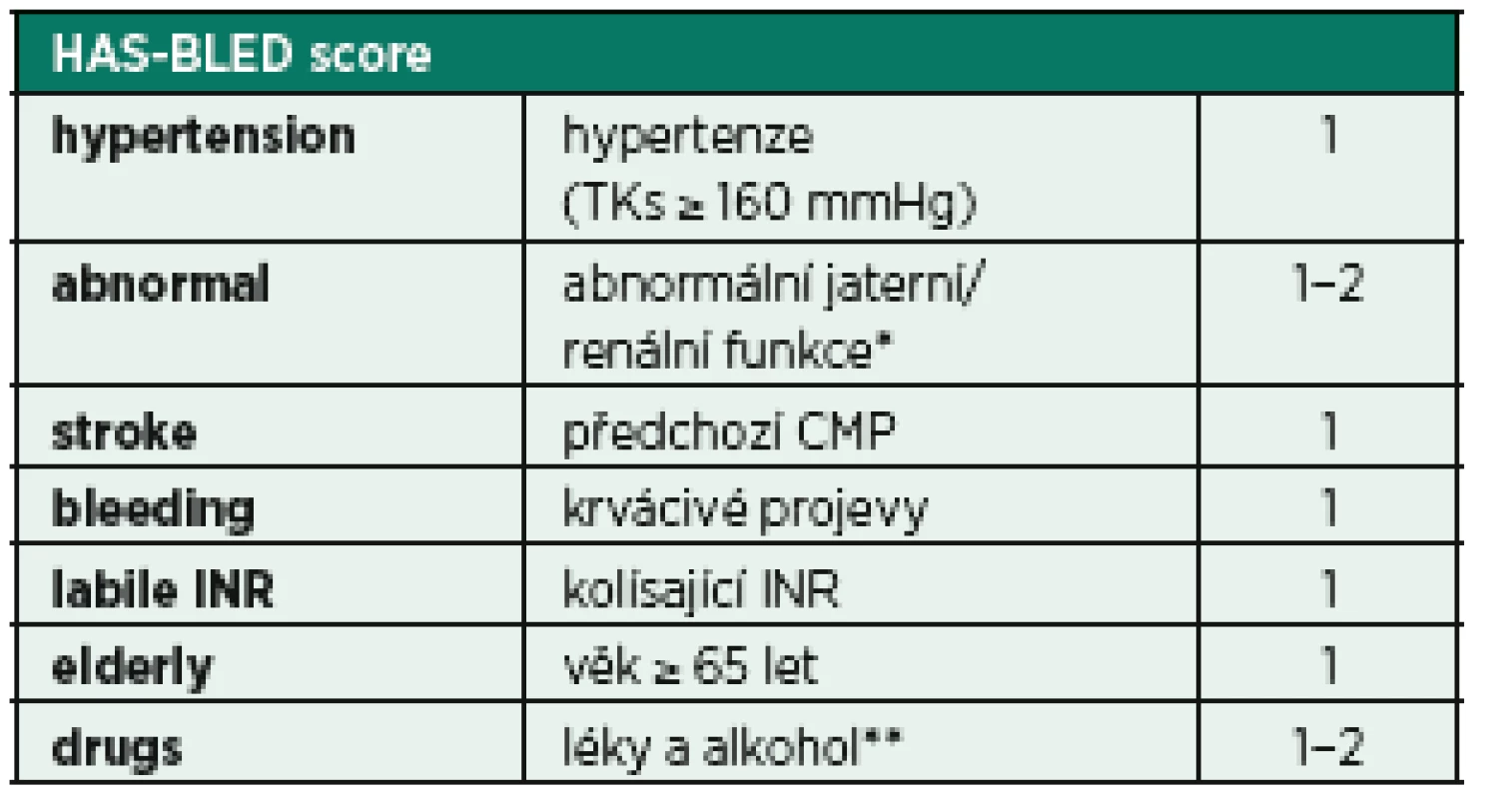
Fibrilace síní může být komplikována tvorbou trombů, případně embolizace. Toto riziko je v populaci kriticky nemocných vyšší (inflamace, prokoagulační stav), proto je vhodné u pacientů s atakou fibrilace síní provést rozhodnutí o zahájení antikoagulační léčby. Pro určení míry rizika tromboembolické komplikace a také případné krvácivé komplikace je možné využít skórovací systémy CHA2DS2-VASc score a HAS-BLED score (tab. 5, 6) [33, 34]. Ačkoli žádný z těchto skórovacích režimů nebyl dosud validován v prostředí IP, mohou být alespoň malou oporou pro samotnou klinickou rozvahu.
Nelehkou otázku představuje i modalita a dávkování adekvátní antikoagulační terapie. Zlatým standardem antikoagulační léčby u akutních stavů zůstává použití nefrakcionovaného heparinu či nízkomolekulárních heparinů, které z důvodů predikovatelného účinku, snadné monitorace (aPTT či hladina anti-Xa) a možné reverzibility efektu představují v intenzivní péči nejvhodnější variantu léčby. Použití kumarinového antikoagulancia nebo nasazení léčby některého z nových antikoagulancií (NOAC – dabigatran, rivaroxaban, apixaban), kde je farmakodynamika, monitorace (v případě NOAC) i případná reverzibilita účinku nepoměrně složitější a které jsou omezeně použitelné u nemocných s akutním poškozením ledvin, nelze v prostředí kriticky nemocných doporučit.
4. NAVRŽENÍ STRATEGIE DLOUHODOBÉ LÉČBY PŘI PROPUŠTĚNÍ Z INTENZIVNÍ PÉČE
Více než dvě třetiny nemocných, u nichž je v prostředí intenzivní péče zachycena první ataka FiSi do 24 hodin, spontánně obnoví SR [35] a nevyžadují další antiarytmickou léčbu. Přesto jsou tito nemocní zatíženi vyšším krátkodobým i dlouhodobým rizikem vzniku ischemické cévní mozkové příhody [36, 37] a před propuštěním z nemocnice by toto riziko mělo být vyhodnoceno s eventuální indikací k trvalé antikoagulační terapii. Je proto důležité, aby propouštěcí zprávy z intenzivní péče obsahovaly informace o proběhlých atakách FiSi v průběhu kritického stavu s doporučením další rozvahy. K ní patří i úvaha o holterovském monitorování k záchytu němých paroxysmů FiSi u rizikové populace. U selektovaných pacientů s perzistující formou FiSi lze zvážit provedení elektivní elektrické kardioverze po třech týdnech účinné antikoagulační léčby (v praxi INR v terapeutickém intervalu alespoň 3x v požadovaném časovém rozmezí), alternativně dříve po vyloučení přítomnosti nitrosrdečního trombu jícnovým echokardiografickým vyšetřením (TEE).
ZÁVĚR
Úspěšná léčba arytmií u kriticky nemocných v intenzivní péči zůstává i nadále velkou výzvou, což je dáno významným nedostatkem klinicky relevantních dat u této velmi specifické skupiny pacientů. Správný postup v klinické praxi by měl být směřován především k přerušení vyvolávající příčiny arytmie nebo alespoň omezení jejího působení. Samotné podání antiarytmika je pak jistým kompromisem vycházejícím ze správného rozpoznání arytmie, zvolené léčebné strategie, osobních zkušeností a především také z potenciálních nežádoucích účinků daného farmaka. Nikdy však neléčíme samotnou tachykardii, ale vždy konkrétního pacienta.
Práce je původní a nebyla publikována ani není zaslána k recenznímu řízení do jiného média.
Autoři prohlašují, že nemají střet zájmů v souvislosti s tématem práce.
Všichni autoři rukopis četli a souhlasí s jeho zněním a zasláním do redakce časopisu Anesteziologie a intenzivní medicína.
Financování:
- Program rozvoje vědních oborů Univerzity Karlovy (Progres Q39)
- MZ ČR – RVO (Fakultní nemocnice Plzeň – FNPl, 00669806)
- Národní program udržitelnosti (NPU I) No. LO1503 poskytnutý MŠMT
Do redakce došlo dne 20. 10. 2016.
Do tisku přijato dne 12. 4. 2017.
Adresa pro korespondenci:
MUDr. Martin Harazim
e-mail: harazimm@fnplzen.cz
Sources
1. Reinelt P, Karth G, Geppert A, Heinz G. Incidence and type of cardiac arrhythmias in critically ill patients: a single center experience in a medical-cardiological ICU. Intensive care medicine. 2011;27 : 1466−1473.
2. Knotzer H, lviayr A, Ulmer H, et al. Tachyarrhythmias in a surgical intensive care unit: a case-controlled epidemiologic study. J Intensive Care Med. 2000;26 : 908−914.
3. Feinberg W, Blackshear J, Laupacis A, Kronmal R, Hart R. Prevalence, age distribution, and gender of patients with atrial fibrillation: analysis and implications. Arch Intern Med. 1995;155 : 469–473.
4. Meierhenrich R, Steinhilber E, Eggermann C, Weiss M, Voglic S, Bögelein D, Stahl W. Incidence and prognostic impact of new-onset atrial fibrillation in patients with septic shock: a prospective observational study. Critical Care. 2010;14.3 : 1.
5. Moss TJ, Ruminski C, Lake DE, Calland JF, Enfield KB, Moorman JR. The impact of incident atrial fibrillation in the intensive care unit. Journal of the American College of Cardiology. 2016;67.13 : 2358.
6. Chen AY, Sokol SS, Kress JP, Lat I. New-onset atrial fibrillation is an independent predictor of mortality in medical intensive care unit patients. Ann Pharmacother. 2015;49 : 523−527.
7. Creswell LL, Schuessler RB, Rosenbloom M, Cox JL. Hazards of postoperative atrial arrhythmias. Ann Thorac Surg. 1993;56 : 539−549.
8. Almassi GH, Schowalter T, Nicolosi AC, Aggarwal A, Moritz TE, Henderson WG, Tarazi R, Shroyer AL, Sethi GK, Grover FL, et al. Atrial fibrillation after cardiac surgery: a major morbid event? Ann Surg. 1997;226 : 501−511.
9. Camm AJ, Kirchhof P, Lip GY, Schotten U, Savelieva I, Ernst S, et al. Guidelines for the management of atrial fibrillation: the Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). European heart journal. 2010, 31.19 : 2369−429.
10. Mayr A, Ritsch N, Knotzer H, Dünser M, Schobersberger W, Ulmer H, et al. Effectiveness of direct-current cardioversion for treatment of supraventricular tachyarrhythmias, in particular atrial fibrillation, in surgical intensive care patients. Crit Care Med. 2003;31 : 401−405.
11. Ganga HV, Noyes A, White CM, et al. Magnesium adjunctive therapy in atrial arrhythmias. Pacing Clin Electrophysiol. 2013;36 : 1308−1318.
12. Opolski G, Stanislawska J, Górecki A, et al. Amiodarone in restoration and maintenance of sinus rhythm in patients with chronic atrial fibrillation after unsuccessful direct–current cardioversion. Clinical cardiology. 1997;20 : 337−340.
13. Sticherling C, Behrens S, Kamke W, et al. Comparison of acute and long-term effects of single-dose amiodarone and verapamil for the treatment of immediate recurrences of atrial fibrillation after transthoracic cardioversion. Europace. 2005;7 : 546−553.
14. Myerburg RJ, Castellanos A. Electrode positioning for cardioversion of atrial fibrillation. The Lancet. 2002;360 : 1263−1264.
15. Kirchhof P., et al. Anterior-posterior versus anterior-lateral electrode positions for external cardioversion of atrial fibrillation: a randomised trial. The Lancet. 2002;360 : 1275−1279.
16. Walsh J., et al. Impedance compensated biphasic waveforms for transthoracic cardioversion of atrial fibrillation: a multi-centre comparison of antero-apical and antero-posterior pad positions. Eur Heart J. 2005;26 : 1298−1302.
17. Olshansky B, Heller EN, Mitchell LB., et al. Are Transthoracic Echocardiographic Parameters Associated With Atrial Fibrillation Recurrence or Stroke?: Results From the Atrial Fibrillation Follow-Up Investigation of Rhythm Management (AFFIRM) Study. Journal of the American College of Cardiology. 2005;45 : 2026−2033.
18. Oral H, Ozaydin M., et al. Effect of atrial fibrillation duration on probability of immediate recurrence after transthoracic cardioversion. Journal of cardiovascular electrophysiology. 2003;14 : 182−185.
19. Kanji S, Williamson DR., et al. Epidemiology and management of atrial fibrillation in medical and noncardiac surgical adult intensive care unit patients. J Crit Care. 2012; 27 : 326.e1−8.
20. Gillinov AM, Bagiella E, Moskowitz AJ., et al. Rate control versus rhythm control for atrial fibrillation after cardiac surgery. N Engl J Med. 2016,374 : 1911−1921.
21. Williams V. A classification of antiarrhythmic actions reassessed after a decade of new drugs. The Journal of Clinical Pharmacology. 1984;24 : 129−147.
22. Naccarelli GV, Wolbrette DL, Khan M., et al. Old and new antiarrhythmic drugs for converting and maintaining sinus rhythm in atrial fibrillation: comparative efficacy and results of trials. The American journal of cardiology. 2003;91 : 15−26.
23. Cardiac Investigators, et al. Preliminary report: effect of encainide and flecainide on mortality in a randomized trial of arrhythmia suppression after myocardial infarction. N Engl J Med. 1989;321 : 406−412.
24. Wiest DB, Haney JS. Clinical pharmacokinetics and therapeutic efficacy of esmolol. Clinical pharmacokinetics. 2012;51 : 347−356.
25. Vietti-Ramus G, Veglio F., et al. Efficacy and safety of short intravenous amiodarone in supraventricular tachyarrhythmias. International journal of cardiology. 1992;35 : 77−85.
26. Amiodarone trials meta-analysis investigators, et al. Effect of prophylactic amiodarone on mortality after acute myocardial infarction and in congestive heart failure: meta-analysis of individual data from 6500 patients in randomised trials. The Lancet. 1997;350(9089):1417−1424.
27. Goldman S, Probst P., et al. Inefficacy of “therapeutic” serum levels of digoxin in controlling the ventricular rate in atrial fibrillation. The American journal of cardiology. 1975;35 : 651−655.
28. Trappe HJ. Vorhofflimmern – Gesichertes und Neues. Dtsch Arztebl Int. 2012;109 : 1−7.
29. Saran T, Perkins GD, Javed MA, Annam V, Leong L, Gao F., et al. Does the prophylactic administration of magnesium sulphate to patients undergoing thoracotomy prevent postoperative supraventricular arrhythmias? A randomized controlled trial. Br J Anaesth. 2011;106 : 785–791.
30. Moran JL, Gallagher J, Peake SL, Cunningham DN., et al. Parenteral magnesium sulfate versus amiodarone in the therapy of atrial tachyarrhythmias: a prospective, randomized study. Crit Care Med. 1995;23 : 1816−1824.
31. Krijthe BP, Heeringa J, Kors JA, et al. Serum potassium levels and the risk of atrial fibrillation: the Rotterdam Study. Int J Cardiol. 2013;168 : 5411−5415.
32. Khan AM, Lubitz SA, et al. Low serum magnesium and the development of atrial fibrillation in the community: the Framingham Heart Study. Circulation. 2013;127 : 33−38.
33. Lip YH, et al. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach: the euro heart survey on atrial fibrillation. Chest Journal. 2010;137 : 263−272.
34. Pisters R, et al. A novel user-friendly score (HAS-BLED) to assess 1-year risk of major bleeding in patients with atrial fibrillation: the Euro Heart Survey. Chest Journal. 2010;138 : 1093−1100.
35. Tracy C, Boushahri A. Managing arrhythmias in the intensive care unit. Critical care clinics. 2014;30 : 365−390.
36. Walkey AJ, et al. Incident stroke and mortality associated with new-onset atrial fibrillation in patients hospitalized with severe sepsis. JAMA. 2011;306 : 2248−2254.
37. Walkey AJ, et al. Long-term outcomes following development of new-onset atrial fibrillation during sepsis. Chest. 2014;146 : 1187−1195.
Labels
Anaesthesiology, Resuscitation and Inten Intensive Care MedicineArticle was published in
Anaesthesiology and Intensive Care Medicine

2017 Issue 4
-
All articles in this issue
- The future, the priorities and strategic objectives of the specialty of Anaesthesiology and Intensive Care Medicine – results of a questionnaire survey among lead clinicians of academic departments in the Czech Republic
-
Preoperative assessment using mobile technologies in the Czech Republic – are our patients ready for it?
Prospective, observational, multicentre, cross-sectional study - Rapid sequence induction in the Czech Republic 2016: Survey
- Successful reversal of cardiac arrest in the course of remifentanil obstetric analgesia using naloxone: Case report and retrospective audit
- Atrial fibrillation in critically ill patients
- Aspiration of gastric contents while using the i-gel laryngeal mask: Case report of three cases
- Anaesthesiology and Intensive Care Medicine
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Rapid sequence induction in the Czech Republic 2016: Survey
- Aspiration of gastric contents while using the i-gel laryngeal mask: Case report of three cases
- Atrial fibrillation in critically ill patients
-
Preoperative assessment using mobile technologies in the Czech Republic – are our patients ready for it?
Prospective, observational, multicentre, cross-sectional study
