Od dyslipidemie k ischemické chorobě srdeční a zpět
From dyslipidemia to ischemic heart disease and vice versa
To halt the progression and inducing regression of atherosclerosis it is necessary to reduce LDL-cholesterol to levels less than 1.3 mmol/l. This can be achieved with high doses of active statins, inhibitors of proprotein convertase subtilisin/kexin 9, LDL/Lp(a) apheresis, or by combination of these methods. The latter two methods are the only substantially reducing other important lipid risk factor, lipoprotein(a). Triglycerides and HDL cholesterol can be improved mainly by lifestyle ganges.
Key words:
atherosclerosis – diagnosis-management – dyslipidemia – ischemic heart disease
Authors:
Jan Piťha
Authors‘ workplace:
Laboratoř pro výzkum aterosklerózy Centra experimentální medicíny IKEM, Praha
; Interní klinika 2. LF UK a FN v Motole, Praha
Published in:
AtheroRev 2016; 1(3): 120-124
Category:
Reviews
Overview
K zastavení progrese a navození regrese aterosklerotických změn je nutné snížit LDL-cholesterol až pod 1,3 mmol/l. V současnosti toho lze dosáhnout vysokými dávkami účinných statinů, inhibitory proprotein kexin subtilizin konvertázy 9, LDL/Lp(a) aferézou či kombinací těchto metod. Dvě posledně jmenované metody jako jediné výrazně snižují i další významný lipidový rizikový faktor lipoprotein(a). Triglyceridy a HDL cholesterol je možné příznivě ovlivnit zejména režimovými opatřeními.
Klíčová slova:
ateroskleróza – diagnostika-léčba – dyslipidemie – ischemická choroba srdeční
Úvod
Dyslipidemie jsou jednou z nejčastějších metabolických poruch a postihují až desítky procent obyvatel průmyslově vyspělých zemí. Jsou jednou z hlavních příčin kardiovaskulárních onemocnění způsobených aterosklerotickým procesem, především smrtících kardiovaskulárních (KV) příhod. Dyslipidemie se v naprosté většině případů vyvíjejí bez příznaků a specifických fyzikálních nálezů. Výrazně zvýšená hladina triglyceridů (nad 11,0 mmol/l) může způsobit pankreatitidu, nicméně tento nález i komplikace jsou vzácné. Naopak velice časté jsou kardiovaskulární příhody, které stále zodpovídají až za polovinu úmrtí v České republice [1].
Při již přítomné ischemické chorobě srdeční, jako při jiných klinických komplikacích aterosklerotického procesu, je většinou přítomna řada dalších matoucích faktorů – difuzní zánět cévní stěny, destabilizující se aterosklerotické pláty, aktivovaný imunitní a trombotický systém, a čelíme tedy komplexnímu patologickému ději v tepenném systému našich pacientů. Víme však téměř jistě, že korekcí doposud klinicky němé dyslipidemie jsme schopni osud našich pacientů zásadně ovlivnit a zastavit progresi aterosklerotických změn a alespoň do určité míry tento proces příznivě zvrátit zpět. Cílem tohoto sdělení je prezentovat současné znalosti o úloze dyslipidemií v procesu klinicky se manifestující aterosklerózy.
Dyslipidemie a progrese aterosklerózy
Aterosklerotické změny vznikají již v dětském věku a mohou se vyvíjet desítky let zcela bez příznaků [2,3]. Přibližně po 45. roce věku u mužů a 55. roce věku u žen se však mohou projevit vážnými klinickými příhodami. První klinická manifestace aterosklerotických změn navíc bývá až u dvou třetin postižených osob fatální [4] a je nejčastěji koronárního původu. I u pacientů, kteří klinickou příhodu přežili, trvá extrémně vysoké riziko jejího opakování s fatálním koncem. Nejvíce ohrožení jsou pacienti s čerstvě prodělanou akutní ischemickou srdeční příhodou, při níž jednu z hlavních rolí zřejmě hrají zánětlivé mechanizmy a původně reparační procesy [5]. Nicméně i pacienti s chronickou formou ischemické choroby srdeční jsou ve velmi vysokém riziku, zejména, jsou-li diabetiky, což je poměrně časté. U těchto pacientů se často vyskytuje smíšená dyslipidemie – vyšší hladina LDL-cholesterolu (LDL-C), a současně vyšší hladina triglyceridů, která je hůře ovlivnitelná – podílí se na ní řada faktorů – centrální obesita, diabetes mellitus, či prediabetes, s těmito nálezy spojené faktory životního stylu – snížená pohybová aktivita, strava s vysokým obsahem živočišných tuků a jednoduchých cukrů. Dvě zásadní složky, které se podílejí na vzniku aterosklerózy, jsou faktory lipidového metabolizmu a imunitní systém, konkrétně modifikované LDL-částice a monocyty. Aktivované monocyty se stávají makrofágy a fagocytují modifikované LDL-částice přítomné v cévní stěně. Následně se z makrofágů naplněných LDL-částicemi stávají pěnové buňky, neschopné již opustit prostor cévní stěny. Po jejich zániku se uvolňuje řada dalších biologických faktorů, zejména enzymy typu metaloproteináz, které dále poškozují cévní stěnu a vedou ke vzniku aterosklerotických změn a k jejich klinické manifestaci, v lepším případě ke stabilní ischemické chorobě srdeční, v horším případě k akutním koronárním příhodám.
Dle současných znalostí se patofyziologicky uplatňují i další dvě silné aterogenní složky lipidového spektra. Jednak jsou to remnantní částice, triglyceridy bohaté lipoproteiny, jakési mezičlánky v látkové výměně lipidů [6]. Druhým významným lipidovým faktorem je lipoprotein(a) – Lp(a) [7]. Lp(a) je v zásadě výrazný aterotrombogenní rizikový faktor, jedná se zjednodušeně o LDL-částici spojenou s molekulou podobnou plazminogenu s vysokým aterotrombogenním potenciálem.
V praxi přítomnost většího množství LDL-částic odvozujeme z vyšších hladin LDL-C. Další dostupný parametr – apolipoprotein B, nám může pomoci určit velikost, počet a zřejmě i vyšší aterogenitu LDL-částic, v případě vyšších triglyceridů lze dle jeho koncentrací odhadnout i aterogenitu lipidového spektra. Přítomnost remnantních částic je signalizována hladinou triglyceridů vyšší než 2,0 ale nižší než 5,0 mmol/l; případně lze z běžně dostupných lipidových parametrů jednoduše spočítat remnantní cholesterol odečtením LDL-C a HDL-cholesterolu (HDL-C) od cholesterolu celkového. Lp(a) se stanovuje nezávisle na dalších rizikových faktorech. Doporučené hodnoty popsaných parametrů jsou uvedeny v tab. 1.
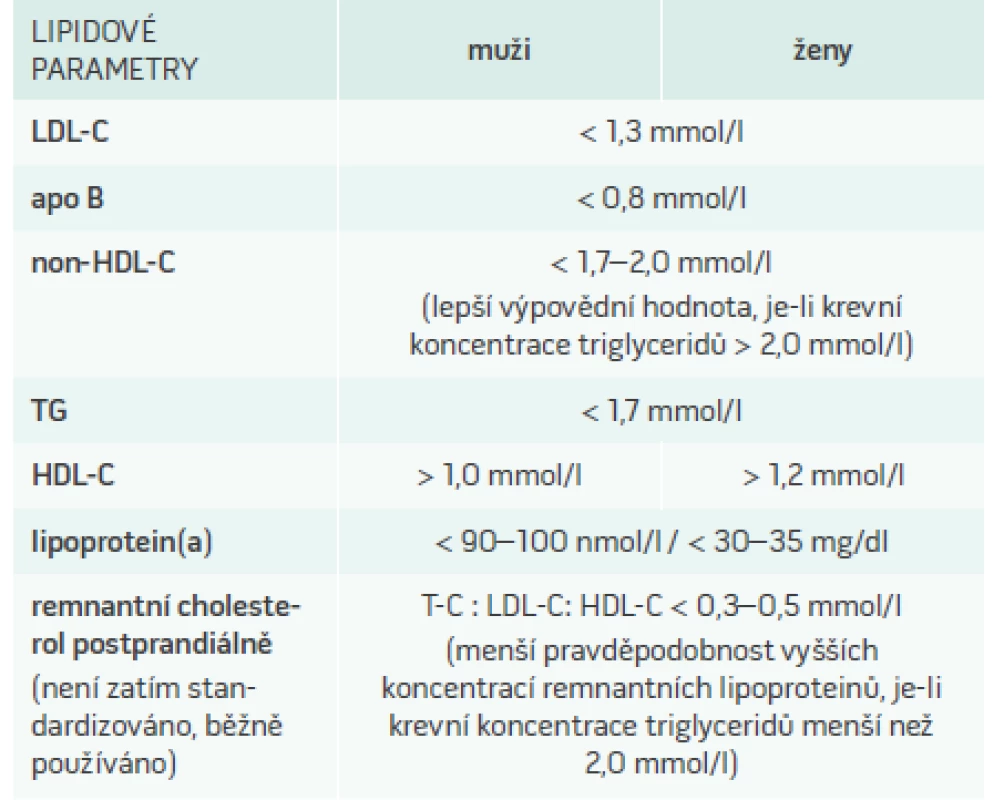
Kontrola dyslipidemie a stabilizace/regrese aterosklerózy
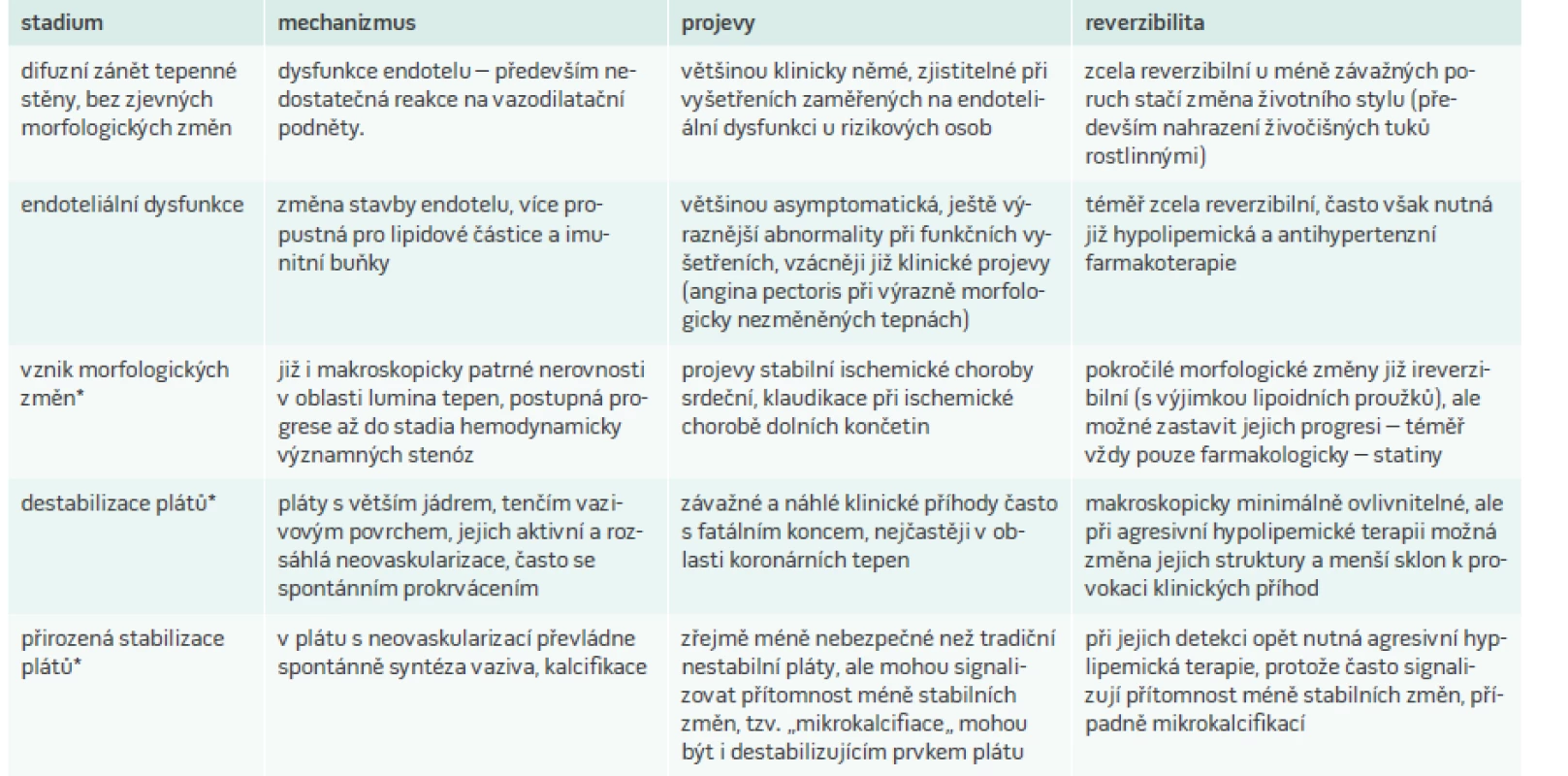
Již přibližně 30 let máme spolehlivá data, že proces aterosklerózy je zastavitelný až zvratitelný. Na základě opakování invazivních (kvantitativní koronarografie, později intrakraniální ultrasonografie) i neinvazivních (ultrasonografie periferně probíhajících tepen – nejčastěji karotických a femorálních) u pacientů intervenovaných z hlediska dyslipidemie bylo zjištěno, že při agresivní léčbě, především LDL-C dochází k malé, ale významné redukci rozsahu aterosklerotických změn [8–11]. Tyto studie původně s niacinem a kolestipolem byly potvrzeny i studiemi s inhibitory 3-hydroxy-3-methylglutaryl koenzymu A reduktázy (statiny) [12] a v současnosti probíhá studie zaměřená na regresi koronární aterosklerózy i novými účinnými hypolipemiky, inhibitory proprotein konvertázy subtilizin/kexin 9 (PCSK9), popsanými dále [13]. K regresi aterosklerotických změn vedla dokonce i velice důrazná a kontrolovaná opatření životního stylu [14], Ve všech studiích zaměřených na aterosklerotické změny byla sice morfologická regrese plátů poměrně malá (a kritizovaná) ale zásadním průvodním nálezem těchto studií byl výrazný pokles klinických příhod, následně ověřený v rozsáhlých randomizovaných a placebem kontrolovaných studiích, v nichž byly hlavním aktérem statiny místo původního niacinu a kolestipolu. Původní představa, že pacienty s manifestní aterosklerózou již není nutné specificky léčit a že důraz má být kladen na primární prevenci, byla tedy nahrazena zjištěním, že právě pacienti, kteří přežili první aterosklerotickou příhodu, z agresivní intervence rizikových faktorů, především dyslipidemie profitují nejvíce. V zásadě regrese aterosklerotických změn neznamená výrazné zmenšení velikosti plátu ale jeho stabilizaci – určité zajizvení, kalcifikaci méně náchylné k rupturám a trombotickým komplikacím.
Stabilizaci, či dokonce regresi aterosklerózy lze tedy navodit především ovlivněním lipidového spektra. U pacientů s již přítomnou ischemickou chorobou srdeční by toto ovlivnění mělo být velice agresivní, především v případě LDL-C. Současné analýzy a studie prokázaly, že velice razantní snížení LDL-C až k hodnotám nižším než 1,3 mmol/l vede k větší jistotě klidného života bez srdečních infarktů [15]. Zásadní jsou režimová opatření, farmakoterapie a u extrémně rizikových pacientů je třeba příliš neváhat s nasazením novějších léčebných postupů.
Zjednodušené shrnutí vývoje aterosklerotických změn a jejich případná reversibilita je prezentováno v tab. 2.
Praktická léčba
Izolovaná hypercholesterolemie
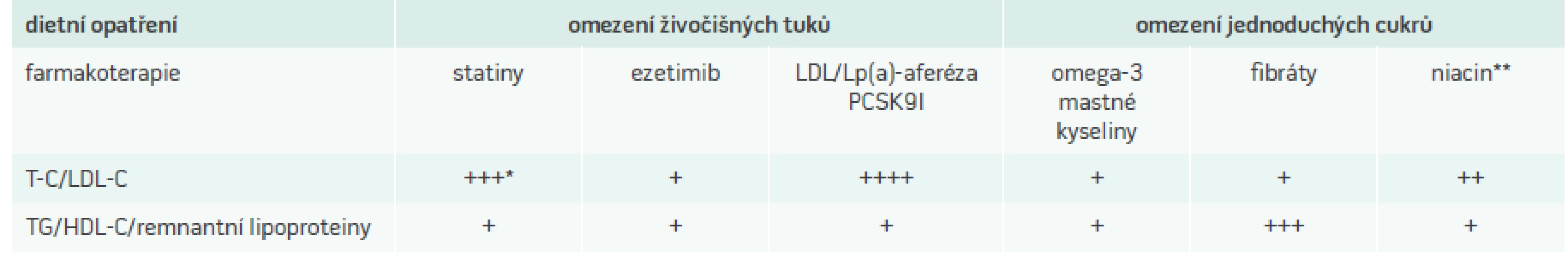
U pacientů s již přítomnou ischemickou chorobou srdeční se jeví jako nejbezpečnější hodnoty LDL-C nižší než 1,3 mmol/l, možná dokonce nižší než 1,0 mmol/l. Samozřejmě není možné těchto hodnot dosáhnout u všech pacientů, ale u extrémně rizikových pacientů (opakované koronární příhody i přes maximální farmakologickou léčbu) jsou cílem, kterého bychom se měli snažit dosáhnout i s nasazením složitějších léčebných metod. Základem k dosažení těchto hodnot je omezení živočišných tuků v potravě a jejich nahrazení tuky rostlinnými. Tato dietní opatření jsou schopna snížit hladinu LDL-C v průměru přibližně o 5–15 %, ovšem vzhledem k vysoké interindividuální citlivosti, lze v některých případech dosáhnout redukce blížící se 30–40 %, tedy srovnatelné s účinnou farmakoterapií. Velice striktní, téměř veganské, diety dosahující tohoto účinku u většiny osob však nejsou dlouhodobě akceptovatelné. Velice dobře tolerovaným potravinovým opatřením je doplnění stravy o 1–2 g sterolů a stanolů denně [16]. K razantnímu snížení LDL-C máme k dispozici především statiny. V průměru snižují LDL-C o 30–40 %, nejúčinnější statiny ve vyšších dávkách jsou schopny u dobře reagujících pacientů snížit hladiny LDL-C až o 60 %. Kromě léčby statiny je v současnosti ověřená kombinační terapie statinů s ezetimibem, což je lék, který snižuje vstřebávání cholesterolu. V klinických studiích, u pacientů s akutním koronárním syndromem, byl prokázán významný vliv kombinace simvastatin/ezetimib [17] na redukci závažných kardiovaskulárních (KV) příhod. U vysoce rizikových osob s nedostatečnou odezvou na tuto léčbu je možné zvážit případně zcela nová léčiva např. PCSK9 [18,19], které se jeví jako velice slibné a v blízké budoucnosti dostupné. Tyto léky vedou k zvýšené recyklaci LDL-receptorů především v jaterních buňkách, a tak výrazně snižují počet cirkulujících LDL-částic, tedy LDL-C. První rozsáhlé prospektivní randomizované a placebem kontrolované studie k definitivnímu ověření redukce KV-příhod a stanovení případných vedlejších účinků budou zřejmě zveřejněny na přelomu let 2016/2017. Na základě výsledků dosavadních studií PCSK9 inhibitory snižují hladinu LDL-C v průměru o více než 50–60 % a jsou dobře tolerovány. Snižují i ostatní aterogenní složky lipidového spektra, velice nadějný je jejich účinek i na lipoprotein(a), který snižují v průměru o 25 %.
Lp(a)
Režimová opatření nemají na hladinu Lp(a) výrazný účinek. Doposud nebyl lipoprotein(a) běžně dostupným farmaky ovlivnitelný, nicméně nejnovější hypolipemika jsou schopna významně snížit i tento faktor. Jedinou doposud dostupnou metodou byla LDL/Lp(a) aferéza, která byla schopna Lp(a) snížit až o 80 %, v současnosti je možnost snížit Lp(a) i inhibitory PCSK9 a to přibližně o 25 % [20].
Triglyceridy
Snížením hladiny triglyceridů je možné ovlivnit i další aterogenní lipidové částice – remnantní lipoproteiny. Na rozdíl od Lp(a) hrají v tomto případě naprosto zásadní úlohu režimová opatření – pohybová aktivita, úplná abstinence alkoholu, snížený příjem tuků a jednoduchých cukrů, v případě přítomnosti diabetes mellitus jeho dobrá kompenzace. Určitým mezistupněm mezi dietními opatřeními a farmakoterapií při snižování triglyceridů jsou omega-3 nenasycené mastné kyseliny (eikosapentaenová, dokosahexaenová a alfa-linolenová). Příznivý vliv může mít na triglyceridy a HDL-C i ukončení kouření. Vysoké dávky účinných statinů, případně jejich kombinace s ostatními hypolipemiky, především ezetimibem, jsou základem terapie většiny aterogenních dyslipidemií u vysoce rizikových pacientů, u kterých chceme snížit LDL-C na co nejnižší hodnoty. Většinou je nutné použít silné statiny ve vyšších dávkách – přibližně ekvivalent 80 mg atorvastatinu používaného ve studiích, případně kombinace statinu s ezetimibem. V přítomnosti ischemické choroby srdeční jsou i při vyšších triglyceridech lékem volby statiny, případně jejich kombinace s ezetimibem. U pacientů s diabetes mellitus by mohly pomoci i fibráty, u kterých byl právě u diabetiků popsán pokles mikrovaskulárních komplikací. Dobrý efekt na triglyceridy mají i inhibitory PCSK9, i když vyšší triglyceridemie není rozhodně jejich indikací. Efekt LDL/Lp(a)-aferézy není také ověřen – je zkoušena u extrémních hypertriglyceridemií, u nichž je hlavním ohrožením pacientů akutní pankreatitis. Nicméně výsledky nejsou zdaleka jednoznačné.
S vyššími hladinami triglyceridů často souvisí i snížené hladiny HDL-C, jehož nižší koncentrace je spojena s vyšším výskytem KV-příhod. Nicméně, jeho farmakologické zvyšování neprokázalo příznivý vliv na výskyt kardiovaskulárních příhod [21].
Shrnutí hypolipemické terapie
Vysoké dávky účinných statinů, případně jejich kombinace s ostatními hypolipemiky, především ezetimibem, jsou základem terapie většiny aterogenních dyslipidemií u vysoce rizikových pacientů, u kterých chceme snížit hodnoty LDL-C na co nejnižší hodnoty. Většinou je nutné použít silné statiny ve vyšších dávkách – přibližně ekvivalent 80 mg atorvastatinu používaného ve studiích, případně kombinace statinu s ezetimibem. Díky dostupným laboratorním metodám máme i možnost průběžně monitorovat, jak je léčba úspěšná. Než budeme schopni ovlivnit komplexní děje při aterosklerotickém procesu celkově, můžeme pouhým snížením aterogenních lipidů zpomalit, zastavit, či zcela zvrátit vývoj jednoho z nejčastějších a nejsmrtelnějších současných onemocnění.
Aterosklerotické onemocnění, které se již manifestuje jako ischemická choroba srdeční, je komplexní děj, který vyžaduje komplexní přístup. Kromě lipidového spektra je třeba se zaměřit i na ostatní rizikové faktory a jejich důslednou korekci. Proto je samozřejmě zásadní znát a případně korigovat i ostatní základní neovlivnitelné a ovlivnitelné rizikové KV-faktory. Mezi neovlivnitelné patří věk, mužské pohlaví a pozitivní rodinná anamnéza KV-příhod aterosklerotického původu (před 60. rokem u mužů, před 65. rokem u žen). Mezi ovlivnitelné patří kromě dyslipidemie kouření, hypertenze a diabetes mellitus. Účinnost současných přístupů k léčbě dyslipidemií je prezentována v tab. 3.
Zásady prevence opakování klinické příhody u pacienta s ischemickou chorobu srdeční
- Pacient s ischemickou chorobou srdeční by neměl odejít z ambulance či lůžka bez zahájení korekce hlavních rizikových faktorů – kouření, hypertenze, diabetes mellitus a především dyslipidemie
- Zásadním cílem je dosáhnout cílové hladiny LDL-cholesterolu méně než 1,3 mmol/l korekce LDL-cholesterolu by měla být prováděna především statiny, případně jejich kombinací s ezetimibem, u diabetiků s hypertriglyceridemií a mikroangiopatií je vhodné do kombinace zvážit i fibrát, u extrémně rizikových pacientů se těchto hodnot LDL snažíme dosáhnout i pomocí novějších léků a agresivnějších postupů – LDL-aferézy a PCSK9-inhibitorů
- Dalším naprosto zásadním krokem je nekouřit, problematičtější pacienty je vhodné doporučit do poradny pro kuřáky
- Cílové hodnoty krevního tlaku jsou 130–140/80–90 mm Hg, a především u pacientů s diabetes mellitus by měly být preferovány ACE-inhibitory, méně agresivní terapie je vhodná u starších pacientů a u pacientů s významnými asymptomatickými stenózami karotických tepen – cílové hodnoty krevního tlaku jsou stejné, ale je vhodné jich dosahovat postupně a začít menšími dávkami
- Cílová hladina glykovaného Hb u pacientů s diabetes mellitus by měla být nižší než 53 mmol/mol; agresivnější terapie vhodná u mladších pacientů
Podpořeno MZ ČR – RVO („Institut klinické a experimentální medicíny – IKEM, IČ 00023001“) a projektem (Ministerstva zdravotnictví) koncepčního rozvoje výzkumné organizace 00064203 (FN MOTOL).
doc. MUDr. Jan Piťha, CSc.
janpitha@ikem.cz
Laboratoř pro výzkum aterosklerózy Centra experimentální medicíny IKEM, Praha
www.ikem.cz
Doručeno do redakce 8. 9. 2016
Přijato po recenzi 30. 9. 2016
Sources
1. Informace dostupné z WWW: <http://www.uzis.cz/katalog/rocenky/zdravotnicka-rocenka-ceske-republiky>.
2. Berenson GS, Srinivasan SR, Bao W et al. Association between multiple cardiovascular risk factors and atherosclerosis in children and young adults. The Bogalusa Heart Study. N Engl J Med 1998; 338(23): 1650–1656.
3. Gidding SS, Rana JS, Prendergast C et al. Pathobiological Determinants of Atherosclerosis in Youth (PDAY) Risk Score in Young Adults Predicts Coronary Artery and Abdominal Aorta Calcium in Middle Age: The CARDIA Study. Circulation 2016; 133(2): 139–146. Dostupné z DOI: <http://dx.doi.org/10.1161/CIRCULATIONAHA.115.018042>.
4. Chambless L, Keil U, Dobson A et al. Population versus clinical view of case fatality from acute coronary heart disease: results from the WHO MONICA Project 1985–1990. Multinational MONItoring of Trends and Determinants in CArdiovascular Disease. Circulation 1997; 96(11): 3849–3859.
5. Dutta P, Courties G, Wei Y et al. Myocardial infarction accelerates atherosclerosis. Nature 2012; 487(7407): 325–329. Dostupné z DOI: <http://dx.doi.org/10.1038/nature11260>.
6. Varbo A, Nordestgaard BG. Remnant cholesterol and ischemic heart disease. Curr Opin Lipidol 2014; 25(4): 266–273. Dostupné z DOI: <http://dx.doi.org/10.1097/MOL.0000000000000093>.
7. Kostner KM, März W, Kostner GM. When should we measure lipoprotein (a)? Eur Heart J 2013; 34(42): 3268–3276. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/eht053>.
8. Blankenhorn DH, Nessim SA, Johnson RL et al. Beneficial effects of combined colestipol-niacin therapy on coronary atherosclerosis and coronary venous bypass grafts. JAMA 1987; 257(23): 3233–3240.
9. Blankenhorn DH. Regression of atherosclerosis: what does it mean? Am J Med 1991; 90(2A): 42S-47S.
10. Cashin-Hemphill L, Mack WJ, Pogoda JM et al. Beneficial effects of colestipol-niacin on coronary atherosclerosis. A 4-year follow-up. JAMA 1990; 264(23): 3013–3017.
11. Blankenhorn DH. Progression and regression of human femoral atherosclerosis.Trans Assoc Life Insur Med Dir Am 1980; 63 : 109–120.
12. Blankenhorn DH, Azen SP, Kramsch DM et al. [MARS Research Group]. Coronary angiographic changes with lovastatin therapy. The Monitored Atherosclerosis Regression Study (MARS). Ann Intern Med 1993; 119(10): 969–976.
13. Puri R, Nissen SE, Somaratne R et al. Impact of PCSK9 inhibition on coronary atheroma progression: Rationale and design of Global Assessment of Plaque Regression with a PCSK9 Antibody as Measured by Intravascular Ultrasound (GLAGOV). Am Heart J 2016; 176 : 83–92. Dostupné z DOI: <http://dx.doi.org/10.1016/j.ahj.2016.01.019>.
14. Ornish D, Scherwitz LW, Billings JH et al. Intensive lifestyle changes for reversal of coronary heart disease. JAMA 1998; 280(23): 2001–2007. Erratum in: JAMA 1999; 281(15): 1380.
15. Boekholdt SM, Hovingh GK, Mora S et al. Very low levels of atherogenic lipoproteins and the risk for cardiovascular events: a meta-analysis of statin trials. J Am Coll Cardiol 2014; 64(5): 485–494. Dostupné z DOI: <http://dx.doi.org/10.1016/j.jacc.2014.02.615>.
16. Reiner Z, Catapano AL, Backer G et al. ESC/EAS Guidelines for the management of dyslipidaemias: the Task Force for the management of dyslipidaemias of the European Society of Cardiology (ESC) and the European Atherosclerosis Society (EAS). Eur Heart J 2011; 32(14): 1769–1818. Dostupné z DOI: <http://dx.doi.org/10.1093/eurheartj/ehr158>.
17. Cannon CP, Blazing MA, Giugliano RP et al. [IMPROVE-IT Investigators]. Ezetimibe Added to Statin Therapy after Acute Coronary Syndromes. N Engl J Med 2015, 372(25): 2387–2397. Dostupné z DOI: <http://dx.doi.org/10.1056/NEJMoa1410489>.
18. Awan Z, Baass A, Genest J. Proprotein convertase subtilisin/kexin type 9 (PCSK9): lessons learned from patients with hypercholesterolemia. Clin Chem 2014; 60(11): 1380–1389. Dostupné z DOI: <http://dx.doi.org/10.1373/clinchem.2014.225946>.
19. Robinson JG, Kastelein JJ. PCSK9 Inhibitors and Cardiovascular Events. N Engl J Med 2015; 373(8): 774.
20. Hoover-Plow J, Huang M. Lipoprotein(a) metabolism: potential sites for therapeutic targets. Metabolism 2013; 62(4): 479–491. Dostupné z DOI: <http://dx.doi.org/10.1016/j.metabol.2012.07.024>.
21. Tuteja S, Rader DJ. High-density lipoproteins in the prevention of cardiovascular disease: Changing the paradigm. Clin Pharmacol Ther 2014; 96(1): 48–56. Dostupné z DOI: <http://dx.doi.org/10.1038/clpt.2014.79>.
Labels
Angiology Diabetology Internal medicine Cardiology General practitioner for adultsArticle was published in
Athero Review

2016 Issue 3
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Memantine Eases Daily Life for Patients and Caregivers
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
-
All articles in this issue
- Aterogénna dyslipidémia – nový cieľ v kardiovaskulárnej prevencii
- Periférne artériové ochorenie dolných končatín a dyslipidémia
- Význam mikroRNA v patofyziologii aterosklerózy a jejich možné klinické využití
- Inhibítory proproteín konvertázy subtilizín/kexín typ 9 (PCSK9)
- Jaké máme další možnosti snížit krevní tlak bez užití antihypertenziva
- Arterin® – doplněk stravy v léčbě dyslipidemie: výsledky krátkodobého klinického sledování
- Vysoká prevalence kardiovaskulárních rizikových faktorů a neuspokojivá kontrola hladin LDL-cholesterolu v populaci 40letých mužů a 50letých žen v České republice
- Je možné zlepšiť primárnu prevenciu ischemickej choroby srdca? A akým spôsobom?
- Od dyslipidemie k ischemické chorobě srdeční a zpět
- Athero Review
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Arterin® – doplněk stravy v léčbě dyslipidemie: výsledky krátkodobého klinického sledování
- Aterogénna dyslipidémia – nový cieľ v kardiovaskulárnej prevencii
- Jaké máme další možnosti snížit krevní tlak bez užití antihypertenziva
- Periférne artériové ochorenie dolných končatín a dyslipidémia
