Zvláštnosti léčby akutního infarktu myokardu a diagnostické problémy u nemocných s diabetes mellitus
Peculiarities of treatment of acute myocardial infarction and diagnostic issues in patients with diabetes mellitus
Glucose tolerance disorders pose a considerable risk of heart ischemia due to pathophysiological disorders induced by hyperglycaemia, and provoke changes affecting haemostatic, vascular and myocardial functions. Hyperglycaemia in patients with acute myocardial infarction is an adverse sign for outcome and has a negative prognostic impact. The administration of insulin with glucose in the course of acute myocardial infarction (AIM) – unless it results in decreased glycaemia – cannot improve the prognosis of the patient, and relative hyperglycaemia associated with the risk of excessive hydration of the patient induced by such treatment may in some cases have a negative impact on treatment results.
Keywords:
acute myocardial infarction – diabetes mellitus
Authors:
J. Špác
Authors‘ workplace:
II. interní klinika LF MU a FN u sv. Anny, Brno
Published in:
Kardiol Rev Int Med 2007, 9(4): 230-235
Category:
Editorial
Overview
Poruchy glukózové tolerance představují mimořádné riziko vzniku ischemie srdečního svalu vzhledem k patofyziologickým poruchám, které navozuje hyperglykemie, a vyvolává změny postihující funkce hemostatické, vaskulární a myokardiální. Hyperglykemie u nemocných s akutním infarktem myokardu je nepříznivým znamením pro další průběh a negativně prognosticky ovlivňuje osud nemocných. Podávání inzulinu společně s glukózou v průběhu akutního infarktu myokardu (AIM) – pokud nevede ke snížení glykemie – nemůže zlepšit prognózu nemocných a někdy může relativní hyperglykemie spojená s rizikem nadměrné hydratace nemocných navozená touto léčbou vést ke zhoršení léčebných výsledků.
Klíčová slova:
akutní infarkt myokardu, diabetes mellitus
Úvod
Poruchy glukózové tolerance představují mimořádné riziko vzniku ischemie srdečního svalu vzhledem k patofyziologickým poruchám, které navozuje hyperglykemie. Na rozdíl od ostatních rizikových faktorů ischemické choroby srdeční (lipidy, hypertenze), které jsme schopni příznivě ovlivnit léčbou, je účinnost našich preventivních opatření u nemocných s diabetes mellitus (DM) zatím velmi nízká a DM je jedním z faktorů podílejících se na velkém procentu manifestace různých forem ischemické choroby [1].
Výskyt a epidemiologie
Dřívější studie a přehledy ukázaly, že 19–23 % nemocných léčených pro akutní koronární syndrom mají DM. Tyto výsledky byly získány na základě anamnestických údajů nemocných nebo podle hodnot lačné glykemie (FPG - fasting plasma glucose), případně podle hodnot glykemie při přijetí. FPG po AIM se ukázala být nezávislým prognostickým faktorem u nediabetických nemocných. Je to faktor ukazující na nepříznivou prognózu a na 3krát vyšší mortalitu. Názory na zvýšenou hodnotu glykemie při příjmu nemocného s AIM nejsou jednotné. Podle některých prací nevede vzestup glykemie při příjmu k vzestupu mortality [2], ale některé práce uvádějí glykemiii vyšší než 6,7 mmol/l jako nezávislý prognostický faktor bez ohledu na přítomnost nebo nepřítomnost DM [3].
Hodnota lačné glykemie je ale nespolehlivý ukazatel poruchy glukózového metabolizmu, neodhalí nemocné s počínající poruchou glukózového metabolizmu a inzulinorezistencí, nejcitlivějším parametrem je hodnota postprandiální glykemie (PPG), která je nejčasnější manifestací diabetu 2. typu. U pacientů s postupně se rozvíjející poruchou glukózové tolerance se glykemie po zátěži sacharidy (PPG) v průběhu času zvyšuje absolutně více než glykemie nalačno. Pro nemocného je nepříznivé i kolísání glykemií – zvyšuje oxidativní zátěž a hodnoty glykovaného hemoglobinu udávající zprůměrňovaný stav glykemie za časové období odráží kardiovaskulární riziko méně přesně než PPG. Řada studií prokázala závislost PPG, aterosklerotického postižení a kardiovaskulární mortality. Pro aterosklerotické postižení u diabetu je příznačné, že se začíná rozvíjet již v počátečních fázích rozvoje glukózové poruchy a v době manifestace diabetu má část nemocných již makroangiopatické komplikace. Proto je někdy DM 2. typu nazýván chorobou z předčasného úmrtí spojenou s hyperglykemií. U diabetu 1. typu je situace poněkud odlišná, protože většinou dochází nejprve ke vzniku mikrovaskulárních komplikací (diabetická retinopatie, neuropatie, neuropatie) souvisejících s úrovní kompenzace glykemie a teprve v pozdějším věku je nemocný ohrožen makrovaskulárními komplikacemi. Tento článek je zaměřen na problematiku diabetiků 2. typu.

V posledních letech se při provádění oGTT nemocným po infarktu myokardu prokázala porucha glukózové tolerance u 65 % nemocných a z toho 25 % mělo nerozpoznaný DM a 40 % porušenou glukózovou toleranci za 3 měsíce po infarktu myokardu [4]. Studie GAMI (Glucose tolerance in patients with AMI) prokázala u nediabetických nemocných s AIM a vstupní glykemií pod 11,1 mmol/l v 67 % patologický nález glukózového metabolizmu – u glukózového tolerančního testu při propuštění z nemocnice – a tato skupina nemocných měla podstatně vyšší mortalitu při 50měsíčním sledování (graf 1) [5].

Zatímco u nediabetických nemocných došlo v posledních letech k poklesu mortality u AIM, diabetičtí nemocní mají významně vyšší mortalitu v časných stadiích AIM i po něm, celková mortalita dosahuje 7–18 % během 30 dní, 15–34 % po 1 roce a až 43 % do 5 let, což jsou hodnoty téměř 2násobné ve srovnání s nediabetickou populací. Prevalence ICHS je u diabetiků 2–3krát vyšší u mužů a až 4–5krát u žen a výrazně je zvýšena zejména u starších nemocných.
U nediabetických nemocných s AIM by proto měl být po skončení akutní fáze onemocnění vyšetřen také glukózový metabolizmus a pro potřeby sekundární prevence bychom měli znát hodnoty postprandiální glykemie, abychom mohli včas diagnostikovat poruchy glukózové tolerance. Postprandiální glykemie by také měla být měřena vždy, když je nalezen rozpor mezi hodnotami glykemie nalačno a hodnotami glykovaného hemoglobinu. Nevýhodou provádění oGTT testu je jeho relativní složitost a někdy udávaná menší reprodukovatelnost v klinické praxi. To pramení ze snadné ovlivnitelnosti oGTT řadou externích faktorů (nutnost dodržet stravu s maximálně 150 g uhlovodanů 3 dny před testem, večer před testem musí mít strava 30–50 g uhlovodanů, nutná je stabilita v medikaci ovlivňující glukózový metabolizmus) [6]. Někteří proto doporučují spolehnout se v následné rizikové stratifikaci jen na klinické znánky inzulinorezistence – tj. na příznaky metabolického syndromu.
Přehled patofyziologických poruch typických pro nemocné s DM 2. typu
Zvýšená mortalita a morbidita na kardiovaskulární onemocnění pozorovaná u nemocných s DM může být přisuzována změnám postihujícím hemostatické funkce, vaskulární a myokardiální.
Hyperglykemie, inzulinová rezistence a z toho vyplývající dyslipidemie jsou hlavní metabolické poruchy tvořící základ cévní, hemostatické a reologické toxicity u diabetiků 2. typu vedoucí k makrovaskulárnímu postižení. Hyperglykemie souvisí s aktivací metabolických cest závislých na proteinkinaze C, s vystupňováním polyolové a hexosaminové cesty, se zvýšenou tvorbou pokročilých produktů glykace a aktivací nukleárního faktoru κpodílejícího se na rozvoji zánětlivé reakce, která zvyšuje oxidační zátěž.
Tyto patofyziologické mechanizmy vedou k endoteliální a cévní dysfunkci a protrombotickému stavu – nadměrné aktivaci destiček a monocytů, nadprodukci cytokinů, nadměrné proliferaci hladkých svalových buněk, aktivaci koagulačních faktorů (zvýšená hodnota rozpustného CD 40L, tkáňového faktoru, PAI-1, fibrinogenu, a von Willebrandova faktoru) a snižují hladinu adiponektinu [7].
Složení aterosklerotického plátu je u diabetiků podobné jako u nemocných bez diabetu, ale diabetické ateromy mají vyšší obsah lipidů a makrofágů s expresí metaloproteináz a silnou lokální zánětlivou složkou v adventicii a neovaskularizací v oblasti aterosklerotického plátu s častým výskytem krvácení do plátů a větší tendencí k ulceracím, trombóze a hemoragiím. Nemocní s DM mají ve srovnání s nediabetiky častěji vícečetná a vícesegmentární postižení koronárních tepen, která podléhají ve větší míře než u nediabetiků tzv. negativní remodelaci. Aterosklerotické změny postihují delší úseky tepen a způsobují extrémní zužování jejich lumen, které se často projevuje difuzně na koronárních tepnách až do oblasti mikrocirkulace. U diabetiků se také vyskytují poruchy na buněčné úrovni včetně porušené schopnosti buněk odolávat ischemii pomocí preconditioningu. Tyto poruchy mohou zhoršovat některé sulfonylureové přípravky blokující neselektivně ATP-kaliové receptory [8].
Hyperglykemie zhoršuje nejen časný, ale i pozdní preconditioning. Jak katetrizační, tak i echokardiografické studie u nemocných s AIM ukázaly, že angina pectoris předcházející AIM nemá protektivní vliv, což je pravděpodobně důsledkem toho, že u diabetiků chybí fenomén preconditioningu [9,10]. DM pravděpodobně nenarušuje schopnost myokardu tvořit kolaterály, i když v minulosti několik prací poukázalo na jejich sníženou tvorbu u diabetiků. Poslední práce ukazují, že proces angiogeneze, který je u diabetiků zvýšen, může souviset i se zvýšenou schopností arteriogeneze vedoucí k tvorbě kolaterál [11].
Srdce diabetika je poškozeno také v důsledku vyššího výskytu hůře kontrolované hypertenze a hypertrofie levé komory srdeční, častější jsou dystrofické změny chlopní a dysfunkce levé komory srdeční. Mikroangiopatie v myokardu diabetiků 2. typu nebyla jednoznačně klinicky zatím potvrzena, i když některé nepřímé známky z menších a experimentálních pozorování svědčí pro možný podíl diabetické kardiomyopatie na kardiovaskulárním postižení [12]. Vegetativní neuropatie vede k oslabenému vnímání bolesti a relativní převaze sympatiku, která je spojena se snížením hustoty betareceptorů srdečních komor a nepříznivým ovlivněním elektrofyziologických vlastností, což se odráží ve variabilitě srdeční frekvence (schéma 2).

Výsledkem všech výše uvedených patofyziologických mechanizmů je extenze infarktového ložiska a riziko následného vzniku těžší dysfunkce levé komory srdeční a vzniku srdečního selhávání. Přetrvávání hemostatických poruch vede k vyššímu riziku opakování ischemií. Stupeň aterosklerotického postižení koreluje spíše s dobou trvání diabetu 2. typu než s jeho závažností. Riziko koronárního srdečního onemocnění je 1,38krát vyšší na každý 10letý nárůst trvání diabetu a riziko kardiovaskulárních úmrtí je 1,86krát vyšší [13].
Zvláštnosti diagnostiky
U diabetiků se vyskytuje 3krát až 4krát častěji nebolestivý průběh srdečního infarktu a příznaky jsou často atypické. Diabetičtí nemocní mají častěji jiné doprovodné symptomy, jako jsou zmatenost, dušnost, nauzea či zvracení. Některé studie ukazují, že až 35 % diabetických nemocných je přijato pro jiné než typicky koronární symptomy. Oslabené vnímání bolesti je příčinou pozdního vyhledání lékařské pomoci a dlouhé prehospitalizační doby a tím i pozdního zahájení adekvátní terapie se sníženou pravděpodobností použití reperfuzní léčby; zvláště se to týká nemocných se současnou vegetativní neuropatií.
Také EKG-křivka je u diabetiků změněna častěji se vyskytujícími raménkovými blokádami a jinými abnormalitami EKG-křivky, které pak mají za následek, že rozpoznání akutní ischemie a ST-elevací je obtížnější [14]. Některé experimentální práce ukazují, že amplituda elevací ST segmentu a T-vln může být snížena neselektivními sulfonyureovými přípravky a tím se může snížit senzitivita EKG v diagnostice AIM maskováním změn ST-úseků [15,16].
Zvláštnosti klinického průběhu
Odlišnost nemocných s DM a AIM od nediabetické populace spočívá v modifikaci klinického průběhu větším rozsahem a progresí změn – jedná se o nemocné staršího věku, s častějšími komorbiditami a větším zastoupením žen, obezity, hypertenze, ischemické choroby dolních končetin a srdečního selhání. Na rozdíl od nediabetiků se u nich méně vyskytuje kuřáctví. Tito nemocní mají 2krát vyšší mortalitu v časných stadiích AIM, i když je mortalita vztažena na rozsah nekrózy. Riziko je výrazně zvýšeno zejména u starších nemocných. DM je rizikovým faktorem pro vznik kardiogenního šoku, poruch atrioventrikulárního převodu i ruptury volné stěny myokardu. Diabetici mají 2krát až 3krát vyšší riziko vzniku srdeční slabosti, protože se vytvářejí podmínky pro remodelaci levé komory v důsledku chronického postižení myokardu neinfarktové oblasti a vysokým výskytem těžších forem diastolické dysfunkce levé komory. Diastolická dysfunkce brání uplatnění řady kompenzačních mechanizmů srdečního selhávání a již relativně malé snížení ejekční frakce vede k rozsáhlým klinickým projevům srdečního selhávání. Navzdory menší velikosti infarktu měřené vzestupem kardiospecifických enzymů a podobné ejekční frakci jako u nediabetiků mají diabetici vyšší mortalitu [17]. Délka hospitalizace nemocných s DM a AIM je o 1/3–1/2 delší než u nediabetiků, protože u nich často dochází k srdečnímu selhání a nutnosti kompenzace diabetu. 5letá mortalita diabetiků je po propuštění z nemocnice 2krát vyšší než u ostatních nemocných (tab. 1).

Zvláštnosti léčby
Pro nemocné s DM je příznačné, že léčba ovlivňující mortalitu (reperfuzní léčba,léčba blokující renin angiotenzinový systém, betablokátory) je používána méně často než u nediabetiků z obavy z vyvolání možných nežádoucích účinků (např. trombolytická léčba nebyla používána u více než 30 % vhodných nemocných s DM a AIM) [18,19].Inhibitory ACE/antagonisté angiotenzinu jsou lékem volby u všech nemocných s aterosklerotickým onemocněním a srdečním selháním, diabetické nemocné nevyjímaje. U nemocných s DM je problémem často obtížně léčitelná diabetická dyslipidemie, charakterizovaná hypertriglyceridemií, snížením HDL a navýšením LDL-cholesterolu. Pokud jde o hypolipidemickou léčbu, nebyly až donedávna publikovány žádné studie, které by se specificky zabývaly jejím efektem na akutní formy ICHS u nemocných s DM. Z provedených studií, necílených primárně na diabetickou populaci, však bylo možno získat solidní data podporující účinnost hypolipidemické léčby u této skupiny nemocných. Přínos léčby inhibitory ACE/antagonisty angiotenzinu a statiny u diabetiků je zpravidla výraznější než u nediabetických nemocných [34].
Reperfuzní léčba
Klíčovým prvkem determinujícím úspěšnost terapie je její časné zahájení co možná nejdříve po začátku potíží a u diabetiků je často problémem prodloužení prehospitalizační doby z důvodů atypické nebo němé symptomatologie. Největší přínos reperfuzní terapie je možno očekávat u skupin nemocných s vysokým rizikem, mezi něž patří právě nemocní s DM. Zpoždění v podání fibrinolytické léčby vede ke zvýšení mortality o 1 %. Proto je dvojnásobně důležité nemocné s DM poučit i o možnosti atypických příznaků infarktové bolesti a o nutnosti časného příjezdu do nemocnice a stále se hledají nové metody použitelné v populaci k odhalení asymptomatických forem ischemie.
Trombolytická léčba
Účinnost a význam časné reperfuze navozené trombolytickou terapií dokládá množství dat z velkých randomizovaných studií. Metaanalýza Fibrinolytic Therapy Trialists’ Collaborative Group, která zahrnula 43 073 nemocných, hodnotila i skupinu 4 529 pacientů s DM. Riziko 30denní mortality bylo vyšší u nemocných s DM (13,6 vs. 8,7 %), avšak absolutní redukce rizika úmrtí u nemocných s DM je 2násobně účinná a dosahovala 3,7 %, zatímco u nediabetiků byla 2,1 %. Fibrinolýza zachrání 35 nemocných na 1 000 nemocných diabetiků oproti 15 nemocným na 1 000 léčených nediabetiků [20]. Riziko intracerebrální hemoragie bylo přitom u nemocných s DM téměř stejné (0,6 vs 0,7 %). Krvácení do sklivce bylo jen vzácnou komplikací. Podle současných názorů by anamnéza retinopatie neměla být kontraindikací k podání trombolýzy s výjimkou nemocných s nedávnou anamnézou retinální hemoragie. Rychlost trombolýzy je u diabetiků zpomalena, je úspěšná jen u menšího počtu nemocných a její neúspěšnost vede k mnohem horším následkům než u nediabetiků [21]. Při angiografické kontrole se u diabetiků nachází větší procento reokluze dosahující až 9,2 % oproti 5,3 % u nediabetiků [22].
Přímá PTCA
Přímá PTCA se u AIM jeví jako účinnější strategie navození reperfuze než trombolytická léčba. Studie, která by hodnotila význam přímé PTCA u AIM u čistě diabetické populace, dosud provedena nebyla. Při krátkodobém sledování jsou výsledky PCI a moderní kombinované antiagregační léčby mezi diabetiky a nediabetiky velmi podobné a ukazují na lepší účinnost reperfuze pomocí PCI. Ve studii PAMI (Primary Angioplasty in Myocardial Infarction) byla hospitalizační mortalita diabetiků 20,8 % při léčbě t-PA (tkáňový aktivátor plazminogenu) ), zatímco z nemocných léčených přímou PTCA nezemřel žádný (p = 0,01) [23]. Také v retrospektivních sledováních a registrech byla úspěšnost primární PCI vyšší – opakování ischemie a nutnost revaskularizace byla při léčbě PCI nižší než při použití fibrinolytické léčby (5,8 % oproti 17,2 % respektive 19,4 % oproti 36,4 %), podobně se také snížila četnost úmrtí (17,5 % oproti 31,3 %) [24]. Zavedení stentů dále zlepšilo výsledky primární PCI [25], ale i přes obnovení průtoku ve větších epikardiálních kmenech koronárních tepen, jejíž úspěšnost je srovnatelná s výsledky u nediabetiků, dokonalého je obnovení reperfuze v oblasti mikrocirkulace dosaženo jen u části diabetiků, někteří udávají jen 50% úspěšnost. Často přetrvávají ST-elevace nad ischemickým ložiskem [26] a je mnohem častější výskyt no reflow fenoménu – tj. chybění perfuze myokardu při zprůchodněné epikardiální tepně [27]. Časné ischemické komplikace po PCI jsou obvykle následkem disekce tepny, retrombózy nebo embolizace. Nemocní s DM mají podstatně vyšší riziko těchto komplikací vzhledem ke zvýšené agregační aktivitě destiček a ostatních krevních elementů. Hlavní rozdíl mezi diabetiky a nediabetiky se objeví při hodnocení dlouhodobého sledování [28], kdy DM představuje nezávislý rizikový faktor restenózy a nežádoucích klinických příhod. Použití stentů dále zlepšilo výsledky PCI a zvláště použití stentů uvolňujících látky s antiproliferativním účinkem (DES - drug eluting stent) . Nejúčinnější jsou u diabetiků stenty potahované antiproliferační látkou rapamycinem - sirolimus (Cypher stenty), což je makrolidové antibiotikum s antiproliferačním účinkem na buňky hladkého svalu, který inhibuje dělení buněk indukované růstovými faktory a cytokiny. Studie SIRIUS prokázala u podskupiny diabetiků snížení restenózy z 50,5 % u kontrolní skupiny na 17,6 % při použití rapamycinu, podobně jako studie ISAAR-Diabetes. V případě použití stentů, které omezují proliferativní odpověď cévní stěny a prodlužují dobu hojení v důsledku uvolňování látek s imunosupresivním účinkem, se podávání duální kombinace antiagregačních látek prodlužuje na 6–8 měsíců a někdy i déle, možná nejlépe doživotně. Nyní probíhají studie hodnotící účinnost těchto sirolimových stentů ve srovnání s CABG u diabetiků (CARDIA), a je možné, že v budoucnu se tento typ stentů ukáže jako rovnocenný v léčbě ischemie CABG.
U diabetiků je zvlášť nutno si uvědomit, že samotná revaskularizace není dostatečná pro zastavení nebo zpomalení aterosklerotického procesu a ovlivnění dlouhodobé prognózy, ale že zásadní význam má kontrola glykemie, krevního tlaku, poruch lipidů a včasná léčba dysfunkce levé komory srdeční již v počátečních stadiích. Možná, že i způsob léčby diabetu bude v budoucnu rozhodovat o kardiovaskulární prognóze nemocných. Zdá se, že přípravky ovlivňující inzulinovou rezistenci (glitazony) mohou být u ischemiků zvláště účinné a snižovat i četnost výskytu restenóz po provedené PCI. Výsledky výzkumu hodnotící kardioprotektivitu jednotlivých léčebných postupů nejsou zdaleka ukončeny (tab. 2).
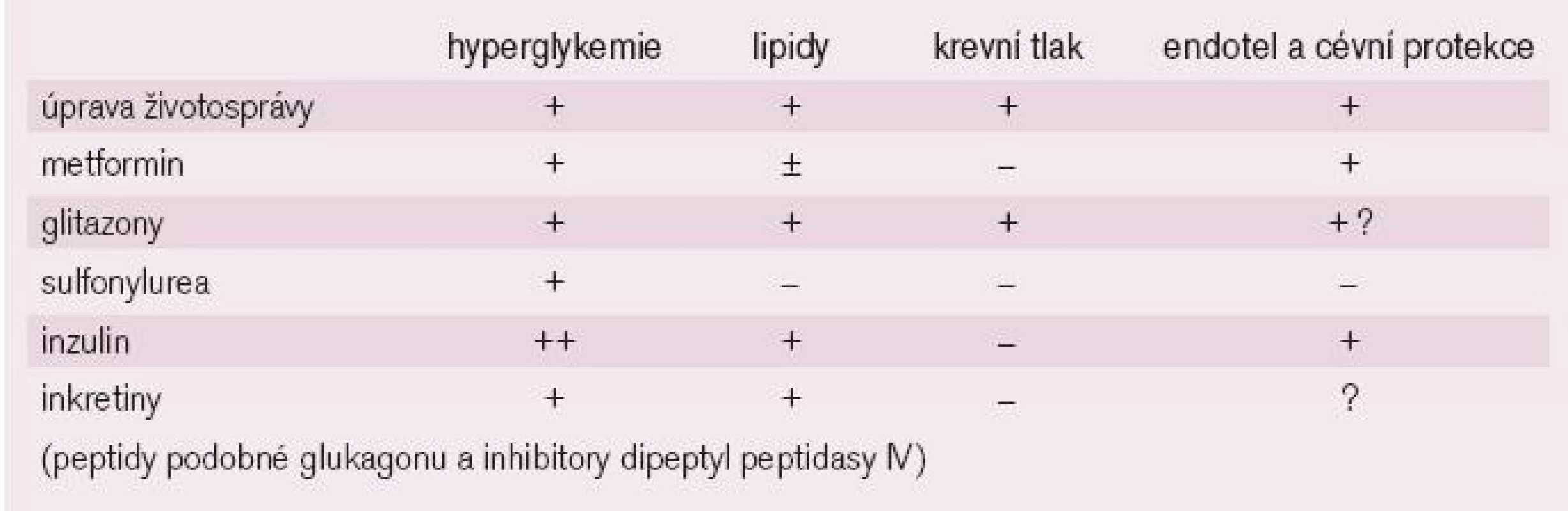
Nízkomolekulární hepariny
Nízkomolekulární hepariny, jmenovitě enoxaparin, jsou minimálně stejně účinné jako nefrakcionovaný heparin v léčbě akutních koronárních syndromů bez elevace úseku ST, nestabilní anginy pectoris a non-Q IM. Studie TIMI 11B ukázala, že největší prospěch z léčby nízkomolekulárním heparinem mají především vysoce rizikoví nemocní, mezi které jsou též řazeni diabetici.
Inhibitory destičkových receptorů IIb/IIIa
Příznivý vliv na snížení mortality a opakování IM a anginy pectoris byl u nemocných s akutními koronárními syndromy bez elevace úseku ST prokázán také pro inhibitory destičkových receptorů IIb/IIIa. Metaanalýza, která zahrnula všechny nemocné s DM z 10 klinických studií hodnotících efekt léčby antagonisty IIb/IIIa receptorů u akutních koronárních syndromů, prokázala, že u diabetiků došlo k 2násobně vyššímu absolutnímu snížení hlavních kardiovaskulárních příhod ve srovnání s nediabetiky. Ani použití vysokých dávek thienopyridinů u diabetiků pravděpodobně nesníží příznivé působení IIb/III antagonistů [36]. Svůj význam má léčba inhibitory destičkových receptorů IIb/IIIa i u nemocných s DM, podstupujících perkutánní koronární intervenci. Je možné, že IIb/III blokátory dokážou u diabetiků snížit výskyt no reflow fenoménu, nejspíše tím, že zabránění ucpání mikrovaskulatury myokardu krevními destičkami [35].
Metabolická terapie
Hyperglykemie u nemocných s AIM je nepříznivé znamení pro další průběh a negativně ovlivňuje prognózu osudu nemocných [29]. Do nedávné minulosti nebylo jasné, ani to, zda má stupeň hyperglykemie rozdílný význam pro nemocné s DM a bez předchozí diagnózy DM. Hyperglykemie se často vyskytuje i u nemocných bez předchozí diagnózy DM a řada prací ukázala, že hyperglykemie u této skupiny nemocných má ještě horší prognostický význam než u nemocných se stanovenou diagnózou DM před vznikem AIM. Hodnocení hladiny glukózy u AIM bylo donedávna zanedbáváno a tento ukazatel se nevyskytuje v žádných rizikových kritériích pro nemocné s AIM. Ani v doporučeních pro léčbu AIM nejsou stanoveny zásady pro léčbu hyperglykemie u AIM. Ukazuje se, že vztah mezi mortalitou a hladinou glykemie během hospitalizace má tvar písmene U – výskyt hypoglykemie (< 3,0 mmol/l) a stejně tak výskyt hyperglykemie (> 6,6 mmol/l) během hospitalizace zvyšuje mortalitu nemocných s AIM a žádoucí cílová hodnota glykemie by se měla pravděpodobně pohybovat mezi 3,0-6,6 mmol/l. Jakým nejvhodnějším způsobem léčby tohoto cíle dosáhnou ale zatím nevíme [30].
Utilizaci glukózy můžeme teoreticky zvýšit podáním inzulinu s glukózou. Užití této kombinace bylo jedním z alternativních postupů léčby AIM a počátky této metabolické léčby sahají do r. 1962, kdy dr. Sodi-Pallares zavedl léčbu zahrnující podávání kombinace glukózy, inzulinu a draslíku u AIM (tzv. polarizační roztok). V následujících letech se pozornost věnovala účinku vysokých dávek inzulinu v těchto směsích s cílem zvrátit inzulinorezistenci. Vycházelo se z předpokladu, že akutní podání inzulinu (samotného u hyperglykemických diabetiků) nebo společně s glukózou a kaliem (GIK; glukóza – inzulin –kalium) může příznivě ovlivnit akutní myokardiální ischemii zvýšením glykolýzy a snížením zpětného vychytávání volných mastných kyselin. Podpora anaerobní glykolýzy v ischemickém myokardu, snížení dostupnosti mastných kyselin, snížená tvorba toxických volných radikálů v ischemickém myokardu a řada dalších přímých a nepřímých účinků inzulinu mohou mít příznivý vliv na myokard. Intenzivní léčba inzulinem a glukózou vede ke snížení destičkových funkcí, snížení aktivity PAI-1 a tím podporuje spontánní fibrinolýzu. To vše může vést k zlepšení prognózy nemocných.
Několik menších studií ukazovalo na příznivé výsledky a metaanalýza 16 studií s asi 5000 nemocnými ukázala na 18% snížení mortality; ale závěry nebyly přijímány jako prokázané. Zvláště u nemocných s dysfunkcí komory vedlo převodnění ke zhoršení prognózy. Švédská prospektivní studie DIGAMI 1 (Diabetes and Insulin - Glucose Infusion in Acute Myocardial Infarction) prokázala, že u 620 diabetických nemocných s AIM se snížila mortalita podáním infuze s glukózou a inzulinem během akutní fáze a následnou intenzifikovanou inzulinoterapií. Inzulinoterapie měla příznivý efekt na všechny příčiny kardiovaskulární mortality (roční mortalita se snížila o 29 %), zejména pak na frekvenci fatálních reinfarktů a výskyt srdečního selhání [31]. Studie DIGAMI 2 (srovnávající 3 skupiny nemocných - intenzivní inzulinový režim s podáváním glukózy a následnou léčbou inzulinem oproti léčbě bez pokračování inzulinem a oproti standardní metabolické kontrole) tyto prvotní nálezy nepotvrdila. Studie měla několik metodických chyb, nepodařilo se dosáhnout prvotního cíle léčby – snížení glykemie na požadovanou úroveň nebylo dosaženo v intenzivně léčené skupině a všechny skupiny měly podobnou hladinu glykemie. Celý soubor 1253 nemocných byl i v kontrolních skupinách po stránce metabolické kompenzace dobře léčen i bez použití inzulinu, také celková mortalita byla ve studii nižší [32].
Metaanalýza studií hodnotící intenzivní léčbu inzulinem a glukózou převážně u nediabetických nemocných neprokázala výhodu této léčby, naposledy ve studii CREATE-ECLA (studie Clinical Trial of Metabolic Modulation in Acute Myocardial Infarction Treatment Evaluation-Estudios Cardiológicos Latinoamérica) u více než 20 000 nemocných s infarktem s ST-elevacemi léčených z 80 % reperfuzí, z nichž se u 18 % diabetiků neprokázalo zlepšení mortality ani srdečního selhání [33].
Závěry ze všech těchto studií ukazují, že podávání inzulinu společně glukózou, pokud nevede ke snížení glykemie, nemůže zlepšit prognózu nemocných a někdy může vést relativní hyperglykemie navozená touto léčbou ke zhoršení léčebných výsledků.
Práce podpořena výzkumným záměrem MSM0021622402 „Časná diagnostika a léčba kardiovaskulárních chorob“
doc.
MUDr. Jiří Špác, CSc.
2. interní klinika LF MU a FN U sv. Anny, Brno
jiri.spac@fnusa.cz
Sources
1.Unal B, Critchley JA, Capewell S. Explaining the decline in coronary heart disease mortality in England and Wales between 1981 and 2000. Circulation 2004; 109 : 1101-1107.
2.Suleiman M, Hammerman H, Boulos M et al. Fasting glucose is an important independent risk factor for 30-day mortality in patients with acute myocardial infarction: A Prospective Study. Circulation 2005; 111 : 754-760.
3.Sala J, Masiá R, González de Molina FJ et al. Short-term mortality of myocardial infarction admission patients with diabetes or hyperglycaemia during admission. J. Epidemiol Community Health 2002; 56 : 707-712.
4.Norhammar A, Tenerz A, Nilsson G et al. Glucose metabolism in patients with acute myocardial infarction and no previous diagnosis of diabetes mellitus: a prospective study. Lancet 2002; 359 : 2140–2144.
5.Bartnik M, Malmberg K, Norhammar A et al. Newly detected abnormal glucose tolerance: an important predictor of long-term outcome after myocardial infarction. Eur Heart J 2004; 25 : 1990-1997.
6.Mooy JM, Grootenhuis PA, de Vries H et al. Intra-individual variation of glucose, specific insulin and proinsulin concentrations measured by two oral glukose tolerance tests in a general Caucasian population: the Hoorn Study. Diabetologia 1996; 39 : 298–305.
7.Chan KC, Chou HH, Wu DJ et al. Diabetes mellitus has an additional effect on coronary artery disease. Jpn Heart J 2004; 45 : 921-927.
8. Garratt KN, Brady PA, Hassinger NL et al. Sulfonylurea drugs increase early mortality in patients with diabetes mellitus after direct angioplasty for acute myocardial infarction. J Am Coll Cardiol 1999; 33 : 119-124.
9.Ishihara M, Inoue I, Kawagoe T et al. Diabetes mellitus prevents ischemic preconditioning in patients with a first acute anterior wall myocardial infarction. J Am Coll Cardiol 2001; 38 : 1007–1111.
10.Solomon SD, Anavekar NS, Greaves S et al for the HEART Investigators. Angina pectoris prior to myocardial infarction protects against subsequent left ventricular remodeling. J Am Coll Cardiol 2004; 43 : 1511–1514.
11.Zbinden R, Zbinden S, Billinger M et al. Influence of diabetes mellitus on coronary collateral flow: an answer to an old controversy. Heart 2005; 91 : 1289-1293.
12.Asbun J, Villarreal FJ. The pathogenesis of myocardial fibrosis in the setting of diabetic cardiomyopathy. J Am Coll Cardiol 2006; 47 : 693-700.
13.Fox CS, Sullivan L, D’Agostino RB, Wilson PWF. The significant effect of diabetes duration on coronary heart disease mortality: The Framingham Heart Study. Diabetes Care 2004; 27 : 704-708.
14. Kvan E, Reikvam A for INPHARM Study Investigators. Thrombolytic treatment in diabetic patients with acute myocardial infarction: lower rates of use than in nondiabetic patients are explained by differences in presenting ECGs. Heart 2004; 90 : 1346–1347.
15.Kondo T, Kubota I, Tachibana H et al. Glibenclamide attenuates peaked T wave in early phase of myocardial ischemia. Cardiovasc Res 1996; 31 : 683–687.
16.Huizar JF, Gonzalez LA, Alderman J et al. Sulfonylureas attenuate electrocardiographic ST-segment elevation during an acute myocardial infarction in diabetics. J Am Coll Cardiol 2003; 42 : 1017-1021.
17.Murcia AM, Hennekens CH, Lamas GA et al. Impact of diabetes on mortality in patients with myocardial infarction and left ventricular dysfunction. Arch Intern Med 2004; 164 : 2273-2279.
18.Piechowski-Jozwiak B, Maulaz A, Bogousslavsky J. Secondary prevention of stroke with antiplatelet agents in patients with diabetes mellitus. Cerebrovasc Dis 2005; 20(Suppl 1): 15-23.
19.Brown LC, Johnson JA, Majumdar SR et al. Evidence of suboptimal management of cardiovascular risk in patients with type 2 diabetes mellitus and symptomatic atherosclerosis. CMAJ 2004; 171 : 1189-1192.
20.Fibrinolytic Therapy Trialists’ (FTT) Collaborative Group. Indications for fibrinolytic therapy in suspected acute myocardial infarction: collaborative overview of early mortality and major morbidity results from all randomized trials of more than 1,000 patients. Lancet 1994; 343 : 311–322.
21.Zairis MN, Lyras AG, Makrygiannis SS et al. Type 2 diabetes and intravenous thrombolysis outcome in the setting of ST elevation myocardial infarction. Diabetes Care 2004; 27 : 967-971.
22.Mak KH, Topol EJ. Emerging concepts in the management of acute myocardial infarction in patients with diabetes mellitus. J Am Coll Cardiol 2000; 35 : 563-568.
23.Harjai KJ, Stone GW, Boura J Comparison of outcomes of diabetic and nondiabetic patients undergoing primary angioplasty for acute myocardial infarction. Am J Cardiol 2003; 91 : 1041-1045.
24.Hsu LF, Mak KH, Lau KW et al. Clinical outcomes of patients with diabetes mellitus and acute myocardial infarction treated with primary angioplasty or fibrinolysis. Heart 2002; 88 : 260-265.
25.Silva JA, Ramee SR, White CJ et al. Primary stenting in acute myocardial infarction: influence of diabetes mellitus in angiographic results and clinical outcome. Am Heart J 1999;138 : 446–455.
26.Angeja BG, de Lemos J, Murphy SA et al. Impact of diabetes mellitus on epicardial and microvascular flow after fibrinolytic therapy. Am Heart J 2002; 144 : 649-656.
27.Prasad A, Stone GW, Stuckey TD et al. Impact of diabetes mellitus on myocardial perfusion after primary angioplasty in patients with acute myocardial infarction. J Am Coll Cardiol 2005; 45 : 508-514.
28.Mathew V, Gersh BJ, Williams BA et al. Outcomes in patients with diabetes mellitus undergoing percutaneous coronary intervention in the current era: A report from the Prevention of REStenosis with Tranilast and its Outcomes (PRESTO) Trial. Circulation 2004; 109 : 476-480.
29.Marfella R, Siniscalchi M, Esposito K et al. Effects of stress hyperglycemia on acute myocardial infarction: Role of inflammatory immune process in functional cardiac outcome. Diabetes Care 2003; 26 : 3129-3135.
30.Malmberg K, Ryde´n L, Wedel H et al for the DIGAMI 2 Investigators. Intense metabolic control by means of insulin in patients with diabetes mellitus and acute myocardial infarction (DIGAMI 2): effects on mortality and morbidity. Eur Heart J 2005; 26 : 650–661.
31.Malmberg K on behalf of the Diabetes Mellitus, Insulin Glucose Infusion in Acute Myocardial Infarction (DIGAMI) Study Group. Prospective randomized study of intensive insulin-treatment on long-term survival after acute myocardial infarction in patients with diabetes mellitus. BMJ 1997; 314 : 1512–1515.
32.Malmberg K, Ryde´n L, Wedel H et al for the DIGAMI 2 Investigators. Intense metabolic control by means of insulin in patients with diabetes mellitus and acute myocardial infarction (DIGAMI 2): effects on mortality and morbidity. Eur Heart J 2005; 26 : 650–661.
33.The CREATE-ECLA Trial Group Investigators. Effect of glucose-insulin-potassium infusion on mortality in patients with acute ST-segment elevation myocardial infarction. JAMA 2005; 293 : 437-446.
34.Shekelle PG et al. Efficacy of angiotensin-converting enzyme inhibitors and beta-blockers in the managementof left ventricular systolic dysfunction according to race, gender, and diabetic status: a meta-analysis of major clinical trials. J Am Coll Cardiol 2003; 41 : 1529-1538.
35.Prasad A, Stone GW, Stuckey TD et al. Impact of diabetes mellitus on myocardial perfusion after primary angioplasty in patients with acute myocardial infarction. J Am Coll Cardiol 2005; 45 : 508-514.
36.Lincoff AM. Important triad in cardiovascular medicine: diabetes, coronary intervention, and platelet glycoprotein IIb/IIIa receptor blockade. Circulation 2003; 107 : 1556-1559.
Labels
Paediatric cardiology Internal medicine Cardiac surgery CardiologyArticle was published in
Cardiology Review

2007 Issue 4
-
All articles in this issue
- Je dilatační kardiomyopatie geneticky podmíněné onemocnění?
- Atypicky se prezentující nebo zcela bezbolestně probíhající AIM
- Zvláštnosti léčby akutního infarktu myokardu a diagnostické problémy u nemocných s diabetes mellitus
- Studie BARI 2D – sekundární prevence a optimální léčebné strategie u diabetiků 2. typu s ischemickou chorobou srdeční
- Je protidestičková léčba indikována v primární prevenci?
- Antiagregační léčba a potahované stenty v roce 2007
- Klinický význam měření distenzibilty karotické tepny
- Mitrální stenóza
- Použití kryodestrukce v nefarmakologické terapii fibrilace síní
- Současné možnosti chirurgické léčby fibrilace síní
- Cardiology Review
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Mitrální stenóza
- Atypicky se prezentující nebo zcela bezbolestně probíhající AIM
- Je dilatační kardiomyopatie geneticky podmíněné onemocnění?
- Je protidestičková léčba indikována v primární prevenci?
