Nefarmakologická léčba z pohledu nových doporučení pro léčbu nemocných s fibrilací síní
Non-pharmacological treatment from the point of view of recent recommendations for the treatment of patients with atrial fibrillation
Non-pharmacological treatment from the point of view of recent recommendations for the treatment of patients with atrial fibrillation. Catheter therapy of atrial fibrillation was established in the late 1990s. Initial pioneer attempts at focal catheter ablation within the pulmonary veins have recently been superceded by novel and clinically tested approaches. Despite the introduction of sophisticated techniques for the procedure and increased clinical knowledge of this arrhythmia, the main principle applied during ablation has not been changed – wide antral isolation of pulmonary veins or other thoracic veins or other thoracic veins complemented by a series of linear or non-linear lesions either in the left or both atria has remained a cornerstone of the procedure. Notwithstanding the enormous effort to achieve a similar clinical success rate as in AV nodal re-entry tachycardia, WPW syndrome or typical atrial flutter, we are witnessing a relatively low long-term success rate, most likely due to the fact that atrial fibrillation is a unique phenomenon, with a continuously evolving arrhythmic substrate. This article summarizes new guidelines for the non-pharmacological treatment of atrial fibrillation and simultaneously gives an overview of the current clinically used technologies for the catheter and surgical ablation.
Keywords:
catheter ablation – atrial fibrillation – guidelines – success rate – novel technologies
Authors:
A. Bulava
Authors‘ workplace:
Kardiocentrum Nemocnice České Budějovice
Published in:
Kardiol Rev Int Med 2011, 13(3): 143-152
Overview
Katetrová léčba fibrilace síní se začala prosazovat na konci 90. let minulého století. První pionýrské pokusy o fokální katetrovou ablaci v plicních žílách byly nahrazeny novými a klinicky testovanými postupy. Přes zavedení sofistikovaných technologií umožňujících navigaci ablačního katetru a nárůstu klinických znalostí o této arytmii se hlavní princip léčby nezměnil – úhelným kamenem zůstává i dnes široká antrální cirkumferenční izolace plicních (a dalších hrudních) žil doplněná dle potřeby o sérii lineárních či nelineárních lézí v levé nebo i pravé síni. Navzdory enormnímu úsilí dosáhnout podobných úspěchů, jako tomu je v katetrové léčbě AV nodální reentry tachykardie, typického flutteru síní či WPW syndromu, jsme u fibrilace síní svědky relativně nízké dlouhodobé úspěšnosti zřejmě proto, že se jedná kvalitativně o zcela odlišnou arytmii s neustále se vyvíjejícím substrátem. Tento text shrnuje nová doporučení pro nefarmakologickou léčbu fibrilace síní a podává zároveň přehled o klinicky dostupných technologiích invazivní katetrové a chirurgické léčby.
Klíčová slova:
katetrová ablace – fibrilace síní – doporučení pro léčbu – úspěšnost – nové technologie
Úvod
Nefarmakologická léčba fibrilace síní (FS) se počala prosazovat na konci 90. let minulého století. První pionýrské pokusy o radiofrekvenční (RF) katetrovou ablaci FS [1] byly nahrazeny novými a klinicky testovanými postupy. Přes zavedení sofistikovaných technologií napomáhajících ablaci a dramatický nárůst klinických zkušeností ve velkých specializovaných centrech se hlavní princip léčby nezměnil – úhelným kamenem zůstává izolace plicních (a dalších hrudních) žil doplněná dle potřeby o sérii lineárních či nelineárních lézí v levé nebo i pravé síni.
Přes enormní úsilí dosáhnout v léčbě FS podobných úspěchů, jako toho jsme svědky u AV nodální reentry tachykardie, typického flutteru síní či WPW syndromu, se u této arytmie jedná kvalitativně o zcela odlišnou jednotku s neustále se vyvíjejícím arytmogenním substrátem. Text shrnuje nová doporučení pro katetrizační léčbu této nejčastější supraventrikulární arytmie a podává zároveň přehled o dostupných technologiích této invazivní léčby.
Možnosti nefarmakologické léčby fibrilace síní
Mezi nefarmakologickou léčbu FS v širším slova smyslu řadíme elektrickou kardioverzi, kardiostimulaci, implantaci síňových defibrilátorů, selektivní nebo neselektivní katetrovou ablaci a implantaci okluderů levosíňového ouška. Strictu senso se často tímto pojmem označuje jen selektivní katetrová nebo chirurgická ablace, protože ta jediná má za cíl přerušit arytmii a udržet normální sinusový rytmus („kurativní“ výkon). Kardiostimulace jako léčba FS per se a implantace síňových defibrilátorů nedoznaly širšího klinického použití a v léčbě FS jsou dnes zcela opuštěny. Ablace AV uzlu doplněná kardiostimulací je léčbou paliativní. Chirurgická ablace indikovaná primárně jen pro léčbu arytmie stojí dnes prozatím ve stínu katetrizačních metod a procedura je prováděna nejčastěji jen jako součást jiného kardiochirurgického výkonu.
Počátky katetrové ablace pro fibrilaci síní
Po úvodních neúspěších na počátku 90. let 20. stol. zopakovat úspěch chirurgické MAZE III procedury katetrovou cestou přišlo zklamání – úspěšnost byla nízká, procento komplikací vysoké a procedurální a skiaskopické časy excesivní [2]. Významným průlomem byla práce Haissaguerreho et al z Bordeaux publikovaná v roce 1996 [3]. Autoři na souboru 45 pacientů podstupujících RFA pro paroxyzmální fibrilaci síní ukázali, že ablace v pravé síni vedla k udržení stabilního sinusového rytmu u 33 % pacientů (doba sledování 11 ± 4 měsíců). Většina z těchto pacientů však stále užívala antiarytmika, která nebyla před RF ablací efektní. Deset pacientů s neúspěšnou RFA v pravé síni pak podstoupilo další ablační zákrok v levé síni s úspěšností udržení sinusového rytmu, která dosahovala již tehdy 60 %. Velice brzy se průkopníci této metody obrátili do levé síně a bylo pozorováno, že ablace fokusů ze svalových rukávců plicních žil dokáže efektivně zabránit rekurenci arytmie [3–5].
K následnému rozvoji ablačních výkonů pro FS v posledních 10–15 letech přispěl technický a technologický vývoj zejména na poli trojrozměrných mapovacích systémů umožňujících přesnou lokalizaci ablačního katetru v srdečních oddílech. První systémy trpěly řadou limitací, zejm. nízkou rychlostí zpracování dat a kvalitou zobrazení. Vývoj technických možností dospěl až do současného stavu rutinního použití obrazové integrace s CT (či MRI) obrazem levé síně [6], zobrazení všech katetrů zavedených do srdce ve virtuální mapě či k rekonstrukci anatomie levé síně intrakardiálním ultrazvukem v reálném čase. Do léčby se stále více prosazují metody robotického nebo magnetickým polem řízeného pohybu ablačního katetru v cílové srdeční struktuře [7].
Klasifikace fibrilace síní – akceptovaná definice pro potřeby invazivní léčby
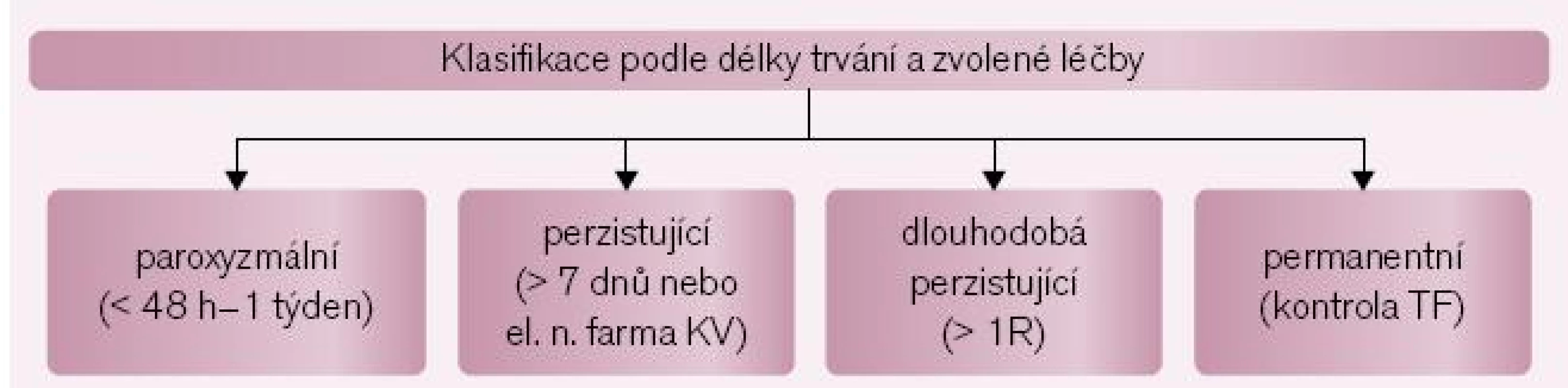
Arytmie může být buď symptomatická, nebo asymptomatická. Často je objevena jako náhodný nález při vyšetření pro další kardiovaskulární nebo zcela jiné onemocnění. Pokud je arytmie zjištěna u pacienta poprvé, hovoříme o primozáchytu FS nebo o první epizodě FS. V této chvíli nelze arytmii blíže klasifikovat. Podle reakce na léčbu a doby trvání pak arytmii klasifikujeme na paroxyzmální, perzistující, dlouhodobou perzistující a permanentní (obr. 1) [8]. Tato klasifikace má zejména význam pro indikaci katetrové ablace FS (viz níže), hranice mezi paroxyzmální a perzistující arytmií však není ostrá, protože u jednoho pacienta se mohou vyskytovat zároveň epizody paroxyzmální i perzistující arytmie per definitionem. Arytmie bez současně přítomného kardiovaskulárního onemocnění se označuje jako izolovaná („lone“) FS.
Současný pohled na indikace k radiofrekvenční katetrové ablaci fibrilace síní
Obecně je katetrová léčba FS vyhrazena pro pacienty s vysoce symptomatickou arytmií, která nereaguje na antiarytmickou léčbu, včetně „uzlových“ antiarytmik kontrolujících tepovou frekvenci. Při indikaci výkonu je třeba podle současných doporučení zvážit zejména [8,9]:
- celkový stav pacienta (přítomnost komorbidit, biologický věk)
- pokročilost onemocnění levé síně (velikost levé síně; typ arytmie – paroxyzmální, perzistující, dlouhodobě perzistující; reakce na elektrickou kardioverzi, délka trvání arytmie apod.)
- přítomnost nebo absenci jiného kardiovaskulárního onemocnění (ischemická choroba srdeční, dilatační či hypertrofická kardiomyopatie, chlopenní vady – zejm. mitrální stenóza a regurgitace atd.)
- další léčebné alternativy (antiarytmická léčba, kontrola frekvence, ablace AV uzlu doplněná kardiostimulací)
- preference a především motivace pacienta (compliance k výkonu – horizontální poloha na sále po dobu 2–4 hod bez možnosti pohnout se, akceptace rizik výkonu, adherence k p. o. léčbě antikoagulancii po výkonu atd.)
Výsledkem celé rozvahy je zvážení potenciálního přínosu zákroku pro pacienta oproti potenciálním rizikům s přihlédnutím k individuální preferenci a motivaci, přičemž v celém procesu hraje též roli zkušenost pracoviště (a operatéra) provádějícího daný výkon.
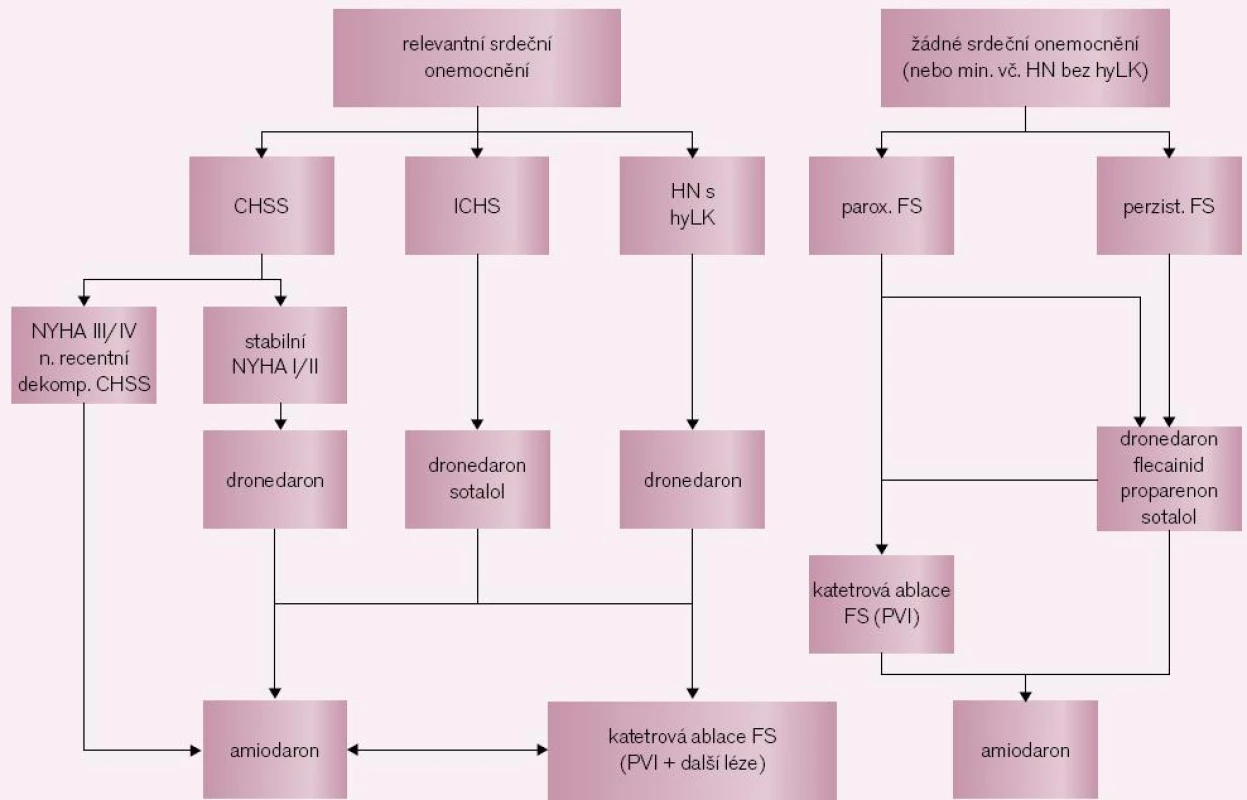
Indikační proces (obr. 2) lze zjednodušit do následujících zásad: 1. indikovaný je pouze symptomatický pacient; 2. pokud je přítomno nějaké relevantní srdeční onemocnění, je nutné testovat antiarytmickou léčbu: v našich podmínkách nejčastěji amiodaron nebo sotalol. Pro dronedaron platí v současné době významné preskripční omezení (tab. 1); 3. u pacientů bez srdečního onemocnění (nebo s minimálním postižením) závisí na typu arytmie: u perzistujících forem bychom opět měli testovat antiarytmickou léčbu (propafenon, flecainid či sotalol) a teprve po selhání této léčby lze pacienta k výkonu indikovat; pokud však jde o formu paroxyzmální, lze pacienta odmítajícího antiarytmika indikovat k RF ablaci jako léčbě první volby (indikační třída IIb [8]); 4. měli bychom se přidržet pravidla, že RF katetrová ablace by u mladších nemocných měla být preferována před dlouhodobou léčbou amiodaronem. Skupiny pacientů, u nichž lze očekávat užitek z výkonu, přehledně shrnuje tab. 2.

![Výběr pacientů k radiofrekvenční katetrové ablaci. Upraveno dle [9].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/b611023c2f151cff72fd29b4dc4848d2.jpg)
Obecně platí, že čím mladší a jinak „zdravější“ pacient, nejlépe bez kardiopatie a v iniciálních stadiích arytmie, kdy má FS schopnost sama sebe ukončit, tím lepší jsou výsledy katetrové léčby. Ačkoli jsou výsledky ablací perzistujících forem arytmie povzbudivé [10,11], stále platí, že úspěšnost první ablace je významně vyšší u formy paroxyzmální [12,13]. Pro definitivní řešení perzistující FS je nutné podstoupit opakované ablace (většinou dva až tři, někdy ale i více výkonů). Tyto výkony jsou také významně delší, protože tam, kde ablace pro paroxyzmální FS končí (tedy izolací plicních žil), tam ablace pro perzistující FS začíná. Potenciálně tak mohou být tyto výkony zatíženy větším počtem komplikací [13,14], ačkoli jednoznačná data o tom neexistují. O těchto aspektech výkonu by měl být pacient rovněž informován. Přínos RF ablace u asymptomatických nemocných s FS nebyl prokázán. Rovněž neochota nebo kontraindikace k užívání warfarinu není sama o sobě indikací k provedení zákroku.
Úspěšnost ablací
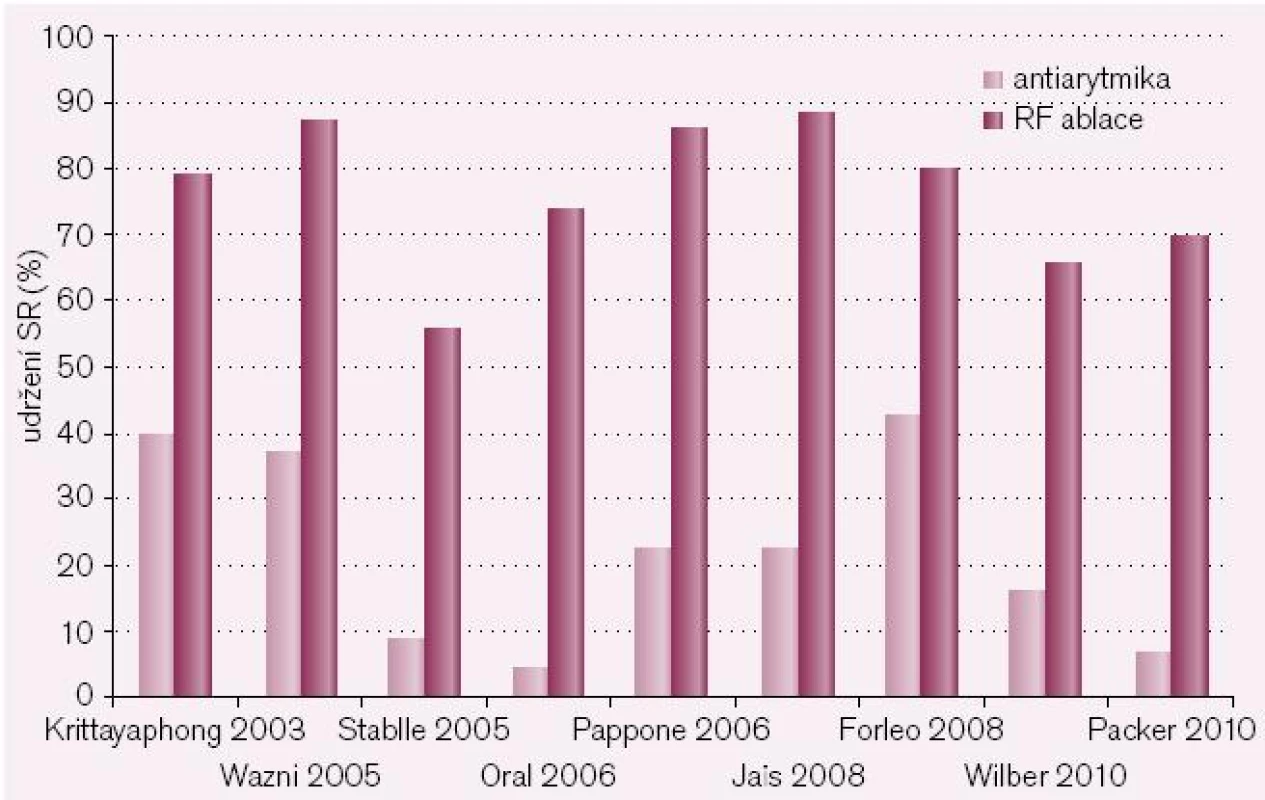
V současné době je k dispozici dostatek údajů, které ukazují, že katetrová ablace je v udržení sinusového rytmu (SR) významně lepší než antiarytmická léčba (obr. 3). Na druhé straně je třeba říci, že většina těchto studií byla provedena u pacientů, kteří byli k ablaci indikováni na podkladě skutečnosti, že antiarytmika u nich nebyla účinná, a doba sledování pacientů je rovněž poměrně krátká. Výsledky recentní metaanalýzy podle Calkinse et al ukazují, že celková úspěšnost ablační léčby se pohybuje mezi 60–80 %, podle toho, zda hodnotíme úspěšnost pouze po 1. výkonu, bez nebo se současnou antiarytmickou léčbou apod. (obr. 4). Je třeba zdůraznit, že data byla získána ve velkých centrech s extrémní zkušeností, jen jedna studie měla > 200 pacientů, žádná studie neměla > dvě participující centra, méně než 50 % studií používalo Holter či záznamníky k detekci recidiv mezi ambulantními návštěvami a taktéž definice úspěchu nebyla zcela jednotná. Recentní data ukazují, že pokud pacienty sledujeme podstatně déle (5 let a více), úspěšnost (a tedy udržení SR) po 1. výkonu se dramaticky snižuje až k 30 % [15,16].
![Metaanalýza úspěšnosti katetrizační léčby fibrilace síní. 1 – úspěch první procedury bez současné léčby antiarytmiky, 2 – úspěch opakovaných procedur bez současné léčby antiarytmiky, 3 – úspěch první procedury s léčbou antiarytmiky nebo bez ní, 4 – úspěch opakovaných procedur s léčbou antiarytmiky nebo bez ní, 5 – relativní četnost opakovaných procedur. Upraveno dle [17].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/5e903196cd95c6d3daae8a68d471144c.jpg)
Předablační vyšetření
Před indikací k RF katetrové ablaci pro FS musí být arytmie dokumentována na 12svodovém EKG nebo na záznamu z Holterova monitorování. Zhruba 5–7 dní před termínem ablace je zapotřebí vysadit p. o. antikoagulancia a pacienta převést na nízkomolekulární heparin (LMWH). Existují však pracoviště, kde warfarin není před výkonem vysazován a procedura je prováděna za účinné hladiny INR. Sami se však k tomuto postupu z bezpečnostních důvodů nekloníme. Před samotnou RF ablací je zapotřebí provést transezofageální echokardiografii k vyloučení trombu v levé síni. Optimálně by mělo být TEE provedeno do 48 hod před výkonem, pokud je časový odstup delší, je nutné zajistit podávání LMWH v léčebné dávce. Sami na našem oddělení provádíme CT a TEE vyšetření den před vlastním zákrokem. Další vyšetření zahrnují krevní obraz, koagulaci a základní iontogram. Samozřejmostí je vyloučení sekundární etiologie arytmie, kde hraje úlohu léčba primárního onemocnění.
Ablační procedura
Princip účinku
Poznání, že arytmie je často spouštěná („trigrovaná“) ze svalových rukávců plicních žil, vedlo nejprve k vytvoření strategie fokální ablace těchto svalových vláken v žilním ostiu [4]. Blízkost ablačních lézí vedla ke značnému riziku stenózy plicní žíly či její úplné okluze. Postupem času byla vyvinuta v současné době užívaná technika široké antrální cirkumferenční izolace plicních žil, protože řada „trigrů“ může být lokalizována právě v antru plicní žíly, a není tak distálněji provedenou izolací eliminována (obr. 5). Vzácněji se vyskytující ektopická ložiska v Marshallově ligamentu jsou řešena izolací koronárního sinu, spouštějící ložiska z horní duté žíly mohou být rovněž řešena její izolací.
U perzistující arytmie se dnes nejčastěji uplatňuje tzv. sekvenční ablační strategie (obr. 6) [10], která zahrnuje izolaci plicních žil, sérii lineárních lézí (typicky mezi levou dolní plicní žílou a mitrálním anulem – tzv. linka mitrálního můstku, mezi levou a pravou horní plicní žílou – tzv. stropní linka, popř. i mezi levou a pravou dolní plicní žílou s vyloučením celé zadní stěny levé síně – tzv. box lesion) a nelineárních lézí – tzv. na elektrogramu založenou ablaci (cílenou na místa s frakcionovanou aktivitou, nejrychlejší aktivitou nebo lokálním aktivačním gradientem). Jako přínosná se považuje současná ablace nervových ganglií a plexů [18]. Protože jsou tyto neuronové sítě a hnízda lokalizovány blízko plicních žil, stávají se často automaticky součástí obkružujících ablačních lézí. Cílem všech lineárních lézí je spojit anatomické či funkční bariéry vedení vzruchu a kompartmentalizovat tak levou síň a zabránit šíření mnohočetných reentry vln. Kritické je z tohoto hlediska ověřit přítomnost bidirekčního bloku vedení vytvořenými liniemi (prevence pozdějších iatrogenních reentry síňových tachykardií). Cílem ablace míst frakcionovaných potenciálů (CFAE – čti „kafé“ – complex fractionated atrial electrograms) je zrušit lokální rotory (lokalizované reentry) udržující arytmii. Zatímco některé práce ukazují příznivý efekt těchto ablačních přístupů [19], jiná data tento efekt nepotvrzují [20].
![Sekvenční ablační strategie pro permanentní fibrilaci síní. Upraveno dle [10].
AT – síňová tachykardie, CS – koronární sinus, FS – fibrilace síní, OLS – ouško levé síně, OPS– ouško pravé síně, RFA – radiofrekvenční katetrová ablace, SR – sinusový rytmus](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/b920fb147ab509c84e6e4f7c0937cfc3.jpg)
Současné dostupné technologie pro katetrovou léčbu
Nejrozšířenějším postupem je v současné době vytváření ablačních lézí v levé síni tzv. „bod po bodu“. Za pomoci trojrozměrných mapovacích systémů (CARTO3, Biosense Webster nebo Ensite NavX, St. Jude Medical) se vytvoří rekonstrukce levé síně. Oba systémy rovněž umožňují integraci s CT (nebo MRI) obrazem (obr. 5). Pak je řiditelným ablačním katetrem vytvářená série ablačních lézí („pálení“), kdy ablace v každém jednotlivém místě trvá cca 30–90 s podle intenzity aplikované energie a odhadu síly kontaktu katetru s tkání.
Katetr může být navigován manuálně, elektromechanickým robotickým systémem nebo magnetickým polem s proměnným vektorem. V současné době je na trhu k dispozici řada takových systémů, které dovolují manipulaci s ablačními katetry ze vzdáleného místa. Úkolem operatéra „u stolu“ je nejprve připravit výkon tak, aby mohl být nakonec ablační katetr umístěn do speciálního ovládacího zařízení a vlastní RF ablace se již provádí vzdáleně, např. z vedlejší místnosti. Tato příprava většinou spočívá v zavedení katetrů do stabilní pozice na cílová místa (pravá síň, koronární sinus, hrot pravé komory, plicní žíla apod.), sjednání transseptální punkce, zavedení katetru pro intrakardiální ultrazvuk a konečně v zavedení ablačního katetru z třísla do cílové srdeční dutiny.
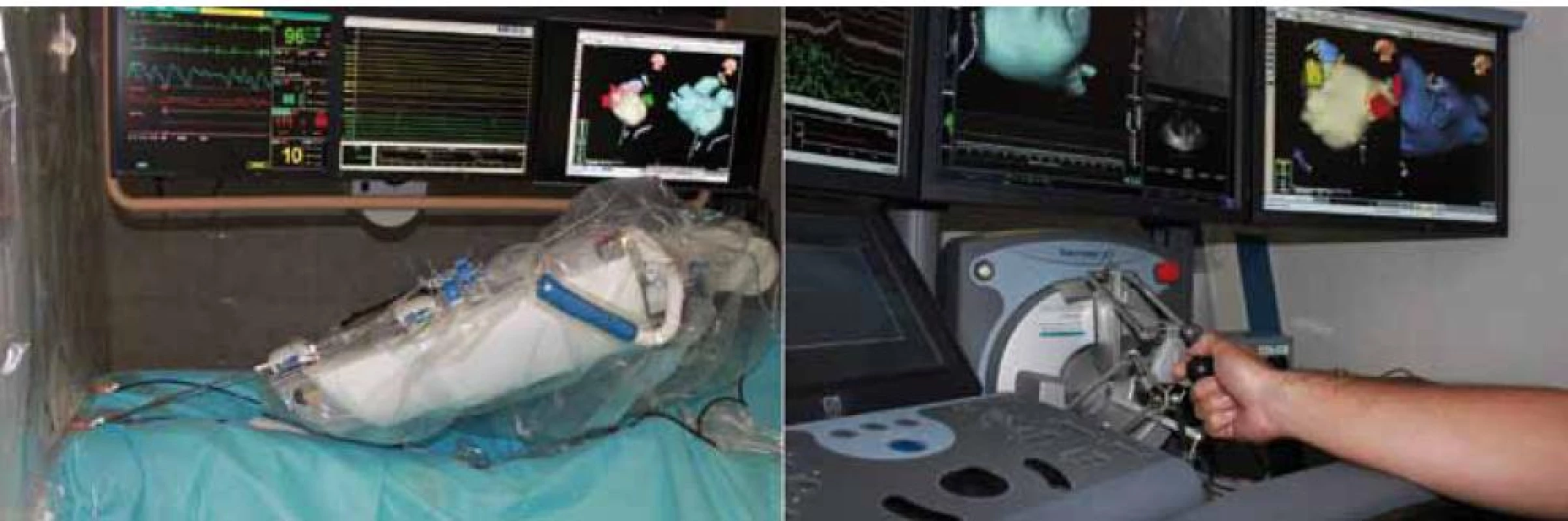
Principiálně existuje dvojí vzdálené ovládání ablačního katetru. Používá se standardní ablační katetr upevněný do robotické paže, která se ovládá 3D joystickem, proto se tyto systémy také někdy nazývají elektromechanické. Příkladem je systém Sensei™ Hansen Medical, Inc. (obr. 7) nebo systém Amigo RCS firmy Catheter Robotics, Inc. Jinou možností je použití speciálního ablačního katetru z feromagnetického materiálu, který je natolik ohebný, že nezaujímá žádný pevný tvar a pokud jej vezmeme do ruky, „visí“ ve směru gravitace (má podobné vlastnosti jako vařená špageta). V magnetickém poli se však katetr pohybuje vždy ve směru výsledného magnetického vektoru, což je základním principem magnetické navigace. Systém je spojen s 3D elektroanatomickou navigací (CARTO nebo Ensite) a pohyby katetru se řídí nastavením vektoru magnetického pole, které je generováno dvěma velkými stacionárními magnety, jako je tomu u systému Niobe® firmy Stereotaxis (obr. 8), nebo elektromagnety s fokusací magnetickou čočkou (systém Catheter Guidance Control and Imaging (CGCI) společnosti Magnetecs).

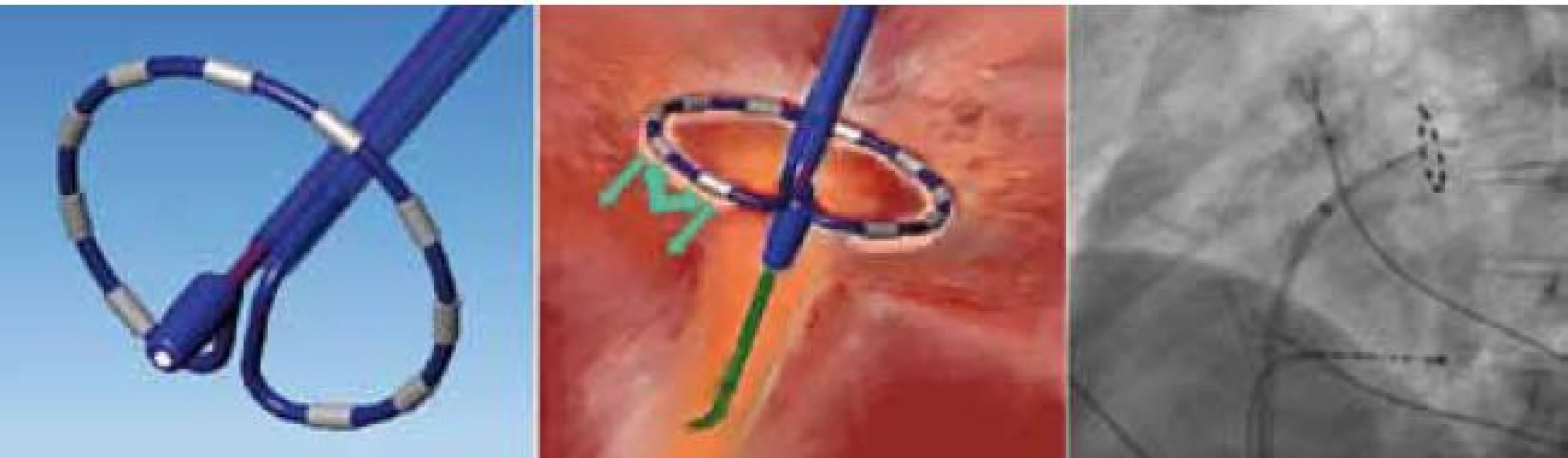
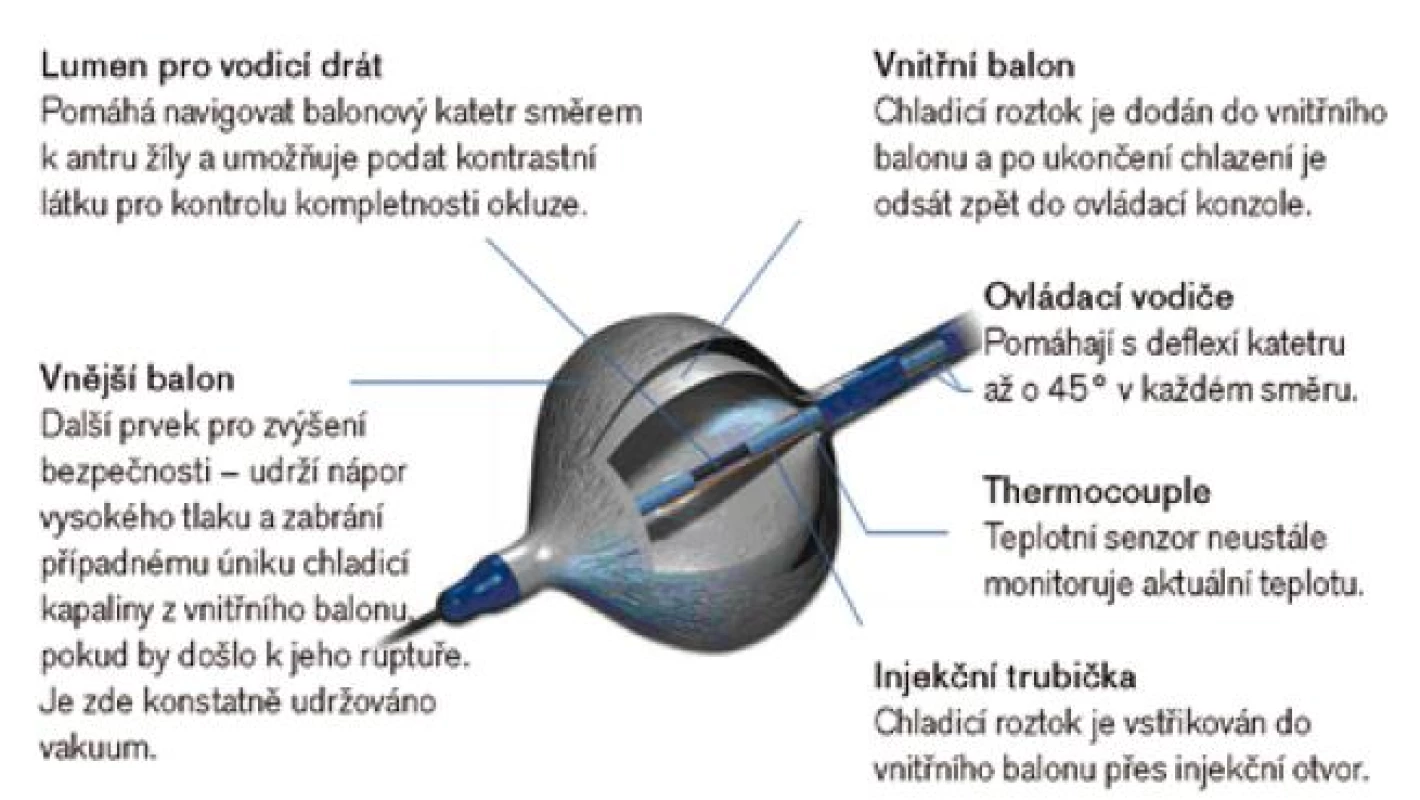
Za účelem překonání limitací metody vytváření lézí „bod za bodem“, které spočívají především v časové náročnosti a riziku vzniku nekompletních linií, byly vytvořeny ablační nástroje, které jedním či několika aplikacemi energie dosáhnou kompletní izolace plicních žil. Ablační katetry používají radiofrekvenční energii (katetr PVAC společnosti Medtronic (obr. 9) nebo katetr MESH společnosti Bard Electrophysiology), jiné systémy užívají balonové katetry a aplikaci kryoenergie (obr. 10) nebo fokusovaného laserového paprsku. Balonové a cirkulární katetry narážejí především na anatomickou různorodost plicních žil a fakt, že je nelze použít na zdroje FS mimo plicní žíly. Z hlediska efektivity jsou literárně udávány přibližně stejné účinnosti jako při použití manuální ablace „bod po bodu“. Jedna malá unicentrická randomizovaná studie udává krátkodobou účinnost srovnatelnou při použití katetru PVAC oproti manuálnímu přístupu ablace za použití systému CARTO [21]. Velkou výhodou použití katetru PVAC oproti 3D mapovacím technologiím a ablaci „bod po bodu“ je významně kratší doba trvání celého ablačního zákroku [21,22]. Rozsáhlejší randomizovaná data srovnávající klinickou úspěšnost jednotlivých technologií dosud nejsou v literatuře k dispozici.
Pooperační péče
Po extrakci všech pouzder a katetrů po zákroku je podáván nízkomolekulární nebo nefrakcionovaný heparin v účinné dávce do doby, než je dosaženo adekvátní inhibice koagulačního systému warfarinem (INR 2,5–3). Doba podávání warfarinu po zákroku by měla činit minimálně tři měsíce (bezpečné období pro endotelizaci endokardiálních ablačních lézí) [8,9]. Další strategie antikoagulační léčby se řídí dle rizikovosti pacienta pro tromboembolickou příhodu (např. skóre CHADS2 nebo CHA2DS2-VASc). Zatím převládá názor, že u pacientů s CHADS2 skóre ≥ 2 se má trvalá antikoagulace spíše ponechat. Data o tomto postupu nejsou jednotná a v praxi ani všeobecně respektovaná, jedná se o preferenci bezpečnější varianty.
Monitoring úspěšnosti katetrové ablace
Antiarytmika mohou být po RF ablaci vysazena nebo jsou častěji ponechávána ke stabilizaci časného období hojení a reverzní remodelace levé síně. Případné recidivy FS, zvláště po ablaci její perzistentní formy, je vhodné co nejdříve ukončit např. elektrickou kardioverzí a proces reverzní remodelace takto podpořit. Období prvních 2–3 měsíců po ablaci se většinou v klinických studiích nehodnotí (tzv. blanking perioda) – recidiva FS nebo jiné arytmie v tomto období není považována za selhání léčby. Případnou opakovanou ablaci je až na výjimky vhodné plánovat ne dříve než po uplynutí prvních 3–6 měsíců po předchozí ablaci.
Hodnocení úspěšnosti výkonu po uplynutí blanking periody je předmětem stálých diskuzí a debat. Konsenzus expertů doporučuje první hodnocení provést po třech měsících po zákroku a pak každých dalších šest měsíců do doby minimálně dvou let po operaci [12]. Minimálním standardem je provedení sedmidenního Holterova monitorování. V diagnostice recidiv arytmie se zřejmě stále častěji budou uplatňovat implantabilní záznamníky, zvláště poté, co v budoucnu dojde k jejich miniaturizaci a nekomplikovanému ambulantnímu zavádění pod kůži prostou punkční technikou.
Komplikace výkonu
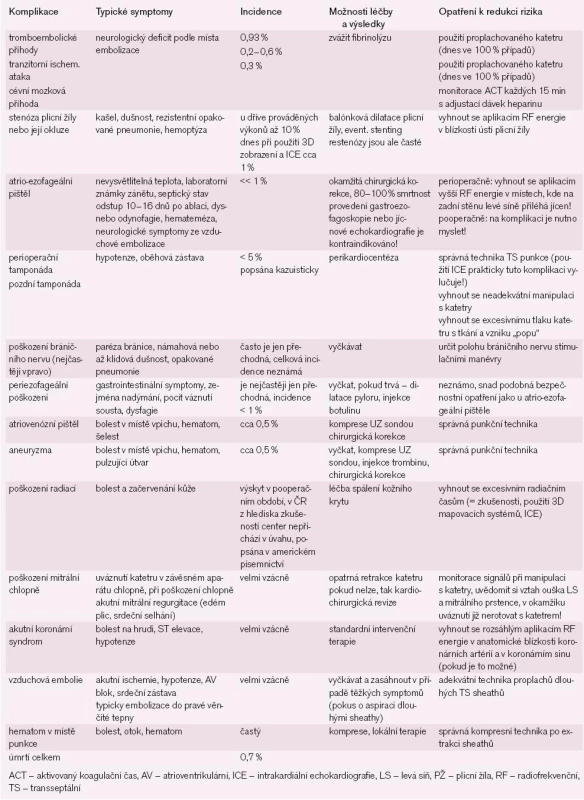
Katetrová ablace může být spojena s rizikem významných komplikací (tab. 3).
Paliativní ablační léčba fibrilace síní
Ablace AV uzlu vede k nevratnému poškození AV převodu a závislosti na kardiostimulaci. Z tohoto důvodu je výkon nutno indikovat s důkladnou rozvahou. Kromě pacientů s FS a rychlou komorovou odpovědí a již zavedenou biventrikulární stimulací by se měla ablace AV uzlu zvážit jen u vysoce symptomatických pacientů rezistentních na farmakologickou kontrolu rytmu či frekvence komor, u nichž nelze předpokládat užitek ze selektivní ablace, nebo je provedení ablace vysoce rizikové, nebo kde tato léčba selhala či byla odmítnuta (tab. 4).
![Indikace pacientů k radiofrekvenční katetrové ablaci AV uzlu a trvalé kardiostimulaci. Upraveno dle [9].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/49b01ad3819f42ab310d0f42ecdb8756.jpg)
Chirurgická ablace
Současně s vývojem ablačních technik experimentovali v 90. letech min. století Cox et al [23] s prováděním chirurgických lézí v síních s cílem eliminovat fibrilaci síní, nejdříve v pokusech na zvířeti a následně pak i v pilotních humánních studiích. Finální produkt jejich výzkumu operace MAZE III (z angl. MAZE = bludiště) byla založena na modelu fibrilace síní, v němž udržení arytmie vyžaduje určité množství síňové svaloviny schopné udržet kritický počet reentrantních vln [24]. Hlavním principem této metody je provedení série transmurálních řezů v pravé i levé síni, která rozdělí síně na dostatečně malé, elektricky izolované okrsky, které nemohou udržet fibrilaci bez ohledu na způsob jejího vzniku. Postupem času bylo zjištěno, že léze v levé síní jsou pro udržení sinusového rytmu dostatečné, přičemž izolace zadní stěny levé síně a plicních žil byla vždy součást výkonu. Tímto přístupem byli Cox et al schopni dosáhnout 93% úspěšnosti udržení sinusového rytmu bez nutnosti užívat antiarytmika v mnohaletém sledování, přičemž transportní funkce síní zůstala u drtivé většiny pacientů zachována [23]. Bohužel, žádné jiné kardiochirurgické pracoviště nedokázalo tuto úspěšnost zopakovat a nezanedbatelná morbidita a operační riziko spojené se sternotomií vedlo k tlaku na hledání alternativ provedení výkonu perkutánní cestou.
Dnes je kardiochirurgická ablace prováděna nejčastěji jako součást jiného operačního zákroku. Technika „cut-and-sew“ byla nahrazena použitím různých ablačních instrumentárií, která dovolují vytvořit léze pod přímou kontrolou zraku. Jako zdroj energie se dnes klinicky nejčastěji používá RF proud nebo hluboké mražení (kryo), alternativně existují instrumentária využívající laser, mikrovlny nebo ultrazvuk. Aplikace lze provádět endokardiálně i epikardiálně a vhodně je lze případně kombinovat. Ve srovnání s katetrizačními metodami lze chirurgickou ablací snadno dosáhnout úplné elektrické izolace s dostatečně transmurálními lézemi. V indikovaných případech, kde se nepředpokládá obnovení sinusového rytmu, lze snesením ouška levé síně ovlivnit riziko následné tromboembolie.
Indikace kardiochirurgické léčby
Pokud je u pacienta s FS indikován kardiochirurgický výkon, je doplnění o perioperační ablaci většinou snadno proveditelné. Proto by měla být perioperační ablace zvážena u naprosté většiny pacientů s paroxyzmální i perzistující FS. Je však třeba vzít v úvahu doprovodná onemocnění, trvání FS, velikost síní a další faktory, které ovlivňují úspěšnost výkonu [25]. Při výrazném zvětšení levé síně a mnohaleté anamnéze FS bývá velmi pokročilá remodelace síní a úspěšnost perioperačních ablací je nízká.
Indikace k provádění zákroku pro FS jako samostatného výkonu (minitorakotomie, torakoskopie) není zdaleka tak jasně přijímána. Záleží většinou na zkušenosti daného pracoviště, a to jak v oblasti chirurgického řešení FS, tak v oblasti provádění katetrových ablací (obr. 11). Obecně je ve světě i v ČR pro FS zatím mnohem častěji prováděna endovazální ablace. Současná evropská doporučení se k primární indikaci chirurgické ablace FS jako prvního výkonu nevyjadřují a její místo spatřují spíše u pacientů, u nichž selhal katetrový přístup (tab. 5).
![Indikace k chirurgické léčbě FS. Upraveno dle [8].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/47cefb837b1723be8d862a5be44f0c09.jpg)
Závěr
Selektivní katetrové ablace mají již dnes v léčbě FS své pevné místo. Řada prospektivních multicentrických studií potvrdila jejich superioritu nad léčbou antiarytmiky, ale mnoho pacientů musí tyto zákroky podstupovat opakovaně, což podtrhuje významné limitace této léčby. Kromě rekondukce předtím izolovaných plicních žil se objevují iatrogenní reentry síňové arytmie na podkladě nekompletních ablačních linií. V současné době také neumíme ablační léčbu „ušít na míru“ pro každého jednotlivého pacienta. Poznání individuální patofyziologie této arytmie dovolí v budoucnu cílenější aplikaci adekvátně umístěných ablačních lézí s výhledem vyšší úspěšnosti výkonů, zejm. u perzistující formy arytmie. Očekáváme také další technologický pokrok zobrazovacích systémů, které v brzké době umožní přesně měřit sílu kontaktu katetru s tkání, a docílit tak transmurálních a permanentních lézí.
Dosud není k dispozici důkaz o tom, že úspěšná ablace FS vede ke snížení mortality. V současné době probíhá prospektivní randomizovaná multicentrická studie, která by na tuto otázku měla odpovědět (Catheter ABlation versus ANtiarrhythmic drug therapy for Atrial fibrillation – CABANA). Lze předpokládat, že časná a úspěšná katetrová léčba FS v iniciálním paroxyzmálním stadiu je nejlepší strategií kontroly rytmu. Tato hypotéza je testována ve studii EAST (Early treatment of Atrial fibrillation for Stroke prevention Trial). Výsledky obou studií by měly být známy v roce 2015.
Doručeno do redakce 22. 6. 2011
Přijato po recenzi 8. 7. 2011
doc. MUDr. Mgr. Alan Bulava, Ph.D.
Kardiocentrum Nemocnice České Budějovice, a.s.
I. interní klinika – kardiologická FN Olomouc
Zdravotně sociální fakulta Jihočeské univerzity v Českých Budějovicích
alanbulava@seznam.cz
Sources
1. Haïssaguerre M, Marcus FI, Fischer B et al. Radiofrequency catheter ablation in unusual mechanisms of atrial fibrillation: report of three cases. J Cardiovasc Electrophysiol 1994; 5 : 743–751.
2. Schwartz JF, Pellersels G, Silvers J. A catheter-based curative approach to atrial fibrillation in humans. Circulation 1993; 90 : 335 (abstract).
3. Haïssaguerre M, Jaïs P, Shah DC et al. Right and left atrial radiofrequency catheter therapy of paroxysmal atrial fibrillation. J Cardiovasc Electrophysiol 1996; 7 : 1132–1144.
4. Haïssaguerre M, Jaïs P, Shah DC et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. N Engl J Med 1998; 339 : 659–666.
5. Haïssaguerre M, Jaïs P, Shah DC et al. Electrophysio-logical end point for catheter ablation of atrial fibrillation initiated from multiple pulmonary venous foci. Circulation 2000; 101 : 1409–1417.
6. Bulava A. Zobrazovací techniky a obrazová integrace v katétrové léčbě fibrilace síní – přehled problematiky a vlastní zkušenosti. Interv Akut Kardiol 2011; 10 : 114–120.
7. Kautzner J, Peichl P, Cihak R et al. Early experience with robotic navigation for catheter ablation of paroxysmal atrial fibrillation. Pacing Clin Electrophysiol 2009; 32 (Suppl 1): S163–S166.
8. European Heart Rhythm Association; European Association for Cardio-Thoracic Surgery. Camm AJ, Kirchhof P, Lip GY et al. Guidelines for the management of atrial fibrillation: the Task Force for the Management of Atrial Fibrillation of the European Society of Cardiology (ESC). Europace 2010; 12 : 1360–1420.
9. Čihák R, Fiala M, Haman L et al. Doporučené postupy u pacientů s fibrilací síní. Cor Vasa v tisku 2011.
10. O‘Neill MD, Jaïs P, Takahashi Y et al. The stepwise ablation approach for chronic atrial fibrillation – evidence for a cumulative effect. J Interv Card Electrophysiol 2006; 16 : 153–167.
11. Fiala M, Chovancik J, Wojnarova D et al. Characterization of residual coronary sinus-related tachycardia during ablation of longstanding persistent atrial fibrillation. Vnitr Lek 2011; 57 : 33–42.
12. European Heart Rhythm Association (EHRA); European Cardiac Arrhythmia Scoiety (ECAS); American College of Cardiology (ACC); American Heart Association (AHA); Society of Thoracic Surgeons (STS). Calkins H, Brugada J, Packer DL et al. HRS/EHRA//ECAS expert Consensus Statement on catheter and surgical ablation of atrial fibrillation: recommendations for personnel, policy, procedures and follow-up. A report of the Heart Rhythm Society (HRS) Task Force on catheter and surgical ablation of atrial fibrillation. Heart Rhythm 2007; 4 : 816–861.
13. Cappato R, Calkins H, Chen SA et al. Updated worldwide survey on the methods, efficacy, and safety of catheter ablation for human atrial fibrillation. Circ Arrhythm Electrophysiol 2010; 3 : 32–38.
14. Cappato R, Calkins H, Chen SA et al. Prevalence and causes of fatal outcome in catheter ablation of atrial fibrillation. J Am Coll Cardiol 2009; 53 : 1798–1803.
15. Bertaglia E, Tondo C, De Simone A et al. Does catheter ablation cure atrial fibrillation? Single-procedure outcome of drug-refractory atrial fibrillation ablation: a 6-year multicentre experience. Europace 2010; 12 : 181–187.
16. Weerasooriya R, Khairy P, Litalien J et al. Catheter ablation for atrial fibrillation: are results maintained at 5 years of follow-up? J Am Coll Cardiol 2011; 57 : 160–166.
17. Calkins H, Reynolds MR, Spector P et al. Treatment of atrial fibrillation with antiarrhythmic drugs or radiofrequency ablation: two systematic literature reviews and meta-analyses. Circ Arrhythm Electrophysiol 2009; 2 : 349–361.
18. Pappone C, Santinelli V, Manguso F et al. Pulmonary vein denervation enhances long-term benefit after circumferential ablation for paroxysmal atrial fibrillation. Circulation 2004; 109 : 327–334.
19. Nademanee K, McKenzie J, Kosar E et al. A new approach for catheter ablation of atrial fibrillation: mapping of the electrophysiologic substrate. J Am Coll Cardiol 2004; 43 : 2044–2053.
20. Oral H, Chugh A, Yoshida K et al. A randomized assessment of the incremental role of ablation of complex fractionated atrial electrograms after antral pulmonary vein isolation for long-lasting persistent atrial fibrillation. J Am Coll Cardiol 2009; 53 : 782–789.
21. Bulava A, Hanis J, Sitek D et al. Catheter ablation for paroxysmal atrial fibrillation: a randomized comparison between multielectrode catheter and point-by-point ablation. Pacing Clin Electrophysiol 2010; 33 : 1039–1046.
22. Boersma LV, Wijffels MC, Oral H et al. Pulmonary vein isolation by duty-cycled bipolar and unipolar radiofrequency energy with a multielectrode ablation catheter. Heart Rhythm 2008; 5 : 1635–1642.
23. Cox JL, Schuessler RB, Lappas DG et al. An 8 1/2-year clinical experience with surgery for atrial fibrillation. Ann Surg 1996; 224 : 267–273.
24. Moe GK, Abildskov JA. Atrial fibrillation as a self-sustaining arrhythmia independent of focal discharge. Am Heart J 1959; 58 : 59–70.
25. Pagé P. CCS Atrial Fibrillation Guidelines Committee. Canadian Cardiovascular Society atrial fibrillation guidelines 2010: surgical therapy. Can J Cardiol 2011; 27 : 67–73.
Labels
Paediatric cardiology Internal medicine Cardiac surgery CardiologyArticle was published in
Cardiology Review

2011 Issue 3
-
All articles in this issue
- Antiarytmická léčba z pohledu nových doporučení pro léčbu nemocných s fibrilací síní
- Nefarmakologická léčba z pohledu nových doporučení pro léčbu nemocných s fibrilací síní
- Antitrombotická léčba z pohledu nových doporučení pro léčbu nemocných s fibrilací síní
- Upstream terapie u fibrilace síní
- Home monitoring nemocných s fibrilacemi síní
- Home monitoring a implantáty
- Telemonitoring krevního tlaku u nemocných s arteriální hypertenzí
- Chronické srdeční selhání u ženy středního věku při nonkompaktní kardiomyopatii
- Cardiology Review
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Antiarytmická léčba z pohledu nových doporučení pro léčbu nemocných s fibrilací síní
- Chronické srdeční selhání u ženy středního věku při nonkompaktní kardiomyopatii
- Antitrombotická léčba z pohledu nových doporučení pro léčbu nemocných s fibrilací síní
- Home monitoring a implantáty
