Těhotenství u pacientek s chlopenními náhradami
Pregnancy in patients with valvular prosthesis
Pregnancy in women with a mechanical heart prosthesis represents increased risk both for the mother and for the child. In mechanical heart valves, low molecular weight heparin does not provide sufficient protection from thromboembolic complications. From this point of view warfarin is safer; it should not, however, be given between the sixth and 12th week of pregnancy due to the risk of embryopathy, especially if the dose exceeds 5 mg. If warfarin is given during labour, a Caesarean section should be performed. There is a risk of intracranial haemorrhage in the foetus. Vaginal delivery is preferable if the mother is in a good clinical condition with good function of the prosthesis and heart and if she is treated with heparin during labour. The article gives a detailed overview of the current guidelines for anticoagulation treatment during pregnancy and delivery in women with a mechanical heart valve. Another and a significantly better option for girls and women during their fertile years are valve-sparing operations, Ross’ operation or implantation of a bioprosthesis. These possibilities should be always carefully considered, even when they carry the risk of reoperation in the future. The elective reoperation does not carry higher risk than the first operation when performed by an experienced team.
Keywords:
pregnancy – mechanical heart prosthesis – thrombosis – anticoagulation – delivery
Authors:
J. Popelová
Authors‘ workplace:
Nemocnice Na Homolce, Praha
; Centrum pro vrozené srdeční vady
v dospělosti, Kardiochirurgické oddělení
Published in:
Kardiol Rev Int Med 2013, 15(3): 153-158
Category:
Overview
Těhotenství žen s mechanickou chlopenní náhradou představuje zvýšené riziko pro matku i plod. Nízkomolekulární heparin neposkytuje dostatečnou ochranu před tromboembolickými komplikacemi u mechanických srdečních náhrad. Warfarin je z tohoto hlediska bezpečnější, avšak s ohledem na možný vznik embryopatií by neměl být podáván mezi 6. a 12. týdnem gravidity, zvláště pokud jeho denní dávka převyšuje 5 mg. Porod císařským řezem je nutný v případě, že je žena v době porodu léčena warfarinem, kdy hrozí riziko intrakraniálního krvácení plodu. Je‑li žena před porodem v dobrém klinickém stavu, má‑li dobrou funkci chlopenní protézy i srdečních komor a je převedena na léčbu heparinem, je doporučován vaginální porod. Článek podává podrobný přehled současných doporučení antikoagulační léčby v těhotenství a v období kolem porodu u žen s mechanickou srdeční chlopní. Alternativou mechanických protéz jsou záchovné operace chlopní, Rossova operace nebo implantace bioprotéz. Tyto možnosti by měly být u dívek a žen ve fertilním věku vždy zváženy, i když s sebou nesou riziko reoperace v budoucnosti. Elektivní reoperace však nemá na zkušeném pracovišti zvýšené riziko oproti primooperaci.
Klíčová slova:
těhotenství – mechanická chlopenní náhrada – trombóza – antikoagulace – porod
Úvod
Těhotenství představuje hyperkoagulační stav se zvýšeným rizikem tromboembolických komplikací. V roce 2011 byla publikována Doporučení Evropské kardiologické společnosti pro kardiovaskulární choroby v těhotenství [1]. Rizikovost těhotenství pro ženy s kardiovaskulárním onemocněním je dělena do čtyř tříd (podle světové zdravotnické organizace – World Health Organization – WHO). Třída I nemá v těhotenství zvýšené riziko, třída II představuje mírně zvýšené riziko, třída III má významně zvýšené riziko a třída IV znamená vysoké riziko, které kontraindikuje těhotenství. Mechanické chlopenní protézy jsou řazeny do třídy III. Také ve studii „Zahara“ představovaly mechanické protézy jeden z osmi vysoce rizikových faktorů kardiovaskulárních příhod v těhotenství [2]. V naší retrospektivní multicentrické studii jsme prokázali některou z kardiovaskulárních komplikací (trombóza protézy, cévní mozková příhoda, nutnost kardiochirurgického výkonu v graviditě, krvácení vyžadující transfuzi nebo revizi) až u 65 % těhotenství s mechanickou protézou [3].
Rizikové faktory novorozeneckých komplikací ze strany matky jsou: NYHA III a IV, cyanóza, kouření, obstruktivní vady levého srdce, mnohočetné těhotenství a také mechanické srdeční protézy a perorální antikoagulační léčba [1,4 – 6].
Těhotenství žen s mechanickou chlopenní náhradou je tedy možné, ale se zvýšeným rizikem pro matku i plod a s nutností velmi pečlivého kardiologického i gynekologického sledování. Riziko spočívá na jedné straně v tromboembolických komplikacích matky, na druhé straně v riziku embryopatie při perorální antikoagulační léčbě. Mohou se vyskytnout i krvácivé komplikace, méně častá je protézová endokarditida. Těhotenství s biologickou chlopenní náhradou je méně rizikové, není však jasné, zda dochází k akceleraci degenerativních změn na bioprotéze v těhotenství.
Proč mají mladé ženy mechanickou chlopenní náhradu?
Hlavním důvodem pro implantaci mechanické chlopenní náhrady v mladém věku jsou v současnosti v rozvinutých zemích vrozené srdeční vady a infekční endokarditida. Ta často vzniká právě na vrozeně abnormálních chlopních (např. bikuspidální chlopeň aorty a prolaps mitrální chlopně). Při operacích vrozených srdečních vad je zvláště u dívek vždy maximální snaha vyhnout se mechanické náhradě. V některých případech to však není možné.
Porevmatické chlopenní vady se v naší populaci mladých žen již prakticky nevyskytují, můžeme se s nimi však setkat u žen z jiných geografických oblastí.
Mitrální chlopeň
Častou abnormalitou mitrální chlopně je myxomatózní degenerace (morbus Barlow), která může být dědičná a může se vyskytnout i u mladých žen. V rukou zkušeného kardiochirurga lze tuto vadu téměř vždy korigovat plastikou bez nutnosti mechanické náhrady.
Vrozené postižení mitrální chlopně je nejčastější u inkompletního defektu atrioventrikulárního septa (defektu septa síní typu primum) s rozštěpem předního cípu mitrální chlopně. Mitrální regurgitace bývá řešena suturou rozštěpu, v dospělosti může být doplněna o anuloplastiku. V některých případech však může být morfologie mitrální chlopně velmi abnormální, se zkráceným a abnormálním závěsným aparátem i abnormálními cípy a může být přítomna závažná reziduální regurgitace (méně často stenóza) i po provedené sutuře rozštěpu. Implantace protézy může být potom nezbytná.
Vzácnou vrozenou stenózu mitrální chlopně (padákovitá – parachute mitrální chlopeň) většinou nelze řešit plastikou, ale je nutná chlopenní náhrada.
Morfologicky trikuspidální chlopeň je ve funkci mitrální chlopně ve vysokotlakém řečišti v systémové pravé komoře u vrozeně korigované transpozice velkých tepen nebo po Mustardově či Senningově korekci d ‑ transpozice velkých tepen. Plastiky těchto chlopní nemají dlouhodobě dobré výsledky při přetrvávající dysfunkci a dilataci systémové pravé komory. Při těžké regurgitaci na těchto chlopních bývá nutná mechanická náhrada.
Aortální chlopeň
Nejčastější vrozenou abnormalitou je bikuspidální chlopeň aorty (u 1 – 2 % běžné populace), vzácná je unikuspidální chlopeň. Aortální chlopeň může být dysplastická a stenotická již od dětského věku nebo může degenerovat až později v dospělosti. Aortální stenóza je v dětství většinou řešena balonkovou valvuloplastikou. Při těžkých degenerativních změnách, zkrácených cípech a kalcifikacích na chlopni již nemusí být chirurgická plastika možná. U méně pokročilých degenerativních změn s prolapsem či perforací cípu lze provést úspěšnou chirurgickou plastiku (rekonstrukci) s dobrým výsledkem, zvláště u aortálních regurgitací.
Shonův syndrom znamená sérii obstrukčních vad (mitrální stenóza, subvalvární a valvární aortální stenóza a koarktace aorty), chirurgické řešení musí být komplexní, není jednoduché a tito pacienti mohou mít v dospělosti současně mitrální i aortální mechanickou náhradu.
Trikuspidální chlopeň
Nejčastější vrozenou vadou trikuspidální chlopně je Ebsteinova anomálie. Asi polovinu těchto těžce abnormálních chlopní lze plastikovat, v opačném případě volíme biologickou náhradu. Mechanickou náhradu do trikuspidální pozice pokud možno neimplantujeme pro velmi vysoké riziko trombózy.
Pulmonální chlopeň
Izolovaná pulmonální stenóza bývá řešena v dětství katetrizační balonkovou valvuloplastikou, kterou je možno provést u jemné chlopně i v dospělosti. Pokud je chlopeň těžce dysplastická a kalcifikovaná, je nutná implantace bioprotézy.
Pulmonální stenóza u Fallotovy tetralogie je řešena chirurgickou resekcí subvalvární stenózy, valvulotomií, někdy i excizí pulmonální chlopně. Po těchto výkonech bývá v dospělosti častá těžká pulmonální regurgitace, která je řešena většinou implantací bioprotézy nebo homograftu. Mechanické protézy jsou do pulmonální pozice implantovány vzácně.
Jaké je reálné riziko komplikací při těhotenství s mechanickou protézou?
Riziko trombózy mechanické chlopně
Trombóza mechanické chlopně s sebou nese jednak riziko systémové embolizace, zvláště pak embolizace do mozkových tepen s následnou cévní mozkovou příhodou, nebo riziko dysfunkce protézy s akutním srdečním selháním s nutností urgentního kardiochirurgického výkonu nebo trombolýzy v těhotenství (obr. 1).
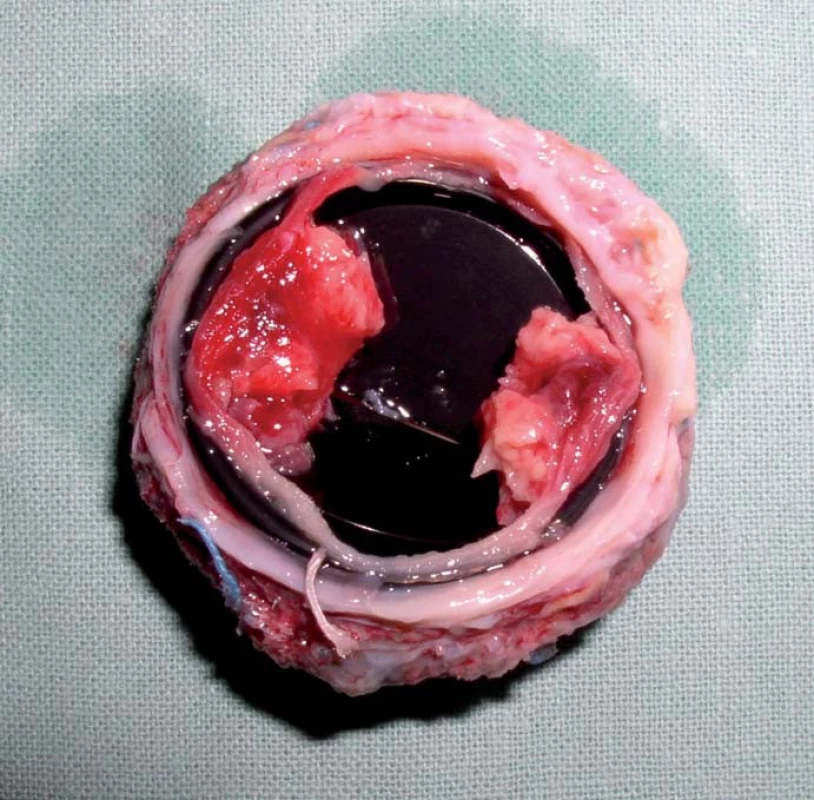
Nízkomolekulární heparin (LMWH) je v těhotenství lékem volby při prevenci a léčbě žilních trombóz. U mechanických chlopní však LMWH na rozdíl od warfarinu neposkytuje v těhotenství dostatečnou ochranu před tromboembolickýcmi komplikacemi. Stejně tak u nefrakcionovaného heparinu (UFH) byl popsán vyšší počet tromboembolických komplikací, zvláště pokud nebyla kontrolována jeho účinnost pomocí aPTT. Kromě toho je zde riziko osteoporózy a trombocytopenie.
V naší nedávno publikované retrospektivní multicentrické studii jsme u 23 těhotenství s mechanickou protézou zaznamenali tři cévní mozkové příhody následkem embolizace při trombóze protézy a tři urgentní kardiochirurgické výkony pro srdeční selhání při trombóze chlopně [3]. Trombóza mechanické chlopně se v našem souboru vyskytla v 26 %, ve všech případech u žen léčených LMWH. Jednalo se o moderní dvoulistové protézy, v jednom případě o diskovou protézu. Trombózy vznikly většinou při nedostatečné kontrole antiXa, v jednom případě však i při účinné hladině antiXa. U žen léčených warfarinem nebyl ani jeden případ trombózy chlopně. Mateřská mortalita byla v našem souboru nulová.
Chan et al udávají ve své rozsáhlé metaanalýze 1 234 těhotenství s mechanickými protézami 33 % tromboembolických komplikací při užití samotného heparinu, 9,2 % při podání warfarinu od 13. týdne a 3,9 % při užití warfarinu po celou dobu těhotenství. Mateřská mortalita byla nejvyšší ve skupině s heparinem (15 %), nižší při podání warfarinu od 13. týdne (4,2 %) a nejnižší při podání warfarinu po celé těhotenství (1,8 %) [7]. Nutno podotknout, že v této studii bylo vyšší zastoupení starších typů protéz a účinnost heparinu nebyla vždy kontrolována, u některých pacientek byly podávány nízké fixní dávky.
V nedávno publikované analýze ROPAC (Registry on pregnancy and structural heart disease) Evropské kardiologické společnosti byla popsána trombóza mechanických chlopní v 6 % (3 z 52) bez bližších údajů o léčbě [8].
V recentních studiích hodnotících LMWH (enoxaparin a dalteparin) v těhotenství byl výskyt tromboembolických komplikací u pacientek léčených LMWH 14,9 % a 16,7 %, většinou v souvislosti s nedostatečnou hladinou antiXa, ale v některých případech i při účinné hladině antiXa. Ve skupině léčených warfarinem se tromboembolické komplikace nevyskytly [9,10]. Většina autorů (včetně autorů současných guidelines) se shoduje na tom, že nízkomolekulární heparin neposkytuje na rozdíl od warfarinu v těhotenství u mechanických chlopní dostatečnou ochranu před tromboembolickými komplikacemi. Přehled počtu tromboembolických komplikací u mechanických chlopní v různých studiích podává tab. 1 [3,7,9 – 14].
Riziko krvácení
Všechny antikoagulační režimy mají zvýšené riziko potratu a hemoragických komplikací včetně retroplacentárního krvácení vedoucího k předčasnému porodu nebo úmrtí plodu [1].
Odhadované riziko většího krvácení u antikoagulovaných pacientek je udáváno kolem 17 % před porodem a 19 % po porodu [9]. V naší studii se krvácení vyskytlo celkem ve 30 % těhotenství, bez rozdílu mezi pacientkami léčenými warfarinem a LMWH [3]. Krvácení se vyskytlo u pacientek s adekvátní antikoagulací (u warfarinu při INR 2,9 a 3,3 u starší mechanické mitrální chlopně a u LMWH při antiXa 0,78 – 0,8 IU/ ml). Krvácení se vyskytlo také u obou pacientek, kterým jsme k LMWH přidali nízkou dávku kyseliny acetylsalicylové (ASA).
Při urgentním neplánovaném porodu u ženy s plnou antikoagulační léčbou je vysoké riziko krvácení. Příslušná opatření jsou uvedena níže.
Riziko postižení plodu
Obecně se novorozenecké komplikace vyskytují u dětí žen s kardiovaskulárním postižením ve 20 – 28 %, s novorozeneckou mortalitou mezi 1 a 4 % [1,2,4 – 6].
Někteří autoři udávají vyšší riziko úmrtí plodu při léčbě warfarinem, což jsme v naší studii při malém počtu pacientek nepotvrdili. Celkový počet abortů a úmrtí plodu byl v naší studii 26 %, bez rozdílu mezi skupinou léčenou warfarinem a LMWH [3]. Ve studii McLintocka [9] byla ztráta plodu včetně předčasného ukončení těhotenství pro fetální hydrocefalus ve 30 % (4/ 13) těhotenství s warfarinem. Někteří autoři starších studií udávají i vyšší procenta ztráty plodu při užívání warfarinu, není však jasné, zda bylo dobře kontrolováno INR [15,16]. Kromě toho měly tyto ženy často pokročilou chlopenní vadu s plicní hypertenzí, trikuspidální regurgitací a s nutností podání diuretik, což byl významný rizikový faktor pro úmrtí plodu [15]. Nebyl prokázán rozdíl mezi počtem zdravých novorozenců mezi skupinou léčenou warfarinem (53 %) a heparinem (57 %); p = NS [15].
Při léčbě heparinem a LMWH jsou častější potraty v prvním trimestru, u warfarinu jsou častější úmrtí plodu ve 2. a 3. trimestru. Při vaginálním porodu při plné antikoagulaci je riziko intrakraniálního krvácení plodu, proto je nutný porod sekcí (viz níže).
Warfarin prochází placentární bariérou. Při jeho užívání v prvním trimestru je riziko embryopatie 0,6 – 10 % v závislosti na dávce [7,17 – 20]. Riziko embryopatie při podávání warfarinu v prvním trimestru bylo 2,6 % při denní dávce warfarinu menší než 5 mg a 8 % při dávce nad 5 mg [21]. Závažné abnormality CNS se vyskytují v 1 % při užívání warfarinu v prvním trimestru. V dalším průběhu těhotenství je menší riziko méně závažných abnormalit CNS [19]. Ke kumarinové embryopatii patří i nazální hypoplazie.
Nízkomolekulární heparin (LMWH) a ne-frakcionovaný heparin (UFH) neprocházejí placentou a nezpůsobují embryopatie. Plod však může být postižen sekundárně, pokud se matka dostane do závažného stavu následkem trombózy mechanické protézy.
Jak postupovat u žen s mechanickou protézou v těhotenství [1,9]
- Perorální antikoagulační léčba by měla pokračovat až do potvrzení těhotenství, jsou nutné časté těhotenské testy.
- Je‑li užívaná dávka warfarinu menší než 5 mg, lze zvážit pokračování této léčby po dobu celého těhotenství s kontrolami INR jednou týdně.
- Je‑li užívaná dávka warfarinu větší než 5 mg nebo matka neakceptuje malé riziko embryopatie (menší než 3 %), je warfarin mezi 6. a 12. týdnem těhotenství nahrazen UFH nebo LMWH. Je nutná pečlivá kontrola účinnosti jednou týdně (aPTT 2 – 3 u UFH a antiXa 0,8 – 1,2 IU/ ml u LMWH za 4 – 6 hod po aplikaci LMWH) s případnou úpravou dávky. Někteří autoři navrhují kontrolu účinnosti LMWH i před aplikací následující dávky (pre‑dose level) s doporučenou hodnotou 0,6 IU/ ml, avšak pro toto doporučení není dostatek podkladů.
- Od 13. do 34. – 36. týdne gravidity lze podávat warfarin s kontrolami INR jednou týdně.
Plánovaný porod
- Vzhledem k riziku fetálního krvácení by měl být warfarin vysazen 2 – 4 týdny před plánovaným porodem a nahrazen UFH nebo LMWH (od 34. – 36. týdne těhotenství).
- Užívá‑li žena antiagregační léčbu, měla by být vysazena 1 – 2 týdny před porodem.
- Vaginální porod je doporučen u žen, které jsou převedeny na LMWH nebo heparin a mají dobrou funkci chlopenní protézy, ostatních chlopní i srdečních komor a nemají dilataci aorty.
- Porod císařským řezem může být zvážen u pacientek s vysokým rizikem chlopenní trombózy tak, aby doba vysazení warfarinu byla co nejkratší.
- 36 hod před indukcí porodu nebo před sekcí by měly být ženy z LMWH převedeny na intravenózní kontinuální infuzi s nefrakcionovaným heparinem (1 250 IU/ hod) s cílovým aPTT 2 – 3.
- Tato infuze by měla být přerušena 4 – 6 hod před porodem. Před zavedením epidurálního katetru by mělo být aPTT v normě.
- Po porodu je opětně zavedena infuze nefrakcionovaného heparinu (500 IU/ hod) za 4 – 6 hod po vaginálním porodu, pokud nemá žena krvácivé komplikace, a za 6 – 12 hod po porodu sekcí s postupným zvýšením dávky k dosažení aPTT 2 – 3.
- Po nekomplikovaném vaginálním porodu lze začít podávat warfarin za jeden den, po sekci nebo při krvácivých komplikacích za 2 – 3 dny. Heparin se vysazuje až po dosažení INR 2.
Neplánovaný předčasný porod
- Při užívání warfarinu v době porodu je vaginální porod kontraindikován pro riziko intrakraniálního fetálního krvácení a je nutný porod císařským řezem.
- Při neplánovaném urgentním porodu pacientky užívající warfarin by měla být podána čerstvá mražená plazma, případně i malá perorální dávka vitaminu K (0,5 – 1 mg) tak, aby bylo INR < 2, porod je veden císařským řezem.
- Novorozenec matky, která užívala do porodu warfarin, by měl dostat čerstvou mraženou plazmu a vitamin K, antikoagulační efekt warfarinu může u novorozence přetrvávat 8 – 10 dnů.
- V případě emergentního porodu pacientky léčené LMWH nebo UFH by měl být podán protamin. U LMWH je jeho efekt jen částečný.
- Dojde‑li k srdečnímu selhání při trombóze chlopně vyžadujícím operaci matky v mimotělním oběhu, lze při gestačním stáří plodu od 28. týdne (výjimečně od 26. týdne) provést císařský řez na kardiochirurgickém sále před kardiochirurgickým výkonem.
Kojení
Heparin, LMWH ani warfarin nepřecházejí do mateřského mléka a mohou být podávány kojící matce bez antikoagulačního efektu pro kojence.
Poznámky
- Nefrakcionovaný heparin neprochází placentární bariérou a je asociován s častějším výskytem trombocytopenie a osteoporózy než LMWH. Subkutánně musí být podáván častěji než LMWH. Je upřednostňován při nutnosti rychlého zrušení účinku pomocí protaminu a u pacientů s renální insuficiencí.
- LMWH – žádný z nízkomolekulárních heparinů není oficiálně schválen pro použití u těhotných žen s mechanickými protézami. Fondaparinux prochází v malé míře placentární bariérou.
- Nová perorální antikoagulancia (např. dabigatran) nejsou schválena pro léčbu mechanických protéz ani mimo těhotenství. Rivaroxaban prochází placentární bariérou a není v těhotenství doporučován.
Jaké jsou alternativní možnosti řešení chlopenní vady u mladých žen?
U žen, které plánují těhotenství a mají těžkou symptomatickou aortální vadu, zvažujeme jinou alternativu, než je mechanická protéza. Ve vhodných případech lze provést plastiku chlopně (záchovnou operaci), lze zvážit Rossovu operaci (implantace vlastní pulmonální chlopně do aortální pozice a homograftu do pulmonální pozice) nebo i implantaci moderní bioprotézy. Plánovaná gravidita je podle současných guidelines indikací ve třídě IIa pro implantaci bioprotézy [22]. U bioprotézy i Rossovy operace je velká pravděpodobnost reoperace v budoucnosti. Reoperace však nemusí mít větší riziko než primooperace a může k ní dojít až v odstupu 10 – 15 let nebo i později.
U mitrálních regurgitací zvažujeme možnost těhotenství s touto vadou, pokud je zachována dobrá funkce nedilatované levé komory, není‑li přítomna plicní hypertenze a je‑li žena ve funkční třídě I – II s příznivým výsledkem zátěžového testu. Jinak preferujeme plastiku i za cenu menší reziduální regurgitace. Bioprotézu pro riziko časné degenerace v mitrální pozici většinou neimplantujeme.
U mitrálních stenóz, zvláště porevmatických, zvažujeme balonkovou valvuloplastiku.
Bioprotézy v těhotenství
Ve věku do 30 let je popsána strukturální degenerace bioprotéz asi u 50 % pacientů za deset let po implantaci, významnější a rychlejší je degenerace u bioprotéz v mitrální než v aortální pozici.
Na to, zda těhotenství urychluje degeneraci bioprotézy, nejsou jednotné názory [1,12,16, 23,24]. Degenerace byla popsána v těhotenství u 10 % starších mitrálních bioprotéz [16]. V prospektivní pětileté studii 85 žen s perikardiálními biologickými protézami došlo ke strukturální degeneraci, trombóze nebo infekční endokarditidě u 27 % žen, které byly těhotné v průběhu sledování, a u 29 % žen, které nebyly těhotné (p = 0,64); nebyl tedy prokázán vliv těhotenství na urychlení degenerace perikardiálních bioprotéz [24].
Závěr
Těhotenství s mechanickou protézou je rizikové, ale toto riziko lze vhodným postupem snížit. V prvním trimestru je obvykle podáván LMWH dvakrát denně s pečlivými týdenními kontrolami antiXa s cílovou hodnotou 0,8 – 1,2 IU/ ml. Alternativou je podání warfarinu i v prvním trimestru, je‑li jeho denní dávka menší než 5 mg. Ve druhém a třetím trimestru lze do 36. týdne těhotenství podávat warfarin s kontrolami INR. Dva týdny před porodem lze doporučit přechod na LMWH a těsně před porodem nefrakcionovaný heparin v i.v. infuzi s kontrolami aPTT. Po porodu je možné podávat warfarin od prvního dne po vaginálním porodu a od třetího dne po porodu sekcí, nemá-li matka krvácivé komplikace. Warfarin lze podávat i při kojení.
Pokud je to možné, volíme u žen ve fertilním věku, které plánují těhotenství, jinou alternativu než mechanickou chlopenní protézu. Těhotenství s bioprotézou, homograftem nebo po úspěšné plastice chlopně či Rossově operaci nemá významně zvýšené riziko, antikoagulace není nutná. Pokud je podávána acetylsalicylová kyselina v nízké dávce, je vhodné ji vysadit 7 – 14 dnů před plánovaným porodem. Ve všech těchto případech je však vysoká pravděpodobnost až jistota reoperace v budoucnosti.
Ženu s chlopenní vadou je nutné včas podrobně informovat o všech rizicích, výhodách a nevýhodách jednotlivých postupů (tab. 2). Při vysokém riziku lze místo těhotenství zvážit i adopci.
![Rizika antikoagulační léčby mechanických protéz v těhotenství – upraveno podle [1,3,7,9–12,15,16,25,26].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/4589a3576dccf582aa02f2bd3cb3c8fc.png)
Doručeno do redakce: 5. 7. 2013
Přijato po recenzi: 26. 7. 2013
doc. MUDr. Jana Popelová, CSc.
Centrum pro vrozené srdeční vady
v dospělosti, Kardiochirurgické oddělení,
Nemocnice Na Homolce, Praha
a Dětské kardiocentrum, FN v Motole, Praha
jana.popelova@homolka.cz
Sources
1. Regitz ‑ Zagrosek V, Lundqvist CB, Borghi C et al. ESC Guidelines on the management of cardiovascular diseases during pregnancy: the Task Force on the Management of Cardiovascular Diseases during Pregnancy of the European Society of Cardiology (ESC). Eur Heart J 2011; 32 : 3147 – 3197.
2. Drenthen W, Boersma E, Balci A et al. Predictors of pregnancy complications in women with congenital heart disease. Eur Heart J 2010; 31 : 2124 – 2132.
3. Popelová J, Zatočil T, Vavera Z et al. Mechanical heart valve prosthesis in pregnancy – multicenter retrospective observational study. Cor Vasa 2012; 54 : 217 – 222.
4. Siu SC, Sermer M, Colman JM et al. Prospective multicenter study of pregnancy outcomes in women with heart disease. Circulation 2001; 104 : 515 – 521.
5. Khairy P, Ouyang DW, Fernandes SM et al. Pregnancy outcomes in women with congenital heart disease. Circulation 2006; 113 : 517 – 524.
6. Siu SC, Colman JM, Sorensen S et al. Adverse neonatal and cardiac outcomes are more common in pregnant women with cardiac disease. Circulation 2002; 105 : 2179 – 2184.
7. Chan WS, Anand S, Ginsberg JS. Anticoagulation of pregnant women with mechanical heart valves: a systematic review of the literature. Arch Intern Med 2000; 160 : 191 – 196.
8. Roos ‑ Hesselink JW, Ruys TP, Stein JI et al. Outcome of pregnancy in patients with structural or ischaemic heart disease: results of a registry of the European Society of Cardiology. Eur Heart J 2013; 34 : 657 – 665.
9. McLintock C, McCowan LM, North RA. Maternal complications and pregnancy outcome in women with mechanical prosthetic heart valves treated with enoxaparin. BJOG 2009; 116 : 1585 – 1592.
10. Abildgaard U, Sandset PM, Hammerstrom J et al.Management of pregnant women with mechanical heart valve prosthesis: thromboprophylaxis with low molecular weight heparin. Thromb Res 2009; 124 : 262 – 267.
11. Yinon Y, Siu SC, Warshafsky C et al. Use of low molecular weight heparin in pregnant women with mechanical heart valves. Am J Cardiol 2009; 104 : 1259 – 1263.
12. Elkayam U, Bitar F. Valvular heart disease and pregnancy: part II: prosthetic valves. J Am Coll Cardiol 2005; 46 : 403 – 410.
13. Oran B, Lee ‑ Parritz A, Ansell J. Low molecular weight heparin for the prophylaxis of thromboembolism in women with prosthetic mechanical heart valves during pregnancy. Thromb Haemost 2004; 92 : 747 – 751.
14. Menschengieser SS, Fondevila CG, Santarelli MT et al. Anticoagulation in pregnant women with mechanical heart valve prostheses. Heart 1999; 82 : 23 – 26.
15. Ashour ZA, Shawky HA, Hassan Hussein M. Outcome of pregnancy in women with mechanical valves. Tex Heart Inst J 2000; 27 : 240 – 245.
16. Sadler I, McCowan L, White H et al. Pregnancy outcomes and cardiac complications in women with mechanical, bioprosthetic and homograft valves. BJOG 2000; 107 : 245 – 253.
17. Schaefer C, Hannemann D, Meister R et al. Vitamin K antagonists and pregnancy outcome. A multi‑centre prospective study. Thromb Haemost 2006; 95 : 949 – 957.
18. Vitale N, De Feo M, De Santo LS et al. Dose‑dependent fetal complications of warfarin in pregnant women with mechanical heart valves. J Am Coll Cardiol 1999; 33 : 1637 – 1641.
19. van Driel D, Wesseling J, Sauer PJ et al. Teratogen update: fetal effects after in utero exposure to coumarins overview of cases, follow‑up findings, and pathogenesis. Teratology 2002; 66 : 127 – 140.
20. Sillesen M, Hjortdal V, Vejlstrup N et al. Pregnancy with prosthetic heart valves – 30 years’ nationwide experience in Denmark. Eur J Cardiothorac Surg 2011; 40 : 448 – 454.
21. Cotrufo M, De Feo M, De Santo LS et al. Risk of warfarin during pregnancy with mechanical valve prostheses. Obstet Gynecol 2002; 99 : 35 – 40.
22. Vahanian A, Alfieri O, Andreotti F et al. Guidelines on the management of valvular heart disease (version 2012). Eur Heart J 2012; 33 : 2451 – 2496.
23. North RA, Sadler L, Stewart AW et al. Long‑term survival and valve‑related complications in young women with cardiac valve replacements. Circulation 1999; 99 : 2669 – 2676.
24. Avila WS, Rossi EG, Grinberg M et al. Influence of pregnancy after bioprosthetic valve replacement in young women: a prospective five‑year study. J Heart Valve Dis 2002; 11 : 864 – 869.
25. Bates SM, Greer IA, Hirsh J et al. Use of antithrombotic agents during pregnancy: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy. Chest 2004; 126 (Suppl 3): 627 – 644.
26. Abbas AE, Lester SJ, Connolly H. Pregnancy and the cardiovascular system. Int J Cardiol 2005; 98 : 179 – 189.
Labels
Paediatric cardiology Internal medicine Cardiac surgery CardiologyArticle was published in
Cardiology Review

2013 Issue 3
-
All articles in this issue
- Katetrizační implantace aortální chlopně (TAVI) – současnost a novinky v roce 2013
- Těhotenství u pacientek s chlopenními náhradami
- Těhotenství u pacientek s vrozenými srdečními vadami
- Extrasystoly – Arytmie a možnosti léčby v kontextu chlopenních vad
- Několik poznámek k historii kardiochirurgie
- Levosimendan a renální funkce
- Vybrané aspekty filozofie kardiologické péče
- Diagnostika aortální stenózy
- Nové směry v chirurgické léčbě aortální stenózy
- Vztah vlny L transmitrálního průtoku a vlny L’ pohybu mitrálního anulu k tlaku v zaklínění v plicnici u pacientů s dilatační kardiomyopatií
- Cardiology Review
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Diagnostika aortální stenózy
- Extrasystoly – Arytmie a možnosti léčby v kontextu chlopenních vad
- Katetrizační implantace aortální chlopně (TAVI) – současnost a novinky v roce 2013
- Několik poznámek k historii kardiochirurgie
