Monoklonální protilátky proti PCSK9 v léčbě dyslipidemií
Monoclonal PCSK9 antibodies in the treatment of dyslipidemias
The use of targeted therapy with monoclonal antibodies is not yet the standard care in cardiology. However, this approach seems feasible for a number of reasons (e. g. high therapeutic efficacy, lower potential for drug‑drug interactions, the possibility of alternate dosing). The identification of a novel protein (proprotein convertase subtilisin/ kexin 9 – PCSK9) grossly impacting on serum LDL‑cholesterol levels led to the preparation of specific monoclonal antibodies blocking its function. This interaction results in a dramatic decrease of LDL‑cholesterol (and other atherogenic lipoproteins) in the serum by 50– 70% above the level achievable by currently available therapies. The safety and efficacy of PCSK9 inhibitors is being tested in a large research program of several manufacturers. This new therapeutic option may offer hope for difficult‑ to‑ treat patients with familial hypercholesterolemia or statin intolerance, and, in the future, possibly also for patients at high cardiovascular risk not achieving LDL‑cholesterol targets with currently available therapies.
Keywords:
cardiovascular risk – LDL‑cholesterol – lipid lowering drugs – PCSK9 – monoclonal antibodies
Authors:
M. Vráblík
Authors‘ workplace:
Centrum preventivní kardiologie, 3. interní klinika 1. LF UK a VFN v Praze
Published in:
Kardiol Rev Int Med 2014, 16(6): 485-488
Category:
Cardiology Review
Overview
Využití cílené terapie pomocí monoklonálních protilátek zatím v kardiologii není běžné. Přesto se tento koncept jeví jako výhodný z řady důvodů (vysoká efektivita terapie, menší riziko lékových interakcí, možnost alternativního dávkování apod.). Identifikace nového proteinu (proprotein‑subtilisin kexin konvertázy 9,PCSK9) s významným vlivem na hladiny sérového LDL cholesterolu vyústila v přípravu specifických monoklonálních protilátek blokujících tento protein. Výsledkem této interakce je dramatické snížení LDL cholesterolu (i dalších aterogenních lipidů) v séru o 50– 70 % nad rámec dosažitelný ostatními dostupnými terapiemi. Bezpečnost a účinnost inhibitorů PCSK9 je testována v rozsáhlém výzkumném programu několika výrobců. Tato nová terapeutická možnost představuje naději pro obtížně léčitelné nemocné s familiární hypercholesterolemií nebo intolerancí statinů a do budoucna možná i pro další pacienty s velmi vysokým a vysokým kardiovaskulárním rizikem nedosahující cílových hodnot LDL cholesterolu běžnými postupy.
Klíčová slova:
kardiovaskulární riziko – LDL cholesterol – hypolipidemika – PCKS9 – monoklonální protilátky
Ovlivnění metabolizmu plazmatických lipoproteinových částic představuje jednu z hlavních možností zpomalení průběhu aterosklerózy a snížení rizika jejích komplikací. Zejména historie snižování hladin LDL cholesterolu (LDL‑c) pomocí statinů dokumentovaná stovkami studií nenechává snad nikoho na pochybách, že je tato strategie ovlivnění rizika aterotrombotických cévních příhod účinná. Na druhé straně v několika posledních letech byla řada pokusů o zlepšení prognózy nemocných další modifikací lipoproteinového metabolizmu nad rámec možností monoterapie statinem často neúspěšná. Vzpomeňme studie s niacinem, inhibitory cholesteryl‑ ester transferázového proteinu, mimetiky apolipoproteinu A1 – v žádné z nich nebyl prokázán další přínos nových terapií ve srovnání s léčbou statinem samotným [1]. Společným jmenovatelem uvedených neúspěšných studií s lipidy modifikujícími látkami bylo zaměření na jiné složky dyslipidemie než na LDL‑c. Na druhé straně, vývoj zaměřený na hledání způsobů, jak snížit koncentrace LDL‑c nad rámec dosažitelný současnými možnostmi, vypadá mnohem nadějněji. Pro terapii homozygotní formy familiární hypercholesterolemie tak byly schváleny (alespoň v USA) léčiva se zcela novým mechanizmem účinku. Lomitapid inhibující produkci lipoproteinových částic blokádou mikrozomálního triglyceridy transferujícího proteinu (MTTP) nebo mipomersen, specifický oligonukleotid omezující transkripci apolipoproteinu B, snižují dramaticky koncentrace aterogenních lipoproteinů včetně LDL‑c [2,3]. Oba zmíněné postupy otvírají sice možnosti pro léčbu nejtěžších forem familiárních dyslipidemií jinak prakticky neovlivnitelných, ale jejich použití stěžují nežádoucí účinky [4]. Nejslibnější se proto jeví vývoj v oblasti inhibitorů proprotein konvertázy subtilizin kexin 9, kterým se budeme v článku věnovat podrobněji.
Proprotein konvertáza subtilizin kexin 9 (PCSK9)
Tento protein s dlouhým a obtížně zapamatovatelným názvem byl objeven jako devátý zástupce skupiny serinových proteáz exprimovaný hlavně hepatocyty a buňkami intestinální mukózy. Jedná se o protein účastnící se intracelulární i extracelulární regulace exprese receptoru pro LDL‑c. Jednou z poznaných funkcí PCSK9 je tvorba komplexu PCSK9 s LDL receptorem a jeho internalizace v endozomu. Vazba PCSK9 na LDL receptor v buňce brání normálnímu průběhu recyklace tohoto receptoru a jeho zpětnému vystavení na plazmatické membráně. Komplex LDL receptor‑ PCSK9 je naopak intracelulárně přemístěn do lysozomu, kde podléhá degradaci. Počet LDL receptorů na povrchu buněk je tak snižován v závislosti na přítomnosti PCSK9 [5]. Schematicky zachycuje tuto situaci obr. 1 [6].
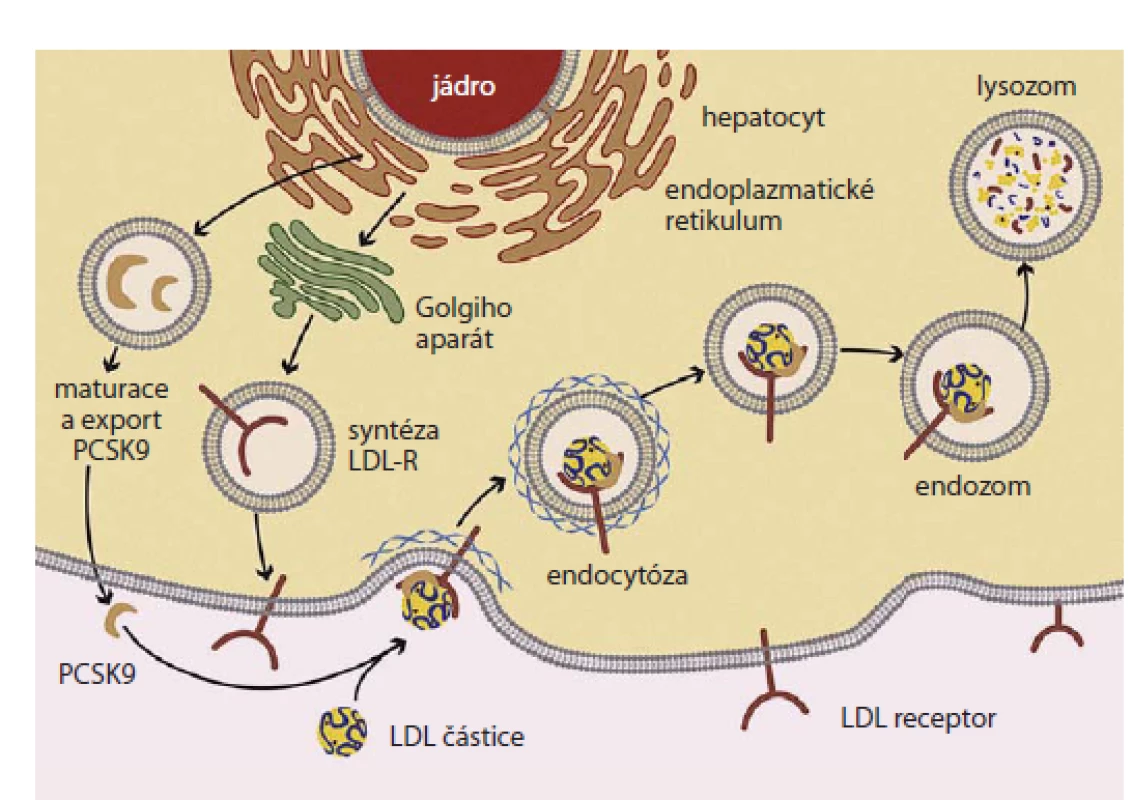
Objev PCSKS9 a poznání funkce v metabolizmu LDL‑c…
…není vůbec otázkou dávné minulosti. Teprve v roce 2003 kolektiv francouzských autorů objevil nový genový lokus v oblasti identifikované jako kódující nově objevený protein, dnes známý jako PCSK9, u rodin s autozomálně dominantní formou familiární hypercholesterolemie [6]. Nález byl poté opakovaně replikován v jiných populacích a bylo zjištěno, že nositelé genových variant zvyšujících aktivitu proteinu (tzv. gain of function mutations – mutace zvyšující funkci) mají významně zvýšené hodnoty celkového cholesterolu a LDL‑c. Pomocí experimentálního modelování i generací myších transgenních modelů zjistili výzkumníci i výše popsaný mechanizmus, jímž PCSK9 zasahuje do regulace homeostázy sérového cholesterolu. Další potvrzení významu PCSK9 pro regulaci koncentrace LDL‑c, ale také v ovlivnění rizika aterotrombotických cévních komplikací, přišlo právě z opačné strany. V epidemiologických studiích sledujících osoby s hypocholesterolemií (hypobetalipoproteinemií) zachytili výzkumníci nositele mutací v genu pro PCSK9 snižující jeho funkci s velmi nízkými koncentracemi LDL‑c. Za velmi ilustrativní lze považovat příběh 40leté vysokoškolsky vzdělané ženy, matky dvou dětí, která se živila jako cvičitelka aerobiku. Pozornost vzbudila zjištěná koncentrace jejího LDL‑c, která byla 0,36 mmol/ l. Genetické vyšetření u ní odhalilo dvě mutace snižující funkci PCSK9 – byla tedy složeným heterozygotem. Oba rodiče i někteří sourozenci vyšetřené probandky byly heterozygoty pro mutace v genu pro PCSK9 a jejich hladiny LDL‑c se pohybovaly pod 1. percentilem populačních rozmezí (obr. 2)
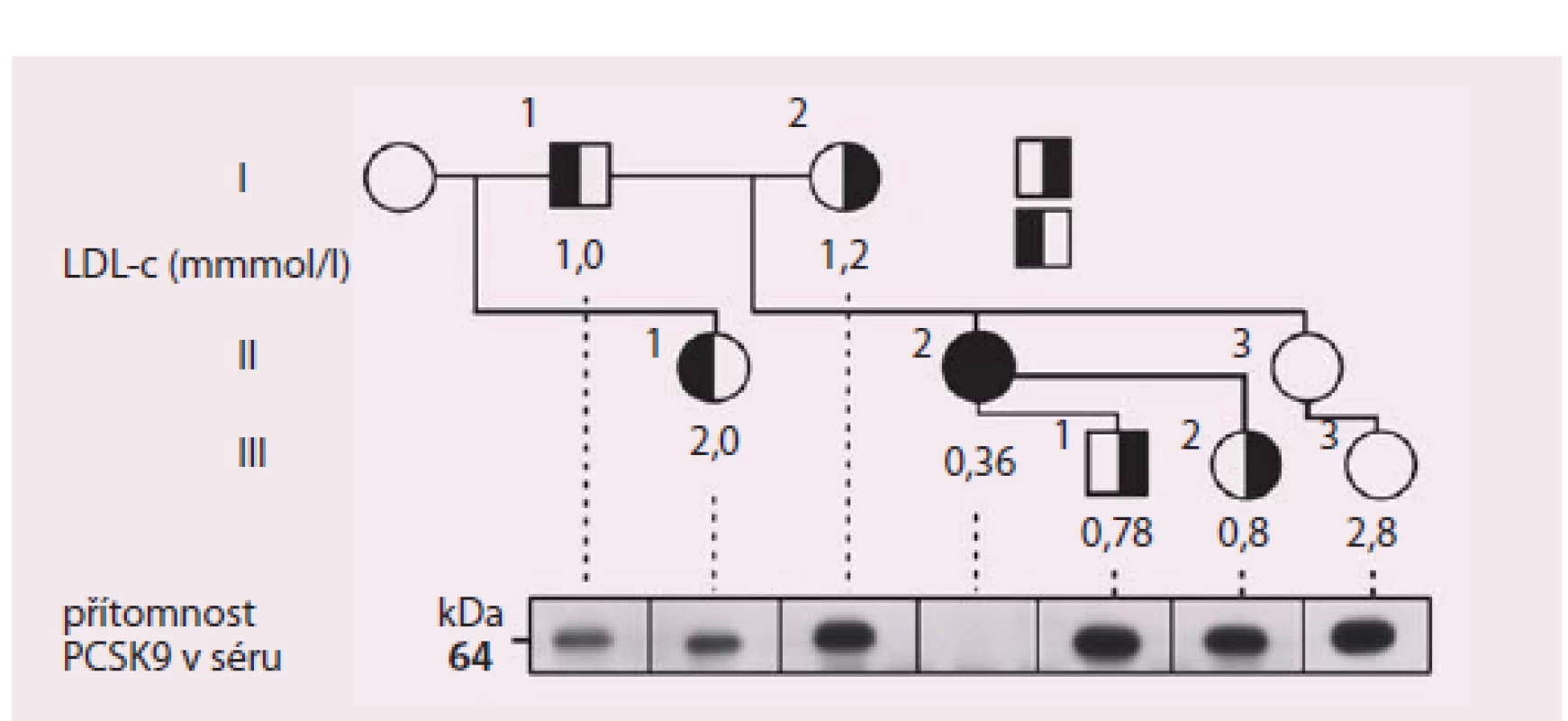
Přitom i stručná charakteristika popsané osoby ukazuje na několik důležitých aspektů praktické absence PCSK9 aktivity. To, že vede k poklesu LDL‑c do velmi nízkých hodnot, není překvapením. Představuje však důležitou informaci o bezpečnosti jak nízké aktivity PCSK9, tak i velmi nízkých hladin LDL‑c. Ty bývají často dávány do souvislosti s různými riziky, mezi nimiž pravidelně dominují myopatie, poruchy kognitivních funkcí a také riziko poruch produkce steroidních hormonů včetně pohlavních. Fakt, že popsaná žena s celoživotně nízkou hladinou LDL‑c intenzivně cvičila, měla vysokoškolské vzdělání a dvě zdravé děti, ilustrují velmi dobře, že nízké koncentrace LDL‑c v séru samy o sobě žádnou z těchto funkcí zásadně neporušují [7]. Následovala další pozorování, která dokumentovala podobný efekt geneticky podmíněného snížení funkce PCSK9 nejen na hladiny sérových lipidů, ale také na riziko ischemické choroby srdeční. Výsledky 15letého sledování kohorty více než 3 300 Afroameričanů sledovaných v rámci studie ARIC vyvolaly velký ohlas – mezi sledovanými bylo identifikováno 85 nositelů mutace v genu pro PCSK9 se snížením funkce tohoto proteinu. Tito probandi měli o 28 % nižší průměrné hladiny LDL‑c. Tento nevelký, ale celoživotní rozdíl mezi „běžnou populační“ úrovní LDL‑cholesterolemie vyústil v dramatický pokles rizika ICHS o 88 % [8]. Není divu, že zájem o PCSK9 jako o potenciální terapeutický cíl na sebe nenechal dlouho čekat.
Možnosti terapeutického ovlivnění PCSK9
Pochopení zásadní úlohy PCSK9 pro metabolizmus LDL receptoru, a tedy i LDL částic, vedly rychle k úvaze o možnosti využití inhibice PCSK9 v léčbě hypercholesterolemie a při snižování rizika aterotrombotických cévních příhod. Jelikož však enzymatická aktivita PCSK9 secernované do cirkulace není rozhodující pro ovlivnění funkce LDL receptoru, nejevila se možnost využití tradiční terapie pomocí tzv. malých molekul, tedy běžně používaný farmakoterapeutický postup využívající perorální formu podání, jako možná. Proto byly hledány způsoby, jak funkci PCSK9 limitovat pomocí biologického léčebného přístupu. V klinickém zkoušení byly terapie interferující s translací pomocí antisense RNA oligonukleotidů i specifické inhibitory RNA, ale nejdále se rozhodně dostal koncept monoklonálních protilátek blokujících interakci mezi PCSK9 a LDL receptory. Výhody tohoto terapeutického přístupu demonstrovalo využití této specifické terapie v jiných oborech medicíny – od gastroenterologie přes dermatologii až po onkologii. Specifická interakce monoklonální protilátky s cílovou molekulou má nízký potenciál k vedlejším účinkům, minimální interakci s běžnými léčivy (tzv. malé molekuly) metabolizovanými prostřednictvím cytochromu P450, vysokou účinnost a možnost intervalového podávání. Proti tomu stojí nevýhody: možnost vzniku protilátek proti terapeuticky používaným monoklonálním protilátkám, které snižují účinnost terapie. Jistě i výskyt nežádoucích účinků typu celkové anafylaktické reakce nebo místní reakce v místě podání a nutnost parenterálního podání snižují využitelnost těchto terapií. V neposlední řadě je produkce monoklonálních protilátek nákladná a časově náročná, a proto dostupná pouze v omezené míře i v dobře fungujících zdravotních systémech [8]. Každopádně rychlý vývoj poznání i technologií umožňujících produkci plně humanizovaných monoklonálních protilátek s nižším imunogenním potenciálem dovolil rozšíření této tzv. cílené léčby a monoklonální protilátky specificky blokující PCSK9 a jeho interakci s LDL receptorem.
Monoklonální protilátky proti PCSK9
Řada farmaceutických a biotechnologických společností dnes vyrábí a testuje monoklonální protilátky proti PCSK9. Přehled vybraných uvádí tab. 1 [9]. Protilátky proti PCSK9 prokázaly svou schopnost zvýšit expresi LDL receptoru a v konečném důsledku snížit hladiny LDL‑c o desítky procent. Ve třetí fázi klinického vývoje jsou tři zástupci: alirokumab, evolokumab a bokocizumab.
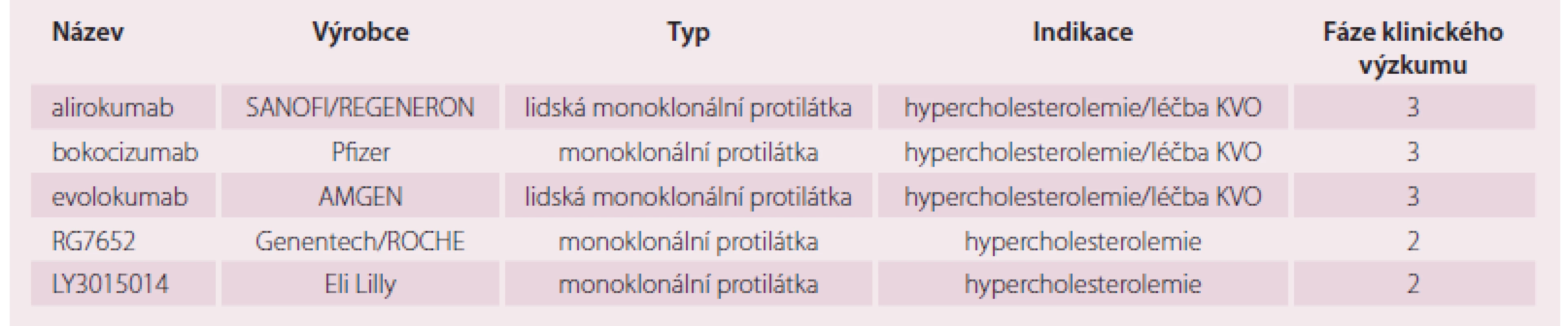
Alirokumab je podáván subkutánně jedenkrát za dva nebo čtyři týdny. Je testován v programu klinických studií ODYSSEY. U pacientů s familiární hypercholesterolemií snižuje koncentraci LDL‑c o 36– 58 % v monoterapii nebo v kombinaci se statinem [10]. Výsledky studie sledující vliv alirokumabu na výskyt kardiovaskulárních (ODYSSEY Outcomes) příhod očekáváme v roce 2018.
Evolokumab je testován v dalším komplexním výzkumném projektu s názvem PROFICIO, který zahrnuje testování evolokumabu v kombinaci se statinem (LAPLACE‑ 2), při intoleranci statinů (GAUSS), v monoterapii (MENDEL‑ 2), u heterozygotů familiární hypercholesterolemie (RUTHERFORD‑ 2) a/ nebo homozygotů familiární hypercholesterolemie (TESLA a TAUSSIG). Podobně jako alirokumab i evolokumab prokázal v ukončených studiích (např. RUTHEFORD, LAPLACE) významné snížení hladin sérových lipidů, včetně jinak obtížně ovlivnitelného aterogenního lipoproteinu (a) (pokles o 20– 30 %) [11]. Jakkoli jsou výsledky ukončených projektů slibné, musíme vyčkat, až evolokumab získá důkazy ze studie FOURIER, která testováním více než 22 000 pacientů po dobu pěti let snad jednoznačně potvrdí místo této nové léčby v prevenci a léčbě aterotrombotických cévních příhod.
Bokocizumab je testován v hodnoceních programu SPIRE. Také v rámci této série klinických studií nás bude nejvíce zajímat výsledek morbiditně‑mortalitních studií, kde jsou primárním sledovaným cílem kardiovaskulární mortalita a kardiovaskulární příhody. Výsledky s bokucizumabem můžeme očekávat v roce 2017 [12].
Monoklonální protilátky proti PCSK9 nebo také PCSK9 inhibitory mají několik zajímavých společných vlastností. Především jsou obecně velmi dobře tolerovány a výskyt nežádoucích účinků se zatím zdá být podobný jako v placebových větvích výše citovaných studií. Problémem není ani subkutánní forma podání, naopak, zdá se, že řada pacientů by dokonce preferovala možnost aplikace v intervalu 1× za 14– 30 dnů před každodenním podáváním tablet. PCSK9 inhibitory mají také pozoruhodně uniformní a výrazný účinek na snižování hladin LDL‑c. Ve studiích jsou většinou přidávány ke standardní terapii včetně maximální nebo maximálně tolerované LDL‑c snižující léčbě. Nedávno prezentované souhrnné výsledky sledování nemocných zařazených do několika studií v rámci programu ODDYSSEY s alirokumabem demonstrovaly pronikavě příznivý efekt této monoklonální protilátky nejen na hladiny LDL‑c, ale i na parametry jako non‑HDL cholesterol či lipoprotein (a) (Lp(a)). Výsledky hodnocení ve 24. týdnu studie ukazuje obr. 3 [13].
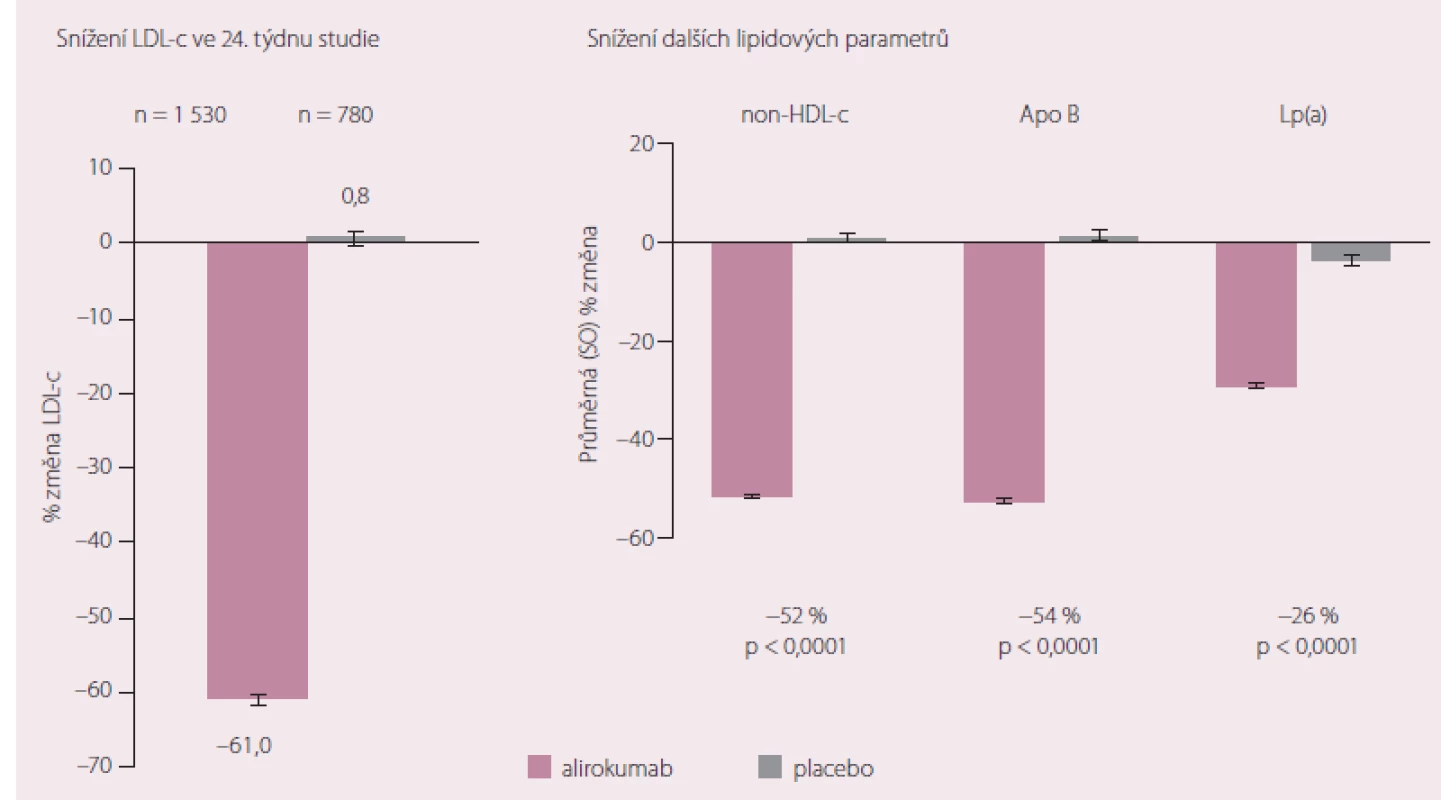
Velmi podobné výsledky ve studii DESCARTES s dvojnásobnou dobou sledování máme k dispozici i pro evolokumab [14].
Patří budoucnost inhibici PCSK9?
Možná ano. Zatím ale buďme zdrženlivě optimističtí. Jisté je, že významný efekt na snížení LDL‑c patrný při použití monoklonálních protilátek proti PCSK9 i u osob dosud obtížně léčitelných (např. nemocní s intolerancí statinů, homozygoté familiární hypercholesterolemie) dává naději těmto vybraných skupinám pacientů již dnes. Tato zjištění ale zatím nebudeme extrapolovat na další skupiny nemocných s vysokým a velmi vysokým kardiovaskulárním rizikem. Rozhodně také v současnosti nelze říci, že nové terapie mohou nahradit etablovaný přístup k léčbě dyslipidemie a ovlivnění kardiovaskulárního rizika založený v první řadě na statinech. Zůstane to tak nejméně do doby, než se podaří prokázat, že inhibitory PCSK9 sníží kromě hladin aterogenních lipoproteinů také rychlost progrese aterosklerózy hodnocenou snížením počtu kardiovaskulárních příhod a úmrtí. Výše zmíněné probíhající klinické studie 3. fáze s celkem více než 50 tisíci zařazenými osobami by takové důkazy měly přinést.
Podpořeno částečně grantem IGA MZ ČR 12217– 5/ 2011.
Doručeno do redakce: 21. 11. 2014
Přijato po recenzi: 4. 12. 2014
doc. MUDr. Michal Vrablík, Ph.D.
www.vfn.cz
vrablikm@seznam.cz
Sources
1. Vrablík M, Češka R. Novinky v oblasti hypolipidemické léčby. Vnitř Lék 2014; 60: 924– 932.
2. Cuchel M, Bloedon LT, Szapary PO et al. Inhibition of microsomal triglyceride transfer protein in familial hypercholesterolemia. N Engl J Med 2007; 356: 148– 156.
3. Kastelein JJ, Wedel MK, Baker BF et al. Potent reduction of apolipoprotein B and low‑ density lipoprotein cholesterol by short‑term administration of an antisense inhibitor of apolipoprotein B. Circulation 2006; 114: 1729– 1735.
4. Sacks FM, Stanesa M, Hegele RA. Severe hypertriglyceridemia with pancreatitis: thirteen years' treatment with lomitapide. JAMA Intern Med 2014; 174: 443– 447. doi: 10.1001/ jamainternmed.2013.13309.
5. Seidah NG. PCSK9 as a therapeutic target of dyslipidemia. Expert Opin Ther Targets 2009; 13: 19– 28. doi: 10.1517/ 14728220802600715.
6. Catapano AL, Papadopoulos N. The safety of therapeutic monoclonal antibodies: implications for cardiovascular disease and targeting the PCSK9 pathway. Atherosclerosis 2013; 228: 18– 28. doi: 10.1016/ j.atherosclerosis.2013.01.044.
7. Abifadel M, Varret M, Rabes JP et al. Mutations in PCSK9 cause autosomal dominant hypercholesterolemia. Nat Genet 2003; 34: 154– 156.
8. Zhao Z, Tuakli‑ Wosornu Y, Lagace TA et al. Molecular characterization of loss‑ of‑ function mutations in PCSK9 and identification of a compound heterozygote. Am J Hum Genet 2006; 79: 514– 523.
9. Cohen JC, Boerwinkle E, Mosley TH Jr et al. Sequence variations in PCSK9, low LDL, and protection against coronary heart disease. N Engl J Med 2006; 354: 1264– 1272.
10. Abifadel M, Elbitar S, El Khoury P et al. Living the PCSK9 adventure: from the identification of a new gene in familial hypercholesterolemia towards a potential new class of anticholesterol drugs. Curr Atherosclerosis Rep 2014; 16: 439. doi: 10.1007/ s11883‑ 014‑ 0439‑ 8.
11. Hansel TT, Kropshofer H, Singer T et al. The safety and side effects of monoclonal antibodies. Nat Rev Drug Discov 2010; 9: 325– 338. doi: 10.1038/ nrd3003.
12. Stein EA, Mellis S, Yancopoulos GD et al. Effect of monoclonal antibody to PCSK9 on plasma LDL cholesterol. N Engl J Med 2012; 366: 1108– 1118. doi: 10.1056/ NEJMoa1105803.
13. Stein EA, Wasserman SM, Dias C et al. AMG‑ 145, Evolocumab. Drugs of the Future 2013, 38: 451– 459.
14. Alirocumab Effectively Lowers LDL Cholesterol in Nine Trials: Top‑ Line Results from ODYSSEY. Medscape 2014; Jul 30. [online] Available from: http:/ / www.medscape.com/ viewarticle/ 829130.
15. Blom D, Hala T, Bolognese M et al. A 52‑week placebo‑ controlled trial of evolocumab in hyperlipidemia. N Engl J Med 2014; 370: 1809– 1819. doi: 10.1056/ NEJMoa1316222.
Labels
Paediatric cardiology Internal medicine Cardiac surgery CardiologyArticle was published in
Cardiology Review

2014 Issue 6
Most read in this issue
- Choroby aorty – diagnostika, klasifikácia a princípy manažmentu
- Kombinace antikoagulační a antiagregační léčby u nemocných po infarktu myokardu indikovaných k antikoagulační léčbě – tzv. triple terapie
- Trojkombinace v léčbě hypertenze
- Kombinace ACE inhibitorů a sartanů – kdy je doporučena?
