Postižení plíce při užívání amiodaronu – „amiodaronová plíce“
Amiodarone lung toxicity – ‘amiodarone lung’
The lung is very sensitive to the possible toxic effects of various agents – either caused by direct toxicity or immunity-driven. The number of drugs with proven lung toxicity is increasing, therefore prescribing physicians should know the possible side effects affecting the lungs. The article briefly summarises current knowledge about amiodarone lung toxicity. A case report of a typical example is provided in the second part of the article.
Keywords:
amiodarone – drug-induced lung toxicity
Authors:
Genzor S.; Žurková M.; Sova M.; Kolek V.
Authors‘ workplace:
Klinika plicních nemocí a tuberkulózy LF UP a FN Olomouc
Published in:
Kardiol Rev Int Med 2019, 21(3): 142-144
Overview
Plíce jsou orgán citlivý k působení různých léčivých i toxických látek, a to jak přímou toxicitou, tak mechanizmy zprostředkovanými imunitně. Léků s prokázanou plicní toxicitou přibývá, proto by měly patřit možné nežádoucí účinky léčby na plicní tkáň k základním vědomostem lékařů, které tyto léky předepisují. Článek stručně shrnuje aktuální znalosti o postižení plic amiodaronem a ilustruje toto onemocnění na kazuistice.
Klíčová slova:
amiodaron – polékové postižení plic
Úvod – polékové postižení plic
V současnosti je známo více než 1 000 léčivých přípravků, které přímo či nepřímo poškozují plíce a dýchací cesty. Jejich aktuální seznam spolu s podrobnou charakteristikou jednotlivých typů postižení je možné najít na stránkách www.pneumotox.com. Většina polékových postižení je reverzibilní, pokud je onemocnění včas diagnostikováno a léčeno [1]. Mezi nejčastější léky, které polékové postižení plic způsobují, patří zejména amiodaron, ale také cytostatika, protizánětlivé a imunosupresivní léky, mnohé tzv. biologické léky (tyrozin-kinázové inhibitory, imatinib, anti-TNF léčba atd.), ale také ilegálně užívané drogy.
Polékové postižení plic může mít různý obraz – od periferní eozinofilie s plicními infiltráty (antikonvulziva, allopurinol, nitrofurantoin, oxicamy, kaptopril a jiné), přes plicní edém (hydrochlorothiazid), difuzní alveolární hemoragii (hydralazin, penicilamin) [2]. Vyšší riziko vývoje polékového postižení plic mají pacienti s anamnézou kouření, s jinými plicními onemocněními a infekcemi. Etiologie není pochopitelně jednotná – většinou se jedná o imunitně zprostředkované patologické procesy, v některých případech pak o přímou toxicitu léků.
Klinicky u pacientů pozorujeme s různým odstupem od zahájení užívání léků – kašel, dušnost, někdy rovněž bolesti na prsou. V některých případech může být rozvoj poškození velmi rychlý, raritně i fatální [3].
Amiodaronová plíce
Plicní postižení při léčbě amiodaronem, tzv. amiodaronová plíce (AP), byla poprvé popsána v roce 1980 Rotmenschem et al [4] na případě neinfekční pneumonie vzniklé po užívání amiodaronu s plnou úpravou stavu po jeho vysazení. Dusman et al [5] pak v roce 1990 publikovali prospektivní observační studii na 573 pacientech užívajících amiodaron – celkem u 33 pacientů (5,8 %) se vyvinulo intersticiální postižení plic v souvislosti s jeho užíváním.
Amiodaronová plíce je způsobena dlouhodobým užíváním amiodaronu, při němž se v tkáních hromadí léčivo i jeho metabolit desethylamiodaron. Obě sloučeniny vyvolávají toxické poškození plic s poruchou endogenního fosfolipidového katabolismu přímou toxicitou. Tím dochází k histologickému obrazu podobnému střádání lipidů v plicní tkáni se sekundární zánětlivou reakcí [6]. Incidence AP závisí na kumulativní dávce amiodaronu, věku pacientů, výskytu přidružených plicních nemocí a pohybuje se v různých skupinách v širokém rozsahu 0,1–50 %. Pokud možno je doporučováno použít co nejnižší dávky amiodaronu – při dávce 400 mg denně se vyvine AP u 5–15 % pacientů [6], při dávce 200 mg je to v běžné populaci pravděpodobně kolem 2 % [6].
Onemocnění se projeví po několika týdnech až letech užívání amiodaronu. AP se většinou projevuje subakutně až chronicky s různým radiologickým nálezem se zastoupením postižení alveolů i plicního intersticia. Kromě difuzních infiltrací může být projevem také unilaterální ohraničené postižení či mnohočetné nodulace, event. i s retikulacemi a pruhovitými opacitami, které jsou známkami plicní fibrózy. Pokud je postižení asymetrické, tak bývá ve většině případů nejvíce postižen pravý horní lalok. Příčina tohoto jevu není přesně známá, předpokládá se účast kyslíkových radikálů, přičemž právě tato oblast plic je teoreticky nejlépe ventilována [7]. Funkční vyšetření odhalí snížení difuzní plicní kapacity – za signifikantní se považuje pokles o 15–20 % oproti výchozím hodnotám, může dojít i k rozvoji restrikční ventilační poruchy [8]. Zvýšení denzity jaterního parenchymu na nativním CT jako známka hepatální toxicity [9], oční postižení a postižení štítné žlázy [10] může napomoci uzavřít diagnózu a je po něm potřeba vždy aktivně pátrat. V nejasných případech je vždy indikováno doplnění bronchoskopie – zejména k vyloučení jiných možných plicních afekcí. V bronchioalveolární laváži nacházíme typicky zvýšené polymorfonukleáry a CD8 T lymfocyty, dále bývají přítomny pěnovité makrofágy – ty však bývají přítomny i u pacientů bez amiodaronové toxicity [11]. Histologický obraz z transbronchiální (kryo)biopsie většinou odhalí pěnovité makrofágy, jinak nebývá velmi typický – je popisován intersticiální zánět, fibrózní změny a hyperplazie pneumocytů II. typu [12].
V lehčích případech spočívá léčba zejména ve vysazení amiodaronu, v závažnějších případech je nutné podávání kortikosteroidů [13]. Obecně se doporučuje podávat iniciálně 40–60 mg prednisonu denně a vzhledem k pomalému vylučování z organizmu kortikoidy postupně detrahovat až po dobu 12 měsíců. Okayasu et al [14] uvádějí, že příliš rychlé předčasné vysazení kortikosteroidů vede častěji k relapsům. Prognóza onemocnění je při časné léčbě dobrá, jsou však popsány i případy pacientů se syndromem akutní dechové tísně (acute respiratory mistress syndrome – ARDS) vzniklém na podkladě amiodaronové toxicity, mortalita je v těchto případech vysoká – až kolem 50 % [15].
Kazuistika
Pacientka, ročník narození 1942, v péči Kliniky plicních nemocí a tuberkulózy FN Olomouc pro syndrom spánkové apnoe a chronickou obstrukční plicní nemoc. V srpnu 2017 pro perzistentní fibrilaci síní nově do terapie amiodaron (200 mg denně). Od března 2018 postupné zhoršování dušnosti, suchý kašel. 29. března 2018 proveden ve spádu pacientky skiagram hrudníku, kde jsou popisovány difuzně v obou plících splývavé stíny, srdce aorto-mitrálního tvaru, dilatované (obr. 1).
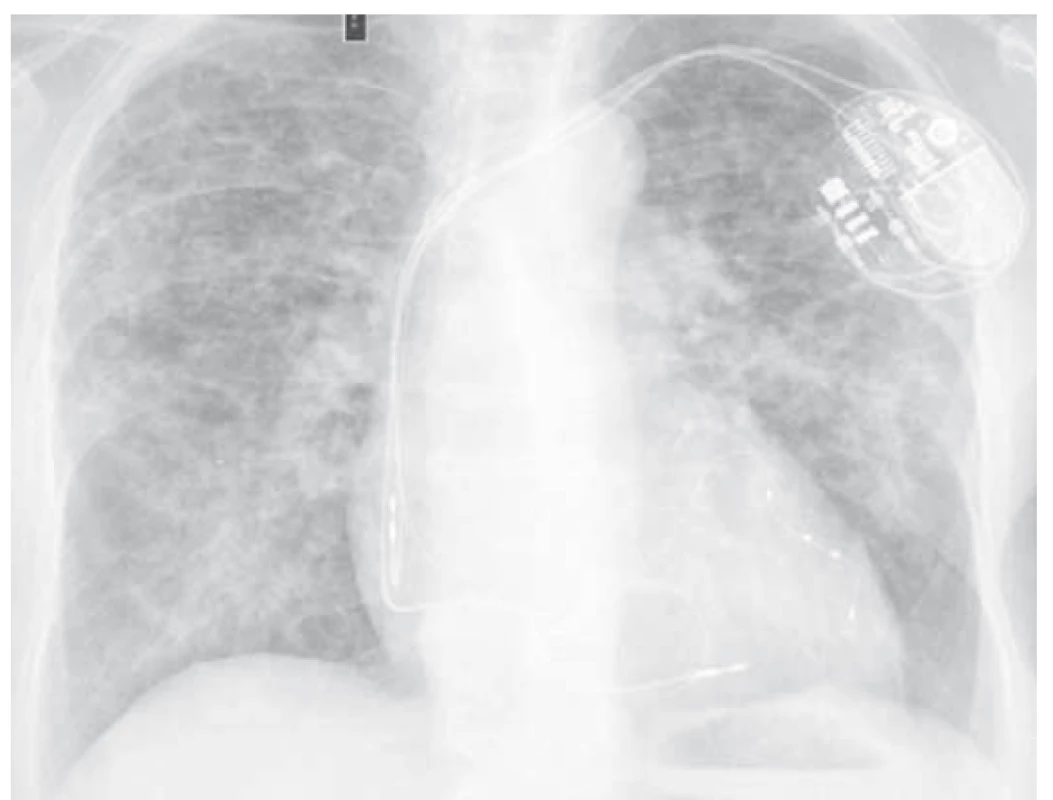
Objednáno CT plic. Pacientka se však pro postupně progredující dušnost dostavuje na naši plicní ambulanci s požadavkem o vyšetření. Klinicky dušnost, saturace 93 %, poslechově dominovali krepitace bilaterálně bazálně. Doplněno vyšetření plicní difuze, kde pokles z normálních hodnot (v květnu 2016 85% transfer faktor a 107% transfer koeficient) na úroveň 35% transfer faktoru a 54% transfer koeficientu. Na počítačové tomografii hrudníku s vysokou rozlišovací schopností (HRCT plic) popisováno bilaterálně masivní postižení intersticia (obr. 2) – mnohočetné nepravidelné proužky, retikulace, opacity mléčného skla až konsolidace s maximem peribronchovaskulárně s relativním ušetřením periferie.
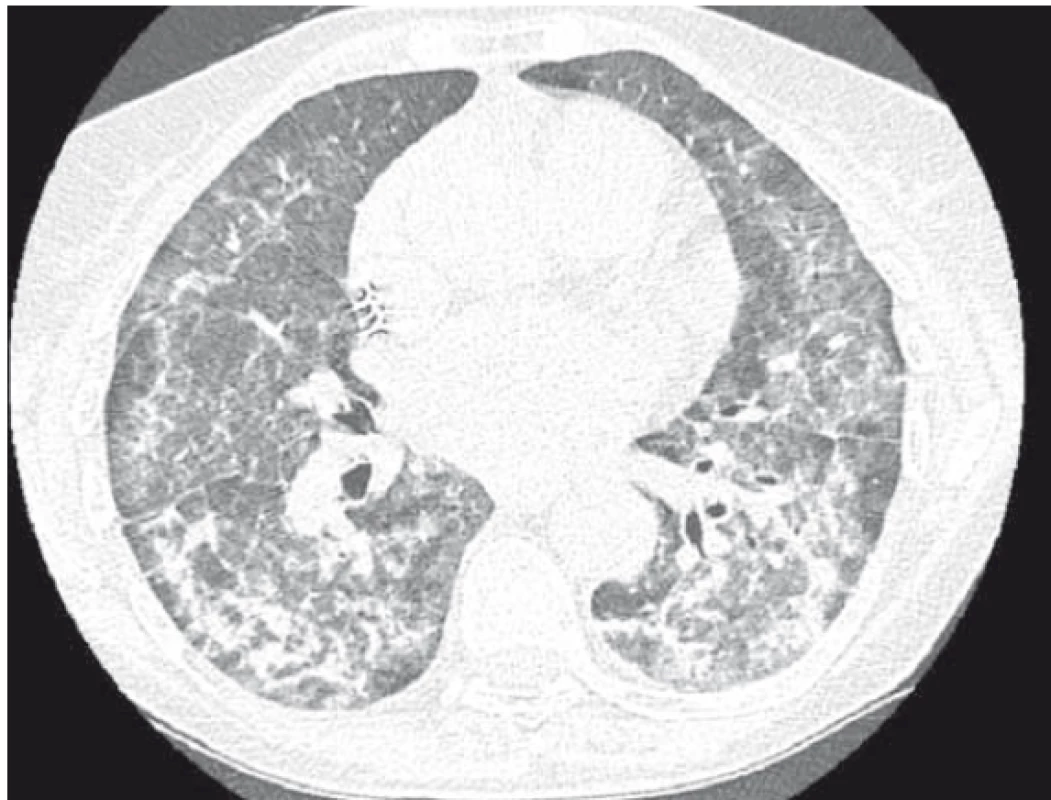
Dle očního vyšetření suspektní postižení rohovky při depozici amiodaronu. Vzhledem ke klinicky a anamnesticky jasné diagnóze – amiodaronové plíce, při současné polymorbiditě pacientky a celkově špatném stavu nedoplňována bronchoskopie ani histologická verifikace.
Pacientka byla následně přijata k hospitalizaci na naši kliniku k zahájení kortikoterapie – iniciálně v dávce 1 mg prednisonu s postupnou detrakcí – celková délka užívání Prednisonu 12 měsíců. Kardiologem vysazen amiodaron (pacientka s BiV-ICD, zajištěna betablokátorem, změna strategie léčby na rate control). Při této léčbě výrazná úprava stavu – opětovný vzestup transfer faktoru i koeficientu, regrese změn na skigramu hrudníku (obr. 3) i HRCT plic (obr. 4), ústup dušnosti i krepitací poslechově. Pacientka je nadále v naší péči a stav je i po vysazení systémových kortikosteroidů velmi dobrý.
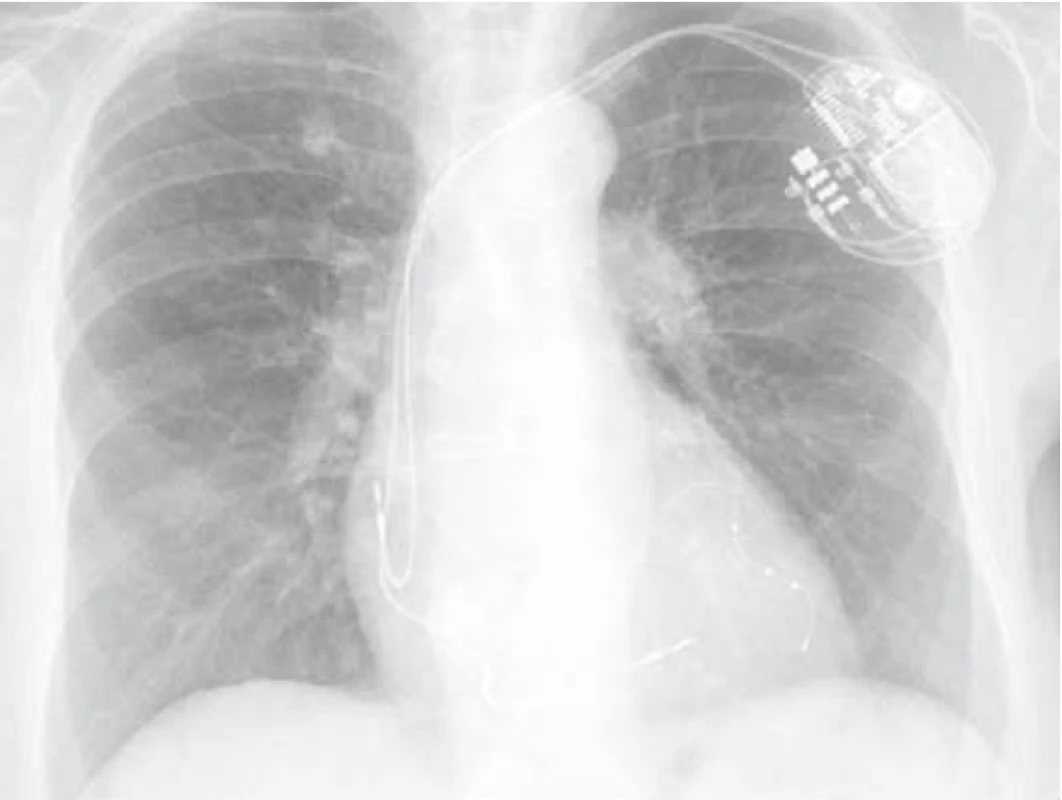
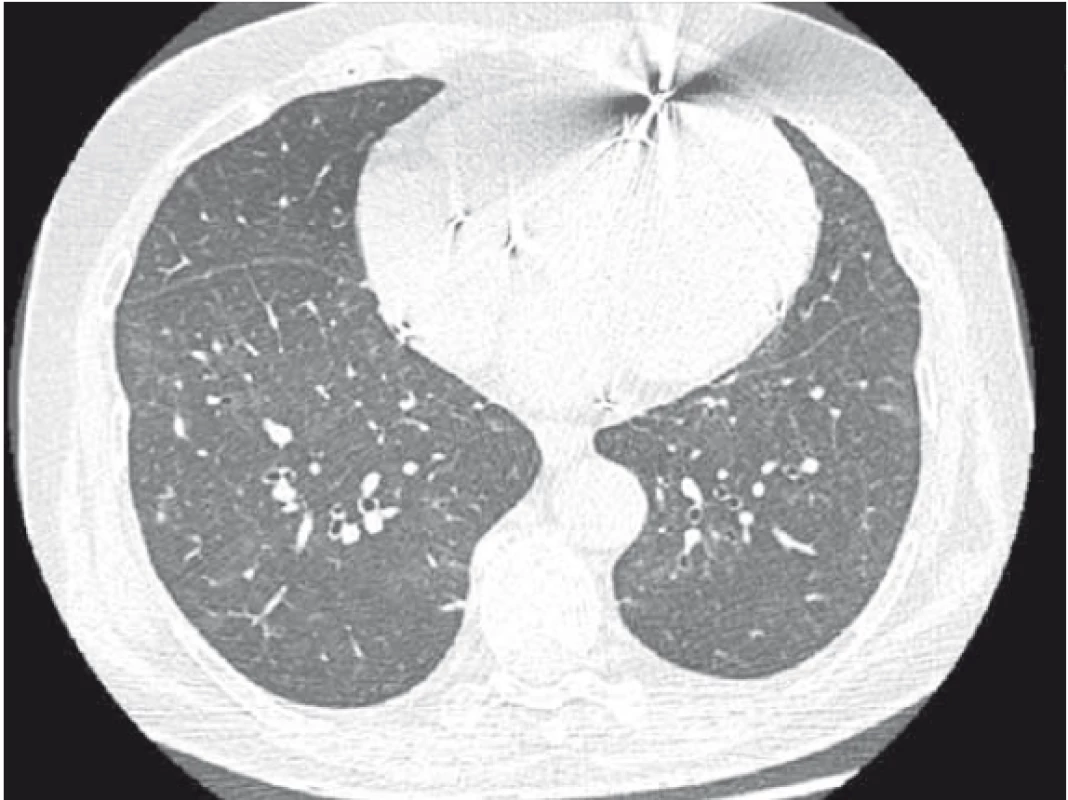
Závěr a doporučení pro praxi
Polékové postižení plic není raritní a je potřeba na něj myslet v případě dušnosti nejasného původu. První kontakt s pacientem často mívá kardiolog či praktický lékař, definitivní diagnózu a léčbu určuje pneumolog. Prognóza je v případě časně zahájené léčby ve většině případů velmi dobrá, není výjimkou ani zhojení plíce ad integrum.
Podpořeno grantem IGA UP: LF_2019_009.
Doručeno do redakce: 3. 9. 2019
Přijato po recenzi: 9. 9. 2019
MU Dr. Samuel Genzor
Sources
1. Vašáková M, Polák J, Matěj R. Intersticiální plicní procesy: od etiopatogeneze přes radiologický obraz k histopatologické diagnóze. 2. vyd. Praha: Maxdorf Jessenius 2016.
2. Lošťáková V, Kuna M, Kolek V et al. Polékové postižení plic. Klin Farmakol Farm 2018 : 32(4): 21–31.
3. Kolek V. Doporučené postupy v pneumologii. 2. vyd. Praha: Maxdorf Jessenius 2016.
4. Rotmensch HH, Liron M, Tupilski M et al. Possible association of pneumonitis with amiodarone therapy (letter). Am Heart J 1980; 100(3): 412–413. doi: 10.1016/ 0002-8703(80)90165-9.
5. Dusman RE, Stanton MS, Miles WN et al. Clinical features of amiodarone-induced pulmonary toxicity. Circulation 1990; 82(1): 51–59. doi: 10.1161/ 01.cir.82.1.51.
6. Camus P, Martin WJ 2nd, Rosenow EC 3rd. Amiodarone pulmonary toxicity. Clin Chest Med 2004; 25(1): 65–75. doi: 10.1016/ S0272-5231(03)00144-8.
7. Marchlinski FE, Gansler TS, Waxman HL et al. Amiodarone pulmonary toxicity. Ann Int Med 1982; 97(6): 839–845. doi: 10.7326/ 0003-4819-97-6-839.
8. Gleadhill IC, Wise RA, Shonfeld SA et al. Serial lung function in patients treated with amiodarone: a prospective study. Am J Med 1989; 86(1): 4–10. doi: 10.1016/ 0002-9343(89)90221-0.
9. Kojima S, Kojima S, Ueno H et al. Increased density of the liver and amiodarone-associated phospholipidosis. Cardiol Res Pract 2009; 2009 : 598940. doi: 10.4061/ 2009/ 598940.
10. Chuang CL, Chern MS, Chang SC. Amiodarone toxicity in a patient with simultaneous involvement of cornea, thyroid gland, and lung. Am J Med Sci 2000; 320(1): 64–68. doi: 10.1097/ 00000441-200007000-00010.
11. Jessurum GA, Crijns HJ. Amiodarone pulmonary toxicity. BMJ 1997; 314 : 619–620.
12. Myers JL, Kennedy JI, Plumb VJ. Amiodarone lung: pathologic findings in clinically toxic patients. Hum Pathol 1987; 18(4): 349–354. doi: 10.1016/ s0046-8177(87)80164-8.
13. Martin WJ 2nd, Rosenow EC 3rd. Amiodarone pulmonary toxicity: Recognition and pathogenisis (Part 1). Chest 1988; 93(5): 1067–1075. doi: 10.1378/ chest.93.5.1067.
14. Okayasu K, Takeda Y, Kojima J et al. Amiodarone pulmonary toxicity: a patient with three recurrences of pulmonary toxicity and consideration of the probable risk of relapse. Intern Med 2006; 45(22): 1303–1307. doi: 10.2169/ internalmedicine.45.1800.
15. Greenspon AJ, Kidwell GA, Hurley W et al. Amiodarone-related post-operative adult respiratory distress syndrome. Circulation 1991; 84 (Suppl 5): 407–415.
Labels
Paediatric cardiology Internal medicine Cardiac surgery CardiologyArticle was published in
Cardiology Review

2019 Issue 3
-
All articles in this issue
- Srdeční selhání a chronická obstrukční plicní choroba
- Plicní hypertenze a syndrom obstrukční spánkové apnoe
- Epidemiologie tuberkulózy
- Těžká komunitní pneumonie
- Idiopatická plicní fibróza – změny v diagnostice a léčbě
- Postižení plíce při užívání amiodaronu – „amiodaronová plíce“
- Sarkoidóza – aktuální pohled na patogenezi, diagnostiku a léčbu
- Kardiovaskulární působení rekreačních drog (kokain, marihuana, metamfetamin)
- PCSK9 inhibitory v klinické praxi – update
- Subfrakcie HDL častíc u srdcového zlyhávania
- Evropský a světový kardiologický sjezd – Paříž 2019
- V hlavní roli adherence - Kongres Evropské společnosti pro hypertenzi, Miláno 2019
- Simultánní intervence více rizikových faktorů – cesta k účinnému snížení kardiovaskulárního rizika
- Cardiology Review
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Kardiovaskulární působení rekreačních drog (kokain, marihuana, metamfetamin)
- Sarkoidóza – aktuální pohled na patogenezi, diagnostiku a léčbu
- Epidemiologie tuberkulózy
- PCSK9 inhibitory v klinické praxi – update
