Stanovení sérových markerů v diferenciální diagnostice časného karcinomu prostaty (pilotní studie)
Changes in serum levels of markers in early detection of prostate cancer (pilot study)
Objective:
Monitoring changes in the levels of biomarkers PSA, %fPSA, [-2]proPSA and calculation of PHI in the diagnostic algorithm of early prostate cancer.
Design:
Pilot study
Material and Methods:
The Immunoanalytical Laboratory of University Hospital in Pilsen examined sera of 76 patients from the Urology department of the University Hospital with suspected prostate cancer who have undergone TRUS biopsy. We assessed the levels of PSA and, if the interval of PSA was between 0-30 µg/l, we also assessed the levels of freePSA, [-2]proPSA and we calculated %fPSA and Prostate Health Index (PHI). The monitored biomarkers were measured using the chemiluminescent DxI 800 instrument (Beckman Coulter, USA). All statistical analyses were calculated using the SAS version 9.2 software.
Results:
We found statistically significant increased levels of [-2]proPSA and PHI in patients diagnosed with prostate cancer by prostate biopsy vs. patients with benign prostate hypertrophy ([-2]proPSA median 14 vs. 27 ng/l, PHI median 35 vs. 77). On the contrary, we did not find any significant difference in tPSA and %freePSA (median tPSA 7.1 vs. 7.7 µg/l and %freePSA 16 vs.11.4%).
Conclusion:
The assessment of [-2]proPSA and the calculation of PHI appear to be of great benefit for a more accurate differential diagnosis of benign hyperplasia.
Key words:
PSA, fPSA , [-2]proPSA , PHI, prostate health index, prostate cancer, biopsy, benign prostate hypertrophy
:
R. Fuchsová 1; O. Topolčan 1; J. Klečka 2; J. Vrzalová 1; M. Hora 2; R. Kučera 1; O. Dolejšová 2; O. Hes 3
:
Laboratoř imunochemické diagnostiky, FN a LF v Plzni, Univerzita Karlova v Praze
1; Urologická klinika, Fakultní nemocnice v Plzni
2; Šiklův patologicko-anatomický ústav, FN a LF v Plzni, Univerzita Karlova v Praze
3
:
Klin. Biochem. Metab., 21 (42), 2013, No. 1, p. 21-24
Cíl studie:
Sledování sérových hladin markerů karcinomu prostaty PSA, %freePSA, [-2]proPSA a výpočet PHI v časné diagnostice karcinomu prostaty.
Typ studie:
Pilotní studie
Materiál a metody:
V imunoanalytické laboratoři Fakultní nemocnice Plzeň (FN) byla vyšetřena séra 76 pacientů Urologické kliniky FN s podezřením na karcinom prostaty a indikovaných k biopsii prostaty pod ultrasonografickou kontrolou (TRUS). U všech pacientů byla stanovena hladina celkového PSA, a pokud byla mezi 0 – 30 µg/l, bylo doplněno stanovení hladin freePSA, [-2]proPSA, vypočítán poměr %freePSA a Prostate Health Index (PHI). Stanovení sledovaných biomarkerů se prováděla chemiluminiscenční metodou na přístroji DxI 800 (Beckman Coulter, USA). Pro veškeré statistické výpočty byl použit statistický software SAS verze 9.2.
Výsledky:
Nalezli jsme statisticky signifikantně zvýšené hladiny [-2]proPSA a PHI u pacientů s histologicky potvrzeným karcinomem prostaty oproti pacientům s benigní hyperplazií prostaty ([-2]proPSA medián 14 vs. 27 ng/l, PHI medián 35 vs. 77). Naopak u celkového PSA a %freePSA jsme statisticky významné rozdíly v hladinách nenalezli (mediány tPSA 7,1 vs. 7,7 µg/l a %freePSA 16 vs. 11,4 %).
Závěr:
Pro zpřesnění diferenciální diagnostiky benigní hyperplazie se zdá být stanovení [-2]proPSA a vypočtení indexu PHI velkým přínosem.
Klíčová slova:
PSA, [-2]proPSA , PHI, index zdravé prostaty, karcinom prostaty, biopsie, benigní hyperplazie prostaty.
Úvod
V současné době existují dva důvody, proč se prakticky přestal provádět celoplošný screening karcinomu prostaty pomocí PSA. Prvním důvodem je, že na sjezdu Americké onkologické společnosti v roce 2011 (ASCO 2011) bylo konstatováno, že pomocí PSA a fPSA nelze odhadnout agresivitu nádorového procesu, a dochází tím ke zbytečnému zahájení léčby i v případech, kde není vůbec indikována (overtherapy). Druhým důvodem je jeho nízká specificita. Tu sice zlepšuje kombinování s % fPSA (nejčastěji používané v České republice) nebo v zahraničí často používanou velocitou a densitou PSA nebo využití na věk adjustovaných referenčních hodnot [1, 2]. Nízká specificita PSA vede k nadměrnému počtu biopsií prostaty – čili k „over diagnostice“ [3]. Hledají se neustále nové markery pro zpřesnění diferenciální diagnostiky [4]. V naší pilotní studii jsme se snažili zjistit, zda stanovení [-2]proPSA (isoformy volného PSA) je schopno pomoci řešit problém „over diagnostiky“.
Materiál a metody
V období od listopadu 2010 do dubna 2012 bylo v imunoanalytické laboratoři FN Plzeň vyšetřeno 76 sér pacientů urologické kliniky s podezřením na karcinom prostaty, u nichž byla provedena TRUS biopsie. Krev byla odebírana z kubitální žíly do odběrových zkumavek VACUETTE®, (Greiner Bio-One, Rakousko). Sérum bylo odděleno centrifugací při 1 700 × g po dobu 10 minut a vzorky byly buď okamžitě zpracovány, nebo – pokud je nebylo možno zpracovat do 3 hodin – byly uchovávány až do doby stanovení při teplotě -20 °C. U všech nemocných bylo vyšetřeno celkové PSA (tPSA), a pokud bylo v rozmezí 0-30 µg/l, bylo doplněno o vyšetření freePSA (fPSA) a [-2]proPSA. Měli jsme ve všech případech k dispozici výsledek palpačního vyšetření prostaty, sonografii a objem prostaty, výsledek biopsie prostaty a byla známa medikace před a v době odběru krevního vzorku, tedy obdobně jako v podobných zahraničních pracích [5,6]. Všechny výše uvedené markery byly stanoveny chemiluminiscenční metodou na přístroji DxI 800 (Beckman Coulter, USA) a vypočteny %freePSA podle vzorce (freePSA/tPSA) x 100 a index PHI=([-2]proPSA /freePSA)x√tPSA. Hodnoty CV se pohybovaly pro [-2]proPSA v rozmezí 3,9-5,6 %, fPSA 6,8-9,9 % a tPSA 6,9-7,5 % (podle použité kontrolní hladiny).
Podle výsledků biopsie prostaty byli nemocní rozděleni do dvou skupin, a to na 50 nemocných s benigní hypertrofií prostaty (negative) a 26 nemocných s karcinomem prostaty (positive). Průměrný věk byl 68 let (49 – 82 let). Za použití statistického softwaru SAS verze 9.2. byla provedena deskriptivní analýza, a vzhledem k nerovnoměrnému počtu pacientů v obou skupinách byla namísto standardního t-testu použita metoda generalizovaných lineárních modelů (GLM) pro porovnání dvou skupin s testovou statistikou F. V box-whisker plotech jsou uváděny hodnoty testové statistiky F a příslušné p-hodnoty (v grafech uváděné jako Prob > F).
Výsledky
Grafy s boxploty stanovovaných markerů pro skupiny benigní a maligní tPSA (obr. 1), [-2]proPSA (obr. 2), %freePSA (obr. 3) a PHI (obr. 4):

![Fig. 2. Boxplot for [-2]proPSA (ng/l) benign and malignant group](https://pl-master.mdcdn.cz/media/image/142076ddb03bbccff6c7c6335d2cefd3.jpg?version=1537792530)


Z grafů vyplývá, že jsme nalezli signifikantní rozdíly mezi skupinami benigních lézí (negative) a maligních lézí (positive) hladin isoenzymu [-2]proPSA a indexu PHI ([-2]proPSA medián 14 vs. 27 ng/l, p> 0,0022, PHI median 35 vs. 77 p>0,0001 ), a naopak nebyly přítomny signifikantní rozdíly mezi hladinami tPSA a %freePSA (medián tPSA 7,1 vs. 7,7 µg/l a %freePSA 16 vs.11,4 %).
Diskuze
Zahraniční autoři do svých souborů zahrnuli pacienty s celkovým PSA 4-10 µg/l, která je považována za oblast hraničních hodnot (šedé zóny) tPSA [7]. Nás ale zajímalo, zda by bylo možné zabránit opakovaně negativním biopsiím u pacientů s tPSA i nad 10 µg/l. Na základě zkušeností z běžné urologické praxe, kdy i u pacientů s tPSA mezi 10 a 30 µg/l existují pacienti s opakovanými negativními biopsiemi, jsme se rozhodli provádět stanovení [-2]proPSA u všech nemocných s celkovým PSA do 30 µg/l. Ve skupině benigních lézí mělo 9 pacientů z padesáti tPSA nad 10 µg/l, a dokonce 3 pacienti nad 20 µg/l.
Naše zjištění nesignifikantních rozdílů v hladinách celkového PSA a %fPSA mezi benigní a maligní skupinou podporují klinickou zkušenost, že tyto markery nepostačují pro svou nízkou specificitu k diferenciální diagnostice mezi BHP a CA prostaty. Provedli jsme tedy analýzu našich pacientů podle standardně vyšetřovaných parametrů (tPSA a %freePSA) versus PHI a hodnotili, zda [-2]proPSA umožní zabránit provedení biopsií. Použili jsme cut-off pro %freePSA hodnotu 20% (nad 20 = benigní léze) a cut-off pro PHI 40 (nad 40 = maligní léze).
Z Tabulky 1 vyplývá, že celkem 34 biopsií (tj. 45 %) ze skupiny indikované na základě patologických hodnot %fPSA bylo negativních, a přitom negativních bio-psií na základě patologického PHI by bylo pouze 14 (tj. 18 %). Zde je třeba vzít také v úvahu, že obecně udávaný počet falešně negativních prvních biopsií je kolem 25 % [8].
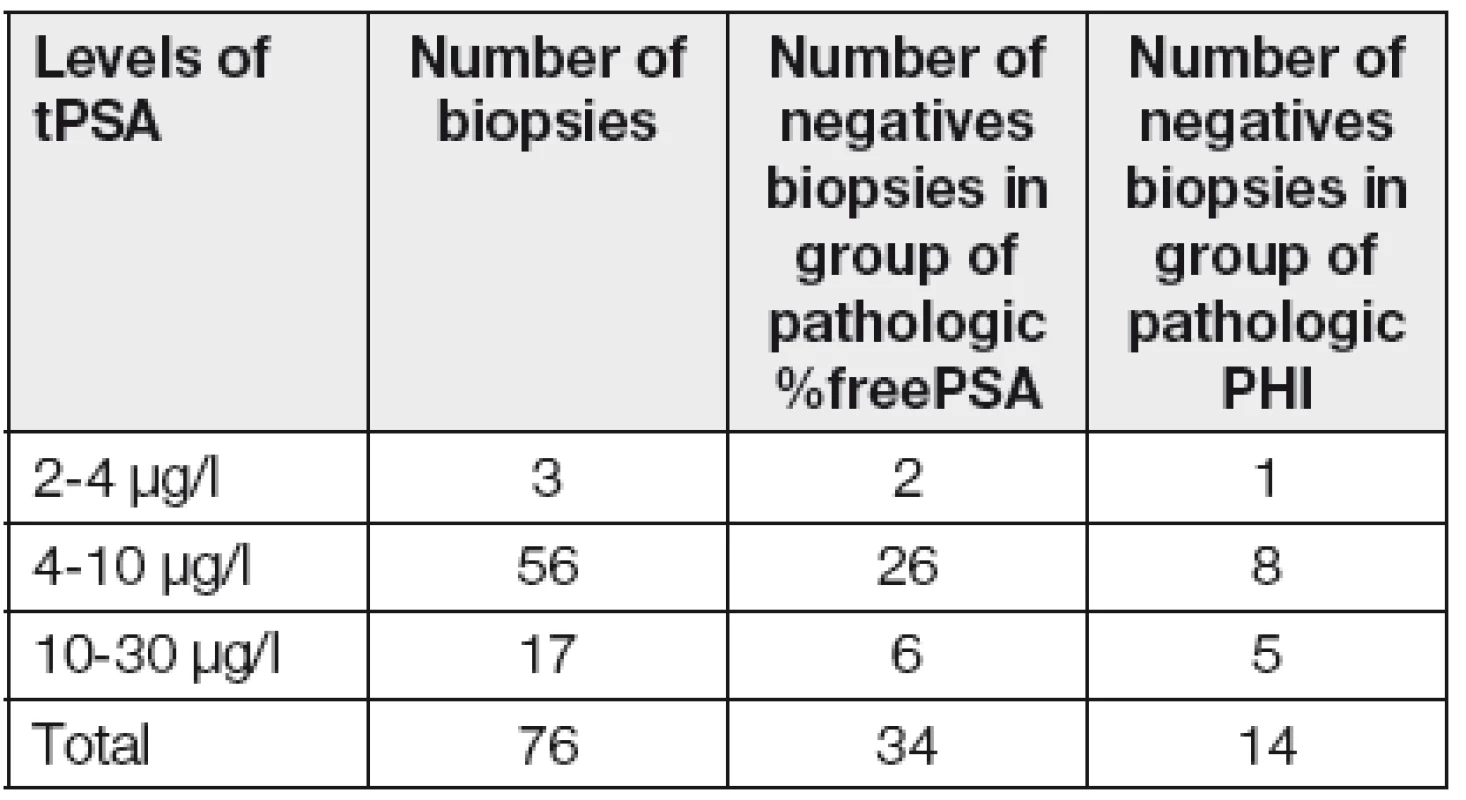
Pokud by se urolog rozhodoval o biopsii na základě standardně prováděné kombinace markerů (tPSA a %free PSA), pak u celkem 7 karcinomů (Tabulka 2) se %freePSA pohybovalo v rozmezí referenčního intervalu (20 až 32 %), a naopak všechny diagnostikované karcinomy měly hodnotu PHI nad 40.
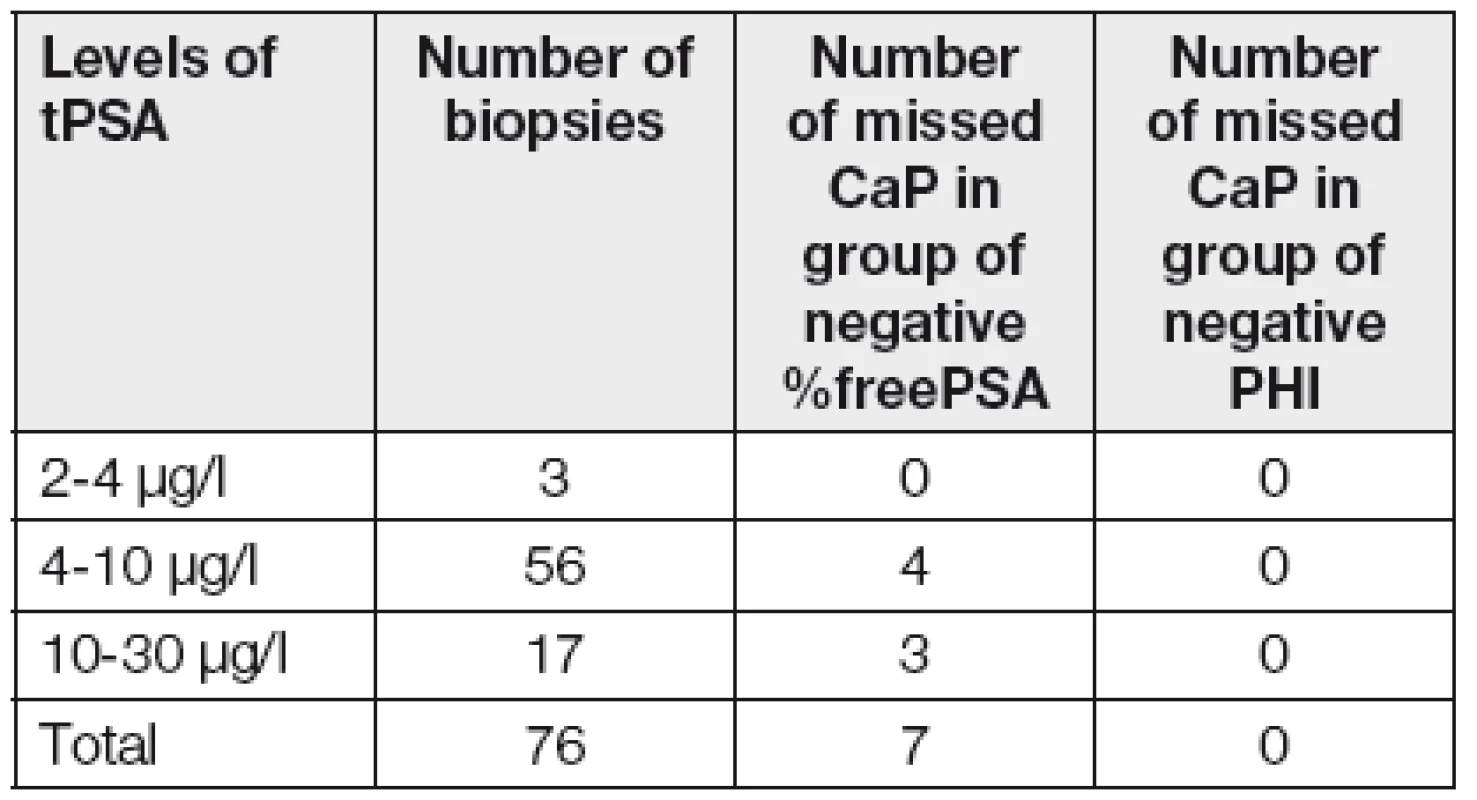
Ve srovnání s literaturou, kde autoři uvádějí zpřesnění indikace k biopsii prostřednictvím výpočtu %freePSA [9, 10], pak v našem souboru přispívá tento výpočet jen velmi omezeně. Silná statistická významnost absolutních hodnot indexu PHI i samotného [-2]proPSA potvrzují, že tyto markery by mohly velmi výrazně pomoci urologovi v jeho rozhodování o provedení biopsie, případně rebiopsie. Toto se ukázalo při úvahách o eventuálních nadbytečných biopsiích. Zabránění provádění zbytečných biopsií by mělo dopady zcela jistě nejen zdravotnické a psychologické, ale nepochybně i ekonomické. Náklady na diagnostiku pomocí těchto markerů představují částku cca 700 Kč, naproti tomu náklady na provedení jedné biopsie dosahují výše cca 5 000 Kč.
Závěr
Naše výsledky svědčí o tom, že stanovení [-2]proPSA a výpočet indexu PHI umožnuje zvýšit spolehlivost diferenciální diagnostiky karcinomu prostaty a současně, pokud ověříme naše pilotní zkušenosti na rozsáhlejší studii, povede ke snížení počtu prováděných biopsií.
Tato studie byla podpořena z projektu Ministerstva zdravotnictví České republiky Institucionální podpora na dlouhodobý koncepční rozvoj výzkumné organizace 00669806 – FN Plzeň.
Do redakce došlo 22. 11. 2012
Adresa pro korespondenci:
MUDr. Radka Fuchsová
FN Plzeň
Laboratoř imunochemické diagnostiky, Oddělení nukleární medicíny
Dr. E. Beneše 13
305 99 Plzeň
e-mail: fuchsovar@fnplzen.cz
Sources
1. Shariat, S. F., et al. Tumor Markers in Prostate Cancer I: Blood-Based Markers. Acta Oncologica (Stockholm, Sweden), 2011, vol. 50 Suppl 1, s. 61-75, ISSN 1651-226X, 0284-186X.
2. Makarov, D. V., et al. Biomarkers for Prostate Cancer. Annual Review of Medicine, 2009, vol. 60, s. 139-151, ISSN 1545-326X, 0066-4219.
3. Heijnsdijk, E. A., et al. Overdetection, Overtreatment and Costs in Prostate-Specific Antigen Screening for Prostate Cancer. British Journal of Cancer, 2009, vol. 101, no. 11, s. 1833-1838, ISSN 1532-1827, 0007-0920.
4. Klečka, J. et al. Nádorové markery karcinomu prostaty. Ces. Urol., 2008, 12(3), s. 173-185.
5. Catalona, W. J., et al. A Multicenter Study of [-2]Pro-Prostate Specific Antigen Combined with Prostate Specific Antigen and Free Prostate Specific Antigen for Prostate Cancer Detection in the 2.0 to 10.0 ng/ml Prostate Specific Antigen Range. The Journal of Urology, 2011, vol. 185, no. 5, s. 1650-1655, ISSN 1527-3792, 0022-5347.
6. Sokoll, L. J., et al. A Prospective, Multicenter, National Cancer Institute Early Detection Research Network Study of [-2]proPSA: Improving Prostate Cancer Detection and Correlating with Cancer Aggressiveness. Cancer Epidemiology, Biomarkers & Prevention: A Publication of the American Association for Cancer Research, Cosponsored by the American Society of Preventive Oncology, 2010, vol. 19, no. 5, s. 1193-1200, ISSN 1538-7755, 1055-9965.
7. Khan, M. A., et al. Evaluation of Proprostate Specific Antigen for Early Detection of Prostate Cancer in Men with a Total Prostate Specific Antigen Range of 4.0 to 10.0 ng/ml. The Journal of Urology, 2003, vol. 170, no. 3, s. 723-726, ISSN 0022-5347, 0022-5347.
8. Roehl, K. A.; Antenor, J. A.; Catalona, W. J. Serial Biopsy Results in Prostate Cancer Screening Study. The Journal of Urology, 2002, vol. 167, no. 6, s. 2435-2439, ISSN 0022-5347, 0022-5347.
9. Catalona, W. J., et al. Use of the Percentage of Free Prostate-Specific Antigen to Enhance Differentiation of Prostate Cancer from Benign Prostatic Disease: A Prospective Multicenter Clinical Trial. JAMA: The Journal of the American Medical Association, 1998, vol. 279, no. 19, s. 1542-1547, ISSN 0098-7484, 0098-7484.
10. Mikolajczyk, S. D., et al. Free Prostate-Specific Antigen in Serum is Becoming More Complex. Urology, 2002, vol. 59, no. 6, s. 797-802, ISSN 1527-9995, 0090-4295.
Labels
Clinical biochemistry Nuclear medicine Nutritive therapistArticle was published in
Clinical Biochemistry and Metabolism

2013 Issue 1
-
All articles in this issue
- Number of cells in the cerebrospinal fluid, energy relations in the cerebrospinal fluid compartment and intensity of inflammatory response in the central nervous system
- Significance and possibilities to examine brain metabolism in neurointensive care by microdialysis
- Changes in serum levels of markers in early detection of prostate cancer (pilot study)
- New regulation hormones of the breast milk
- The prevalence of decreased glomerular filtration rate in patients with monoclonal gammopathy of undetermined significance
- Clinical Biochemistry and Metabolism
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Significance and possibilities to examine brain metabolism in neurointensive care by microdialysis
- Number of cells in the cerebrospinal fluid, energy relations in the cerebrospinal fluid compartment and intensity of inflammatory response in the central nervous system
- Changes in serum levels of markers in early detection of prostate cancer (pilot study)
- New regulation hormones of the breast milk
