Neo‑adjuvantná chemoterapia s následnou IDS (interval debulking surgery) v liečbe pokročilého karcinómu ovária – retrospektívna analýza
Neo‑Adjuvant Chemotherapy Followed by Interval Debulking Surgery in Advanced Ovarian Cancer Treatment – a Retrospective Study
Backgrounds:
Primary debulking surgery and chemotherapy (paclitaxel and carboplatin) remain the standard treatment for advanced ovarian cancer. The size of the residual tumour after primary debulking surgery has proved to be an important prognostic determinant. Complete tumour debulking without any macroscopic residual disease is considered the optimal primary debulking surgery. It is not possible to perform such an aggressive operation in patients with advanced ovarian cancer due to the bad performance status and extensive disease. Neo ‑ adjuvant chemotherapy and interval debulking surgery seem to be an effective treatment strategy in this group of patients.
Material and Methods:
The retrospective analysis evaluated the efficiency of interval debulking surgery in correlation with progression‑free and overall survival in patients with advanced ovarian cancer. 38 patients were treated with standard chemotherapy: paclitaxel 175 mg/ m2 and carboplatin 5 – 6 AUC every three weeks. According to the clinical response, surgical debulking was considered, after which postoperative chemotherapy was given. Ineligible patients for interval debulking were treated with 2nd line chemotherapy.
Results:
After neo ‑ adjuvant chemotherapy, 24 patients of the group of 38 achieved partial remission and interval debulking surgery was indicated. Optimal interval debulking surgery was performed in 12 patients, suboptimal debulking surgery in 12 patients. Of the entire group, 14 patients did not show any adequate response to the primary treatment, they did not have interval debulking surgery indicated and they were treated with 2nd line chemotherapy. Progression‑free survival in patients after optimal debulking was 11 months, median overall survival was not achieved (OS > 42.5 months). Progression‑free survival in patients after suboptimal debulking was 6 months and median overall survival was 33 months. Median overall survival in patients without surgical treatment was 21.5 months.
Conclusion:
The results of the study confirm that neo ‑ adjuvant chemotherapy with subsequent interval debulking surgery is a suitable therapeutic approach in primary inoperable patients with advanced ovarian cancer.
Key words:
ovarian cancer – surgery – neo adjuvant therapy – chemotherapy
Authors:
M. Tkáčová 1,2; B. Vertaková‑ krakovská 1,2; B. Belohorská 1,2; V. Miškovská 1,2; L. Heľpianska 1,2; D. Ondruš 1; M. Ondrušová 3,4; S. Špánik 1,2; J. Švec 1
Authors‘ workplace:
I. onkologická klinika LF UK, Bratislava, Slovenská republika
1; Interná‑ onkologická klinika OÚSA, Bratislava, Slovenská republika
2; Ústav experimentálnej onkológie SAV, Bratislava, Slovenská republika
3; Institut biostatistiky a analýz, Masarykova univerzita, Brno
4
Published in:
Klin Onkol 2009; 22(6): 273-277
Category:
Original Articles
Overview
Východiská:
Za štandardnú liečbu pokročilého karcinómu ovária sa považuje primárna radikálna operácia s následným podaním chemoterapie v zložení paklitaxel a karboplatina. Dokázalo sa, že veľkosť reziduálneho tumoru po primárnej radikálnej operácii (debulkizácii) má prognostický význam. Ako optimálna primárna debalkizačná operácia sa hodnotí kompletná debalkizácia tumoru bez prítomnosti makroskopického rezidua. U určitej skupiny pacientok s pokročilým karcinómom ovária nie je možné túto operáciu vykonať vzhľadom na veľký rozsah ochorenia a zlý stav telesnej výkonnosti. Neo ‑ adjuvantná chemoterapia a IDS predstavuje alternatívny postup v liečbe danej skupiny pacientok.
Materiál a metódy:
Autori v retrospektívnej analýze hodnotili efektivitu IDS v korelácii s časom do progresie ochorenia a celkovým prežívaním pacientok s pokročilým karcinómom ovária. Celkovo 38 pacientok sa primárne liečilo štandardnou chemoterapiou v schéme: paklitaxel 175 mg/ m2 a karboplatina 5 – 6AUC podávanou každé tri týždne. Podľa klinickej odpovede sa zvážila IDS, po ktorej pacientky pokračovali v identickej chemoterapii. Pacientky, u ktorých nebola indikovaná IDS, pokračovali druholíniovou chemoterapiou.
Výsledky:
Zo súboru 38 pacientok po neo ‑ adjuvantnej chemoterapii 24 pacientok dosiahlo parciálnu remisiu ochorenia a následne boli indikované na IDS. Optimálna odložená radikálna operácia bola vykonaná u 12 pacientok, suboptimálna u 12 pacientok. Z celého súboru 14 pacientok nedosiahlo adekvátnu odpoveď na primárnu liečbu, nebola u nich indikovaná odložená radikálna operácia a pokračovali v liečbe druhou líniou chemoterapie. Čas do progresie ochorenia u pacientok po optimálnej debalkizácii bol 11 mesiacov, medián celkového prežívania nebol dosiahnutý (OS > 42,5 mesiaca). U pacientok po suboptimálnej debalkizácii bol čas do progresie ochorenia 6 mesiacov a medián celkového prežívania 33 mesiacov. V skupine pacientok, u ktorých chirurgická liečba nebola indikovaná, bol medián celkového prežívania 21,5 mesiaca.
Záver:
Výsledky analýzy potvrdili, že neo ‑ adjuvantná chemoterapia s následnou IDS je vhodný terapeutický postup v liečbe pokročilého iniciálne inoperabilného karcinómu ovária.
Kľúčové slová:
ovariálny karcinóm – chirurgická liečba – neo ‑ adjuvantná liečba – chemoterapia
Východiská
Zhubné nádory vaječníka majú v rámci nádorov ženských pohlavných orgánov osobitné zastúpenie, a to z viacerých dôvodov: chýba jednoznačná detekovateľná in situ forma nádoru, neexistujú účinne aplikovateľné spôsoby screeningu a samotný nádor sa často manifestuje v klinicky pokročilom štádiu s nepriaznivou prognózou. Incidencia zhubných nádorov vaječníka značne varíruje medzi jednotlivými štátmi. Všeobecne vyššie hodnoty sa zaznamenávajú vo vyspelých v porovnaní s rozvojovými krajinami. Rozdiely vo výskyte ochorenia sa vysvetľujú jednak rozdielmi v kompletnosti zozbieraných dát v jednotlivých krajinách sveta, ale s väčšou pravdepodobnosťou sa tu uplatňuje vplyv odlišných počtov hysterektómií a ooforektómií v jednotlivých krajinách, ako aj aplikácia orálnych kontraceptív a priemerná parita žien. Slovenská republika sa hodnotami štandardizovanej incidencie 13,1/100 000 žien v roku 2005 zaraďuje medzi krajiny so stredným výskytom tohto ochorenia [1].
Vo väčšine vyspelých štátov sveta, vrátane SR, zostáva incidencia nádorov ovária za posledných 25 rokov pomerne stabilizovaná, aj keď sa zaznamenal vzostup ochorenia u starších a pokles u mladších žien. Celkovo má krivka vekovo špecifickej incidencie v SR stúpajúci trend od cca 30.–40. roku života, s kulmináciou v 7. decéniu a následným miernym poklesom výskytu ochorenia.
Vzhľadom na relatívne zlú prognózu ochorenia (iba 26–34% chorých prežíva viac ako 5 rokov) sa hodnoty štandardizovanej mortality v mnohých krajinách blížia k hodnotám incidencie. Päťročné celkové prežívanie pacientok s nádorom vaječníka v SR predstavuje 33,0%, SR sa tak približuje k celoeurópskym priemerným hodnotám (36,7%) prežívania chorých s nádorom ovária. Štandardizovaná mortalita v SR v roku 2005 bola 6/100 000 [1].
Karcinóm ovária patrí teda medzi malignity s nepriaznivou prognózou, až 70% pacientok v čase stanovenia diagnózy má pokročilé ochorenie (štádium FIGO III, IV) [2]. Štandardná liečba pokročilého karcinómu ovária zahàňa agresívny chirurgický zákrok (debalkizáciu) s úmyslom odstránenia čo najväčšieho objemu tumoru a kombinovanú chemoterapiu v zložení paklitaxel a platinový derivát. Veľkosť reziduálneho tumoru po primárnej operácii má prognostický význam [3–4]. Bristow et al [5] vo veľkej meta analýze (6 885 pacientok) potvrdil pozitívnu koreláciu medzi percentom radikálnych operácií a celkovým prežívaním [3–5]. Každé 10% zmenšenie objemu reziduálneho tumoru spôsobí zväčšenie mediánu celkového prežívania o 5,5%. Práve preto sa kladie veľký dôraz na rozsah primárnej debalkizácie, ktorá by mala byť optimálna. Podľa GOG skupiny sa za optimálnu primárnu debalkizáciu považuje chirurgický výkon, po ktorom nie je v abdomene prítomná žiadna makroskopická choroba [6]. Väčšina pacientok s pokročilým karcinómom ovária má v čase stanovenia diagnózy prítomné rozsiahle intraabdominálne metastázy a len 40–60% z nich je schopných podstúpiť primárnu radikálnu operáciu [7]. Pomerne rozsiahly operačný výkon je spojený s vysokou pooperačnou morbiditou a mortalitou, čo často spôsobí odklad adjuvantnej chemoterapie. Pooperačné komplikácie a časový odklad adjuvantnej chemoterapie znižujú efektivitu primárnej radikálnej operácie. Posledné roky sa skúma neo adjuvantná chemoterapia s následnou odloženou radikálnou operáciou (interval debulking surgery – IDS) ako alternatívny postup pre liečbu pacientok s pokročilým karcinómom ovária, ktoré majú veľký rozsah ochorenia a zlý stav telesnej výkonnosti. Tento terapeutický prístup prináša menej pooperačných komplikácií, skrátenie hospitalizácie a dosiahnutie menšieho reziduálneho tumoru po operácii [7]. Doteraz nie sú stanovené žiadne odporúčania, ktoré by definovali postavenie neo adjuvantnej chemoterapie pre liečbu pokročilého karcinómu ovária.
Cieľom retrospektívnej analýzy bolo zistiť, či IDS ovplyvňuje čas do progresie ochorenia a celkové prežívanie pacientok s primárnym pokročilým karcinómom ovária.
Materiál a metódy
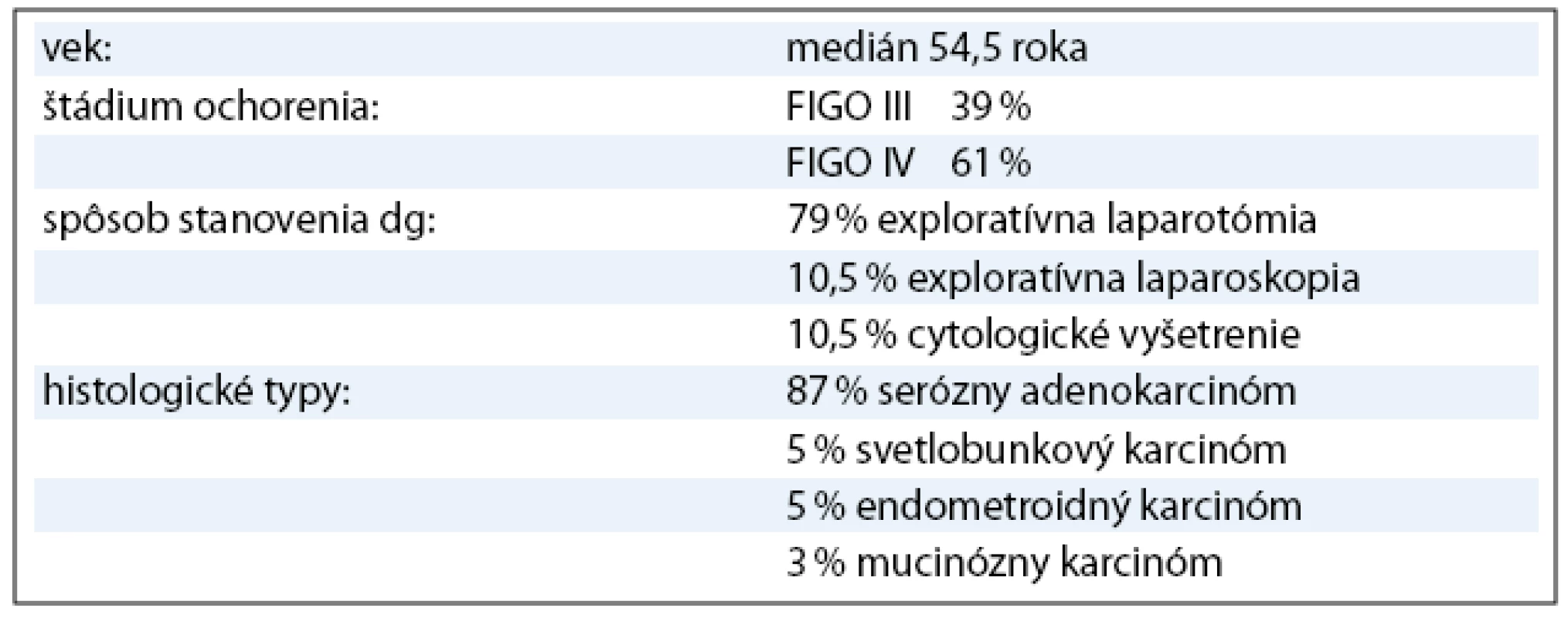
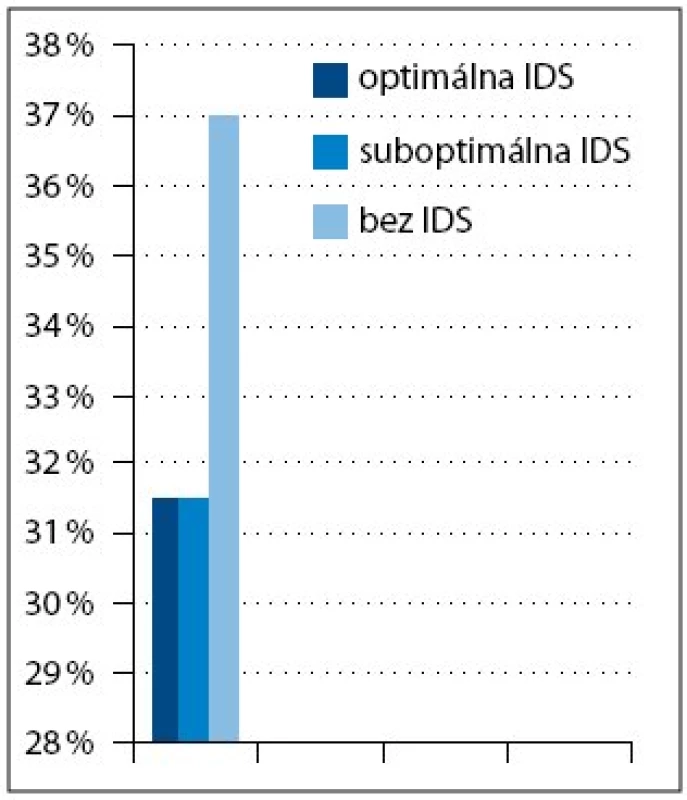
Do súboru bolo zaradených 38 pacientok s pokročilým karcinómom ovária, ktoré sa liečili v období rokov 2000–2006. Všetky pacientky mali v čase stanovenia diagnózy inoperabilné štádium ochorenia. Diagnóza bola stanovená u 30 pacientok (79%) exploratívnou laparotómiou, u štyroch (10,5%) exploratívnou laparoskopiou a u štyroch (10,5%) cytologickým vyšetrením (tab. 1). Pacientky sa liečili štandardnou neo adjuvantnou kombinovanou chemoterapiou podľa schémy: paklitaxel 175mg/m2 a karboplatina 5–6AUC podávané každé 3 týždne (PC). Súčasne sa aplikovala štandardná antiemetická a antialergická premedikácia. Podľa klinickej odpovede na túto primárnu liečbu multidisciplinárny tím zvážil odloženú radikálnu operáciu (interval debulking surgery – IDS). Na základe odpovede na neo adjuvantnú chemoterapiu a na základe rozsahu IDS sme pacientky v súbore rozdelili do troch skupín (tab. 2). V 1. skupine bolo 12 pacientok, ktoré sa liečili tromi cyklami predoperačnej chemoterapie s následnou optimálnou IDS a pooperačne 3–5 cyklami identickej chemoterapie. V 2. skupine bolo 12 pacientok, ktoré predoperačne dostali 3–4 cykly chemoterapie s následnou suboptimálnou IDS a pooperačne pokračovali 3–6 cyklami identickej chemoterapie. V 3. skupine bolo 14 pacientok, ktoré sa liečili predoperačne 3–10 cyklami chemoterapie, nedosiahli stav operability, a preto pokračovali druholíniovou chemoterapiou. Klinická odpoveď na iniciálnu liečbu sa hodnotila na základe fyzikálneho vyšetrenia, CT vyšetrenia a podľa stanovenia hladiny markeru CA 125. Za adekvátnu klinickú odpoveď na iniciálnu chemoterapiu sa považovala parciálna remisia (PR) ochorenia. Pri dosiahnutí danej klinickej odpovede sa indikovala odložená radikálna operácia s cieľom maximálnej cytoredukcie. Aj keď sa v literatúre neuvádzajú pojmy ako optimálna a suboptimálna IDS, v našom sledovanom súbore sme si ich dovolili použiť. Dôvodom bol fakt, že primárny radikálny chirurgický výkon sa realizoval po primárnej chemoterapii s časovým odstupom. IDS bola preto primárna cytoredukčná operácia. Za optimálnu odloženú radikálnu operáciu sa považovala taká, kde reziduálny tumor bol < 1cm v najväčšom priemere. Ak bol reziduálny tumor > 1cm, odložená radikálna operácia sa považovala za suboptimálnu. Pooperačne pacientky pokračovali v identickej chemoterapii. Po skončení pooperačnej chemoterapie bola zhodnotená klinická odpoveď pomocou fyzikálneho vyšetrenia, CT vyšetrenia a stanovenia hladiny markeru CA 125. Ak sa iniciálnou liečbou nedosiahla PR ochorenia, operabilný stav, pacientky pokračovali druholíniovou chemoterapiou.


Výsledky
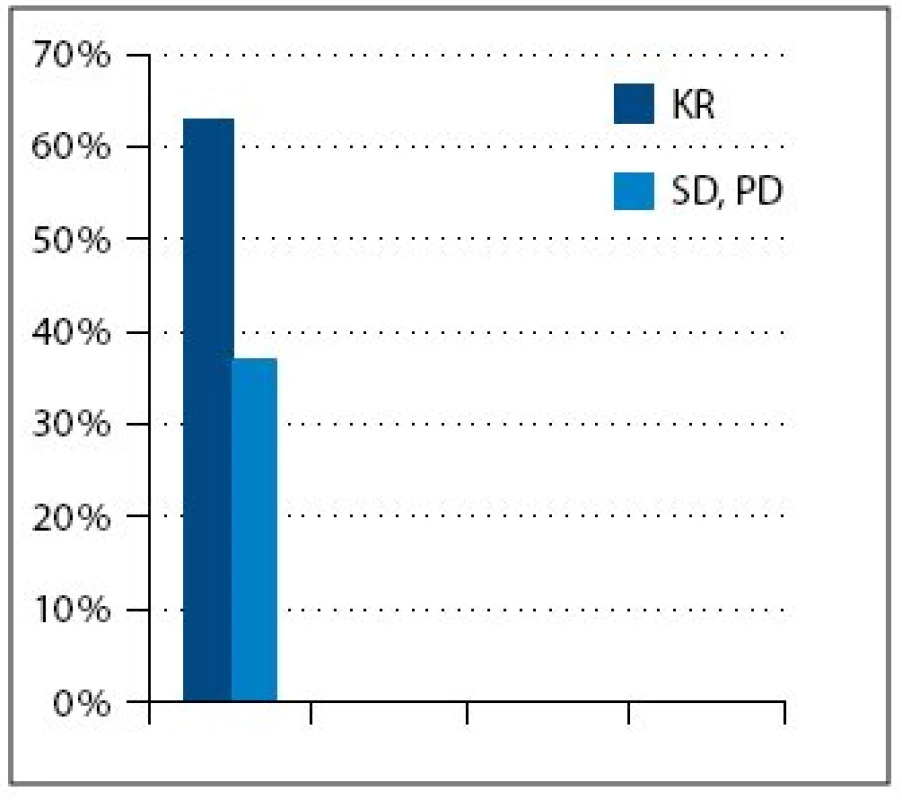
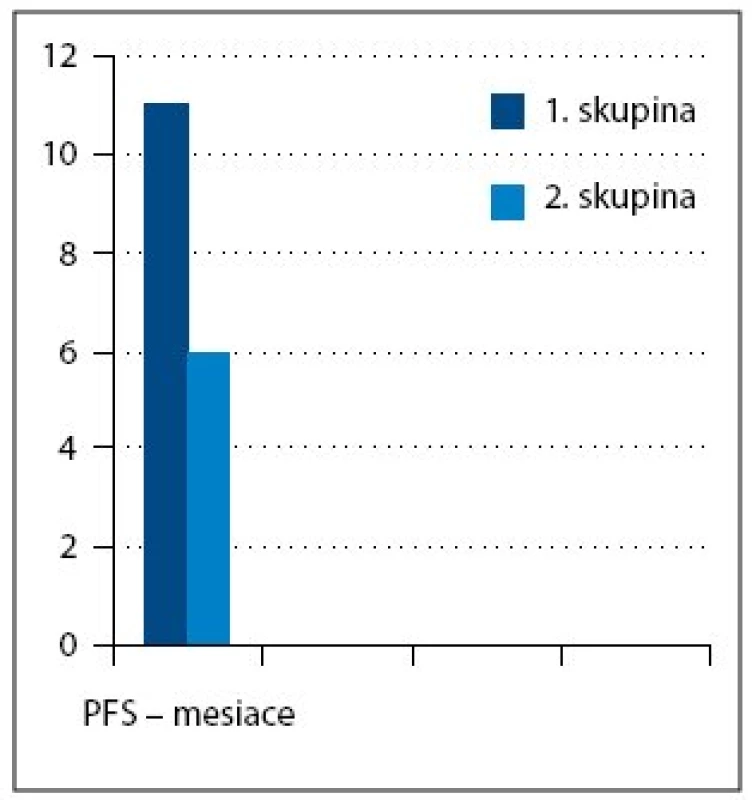
Medián veku pacientok zaradených do súboru bol 54,5 roka. V súbore bolo 15 (39%) pacientok s ochorením v štádiu FIGO III a 23 (61%) v štádiu FIGO IV. Najčastejší histologicky v sledovanom súbore bol serózny adenokarcinóm u 33 pacientok (87%) (tab. 1). Všetkých 24 pacientok v 1. a 2. skupine dosiahlo po neo adjuvantnej chemoterapii, IDS a pooperačnej chemoterapii kompletnú remisiu (KR) ochorenia. V 3. skupine, kde bolo 14 pacientok, sa po iniciálnej liečbe dosiahla len stabilizácia alebo došlo k progresii ochorenia, preto sa IDS neindikovala a pacientky pokračovali v liečbe druhou líniou chemoterapie (tab. 3, obr. 1). Čas do progresie ochorenia (progression free survival – PFS) v 1. skupine bol 11 mesiacov, medián celkového prežívania (overall survival – OS) v čase zhodnotenia výsledkov nebol dosiahnutý (> 42,5 mesiacov). V 2. skupine bol čas do progresie ochorenia 6 mesiacov a medián celkového prežívania bol 33 mesiacov (obr. 3). Pacientky v 3. skupine dosiahli stabilizáciu alebo progresiu ochorenia, pokračovali v liečbe druhou líniou chemoterapie, preto čas do progresie ochorenia nebolo možné hodnotiť. Medián celkového prežívania v 3. skupine bol 21,5 mesiaca.
Diskusia
V tejto retrospektívnej analýze sme potvrdili priamu koreláciu medzi klinickou odpoveďou na neo adjuvantnú chemoterapiu a prognózou pacientky. Čím sa dosiahla lepšia klinická odpoveď, tým sa mohol vykonať radikálnejší operačný výkon. V našom súbore bola optimálna debalkizácia vykonaná u 31,5% pacientok. Zahraniční autori uvádzajú v nerandomizovaných klinických štúdiách 60–75% optimálnych debalkizácií po neo adjuvantnej chemoterapii [2]. Rozdielnosť výsledkov je pravdepodobne spôsobená chybou malých čísel pri malom súbore pacientok, vyšším podielom pacientok s ochorením v štádiu IV a faktom, že pred iniciálnou systémovou liečbou nebola vykonaná ani čiastočná debalkizácia tumoru, len odobratie vzorky na histologické vyšetrenie. Radikálnejší operačný zákrok viedol k predĺženiu času do progresie ochorenia a k zlepšeniu prežívania pacientok s pokročilým karcinómom ovária. Potvrdili sme, že správne načasovanie radikálnej operácie a veľkosť reziduálneho tumoru boli v našom súbore prognostický významné. U pacientok v 3. skupine s platina rezistentným karcinómom ovária bola prognóza nepriaznivá. Výsledky tejto štúdie predpokladajú, že daná stratégia liečby je vhodná pre pacientky s iniciálne pokročilým inoperabilným karcinómom ovária. Viacero retrospektívnych štúdií [8–12] podporuje hypotézu, že určitá podskupina pacientok s pokročilým karcinómom ovária liečených neo adjuvantnou chemoterapiou s následnou IDS, profituje z daného liečebného postupu predĺžením celkového prežívania a znížením pooperačnej morbidity [13]. V literatúre sa uvádzajú dve prospektívne randomizované štúdie, ktoré sa zaoberali témou neo adjuvantnej chemoterapie a IDS. V klinickej štúdii EORTC [3–4,14–16] bolo 278 pacientok s karcinómom ovária (štádium IIb–IV) iniciálne suboptimálne debalkizovaných s reziduálnym tumorom > 1cm. Po prvých troch cykloch chemoterapie cyklofosfamid a cisplatina (CP) boli pacientky randomizované do dvoch ramien. V prvom ramene pokračovali ďalšími troma cyklami identickej chemoterapie. V druhom ramene pacientky podstúpili IDS a následne dostali tri cykly identickej chemoterapie. Táto štúdia potvrdila lepší čas do progresie ochorenia a celkové prežívanie v ramene s IDS. Odlišné výsledky však priniesla klinická štúdia GOG 152 [3–4,14], ktorá mala podobnú schému a vstupné kritériá ako EORTC štúdia. V súbore bolo 425 pacientok s karcinómom ovária po iniciálnej suboptimálnej debalkizácii. Po úvodných troch cykloch chemoterapie paklitaxel s cisplatinou boli pacientky randomizované do ramena, kde pokračovali v identickej chemoterapii tromi cyklami alebo podstúpili IDS s následným podaním troch cyklov identickej chemoterapie. Štúdia nepotvrdila, že IDS zlepšuje čas do progresie ochorenia a celkové prežívanie pacientok s karcinómom ovária [14]. Jedným z hlavných rozdielov medzi štúdiami bol vyšší podiel pacientok s ochorením v štádiu IV v súbore EORTC štúdie, ich horší stav telesnej výkonnosti a väčší objem reziduálneho tumoru po primárnej operácii nevykonanej v špecializovaných gynekoonkologických centrách. EORTC klinická štúdia potvrdila, že IDS vykonávaná skúsenými špecialistami zlepšuje prežívanie pacientok, ktoré neboli primárne optimálne operované. Na druhej strane klinická štúdia GOG 152 potvrdila, že IDS nie je indikovaná u pacientok, ktoré podstúpili iniciálne maximálny debalkizačný výkon na špecializovanom pracovisku [14,17]. Načasovanie odloženej radikálnej operácie nie je štandardizované. Podľa Goldie Coldmanovej hypotézy podanie menšieho počtu cyklov chemoterapie pred operačným výkonom má väčší benefit, pretože pooperačný reziduálny tumor ostane chemosenzitívny [13]. Pred plánovaním IDS je dôležité zhodnotiť odpoveď na iniciálnu systémovú liečbu, a to na základe poklesu hladiny markeru CA 125, zmenšenia rozsahu tumoru zobrazovacím vyšetrením a zlepšením klinického stavu pacientky [13].
Záver
Radikálna chirurgická liečba je najdôležitejším terapeutickým prvkom v primárnej liečbe pokročilého karcinómu ovária. U určitej skupiny pacientok s pokročilým ochorením a zlým stavom telesnej výkonnosti by bol daný zákrok rizikový. Preto je vhodné u danej skupiny pacientok začať liečbu štandardnou chemoterapiou v schéme paklitaxel a platinový derivát a podľa liečebnej odpovede zvážiť IDS. Správne načasovanie chirurgickej debalkizácie v liečbe pokročilého karcinómu ovária môže byť prognostický významné.
Autoři
deklarují, že v souvislosti s předmětem studie nemají žádné
komerční zájmy.
The
authors declare they have no potential conflicts of interest
concerning drugs, pruducts, or services
used in the study.
Redakční
rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro
publikace zasílané do biomedicínských
časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform
requirements” for biomedical papers.
MUDr. Marcela Tkáčová
I.
onkologická klinika LF UK a OÚSA
Heydukova
10
812
50 Bratislava
Slovenská
republika
e-mail:
lickovamarcela@yahoo.com
Sources
1. Safaei Diba Ch, Pleško I, Obšitniková A et al. Incidencia zhubných nádorov v Slovenskej republike 2005. Národný onkologický register SR, NCZI 2009.
2. Deo SVS, Hemant G, Shukla NK et al. Neoadjuvant chemotherapy followed by surgical cytoreduction in advanced epithelial ovarian cancer. Indian J Cancer 2006; 43(3): 117 – 121.
3. Vergote IB. Neoadjuvant chemotherapy in advanced ovarian cancer. American Society of Clinical Oncology. Educational Book 2004; 285 – 291.
4. Rose PG. Neoadjuvant chemotherapy for ovarian cancer. American Society of Clinical Oncology. Educational Book 2004; 276 – 284.
5. Bristow RE, Tomacruz RS, Armstrong DK et al. Survival effect of maximal cytoreductive surgery for advanced ovarian carcinoma during the platinum era: a metaanalysis. J Clin Oncol 2002; 20(5): 1248 – 1259.
6. Fader AN, Rose PG. Role of Surgery in Ovarian Cancer. J Clin Oncol 2007; 25(20): 2873 – 2880.
7. Le T, Shahriari L, Hopkins W et al. Prognostic significance of tumor necrosis in ovarian cancer patients treated with neoadjuvant chemotherapy and interval surgical debulking. Int J Gynecol Cancer 2006; 16 (3): 986 – 990.
8. Vergote I, De Wever I, Tjalma W et al. Neoadjuvant chemotherapy or primary debulking surgery in advanced ovarian carcinoma: a retrospective analysis of 285 patients. Gynecol Oncol 1998; 71 (3): 431 – 436.
9. Ansquer Y, Leblanc E, Clough K et al. Neoadjuvant chemotherapy for unresectable ovarian carcinoma ‑ a French multicenter study. Cancer 2001; 91 (12): 2329 – 2334.
10. Kuhn W, Rutke S, Späthe K et al. Neoadjuvant chemotherapy followed by tumor debulking prolongs survival for patients with poor prognosis in International Federation of Gynecology and Obstetrics Stage IIIC ovarian carcinoma. Cancer 2001; 92 (10): 2585 – 2591.
11. Kayikcioglu F, Kose MF, Boran N et al. Neadjuvant chemotherapy or primary surgery in advanced epithelial ovarian carcinoma. Int J Gynecol Cancer 2001; 11 (6): 466 – 470.
12. Mazzeo F, Berliere M, Kerger J et al. Neoadjuvant chemotherapy followed by surgery and adjuvant chemotherapyin patients with primarily unresectable, advanced‑stage ovarian cancer. Gynecol Oncol 2003; 90(1):163 – 169.
13. Krasner C, Duska L. Management of Women With Newly Diagnosed Ovarian cancer. Seminars in Oncology: Gynecol Cancer Update 2009; 36(2): 91 – 101.
14. Vergote I, van Gorp T, Amant F et al. Timing of debulking surgery in advanced ovarian cancer. Int J Gynecol Cancer 2008, 18 (Suppl 1): 11 – 19.
15. Thigpen T. The If and when of surgical debulking for ovarian carcinoma. N Engl J Med 2004; 351(24): 2544 – 2546.
16. Tesařik Z. Kontroverze v moderní léčbě pokročilého ovariálního karcinomu. Klin Onkol 2002; 15(4): 136 – 141.
17. Vergote I, van Gorp T, Amant F et al. Neoadjuvant chemotherapy for ovarian cancer. Oncology (Williston Park) 2005; 19(12): 1615 – 1622.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2009 Issue 6
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole vs. Tramadol in Postoperative Analgesia
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Komentár k vývoju konceptu prognostických faktorov chronickej lymfocytovej leukémie: Cesta od prognostických faktorov k prediktorom liečebnej odpovede
- Vakcinace proti chřipce u dospělých pacientů se solidními nádory
- Inhibítory aromatázy v prevencii rakoviny prsníka: možnosti aplikácie u premenopauzálnych žien
- Neo‑adjuvantná chemoterapia s následnou IDS (interval debulking surgery) v liečbe pokročilého karcinómu ovária – retrospektívna analýza
- Viditelnost na ultrasonografii jako nejsilnější prediktor invazivity u duktálních karcinomů in situ v retrospektivní studii
- Resekce pankreatu pro metastázy karcinomu ledviny
- Způsob života u onkologických pacientů – jak a kdy ho měnit?
- Chirurgie karcinomu prsu v České republice
- Dispenzarizace osob s familiárním výskytem kolorektálního karcinomu
- Hodnota zobrazenia 18- FDG PET/ CT u pacientov s atypickým metastatickým karcinómom – kazuistika: 18- FDG PET/CT pri kolorektálnych karcinómoch
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Neo‑adjuvantná chemoterapia s následnou IDS (interval debulking surgery) v liečbe pokročilého karcinómu ovária – retrospektívna analýza
- Inhibítory aromatázy v prevencii rakoviny prsníka: možnosti aplikácie u premenopauzálnych žien
- Vakcinace proti chřipce u dospělých pacientů se solidními nádory
- Dispenzarizace osob s familiárním výskytem kolorektálního karcinomu
