Tuberózní skleróza
Authors:
R. Vrtěl 1; H. Fillipová 1; R. Vodička 1; A. Šantavá 1; V. Curtisová 1; L. Foretová 2
Authors‘ workplace:
Ústav lékařské genetiky a fetální medicíny, FN Olomouc 2Oddělení epidemiologie a genetiky nádorů MOÚ, Brno
1
Published in:
Klin Onkol 2009; 22(Supplementum): 50-53
Recenze: Bartoš J., Benešová L., Bendlová B., Bendová M., Brančíková D., Bravencová Z., Cahová S., Eckschlager T., Ganevová M., Hajdúch M., Halámková J., Hořínová V., Hrabětová P., Holubec L., Kalábová R., Kiss I., Kleibl Z., Kohoutová M., Koudová M., Krutílková V., Křepelová A., Kubecová M., Melichar B., Minárik M., Musilová D., Mrázová I., Novotný J., Obermannová R., Ostřížková L., Palácová M., Petráková K., Plevová P., Pohlreich P., Puchmajerová A., Putzová M., Slavíček L., Šachlová M., Štekrová J., Štěpánková V., Vaňásek J., Vítek P., Zikán M., Zimovjanová M.
Zodpovědné geny: TSC1, TSC2
Typ dědičnosti: autozomálně dominantní
Genetické testování indikuje klinický genetik.
Pracoviště poskytující analýzu genu v ČR (pracovník odpovědný za analýzu genu):
Ústav lékařské genetiky a fetální medicíny, FN Olomouc, RNDr. R. Vrtěl, Ph.D., vrtel@fnol.cz
Charakteristika syndromu
Tuberózní skleróza je genetické onemocnění s incidencí odhadovanou až na 1 : 5 800 živě narozených, které se projevuje tvorbou benigních tumorů (hamartomů) nebo (hamarcií), postihujících četné orgánové systémy, nejčastěji kůži, mozek, ledviny a srdce. Postižen však může být prakticky jakýkoli orgánový systém. Typické pro onemocnění je značná variabilita symptomů a různá závažnost postižení. Rozdílná exprese je pozorována nejen u pacientů z různých rodin, ale rovněž mezi postiženými příbuznými téže rodiny. Mnoho klinických manifestací souvisí s věkem pacienta. V novorozeneckém období jsou časté rozsáhlé hamartomy, které mohou být příčinou úmrtí. V pozdějším věku může život ohrozit zejména těžká a na terapii obtížně reagující epilepsie a komplikace spojené s přítomností subependymálního obrovskobuněčného astrocytomu SEGA (asociovaný hydrocefalus). Postižení ledvin spolu s poškozením CNS mohou být příčinou mortality v adolescenci a dospělosti. V tomto období se jedná především o selhání ledvin, náhlé vnitřní krvácení z velkých hamartomů v ledvinách či mozku, vzácně i vznik renálního karcinomu. Zvětšující se angiomyolipomy (AML) nebo renální cysty mohou destrukcí renálního parenchymu vést až k renálnímu selhání. U žen ve věku 20 až 40 let může být fatální rovněž postižení plic lymfangioleiomyomatózou (LAM).
Dědičnost je autozomálně dominantní. Příčinná mutace je v jednom ze dvou tumor-supresorových genů. Gen TSC1, lokalizovaný na 9q34, kóduje hamartin, gen TSC2 je lokalizován na 16p13.3 a kóduje tuberin. Dvě třetiny případů vznikají jako nové mutace. Bylo popsáno přes tisíc mutací (cca 30% v genu TSC1 a 70% v genu TSC2). Tuberin reguluje malé G-proteiny (Rap1a, Rab5 a Rheb), dráhu translace, růstu a buněčné proliferace. Hamartin interaguje s rodinou aktin vázajících proteinů (ezrin radixin moesin), rovněž reguluje buněčný cyklus interakcí s CDK. Hamartin s tuberinem tvoří heterodimery – společně regulují buněčnou proliferaci.
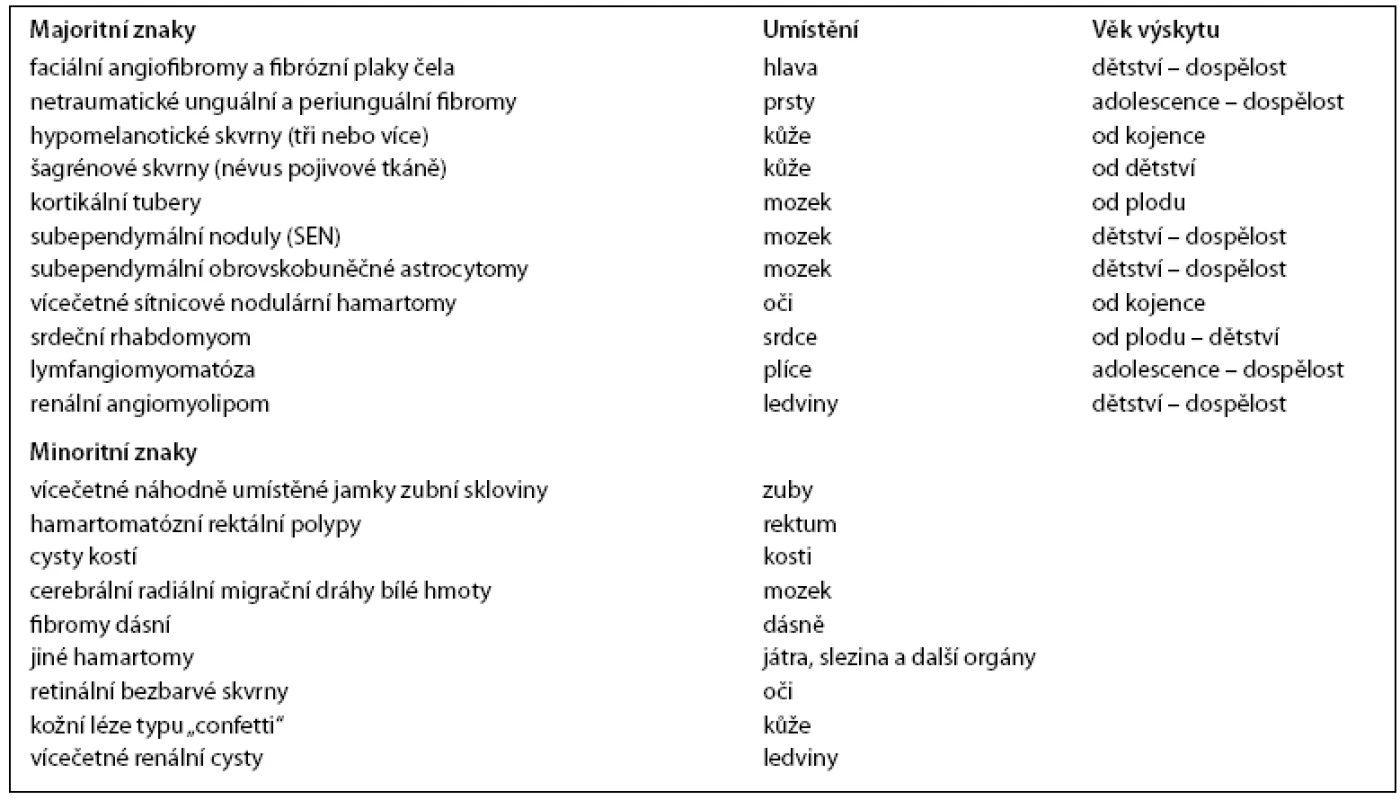
Extrémní variabilita exprese je částečně dána typem mutace a náhodným výskytem mutace druhé alely tumor-supresoru. Diagnóza je stanovena na základě kombinace typických symptomů. Uvedená nová kritéria jsou dle autorů E. S. Roach a S. P. Sparagana [57].
Při výskytu lymfangiomyomatózy a renálního angiomyolipomu musí být přítomny další TSC znaky pro stanovení TSC diagnózy (oba dohromady považovány za 1 majoritní znak)!
Definitivní diagnóza TSC je dána přítomností
- buď dvou majoritních znaků nebo
- jednoho majoritního a dvou minoritních znaků.
Pravděpodobná diagnóza TSC je dána přítomností:
- jednoho majoritního a jednoho minoritního znaku.
Možná diagnóza TSC je při přítomnosti:
- buď jednoho majoritního nebo
- dvou či více minoritních znaků.
Pozn.: Epileptické záchvaty ani infantilní křeče nově nejsou zahrnovány mezi diagnostická kritéria vzhledem k nespecifičnosti a různorodosti původu.
Kompletní diagnostické vyšetření v případě podezření na TSC zahrnuje [19]
- osobní a rodinnou anamnézu zaměřením na znaky TSC
- kožní vyšetření Woodovou lampou (pro odhalení hypomelanotických skvrn), prohlídka prstů (unguální fibromy), kontrola obličeje (angiofibromy) a úst (dentální jamky a fibromy dásní)
- CT případně MRI vyšetření hlavy (kortikální tubery a SEN)
- EEG, zejména při přítomnosti epilepsie
- ultrazvuk ledvin (AML a cysty)
- echokardiogram v kojeneckém období (rhabdomyom)
- fundoskopie (sítnicové nodulární hamartomy a achromatické skvrny)
- hodnocení chování a neurologického vývoje
- CT hrudi u adultních žen
Indikace k vyšetření genu: Klinické podezření na podkladě výše uvedených symptomů.
Familiární výskyt: Indikováno u příbuzných osob TSC pacientů, kteří mají riziko nosičství mutace TSC genu.
Sporadický výskyt: Vyšetření indikováno u osob v případě, že splňují indikační kritéria dle tab. 1.
Testování je indikováno genetikem po genetickém poradenství a podepsání informovaného souhlasu.
Prediktivní vyšetření je možné i v dětství.
Prenatální diagnostika je možná vazebnou analýzou nebo přímou analýzou v rodině s odhalenou kauzální mutací.
Preimplantační diagnostika je možná v závažných případech ve vybraných pracovištích po konzultaci s klinickým genetikem.
Doporučení ke sledování příbuzných (nosičů v rodinách s prokázanou mutací i příbuzných v rizikových rodinách s neprokázanou mutací).
Prevence
Vyžaduje multidisciplinární tým lékařů: neurolog, oftalmolog, dermatolog, genetik, kardiolog, nefrolog, pulmolog, psychiatr, psycholog aj.
V případě odhalení kauzální mutace, nebo při vyslovení klinické diagnózy TSC je vhodné provést doporučená vyšetření. Doporučena je dispenzární péče neurologa, nefrologa, oftalmologa, dermatologa, pneumologa, v neonatálním období a v dětství také péče kardiologa.
DNA diagnostika je velmi náročná a ne vždy se podaří příčinnou mutaci odhalit. Pro umožnění vazebné analýzy bývá třeba vyšetřit dle výše uvedených kritérií příbuzné v riziku.
Úpravy preventivního schématu jsou vhodné dle rodinné anamnézy.
Vyšetření, zda má pacient problémy vyžadující pozornost jak při 1. návštěvě, tak při následných kontrolách týkající se:
- epilepsie
- neurologických problémů
- srdečních symptomů
- kožních lézí
- ledvinných komplikací
- plicních problémů
- vývojových a psychologických problémů
Návrh prevence –The Tuberous Sclerosis Consensus Conference, July, 1998
- podrobná osobní anamnéza s ohledem na možné příznaky TS
- kraniální CT/NMR po 1–3 letech u dětí a adolescentů
- renální ultrazvuk každoročně, po půl roce v případě angiomyolipomů do 4cm
- renální CT/NMR, pokud jsou zjištěny velké nebo četné nádory ledvin
- oční vyšetření ročně
- EKG a echokardiografie u srdečních problémů
- neurologické a vývojové hodnocení při nástupu do školy, dále v případě problémů
- EEG v případě epilepsie
- CT hrudníku v případě plicních problémů
Vzhledem k tomu, že retinální léze způsobují progresivní poruchu vízu vzácně, stačí běžné oční kontroly.
Rutinní kožní kontroly většinou nejsou potřebné. U jedinců, kteří potřebují léčbu, je vhodné sledování specialistou.
Vyšetření u příbuzných v riziku
- genetické vyšetření a rodinná anamnéza
- klinické vyšetření včetně fundoskopie a kožního vyšetření s UV lampou
- CT nebo NMR mozku
Doporučení pro epilepsii
- zhodnocení současných záchvatů
- přezkoumání současné antiepileptické medikace
- v případě potřeby provést EEG
Doporučení pro neurologické problémy
- provést urgentní scan mozku (NMR nebo CT), jestliže příznaky naznačují zvýšený intrakraniální tlak nebo při fokálních neurologických symptomech
- jinak kontrola 1krát za 1–3 roky
Doporučení pro kardiální vyšetření
- novorozenecké EKG
- EKG v případě arytmie, preoperativně nebo v případě nevysvětlitelné ztráty vědomí
Doporučení pro kožní léze
- zvážení léčby faciálních angiofibromů a dalších kožních lézí
Doporučení pro sledování renální choroby
- každoroční kontrola krevního tlaku
- pravidelná kontrola renálních funkcí u dospělých a dětí s PKD
- test renální funkce při přítomnosti angiomyolipomů
- každoroční renální UZ při lézích, nebo je li to indikováno, jinak pravidelně 1krát za 1–3 roky
- odeslat ke specialistovi při zřetelné hematurii
- odeslat ke specialistovi při zamýšlené léčbě renální léze
- závažné renální léze s nízkým obsahem tuku (dle UZ) je třeba pečlivě vyšetřit odborníkem
Doporučení pro pulmonální problémy
U symptomatických případů respiratorní vyšetření včetně:
- spirometrie
- RTG hrudníku
- vysoce rozlišovací CT
interval kontroly 6–12 měsíců
Doporučení pro hodnocení vývoje
- při podezření na opoždění vývoje zhodnotit intelektuální a kognitivní profil pro včasné identifikování a řešení problémů (ve věku 2–3 a 7–8 roků)
- kontaktovat specialistu
- pravidelné kontroly s vyšetřením na pervazivní vývojové poruchy minimálně ve věku 2, 4, 7 a 15 let
- zvážit sociální pomoc
doc. RNDr. Radek Vrtěl, Ph.D.
Ústav lékařské genetiky a fetální
medicíny
Fakultní nemocnice Olomouc
I. P. Pavlova 6
775 20 Olomouc
e-mail: vrtel@fnol.cz
Sources
1. Ahlsén G, Gilberg IC, Lindblom R et al. Tuberous sclerosis in Western Sweden. Arch Neurol 1994; 51 : 76–81.
2. Ali JB, Sepp T, Ward S et al. Mutations in the TSC1 gene account for a minority of patients with tuberous sclerosis. J Med Genet 1998; 35 : 969–972.
3. Al-Saleem T, Wessner LL, Scheithauer BW et al. Malignant tumors of the kidney, brain, and soft tissues in children and young adults with the tuberous sclerosis complex. Cancer 1998; 83(10): 2208–2216.
4. Asano E, Chugani DC, Muzik O et al. Multimodality imaging for improved detection of epileptogenic foci in TSC. Neurology 2000; 54 : 1976–1984.
5. Astrinidis A, Khare L, Carsillo T et al. Mutational analysis of the tuberous sclerosis gene TSC2 in patients with pulmonary lymphangioleiomyomatosis. J Med Genet 2000; 37(1): 55–57.
6. Au KS, Rodriguez JA, Finch J et al. Germ line mutational analysis of the TSC2 gene in 90 tuberous sclerosis patients. Am J Hum Genet1998; 62 : 286–294.
7. Au KS, Rodriguez JA, Rodriguez E et al. Mutations and polymorphisms in the tuberous sclerosis complex gene on chromosome 16. Hum Mut 1997; 9 : 23–29.
8. Au KS, Williams AT, Gambello MJ et al. Molecular genetic basis of tuberous sclerosis complex: from bench to bedside. J Child Neurol 2004; 19(9): 699–709. Review.
9. Au KS, Williams AT, Roach ES et al. Genotype/phenotype correlation in 325 individuals referred for a diagnosis of tuberous sclerosis complex in the United States. Genet Med 2007; 9(2): 88–100.
10. Baron Y, Barkovich AJ. MR imaging of tuberous sclerosis in neonates and young infants. AJNR Am J Neuroradiol 1999; 20 : 907–916.
11. Bernstein J. Renal cystic disease in the tuberous sclerosis complex. Pediatr Nephrol 1993; 7 : 490–495. Review.
12. Bjornsson J, Short MP, Kwiatkowski DJ et al. Tuberous sclerosis associated renal cell carcinoma. Clinical, pathological, and genetic features. Am J Pathol 1996; 149 : 1201–1208.
13. Brook-Carter PT, Peral B, Ward CJ et al. Deletion of the TSC2 and PKD1 genes associated with severe infantile polycystic kidney disease – a contiguous gene syndrome. Nature Genet 1994; 8 : 328–332.
14. Carbonara C, Longa L, Grosso E et al. 9q34 loss of heterozygosity in a tuberous sclerosis astrocytoma suggests a growth suppressor like activity also for the TSC1 gene. Hum Mol Genet1994, 3(10): 1829–1832.
15. Carsillo T, Astrinidis A, Henske EP. Mutations in the tuberous sclerosis complex gene TSC2 are a cause of sporadic pulmonary lymphangioleiomyomatosis. Proc Natl Acad Sci U. S. A 2000, 97 : 6085–6090.
16. Castro M, Shepherd CW, Gomez MR et al. Pulmonary tuberous sclerosis. Chest 1995; 107 : 189–195.
17. Connolly MB, Hendson G, Steinbok P. Tuberous sclerosis complex: a review of the management of epilepsy with emphasis on surgical aspects. Childs Nerv Syst; 22(8): 896–908. Epub 2006 Jun 13. Review.
18. Costello LC, Hartman TE, Ryu JH. High frequency of pulmonary lymphangioleiomyomatosis in women with tuberous sclerosis complex. Mayo Clin Proc 2000; 75 : 591–594.
19. Crino PB, Nathanson KL, Henske EP. The tuberous sclerosis complex. N Engl J Med 2006; 355(13): 1345–1356. Review.
20. Crooks DM, Pacheco-Rodriguez G, DeCastro RM et al. Molecular and genetic analysis of disseminated neoplastic cells in lymphangioleiomyomatosis. Proc Natl Acad Sci U. S. A 2004; 101(50): 17462–17467.
21. Curatolo P, Porfirio MC, Manzi B et al. Autism in tuberous sclerosis. Eur J Paediatr Neurol 2004; 8(6): 327–332. Review.
22. Dabora SL, Jozwiak S, Franz DN et al. Mutational analysis in a cohort of 224 tuberous sclerosis patients indicates increased severity of TSC2, compared with TSC1, disease in multiple organs. Am J Hum Genet 2001; 68(1): 64–80.
23. Devlin LA, Shepherd CH, Crawford H et al. Tuberous sclerosis complex: clinical features, diagnosis, and prevalence within Northern Ireland. Dev Med Child Neurol 2006; 48(6): 495–499.
24. Ewalt DH, Sheffield E, Sparagana SP et al. Renal lesion growth in children with tuberous sclerosis complex. J Urol 1998; 160(1): 141–145.
25. Franz DN, Leonard J, Tudor C et al. Rapamycin causes regression of astrocytomas in tuberous sclerosis complex. Ann Neurol 2006; 59(3): 490–498.
26. Gomez MR. Tuberous Sclerosis. New York: Raven Press 1999.
27. Goncharova EA, Goncharov DA, Lim PN et al. Modulation of cell migration and invasiveness by tumor suppressor TSC2 in lymphangioleiomyomatosis. Am J Respir Cell Mol Biol 2006; 34(4): 473–480.
28. Goodman M, Lamm SH, Engel A et al. Cortical tuber count: a biomarker indicating neurologic severity of tuberous sclerosis complex. J Child Neurol 1997; 12 : 85–90.
29. Harrison JE, O‘Callaghan FJ, Hancock E et al. Cognitive deficits in normally intelligent patients with tuberous sclerosis. Am J Med Genet 1999; 88 : 642–646.
30. Henske EP, Neumann HP, Scheithauer BW et al. Loss of heterozygosity in the tuberous sclerosis (TSC2) region of chromosome band 16p13 occurs in sporadic as well as TSC associated renal angiomyolipomas. Genes Chromosomes Cancer 1995; 13(4): 295–298.
31. Henske EP, Scheithauer BW, Short MP et al. Allelic loss is frequent in tuberous sclerosis kidney lesions but rare in brain lesions. Am J Hum Genet 1996; 59 : 400–406.
32. Henske EP, Wessner LL, Golden J et al. Loss of tuberin in both subependymal giant cell astrocytomas and angiomyolipomas supports a two hit model for the pathogenesis of tuberous sclerosis tumors. Am J Pathol 1997; 151 : 1639–1647.
33. Herron J, Darrah R, Quaghebeur G. Intra-cranial manifestations of the neurocutaneous syndromes. Clin Radiol 2000; 55(2): 82–98. Review.
34. Hirasaki S, Koide N, Ogawa H et al. Tuberous sclerosis associated with multiple hepatic lipomatous tumors and hemorrhagic renal angiomyolipoma. Intern Med 1999; 38 : 345–348.
35. Holley DG, Martin GR, Brenner JI et al. Diagnosis and management of fetal cardiac tumors: a multicenter experience and review of published reports. J Am Coll Cardiol 1995; 26 : 516–520.
36. Hosoya M, Naito H, Nihei K. Neurological prognosis correlated with variations over time in the number of subependymal nodules in tuberous sclerosis. Brain Dev 1999; 21 : 544–547.
37. Hung CC, Su YN, Chien SC et al. Molecular and clinical analyses of 84 patients with tuberous sclerosis complex. BMC Med Genet 2006; 7 : 72.
38. Hunt A, Lindenbaum RH. Tuberous sclerosis: A new estimate of prevalence within the Oxford region. J Med Genet 1984; 21 : 272–277.
39. Jambaqué I, Cusmai R, Curatolo P et al. Neuropsychological aspects of tuberous sclerosis in relation to epilepsy and MRI findings. Dev Med Child Neurol 1991; 33 : 698–705.
40. Jones AC, Daniells CE, Snell RG et al. Molecular genetic and phenotypic analysis reveals differences between TSC1 and TSC2 associated familial and sporadic tuberous sclerosis. Hum Mol Genet 1997; 6 : 2155–2161.
41. Jones AC, Shyamsundar MM, Thomas MW et al. Comprehensive mutation analysis of TSC1 and TSC2-and phenotypic correlations in 150 families with tuberous sclerosis. Am J Hum Genet 1999; 64(5): 1305–1315. Review.
42. Jozwiak J, Jozwiak S. Giant cells: contradiction to two hit model of tuber formation? Cell Mol Neurobiol 2007; 27(2): 251–261.
43. Jozwiak S, Kotulska K, Kasprzyk-Obara J et al. Clinical and genotype studies of cardiac tumors in 154 patients with tuberous sclerosis complex. Pediatrics 2006; 118(4): e1146–e1151.
44. Jozwiak S, Schwartz RA, Janniger CK et al. Skin lesions in children with tuberous sclerosis complex: their prevalence, natural course, and diagnostic significance. Int J Dermatol 1998; 37 : 911–917.
45. Karbowniczek M, Yu J, Henske EP. Renal angiomyolipomas from patients with sporadic lymphangiomyomatosis contain both neoplastic and non neoplastic vascular structures. Am J Pathol 2003; 162(2): 491–500.
46. Knudson AGJ. Mutation and cancer; statistical study of retinoblastoma. Proc Natl Acad Sci U.S.A. 1971; 68 : 820–823.
47. Krymskaya VP. Tumour suppressors hamartin and tuberin: intracellular signalling. Cell Signal 2003; 15(8): 729–739. Review.
48. Kwiatkowska J, Jozwiak S, Hall F et al. Comprehensive mutational analysis of the TSC1 gene: observations on frequency of mutation, associated features, and nonpenetrance. Ann Hum Genet 1998; 62 : 277–285.
49. Kwiatkowski DJ. Tuberous sclerosis: from tubers to mTOR. Ann Hum Genet 2003; 67(Pt 1): 87–96. Review.
50. Lindor NM, Greene M, for the Mayo Familial Cancer Program. The concise handbook of family cancer syndromes. J Natl Cancer Inst 1998; 90 : 1039–1071.
51. Mitchell AL, Parisi MA, Sybert VP. Effects of pregnancy on the renal and pulmonary manifestations in women with tuberous sclerosis complex. Genet Med 2003; 5(3): 154–160.
52. Moss J, Avila NA, Barnes PM et al. Prevalence and clinical characteristics of lymphangioleiomyomatosis (lam) in patients with tuberous sclerosis complex. Am J Respir Crit Care Med 2001; 164 : 669–671.
53. Niida Y, Stemmer-Rachamimov AO, Logrip M et al. Survey of somatic mutations in tuberous sclerosis complex (TSC) hamartomas suggests different genetic mechanisms for pathogenesis of TSC lesions. Am J Hum Genet 2001; 69 : 493–503.
54. Nir A, Tajik AJ, Freeman WK et al. Tuberous sclerosis and cardiac rhabdomyoma. Am J Cardiol 1995; 76 : 419–421.
55. Osborne JP, Jones AC, Burley MW et al. Non-penetrance in tuberous sclerosis. Research Letters. Lancet 2000; 355 : 1698–1698.
56. Patel U, Simpson E, Kingswood JC et al. Tuberose sclerosis complex: analysis of growth rates aids differentiation of renal cell carcinoma from atypical or minimal-fat-containing angiomyolipoma. Clin Radiol 2005; 60(6): 665–673.
57. Roach ES, Sparagana SP. Diagnosis of tuberous sclerosis complex. J Child Neurol 2004; 19 : 643–649.
58. Rosner M, Freilinger A, Hengstschlager M. Proteins interacting with the tuberous sclerosis gene products. Amino Acids 2004; 27 : 119–128.
59. Rowley SA, O‘Callaghan FJ, Osborne JP. Ophthalmic manifestations of tuberous sclerosis: a population based study. Br J Ophthalmol 2001; 85(4): 420–423.
60. Sampson JR, Jones A, Maheshwar M et al. Excess of TSC2 over TSC1 mutations in tuberous sclerosis and evidence for phenotype difference. Eur J Hum Genet 1998; 6 (Suppl 1): 61.
61. Sampson JR, Scahill SJ, Stephenson JBP et al. Genetic aspects of tuberous sclerosis in the West of Scotland. J Med Genet 1989; 26 : 28–31.
62. Sancak O, Nellist M, Goebloed M et al. Mutational analysis of the TSC1 and TSC2 genes in diagnostic setting: genotype-phenotype correlations and comparsion of diagnostic DNA techniques in Tuberous Sclerosis Complex. Eur J Hum Genet 2005; 13 : 731–741.
63. Shepherd CW, Gomez MR, Lie JT et al. Causes of death in patients with tuberous sclerosis. Mayo Clin Proc 1991; 66 : 792–796.
64. Smalley SL, Burger F, Smith M. Phenotypic variation of tuberous sclerosis in a single extended kindred. J Med Genet 1994; 31 : 761–765.
65. Smalley SL. Autism and tuberous sclerosis. J Autism Dev Disord 1998; 28 : 407–414. Review.
66. Smolarek TA, Wessner LL, McCormackm FX et al. Evidence that lymphangiomyomatosis is caused by TSC2 mutations: chromosome 16p13 loss of heterozygosity in angiomyolipomas and lymph nodes from women with lymphangiomyomatosis. Am J Hum Genet 1998; 62(4): 810–815.
67. Suzuki K, Ogura T, Yokose T et al. Loss of heterozygosity in the tuberous sclerosis gene associated regions in adenocarcinoma of the lung accompanied by multiple atypical adenomatous hyperplasia. Int J Cancer 1998; 79 : 384–389.
68. The European Chromosome 16 Tuberous Sclerosis Consortium: Identification and Characterization of the Tuberous Sclerosis Gene on Chromosome 16. Cell 1993; 75 : 1305–1315.
69. Torres OA, Roach ES, Delgado MR et al. Early diagnosis of subependymal giant cell astrocytoma in patients with tuberous sclerosis. J Child Neurol 1998; 13(4): 173–177.
70. van Slegtenhorst M, de Hoogt R, Hermans C. Identification of the tuberous sclerosis gene TSC1 on chromosome 9q34. Science 1997; 277 : 805–808.
71. Verhaaren HA, Vanakker O, De Wolf D et al. Left ventricular outflow obstruction in rhabdomyoma of infancy: meta analysis of the literature. J Pediatr 2003; 143(2): 258–263.
72. Verhoef S, Bakker L, Tempelaars AM et al. High rate of mosaicism in tuberous sclerosis complex. Am J Hum Genet 1999; 64 : 1632–1637.
73. Verhoef S, Vrtel R, van Essen T et al. Somatic masaicism and clinical variation in tuberous sclerosis complex. Lancet 1995; 345 : 202.
74. Webb DW, Clarke A, Fryer A et al. The cutaneous features of tuberous sclerosis: a population study. Br J Dermatol 1996; 135 : 1–5.
75. Webb DW, Thomas RD, Osborne JP. Cardiac rhabdomyomas and their association with tuberous sclerosis. Arch Dis Child 1993; 68 : 367–370.
76. Wienecke R, Fackler I, Linsenmaier U et al. Antitumoral activity of rapamycin in renal angiomyolipoma associated with tuberous sclerosis complex. Am J Kidney Dis 2006; 48(3): e27–e29.
77. Yates JRW. Tuberous sclerosis. Eur J Hum Genet 2006; 14 : 1065–1073.
78. Yu J, Astrinidis A, Henske EP. Chromosome 16 loss of heterozygosity in tuberous sclerosis and sporadic lymphangiomyomatosis. Am J Respir Crit Care Med 2001; 164(8 Pt 1): 1537–1540.
79. Zaroff CM, Devinsky O, Miles D, Barr WB. Cognitive and behavioral correlates of tuberous sclerosis complex. J Child Neurol 2004; 19(11): 847–852.
80. Zimmerhackl LB, Rehm M, Kaufmehl K et al. Renal involvement in tuberous sclerosis complex: a retrospective survey. Pediatr Nephrol 1994; 8 : 451–457.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2009 Issue Supplementum
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Safety and Tolerance of Metamizole in Postoperative Analgesia in Children
-
All articles in this issue
- Syndrom hereditárního karcinomu prsu a ovarií
- Hereditární nepolypózní kolorektální karcinom (HNPCC, Lynchův syndrom)
- Familiární adenomatózní polypóza
- Syndrom Li-Fraumeni
- Von Hippel-Lindauova choroba
- Mnohočetná endokrinní neoplazie typ 1 – syndrom MEN 1
- Mnohočetná endokrinní neoplazie typ 2 – syndrom MEN 2
- Syndrom familiárního melanomu (s dysplastickými naevy či bez nich)
- Gorlinův syndrom
- Peutz-Jeghersův syndrom
- Přehled syndromů spojených s rizikem nádorů dětského věku
- Tuberózní skleróza
- Hereditární pankreatitida
- Cowdenův syndrom
- Doporučení k provedení profylaktické operace pro snížení rizika gynekologických malignit u žen s hereditárním rizikem
- Současné vyšetřovací metody v diagnostice a sledování familiárních polypóz. Vyšetření tenkého střeva
- Limitace genetického testování v onkologii
- Předpoklady pro preimplantační genetickou diagnostiku (PGD) u nosičů mutací v nádorových predispozičních genech
- Komentář: Preimplantační genetická diagnostika
- Komentář: Možnosti asistované reprodukce při kontrole přenosu rizikových genů na děti
- Komentář: Preimplantační genetická diagnostika
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Hereditární pankreatitida
- Gorlinův syndrom
- Mnohočetná endokrinní neoplazie typ 2 – syndrom MEN 2
- Mnohočetná endokrinní neoplazie typ 1 – syndrom MEN 1
