Velmi malé karcinomy prsu, HER2-pozitivní a léčba trastuzumabem v adjuvanci
Very Small Breast Cancer, HER2 Positive, and Trastuzumab in Adjuvant Treatment
Breast cancer patients with a tumor size of ≤ 1 cm are still rare but their number is increasing as a consequence of mammary screening. It is logical that the best adjuvant treatment in such cancers is often discussed with respect to the risk of relapse of the disease. The number of patients in clinical trials with very small breast cancer is quite low, and a specific clinical trial for such patients is not planned. Retrospective analysis of some clinical trials which included patients with breast cancer and with very small size shows the worse prognosis of patients with HER2 positive tumors. Indirectly, we can assume the application of adjuvant treatment with trastuzumab in such very small breast cancer. However, the decision should be individual with regards to further risk factors for the disease and risk of the treatment itself. This article is more a contemplation in order to provoke discussion on this provocative subject.
Key words:
breast cancer – very small tumors – trastuzumab – adjuvant treatment
Authors:
R. Vyzula
Authors‘ workplace:
Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno
Published in:
Klin Onkol 2010; 23(1): 21-24
Category:
Reviews
Overview
Pacientky s karcinomem prsu ≤ 1 cm jsou sice stále vzácné, ale v důsledku fungujícího mamárního screeningu jejich počet roste. Vhodná adjuvantní léčba u těchto pacientek je v dnešní době opakovaně často diskutována s ohledem na riziko relapsu onemocnění. V klinických studiích je zastoupení velmi malých nádorů méně časté a samotná klinická studie na adjuvantní léčbu velmi malých nádorů se neplánuje. Bližší retrospektivní analýza studií, které mají v malém počtu zahrnuty i velmi malé nádory, ukazuje na horší prognózu těchto pacientek v případě přítomnosti pozitivity HER2. Nepřímo lze tedy usuzovat na vhodnost adjuvantní léčby s přítomností trastuzumabu i u takto malých nádorů prsu. Rozhodnutí však musí být individuální s ohledem na ostatní rizika onemocnění a rizika samotné léčby pro danou pacientku. Článek je spíše úvahou k vyvolání diskuze na toto provokativní téma.
Klíčová slova:
karcinom prsu – velmi malé nádory – trastuzumab – adjuvantní léčba
Přes dosažené pokroky a rozšiřující se portfolio léčebných možností je karcinom prsu v okamžiku, kdy vzniknou vzdálené metastázy, nadále nevyléčitelným onemocněním. Je proto důležitá správná indikace adjuvantní léčby, která může vzniku metastáz zabránit, a zvýšit tak šanci nemocných na vyléčení. K nejdůležitějším kritériím při indikaci adjuvantní léčby patří, mimo jiné, stadium nemoci, zahrnující velikost nádoru, přítomnost nebo nepřítomnost infiltrace nádorovým onemocněním lymfatických uzlin, diferenciaci nádorových buněk (G), přítomnost steroidních receptorů a přítomnost růstového receptoru HER2. Se zavedením mammografického screeningu stoupá podíl nemocných s nádory stadia I, tedy s nádory do 2cm a s negativním postižením lymfatických uzlin. Často jsou zachyceny i nádory menší než 1cm (T1a, T1b). Navzdory výsledkům četných klinických studií se názor na standardní adjuvantní léčbu u pacientek s takto malými nádory kontinuálně mění. Randomizované klinické studie se většinou zabývají nádory většími než 1cm a menší nádory jsou zařazovány jen v mizivém procentu. Hanrahan et al [6] v roce 2006 publikovali přehled, který se zabývá prognózou nemocných s nádory T1a,b N0, které neměly systémovou adjuvantní léčbu. Zatímco některé studie uvádějí 90% desetileté přežití bez relapsu, při negativních prognostických faktorech, zejména při nízké diferenciaci (G3) nebo lymfovaskulární invazi, klesá desetileté přežití bez relapsu až na 75%. Autoři proto doporučují u těchto nemocných podání adjuvantní chemoterapie a její zvážení u ostatních nemocných s ohledem na další prognostické faktory. Rovněž v konsenzu odborníků ze St. Gallen [4] je doporučována adjuvantní léčba u nemocných se středním rizikem. Při negativních uzlinách je střední riziko dáno přítomností alespoň jednoho z následujících faktorů: nádor větší než 2cm, grade 2–3, přítomnost extenzivní perivaskulární invaze, negativita hormonálních receptorů, pozitivita HER2 a věk pod 35 let.
Jak je uvedeno výše, je střední riziko, při kterém je doporučována systémová adjuvantní léčba, dáno již samotnou HER2-pozitivitou nádoru. Má být součástí této léčby i blokáda HER2? Do studií hodnotících adjuvantní léčbu trastuzumabem byly zařazovány i nemocné s negativními uzlinami a nádory většími než 1cm a adjuvantní léčba trastuzumabem se u těchto nemocných obecně doporučuje. Jiná je ovšem situace u nemocných s nádory menšími než 1cm. Tyto nemocné do studií zařazovány nebyly, data o účinnosti trastuzumabu u této podskupiny nemocných tedy nejsou k dispozici.
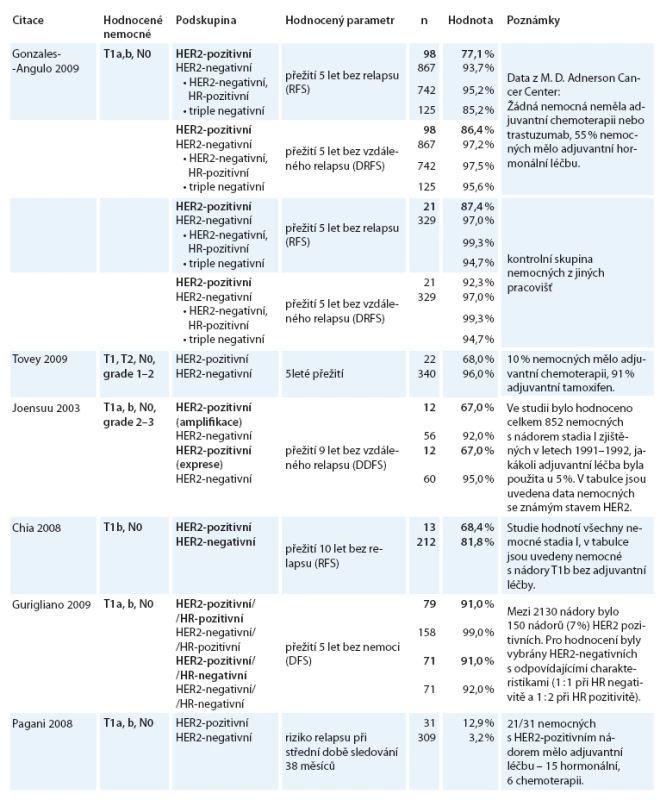
V odborné literatuře se objevují práce [2,3,5,7,8,11], které retrospektivně hodnotí výsledky léčby u žen s malými nádory a negativním postižením uzlin. Výsledky těchto analýz shrnuje tabulka. HER2 pozitivita je i v případě nádorů menších než 1cm spojena s dvou až pětinásobně vyšším rizikem relapsu ve srovnání s nádory HER2-negativními. Trastuzumab v těchto klinických studiích, nebyl aplikován. Pouze Rodrigues et al [10] retrospektivně hodnotili výsledky léčby 75 nemocných s nádory menšími než 1cm. 31 nemocných bylo léčeno adjuvantní chemoterapií a trastuzumabem a při střední době sledování 25 měsíců nebyl zaznamenán žádný případ relapsu, avšak u 44 nemocných bez adjuvantní léčby byly 3 případy relapsu, z toho jeden případ fatální.
Tato data hodnotí ve svém editorialu Burstein a Winer [1]. Konstatují, že v současné době neexistují přímé důkazy, že trastuzumab povede ke snížení četností relapsů u skupiny nemocných s velmi malými nádory a HER2-pozitivitou, je však k dispozici řada nepřímých dat týkajících se prognózy pacientek, a tím vyvolávají otázku oprávněnosti jeho podání. Bližší analýza dat klíčových studií z tabulky ukazuje, že snížení rizika relapsu při podální trastuzumabu je reálně možné. Proto se stále častěji setkáváme s názory vedoucími ke zvážení podání chemoterapie + trastuzumab i u velmi malých nádorů karcinomu prsu, ale po vyhodnocení dalších rizikových faktorů. Výskyt nádorů o velikosti 5mm a méně je nadále nízký, hodnocení rizika relapsu je sice obtížné, lze však předpokládat, že bude nižší než u větších nádorů – s ohledem na rizika spojená s podáním adjuvantní chemoterapie nelze její podání u tak malých nádorů doporučit. Tyto závěry se odrážejí i v současných doporučeních NCCN, kdy pro nádory o velikosti 0,6–1cm a pro nádory menší s pN1mi doporučují zvážení adjuvantní chemoterapie a trastuzumab, ale u nádorů ≤ 5mm a negativním postižení uzlin se o jeho podání neuvažuje.
Burstein s Winerem [1] rovněž diskutují o možnosti použití režimů méně náročných, než jsou běžně užívané režimy pro adjuvantní léčbu pokročilejších nádorů. Protože provedení velké randomizované studie u nemocných s malými nádory je nereálné, zahájili prospektivní studii hodnotící režim s paklitaxelem + trastuzumabem podávaným po dobu 12 týdnů s následnou monoterapií trastuzumabem. Výsledky budou porovnány s historickými kontrolami.
Závěrem této krátké úvahy lze konstatovat, že s možnostmi časného záchytu nádoru se zvyšuje podíl nemocných s nádory stadia I. V randomizovaných studiích adjuvantní léčby jsou však tyto nemocné zastoupeny v menšině a nemocné s nádory do 1cm byly do studií zařazovány jen výjimečně. Dostupné analýzy ukazují, že i u těchto nemocných dochází k relapsu onemocnění a riziko relapsu úměrně stoupá s přítomností rizikových faktorů. Jedním z rizikových faktorů je i HER2 pozitivita. Ačkoli nejsou k dispozici žádná data, která by jednoznačně ukazovala na prospěšnost adjuvantní léčby nemocných s malými HER2 pozitivními nádory, je vhodné i u těchto nemocných zvážit také další rizikové faktory, jako jsou histopatologický stupeň, stav hormonálních receptorů, vaskulární invaze na straně jedné a rizika vyplývající z podání léčby na straně druhé, a i těmto nemocným individuálně adjuvantní léčbu včetně léčby trastuzumabem nabídnout. Je jasné, že toto téma vyžaduje další bližší studium, ale již dnes je určitě vhodné navodit diskuzi o možnostech léčby i pro tyto pacientky.
Autor
deklaruje, že v souvislosti s předmětem studie nemá žádné
komerční zájmy.
The
author declares he has no potential conflicts of interest concerning
drugs, pruducts, or services
used in the study.
Redakční
rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro
publikace zasílané do biomedicínských
časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform
requirements” for biomedical papers.
prof.
MUDr. Rostislav Vyzula, CSc.
Klinika
komplexní onkologické péče
Masarykův
onkologický ústav
Žlutý
kopec 7
656
53 Brno
e-mail:
vyzula@mou.cz
Sources
1. Burstein HJ, Winer EP. Refining therapy for human epidermal growth factor receptor 2 - positive breast cancer: T stands for trastuzumab, tumor size, and treatment strategy. J Clin Oncol 2009; 27(34): 5671 – 5673.
2. Chia S, Norris B, Speers C et al. Human Epidermal Growth Factor Receptor 2 Overexpression as a Prognostic Factor in a Large Tissue Microarray Series of Node ‑ Negative Breast Cancers. J Clin Oncol 2008; 26(35): 5697 – 5704.
3. Curigliano G, Viale G, Bagnardi V et al. Clinical relevance of HER2 overexpression/ amplification in patients with small tumor size and node ‑ negative breast cancer. J Clin Oncol 2009; 27(34): 5693 – 5699.
4. Goldhirsch A, Wood WC, Gerber RD et al. Progress and promise: highlights of the international expert consensus on the primary therapy of early breast cancer 2007. Ann Oncol 2007; 18(7): 1133 – 1144.
5. Gonzalez ‑ Angulo AM, Litton JK, Broglio KR et al. High Risk of Recurrence for Patients with Breast Cancer who Have Human Epidermal Growth Factor Receptor 2 - Positive, Node ‑ Negative Tumors 1 cm or Smaller. J Clin Oncol 2009; 27(34): 5700 – 5706.
6. Hanrahan EO, Valero V, Gonzales ‑ Angulo AM et al. Prognosis and Management of Patients with Node ‑ Negative Invasive Breast Carcinoma That Is 1 cm or Smaller in Size (stage 1; T1a,bN0M0): A Review of the Literature. J Clin Oncol 2006; 24(13): 2113 – 2122.
7. Joensuu H, Idoly J, Lundin M et al. Amplification of erbB2 and erbB2 Expression Are Superior to Estrogen Receptor Status As Risk Factors for Distant Recurrence in pT1N0M0 Breast Cancer: A Nationwide Population‑based Study. Clin Cancer Res 2003; 9(3): 923 – 930.
8. Pagani A, Milani A, Freoni V et al. Clinical outcome of very small (<1 cm) HER2 positive breast cancer and the role of trastuzumab as adjuvant treatment. Ann Oncol 2008; 19 (Suppl 9): ix87 – ix102. L2.
9. Piccart ‑ Gebhart MJ, Procter M, Leyland ‑ Jones B et al. Trastuzumab after Adjuvant Chemotherapy in HER2 - Positive Breast Cancer. N Engl J Med 2005; 353 : 1659 – 1672.
10. Rodrigues MJ, Wassermann J, Albiges ‑ Sauvin L et al. Treatment of node ‑ negative infra ‑ centimetric HER2+ invasive breast carcinomas: A joint AERIO/ REMAGUS study. J Clin Oncol 2009; 27 (Suppl; Abstr 517).
11. Tovey SM, Brown S, Doughty JC et al. Poor survival outcomes in HER2 - positive breast cancer patiens with low ‑ grade, node ‑ negative tumours. Br J Cancer 2009; 100 : 680 – 683.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2010 Issue 1
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- NK buňky, chemokiny a chemokinové receptory
- Nové pohledy moderní medicíny na léčbu pomocí kmenových buněk, její praktické a etické důsledky
- Angiogeneze jako součást nádorového „ekosystému“ a možnosti jejího ovlivnění
- Velmi malé karcinomy prsu, HER2-pozitivní a léčba trastuzumabem v adjuvanci
- Průkaz vlivu estrogenových a progesteronových receptorů na přežití u karcinomu prsu bez cytostatické a hormonální léčby v malém souboru pacientek
- Dlouhodobá odpověď jaterních metastáz karcinomu prsu na léčbu kapecitabinem – kazuistické sdělení
- Dlouhodobé výsledky léčby Hodgkinovy choroby: zkušenosti z univerzitní nemocnice v Sofii
- Malobunkový karcinóm vaječníkov s metastázami do prsníku: kazuistika
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Velmi malé karcinomy prsu, HER2-pozitivní a léčba trastuzumabem v adjuvanci
- NK buňky, chemokiny a chemokinové receptory
- Průkaz vlivu estrogenových a progesteronových receptorů na přežití u karcinomu prsu bez cytostatické a hormonální léčby v malém souboru pacientek
- Dlouhodobá odpověď jaterních metastáz karcinomu prsu na léčbu kapecitabinem – kazuistické sdělení
