Vakcinace proti lidskému papillomaviru v ČR
Authors:
L. Mouková; R. Feranec; Josef Chovanec
Authors‘ workplace:
Oddělní gynekologické onkologie, Masarykův onkologický ústav, Brno
Published in:
Klin Onkol 2010; 23(2): 125-126
Category:
Oncology Highlights
Úvod
Lidský papillomavirus (human papillomavirus – HPV) hraje hlavní roli v etiopatogenezi karcinomu hrdla děložního a významně se podílí na vzniku spinocelulárních karcinomů vaginy, vulvy, penisu, anu a orofaciální oblasti.
HPV je druhově a tkáňově specifický. U člověka bylo popsáno cca 120 sérotypů HPV, které podle onkogenního potenciálu dělíme na high risk HPV (sérotypy 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59) a low risk HPV (sérotypy 6, 11, 34, 40, 42, 43, 44, 54, 70, 72, 74, 81) [1]. Na vzniku karcinomu děložního hrdla se podílí cca v 70 % HPV typ 16 a 18 a cca ve 20 % HPV typy 31, 33, 45, 52 a 58 [2].
HPV viry se přenáší zejména pohlavním stykem, dále je možný přenos z rukou či úst na pohlavní orgány a při porodu z matky na dítě. Mezi rizikové faktory vzniku karcinomu děložního hrdla patří časné zahájení sexuálního života, pohlavní promiskuita, koincidence jiných sexuálně přenosných chorob, opakovaná porodní poranění děložního hrdla, kouření cigaret, hormonální antikoncepce, imunosupresiva, primární a sekundární imunodeficitní stavy [2]. Promořenost populace HPV ve věku od 16 do 18 let je cca 80 %. Při dobrém imunitním systému jedince bývá virus po určité době přirozeně zničen. Taktéž může v organizmu přetrvávat, aniž by způsoboval patologické změny. Při oslabení imunitního systému se high risk HPV viry zabudují do genomu buněk hostitele, kde odstartují přednádorové až nádorové změny. Inkubační doba je 1 až 8 měsíců, k tvorbě protilátek dochází zhruba za 9 až 12 měsíců.
Princip vakcinace
Podstatou vakcinace je aplikace synteticky připravených L1 proteinů (VLP – virus‑like ‑ particle) virové kapsidy, které stimulují tvorbu protilátek proti příslušným sérotypům HPV.
Vakcíny dostupné v ČR
V České republice byla jako první aplikována kvadrivalentní vakcína Silgard dne 5. 12. 2006 v Brně. Dne 20. 9. 2007 byla Evropskou komisí schválena aplikace bivalentní vakcíny Cervarix. V České republice jsou v současné době k dispozici dvě rekombinantní vakcíny:
Kvadrivalentní vakcína Silgard (Gardasil) obsahuje L1 protein HPV sérotypu 6, 11, 16 a 18. Aplikační schéma je 0., 2. a 6. měsíc, je možno využít zkráceného schématu 0., 1. a 4. měsíc. Všechny tři dávky je nutno aplikovat do 1 roku od první vakcinace. Vakcinovat lze i při kojení. Je možno vakcinovat chlapce i dívky od 9 let do 15 let, dále dívky a ženy od 16 let do 26 let. Od září 2009 je schválena Evropskou komisí informace o účinnosti pro ženy ve věku od 24 let do 45 let.
Vakcína je indikována v prevenci vysokého stupně cervikální dysplazie (CIN II a CIN III), vysokého stupně vulvárních a vaginálních dysplastických lézí, karcinomu děložního hrdla iniciovanými HPV typy 16 a 18, a bradavic zevního genitálu v příčinné souvislosti s HPV typem 6 a 11. Studie Future jsou zaměřeny na průkaz prevencí lézí. Účinnost vakcinace je prokázána na dobu 5,5 let.
Bivalentní vakcína Cervarix obsahuje protein L1 typu HPV 16 a 18. Aplikační schéma je 0., 1. a 6. měsíc. Vakcinace při kojení není v indikaci SPC. Vakcinují se ženy a dívky ve věku 15 let až 25 let. Vakcína je indikována k prevenci vysokého stupně cervikální intraepiteliální neoplazie (CIN II a CIN III) a karcinomu děložního hrdla, způsobené HPV typem 16 a 18. Studie Patricia zdůrazňují hlavně koncentrace titru protilátek a prevenci perzistující infekce. Díky novému adjuvans v přípravku je po vakcinaci výraznější imunitní odpověď projevující se tvorbou vyšších hladin protilátek a větším množstvím paměťových buněk [3]. Účinnost vakcinace je prokázána na dobu 6,4 let.
Ke dni 31. 12. 2009 bylo v České republice naočkováno přibližně 112 830 osob. Z toho cca 70 % vakcínou Silgard, což se odvíjí i od dřívějšího příchodu tohoto preparátu na trh.
HPV testace není před očkováním rutinně indikována. Mladé ženy a dívky mají vysokou schopnost přirozenými imunitními mechanizmy infekci zničit a výsledek testace neukáže předchozí kontakt s infekcí. Pokud je žena infikována některým z virů, jehož L1 protein je obsažen ve vakcíně, stále ještě profituje z očkování proti ostatním virům a ze zkřížené ochrany [4]. Nežádoucí účinky neživých vakcín jsou minimální, nejčastěji bývá bolestivost a zarudnutí v místě vpichu. U obou vakcín je prokázána zkřížená protekce proti dalším high risk HPV typům.
K indikacím a způsobu vakcinace je vhodné poznamenat:
- Optimální je vakcinace u dětí a mladistvích, kteří ještě nezahájili sexuální život. Účinek vakcinace proti HPV 16 a 18 se udává až 100 %.
- Dívky a ženy, které již měly pohlavní styk, by měly být před vakcinací gynekologicky vyšetřeny.
- Dle doporučení České gynekologicko‑porodnické společnosti vakcinace u žen nad 26 let a vakcinace mužů není postupem non lege artis. I zde je nutné důkladné poučení [4].
- Dle doporučení České gynekologicko‑porodnické společnosti mohou být očkovány i ženy s abnormálním výsledkem cytologie, kondylomaty či ošetřenou prekancerózou v anamnéze. Tyto pacientky je nutno informovat o tom, že vakcíny nemají terapeutický efekt a že benefit vakcinace bude pro ně nižší [4].
- Dle doporučení České gynekologicko‑porodnické společnosti provedení jakéhokoliv vyšetření či testu (HPV test, onkologická cytologie, kolposkopie) před vakcinací není nutné, žena má být ale upozorněna na nutnost pravidelných gynekologických kontrol. Na screeningu karcinomu děložního hrdla se nic nemění [4].
- Vakcinace v době gravidity není indikována. V klinických studiích sice neplánovaně otěhotněly některé pacientky, ale počty těhotenských abnormalit byly stejné jako u neočkovaných žen.
- Je nutné aplikovat všechny 3 dávky vakcín s respektováním vakcinačních schémat dle doporučení jednotlivých SPC preparátů.
- Není doporučeno vakcinovat v době nemoci, kdy je oslaben imunitní sy-stém. V tomto případě je vhodné vakcinaci odložit cca o 14 dnů.
- V případě plánované současné vakcinace proti jinému onemocnění je vhodné vakcinaci posunout alespoň o 1 – 2 týdny, aby se dal zjistit původ případné alergické reakce. V případě nutné aplikace dvou vakcín v týž den se doporučuje vakcinace na rozdílná místa.
- Preskripci vakcíny a vakcinaci může provádět v České republice kterýkoliv lékař. U dětí bývá vakcinace většinou v rukou pediatra, u dospívajících a starších žen pak většinou gynekologa.
Úhrada vakcinace zdravotními pojišťovnami v České republice
Ceny obou vakcín jsou v České republice zhruba stejné, výrazně se ovšem liší v různých lékárnách i u jednotlivých lékařů. Pohybují se cca od 2 800 Kč do 3 500 Kč za 1 dávku vakcíny. K částečné či plné úhradě vakcinace přistupovaly zdravotní pojišťovny v ČR postupně. Zpočátku byly vakcíny hrazeny pouze v omezeném věkovém rozmezí u dívek a žen, později byla možnost úhrady z tzv. rodinných balíčků preventivních programů. Některé pojišťovny začaly hradit i vakcinaci u chlapců.
Úhrada vakcinace proti HPV infekci se každým rokem mění, aktuální přehled pro rok 2010 ukazuje tab. 1.
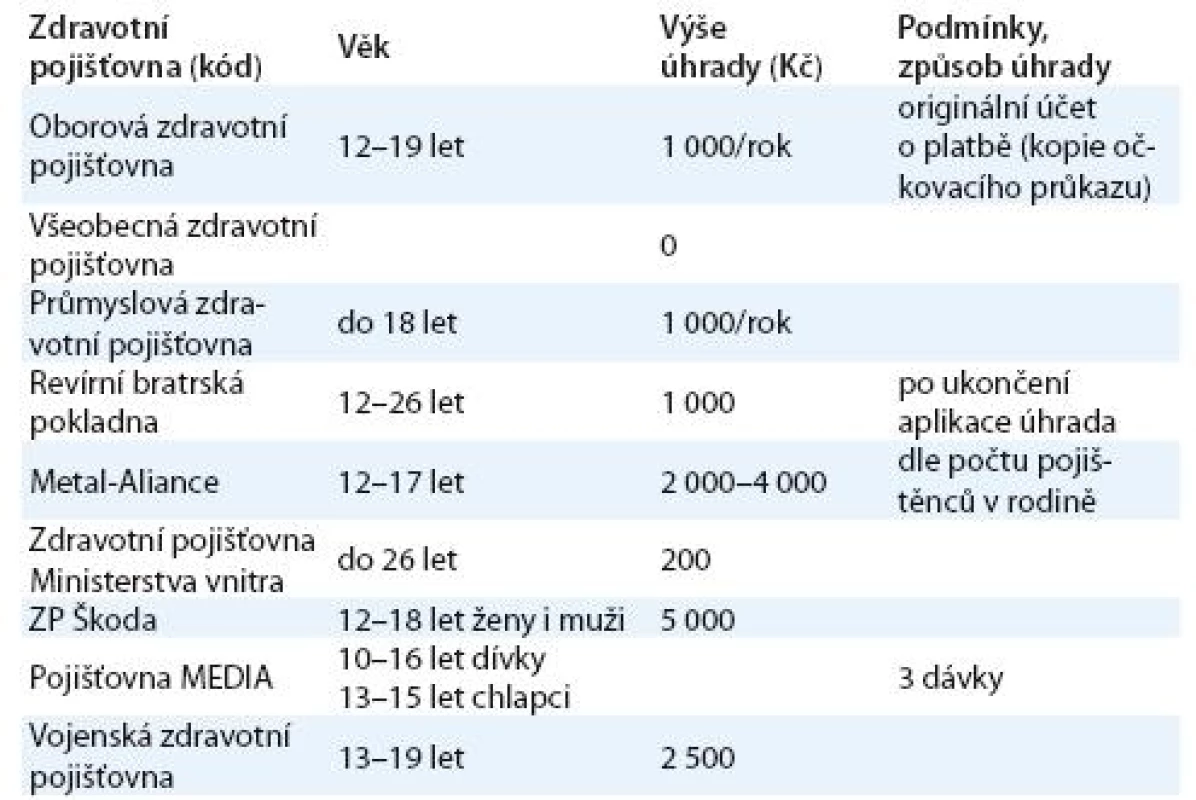
Závěr
Lidský papillomavirus typ 16 a 18 zodpovídá za 70 % karcinomů děložního hrdla. Předpokládá se, že pokud by byly naočkovány všechny dívky a ženy v daných indikacích, při zavedeném organizovaném screeningu, došlo by za 20 let k poklesu výskytu karcinomu děložního hrdla cca o 70 %.
Nezanedbatelná je ochrana vakcíny proti kondylomatům, které způsobují papillomaviry typu 6 a 11, jejichž medikamentózní terapie bývá velmi zdlouhavá.
Byly již zahájeny studie zabývající se terapeutickými a terapeuticko‑profylaktickými vakcínami, které mohou sehrát v budoucnosti významnou roli v léčbě karcinomu děložního hrdla a jeho prekanceróz.
MUDr. Lucie Mouková
Oddělení gynekologické onkologie
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: moukova@mou.cz
Sources
1. Tachezy R. Epidemiologie genitální papillomavirové infekce ve světě a ČR. Moderní gynekologie a porodnictví 2006; 15(4 Suppl A): 589 – 594.
2. Cibula D, Petruželka L. Onkogynekologie. 1. vyd. Praha: Grada 2009 : 393 – 394, 399 – 400.
3. Cibula D. Cervarix – další krok v primární prevenci cervikálního karcinomu. Medical Tribune 2007; 3(29): reprint.
4. Fait T a kol. Očkování proti lidským papilomavirům: Kvadrivalentní HPV vakcína Silgard tři roky v klinické praxi. Maxdorf 2009.
5. Schwarz TF. Human papillomavirus – 16/ 18 candidate vaccine adjuvanted with ASO4 and its impact on the incidence of cervical cancer. Expert Rev Obst Gynecology 2007; 2(3): 293 – 303.
6. Olsson SE, Villa LL, Costa RLR et al. Induction of immune memory following administration of prophylactic quadrivalent human papillomavirus (HPV) types 6/ 11/ 16/ 18 L1 virus‑like particle (VLP) vaccine. Vaccine 2007; 25(26): 4931 – 4939.
7. Bosch FX, Castellsagué X, de Sanjosé S. HPV and cervical cancer: screening or vaccination. Br J Cancer 2008; 98(1): 15 – 21.
8. Kahn JA. HPV Vaccination for the Prevention of Cervical Intraepithelial Neoplasia. N Engl J Med 2009; 361(3): 271 – 278.
9. Pluta M, Rob L, Robová H et al. Onemocnění spojená s infekcí humánním papilomavirem. Farmakoterapie reprint 2007; 3(5): 529 – 532.
10. Joura EA, Leodolter S, Hernanandez ‑ Avila M et al. Efficacy of quadrivalent prophylactis human papillomavirus (type 6, 11, 16, 18) L1 virus – like ‑ particle vaccinae against high‑grade vulval and vaginal lesions: a combined analysis of three clinical trials. Lancet 2007; 369(9574): 1693 – 1702.
11. de Villiers EM, Fauqet C, Broker TR et al. Classification of papillomaviruses. Virology 2004; 324(1):17 – 27.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2010 Issue 2
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Soudobý pohled na léčbu jaterních metastáz kolorektálního karcinomu
- Radioterapie lůžka prostaty – kdy a co léčit?
- Detekce sentinelové uzliny u pacientek s karcinomem endometria s využitím hysteroskopie
- Použití lenalidomidu v léčbě mnohočetného myelomu
- Monitorace efektivity chirurgické léčby maligních pleurálních výpotků
- Nízkodávková rádioterapia v liečbe plantárnej fasciitídy
- Naše skúsenosti s analýzou génu PTEN u pacientov s podozrením na Cowdenovej syndróm
- Liečba rekurentného karcinómu ovária – retrospektívna analýza
- Vakcinace proti lidskému papillomaviru v ČR
- Cirkulujúce nádorové bunky u rakoviny prsníka – prehľad
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Nízkodávková rádioterapia v liečbe plantárnej fasciitídy
- Radioterapie lůžka prostaty – kdy a co léčit?
- Detekce sentinelové uzliny u pacientek s karcinomem endometria s využitím hysteroskopie
- Naše skúsenosti s analýzou génu PTEN u pacientov s podozrením na Cowdenovej syndróm
