Molekulárně biologická diagnostika mutací genu KRAS a BRAF u pacientů s kolorektálním karcinomem – zkušenosti laboratorního pracoviště
Molecular Biological Diagnostics of KRAS and BRAF Mutations in Patients with Colorectal Cancer – Laboratory Experience
Background:
Targeted biological therapy based on blocking growth factor receptors and inhibition of cancer-inducing signaling pathways is a new treatment facility for patients with colorectal cancer (CRC). Therapeutic agents are monoclonal antibodies targeting epidermal growth factor receptor (EGFR). Gene aberrations in the EGFR-induced pathways are negative predictors of therapeutic response. Determination of non-mutated KRAS is a requirement for the indication of targeted anti-EGFR therapy in the present time, BRAF mutation analysis is recommended. Comparison of our results with published data and verification of routine laboratory methods in relation to diagnostic kits were the purposes of this study.
Patients and Methods:
In addition to routine methods based on PCR, direct sequencing as well as two diagnostic kits for KRAS (codon 12 and 13) and BRAF (codon 600) mutation analysis were used for 132 patients.
Results:
KRAS mutations were detected in 45 patients (34%), V600E mutation of the BRAF gene in 9 patients (7%). Both mutations simultaneously were not detected. Tissues from primary tumor and metastases were available from 33 patients. KRAS mutation was detected in 13 cases of this group. KRAS mutations in tumor and metastasis were of the same type in 9 patients; types of mutation in both tissues were different in one case. KRAS mutation only in one tissue was detected in 3 cases. BRAF mutation in both tissues was detected in the 4 patients. A low percentage of tumor cells in 17 patients’ specimen did not allow performance of routine analysis and diagnostic kit was used.
Conclusion:
The frequency of KRAS and BRAF mutations in our cohort of patients corresponds to published data. The suitability of metastatic tissue analysis due to tumor heterogeneity was confirmed. KRAS analysis requires a comprehensive methodological approach with regard to reduced DNA quality and different percentage of tumor cells in tissue. For this reason, commercial diagnostic kits constitute a suitable supplement to standard methods.
Key words:
colorectal neoplasms – KRAS – BRAF – molecular targeted therapy – monoclonal antibodies – molecular diagnostics
Authors:
B. Robešová 1; Marika Bajerová 1
; A. Vašíková 1; L. Ostřížková 2
; J. Hausnerová 3; J. Kyclová 3; Š. Pospíšilová 1,4; J. Mayer 1,4; D. Dvořáková 1,4
Authors‘ workplace:
Centrum molekulární biologie a genové terapie, Interní hematologická a onkologická klinika LF MU a FN Brno
1; Interní hematologická a onkologická klinika LF MU a FN Brno
2; Ústav patologie, FN Brno
3; CEITEC – Středoevropský technologický institut, MU Brno
4
Published in:
Klin Onkol 2013; 26(1): 25-30
Category:
Original Articles
Overview
Východiska:
Cílená biologická léčba založená na blokování receptorů růstových faktorů a inhibici signálních drah navozujících nádorové bujení je novou terapeutickou možností pro pacienty s kolorektálním karcinomem. Standardními přípravky této terapie jsou monoklonální protilátky zacílené na receptor epidermálního růstového faktoru (EGFR). Negativním prediktorem léčebné odpovědi jsou aberace v genech účastnících se signálních kaskád spouštěných EGFR. V současné době je podmínkou pro indikaci cílené anti-EGFR terapie průkaz nemutovaného genu KRAS, doporučena je i mutační analýza genu BRAF. Cílem práce bylo srovnat výsledky našeho pracoviště s publikovanými údaji a ověřit využitelnost standardních laboratorních metod ve srovnání s diagnostickými soupravami.
Soubor pacientů a metody:
Pro analýzu KRAS (kodon 12 a 13) a BRAF (kodon 600) u 132 pacientů byly použity standardní metody na principu PCR a přímé sekvenace a dvě diagnostické soupravy.
Výsledky:
Mutace KRAS byly prokázány u 45 pacientů (34 %), mutaci V600E genu BRAF neslo 9 pacientů (7 %). Přítomnost obou mutací u stejného pacienta nebyla detekována. U 33 pacientů byl dostupný jak primární tumor, tak metastatická tkáň. V 13 případech byla v tomto souboru zachycena mutace KRAS. U 9 pacientů byla detekovaná KRAS mutace v tumoru a v metastatické tkáni shodná, v jednom případě se typ mutace lišil. Ve 3 případech byla KRAS mutace zachycena pouze v jednom materiálu. Mutace BRAF byla u 4 pacientů detekována v obou materiálech. Nízký podíl nádorových buněk ve vzorku 17 pacientů neumožnil provést standardní mutační analýzu a vyšetření bylo provedeno diagnostickou soupravou s pozitivním nálezem u 6 pacientů.
Závěr:
Frekvence mutací KRAS a BRAF v analyzovaném souboru odpovídá publikovaným údajům, potvrdilo se, že vzhledem k heterogenitě nádoru je vhodné vyšetřovat i metastatickou tkáň, je-li dostupná. Mutační analýza KRAS vyžaduje komplexní metodický přístup s ohledem na sníženou kvalitu DNA a rozdílné zastoupení nádorových buněk ve vzorku. Z tohoto důvodu představují komerční diagnostické soupravy vhodný doplněk standardních postupů.
Klíčová slova:
kolorektální nádory – KRAS – BRAF – cílená terapie – monoklonální protilátky – molekulární diagnostika
Úvod
Zhoubný novotvar tlustého střeva a konečníku (kolorektální karcinom – CRC) je jednou z nejčastějších onkologických diagnóz postihujících trávicí trakt. Z evropského i celosvětového pohledu se tato diagnóza v České republice vyznačuje nadprůměrným výskytem a představuje zde druhé nejčastější nádorové onemocnění. Každoročně je v České republice kolorektální karcinom objeven asi u 8 tis. lidí a více než polovina z nich na něj umírá [1]. Vysoká úmrtnost pacientů souvisí se skutečností, že téměř polovina nádorů je zjištěna až v pokročilém stadiu. Až u jedné čtvrtiny nemocných jsou v okamžiku stanovení diagnózy přítomny metastázy a pětileté přežití těchto pacientů nepřesahuje 10 % [2,3].
V průběhu posledního desetiletí se stala součástí léčebných schémat u nádorů kolorekta cílená biologická léčba. Standardními přípravky biologické terapie jsou monoklonální protilátky (mAb) namířené proti receptoru epidermálního růstového faktoru (EGFR) a protilátky proti receptoru vaskulárního endoteliálního růstového faktoru (VEGF) [4]. V současné době jsou v České republice k léčbě kolorektálního karcinomu používány dvě anti-EGFR monoklonální protilátky: rekombinantní chimérická protilátka cetuximab (Erbitux®) od roku 2005 a rekombinantní plně humanizovaná panitumumab (Vectibix®) od roku 2008. Rekombinantní humanizovaná monoklonální protilátka proti VEGF bevacizumab (Avastin®) se dostává do klinické praxe v léčbě metastazujícího kolorektálního karcinomu v České republice v roce 2005.
Zatímco pro výběr pacientů vhodných k terapii anti-VEGF mAb není dosud k dispozici žádný klinický ani biochemický marker, pro kvalifikované rozhodnutí o typu cílené léčby anti-EGFR mAb pokročilého a metastatického CRC je třeba znát mutační status genu KRAS, protože aktivační mutace KRAS přítomné v nádorové tkáni u pacientů s CRC jsou negativním prediktorem léčebné odpovědi. Mutační analýza genu KRAS a průkaz jeho nemutovaného stavu u pacienta byly ustanoveny jako přímá podmínka pro indikaci léčiv cílených na receptor pro EGFR [5].
EGFR je transmembránový protein patřící do rodiny tyrozinkinázových receptorů pro růstové faktory (HER). Po navázání ligandu na extracelulární doménu receptoru dochází k autofosforylaci intracelulárních tyrozinkinázových zbytků, což vede k aktivaci signální kaskády zahrnující dráhy RAS/RAF/MAPK, PI3K/AKT a STAT/AKT, významné pro vývoj a progresi nádorových onemocnění. Dráha vedoucí z RAS k MAPK se účastní regulace buněčného cyklu, genové transkripce a buněčného dělení. Dráha PI3K/AKT reguluje signály ovlivňující přežití buňky a signály zabraňující apoptóze. Receptor EGFR aktivuje i dráhu STAT/AKT, která působí na transkripci genů účastnících se procesu přežívání buněk [3,6,7]. Biologická léčba mAb je zacílena na extracelulární doménu receptoru EGFR. Monoklonální protilátky se vážou na tuto doménu a soutěží s přirozenými ligandy o vazbu na receptor. Vazba protilátky zablokuje ligandem indukovanou aktivaci EGFR [8]. Úroveň exprese EGFR u CRC koreluje s progresí onemocnění, s rychlostí metastatického šíření a špatnou prognózou onemocnění, avšak nesouvisí s účinností anti-EGFR terapie [9–11]. S účinností anti-EGFR terapie souvisí přítomnost aberací v sekvenci onkogenu KRAS, který kóduje protein hrající důležitou úlohu v signální dráze spouštěné EGFR. V nádorových buňkách se může gen KRAS vyskytovat ve své normální podobě (nemutovaný typ, angl. wild type) nebo jsou v jeho sekvenci přítomny aberace na úrovni bodových mutací (mutovaný typ). V nádorech s nemutovaným typem je exprese KRAS proteinu aktivována pouze přechodně přes vazbu EGFR, zatímco v případech mutovaného genu KRAS dochází k jeho konstitutivní aktivaci a takové nádory vykazují sníženou odpověď na EGFR inhibici [8]. Kromě kolorektálního karcinomu se mutace v genu KRAS vyskytují i u jiných nádorových onemocnění, jako je nemalobuněčný karcinom plic či adenokarcinom pankreatu [12,13].
Frekvence mutací v genu KRAS u pacientů s CRC je uváděna v rozmezí 30–40 % [14]. Klinické studie však ukázaly, že pouze 8–23 % pacientů s metastazujícím CRC odpovídá na terapii monoklonálními protilátkami [6] a bylo prokázáno, že ve skupině pacientů s nemutovaným KRAS genem vykazuje pozitivní odpověď na cílenou terapii pouze 40–60 % [15]. To naznačuje existenci jiných příčin ovlivnění léčby než přítomnost mutace KRAS. Vedle mutovaného genu KRAS se předpokládá možnost výskytu aktivačních mutací v dalších genech signální kaskády EGFR, které tuto sníženou reakci na anti-EGFR terapii mohou způsobovat. Jako jedna z možností jsou uváděny mutace v genu BRAF. U téměř 10 % pacientů s CRC lze detekovat bodovou mutaci V600E v exonu 15 genu BRAF [16,17]. Současný výskyt mutace v obou genech KRAS a BRAF u stejného pacienta je velmi raritní [18].
V literatuře je uváděno téměř 3 000 bodových mutací genu KRAS analyzovaných u CRC [19]. Více než 90 % detekovaných mutací genu KRAS jsou bodové mutace v exonu 2 (kodon 12 a 13); mutace v dalších exonech, například v exonu 3 (kodon 61) a v exonu 4 (kodon 146) byly také publikovány, ale jejich frekvence je nízká (1–4 %) a klinická relevance není zcela jasná, proto se jejich analýza v klinické praxi rutinně neprovádí [20]. V odborné literatuře je publikován možný odlišný mutační stav KRAS primárního tumoru a metastázy. Vztah k cílené terapii mAb je ve všech případech stejný [21,22]. U pacientů s CRC je mutovaný stav genů KRAS a BRAF používán jako marker s negativní predikcí [5,8,16]. Analýzou mutací v obou genech KRAS a BRAF u pacientů s CRC lze zvýšit podíl zachycených pacientů rezistentních k anti-EGFR terapii [18].
Naše pracoviště v rámci FN Brno provádí vyšetření mutačního stavu genu KRAS i BRAF u pacientů s kolorektálním karcinomem. Cílem práce je srovnat výsledky našeho pracoviště s publikovanými údaji a ověřit využitelnost standardních laboratorních metod ve srovnání s diagnostickými soupravami.
Metodika a soubor
Molekulárně biologická analýza mutací genů KRAS a BRAF byla provedena u vzorků 132 pacientů s kolorektálním karcinomem vyšetřených a léčených ve FN Brno, které byly odebrány v období 11/2009–10/2012. Vyšetření bylo provedeno na základě indikace ošetřujícího lékaře. Souhlas s vyšetřením pacient vyjádřil podepsáním informovaného souhlasu. Analyzovaným materiálem byly formalínem fixované, do parafínu zalité vzorky nádorové tkáně (FFPE) z primárních tumorů, případně z metastatického ložiska. U každého FFPE byla na Ústavu patologie FN Brno provedena histologická konfirmace přítomnosti nádorových buněk včetně stanovení podílu nádorové tkáně ve vzorku a imunohistochemického ověření exprese EGFR. Vstupním materiálem pro molekulárně biologické vyšetření byla DNA izolovaná pomocí extrakční soupravy QIAamp DNA FFPE Tissue Kit (Qiagen) nebo cobas DNA Sample Preparation Kit (Roche). Kvalita a množství získané DNA byly ověřovány spektrofotometricky (NanoDrop 2000, Thermo Scientific) nebo fluorimetricky (Victor3 1420 Multilable Counter, PerkinElmer).
V genu KRAS byla analyzována oblast exonu 2 se zaměřením na bodové záměny v kodonech 12 a 13. Byla použita metoda High Resolution Melt (HRM) upravená na základě publikovaných údajů [23]. Principem metody je sledování teploty tání fluorescenčně značených amplifikátů analyzované oblasti DNA. Sekvenčně odlišné fragmenty DNA se projeví charakteristickou křivkou tání. Analýza je prováděna na přístroji RotorGene 6000 (Corbet Research). Detekční limit metody je 10 % nádorových buněk ve vzorku. V případě záchytu mutace metodou HRM byla bodová záměna nukleotidů charakterizována metodou přímé sekvenace pomocí genetického analyzátoru ABI Prism 3130 xl Genetic Analyzer (Applied Biosystems). Detekční limit přímé sekvenace pro záchyt bodové mutace je 25 % nádorových buněk ve vzorku. Pro analýzu vzorků s obsahem nádorových buněk mimo detekční limit HRM a přímé sekvenace byly použity diagnostické soupravy cobas KRAS Mutation Test (Roche) a nebo KRAS StripAssay (ViennaLab). Souprava cobas KRAS Mutation Test (Roche) využívá modifikovaného principu HRM (TaqMelt technologie) s asymetrickou PCR amplifikací exonů 2 a 3 pro detekci více než 19 bodových mutací, analýza je prováděna na přístroji Cobas z480 (Roche). Souprava KRAS StripAssay (ViennaLab) využívá reverzní hybridizace specifických biotinylovaných amplifikačních produktů na testovací nitrocelulózový proužek s imobilizovanými oligonukleotidovými sondami pro detekci 13 nejčastějších bodových mutací KRAS. Místo hybridizace je na proužku vizualizované pomocí reakce s barevným substrátem (streptavidin alkalická fosfatáza). Obě diagnostické soupravy umožňují současnou analýzu kodonu 12 a 13 (exon 2) a kodonu 61 (exon 3). Citlivost diagnostických souprav je deklarována jako schopnost záchytu 1 % obsahu nádorových buněk u KRAS StripAssay (ViennaLab) a 5 % přímo na FFPE řezech u cobas KRAS Mutation Test (Roche).
Metoda mutační analýzy byla zvolena na základě hodnocení zastoupení nádorových buněk v získaném tkáňovém materiálu. V případě, že tkáň obsahovala více než 10 % nádorových buněk, byl vzorek analyzován metodou HRM. Vzorky s obsahem nádorové tkáně do 10 % byly testovány pomocí diagnostických souprav. V případě pozitivního výsledku metody HRM byl vzorek došetřován buď přímou sekvenací nebo diagnostickou soupravou, podle podílu nádorových buněk.
Mutační analýza genu BRAF byla zaměřena na bodovou mutaci V600E v exonu 15 metodou alelické diskriminace [24]. Principem této metody je real--time PCR reakce s dvěma TaqMan sondami v jedné reakční směsi (jedna je specifická pro mutovanou a druhá pro nemutovanou sekvenci) s odlišným fluorescenčním značením. V případě homologie sondy s příslušnou sekvencí dojde k nárůstu fluorescenčního signálu, který je analyzován softwarem termocykleru (7900HT Fast Real-Time PCR System, Applied Biosystems). Touto metodou je možno zachytit mutaci na úrovni 5 % nádorových buněk ve vzorku. Konfirmace záchytu mutace u vzorků s dostatečným podílem nádorových buněk (nad 25 %) byla provedena přímou sekvenací [25].
Výsledky
Molekulárně biologická analýza exonu 2 genu KRAS byla provedena u 132 pacientů. Vyšetřovanými vzorky byly převážně resekáty primárního tumoru, kde byl podíl nádorových buněk v rozmezí 2–99 %. U 45/132 pacientů (34 %) byla detekována mutace v genu KRAS, a to v kodonu 12 nebo 13. Celkem bylo specifikováno sedm rozdílných nukleotidových záměn. U 87/132 pacientů (66 %) nebyla v těchto kodonech mutace genu KRAS nalezena (graf 1). Vzorky 17 pacientů obsahovaly méně než 10 % nádorové tkáně, detekce mutací KRAS byla proto provedena diagnostickou soupravou StripAssay (ViennaLab). U 6/17 těchto pacientů byl výsledek mutační analýzy pozitivní. Dodatečně bylo všech 17 pacientů vyšetřeno i metodou HRM, která, i přes svou nižší citlivost, dokázala zachytit mutace u třech pacientů, zatímco metoda přímého sekvenování byla ve všech analyzovaných vzorcích negativní.

V celém souboru 132 pacientů byla provedena analýza bodové mutace V600E genu BRAF a tato mutace byla zachycena u 9/132 pacientů (7 %). U všech pacientů pozitivních na mutaci genu BRAF byla detekována nemutovaná sekvence genu KRAS. Ve čtyřech případech pozitivity BRAF byl dostupný vzorek primárního tumoru i metastázy. Ve všech čtyřech případech byla mutace genu BRAF detekována u obou typů vzorků. Schematické znázornění rozložení zachycených mutací v genech KRAS a BRAF v analyzovaném souboru je uvedeno graficky (graf 2).

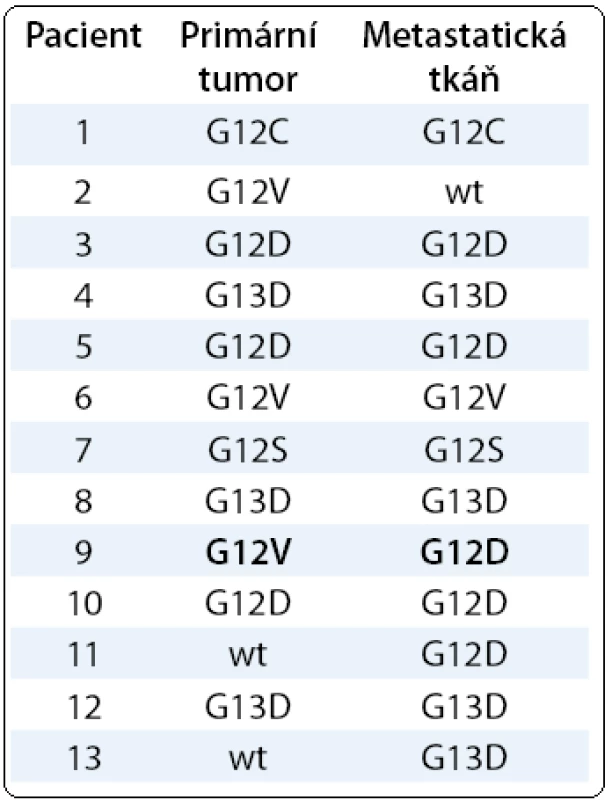
V 33 případech byl dostupný od pacienta odběr tkáně primárního tumoru i odběr tkáně z metastatického ložiska. V tomto souboru u 20/33 pacientů nebyla mutace KRAS detekována ani v jednom typu materiálu, u 13/33 pacientů byl potvrzen mutační stav KRAS. U 10/13 pacientů byla nalezena mutace jak v primárním tumoru, tak v metastatické tkáni, přitom v devíti případech se jednalo o stejný typ mutace v obou materiálech, u jednoho pacienta se typ mutace ve vyšetřovaných materiálech lišil. Ve třech případech (3/13) byla mutace KRAS prokázána pouze v jednom typu materiálu (tab. 1). Podíl nádorových buněk u těchto tří vzorků byl v primárním tumoru vysoký (50–90 %), ve tkáni metastatického ložiska u dvou pacientů bylo nádorových buněk zastoupeno méně (20 %), v jednom případě pouze 2 %. Analýza HRM byla provedena ve všech vzorcích. Aktivační mutace byly zachycené HRM v primárním tumoru u dvou pacientů a byly potvrzeny diagnostickou soupravou, pouze v metastatické uzlině ve 2 % nádorových buněk byla mutace prokázána jen soupravou.
Diskuze a závěr
Byl analyzován soubor pacientů s kolorektálním karcinomem léčených ve FN Brno. Vyšetření mutací v genu KRAS a BRAF se provádí v rámci pracoviště FN Brno, používané metody jsou dostatečně senzitivní, robustní a pravidelně ověřované externí kontrolou kvality. Metody jsou navrženy tak, aby vyhovovaly analýze DNA získané z materiálu po formalínové fixaci, která do značné míry ovlivní kvalitu DNA ve srovnání s nativním vzorkem [26]. Postup při vyšetřování je individuální vzhledem k charakteru vzorku, metoda je volena dle podílu nádorových buněk v materiálu a dle množství a kvality extrahované DNA. HRM analýza se osvědčila jako rychlá, dostupná a dostatečně citlivá pro detekci mutací v genu KRAS (detekční limit 10 %). Jistým omezením metody je skutečnost, že není schopna přesně specifikovat bodovou záměnu detekovanou u daného pacienta (identifikuje pouze sekvenční odlišnost od nemutované sekvence) a tuto je v případě potřeby možno došetřit další analýzou, která současně provede ověření pozitivního výsledku. Diagnostické soupravy rozšiřují možnosti záchytu mutace KRAS pod detekční limit HRM. Při použití KRAS StripAssay (ViennaLab) lze získat i informaci o typu detekované bodové záměny, souprava je výrobcem nastavena na detekci omezeného počtu mutací (10 typů bodových záměn v kodonech 12 a 13, tři typy mutací v kodonu 61). Diagnostická souprava cobas KRAS Mutation Test (Roche) umožňuje pouze detekci mutace ve vzorku bez bližší specifikace typu nukleotidové záměny, ale zachytí větší počet mutací a jedná se o uzavřený testovací systém s minimalizací možné chyby způsobené pracovníkem. Pro analýzu mutačního stavu genu BRAF je metodika nastavena na detekci nejčastěji se vyskytující mutace V600E [15,16].
Podíl vzorků s obsahem nádorových buněk méně než 10 % představoval v našem souboru 13 % (17/132 pacientů). Validní vyšetření těchto pacientů bylo možné provést pouze diagnostickými soupravami, jejichž detekční limit umožňuje testovat tkáň s nízkým zastoupením nádorových buněk. Zavedení několika typů mutačních analýz je tedy důležité z hlediska možnosti volby dle kvality i kvantity materiálu, nízkého obsahu nádorové tkáně nebo pro ověření nejasných výsledků.
Zjištěné frekvence výskytu aktivačních mutací KRAS a BRAF v našem souboru korelují s literárními údaji [8,9,14,15]. Cenné údaje byly získány v případě analýzy souboru, u kterého byl k dispozici vzorek primárního tumoru a metastázy od stejného pacienta. V souladu s publikovanými údaji jsme zachytili jak případy shody mutačního stavu KRAS v primárním tumoru a metastatické tkáni, tak jejich odlišnost [21,22,27]. U jednoho pacienta byl detekován variabilní typ bodové záměny KRAS v primárním tumoru a v metastatickém ložisku v jaterní tkáni, tato skutečnost je raritní, ale přesto byla již dříve popsána [28]. Zachycení neshodného mutačního stavu KRAS v primárním tumoru a metastáze svědčí o značné heterogenitě nádoru a nutnosti analýzy metastatických ložisek, jsou-li k dispozici.
Podobné případy rozdílného výskytu mutace v primárním tumoru a metastatických tkáních byly publikovány i u jiných genů a tumorů, např. mutace genu EGFR u nemalobuněčného karcinomu plic [12].
Zjištěný podíl pacientů s mutací BRAF není zanedbatelný (7 %), což je v souladu s očekávanou četností [16,17]. Metoda záchytu mutace V600E (alelická diskriminace) je pro rutinní používání vhodná, dostatečně citlivá a robustní. Záchytem pacientů s mutací BRAF je zpřesněna indikace cílené terapie monoklonálními protilátkami. Tato informace umožňuje zvýšení efektivnosti aplikace biologické léčby.
Přístup k molekulárně biologické diagnostice CRC je zahrnut v doporučeních farmakoterapeutických postupů, které pravidelně vydává Česká onkologická společnost ČLS JEP [5]. Analýza mutačního stavu genu KRAS je zde uváděna jako nepodkročitelné minimum pro indikaci cílené léčby u pacientů s CRC, detekce mutací v genu BRAF (V600E) jako doporučené vyšetření. Vzhledem k rozšiřujícím se možnostem cílené terapie monoklonálními protilátkami jsou dnes molekulárně biologické metody nezbytnou součástí diagnostiky u pacientů s kolorektálním karcinomem. Diagnostika záchytu mutací KRAS a BRAF je nastavena pro rutinní používání v klinické praxi, při analýze je zohledněn charakter vzorku (typ fixace, podíl nádorových buněk). Komplexní analýza mutačního stavu genu KRAS a BRAF poskytuje podklady pro efektivní využití cílené léčby. Nezbytným předpokladem je fungující mezioborová spolupráce všech zúčastněných složek (onkologická klinika, chirurgie, histopatologie, laboratorní pracoviště). Je zřejmé, že význam této spolupráce bude dále narůstat spolu s rozšiřujícím se spektrem prognostických a prediktivních markerů nejenom u kolorektálního karcinomu, ale u nádorových onemocnění obecně.
Práce byla podpořena grantovými projekty projekty MŠMT MSM0021622430, OPVK SuPReMMe CZ.1.07/2.3.00/20.0045 a VaVPI CEITEC CZ.1.05/1.1.00/02.0068.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
Mgr. Blanka Robešová, CSc.
Centrum molekulární biologie a genové terapie
Interní hematologická a onkologická klinika LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: blanka.robesova@fnbrno.cz
Obdrženo: 11. 10. 2012
Přijato: 21. 11. 2012
Sources
1. www.svod.cz. Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice [online], cit. 2012-9-10. Dostupný z WWW: http://www.svod.cz.
2. Haggar FA, Boushey RP. Colorectal Cancer Epidemiology: Incidence, Mortality, Survival, and Risk Factors. Clin Colon Rectal Surg 2009; 22(4): 191–197.
3. Monzon FA, Ogino S, Hammond ME et al. The role of KRAS mutation testing in the management of patients with metastatic colorectal cancer. Arch Pathol Lab Med 2009; 133(10): 1600–1606.
4. Lièvre A, Bachet JB, Le Corre D et al. KRAS mutation status is predictive of response to cetuximab therapy in colorectal cancer. Cancer Res 2006; 66(8): 3992–3995.
5. Modrá kniha České onkologické společnosti. Platnost od 1. 8. 2012. Brno, Česká onkologická společnost ČLS JEP 2012.
6. Lièvre A, Bachet JB, Boige V et al. KRAS mutations as an independent prognostic factor in patients with advanced colorectal cancer treated with cetuximab. J Clin Oncol 2008; 26(3): 374–379.
7. Siena S, Sartore-Bianchi A, Di Nicolantonio F et al. Biomarkers predicting clinical outcome of epidermal growth factor receptor-targeted therapy inmetastatic colorectal cancer. J Natl Cancer Inst 2009; 101(19): 1308–1324.
8. van Krieken JH, Jung A, Kirchner T et al. KRAS mutation testing for predicting response to anti-EGFR therapy for colorectal carcinoma: proposal for an European quality assurance program. Virchows Arch 2008; 453(5): 417–431.
9. Amado RG, Wolf M, Peeters M et al. Wild-type KRAS is required for panitumumab efficacy in patients with metastatic colorectal cancer. J Clin Oncol 2008; 26(10): 1626–1634.
10. Patil DT, Fraser CR, Plesec TP. KRAS testing and its importance in colorectal cancer. Curr Oncol Rep 2010; 12(3): 160–167.
11. Stintzing S, Heinemann V, Moosmann N et al. The treatment of colorectal carcinoma with monoclonal antibodies: the importance of KRAS mutation analysis and EGFR status. Dtsch Arztebl Int 2009; 106(12): 202–206.
12. Sun L, Zhang Q, Luan H et al. Comparison of KRAS and EGFR gene status between primary non-small cell lung cancer and local lymph node metastases: implications for clinical practice. J Exp Clin Cancer Res 2011; 17; 30 : 30.
13. Pellegata NS, Sessa F, Renault B et al. K-ras and p53 gene mutations in pancreatic cancer: ductal and nonductal tumors progress through different genetic lesions. Cancer Res 1994; 54(6): 1556–1560.
14. Bando I, Cillero L, Sanz-Ortega J et al. Study of KRAS new predictive marker in a clinical laboratory. Clin Transl Oncol 2012; 14(12): 937–942.
15. Laurent-Puig P, Cayre A, Manceau G et al. Analysis of PTEN, BRAF, and EGFR status in determining benefit from cetuximab therapy in wild-type KRAS metastatic colon cancer. J Clin Oncol 2009; 27(35): 5924–5930.
16. Van Cutsem E, Dicato M, Arber N et al. Molecular markers and biological targeted therapies in metastatic colorectal cancer: expert opinion and recommendations derived from the 11th ESMO/World Congress on Gastrointestinal Cancer, Barcelona, 2009. Ann Oncol 2010; 21 (Suppl 6): vi1–vi10.
17. Simi L, Pratesi N, Vignoli M et al. High-resolution melting analysis for rapid detection of KRAS, BRAF, and PIK3CA gene mutations in colorectal cancer. Am J Clin Pathol 2008; 130(2): 247–253.
18. Richman SD, Seymour MT, Chambers P et al. KRAS and BRAF mutations in advanced colorectal cancer are associated with poor prognosis but do not preclude benefit from oxaliplatin or irinotecan: results from the MRC FOCUS trial. J Clin Oncol 2009; 27(35): 5931–5937.
19. Edkins S, O‘Meara S, Parker A et al. Recurrent KRAS codon 146 mutations in human colorectal cancer. Cancer Biol Ther 2006; 5(8): 928–932.
20. Neumann J, Zeindl-Eberhart E, Kirchner T et al. Frequency and type of KRAS mutations in routine diagnostic analysis of metastatic colorectal cancer. Pathol Res Pract 2009; 205(12): 858–862.
21. Artale S, Sartore-Bianchi A, Veronese SM et al. Mutations of KRAS and BRAF in primary and matched metastatic sites of colorectal cancer. J Clin Oncol 2008; 26(25): 4217.
22. Velho S, Oliveira C, Seruca R. KRAS mutations and anti-epidermal growth factor receptor therapy in colorectal cancer with lymph node metastases. J Clin Oncol 2009; 27(1): 158–159.
23. Krypuy M, Newnham GM, Thomas DM et al. High resolution melting analysis for the rapid and sensitive detection of mutations in clinical samples: KRAS codon 12 and 13 mutations in non-small cell lung cancer. BMC Cancer 2006; 6 : 295.
24. Benlloch S, Payá A, Alenda C et al. Detection of BRAF V600E mutation in colorectal cancer: Comparison of automatic sequencing and Real-Time chemistry metodology. J Mol Diagn 2006; 8(5): 540–543.
25. Willmore-Payne C, Holden JA, Tripp S et al. Human malignant melanoma: detection of BRAF - and c-kit-activating mutations by high-resolution amplicon melting analysis. Hum Pathol 2005; 36(5): 486–493.
26. Gallegos Ruiz MI, Floor K, Rijmen F et al. EGFR and K-ras mutation analysis in non-small cell lung cancer: comparison of paraffin embedded versus frozen specimens. Cell Oncol 2007; 29(3): 257–264.
27. Loupakis F, Pollina L, Stasi I et al. PTEN expression and KRAS mutations on primary tumors and metastases in the prediction of benefit from cetuximab plus irinotecan for patients with metastatic colorectal cancer. J Clin Oncol 2009; 27(16): 2622–2629.
28. Knijn N, Mekenkamp LJ, Klomp M et al. KRAS mutation analysis: a comparison between primary tumours and matched liver metastases in 305 colorectal cancer patients. Br J Cancer 2011; 104(6): 1020–1026.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2013 Issue 1
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Inhibitory proteazomu v léčbě mnohočetného myelomu
- Molekulárně biologická diagnostika mutací genu KRAS a BRAF u pacientů s kolorektálním karcinomem – zkušenosti laboratorního pracoviště
- Chirurgie plicních metastáz
- Maligní melanom léčený intenzivní chemoterapií, podobnost histologického obrazu maligního melanomu a nádorů měkkých tkání, kazuistika pacientky
- Hepatotoxicita po cyproteron acetátu v léčbě karcinomu prostaty – kazuistika
- Germinatívne nádory pineálnej oblasti: prehľad
- Primární rakovina žlučníku diagnoastikovaná pooperačně po elektivní a hospitalizační cholecystektomii
- Recidivující krvácení z jater a hemoperitoneum jako následek masivního postižení AL amyloidózou: popis případu a přehled literatury
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Germinatívne nádory pineálnej oblasti: prehľad
- Inhibitory proteazomu v léčbě mnohočetného myelomu
- Maligní melanom léčený intenzivní chemoterapií, podobnost histologického obrazu maligního melanomu a nádorů měkkých tkání, kazuistika pacientky
- Chirurgie plicních metastáz
