Léčba a prognóza pacientů s relabovaným nebo refrakterním Hodgkinovým lymfomem nevhodných k transplantaci kmenových buněk
Treatment and Prognosis of Relapsed or Refractory Hodgkin Lymphoma Patients Ineligible for Stem Cell Transplantation
Background:
Relapses occur in 20–30% of patients with Hodgkin lymphoma (HL). Currently, there is no widely accepted standard treatment strategy in relapsed/refractory HL patients ineligible for autologous stem cell transplantation (ASCT). This article retrospectively evaluates survival and prognosis of patients with relapsed/refractory HL who were not suitable for high-dose chemotherapy and ASCT. New drugs and their efficacy in this indication are also disscussed.
Patients and Methods:
A total of 17 patients treated with at least three lines of standard chemotherapy ± radiotherapy were analysed. High-dose chemotherapy and ASCT was not indicated due to advanced age (seven patients), chemorefractory disease (seven patients), cardiotoxicity (two patients) and insufficient stem cell collection of CD34+ cells (one patient).
Results:
Median follow-up of the whole group after establishing the diagnosis was 3.48 years. Overall response to the second-line treatment was achieved in eight patients (47.0%). Four patients (23,5%) were classified as primary refractory after the first-line treatment and three more chemorefractory patients (17,6%) were detected after the second-line treatment. Out of 17 patients four are still alive (23,5%) in remission and 13 have died (eight due to HL progressions, four due to toxicity of the treatment and one patient with unknown cause of death). The estimated 5-year overall survival from the time of initial diagnosis was 46.3% and 30.8% when counted from the diagnosis of the first relapse. The estimated 5-year overall survival of four primary chemorefractory patients was significantly worse when compared to the group of 13 relapsed patients: 0 vs. 60.6%, p < 0,001.
Conclusion:
Prognosis of relapsed/refractory HL patients ineligible for ASCT and treated with several lines of standard chemotherapy ± radiotherapy is poor. Brentuximab vedotin is indicated in primary refractory patients in the second-line settings and in other relapsed patients in the third-line treatment. This strategy would help to increase the number of remissions, hence achieving a higher survival rate.
Key words:
Hodgkin lymphoma – relapse – brentuximab vedotin
This study was supported by the research project P 27/2012, Third Faculty of Medicine, Charles University in Prague.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Submitted:
9. 9. 2014
Accepted:
28. 9. 2014
Authors:
H. Mociková 1; A. Sýkorová 2; P. Štěpánková 2; J. Marková 1; J. Michalka 3; Z. Král 3; L. Burešová 4; D. Belada 2
Authors‘ workplace:
Interní hematologická klinika 3. LF UK a FN Královské Vinohrady, Praha
1; IV. interní hematologická klinika LF UK a FN Hradec Králové
2; Interní hematologická a onkologická klinika LF MU a FN Brno
3; DSC Services, s. r. o., Tišnov
4
Published in:
Klin Onkol 2014; 27(6): 424-428
Category:
Original Articles
doi:
https://doi.org/10.14735/amko2014424
Overview
Východiska:
Relapsy po léčbě Hodgkinova lymfomu (HL) se vyskytují u 20 – 30 % pacientů. U relabovaných/ refrakterních pacientů s HL, kteří nejsou vhodní k autologní transplantaci kmenových buněk (autologous stem cell transplantation – ASCT), není určena standardní strategie léčby. V článku je retrospektivně hodnoceno přežití a prognóza pacientů s relabovaným/ refrakterním HL, kteří jsou nevhodní k vysokodávkované chemoterapii s ASCT. V diskuzi je uveden přehled nových léků používaných v této indikaci.
Pacienti a metody:
Do analýzy bylo zařazeno 17 pacientů, kteří byli léčeni minimálně třemi liniemi standardní chemoterapie ± radioterapie. Vysokodávkovaná chemoterapie s ASCT nebyla indikována ve 2. a další linii léčby z důvodu vysokého věku (sedm pacientů), refrakternosti HL (sedm pacientů), kardiotoxicity (dva pacienti) a pro nedostatečný štěp kmenových buněk (jeden pacient).
Výsledky:
Medián sledování celé skupiny pacientů od diagnózy byl 3,48 roku. Celková odpověď na 2. linii léčby byla dosažena u osmi pacientů (47,0 %). Po 1. linii léčby byli čtyři pacienti (23,5 %) primárně refrakterní a po 2. linii léčby stoupl počet refrakterních případů o tři pacienty (17,6 %). Ze 17 pacientů žijí čtyři v remisi (23,5 %) a 13 zemřelo (osm na progresi HL, čtyři na toxicitu a u jednoho pacienta je příčina úmrtí neznámá). Pětileté celkové přežití celé skupiny od diagnózy bylo 46,3 % a od diagnózy prvního relapsu 30,8 %. Pětileté celkové přežití u čtyř primárně refrakterních pacientů bylo významně horší ve srovnání se skupinou 13 relabovaných pacientů: 0 vs 60,6 %, p < 0,001.
Závěr:
Prognóza relabovaných/ refrakterních pacientů s HL nevhodných k ASCT, kteří byli opakovaně léčeni standardní chemoterapií ± radioterapií, je špatná. U primárně refrakterních pacientů je indikováno zařazení brentuximab vedotinu do 2. linie léčby a u ostatních relabovaných pacientů do 3. linie léčby. Tato strategie pomůže zvýšit podíl remisí s cílem prodloužení celkového přežití.
Klíčová slova:
Hodgkinův lymfom – relaps – brentuximab vedotin
Úvod
Moderní kombinovaná chemoterapie a radioterapie v 1. linii léčby vede k vyléčení více než 80 % pacientů s Hodkinovým lymfomem (HL) [1 – 4]. Po 1. linii léčby 20 – 30 % pacientů relabuje nebo progreduje. Část těchto pacientů je refrakterní již na 1. linii léčby. U relabujících pacientů je standardem záchranná chemoterapie s následnou autologní transplantací kmenových buněk (autologous stem cell transplantation – ASCT), která umožňuje delší přežití ve srovnání se skupinou relabovaných pacientů bez transplantace [5,6]. V ČR je u pacientů s HL léčených vysokodávkovanou chemoterapií a ASCT 5leté celkové přežití (overall survival – OS) 71 % a přežití bez relapsu/ progrese (progression‑free survival – PFS) 54 % [7].
K nejčastějším důvodům neprovedení ASCT patří vysoký věk a primárně refrakterní onemocnění s rychlou progresí onemocnění. K dalším příčinám patří toxicita předchozí léčby, přidružené závažné onemocnění, celkový stav pacienta, nedostatečný štěp s nízkým počtem kmenových buněk, preference pacienta nebo náboženské přesvědčení [8,9]. Prospektivní studie zaměřené na účinnost 2. linie standardní chemoterapie ± radioterapie u relabovaných nebo refrakterních HL nevhodných k ASCT dosud nebyly provedeny a vychází se z údajů randomizované studie, která srovnávala nemocné léčené čtyřmi cykly chemoterapie DexaBEAM (dexametason, karmustin, etoposid, cytarabin, melfalan) oproti pacientům, kteří dostali dva cykly DexaBEAM s následnou chemoterapií s vysokými dávkami BEAM a ASCT [6]. Pacienti ve skupině s ASCT měli významně lepší prognózu oproti skupině bez transplantace – 3leté přežití bez selhání léčby (freedom from treatment failure – FFTF) bylo 55 vs 34 % [6]. Tato studie zahrnovala pouze vybranou skupinu pacientů, kteří odpověděli na záchrannou léčbu, a ne pacienty, kteří byli na léčbu primárně refrakterní.
Cílem této analýzy bylo vyhodnocení OS a PFS nebo progrese u pacientů s relabovaným nebo refrakterním HL, kteří nebyli vhodní k vysokodávkované chemoterapii s ASCT a byli léčeni minimálně třemi liniemi léčby.
Soubor pacientů a metody
Pacienti
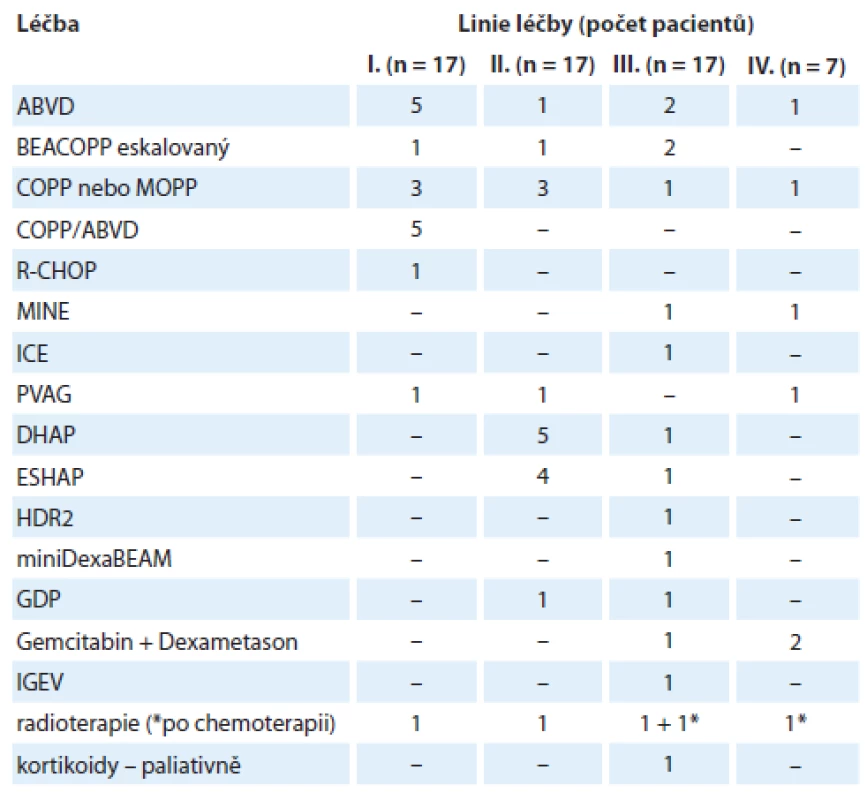
Do analýzy bylo zařazeno celkem 17 pacientů s relabovaným nebo refrakterním HL z tří center v ČR, kteří nebyli vhodní k transplantaci kmenových buněk a dostali minimálně tři linie léčby v letech 1979 – 2014. Charakteristika pacientů je uvedena v tab. 1. Medián věku v době diagnózy byl 60 (21 – 75) let. Léčba 1. – 4. linie je shrnuta v tab. 2. Standardní režimy ABVD (doxorubicin, bleomycin,vinblastin, dakarbazin) a BEACOPP (bleomycin, etoposid, doxorubicin, cyklofosfamid, vinkristin, prokarbazin a prednison) byly použity ve 2. – 4. linii léčby v případech, ve kterých byla v 1. linii podána jiná léčba a nedošlo k překročení maximální souhrnné dávky doxorubicinu. Režimy COPP (cyklofosfamid, vinkristin, prokarbazin, prednison) a MOPP (mustargen, vinkristin, prokarbazin, prednison) byly použity v 1. linii, při relapsu u pacientů ve věku nad 60 let a u pacientů s kontraindikací pro doxorubicin. Chemoterapie PVAG (prednison, vinblastin, doxorubicin, gemcitabin) byla použita u pacientů nad 60 let v 1., 2. a 4. linii. Ve 2. – 4. linii léčby byly podány následující záchranné režimy: DHAP (dexametazon, cytarabin, cisplatina), ESHAP (etoposid, cytarabin, cisplatina, methylprednisolon, MINE (mesna, ifosfamid, novantron, etoposid), ICE (ifosfamid, karboplatina, etoposid), HDR2 (2× DHAP, vysoké dávky cyklofosfamidu, vysoké dávky metotrexátu, vinkristin, vysoké dávky etoposidu), DexaBEAM, GDP (gemcitabin, dexametazon, cisplatina) a IGEV (ifosfamid, gemcitabin, vinrelbin, prednison). Jednomu pacientovi s iniciální diagnózou folikulárního B NHL byl v 1. linii podán režim R ‑ CHOP (rituximab, cyklofosfamid, doxorubicin, vinkristin, prednison). V době relapsu byla původní diagnóza zrevidována na HL s lymfocytární deplecí. Pacient byl následně léčen režimem pro HL. Ve 2. – 4. linii bylo podáno celkem 1 – 8 cyklů kombinované chemoterapie s kurativním záměrem. Paliativně bylo u jednoho pacienta podáno 12 cyklů gemcitabinu v kombinaci s dexametasonem ve 4. linii léčby. Paliativně byly též podány samotné kortikoidy u jednoho pacienta ve 3. linii léčby se závažným kardiálním onemocněním, který nebyl schopen intenzivnější léčby. Radioterapie byla použita v relapsu jako součást kombinace s chemoterapií u jednoho pacienta, samostatně s kurativním záměrem u dvou pacientů a jako paliativní léčba u jednoho pacienta.
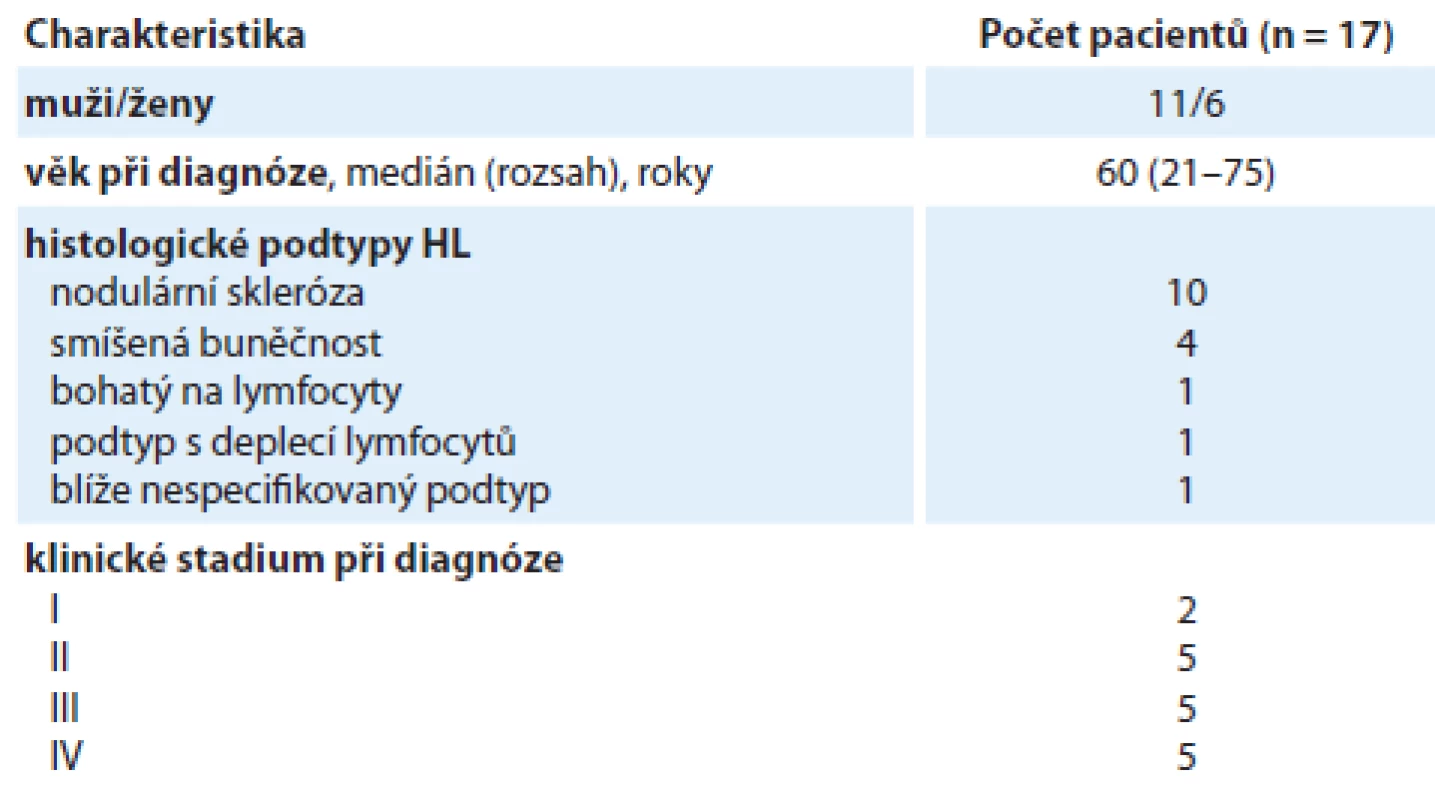
ASCT nebyla v analyzovaném souboru provedena pro vysoký věk (sedm pacientů), refrakterní onemocnění (sedm pacientů), kardiotoxicitu (dva pacienti) a pro nedostatečný počet CD34 pozitivních buněk ve štěpu kmenových buněk (jeden pacient).
Statistika
OS bylo hodnoceno od data diagnózy až do data úmrtí z jakékoliv příčiny. Přežití bez relapsu nebo progrese bylo vypočteno od data zahájení 1. linie léčby do data prvního relapsu. Přežití bez relapsu nebo progrese 2 (progression‑free survival – PFS2) bylo vypočteno od data zahájení 2. linie léčby až do data následujícího relapsu. K hodnocení OS a PFS byla použita Kaplan ‑ Meierova metoda a srovnání mezi podskupinami bylo vyhodnoceno pomocí log‑rank testu. Použitbyl software R (R Core Team / 2012/ . R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria).
Výsledky
Medián sledování celé skupiny pacientů od diagnózy byl 3,48 (0,30 – 33,05) roku. Medián sledování u čtyř pacientů s primárně refrakterním HL byl 1,48 (0,30 – 1,86) roku a u ostatních pacientů byl 5,98 (1,79 – 33,05) roku.
Celkem osm ze 17 (47,0 %) pacientů odpovědělo na 2. linii léčby, z toho šest pacientů dosáhlo kompletní remise (complete remission – CR) a dva pacienti parciální remise (partial remission – PR). U těchto osmi pacientů byla příčinou neprovedení transplantace limitace věkem nebo komorbidita. U šesti (35,3 %) pacientů v CR po 2. linii léčby byla léčba úspěšná i v dalším relapsu s dosažením další CR. Dva (11,8 %) pacienti v PR po 2. linii léčby byli dále sledováni a následně progredovali po čtyřech, resp. pěti měsících od ukončení předchozí léčby – v progresi již u nich ani další chemoterapií nebyla dosažena remise.
U dalších dvou pacientů byl po 2. linii léčby stav hodnocen jako stabilní nemoc. Tito pacienti během tří měsíců progredovali a byli dále rezistentní na 3. linii léčby.
Po 1. linii léčby byli ze 17 pacientů čtyři (23,5 %) primárně refrakterní a neodpověděli ani na další linie léčby. Po 2. linii léčby se počet refrakterních pacientů zvýšil o další tři (17,6 %) pacienty, kteří byli rovněž rezistentní na další linie léčby.
Z celkového počtu 17 pacientů žijí v remisi čtyři nemocní (23,5 %), ale dva z nich mají závažné nežádoucí účinky v důsledku předchozí léčby – u jednoho dominuje kardiální toxicita a aseptická nekróza hlavic obou femurů, u dalšího pacienta dominuje chronická renální insuficience. Nejčastější příčinou úmrtí byla progrese po 3. nebo 4. linii léčby u osmi pacientů, dále toxicita léčby u čtyř pacientů, z toho tři pacienti zemřeli v důsledku hematologické toxicity a infekce v průběhu záchranné léčby a jeden pacient zemřel na kardiální selhání. U jednoho pacienta nebyla příčina smrti objasněna.
Pětiletý celkový OS od diagnózy u 17 pacientů byl 46,3 % (95% CI 27,6 – 77,8 %) (graf 1A) a od diagnózy prvního relapsu 30,8 % (95% CI 14,4 – 65,8 %) (graf 1B).

Pětiletý celkový OS u čtyř primárně refrakterních pacientů byl významně horší ve srovnání se skupinou 13 relabovaných pacientů – 0 vs 60,6 % (95% CI 38,7 – 94,7 %; p < 0,001) (graf 2A). Rovněž byl prokázán statisticky významný rozdíl 5letého OS od data progrese nebo prvního relapsu mezi skupinou primárně refrakterních a relabovaných pacientů – 0 vs 40,6 % (95% CI 20,0 – 82,5 %; p = 0,002) (graf 2B).

Pětiletý OS osmi pacientů, kteří dosáhli remisi (kompletní nebo parciální) po 2. linii léčby, byl 85,7 % (95% CI 63,3 – 100 %). U devíti pacientů, kteří remise nedosáhli, byl 5letý OS 11,1 % (95% CI 1,8 – 70,5 %). Byl nalezen statisticky významný rozdíl v OS mezi skupinou pacientů, kteří dosáhli remise po 2. linii léčby, a těmi, kteří remise nedosáhli (p = 0,001). Rovněž byl evidentní rozdíl 5letého OS od data progrese nebo prvního relapsu mezi skupinou pacientů v remisi a bez remise po 2. linii léčby – 60,0 vs 0 % (95% CI 33,1 – 100 %; p nelze stanovit).
Pětiletý PFS2 (od data zahájení 2. linie léčby do druhého relapsu) u osmi pacientů v CR a PR po 2. linii léčby byl 37,5 % (95% CI 15,3 – 91,7 %).
Diskuze
V našem souboru pacientů byl vysoký věk a refrakterní HL nejčastější příčinou neprovedení transplantace v 2. a další linii léčby. Naše analýza potvrzuje výsledky předchozích studií [8], kde prognosticky nejhorší skupinou bylo primárně refrakterní onemocnění, u kterého nebylo možné provést ASCT v důsledku rychlé progrese a chemorezistence – u čtyř primárně refrakterních pacientů bylo významně horší 5leté OS ve srovnání se skupinou 13 relabovaných pacientů, p < 0,001 (graf 1). V relapsu 13 pacientů absolvovalo standardní chemoterapii ± radioterapii, ale počet pacientů rezistentních na tuto standardní léčbu vzrostl v dalších liniích léčby. V případech, kdy se k rezistenci přidala i toxicita léčby, pacienti byli ve 4. linii léčeni již pouze paliativně.
Dlouhodobě přežívají pouze čtyři pacienti (23,5 %), kteří dosáhli remise i po opakovaných relapsech, ale dva z těchto nemocných trpí závažnými dlouhodobými nežádoucími účinky předchozí léčby, které významně ovlivňují kvalitu jejich života a rovněž vyhlídky na dlouhodobé přežití. Výše uvedené výsledky ukazují, že standardní chemoterapie má v relapsu/ progresi limitovanou účinnost u pacientů nevhodných k ASCT, která je navíc spojena s významnými nežádoucími účinky. Proto je u těchto pacientů indikována léčba novými léky. K nim patří brentuximab vedotin (BV). Brentuximab vedotin je konjugát protilátky anti CD30 a monometyl auristatinu E a dosahuje 75% celkové odpovědi u relabovaných/ refrakterních pacientů s HL, kteří relabovali po ASCT [10]. Zejména u pacientů refrakterních na 1. linii léčby a z tohoto důvodu nevhodných k ASCT je BV vhodnou léčbou ve 2. linii, která může vést k remisi onemocnění a k následné ASCT. Dvě studie fáze I prokázaly jeho účinnost u šesti z 20 pacientů, kteří nebyli léčeni ASCT (dvě kompletní a čtyři parciální remise). Medián trvání odpovědi nebyl dosažen (> 6,8 až > 13,8 měsíce) a tři z šesti pacientů následně podstoupili ASCT [9]. Sasse et al vyhodnotili 14 pacientů s primárně refrakterním nebo relabovaným HL, u kterých předtím nebyla provedena ASCT – remise byla dosažena u 10 ze 14 (71 %) pacientů, z toho pět dosáhlo CR, která umožnila následně transplantaci kmenových buněk. Medián PFS byl 9 měsíců a medián OS nebyl dosažen [11]. V současnosti probíhají studie se sekvenčním podáním BV a ICE u relabovaných/ refrakterních pacientů s HL, kteří jsou kandidáti na ASCT.
Další dostupnou možností u relabovaných/ refrakterních HL je cytotoxická látka bendamustin – je to antimetabolit, který má současně alkylační vlastnosti. U relabovaných nebo refrakterních pacientů nevhodných k transplantaci dosahuje bendamustin celkové odpovědi 56 – 58 % (31 – 33 % CR) a je možné jej použít k dosažení remise před následnou transplantací nebo v paliativní léčbě [12,13].
Experimentálně se ve studiích zkoušejí u relabovaných/ refrakterních HL následující nové léky, např. inhibitor mTOR – everolimus (dosahuje celkové odpovědi 47 %, z toho 5 % CR) [14], inhibitory histondeacetylázy – panobinostat (dosahuje celkové odpovědi 27 %, z toho 4 % CR) [15] a mocetinostat (dosahuje celkové odpovědi 27 %) [16]. Z imunomodulačních léků se zkoušel lenalidomid s dosaženou celkovou odpovědí u 19 % pacientů [17]. Jako perspektivní se jeví v této indikaci kombinace výše uvedených léků.
Závěr
Prognóza pacientů s primárně refrakterním nebo s opakovaně relabujícím HL po 2. a další linii standardní chemoterapie ± radioterapie a nevhodných k ASCT je špatná. U těchto pacientů je indikován brentuximab vedotin, který je účinný i u refrakterních HL bez předchozí transplantace. Jeho časnější zařazení do 2. linie léčby u primárně refrakterních pacientů nebo do 3. linie léčby u relabovaných pacientů pomůže zvýšit počet remisí, umožní u části z nich autologní nebo alogenní transplantaci kmenových buněk a pomůže prodloužit jejich OS.
Práce byla realizována za podpory výzkumného projektu P 27/2012 Univerzity Karlovy, 3. lékařské fakulty v Praze.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Heidi Móciková, Ph.D.
Interní hematologická klinika
3. LF UK a FN Královské Vinohrady
Šrobárova 1150/50
100 34 Praha 10
e-mail: heidi.mocikova@seznam.cz
Obdrženo: 9. 9. 2014
Přijato: 28. 9. 2014
Sources
1. Gordon L, Hong F, Fisher R et al. Randomized phase III trial of ABVD versus Stanford V with or without radiation therapy in locally extensive and advanced‑stage Hodgkin lymphoma: an intergroup study coordinated by the Eastern Cooperative Oncology Group (E2496). J Clin Oncol 2013; 31(6): 684 – 691. doi: 10.1200/ JCO.2012.43.4803.
2. Engert A, Diehl V, Franklin J et al. Escalated‑dose BEACOPP in the treatment of patients with advanced‑stage Hodgkin‘s lymphoma: 10 years of follow‑up of the GHSG HD9 study. J Clin Oncol 2009; 27(27): 4548 – 4554. doi: 10.1200/ JCO.2008.19.8820.
3. Carde P, Karrasch M, Fortpied C et al. ABVD (8 cycles) versus BEACOPP (4 escalated cycles => 4 baseline) in stage III – IV high‑risk Hodgkin lymphoma (HL): first results of EORTC 20012 Intergroup randomized phase III clinical trial. J Clin Oncol 2012; 30 (Suppl): 510.
4. Skoetz N, Trelle S, Rancea M et al. Effect of initial treatment strategy on survival of patients with advanced‑stage Hodgkin‘s lymphoma: a systematic review and network meta‑analysis. Lancet Oncol 2013; 14(10): 943 – 952. doi: 10.1016/ S1470 ‑ 2045(13)70341 ‑ 3.
5. Linch DC, Winfield D, Goldstone AH et al. Dose intensification with autologous bone ‑ marrow transplantation in relapsed and resistant Hodgkin‘s disease, results of a BNLI randomised trial. Lancet 1993; 341(8852): 1051 – 1054.
6. Schmitz N, Pfistner B, Sextro M et al. Aggressive conventional chemotherapy compared with high‑dose chemotherapy with autologous haemopoietic stem ‑ cell transplantation for relapsed chemosensitive Hodgkin’s disease: a randomised trial. Lancet 2002; 359(9323): 2065 – 2071.
7. Mociková H, Pytlík R, Raida L et al. Léčba pacientů s relabovaným/ refrakterním Hodgkinovým lymfomem. Klin Onkol 2011; 24(2): 121 – 125.
8. Josting A, Rueffer U, Franklin J et al. Prognostic factors and treatment outcome in primary progressive Hodgkin lymphoma: a report from the German Hodgkin Lymphoma Study Group. Blood 2000; 96(4): 1280 – 1286.
9. Forero‑Torres A, Fanale M, Advani R et al. Brentuximab vedotin in transplant ‑ naive patients with relapsed or refractory Hodgkin lymphoma: analysis of two phase I studies. Oncologist 2012; 17(8): 1073 – 1080. doi: 10.1634/ theoncologist.2012 ‑ 0133.
10. Younes A, Gopal AK, Smith SE et al. Results of a pivotal phase II study of brentuximab vedotin for patients with relapsed or refractory Hodgkin‘s lymphoma. J Clin Oncol 2012; 30(18): 2183 – 2189. doi: 10.1200/ JCO.2011.38.0410.
11. Sasse S, Rothe A, Goergen H et al. Brentuximab vedotin (SGN ‑ 35) in patients with transplant ‑ naive relapsed/ refractory Hodgkin lymphoma. Leuk Lymphoma 2013; 54(10): 2144 – 2148. doi: 10.3109/ 10428194.2013.775434.
12. Corazzelli G, Angrilli F, D‘Arco A et al. Efficacy and safety of bendamustine for the treatment of patients with recurring Hodgkin lymphoma. Br J Haematol 2013; 160(2): 207 – 215. doi: 10.1111/ bjh.12120.
13. Moskowitz AJ, Hamlin PA Jr, Perales MA et al. Phase II study of bendamustine in relapsed and refractory Hodgkin lymphoma. J Clin Oncol 2013; 31(4): 456 – 460. doi: 10.1200/ JCO.2012.45.3308.
14. Johnston PB, Inwards DJ, Colgan JP et al. A Phase II trial of the oral mTOR inhibitor everolimus in relapsed Hodgkin lymphoma. Am J Hematol 2010; 85(5): 320 – 324. doi: 10.1002/ ajh.21664.
15. Younes A, Sureda A, Ben ‑ Yehuda D et al. Panobinostat in patients with relapsed/ refractory Hodgkin‘s lymphoma after autologous stem ‑ cell transplantation: results of a phase II study. J Clin Oncol 2012; 30(18): 2197 – 2203. doi: 10.1200/ JCO.2011.38.1350.
16. Younes A, Oki Y, Bociek RG et al. Mocetinostat for relapsed classical Hodgkin‘s lymphoma: an open ‑ label, single‑arm, phase 2 trial. Lancet Oncol 2011; 12(13): 1222 – 1228. doi: 10.1016/ S1470 ‑ 2045(11)70265 ‑ 0.
17. Fehniger TA, Larson S, Trinkaus K et al. A phase 2 multicenter study of lenalidomide in relapsed or refractory classical Hodgkin lymphoma. Blood 2011; 118(19): 5119 – 5125. doi: 10.1182/ blood ‑ 2011 ‑ 07 ‑ 362475.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2014 Issue 6
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Nežádoucí účinky novodobé léčby maligního melanomu a jejich léčba/ management
- Subependymální obrovskobuněčný astrocytom u pacientů s tuberózní sklerózou – farmakologická léčba mTOR inhibitory
- Léčba a prognóza pacientů s relabovaným nebo refrakterním Hodgkinovým lymfomem nevhodných k transplantaci kmenových buněk
- Spinocelulárny karcinóm v ložisku cirkumskriptnej sklerodermie
- Incidence a mortalita nádorových onemocnění v České republice
- Prvá slovenská skúsenosť s použitím vinflunínu v druhej línii liečby pokročilých urotelových karcinómov
- Mnohopočetný metachrónny malígny fibrózny histiocytóm na horných končatinách – kazuistika
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Nežádoucí účinky novodobé léčby maligního melanomu a jejich léčba/ management
- Incidence a mortalita nádorových onemocnění v České republice
- Subependymální obrovskobuněčný astrocytom u pacientů s tuberózní sklerózou – farmakologická léčba mTOR inhibitory
- Spinocelulárny karcinóm v ložisku cirkumskriptnej sklerodermie
