Maligní lymfomy − minulost, současnost a budoucnost
Malignant Lymphomas – Past, Present and Future
This review summarizes the key steps on the way to understanding lymphoma biology and management. The history of lymphomas started in 1832 when Thomas Hodgkin first presented lymphomas. Classification of lymphoproliferative tumors has changed almost every 10 years as a reflection of deeper knowledge of this disease. Systemic therapy has developed in several steps starting by monotherapy with different chemotherapeutic agents, followed by the era of combination chemotherapy and by the rituximab era, which significantly changed the treatment paradigm. Several years ago, we entered into the fourth era characterized by many different targeted treatments. Radiotherapy remains an important part of lymphoma management. Lymphoproliferative tumors incidence is growing but mortality has started to decline starting in the year 2000 as the reflection of targeted therapy based on biology and pathogenesis.
Key words:
lymphoma – classification – chemotherapy − targeted therapy
This study was supported by grants of Internal Grant Agency of the Czech Ministry of Health No. NT13072-4/2012 a NT12193-5/2011 and PRVOUK-27/LF1/1.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted:
1. 10. 2015
Accepted:
3. 10. 2015
Authors:
M. Trněný; P. Klener Jr.; R. Pytlík
Authors‘ workplace:
I. interní klinika – klinika hematologie 1. LF UK a VFN v Praze
Published in:
Klin Onkol 2015; 28(Supplementum 3): 55-63
doi:
https://doi.org/10.14735/amko20153S55
Overview
Předkládaný přehled velmi stručně shrnuje zásadní mezníky ve vývoji poznání a léčby maligních lymfomů. Historie poznání maligních lymfomů se datuje od prvního popisu Thomasem Hodgkinem v roce 1832. Klasifikace lymfoproliferativních nádorů se prakticky každých 10 let měnila jako odraz prohlubujícího se poznání. Systémová léčba se vyvíjela v několika etapách od chemoterapie v monoterapii, přes kombinovanou chemoterapii, imunoterapii reprezentovanou rituximabem až do zatím čtvrté etapy, která je charakterizována řadou nových léků zaměřených na důležité patogenetické mechanizmy vzniku a růstu lymfomů. Radioterapie zůstává nedílnou a důležitou součástí léčby lymfomů. Incidence lymfoproliferací stále roste, ale do roku 2000 začala klesat mortalita jako důsledek cílené léčby založené na znalostech biologie a patogeneze.
Klíčová slova:
lymfom – klasifikace – chemoterapie − cílená léčba
Historie lymfomů
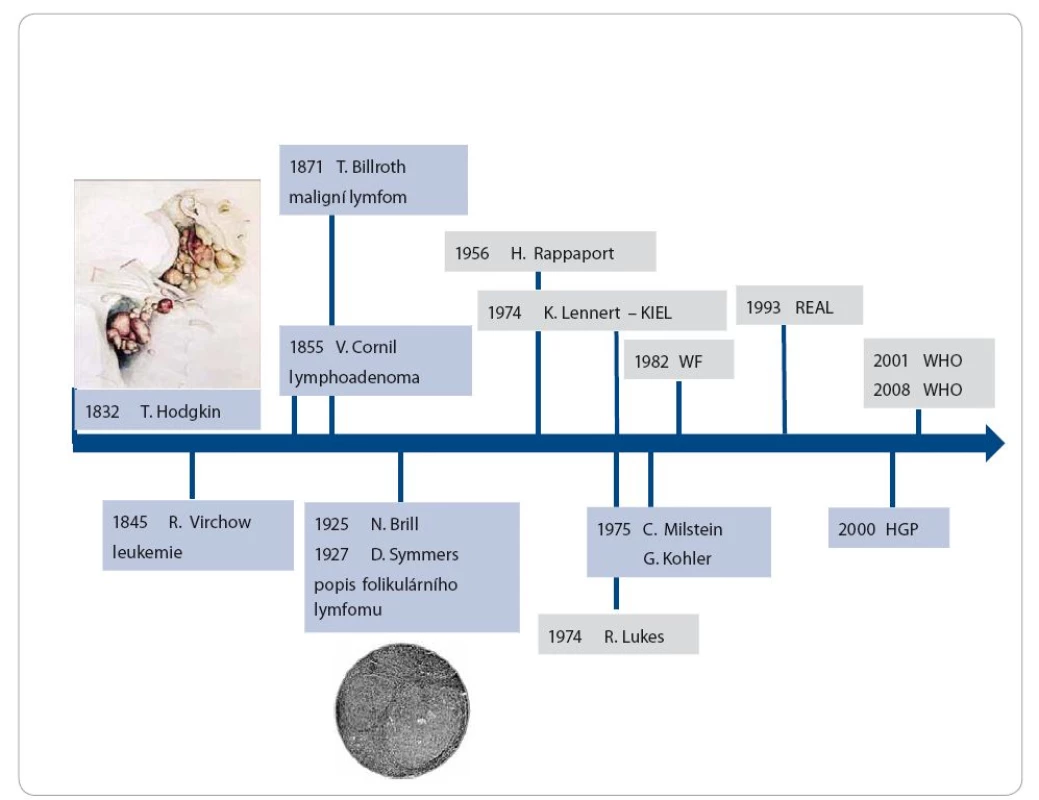
Hodgkinův lymfom a potažmo i non‑Hodgkinovy lymfomy nesou svůj název po dr. Thomasu Hodgkinovi (17. 8. 1798 − 5. 4. 1866), který v roce 1832 [1] popsal několik případů nemocných s adenomegalií, splenomegalií. V následujícím století byly některé z těchto případů histologicky verifikovány jako klasické případy toho, co nynější klasifikace nazývá klasickým Hodgkinovým lymfomem s Reed ‑ Sternbergovými buňkami. Dnes užívané termíny leukemie použil poprvé v 19. století R. Virchow v roce 1845 a slovo lymfom v roce 1871 T. Billroth. Názvoslovný vývoj v oblasti lymfomů probíhal (a probíhá) celou dobu, stejně jako klasifikační pokusy. Po druhé světové válce se ujal jako první široce používaná klasifikace Rappaportův popis folikulárních lymfomů (FL) z roku 1956, jenž kladl důraz na přesná morfologická kritéria [2,3]. Postupný rozvoj imunologických metod a poznání funkčních vztahů ve vývoji lymfocytů vedl v roce 1974 ke vzniku dvou klasifikací. Na americkém kontinentě Lukesovy [4], nazývané též Lukesovy ‑ Collinsovy, a v Evropě tzv. Kielské klasifikace [5,6]. Zásadním posunem v technologickém instrumentáriu bylo objevení metody tvorby monoklonálních protilátek Kohlerem a Milsteinem v roce 1975 [7]. Umožnilo prudký rozvoj poznatků a přenos těchto pozorování do diagnostiky, ale také postupně do oblasti terapie. Terminologická nejednotnost a z toho vyplývající neschopnost porovnávat různé sestavy nemocných a přenášet poznatky mimo publikující pracoviště vedly ke snaze sjednotit klasifikaci. Prvním krokem byla snaha vytvořit alespoň něco jako „překladový slovník“ mezi jednotlivými klasifikacemi, což našlo odraz v dokumentu Working formulation publikovaném v roce 1982 [8]. Rozvoj cytogenetických a molekulárně biologických technik vedl dále k prohloubení znalostí o biologické charakteristice nádorů, jejich vývoje. Pracovní skupina hematopatologů a kliniků již z obou břehů Atlantického oceánu publikovala v roce 1994 pracovní verzi tzv. REAL klasifikace (Revised European and American Lymphoma Classification) [9]. Dříve zmíněný rozvoj molekulární biologie a technologií je charakterizován mimo jiné projektem cíleným na poznání celého lidského genomu (Human Genome Project − HGP). Tyto poznatky akcelerovaly další poznání i v oblasti nádorů, v tomto případě lymfomů a leukemií [10]. REAL klasifikace se pak stala podkladem pro celosvětovou WHO klasifikaci nádorů hematopoetické a lymfoidní tkáně v roce 2001 a 2008 [11,12]. V současné době proběhl její update. Obrázek 1 shrnuje jednotlivé časové mezníky ve vývoji klasifikací.
Biologie a současná klasifikace lymfomů
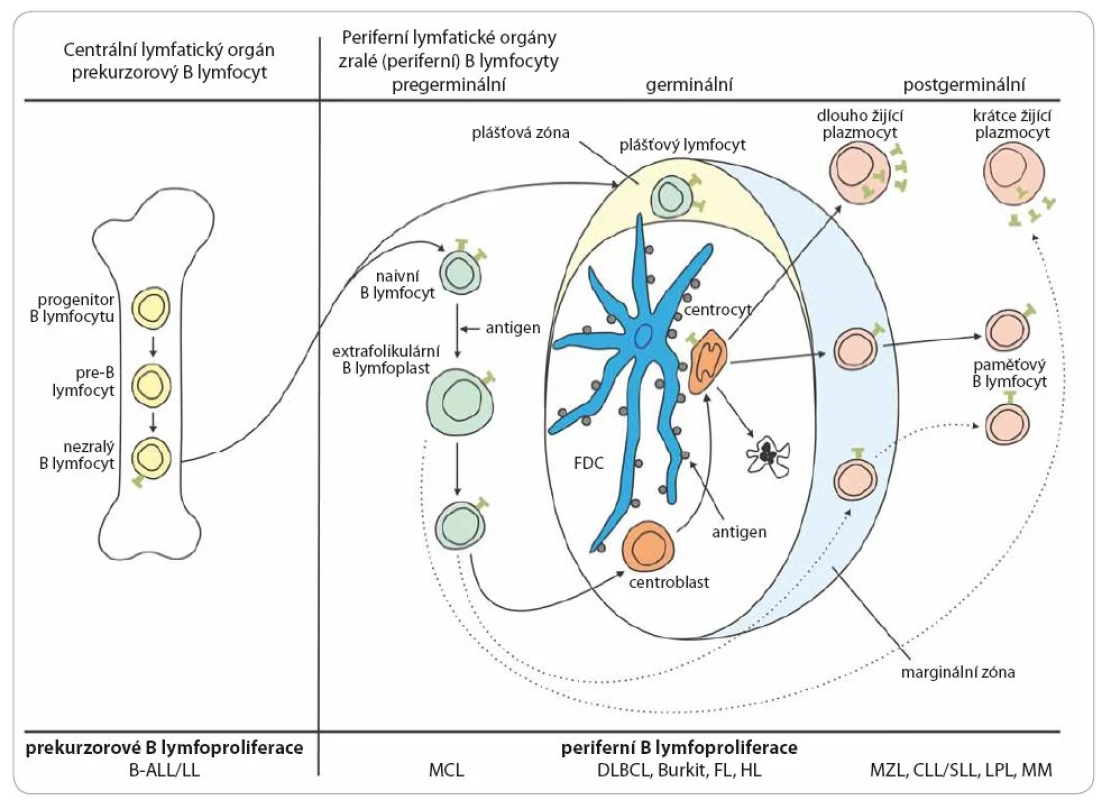
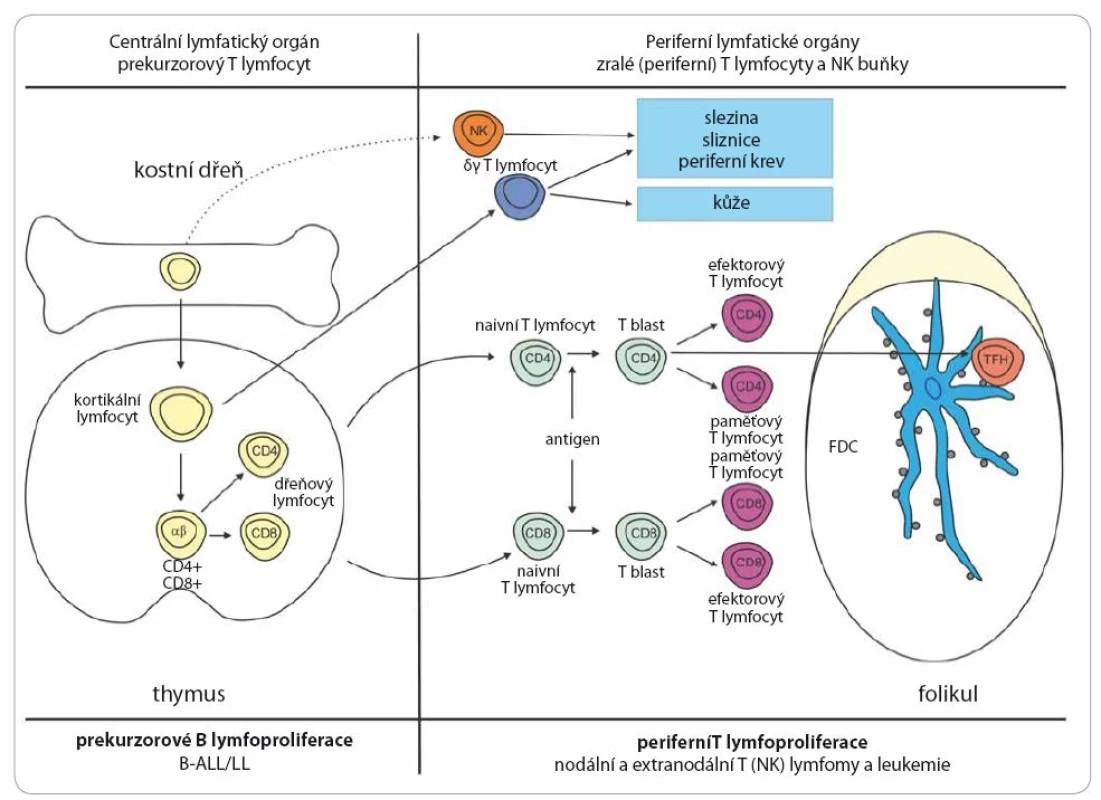
Lymfomy mohou vzniknout na jakémkoli stupni vývoje lymfocytu. Schématicky je vývoj B lymfocytu a jemu odpovídající jednotky shrnut na obr. 2 a vývoj T lymfocytu na obr. 3. Na úrovni prekurzorové buňky dochází ke vzniku akutní lymfoblastové leukemie (ALL) a lymfoblastového lymfomu (LL). Současný pohled na biologii a kliniku těchto dvou jednotek − stejně jako na chronickou lymfocytární leukemii (CLL) a lymfom z malých lymfocytů (small lymphocytic lymphoma − SLL) − je ten, že se jedná o jednu jednotku s rozdílnou klinickou manifestací. Mimo ALL a LL řadíme všechny ostatní jednotky do skupiny periferních lymfoproliferací. To ovšem neznamená, že některé prvotní události nevznikají již na úrovni prekurzorových buněk. Příkladem může být t(14;18)(q32;q21), která vzniká již v kostní dřeni a pro vývoj FL, pro nějž je typická, ale pro jeho vývoj ne postačující, jsou nutné další události [13]. Většina B lymfoproliferací vychází z buněk, které prošly zárodečným centrem. Zásadní událostí je zde prezentace antigenu pomocí profesionálních antigen prezentujících buněk a na základě toho prodělaná somatická hypermutace ve variabilní oblasti Ig genu. Buňky, u nichž došlo k úspěšné hypermutaci, se dále vyvíjejí do paměťových nebo plazmatických buněk. U těch, u nichž byla vysoce afinní mutace neúspěšná, je indukována apoptóza [14]. Buňky mohou z této apoptózy uniknout a tyto mechanizmy se potom podílejí na nádorovém vzniku. Jedním z mechanizmů, který může stát za umožněním tohoto úniku, je infekce virem EBV. Z buněk, které prošly germinálním centrem, vznikají FL, DLBCL (difuzní velkobuněčný B lymfom), Hodgkinův lymfom, Burkittův lymfom a další. Mechanizmus antigenní prezentace nemusí být vždy závislý na antigen prezentujících buňkách. B lymfocyty, které se setkají s antigenem alternativním způsobem, mohou potom procházet marginální zónou a mohou z nich také vznikat paměťové lymfocyty nebo lymfocyty produkující protilátky. Jejich charakteristikou potom je, že nenesou somatickou mutaci. To částečně vysvětluje, proč CLL vzniká z paměťových B lymfocytů, ale část nese somatickou mutaci IgVH a část ne [15]. Lymfom z plášťových buněk (mantle cell lymphoma – MCL) vzniká z naivních B lymfocytů nacházejících se nebo recirkulujících plášťovou zónou a nese typickou translokaci t(11;14)(q13;q32), která je základním patogenetickým mechanizmem. Z buněk marginální zóny potom vznikají zejména lymfomy z marginální zóny, jenž jsou však většinou extranodální. Obrázek 3 zjednodušeně představuje dráhu vývoje T lymfocytů a vznik T lymfoproliferací. I ty můžeme rozdělit na prekurzorové (T ALL a T lymfoblastový lymfom) a periferní. Z periferních T lymfomů jsou nejčastější anaplastický velkobuněčný lymfom (ALCL − alk pozitivní nebo negativní), angioimunoblastický T lymfom (AITL) a periferní T lymfom blíže nespecifikovaný (PTL NOS). Existuje celá řada primárně extranodálních T lymfomů, zejména kožních, ale také postihujících gastrointestinální trakt a další. Při vzniku lymfomů hrají klíčovou roli i změny epigenetické [16,17]. Nejedná se však pouze o změny na úrovni vlastní nádorové lymfomové buňky, ale v patogenezi se uplatňuje velkou mírou mikroprostředí [18,19].
Etiologie
Jedním z nejdůležitějších faktorů vzniku lymfomu je porucha imunitního systému. Zejména se jedná o imunosupresi, kdy jako extrémní případy může sloužit HIV infekce a rozvoj AIDS [20], stav po transplantacích solidních orgánů s následnou imunosupresí (post transplantační lymfomproliferace) [21]. Existuje kauzální souvislost mezi některými infekčními agens a vznikem lymfomů, i když penetrace je velmi nízká. Mechanizmus může být buď přímý (např. zabudování do genomu buňky) třeba u EBV, HTLV1, KSHV. Nebo se dále uplatňuje chronická antigenní stimulace, jako je tomu např. u Helicobacter pylori, Borrelia Burgdorferi, Chlamydia psitacci. Z virových agens se může uplatnit již zmíněný HIV, EBV, HCV. Imunosupresivní mechanizmus byl popsán u EBV, HIV, KSHV [22]. Rovněž existuje v některých případech rodinná zátěž, jak bylo uvedeno v řadě familiárních výskytů [23,24].
Epidemiologie
Incidence maligních lymfomů kolísá kolem 15 na 100 000 obyvatel s poměrně velkou geografickou variací. V roce 2011 bylo v ČR diagnostikováno téměř 2 500 nových nemocných, což představuje stav, kdy každé 3,5 hod je diagnostikován nový pacient. Největší skupina jsou non‑Hodgkinovy lymfomy následované CLL a Hodgkinovým lymfomem. Incidence těchto lymfoproliferací s výjimkou Hodgkinova lymfomu zatím každoročně stoupá. Jen od roku 2000 incidence stoupla o více než 30 %. Od tohoto roku jsme však také začali pozorovat stagnaci a postupný pokles úmrtnosti na tyto choroby. Poměr zemřelých na jedno z těchto nádorových onemocnění vůči nově diagnostikovaným klesl z 55 % v roce 1981 na 37 % v roce 2010, resp. 42 % v roce 2011 (graf 1) [25].
![Vývoj incidence a mortality na lymfom (Hodgkinův i non-Hodgkinův) a chronické lymfocytární leukemie v ČR (z dat Ústavu národního zdraví a Národního onkologického registru [25]).](https://pl-master.mdcdn.cz/media/image/858c4ec24f537f2ed167af15b38faa0c.jpg?version=1537795017)
Diagnóza a stážování
V oblasti diagnostiky lymfomů se v současnosti uplatňuje vysoce specializovaná hematopatologie s instrumentáriem imunohistochemickým, průtokovou cytometrií a molekulární biologií. Pro zjištění rozsahu onemocnění a hodnocení odpovědi jsou v současné době aplikována mezinárodní doporučení, která jsou založena u řady podtypů na využití celotělové PET s použitím 18fluorodeoxyglukózy (FDG) [26,27]. Přestože neexistuje v některých jednotlivých bodech těchto doporučení shoda a je stále nutné používat spolu s PET i CT a v řadě případů pouze CT, znamená využití PET významný posun. Na druhou stranu je nutná při hodnocení výsledků léčby obezřetnost tam, kde přetrvává nebo se objeví znovu PET pozitivita, neboť to může být v důsledku nenádorové příčiny (reaktivní změny, infekce, granulomatózní proces). Vždy se proto snažíme indikovat histologickou revizi.
Léčba
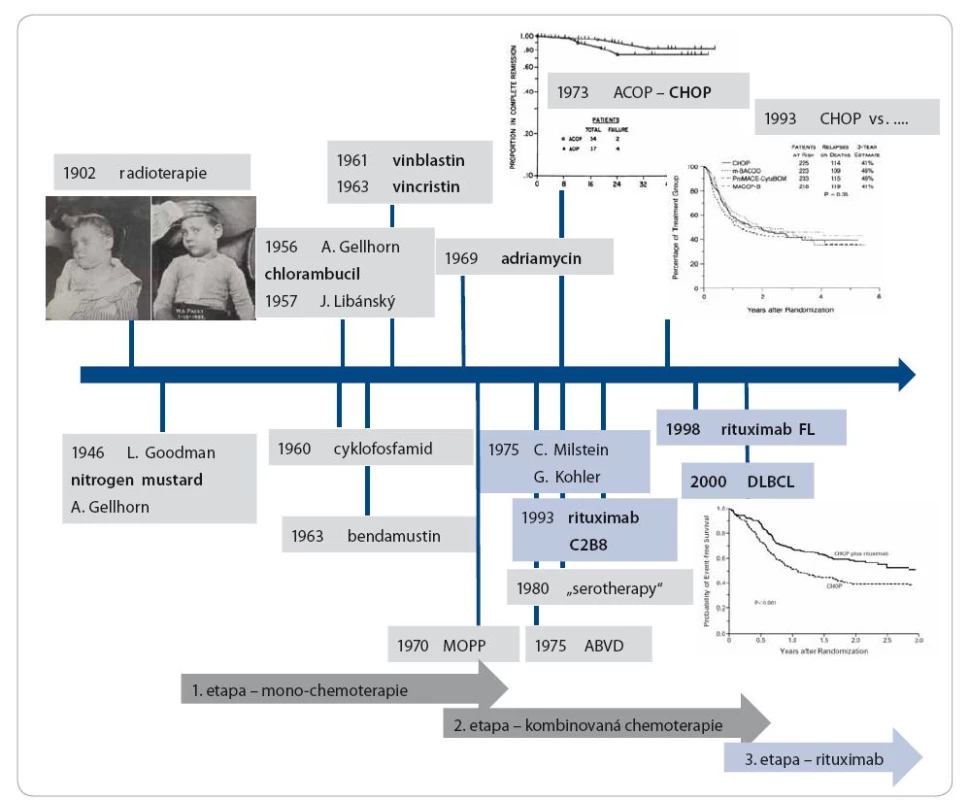
Léčba lymfomů je příkladem velmi úspěšné aplikace moderních léčebných poznatků, které v současnosti vycházejí ze stále lepšího poznání patogeneze a biologických charakteristik. Přehledně vývoj shrnuje obr. 4. Jedním z prvních dokladů o velmi dobré senzitivitě lymfomu k radioterapii byla práce z roku 1902 [28] (fotografie léčeného chlapce je na obr. 4). Další vývoj nastal po roce 1945 a můžeme ho rozdělit do několika fází. První fází bylo objevení a zavedení vlastní chemoterapie. V letech 1946–1970 byla objevena prakticky všechna cytostatika, která používáme dodnes. Dokonce i lék, jenž prožil své znovuzrození počátkem tohoto tisíciletí – benda-mustin [29], byl objeven v roce 1963 [30]. Monoterapie znamenala jistě zlepšení léčebných výsledků, ale za další významnou etapu je nutné považovat éru kombinované chemoterapie. V roce 1970 publikovala skupina vedená DeVitou kombinovaný režim MOPP (nitrogen ‑ mustard, vinkristin, prokarbazin a prednison) u nemocných s Hodgkinovým lymfomem [31], i když, jak uvádí v tomto článku, začali ho používat v roce 1964. V roce 1975 publikovala skupina vedená Bonadonnou studii s antracyklinovým režimem ABVD (adriamycin, bleomycin, vinblastin, dakarbazin) [32], který používáme dosud. Hodgkinův lymfom se tak stal prvním nádorem, který bylo možné vyléčit v pokročilém stadiu. V roce 1973 byl publikován skupinou vedenou Emilem Freiem III. režim ACOP, který je vlastně režimem CHOP, a byl použit v léčbě non‑Hodgkinových lymfomů [33]. I tento režim používáme rovněž až do dnešní doby. Existovala snaha zlepšit výsledky léčby dalšími kombinacemi, v originálních reportech vypadaly příznivě, ale v případě non‑Hodgkinových lymfomů se ukázalo, že prakticky žádný není lepší než CHOP [34]. Snad jedinou výjimkou je režim ACVBP, který se ukázal jako lepší než CHOP jak v prerituximabové éře [35], tak v kombinaci s rituximabem [36]. U Hodgkinova lymfomu byl zaveden intenzivnější režim – eskalovaný BEACOPP – , který vykazuje ve srovnání s COPP/ ABVD větší efektivitu, ale za cenu vyšší toxicity [37]. Třetí významnou kapitolou léčby lymfomů, kterou můžeme datovat od 90. let minulého století do současnosti, je zavedení imunoterapie monoklonálními protilátkami. První práce fáze I studie s rituximabem byla publikována v roce 1994 [38], zásadní fáze II studie s touto anti‑CD20 chimérickou protilátkou v monoterapii byla uveřejněna v roce 1998 [39]. Počátek této kapitoly však najdeme již v roce 1975, kdy byla publikována metoda výroby monoklonálních protilátek [7], a již v roce 1980 byla monoklonální protilátka Ab 89 proti blíže nespecifikovanému antigenu testována na pacientovi [40]. Zavedení kombinované imunochemoterapie, nejčastěji představované kombinací R ‑ CHOP [41], byl krok, který výrazně změnil léčebné možnosti. Od roku 2000 se také zastavila a začala klesat úmrtnost na lymfomy a CLL. Jestliže ještě v prvním desetiletí tohoto století byla zásadní otázka, zda rituximab zlepší výsledky spolu s chemoterapií nebo ne, v současnosti se otázka obrátila ve formulaci: Jaká chemoterapie je nejlepším partnerem rituximabu? Postupně se objevily další nahé protilátky, např. obinutuzumab, který se ukázal ve srovnání dvou anti‑CD20 protilátek u CLL lepší než rituximab [42]. Lze tedy říci, že v posledních 10 letech byla odstartována zatím poslední, v pořadí čtvrtá, zásadní kapitola vývoje léčby lymfomů. Rituximab zůstává základem úspěšné léčby B lymfoproliferací, ale objevují se snahy nahradit ho účinnějšími variantami anti‑CD20 protilátky. Rovněž se objevují protilátky proti novým cílům, modifikace anti-CD20 protilátek a testuje se celá řada nových látek.

Výhled s novými léky
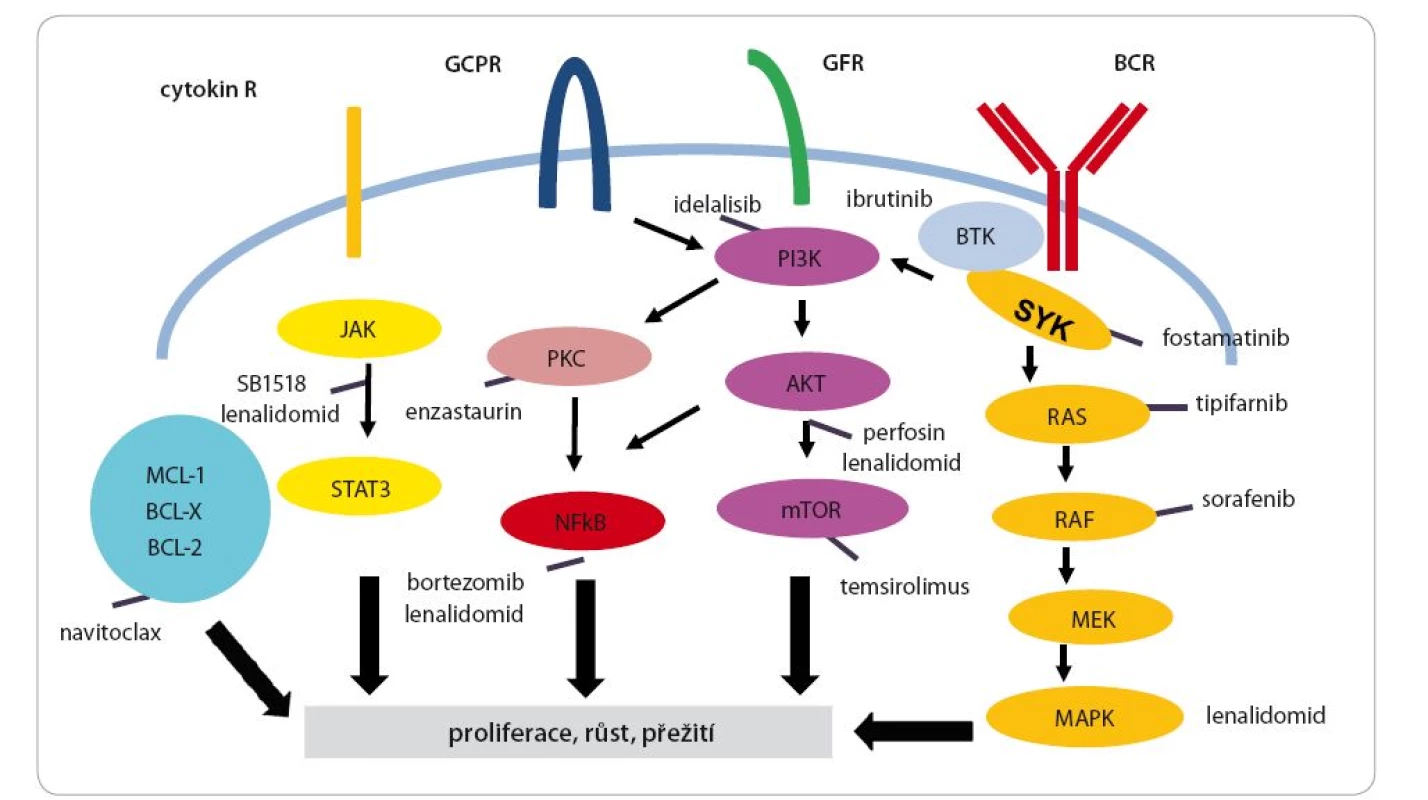
O obinutuzumabu jako nové anti‑-CD20 protilátce již byl pojednáno. Dosud jako jediná nová protilátka ukázal lepší výsledky než rituximab, alespoň u CLL. Protilátky také mohou být modifikovány, může být na ně navázána radioaktivní látka, např. ibritumomab (anti‑CD20 protilátka) tiuxetan s 90Ytriem [43]. Poprvé se uplatnily protilátky u jiných lymfoproliferací než z B lymfocytů. Jedná se o anti‑CD30 protilátku brentuximab vedotin, kde je navázána antitubulinová látka auristatin. Tato protilátka se ukázala jako účinná u Hodgkinova lymfomu [44] a anaplastického velkobuněčného lymfomu, který je také CD30 pozitivní [45]. Jako velmi atraktivní se jeví koncept tzv. BiTe protilátek, které jsou bispecifické, obvykle anti‑CD3 cílené na T lymfocyt a další vazebné místo na cílové buňce. Příkladem může být blinatumomab (anti‑CD3 a anti‑CD19) a jeho použití u ALL [46] a nově i u lymfomů [47] nebo protilátka AFM13 (anti‑CD30/ CD16A) testovaná ve fázi I u Hodgkinova lymfomu [48]. Další velkou skupinou nových léků jsou látky, které jsou zaměřeny na jednotlivé dráhy důležité v patogenezi lymfomů, jak je vidět na obr. 5 (modifikováno podle [49,50]). Jako velmi důležitá se ukazuje dráha signalizace B buněčného receptoru (BCR), zejména u DLBCL ABC (activated B ‑ cell) podtypu, CLL a MCL. Inhibitor Brutonovy kinázy ibrutinib je velmi potentní lék pro MCL [51] i CLL [52]. Recentně byly publikovány výsledky studie časné fáze u DLBCL podtypu ABC [53]. Další lék, který se dostává do klinické praxe, je inhibitor fosfatidylinositol ‑ 3-kinázy delta (PI3K) idelalisib. V kombinaci s rituximabem je používán u CLL [54] a je účinný u refrakterního FL [55]. Venetoclax (ABT ‑ 199) účinkuje prostřednictvím selektivní blokády bcl ‑ 2 proteinu a byly prezentovány velmi povzbudivé výsledky u CLL [56]. Poslední skupina léků, o níž je nutné se zmínit, jsou léky zasahující do mikroprostředí a ovlivňující interakci mezi lymfomem a imunitním systémem. Sem patří léky ze skupiny imidů, zejména lenalidomid. Je to lék s pleiotropním efektem jak na lymfomovou buňku, tak na mikroprostředí. Velmi povzbudivé výsledky byly publikovány v kombinaci s rituximabem u nemocných s FL jak v primoterapii [57], tak v relapsu [58]. V obou indikacích probíhají randomizované studie fáze III. Lenalidomid je rovněž velmi účinný lék u nemocných s relapsem MCL, jak bylo demonstrováno v randomizované studii [59]. Stejně jako v případě ibrutinibu se zdá, že účinkuje u DLBCL podtypu ABC a v kombinaci s imunochemoterapií R ‑ CHOP [60] je nadějnou cestou pro tento prognosticky nepříznivý podtyp DLBCL. Posledními zmíněnými jsou tzv. checkpoint inhibitory, které blokují vazbu PD-1 a PD-L1, což je cesta, kterou se tumor snaží uniknout imunitnímu dozoru. Z hematologických diagnóz se zatím největší efekt ukázal u nemocných s Hodgkinovým lymfomem, kde byl použit nivolumab [61] nebo pembrolizumab [63]. U FL byla s nadějnými výsledky testována kombinace pidilizumabu s rituximabem [63].
Závěr
Závěrem lze shrnout, že vývoj poznání v oblasti lymfoproliferativních nádorů velmi efektivně umožnil výrazně zlepšit léčebné výsledky. Obzvláště v poslední době se nalézáme v období dramatického rozvoje cílené léčby, která vychází z rychle se prohlubujících poznatků o biologii a patogenezi lymfomů.
Práce byla podpořena granty IGA MZ ČR č. NT13072-4/2012 a NT12193-5/2011 a PRVOUK 27/LF1/1.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do bi omedicínských časopisů.
prof. MUDr. Marek Trněný, CSc.
I. interní klinika – klinika hematologie 1. LF UK a VFN v Praze
U Nemocnice 2
128 08 Praha 2
e-mail: trneny@lf1.cuni.cz
Obdrženo: 1. 10. 2015
Přijato: 3. 10. 2015
Sources
1. Hodgkin T. On some morbid appearances of the absorbent glands and spleen. Med Chir Trans 1832; 17 : 69 – 97.
2. Hicks EB, Rappaport H, Winter WJ. Follicular lymphoma; a re‑evaluation of its position in the scheme of malignant lymphoma, based on a survey of 253 cases. Cancer 1956; 9(4): 792 – 821.
3. Rappaport H. Tumors of the Hamatopoietic systems. In: Atlas of Tumor Pathology. Armed Forces Institute of Pathology, 1966.
4. Lukes RJ, Collins RD. Immunologic characterization of human malignant lymphomas. Cancer 1974; 34 (Suppl 4): 1488 – 1503.
5. Bennett M, Farrer ‑ Brown G, Henry K et al. Classification of non‑Hodgkin‘s lymphomas. Lancet 1974; 304(7877): 405 – 408.
6. Lennert K. Morphology and classification of malignant lymphomas and so ‑ called reticuloses. Acta Neuropathol Suppl 1975; Suppl 6 : 1 – 16.
7. Kohler G, Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature 1975; 256(5517): 495 – 497.
8. National Cancer Institute sponsored study of classifications of non‑Hodgkin‘s lymphomas: summary and description of a working formulation for clinical usage. The Non ‑ Hodgkin‘s Lymphoma Pathologic Classification Project. Cancer 1982; 49(10): 2112 – 2135.
9. Harris NL, Jaffe ES, Stein H et al. A revised European ‑ American classification of lymphoid neoplasms: a proposal from the International Lymphoma Study Group. Blood 1994; 84(5): 1361 – 1392.
10. Alizadeh AA, Eisen MB, Davis RE et al. Distinct types of diffuse large B ‑ cell lymphoma identified by gene expression profiling. Nature 2000; 403(6769): 503 – 511.
11. World Health Organization Classification of Tumours. Pathology and genetics of tumours of haematopoietic and lymphoid tissue. Lyon: IARC Press 2001.
12. Swerdlow SH, Campo E, Harris NL et al (eds). WHO classification of tumours of haematopoietic and lymphoid tissues. Lyon: IARC Press 2008.
13. Mamessier E, Broussais ‑ Guillaumot F, Chetaille B et al. Nature and importance of follicular lymphoma precursors. Haematologica 2014; 99(5): 802 – 810. doi: 10.3324/ haematol.2013.085548.
14. De Silva NS, Klein U. Dynamics of B cells in germinal centres. Nat Rev Immunol 2015; 15(3): 137 – 148. doi: 10.1038/ nri3804.
15. Chiorazzi N, Rai KR, Ferrarini M. Chronic lymphocytic leukemia. N Engl J Med 2005; 352(8): 804 – 815.
16. Jiang Y, Hatzi K, Shaknovich R. Mechanisms of epigenetic deregulation in lymphoid neoplasms. Blood 2013; 121(21): 4271 – 4279. doi: 10.1182/ blood ‑ 2012 ‑ 12 ‑ 451799.
17. Jiang Y, Melnick A. The epigenetic basis of diffuse large B ‑ cell lymphoma. Semin Hematol 2015; 52(2): 86 – 96. doi: 10.1053/ j.seminhematol.2015.01.003.
18. Ame ‑ Thomas P, Tarte K. The yin and the yang of follicular lymphoma cell niches: role of microenvironment heterogeneity and plasticity. Semin Cancer Biol 2014; 24 : 23 – 32. doi: 10.1016/ j.semcancer.2013.08.001.
19. Scott DW, Gascoyne RD. The tumour microenvironment in B cell lymphomas. Nat Rev Cancer 2014; 14(8): 517 – 534. doi: 10.1038/ nrc3774.
20. Gloghini A, Dolcetti R, Carbone A. Lymphomas occurr-ing specifically in HIV ‑ infected patients: from pathogenesis to pathology. Semin Cancer Biol 2013; 23(6): 457 – 467. doi: 10.1016/ j.semcancer.2013.08.004.
21. Al ‑ Mansour Z, Nelson BP, Evens AM. Post‑transplant lymphoproliferative disease (PTLD): risk factors, diagnosis, and current treatment strategies. Curr Hematol Malig Rep 2013; 8(3): 173 – 183. doi: 10.1007/ s11899 ‑ 013 ‑ 0162 ‑ 5.
22. De Paoli P, Carbone A. Microenvironmental abnormalities induced by viral cooperation: Impact on lymphomagenesis. Semin Cancer Biol 2015; 34 : 70 – 80. doi: 10.1016/ j.semcancer.2015.03.009.
23. Altieri A, Bermejo JL, Hemminki K. Familial risk for non‑Hodgkin lymphoma and other lymphoproliferative malignancies by histopathologic subtype: the Swedish Family ‑ Cancer Database. Blood 2005; 106(2): 668 – 672.
24. Goldin LR, Bjorkholm M, Kristinsson SY et al. Highly increased familial risks for specific lymphoma subtypes. Br J Haematol 2009; 146(1): 91 – 94. doi: 10.1111/ j.1365 ‑ 2141.2009.07721.x.
25. Uzis.cz [internetová stránka]. Ústav zdravotnických informací a statistiky. Novotvary. Dostupné z: http:/ / www.uzis.cz/ katalog/ zdravotnicka ‑ statistika/ novotvary.
26. Cheson BD, Fisher RI, Barrington SF et al. Recommendations for initial evaluation, staging, and response assessment of Hodgkin and non‑Hodgkin lymphoma: the Lugano classification. J ClinOncol 2014; 32(27): 3059 – 3068.
27. Barrington SF, Mikhaeel NG, Kostakoglu L et al. Role of imaging in the staging and response assessment of lymphoma: consensus of the International Conference on Malignant Lymphomas Imaging Working Group. J Clin Oncol 2014; 32(27): 3048 – 3058.
28. Pusey W. Cases of sarcoma and Hodgkin’s disease treated by exposures to X‑ray – a preliminary report. JAMA 1902; 38(3): 166 – 169.
29. Cheson BD, Rummel MJ. Bendamustine: rebirth of an old drug. J Clin Oncol 2009; 27(9): 1492 – 1501. doi: 10.1200/ JCO.2008.18.7252.
30. Ozegowski W, Krebs D. w ‑ [bis ‑ (chlorethyl) – amino ‑ benzimidazolyl ‑ (2)] – propionic or butyric acids as potential cytostatic agents. J Prakt Chem 1963; 20 : 178 – 186.
31. Lowenbraun S, DeVita VT, Serpick AA. Combination chemotherapy with nitrogen mustard, vincristine, procarbazine, and prednisone in lymphosarcoma and reticulum cell sarcoma. Cancer 1970; 25(5): 1018 – 1025.
32. Bonadonna G, Zucali R, Monfardini S et al. Combination chemotherapy of Hodgkin‘s disease with adriamycin, bleomycin, vinblastine, and imidazole carboxamide versus MOPP. Cancer 1975; 36(1): 252 – 259.
33. Gottlieb JA, Gutterman JU, McCredie KB et al. Chemotherapy of malignant lymphoma with adriamycin. Cancer Res 1973; 33(11): 3024 – 3028.
34. Fisher RI, Gaynor ER, Dahlberg S et al. Comparison of a standard regimen (CHOP) with three intensive chemotherapy regimens for advanced non‑Hodgkin‘s lymphoma. N Engl J Med 1993; 328(14): 1002 – 1006.
35. Tilly H, Lepage E, Coiffier BA et al. Intensive conventional chemotherapy (ACVBP regimen) compared with standard CHOP for poor ‑ prognosis aggressive non‑Hodgkin lymphoma. Blood 2003; 102(13): 4284 – 4289.
36. Récher C, Coiffier B, Haioun C et al. Intensified chemotherapy with ACVBP plus rituximab versus standard CHOP plus rituximab for the treatment of diffuse large B ‑ cell lymphoma (LNH03 - 2B): an open ‑ label randomised phase 3 trial. Lancet 2011; 378(9806): 1858 – 1867. doi: 10.1016/ S0140 ‑ 6736(11)61040 ‑ 4.
37. Diehl V, Franklin J, Pfreundschuh M et al. Standard and increased‑dose BEACOPP chemotherapy compared with COPP ‑ ABVD for advanced Hodgkin‘s disease. N Engl J Med 2003; 348(24): 2386 – 2395.
38. Maloney DG, Liles TM, Czerwinski DK et al. Phase I clinical trial using escalating single‑dose infusion of chimeric anti‑CD20 monoclonal antibody (IDEC ‑ C2B8) in patients with recurrent B ‑ cell lymphoma. Blood 1994; 84(8): 2457 – 2466.
39. McLaughlin P, Grillo L, Link BK et al. Rituximab chimeric anti‑CD20 monoclonal antibody therapy for relapsed indolent lymphoma: half of patients respond to a four‑dose treatment program. J Clin Oncol 1998; 16(8): 2825 – 2833.
40. Nadler LM, Stashenko P, Hardy R et al. Serotherapy of a patient with a monoclonal antibody directed against a human lymphoma‑associated antigen. Cancer Res 1980; 40(9): 3147 – 3154.
41. Coiffier B, Lepage E, Herbrecht R et al. MabThera (rituximab) plus CHOP is superior to CHOP alone in elderly patients with diffuse large B ‑ cell lymphoma (DLCL): intermi results of a randomized GELA trial. Blood 2000; 96 (Suppl 1):950 – 950.
42. Goede V, Fischer K, Busch R et al. Obinutuzumab plus Chlorambucil in patients with CLL and coexisting conditions. N Engl J Med 2014; 370(12): 1101 – 1110. doi: 10.1056/ NEJMoa1313984.
43. Morschhauser F, Radford J, Van Hoof A et al. Phase III trial of consolidation therapy with yttrium ‑ 90 - ibritumomab tiuxetan compared with no additional therapy after first remission in advanced follicular lymphoma. J Clin Oncol 2008; 26(32): 5156 – 5164. doi: 10.1200/ JCO.2008.17.2015.
44. Younes A, Gopal AK, Smith SE et al. Results of a pivotal phase II study of brentuximab vedotin for patients with relapsed or refractory Hodgkin‘s lymphoma. J Clin Oncol 2012; 30(18): 2183 – 2189. doi: 10.1200/ JCO.2011.38.0410.
45. Pro B, Advani R, Brice P et al. Brentuximab vedotin (SGN ‑ 35) in patients with relapsed or refractory systemic anaplastic large ‑ cell lymphoma: results of a phase II study. J Clin Oncol 2012; 30(18): 2190 – 2196. doi: 10.1200/ JCO.2011.38.0402.
46. Topp MS, Gokbuget N, Stein AS et al. Safety and activity of blinatumomab for adult patients with relapsed or refractory B ‑ precursor acute lymphoblastic leukaemia: a multicentre, single‑arm, phase 2 study. Lancet Oncol 2015; 16(1): 57 – 66. doi: 10.1016/ S1470 ‑ 2045(14)71170 ‑ 2.
47. Viardot A, Goebeler M, Hess G et al. Treatment of relapsed/ refractory diffuse large B ‑ cell lymphoma with the bispecific T ‑ cell engager (BiTE®) antibody construct blinatumomab: primary analysis results from an open ‑ label, phase 2 study. Blood 2014; 124(21): 4460 – 4460.
48. Rothe A, Sasse S, Topp MS et al. A phase 1 study of the bispecific anti‑CD30/ CD16A antibody construct AFM13 in patients with relapsed or refractory Hodgkin lymphoma. Blood 2015; 125(26): 4024 – 4031. doi: 10.1182/ blood ‑ 2014 ‑ 12 ‑ 614636.
49. Reeder CB, Ansell SM. Novel therapeutic agents for B ‑ cell lymphoma: developing rational combinations. Blood 2011; 117(5): 1453 – 1462. doi: 10.1182/ blood ‑ 2010 ‑ 06 ‑ 255067.
50. Perez ‑ Galan P, Dreyling M, Wiestner A. Mantle cell lymphoma: biology, pathogenesis, and the molecular basis of treatment in the genomic era. Blood 2011; 117(1): 26 – 38. doi: 10.1182/ blood ‑ 2010 ‑ 04 ‑ 189977.
51. Wang ML, Rule S, Martin P et al. Targeting BTK with ibrutinib in relapsed or refractory mantle ‑ cell lymphoma. N Engl J Med 2013; 369(6): 507 – 516. doi: 10.1056/ NEJMoa1306220.
52. Byrd JC, Brown JR, O‘Brien S et al. Ibrutinib versus ofatumumab in previously treated chronic lymphoid leukemia. N Engl J Med 2014; 371(3): 213 – 223. doi: 10.1056/ NEJMoa1400376.
53. Wilson WH, Young RM, Schmitz R et al. Targeting B cell receptor signaling with ibrutinib in diffuse large B cell lymphoma. Nat Med 2015; 21(8): 922 – 926.
54. Flinn I, Kimby E, Cotter FE et al. A phase III, randomized, controlled study evaluating the efficacy and safety of idelalisib (GS ‑ 1101) in combination with ofatumumab for previously treated chronic lymphocytic leukemia (CLL). ASCO Meeting Abstracts 2013; 31 (Suppl 15): TPS7131.
55. Gopal AK, Kahl BS, de Vos S et al. PI3Kd inhibition by idelalisib in patients with relapsed indolent lymphoma. N Engl J Med 2014; 370(11): 1008 – 1018. doi: 10.1056/ NEJMoa1314583.
56. Seymour J, Davids MS, Pagel JM et al. Bcl ‑ 2 Inhibitor ABT ‑ 199 (GDC ‑ 0199) monotherapy shows anti‑tumor activity including complete remissions in high‑risk relapsed/ refractory (R/ R) chronic lymphocytic leukemia (CLL) and Small lymphocytic lymphoma (SLL). Blood 2013; 122(21): 872 – 872.
57. Fowler NH, Davis RE, Rawal S et al. Safety and activity of lenalidomide and rituximab in untreated indolent lymphoma: an open ‑ label, phase 2 trial. Lancet Oncol 2014; 15(12): 1311 – 1318. doi: 10.1016/ S1470 ‑ 2045(14)70455 ‑ 3.
58. Wang M, Fowler N, Wagner ‑ Bartak N et al. Oral lenalidomide with rituximab in relapsed or refractory diffuse large cell, follicular and transformed lymphoma: a phase II clinical trial. Leukemia 2013; 27(9): 1902 – 1909. doi: 10.1038/ leu.2013.95.
59. Trneny M, Lamy T, Walewski J et al. Phase II randomized, multicenter study of lenalidomide vs best investigator’s choice in relapsed/ refractory mantle cell lymphoma: results of the MCL ‑ 002 (SPRINT) study. Blood 2014; 124(21): 626.
60. Vitolo U, Chiappella A, Franceschetti S et al. Lenalidomide plus R ‑ CHOP21 in elderly patients with untreated diffuse large B ‑ cell lymphoma: results of the REAL07 open ‑ label, multicentre, phase 2 trial. Lancet Oncol 2014; 15(7): 730 – 737. doi: 10.1016/ S1470 ‑ 2045(14)70191 ‑ 3.
61. Ansell SM, Lesokhin AM, Borrello I et al. PD ‑ 1 blockade with nivolumab in relapsed or refractory Hodgkin‘s lymphoma. N Engl J Med 2015; 372(4): 311 – 319. doi: 10.1056/ NEJMoa1411087.
62. Moskowitz CH, Ribrag V, Michot JM et al. PD ‑ 1 Blockade with the monoclonal antibody pembrolizumab (MK ‑ 3475) in patients with classical Hodgkin lymphoma after brentuximab vedotin failure: preliminary results from a phase 1b study (KEYNOTE ‑ 013). Blood 2014; 124(21): 290.
63. Westin JR, Chu F, Zhang M et al. Safety and activity of PD1 blockade by pidilizumab in combination with rituximab in patients with relapsed follicular lymphoma: a single group, open ‑ label, phase 2 trial. Lancet Oncol 2014; 15(1): 69 – 77. doi: 10.1016/S1470 ‑ 2045(13)70551 ‑ 5.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2015 Issue Supplementum 3
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Safety and Tolerance of Metamizole in Postoperative Analgesia in Children
-
All articles in this issue
- Molekulární prognostické markery chronické lymfocytární leukemie a jejich klinický význam
- Význam minimální zbytkové nemoci u chronické lymfocytární leukemie
- Monoklonální protilátky v léčbě chronické lymfocytární leukemie v roce 2015
- Léčebné možnosti pro nemocné s chronickou lymfocytární leukemií a významnými přidruženými chorobami
- Léčba chronické lymfocytární leukemie s aberací TP53
- Malé molekuly v léčbě chronické lymfocytární leukemie v roce 2015 a v blízké budoucnosti
- Aktuality v podpůrné léčbě chronické lymfocytární leukemie
- Maligní lymfomy − minulost, současnost a budoucnost
- Difuzní velkobuněčný B lymfom – moderní způsoby diagnostiky a molekulárně cílené léčby
- Folikulární lymfom
- Lymfom z plášťových buněk – současný stav poznání a možnosti léčby
- Záchranná léčba a role transplantací u lymfomů
- Současné možnosti imunoterapie nádorových onemocnění
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Difuzní velkobuněčný B lymfom – moderní způsoby diagnostiky a molekulárně cílené léčby
- Folikulární lymfom
- Lymfom z plášťových buněk – současný stav poznání a možnosti léčby
- Záchranná léčba a role transplantací u lymfomů
