Lymfom z plášťových buněk – současný stav poznání a možnosti léčby
Mantle Cell Lymphoma – Cutting ‑ edge Diagnostics and Treatment Approaches
Background:
Mantle cell lymphoma represents a specific subtype of B ‑ cell non‑Hodgkin lymphoma characterized on the molecular level by translocation t(11;14)(q13;q32) leading to aberrant overexpression of cyclin D1 and deregulation of the cell cycle. Despite sporadic indolent forms of mantle cell lymphoma, majority of patients present with advanced aggressive disease that requires immediate treatment. Despite chemosensitive nature of mantle cell lymphoma, approximately 10% patients present with a refractory disease, and the vast majority of patients who initially respond to therapy, relapse sooner or later. The course of mantle cell lymphoma thus represents a chronically relapsing malignancy requiring further and further lines of therapies. Prognosis of relapsed or refractory (R/ R) mantle cell lymphoma is dismal.
Aim:
The goal of this article is to provide a cutting ‑ edge review of currently used diagnostic and treatment approaches for mantle cell lymphoma.
Results:
Several key modifications of the therapeutic algorithm of mantle cell lymphoma treatment implemented in the past 10 years resulted in significantly improved prognosis of patients. The milestones in the therapy of mantle cell lymphoma include incorporation of anti‑CD20 monoclonal antibody rituximab into induction therapy, intensification of polychemotherapeutic regimen including implementation of high‑dose cytarabine, consolidation of response with high‑dose therapy and autologous stem cell transplantation (HDT ‑ ASCT) in younger fit patients, and maintenance therapy with rituximab in the elderly patients. Besides such “optimization” of front‑line therapy, introduction of novel anti‑lymphoma agents into therapy of R/ R mantle cell lymphoma also contributed (and will contribute in the future) to improved prognosis of mantle cell lymphoma. Among these agents, there is a new cytostatic drug bendamustine, Bruton tyrosine ‑ kinase inhibitor ibrutinib, immunomodulatory agent lenalidomide, mTOR inhibitor temsirolimus and proteasome inhibitor bortezomib.
Conclusion:
The overall survival of mantle cell lymphoma virtually doubled in the recent 10 years as a result of two key factors: 1. optimization of front‑line therapy with “conventional” anti‑lymphoma agents, and 2. brand new possibilities of therapy for R/ R mantle cell lymphoma thanks to the introduction of novel anti‑lymphoma agents. Combinatorial approaches using most efficacious combinations of novel and conventional anti‑mantle cell lymphoma agents will definitely lead to further improvements of survival parameters in mantle cell lymphoma patients in near future.
Key words:
mantle cell lymphoma – minimal residual disease – autologous transplantation
This study was supported by project PRVOUK-27//LF1/1, IGA-MZ NT/13072-4, IGA-MZ NT 13201-4/2012.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted:
24. 9. 2015
Accepted:
27. 9. 2015
Authors:
P. Klener Jr.; M. Trněný
Authors‘ workplace:
I. interní klinika – klinika hematologie 1. LF UK a VFN v Praze
Published in:
Klin Onkol 2015; 28(Supplementum 3): 80-86
doi:
https://doi.org/10.14735/amko20153S80
Overview
Východiska:
Lymfom z plášťových buněk představuje specifický podtyp B ‑ non ‑ Hodgkinova lymfomu charakterizovaný na molekulární úrovni přítomností translokace t(11;14)(q13;q32), která vede k aberantní expresi cyklinu D1 a následné deregulaci buněčného cyklu. Navzdory sporadickému výskytu indolentních forem lymfomu z plášťových buněk nevyžadujících řadu měsíců či dokonce let terapii převažují v běžné klinické praxi jednoznačně agresivní formy lymfomu z plášťových buněk. Přestože má lymfom z plášťových buněk chemosenzitivní povahu, cca 10 % pacientů na léčbu neodpoví (refrakterní nemoc) a většina zbylých pacientů prodělá dříve či později návrat (relaps) choroby. Průběh léčby lymfomu z plášťových buněk tak z dlouhodobé perspektivy obvykle probíhá pod obrazem chronicky relabujícího onemocnění vyžadujícího aplikace dalších a dalších linií léčby. Prognóza relabujícího lymfomu z plášťových buněk je však extrémně nepříznivá.
Cíl:
Cílem tohoto přehledu je shrnout současné postupy v diagnostice a terapii lymfomu z plášťových buněk.
Výsledky:
Terapeutický algoritmus primoterapie lymfomu z plášťových buněk doznal v poslední dekádě řady modifikací, které významně zlepšily prognózu pacientů. Mezi klíčové milníky léčby lymfomu z plášťových buněk patří např. včlenění monoklonální protilátky rituximab do indukční části terapie, intenzifikace polychemoterapeutických režimů u mladších pacientů včetně implementace vysokodávkovaného cytarabinu, pevné ukotvení konsolidace léčebné odpovědi pomocí vysokodávkované terapie a autologní transplantace kostní dřeně u mladších pacientů nebo začlenění udržovací léčby rituximabem. Kromě této „optimalizace“ primoterapie bylo dalším klíčovým faktorem zlepšení prognózy pacientů s lymfomem z plášťových buněk schválení nových účinných léků v posledních několika letech. Nové léky totiž zásadním způsobem rozšířily paletu léčebných možností relapsů či refrakterních forem lymfomu z plášťových buněk, které byly dříve indikovány k paliativní či symptomatické léčbě. Mezi tyto léky patří staronové cytostatikum bendamustin, inhibitor Brutonovy tyrozinkinázy ibrutinib, imunomodulační látka lenalidomid, inhibitor mTOR temsirolimus a inhibitor proteazomu bortezomib.
Závěr:
Díky dvěma klíčovým faktorům, tj. 1. optimalizaci primoterapie pomocí „konvenčních“ protilymfomových léků a postupů a 2. významnému rozšíření možností léčby relapsů pomocí nových léků, se celkové přežití pacientů s lymfomem z plášťových buněk za posledních 10 let v zásadě zdvojnásobilo (z 3 – 4 let v první dekádě nového tisíciletí na současných 6 – 8 let). Optimální využití nových léků včetně jejich vzájemných kombinací povede zcela jistě v blízké budoucnosti k dalšímu zlepšení prognózy pacientů s lymfomem z plášťových buněk.
Klíčová slova:
lymfom z plášťových buněk – minimální reziduální choroba – autologní transplantace
Epidemiologie a diagnostická kritéria
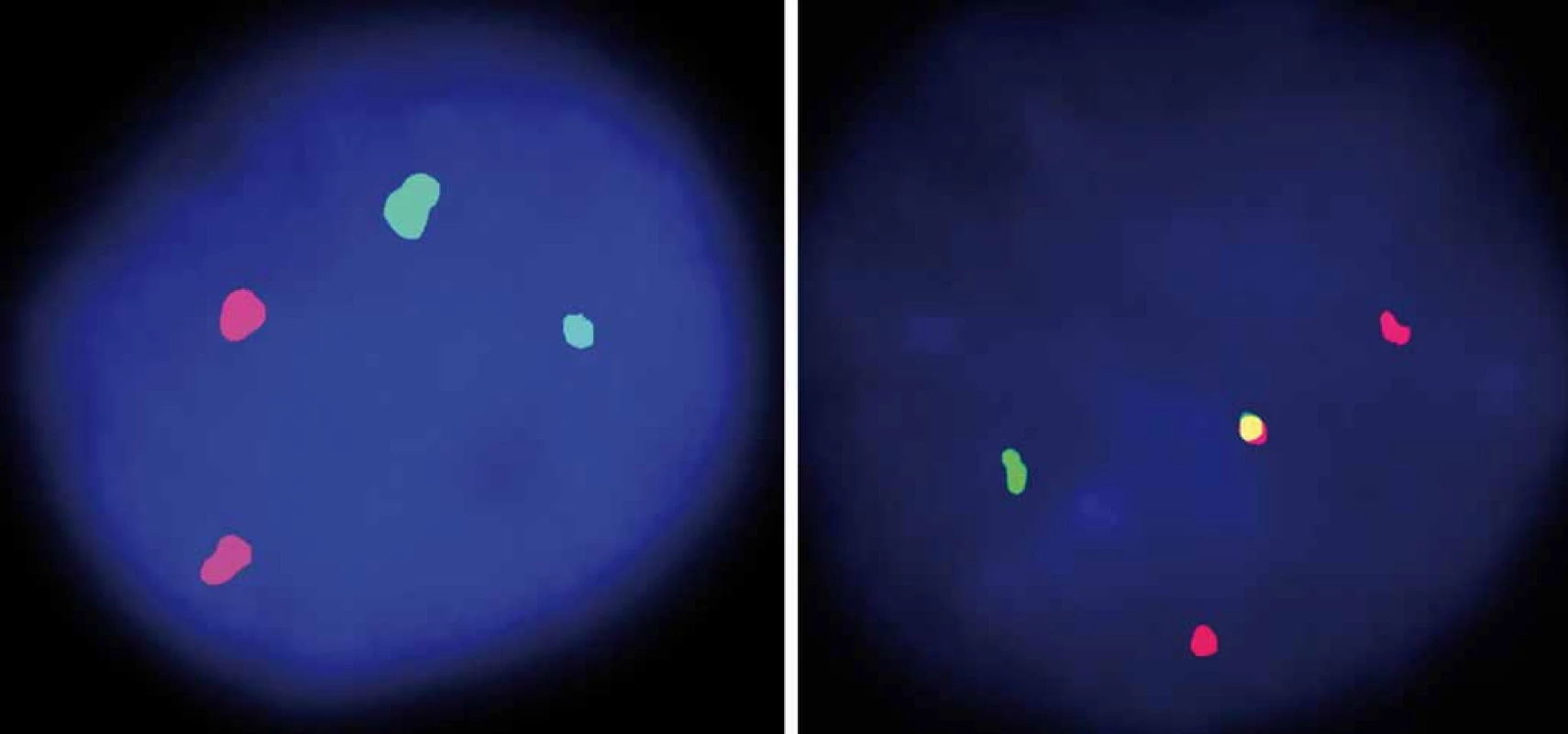
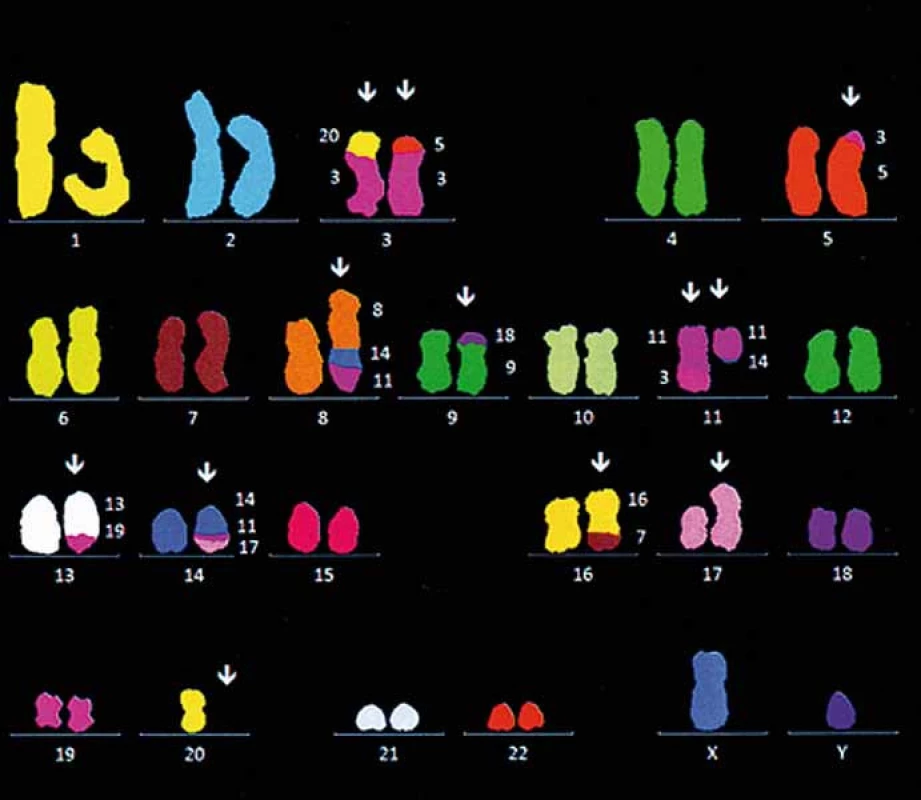
Incidence non ‑ Hodgkinových lymfomů (NHL) v ČR je cca 16/ 100 000/ rok, což ročněobnáší téměř 2 000 nově diagnostiko-vaných pacientů. B lymfomy (B ‑ NHL) jsou výrazně četnější ve srovnání s T lymfomy (T ‑ NHL) a to v poměru cca 9 : 1. Podle klinického průběhu lze lymfomy dělit na agresivní a indolentní. Nejčastější typy B ‑ NHL na západní polokouli představují difuzní velkobuněčný lymfom (patřící mezi agresivní lymfomy) a folikulární lymfom (náležící mezi indolentní lymfomy). Lymfom z plášťových buněk (mantle cell lymphoma – MCL) tvoří cca 6 – 8 % B ‑ NHL [1]. MCL je charakterizován na molekulární úrovni translokací t(11;14)(q13;q32), která vede k juxtapozici a nadměrné expresi cyklinu D1 (obr. 1). Kromě této patognomonické aberace nacházíme u MCL celou škálu dalších cytogenetických změn, včetně mutace genu pro ATM (např. delece 11q22 – 23), TP53 (delece 17p13) či CDKN2A/ p16INK4A/ p14ARF (delece lokusu 9p21). Vedle nadměrné exprese cyklinu D1 nacházíme u části pacientů nadměrnou expresi cyklin‑dependentní kinázy CDK4 (amplifikace 12q13), antiapoptotického regulátoru BCL2 či ubikvitin‑ligázy MDM2. Tyto změny vedou k poruchám průchodu buňky buněčným cyklem a defektní opravě DNA, což má za následek zvýšenou frekvenci vzniku sekundárních mutací [2]. MCL je nemoc staršího věku, medián věku při stanovení diagnózy je 66 let. Onemocnění se z nejasného důvodu vyskytuje častěji u mužů než u žen v poměru cca 2 – 3 : 1. MCL má charakteristický imunofenotyp – typická je pozitivita CD19, CD20 a CD5, zatímco znaky CD10, CD23 a CD200 jsou obvykle negativní. V případě histologického vyšetření zvětšené uzliny či infiltrovaného orgánu lze prakticky u všech pacientů s MCL prokázat zvýšenou expresi cyklinu D1 a BCL2 antiapoptotického proteinu. Na základě morfologie rozeznáváme méně agresivní klasickou (konvenční) variantu a agresivnější blastoidní varianty (pleomorfní a blastickou). U blastoidních variant MCL nacházíme často sekundární aberace, včetně mutací transkripčního faktoru MYC (amplifikace 8q24, translokace t(8;14)) či komplexní změny karyotypu (obr. 2). Typicky se u pacientů s MCL při diagnóze vyskytuje kromě obvykle rozsáhlého nodálního postižení (tj. postižení uzlin a sleziny) i extranodální postižení lymfomem, nejčastěji infiltraci kostní dřeně MCL klonem (u cca 80 % pacientů) zvláště s vyplavováním MCL buněk do periferní krve (leukemizace). Časté je též postižení gastrointestinálního traktu (infiltrace žaludku či střev). Postižení CNS, obvykle ve formě infiltrace likvoru detekovatelné pomocí průtokové cytometrie, nacházíme vstupně u < 5 % pacientů. Mezi hlavní rizikové faktory infiltrace CNS patří vysoká hladina laktátdehydrogenázy, blastoidní morfologická varianta choroby, nízký výkonnostní stav (tzv. performance status) a vysoké riziko dle mezinárodního prognostického indexu pro MCL (MCL international prognostic index – MIPI) (viz dále).
Prognostické ukazatele
Na základě čtyř parametrů (věk, počet leukocytů, hladina laktátdehydrogenázy a výkonnostní stav) tvořících MIPI lze pacienty s MCL při diagnóze rozdělit do tří rizikových skupin s odhadem předpokládaného přežití – pacienty s nízkým, středním a vysokým rizikem dle MIPI [3,4]. Analýza dat českých pacientů s MCL z registru Kooperativní lymfomové skupiny za období 1999 – 2010 prokázala, že pacienti s nízkým, středním a vysokým rizikem dle MIPI vykazují medián celkového přežití (overall survival – OS) 8,8, 4,5, resp. 2,1 roku od stanovení diagnózy [5]. Kromě MIPI se mezi důležité prognostické ukazatele řadí též proliferační index dle Ki ‑ 67/ MIB1 [6]. Bylo opakovaně potvrzeno, že pacienti s proliferačním indexem dle Ki ‑ 67 ≥ 30 % vykazují statisticky významně horší prognózu ve srovnání s pacienty s proliferačním indexem < 30 %. Mezi další nepříznivé prognostické ukazatele patří mutace tumor ‑ supresorového genu TP53 (delece 17p, nebo bodové mutace TP53) [7]. Diagnóza je založena na imunohistochemické detekci zvýšené exprese cyklinu D1 v bioptované uzlině či kostní dřeni, a v záchytu translokace t(11;14) v lymfomové populaci. Vstupní vyšetření (staging) zahrnuje kromě toho zjištění rozsahu choroby pomocí CT či PET ‑ CT a vyšetření kostní dřeně (trepanobiopsie). U pacientů s vysokým rizikem postižení CNS je vhodné vstupní vyšetření likvoru pomocí průtokové cytometrie. U pacientů s neurologickou symptomatikou budící klinické podezření na postižení CNS lymfomem je kromě vyšetření likvoru na místě též provedení vstupního CT či MRI hlavy. Mezi nejdůležitější prognostické faktory po léčbě patří dosažení kompletní remise dle CT (s dosažením remise choroby v kostní dřeni dle trepanobiopsie), dosažení PET ‑ negativity pomocí PET a dosažení molekulární remise pomocí stanovení minimální reziduální choroby (minimal residual disease – MRD) v kostní dřeni a periferní krvi (obr. 3).
Minimální zbytková nemoc
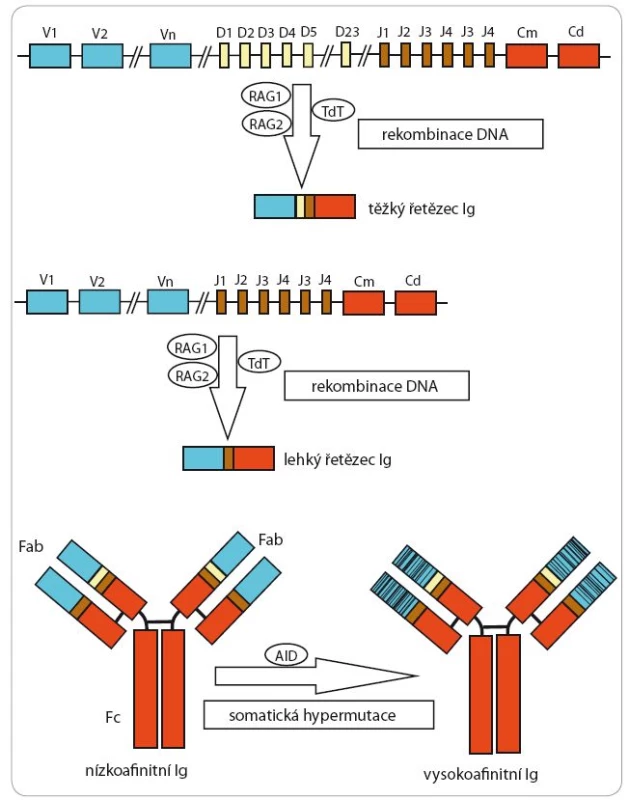
Minimální zbytková (reziduální) nemoc (MRD) znamená záchyt zbytkové populace MCL buněk v množství, které je pod limitem standardních vyšetřovacích metod, jimiž se hodnotí odpověď na léčbu (tj. CT, PET ‑ CT, imunohistochemické (IHC) vyšetření kostní dřeně) [8]. MRD lze stanovit buď pomocí průtokové cytometrie (8barevné kombinace s citlivostí 10– 4) nebo pomocí kvantitativní polymerázové řetězové reakce (qPCR) s citlivostí 10– 5 až 10– 7. MRD se obvykle stanovuje v kostní dřeni a periferní krvi pacienta v průběhu léčby a po léčbě. Výhodou stanovení MRD pomocí průtokové cytometrie je jednak rychlost metodiky (výsledek je k dispozici během hodin od odběru materiálu), jednak absence pracného nastavování systému pro detekci pacient ‑ specifických primerů (v případě stanovení MRD pomocí PCR). Nevýhodou ve srovnání s PCR metodikou je nižší citlivost a nezbytná dostupnost čerstvého materiálu. Molekulárním cílem pro qPCR je záchyt translokace t(11;14) - tato metoda je využitelná u všech pacientů, u kterých lze translokaci technicky zachytit (pouze cca 30 % pacientů). Alternativním molekulárním cílem pro sledování MRD pomocí qPCR je záchyt přestavby variabilních úseků těžkých řetězců pro imunoglobuliny (obr. 4) [9]. Podmínkou pro konstrukci pacient ‑ specifických primerů je dostatečné množství biologického materiálu při stanovení diagnózy (významně infiltrovaná periferní či dřeňová krev), které umožní vytvoření ředící řady nezbytné pro následnou kvantifikaci MRD. Sekvenování nové generace (next ‑ generation sequencing – NGS) založené na masivní paralelní sekvenaci umožňuje záchyt a konstrukci molekulárních cílů v materiálu s relativně nízkou infiltrací MCL klonem [10]. Širšímu využití NGS však zatím brání vysoká cena vyšetření. Recentně jsme prokázali, že pro přípravu pacient ‑ specifických cílů lze použít kromě lymfomových buněk izolovaných z periferní krve či kostní dřeně též DNA izolovanou z parafínových bločků orgánů infiltrovaných lymfomem [11]. Kromě kvantifikace translokace t(11;14) či přestavby variabilních úseků těžkých řetězců pro imunoglobuliny existují alternativní metody monitorace MRD, např. kvantifikace exprese cyklinu D1 či SOX11 pomocí PCR. Stanovení MRD má dle naprosté většiny dosud publikovaných prací důležitý prognostický význam [8]. Dosažení tzv. molekulární remise (tj. MRD ‑ negativity) po léčbě je asociováno s lepší prognózou ve srovnání s přetrvávajícím záchytem zbytkové MCL populace (tj. MRD‑pozitivitou). Jako tzv. molekulární relaps se označuje situace, kdy po původním dosažení MRD ‑ negativity dojde k opětovnému záchytu MCL buněk, aniž dojde ke klinicky manifestnímu relapsu choroby. Vzhledem k tomu, že molekulární relaps předchází téměř ve 100 % klinický návrat choroby, indikují některá pracoviště tzv. preemptivní terapii obvykle založenou na imunoterapii pomocí monoklonální protilátky rituximab.
Terapie mladších pacientů
Léčba MCL se dělí podle toho, zda pacient je či není schopen absolvovat léčbu pomocí vysokodávkované chemoterapie [12]. Pacienti únosní vysokodávkované léčby jsou léčeni ve třech fázích: indukce → konsolidace → udržovací fáze. Indukční fáze má za cíl navodit kompletní remisi onemocnění. Standardem je intenzifikovaný imunochemoterapeutický režim obsahující alkylační cytostatikum cyklofosfamid, antryklin doxorubicin (adriamycin), vinca ‑ alkaloid vinkristin, vysokodávkovaný cytarabin (high‑dose araC – HDAC), anti‑CD20 monoklonální protilátku (R)ituximab a kortikoidy (např. R ‑ MaxiCHOP, R ‑ HyperCVAD, R ‑ HDAC) [13 – 17]. Včlenění rituximabu a HDAC do indukčního režimu významným způsobem přispělo ke zlepšení prognózy pacientů s MCL v posleních 10 letech [5,18,19]. Podává se obvykle šest cyklů chemoterapie v intervalu 21 dnů (např. R ‑ MaxiCHOP/ R ‑ HDAC, 3 + 3 cykly). Většina pacientů (kolem 80 – 90 %) vykáže po indukční části léčby klinicky objektivně měřitelnou odpověď (parciální nebo kompletní remisi onemocnění). Léčebná odpověď je následně konsolidována vysokodávkovanou chemoterapií a autologní transplantací kostní dřeně (ASCT) [20]. Recentně publikované práce naznačují, že podávání udržovací terapie pomocí anti‑CD20 monoklonální protilátky rituximab (obvykle v intervalu 2 – 3 měsíců po dobu min. 2 let) prodlužuje bezpříznakové období [21]. Součástí léčby pacientů s prokázanou infiltrací CNS je v případě meningeálního postižení opakovaná intratekální aplikace depotního cytarabinu, v případě ložiskového postižení CNS je nutná systémová léčba vysokodávkovaným metotrexátem.
Terapie starších či komorbidních pacientů
Terapie starších či komorbidních pacientů (tj. pacientů neúnosných vysokodávkované terapie a ASCT) je založena na středně intenzivních imunochemoterapeutických režimech složených z alkylačních látek a antracyklinů (cyklofosfamid + doxorubicin + vinkristin + prednizon – CHOP) či na staronovém cytostatiku bendamustinu, vždy v kombinaci s rituximabem (tj. R ‑ CHOP nebo R ‑ bendamustin) [22]. Bylo prokázáno, že pacienti léčení režimem R ‑ CHOP profitují z následné udržovací terapie rituximabem [23]. Terapie pacientů, pro které jsou z důvodu vysokého věku či významných komorbidit rizikové i středně intenzivní léčebné režimy, je založena na alkylačních látkách (cyklofosfamid, chlorambucil), opět v kombinaci s rituximabem.
Terapie relapsu či progrese onemocnění
V současné době neexistuje „standardní“ léčba relabovaných či refrakterních pacientů s MCL [24]. V případě návratu (relapsu) choroby se za jedinou potenciálně kurativní metodu považuje alogenní transplantace kostní dřeně (alloSCT) [21]. Optimální výsledky alloSCT jsou dosahovány u pacientů, kteří pomocí záchranných léčebných režimů dosáhnou ≥ 2. kompletní remise. K navození remise se nejčastěji používají intenzifikované chemoterapeutické režimy založené na platinových derivátech, v kombinaci s vysokodávkovaným cytarabinem (režim DHAP – cisplatina, vysokodávkovaný cytarabin, dexametazon), etopozidem (ESHAP – etopozid, vysokodávkovaný cytarabin, cisplatina) nebo gemcitabinem (GDP – gemcitabin, cisplatina, dexametazon), vždy v kombinaci s kortikoidy a obvykle v kombinaci s rituximabem (v případě přetrvávající CD20‑pozitivity lymfomu). U části pacientů dojde při relapsu k transformaci do blastické varianty MCL, která bývá na molekulární úrovni doprovázena sekundárními aberacemi či komplexními změnami karyotypu – tito pacienti mají extrémně špatnou prognózu. Obzvláště nepříznivou prognózu mají také pacienti, u kterých dojde k návratu choroby v CNS. Všichni pacienti, u nichž nelze uvažovat o indikaci k provedení alloSCT, nemají vhodného dárce kostní dřeně nebo tento léčebný postup odmítnou, by měli být léčeni v rámci klinických studií. Pokud pacienti nesplňují kritéria pro vstup do studie, terapii v rámci klinické studie odmítnou nebo pokud není vhodná studiová léčba k dispozici, je k dispozici celá škála protilymfomových látek zahrnující jednak standardně hrazené chemoterapeutické režimy založené na platinových derivátech či fludarabinu, jednak tzv. nové léky, u nichž je nezbytné žádat příslušnou zdravotní pojišťovnu o schválení zvýšené úhrady (viz další kapitola).
Nové léky v terapii relabovaného/ refrakterního MCL
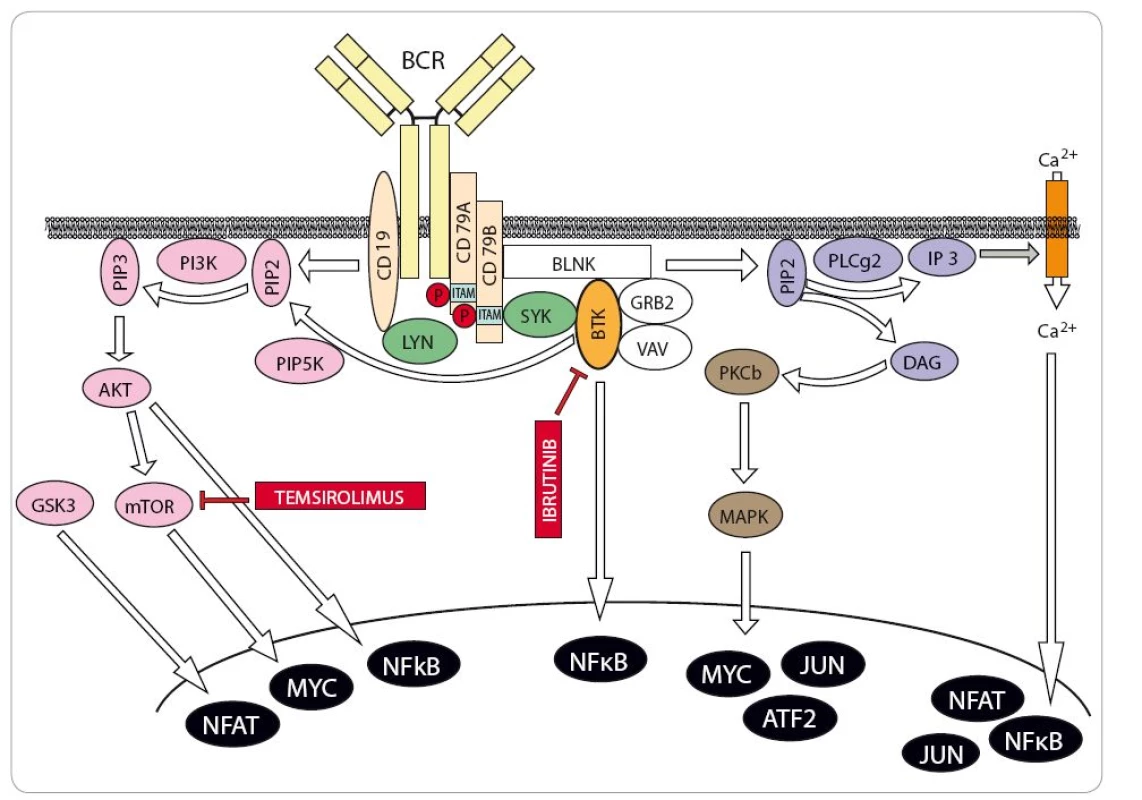
V posledních letech bylo do terapie MCL zavedeno několik nových léků, které významným způsobem rozšířily možnosti léčby zejména relabovaného/ refrakterního MCL (R/ R MCL). Temsirolimus (Torisel®) je inhibitor mTOR schválený v Evropě k léčbě R/ R MCL [25]. Klíčová registrační studie fáze III však prokázala poměrně skromné prodloužení přežití bez progrese choroby v kohortě pacientů léčených temsirolimem ve srovnání s pacienty léčenými výběrem investigátora (investigator’s choice – IC). Bortezomib (Velcade®), inhibitor proteazomu, je zatím registrován v indikaci R/ R MCL pouze v USA [26]. Podobně jako temsirolimus ani monoterapie bortezomibem ovšem není s to u většiny pacientů navodit remise trvající déle než několik měsíců. Naproti tomu lenalidomid (Revlimid®), imunomodulační látka s dosud ne zcela vyjasněným mechanizmem protilymfomového působení, dokáže u části pacientů navodit i dlouhodobé remise [27,28]. Spolehlivý molekulární marker, který by predikoval účinnost léčby lenalidomidem, však zatím není znám. Další účinnou látkou v terapii R/ R MCL je staronové cytostatikum bendamustin (Levact®), který u pacientů s R/ R MCL prokázal dobrý účinek v kombinaci s rituximabem [29]. V některých zemích se kombinace bendamustinu a rituximabu používá u starších pacientů v 1. linii terapie, neboť je při srovnatelné účinnosti méně toxická než režim R ‑ CHOP [22]. Převratným lékem v léčbě nejen MCL je ibrutinib (Imbruvica®), inhibitor Brutonovy tyrozinkinázy, která představuje klíčovou molekulu přenášející signál z B buněčného receptoru (BCR) do nitra buňky (obr. 5) [30]. Inhibice signalizace z BCR je pro většinu MCL buněk letální. Nadějné výsledky v pilotních klinických studiích projevil specifický inhibitor BCL2 venetoclax (ABT ‑ 199/ GDC ‑ 0199). Vzhledem k tomu, že žádný z nových léků není s to navodit trvalou remisi u pacientů s R/ R MCL, zaměřují se v současné době klinické studie na analýzu protilymfomové účinnosti (a bezpečnosti) kombinovaných režimů zahrnujících nové a staré léky. Dobrou účinnost v terapii R/ R MCL prokázaly kombinace bendamustinu s rituximabem a cytarabinem (režim R ‑ BAC), ibrutinibu s rituximabem, lenalidomidu s rituximabem či temsirolimu s bendamustinem a rituximabem (režim BERT) [31 – 33]. Nechemoterapeutická kombinace lenalidomidu a rituximabu (R2) se testuje jako alternativa k udržovací monoterapii rituximabem.
Shrnutí
Léčba (a prognóza) MCL doznala v poslední dekádě převratných změn. Díky dvěma klíčovým faktorům, 1. optimalizaci primoterapie pomocí „konvenčních“ protilymfomových léků a léčebných postupů a 2. významnému rozšíření možností léčby relapsů zavedením nových léků do klinické praxe, se celkové přežití pacientů s MCL za posledních 10 let v zásadě zdvojnásobilo (z 3 – 4 let v první dekádě nového tisíciletí na v současnosti odhadovaných 6 – 8 let). Optimální využití nových léků včetně jejich vzájemných kombinací mezi sebou či spolu se „starými“ léčivy povedou zcela jistě v blízké budoucnosti k dalšímu zlepšení prognózy pacientů s MCL.
Tato práce byla podpořena projektem PRVOUK-27/LF1/1, IGA-MZ NT/13072-4, IGA-MZ NT 13201-4/2012.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Pavel Klener Jr., Ph.D.
I. interní klinika – klinika hematologie
1. LF UK a VFN v Praze
U Nemocnice 2
128 08 Praha 2
e-mail: pavel.klener2@vfn.cz
Obdrženo: 24. 9. 2015
Přijato: 27. 9. 2015
Sources
1. Dreyling M. Mantle cell lymphoma: biology, clinical presentation, and therapeutic approaches. Am Soc Clin Oncol Educ Book 2014 : 191 – 198. doi: 10.14694/ EdBook_AM.2014.34.191.
2. Zhang J, Jima D, Moffitt AB et al. The genomic landscape of mantle cell lymphoma is related to the epigenetically determined chromatin state of normal B cells. Blood 2014; 123(19): 2988 – 2996. doi: 10.1182/ blood ‑ 2013 ‑ 07 ‑ 517177.
3. Hoster E, Dreyling M, Klapper W et al. A new prognostic index (MIPI) for patients with advanced‑stage mantle cell lymphoma. Blood 2008; 111(2): 558 – 565.
4. Hoster E, Klapper W, Hermine O et al. Confirmation of the mantle ‑ cell lymphoma International Prognostic Index in randomized trials of the European Mantle ‑ Cell Lymphoma Network. J Clin Oncol 2014; 32(13): 1338 – 1346. doi: 10.1200/ JCO.2013.52.2466.
5. Salek D, Vesela P, Boudova L et al. Retrospective analysis of 235 unselected patients with mantle cell lymphoma confirms prognostic relevance of Mantle Cell Lymphoma International Prognostic Index and Ki ‑ 67 in the era of rituximab: long‑term data from the Czech Lymphoma Project Database. Leuk Lymphoma 2014; 55(4): 802 – 810. doi: 10.3109/ 10428194.2013.815349.
6. Klapper W, Hoster E, Determann O et al. Ki ‑ 67 as a prognostic marker in mantle cell lymphoma ‑ consensus guidelines of the pathology panel of the European MCL Network. J Hematop 2009; 2(2): 103 – 111. doi: 10.1007/ s12308 ‑ 009 ‑ 0036 ‑ x.
7. Stefancikova L, Moulis M, Fabian P et al. Loss of the p53 tumor suppressor activity is associated with negative prognosis of mantle cell lymphoma. Int J Oncol 2010; 36(3): 699 – 706.
8. Pott C, Hoster E, Delfau ‑ Larue MH et al. Molecular remission is an independent predictor of clinical outcome in patients with mantle cell lymphoma after combined immunochemotherapy: a European MCL intergroup study. Blood 2010; 115(16): 3215 – 3223. doi: 10.1182/ blood ‑ 2009 ‑ 06 ‑ 230250.
9. van Dongen JJ, Langerak AW, Bruggemann M et al. Design and standardization of PCR primers and protocols for detection of clonal immunoglobulin and T ‑ cell receptor gene recombinations in suspect lymphoproliferations: report of the BIOMED ‑ 2 Concerted Action BMH4-CT98 - 3936. Leukemia 2003; 17(12): 2257 – 2317.
10. Rogers YH, Venter JC. Genomics: massively parallel sequencing. Nature 2005; 437(7057): 326 – 327.
11. Kalinova M, Fronkova E, Klener P et al. The use of formalin‑fixed, paraffin‑embedded lymph node samples for the detection of minimal residual disease in mantle cell lymphoma. Br J Haematol 2015; 169(1): 145 – 148. doi: 10.1111/ bjh.13182.
12. Dreyling M, Ferrero S, Hermine O. How to manage mantle cell lymphoma. Leukemia 2014; 28(11): 2117 – 2130. doi: 10.1038/ leu.2014.171.
13. Merli F, Luminari S, Ilariucci F et al. Rituximab plus HyperCVAD alternating with high dose cytarabine and methotrexate for the initial treatment of patients with mantle cell lymphoma, a multicentre trial from Gruppo Italiano Studio Linfomi. Br J Haematol 2012; 156(3): 346 – 353. doi: 10.1111/ j.1365 ‑ 2141.2011.08958.x.
14. Romaguera JE, Fayad LE, Feng L et al. Ten‑year follow‑up after intense chemoimmunotherapy with rituximab ‑ HyperCVAD alternating with rituximab ‑ high dose methotrexate/ cytarabine (R ‑ MA) and without stem cell transplantation in patients with untreated aggressive mantle cell lymphoma. Br J Haematol 2010; 150(2): 200 – 208. doi: 10.1111/ j.1365 ‑ 2141.2010.08228.x.
15. Bernstein SH, Epner E, Unger JM et al. A phase II multicenter trial of hyperCVAD MTX/ Ara ‑ C and rituximab in patients with previously untreated mantle cell lymphoma; SWOG 0213. Ann Oncol 2013; 24(6): 1587 – 1593. doi: 10.1093/ annonc/ mdt070.
16. Lefrere F, Delmer A, Suzan F et al. Sequential chemotherapy by CHOP and DHAP regimens followed by high‑dose therapy with stem cell transplantation induces a high rate of complete response and improves event‑free survival in mantle cell lymphoma: a prospective study. Leukemia 2002; 16(4): 587 – 593.
17. Delarue R, Haioun C, Ribrag V et al. CHOP and DHAP plus rituximab followed by autologous stem cell transplantation in mantle cell lymphoma: a phase 2 study from the Groupe d‘Etude des Lymphomes de l‘Adulte. Blood 2013; 121(1): 48 – 53. doi: 10.1182/ blood ‑ 2011 ‑ 09 ‑ 370320.
18. Lenz G, Dreyling M, Hoster E et al. Immunochemotherapy with rituximab and cyclophosphamide, doxorubicin, vincristine, and prednisone significantly improves response and time to treatment failure, but not long‑term outcome in patients with previously untreated mantle cell lymphoma: results of a prospective randomized trial of the German Low Grade Lymphoma Study Group (GLSG). J Clin Oncol 2005; 23(9): 1984 – 1992.
19. Geisler CH, Kolstad A, Laurell A et al. Nordic MCL2 trial update: six‑year follow‑up after intensive immunochemotherapy for untreated mantle cell lymphoma followed by BEAM or BEAC + autologous stem ‑ cell support: still very long survival but late relapses do occur. Br J Haematol 2012; 158(3): 355 – 362. doi: 10.1111/ j.1365 ‑ 2141.2012.09174.x.
20. Robinson S, Dreger P, Caballero D et al. The EBMT/ EMCL consensus project on the role of autologous and allogeneic stem cell transplantation in mantle cell lymphoma. Leukemia 2015; 29(2): 464 – 473. doi: 10.1038/ leu.2014.223.
21. Vaughn JE, Sorror ML, Storer BE et al. Long‑term sustained disease control in patients with mantle cell lymphoma with or without active disease after treatment with allogeneic hematopoietic cell transplantation after nonmyeloablative conditioning. Cancer. In press 2015. doi: 10.1002/ cncr.29498.
22. Rummel MJ, Niederle N, Maschmeyer G et al. Bendamustine plus rituximab versus CHOP plus rituximab as first‑line treatment for patients with indolent and mantle ‑ cell lymphomas: an open ‑ label, multicentre, randomised, phase 3 non‑inferiority trial. Lancet 2013; 381(9873): 1203 – 1210. doi: 10.1016/ S0140 ‑ 6736(12)61763 ‑ 2.
23. Kluin‑Nelemans HC, Hoster E, Hermine O et al. Treatment of older patients with mantle ‑ cell lymphoma. N Engl J Med 2012; 367(6): 520 – 531. doi: 10.1056/ NEJMoa1200920.
24. Dreyling M, Geisler C, Hermine O et al. Newly diagnosed and relapsed mantle cell lymphoma: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow‑up. Ann Oncol 2014; 25 (Suppl 3): 83 – 92. doi: 10.1093/ annonc/ mdu264.
25. Hess G, Herbrecht R, Romaguera J et al. Phase III study to evaluate temsirolimus compared with investigator‘s choice therapy for the treatment of relapsed or refractory mantle cell lymphoma. J Clin Oncol 2009; 27(23): 3822 – 3829.
26. Robak T. Bortezomib in the treatment of mantle cell lymphoma. Future Oncol. In press 2015.
27. Goy A, Sinha R, Williams ME et al. Single‑agent lenalidomide in patients with mantle ‑ cell lymphoma who relapsed or progressed after or were refractory to bortezomib: phase II MCL ‑ 001 (EMERGE) study. J Clin Oncol 2013; 31(29): 3688 – 3695. doi: 10.1200/ JCO.2013.49.2835.
28. Zinzani PL, Vose JM, Czuczman MS et al. Long‑term follow‑up of lenalidomide in relapsed/ refractory mantle cell lymphoma: subset analysis of the NHL‑003 study. Ann Oncol 2013; 24(11): 2892 – 2897. doi: 10.1093/ annonc/ mdt366.
29. Robinson KS, Williams ME, van der Jagt RH et al. Phase II multicenter study of bendamustine plus rituximab in patients with relapsed indolent B ‑ cell and mantle cell non‑Hodgkin‘s lymphoma. J Clin Oncol 2008; 26(27): 4473 – 4479. 10.1200/ JCO.2008.17.0001.
30. Wang ML, Rule S, Martin P et al. Targeting BTK with ibrutinib in relapsed or refractory mantle ‑ cell lymphoma. N Engl J Med 2013; 369(6): 507 – 516. doi: 10.1056/ NEJMoa1306220.
31. Visco C, Finotto S, Zambello R et al. Combination of rituximab, bendamustine, and cytarabine for patients with mantle ‑ cell non‑Hodgkin lymphoma ineligible for intensive regimens or autologous transplantation. J Clin Oncol 2013; 31(11): 1442 – 1449. doi: 10.1200/ JCO.2012.45.9842.
32. Wang M, Fayad L, Wagner ‑ Bartak N et al. Lenalidomide in combination with rituximab for patients with relapsed or refractory mantle ‑ cell lymphoma: a phase 1/ 2 clinical trial. Lancet Oncol 2012; 13(7): 716 – 723. doi: 10.1016/ S1470 ‑ 2045(12)70200 ‑ 0.
33. Hess G, Keller U, Scholz CW et al. Safety and efficacy of temsirolimus in combination with bendamustine and rituximab in relapsed mantle cell and follicular lymphoma. Leukemia 2015; 29(8): 1695 – 1701. doi: 10.1038/leu.2015.60.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2015 Issue Supplementum 3
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Molekulární prognostické markery chronické lymfocytární leukemie a jejich klinický význam
- Význam minimální zbytkové nemoci u chronické lymfocytární leukemie
- Monoklonální protilátky v léčbě chronické lymfocytární leukemie v roce 2015
- Léčebné možnosti pro nemocné s chronickou lymfocytární leukemií a významnými přidruženými chorobami
- Léčba chronické lymfocytární leukemie s aberací TP53
- Malé molekuly v léčbě chronické lymfocytární leukemie v roce 2015 a v blízké budoucnosti
- Aktuality v podpůrné léčbě chronické lymfocytární leukemie
- Maligní lymfomy − minulost, současnost a budoucnost
- Difuzní velkobuněčný B lymfom – moderní způsoby diagnostiky a molekulárně cílené léčby
- Folikulární lymfom
- Lymfom z plášťových buněk – současný stav poznání a možnosti léčby
- Záchranná léčba a role transplantací u lymfomů
- Současné možnosti imunoterapie nádorových onemocnění
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Difuzní velkobuněčný B lymfom – moderní způsoby diagnostiky a molekulárně cílené léčby
- Folikulární lymfom
- Lymfom z plášťových buněk – současný stav poznání a možnosti léčby
- Záchranná léčba a role transplantací u lymfomů
