Antiproliferační účinek analog somatostatinu – analýza dat a klinické aplikace v kontextu výsledků studie CLARINET
Antiproliferative Effect of Somatostatin Analogs – Data Analyses and Clinical Applications in the Context of the CLARINET Study
Background:
Somatostatin analogs (SSAs) are antisecretory agents that have been used to control hormonal syndromes associated with neuroendocrine tumors for more than 20 years. Recent phase III randomized, placebo controlled trials demonstrated their antiproliferative effects. The PROMID study showed that octreotide LAR (long-acting repeatable) treatment had anti-tumor effects. CLARINET, an international multicenter controlled study, provides new evidence that lanreotide has antiproliferative effects. Depot lanreotide significantly prolonged progression-free survival among patients with metastatic gastroenteropancreatic neuroendocrine tumors (GEP-NETs). Because GEP-NETs are biologically diverse in terms of primary tumor site and functional status, preventing progression can be difficult.
Aim:
This review summarizes data supporting the role of SSAs, in particular lanreotide, as antiproliferative agents for the treatment of patients with GEP-NETs.
Conclusion:
The CLARINET study is the most powerful (in sence of data, results, clinical aplication) randomized study of the antiproliferative effects of SSA in GEP-NET patients. The median lanreotide-associated progression-free survival in the CLARINET core study or in open-label extension study was 32.8 vs. 18 months for placebo. Thus, early treatment with lanreotide is expected to prolong progression-free survival. Lanreotide is now recommended for the treatment of patients with well-differentiated metastatic grade 1 and grade 2 GEP-NETs (i.e., those with a Ki-67 proliferative index < 10%) located in the pancreas, small intestine, or in cases where the location of the primary tumor is unknown, regardless of the degree of liver involvement.
Key words:
somatostatin – neuroendocrine tumors – angiogenesis – apoptosis – antiproliferative effect
This work was supported by MEYS-NPS I-LO1413.
The author declares she has no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted:
2. 12. 2015
Accepted:
20. 3. 2016
Authors:
B. Bencsiková
Authors‘ workplace:
Klinika komplexní onkologické péče, Masarykův onkologický ústav, Brno RECAMO, Masarykův onkologický ústav, Brno
Published in:
Klin Onkol 2016; 29(4): 253-258
Category:
Review
doi:
https://doi.org/10.14735/amko2016253
Overview
Východiska:
Somatostatinová analoga (SSA) jsou již více než dvě desetiletí využívána k léčbě hormonálních syndromů spojených s neuroendokrinními nádory. V posledních letech dvě randomizované placebem kontrolované klinické studie fáze III prokazují jejich antiproliferační účinek. Protinádorový účinek oktreotidu LAR (long-acting repeatable) byl prokázán v randomizované, placebem kontrolované studii fáze III PROMID. Antiproliferační efekt lanreotidu autogel byl prokázán v mezinárodní multicentrické placebem kontrolované studii fáze III CLARINET. Lanreotid v léčbě pacientů s metastatickým gastroenteropankreatickým neuroendokrinním nádorem (GEP-NET) signifikantně prodlužuje dobu přežití bez známek progrese onemocnění. Vzhledem k biologické odlišnosti GEP-NET může být oddálení progrese onemocnění obtížné, závisí na původu primárního nádoru a funkčním stavu.
Cíl:
V souhrnném článku analyzuji data potvrzující roli SSA, se zaměřením na lanreotid, jako antiproliferačních látek v léčbě pacientů s GEP-NET.
Závěr:
Studie CLARINET dnes představuje nejsilnější randomizovanou studii zabývající se antiproliferačním efektem SSA u pacientů s GEP-NET. Medián přežití bez progrese v základní studii CLARINET nebo v její open-label extenzi při léčbě lanreotidem byl 32,8 vs. 18 měsíců při léčbě placebem. Včasné zahájení léčby přináší pacientům benefit v oddálení progrese onemocnění. Nyní je doporučena léčba lanreotidem u pacientů s dobře diferencovaným metastatickým grade 1 a grade 2 GEP-NET (tedy s Ki-67 proliferačním indexem < 10 %) lokalizovaným v pankreatu, tenkém střevě nebo v případě neznámého prima, nezávisle na rozsahu jaterního postižení. Dostupná data prokazují, že léčba lanreotidem významně prodlužuje čas do progrese u pacientů s metastatickým GEP-NET.
Klíčová slova:
somatostatin – neuroendokrinní nádory – angiogeneze – apoptóza – antiproliferační efekt
Úvod
Neuroendokrinní nádory (NET) patří do skupiny vzácných zhoubných nádorů. Ročně je v ČR nově diagnostikováno přibližně 200 NET [1]. Představují heterogenní skupinu nádorů vznikající v různých orgánech, zejména v zažívacím traktu, plicích, pankreatu, močovém traktu, v kůži a jinde. Jejich biologické chování může být zcela indolentní až vysoce agresivní. Rozdíly jsou i v klinických projevech, v závislosti na přítomnosti hormonální aktivity. Zvláštní skupinu zahrnují gastroenteropankreatické NET (GEP-NET), které se dělí podle WHO klasifikace z roku 2010 (založené na hodnocení stupně diferenciace, gradu, mitotickém indexu, Ki-67) na NET dobře diferencované grade 1 a 2 (NET G1 a G2) a neuroendokrinní karcinomy (G3, malobuněčné nebo velkobuněčné) [2]. Toto rozdělení má zasadní význam pro výběr vyšetřovacích metod a zejména léčebného postupu. V současné době je kurativní pouze léčba chirurgická. V léčbě NET G1 a G2 se u metastatického onemocnění aplikuje léčba lokoregionální při léčbě jaterních metastáz a léčba systémová, která je cílená na somatostatinové receptory (SSTR), VEGF transdukční kaskádu, mTOR metabolickou cestu a ve vybraných případech lze zvažovat i chemoterapii (pankreatické NET). Špatně diferencované NET se léčí analogicky s malobuněčným plicním karcinomem, a to chemoterapií, která je založena na platinovém derivátu.
Somatostatinová analoga (SSA) ve většině případů dobře kontrolují karcinoidový syndrom i jiné hormonální syndromy u funkčních NET. Kromě známého antisekretorického účinku nově četné preklinické a klinické studie potvrzují efekt antiproliferační, antiangiogenní, proapoptotický a imunomodulační. Účinek somatostatinu je zprostředkován prostřednictvím pěti typů SSTR (SSTR1 – 5) a je tkáňově specifický. U NET je nejčastější zastoupení SSTR2 a SSTR5.
Následující text pojednává o významném pokroku v postavení SSA v léčbě GEP-NET G1 a G2.
Somatostatin
Somatostatin byl poprvé izolován v roce 1973 a poté syntetizován [3]. Somatostatin je vytvářen jako velká prekurzorová molekula, která podléhá tkáňově specifické enzymatické degradaci. Vyskytuje se ve dvou formách lišících se počtem aminokyselin (AK) v peptidovém řetězci, kratší forma (o 14 AK) je produkována hlavně buňkami hypotalamu, delší forma (o 28 AK) je secernována převážně v gastrointestinálním traktu, a to D buňkami Langerhansových ostrůvků slinivky břišní a dalšími tkáněmi. Somatostatin tlumí sekreci růstového hormonu a thyrotropinu v adenohypofýze, inhibuje vylučování exokrinních a endokrinních hormonů pankreatu (inzulinu a glukagonu) a dalších střevních a žaludečních hormonů, jako jsou gastrin, sekretin, cholecystokinin, motilin, VIP (vazoaktivní střevní peptid). Somatostatin obecně inhibuje motilitu a sekreci intestinální, žaludeční, pankreatickou a biliární, má vliv na vstřebávání živin v tenkém střevě [4]. Hemodynamický efekt somatostatinu není zcela jasný; některé studie prokázaly jeho vazokonstrikční efekt ve splanchniku, snížení portálního tlaku, ale i průtoku žaludeční sliznicí, čehož lze využít při krvácení z kongestivní gastropatie [5]. Nevýhodou je velmi krátký poločas (asi 2 min) a rebound hypersekrece po přerušení aplikace. Duální účinek přirozených somatostatinů, inhibice sekrece hormonů a buněčného růstu vedla k rozvoji jejich použití v klinické praxi.
Somatostatin se váže na specifické buněčné povrchy prostřednictvím zvláštních SSTR, zatím bylo popsáno celkem pět podtypů (SSTR1–5) [6]. Cílové tkáně exprimují vysokou denzitu několika receptorových subtypů, v případě GEP-NET převažuje SSTR2 [7,8]. Nově byla popsána existence "truncated SSTR", jejich biologický význam je předmětem dalšího výzkumu [9]. Inhibiční antisekretorický účinek aktivovaných SSTR zprostředkují nejméně čtyři intracelulární signální dráhy, které zahrnují inhibici adenylátcyklázy, aktivaci K+/Ca2+ kanálů, proteinových kináz a intracelulárních fosfotyrozinfostatáz [10].
Oktreotid je synteticky vyrobený oktapeptidový derivát somatostatinu z roku 1982, jenž má větší inhibiční účinky než somatostatin, jeho poločas po s.c. aplikaci je prodloužen na 2 hod a podává se zpravidla 2–3krát denně. Dalším systetickým derivátem používaným v Evropě od roku 1998 je lanreotid. Tato analoga (tab. 1) mají podobné farmakologické účinky jako somatostatin, odlišnosti v působení jsou dány patrně rozdílnou vazbou na SSTR [11].
![Somatostatin a jeho analoga. Volně podle [11].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/c634a1c6c25f193e151c1b37dee06aff.jpg)
Lékové formy SSA s prodlouženým uvoňováním jsou sandostatin LAR (oktreotid) a somatuline autogel (lanreotid). Podávají se zpravidla 1krát měsíčně.
Pasireotid je nový panreceptorový SSA, aktuálně schválen pro léčbu pokročilé Cushingovy nemoci [12]. Postavení pasireotidu v léčbě NET je zatím předmětem klinických studií.
Indikace SSA
Základní indikací SSA je léčba akromegalie. Podání SSA vede ke zmenšení adenomu hypofýzy, dochází ke snížení hladin GH a IGF-1 (insulin-like growth factor) a klinickému zlepšení stavu pacientů – léčba odstraňuje bolesti hlavy, kloubů, známky kardiomyopatie. U pacientů s akromegalií léčených lanreotidem autogelem 120 mg bylo po 48 týdnech léčby pozorováno klinicky významné zmenšení objemu tumoru o ≥ 20 % u 62,3 % pacientů [13]. Další významnou indikací je léčba symptomů spojených s NET, nově rozšířena i o indikaci léčby s antiproliferačním záměrem. SSA se uplatňují mimo jiné i při potlačování průjmů při střevní rejekční reakci, při fistulích, úporných průjmech provázejících AIDS, u pacientů s ileostomií.
Mechanizmus vlivu SSA na růst nádoru
Protinádorový účinek SSA je přímý a nepřímý (schéma 1). Přímá inhibice proliferace (schéma 2) nádorových buněk (zástava buněčného cyklu ve fázi G1) a indukce apoptózy je zprotředkována cestou aktivace SSTR na povrchu nádorových buněk. Studie in vitro prokazují, že všechny receptorové subtypy (SSTR1 – 5) se mohou podílet na inhibici buněčné proliferace cestou intracelulárních signálních drah, primárně cestou MAP-kináz a aktivací fosfotyrozinfosfatáz [14,15]. Specifické receptorové subtypy (SSTR2, SSTR3) vedou k apoptóze [16]. Nepřímý antiproliferativní účinek zahrnuje inhibici sekrece růstového faktoru (IGF-1), inhibici angiogeneze a imunomodulační efekt [17].

![Schéma 2. Přímá antiproliferační aktivita SSA. Volně podle [14–16].](https://pl-master.mdcdn.cz/media/image/0bd520301f70300d81b7500aa84ac42c.jpg?version=1537792244)
Antiangiogenní účinek SSA
SSA inhibují neovaskularizaci pravděpodobně prostřednictvím vaskulárních SSTR2 peritumorálně [18]. Dalším antiangiogenním mechanizmem SSA je inhibice růstových faktorů (PDGF, IGF-1, EGFR), které stimulují proliferaci endotelií a buněk hladké svaloviny [19]. Oktreotid vede k inhibici proliferace endoteliálních buněk cestou over-exprese SSTR2 a SSTR5 [20]. Snížení uvolňování oxidu dusnatého je považováno za primární mechanizmus vedoucí k inhibici angiogeneze [21] a inhibice cirkulujícího VEGF [22]. Endoteliální buňky normálně neexprimují SSTR2, který se však objevuje v případě jejich proliferace [23].
Imunomodulační účinek SSA
Různé buňky imunitního systému (lymfocyty, monocyty) exprimují SSTR na svém povrchu. SSA regulují sekreci cytokinů B, T buněk a monocytů [24]. Touto cestou pravděpodobně ovlivňují mechanizmy zánětu a imunity, což by mohlo potencovat antiproliferační účinek [25].
Pro-apoptotická aktivita SSA
V experimentu SSA inhibují růst prasečího chondrosarkomu jako model nádoru bez přítomnosti SSTR [26].
V léčbě inzulinomů v experimentu na krysách došlo k signifikantní inhibici nádorového růstu v závislosti na stavu fosforylace proteinů signální dráhy PI3K/Akt/mTOR [27].
Eriksson et al publikovali zajímavá data o nárůstu apoptózy ve vzorcích tkání získaných od pacientů léčených vysokou dávkou SSA. Uvádějí, že apoptóza koreluje s biochemickou odpovědí a stabilizací onemocnění v 70 % případů [28]. Faiss et al pozorovali celkovou léčebnou odpověď (overall response rate – ORR) 6,7 % ve skupině 24 pacientů léčených ultravysokou dávkou lanreotidu (15 mg/den), srovnatelnou s odpovědí při léčbě standardní dávkou lanreotidu [29].
Protinádorový efekt SSA je závislý na podané dávce, negativní výsledek některých studií může vzniknout v důsledku podání příliš nízkých dávek SSA, tudíž nedochází k optimální saturaci SSTR. Avšak podání ultravysokých dávek, příkladem je dávka lanreotidu nad 10 mg/ den, rovněž nevede k výraznějšímu protinádorovému účinku [30]. Regrese nádoru byla v průměru dosažena u méně než 10 % pacientů, avšak až u 50 % pacientů s NET různých lokalit byla dosažena stabilizace. Ve skupině pacientů bez léčby SSA byla dosažena stabilizace u 37–45 % pacientů. Medián trvání stabilizace byl 26,5 měsíce [31]. Další studie pacientů s progredujícím onemocněním léčených vysokou dávkou lanreotidu (3–5 g/den) prokázala stabilizaci v 47 % případů [32]. Welin et al potvrzují stabilizaci nádoru po dobu 6–24 měsíců u 75 % pacientů s NET středního střeva (midgut) [33].
Klinické studie potvrzující protinádorový účinek SSA v léčbě neresekabilních/metastatických NET
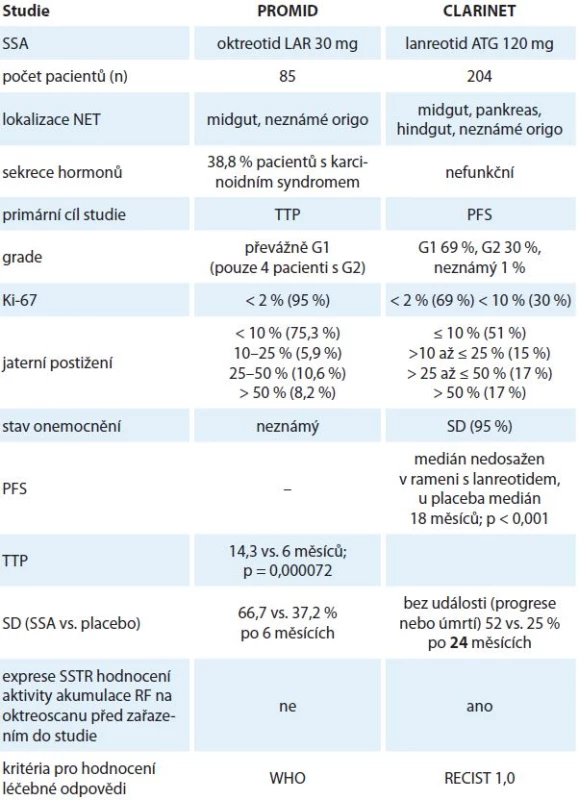
Antiproliferační efekt oktreotidu LAR byl prokázán v randomizované, placebem kontrolované studii fáze III PROMID, která prokázala prodloužení doby do progrese tumoru (time to progression – TTP) u NET G1 středního střeva (midgut) při léčbě oktreotidem LAR 30 mg ve srovnání s placebem [34]. Účinnost byla dokumentována jak u hormonálně funkčních, tak u nefunkčních nádorů. Účinek byl pozorován u pacientů s resekovaným primárním nádorem a malým postižením jaterního parenchymu (< 10 %). Vzhledem k malému počtu úmrtí v obou ramenech studie a vysokému počtu crossover studie PROMID neposkytuje data hodnotící přežívání. Na základě studie PROMID lze indikovat oktreotid LAR 30 mg podávaných každé čtyři týdny jako protinádorovou léčbu u pacientů s pokročilými NET G1 středního střeva (midgut) nebo neznámou lokalizací primárního nádoru, pokud je předpoklad, že origo je v oblasti midgut.
Antiproliferační efekt lanreotidu autogelu 120 mg u GEP-NET byl prokázán v mezinárodní multicentrické placebem kontrolované studii fáze III CLARINET [35]. Výsledky studie CLARINET poukazují na signifikantní snížení rizika progrese onemocnění nebo úmrtí (progression-free survival – PFS) u pacientů s nefunkčními GEP-NET nebo NET s neznámou primární lokalizací (u kterých byl vyloučen původ v zadním střevě – hindgut), G1 a G2 (proliferační index Ki-67 < 10 %), se střední (≤ 25 %) i vysokou (> 25 %) jaterní tumorózní náloží (graf 1).

Podle lokalizace primárního nádoru byl největší přínos pozorován v léčbě pacientů s midgut NET (HR 0,35; p = 0,009). Je třeba zdůraznit, že terapeutický účinek ve stanovených podskupinách byl srovnatelný s přínosem v celkové hodnocené populaci, s výjimkou pacientů s nádory dolní části trávicího traktu (hindgut).
Přímé srovnání studií PROMID a CLARINET (tab. 2) není dost dobře možné z několika důvodů. Jedná se o rozdíly v charakteristikách zařazených pacientů – studie CLARINET zahrnuje i non-midgut NET, G2 nádory, nádory s větším rozsahem jaterního postižení, skupinu pacientů s indolentním průběhem onemocnění (96 % pacientů bylo bez známek progrese 3 – 6 měsíců před randomizací). Dalším důvodem je způsob hodnocení léčebné odpovědi, ve studii PROMID byla použita kritéria pro hodnocení léčebné odpovědi podle WHO a ve studii CLARINET RECIST kritéria verze 1.0, i nestejnorodost nádorů z hlediska hormonální sekrece. Na základě výsledků studie CLARINET lze konstatovat, že léčba lanreotidem oddaluje signifikantně riziko progrese u pacientů s GEP-NET G1 a G2 (Ki-67 < 10 %) se stabilním onemocněním nezávisle na objemu jaterního postižení.
Včasné zahájení léčby lanreotidem favorizuje i dobrá dlouhodobá tolerance léčby, která je příznivější, než je tomu při léčbě chemoterapií nebo cílené léčbě sunitinibem a everolimem (které jsou ale indikovány pouze u pacientů s pankreatickými NET a progresí onemocnění). Open-label extenze (OLE) studie CLARINET zahrnula 88 nemocných, kteří měli stabilizaci onemocnění (stabilization disease – SD) na konci studie nebo pokud vykazovali progresi onemocnění (progression disease – PD) při podávání placeba během základní studie. Lanreotid byl podáván do (další) progrese nebo úmrtí. Medián PFS ve skupině LAN-LAN (lankreotid-lanreotid; pacienti zařazení do OLE, kteří měli SD při léčbě lanreotidem na konci základní studie) byl 32,8 měsíce, medián PFS ve skupině PLACEBO-LAN (placebo-lanreotid; skupina, která vykazovala PD při podávání placeba v základní studii a náledně v OLE dostávala lanreotid) byl 14 měsíců [36].
Výsledky obou těchto studií s prokázaným protinádorovým účinkem SSA se odrazily nejen v SPC, ale i v doporučeních pro klinickou praxi, kde pro pankreatické tumory je vyhrazen lanreotid, stejně jako pro podskupinu G2 midgut tumorů (s proliferačním indexem Ki-67 < 10 %). Pro G1 midgut tumory jsou indikovány oba preparáty (tab. 3).

Závěr
Studie CLARINET dnes představuje nejsilnější randomizovanou studii zabývající se antiproliferačním efektem SSA u pacientů s GEP-NET. Medián PFS v základní studii CLARINET nebo v její OLE při léčbě lanreotidem byl 32,8 vs. 18 měsíců při léčbě placebem. Včasné zahájení léčby přináší pacientům benefit v oddálení progrese onemocnění.
Budoucí perspektivy v léčbě SSA ukážou výsledky studií s high-dose SSA (studie NETTER-1; CLARINET forte), SSA v kombinaci (s bevacizumabem, sunitinibem, everolimem, axitinibem atd.) a SSA.
Práce byla podpořena projektem MŠMT-NPU I-LO1413.
Autorka deklaruje, že v souvislosti s předmětem studie nemá žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Beatrix Bencsiková, Ph.D.
Klinika komplexní onkologické péče
Masarykův onkologický ústav
Žlutý kopec 7
656 53 Brno
e-mail: bencsikova@mou.cz
Obdrženo: 2. 12. 2015
Přijato: 20. 3. 2016
Sources
1. Tomášek J et al. Onkologie minimum pro praxi. 1. vyd. Praha: Axonite Edice Asclepius 2015 : 237.
2. Boznan F, Carneiro FT, Hrubon RH et al. World Health Organization Classification of tumours, pathology and genetics of tumours of the digestive system. Lyon: IARC Press 2010.
3. Brazeau P, Gullemin R. Editorial: Somatostatin: nextcomer from the hypothalamus. N Engl J Med 1974; 290(17): 963 – 964.
4. Ganong WF. Přehled lékařské fyziologie. 20. vyd. Praha: Galén 2005 : 890.
5. Ehrmann J, Hůlek P et al. Hepatologie. 2. vyd. Praha: Grada 2014 : 186.
6. Patel YC, Srikant CB. Somatostatin receptors. Trends Endocrinol Metab 1997; 8(10): 398 – 405.
7. Papotti M, Bongiovanni M, Volante M et al. Expression of somatostatin receptor types 1–5 in 81 cases of gastrointestinal and pancreatic endocrine tumors. A correlative immunohistochemical and reverse-transcriptase polymerase chain reaction analysis. Virchows Arch 2002; 440(5): 461 – 475.
8. Kaemmerer D, Specht E, Sänger J et al. Somatostatin receptors in bronchopulmonary neuroendocrine neoplasms: new diagnostic, prognostic, and therapeutic markers. J Clin Endocrinol Metab 2015; 100(3): 831 – 840. doi: 10.1210/ jc.2014-2699.
9. Castaño JP, Sundin A, Maecke HR et al. Gatrointestinal neuroendocrine tumors (NETs): new diagnostic and therapeutic challenges. Cancer Metastasis Rev 2014; 33(1): 353 – 359. doi: 10.1007/ s10555-013-9465-1.
10. Modlin IM, Pavel M, Kidd M et al. Review article: somatostatin analogues in the treatment of gastroenteropancreatic neuroendocrine (carcinoid) tumours. Aliment Pharmacl Ther 2010; 31(2): 169 – 188. doi: 10.1111/ j.1365-2036.2009.04174.x.
11. Oberg K. Established clinical use of octreotide and lanreotide in oncology. Chemotherapy 2001; 47 (Suppl 2):40 – 53.
12. Colao A, Petersenn S, Newell-Price J et al. Pasireotide B2305 Study Group. A 12-month phase 3 study of pasireotide in Cushing‘s disease. N Engl J Med 2012; 366(10): 914 – 924. doi: 10.1056/ NEJMoa1105743.
13. Caron PJ, Bevan JS, Petersenn S et al. Tumor shrinkage with lanreotide autogel 120 mg as primary therapy in acromegaly: results of a prospective multicenter clinical trial. J Clin Endocrinol Metab 2014; 99(4): 1282 – 1290. doi: 10.1210/ jc.2013-3318.
14. Weckbecker G, Lewis I, Albert R et al. Opportunities in somatostatin research: biological, chemical and therapeutical aspects. Nat Rev Drug Discov 2003; 2(12): 999 – 1017.
15. Florio T. Somatostatin receptor signalling: phosphotyrosine phosphatases. Mol Cell Endocrinol 2008; 286(1 – 2): 40 – 48.
16. Lattuada D, Casnici C, Venuto A. The apoptotic effect of somatostatin analouges SMS 201–995 on human lymphocytes. J Neuroimmunol 2002; 133(1 – 2): 211 – 216.
17. Eriksson B, Oberg K. Summing up 15 years of somatostatin analog therapy in neuroendocrine tumors: future outlook. Ann Oncol 1999; 10 (Suppl 2): S31 – S38.
18. Kumar M, Liu ZR, Thapa L et al. Angiogenic effect of somatostatin receptor subtype 2 on pancreatic cancer cell line: inhibition of vascular endothelial growth factor and matrix metalloproteinase-2 expression in vitro. World J Gastroenterol 2004; 10(3): 393 – 399.
19. Woltering EA, Watson JC, Perin-Lea RC et al. Somatostatin analogs: angiogenesis inhibitors with novel mechanism of action. Invest New Drugs 1997; 15 : 77 – 86.
20. Adams RL, Adams IP, Lindow SW et al. Somatostatin receptors 2 and 5 are preferentially expressed in proliferating endothelium. Br J Cancer 2005; 92(8): 1493 – 1498.
21. Arena S, Pattarozzi A, Corsaro A et al. Somatostatin receptor subtype-dependent regulation of nitric oxide release: involvement of different intracellular pathways. Mol Endocrinol 2005; 19(1): 255 – 267.
22. Kumar M, Liu ZR, Thapa L et al. Anti-angiogenic effects of somatostatin receptor subtype 2 on human pancreatic cancer xenografts. Carcinogenesis 2004; 25(11): 2075 – 2081.
23. Dimitroulopoulos D, Xinopoulos D, Tsamakidis K. Long acting octreotide in the treatment of advanced hepatocellular carcinoma. J Cancer Res Clin Oncol 2006; 132(11): 699 – 708.
24. Lichtenauer-Kaligis EG, Dalm VA, Oomen SP et al. Differential expression of somatostatin receptor subtypes in human peripheral blood mononuclear cell subsets. Eur J Endocrinol 2004; 150(4): 565 – 577.
25. Susini C, Buscali L. Rationale for the use of somatostatin analogs as antitumor agents. Ann Oncol 2006; 17(12): 1733 – 1742.
26. Reubi JC. A somatostatin analogue inhibits chondrosarkoma and insulinoma tumor growth. Acta Endocrinol 1985; 109(1): 108 – 114.
27. Romeo S, Milione M, Gatti A. Complete clinical remission and disappearance of liver metastases after treatment with somatostatin analogues in a 40-year-old woman with a malignant insulinoma positive for somatostatin receptors type 2. Horm Res 2006; 65(3): 120 – 125.
28. Eriksson B, Renstrup J, Imam H et al. High-dose treatment with lanreotide of patients with advanced neuroendocrine gastrointestinal tumors: clinical and biological effects. Ann Oncol 1997; 8(10): 1041 – 1044.
29. Faiss S, Rath U, Mansmann U. Ultra-high-dose lanreotide treatment in patients with metastatic neuroendocrine gastroenteropancreatic tumors. Digestion 1999; 60(5): 469 – 476.
30. Kvols LK, Woltering EA. Role of somatostatin analogs in the clinical management of non-neuroendocrine solid tumors. Anticancer Drugs 2006; 17(6): 601 – 608.
31. Panzuto F, Di Fonzo M, Iannicelli E. Long-term clinical outcome of somatostatin analogues for treatment of progressive, metastatic, well-differentiated entero-pancreatic endocrine carcinoma. Ann Oncol 2006; 17(3): 461 – 466.
32. Faiss S, Scherubl H, Riecken EO. Drug therapy in metastatic neuroendocrine tumors of the gastroenteropancreatic system. Recent Results Cancer Res 1996; 142 : 193 – 207.
33. Welin SV, Janson ET, Sundin A. High-dose treatment with a long-acting somatostatin analogue in patients with advanced midgut carcinoid tumours. Eur J Endocrinol 2004; 151(1): 107 – 112.
34. Rinke A, Müller HH, Schade-Brittinger C et al. Placebo-controlled, double-blind, prospective, randomised study on the effect of octreotide LAR in the control of tumor growth in patients with metastatic neuroendocrine midgut tumors: a report from the PROMID Study Group. J Clin Oncol 2009; 27(28): 4656 – 4663. doi: 10.1200/ JCO.2009.22.8510.
35. Caplin ME, Pavel M, Ćwikła JB et al. Lanreotide in metastatic enteropancreatic neuroendocrine tumors. N Engl J Med 2014; 371(3): 224 – 233. doi: 10.1056/ NEJMoa1316158.
36. Sedláčková E. Studie CLARINET a její následná opel-label fáze. Remedia 2014; 24 : 495 – 498.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2016 Issue 4
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Antiproliferační účinek analog somatostatinu – analýza dat a klinické aplikace v kontextu výsledků studie CLARINET
- Dva pohledy na vývoj nádorů
- Vplyv liečby na kognitívne funkcie a kvalitu života u pacientov s karcinomom semenníkov
- Vliv paliativní chemoterapie na kvalitu života nemocných s karcinomem žaludku
- Vícenásobné nádorové onemocnění plic – kazuistika a přehled literatury
- Hodnocení klinického stadia a léčebné odpovědi u maligních lymfomů – doporučení Kooperativní lymfomové skupiny na základě revidovaných kritérií z roku 2014 (Luganská klasifikace)
- Indikace radioterapie u pacientů s hematologickými malignitami v průběhu pěti let provozu modernizovaného centra Onkologické a radioterapeutické kliniky v Plzni
- Sentinelová uzlina u melanomu – studie provedená v jižní Brazílii
- Primární mukoepidermoidní karcinom slzného vaku – kazuistika a přehled literatury
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Vliv paliativní chemoterapie na kvalitu života nemocných s karcinomem žaludku
- Dva pohledy na vývoj nádorů
- Vplyv liečby na kognitívne funkcie a kvalitu života u pacientov s karcinomom semenníkov
- Primární mukoepidermoidní karcinom slzného vaku – kazuistika a přehled literatury
