Klinický a funkční význam vybraných polymorfizmů CASP8 a CASP9 u karcinomu prsu
Clinical and Functional Importance of Selected CASP8 and CASP9 Polymorphisms in Breast Carcinoma
Background:
Caspase-8 and caspase-9 (encoded by CASP8 and CASP9) are executive caspases of programmed cell death (apoptosis). Dysregulation of apoptosis plays an important role in cancer development, progression, and resistance to anticancer therapy. The goal of this work was to evaluate potential associations between polymorphisms in CASP8 and CASP9, previously linked to breast cancer risk, and the transcript levels of these genes (including their alternative anti-apoptotic variants) in tumor tissues and the clinical characteristics of the patients.
Material and Methods:
Sanger sequencing, high resolution melting (HRM) analysis, and allelic discrimination were used to identify polymorphisms in DNA samples isolated from tumor tissues and peripheral blood lymphocytes of 60 breast carcinoma patients. Total transcript levels of CASP8 and CASP9, and levels of alternative splicing variants CASP8L and CASP9B, were quantified by real-time PCR in tumor tissues. Clinically interesting associations were validated in DNA from lymphocytes of 615 breast carcinoma patients.
Results:
A haplotype in CASP9 composed of three polymorphisms rs4645978-rs2020903-rs4646034 was significantly associated with CASP9 expression in tumors, with the expression of the progesterone receptor and ERBB2, and with the TNBC subtype of breast carcinoma in the validation study. The associations between the rs3834129 polymorphism in CASP8 and stage of disease, rs6435074 with grade, expression of estrogen receptor and ERBB2, and rs6723097 with ERBB2 expression have not yet been validated. However, rs6723097 was associated with disease-free survival in patients treated with hormonal therapy.
Conclusion:
This study reveals a previously unknown and presumably functional (in silico) association between a haplotype in CASP9 and molecular and clinical phenotypes of breast carcinoma. The potential clinical utility of this association for prognostication of breast carcinoma should be evaluated by independent studies.
Key words:
breast carcinoma – caspases – polymorphisms – functional – clinical – importance
This work was supported by grant of the CU Grant Agency No. 1444313, and grant of the Internal Grant Agency of the Czech Ministry of Health No. 15-25618A.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted:
3. 3. 2016
Accepted:
26. 10. 2016
Authors:
V. Brynychová 1,2; R. Václavíková 1; K. Kubáčková 3; M. Mrhalová 4; R. Kodet 4; K. Rauš 5; D. Vrána 6; J. Gatěk 7
; M. Bendová 8; P. Souček 1
Authors‘ workplace:
Oddělení toxikogenomiky, Státní zdravotní ústav, Praha
1; 3. lékařská fakulta UK v Praze
2; Onkologická klinika 2. LF UK a FN Motol, Praha
3; Ústav patologie a molekulární medicíny, 2. LF UK a FN Motol, Praha
4; Ústav pro péči o matku a dítě, Praha
5; Onkologická klinika LF UP a FN Olomouc
6; Chirurgické oddělení, Nemocnice Atlas, Zlín
7; Gynekologicko-porodnická klinika 3. LF UK a FN Královské Vinohrady, Praha
8
Published in:
Klin Onkol 2016; 29(6): 445-453
Category:
Original Articles
doi:
https://doi.org/10.14735/amko2016445
Overview
Východiska:
Kaspázy 8 a 9 (kódované geny CASP8 a CASP9) jsou hlavními iniciačními kaspázami programované buněčné smrti (apoptózy), jejíž deregulace může vést ke vzniku a progresi nádorového onemocnění i k lékové rezistenci pacientek. Cílem práce bylo ověřit, zda existuje vztah mezi výskytem polymorfizmů v CASP8 a CASP9 spojovaných s rizikem vzniku karcinomu prsu, hladinami transkriptu těchto genů (vč. hladin alternativních proti-apoptických variant) v nádorových tkáních karcinomu prsu a klinickým profilem pacientek.
Materiál a metody:
Polymorfizmy byly stanoveny metodami Sangerova sekvenování, pomocí high resolution melting analýzy (HRM) a alelické diskriminace ve vzorcích DNA nádorových tkání a krevních lymfocytů získaných od 60 pacientek. Hladiny celkového transkriptu CASP8, CASP9 a alternativních variant CASP8L a CASP9B byly stanoveny ve vzorcích nádorové tkáně pomocí kvantitativní PCR (polymerase chain reaction) v reálném čase. Klinicky zajímavé vztahy byly následně ověřeny na souboru vzorků DNA získaných z periferní krve od 615 pacientek.
Výsledky:
Výskyt haplotypu rs4645978-rs2020903-rs4646034 v CASP9 významně asocioval s hladinou celkového transkriptu CASP9 v nádorech, expresí progesteronového receptoru, expresí ERBB2 a TNBC subtypem karcinomu prsu. Významné vztahy polymorfizmu rs3834129 v CASP8 se stadiem onemocnění, polymorfizmu rs6435074 s expresí estrogenního receptoru, ERBB2 expresí a s gradem nádorů, a polymorfizmu rs6723097 s expresí ERBB2 nebyly validační studií potvrzeny. Nicméně nosičky alely A v polymorfizmu rs6723097 v CASP8 léčené hormonální terapií vykazovaly delší bezpříznakové přežívání než nosičky genotypu CC.
Závěr:
Současná studie odhalila dosud neznámý a potenciálně (in silico) funkční vztah haplotypu CASP9, složeného ze tří polymorfizmů typu SNP, k molekulárnímu i klinickému fenotypu karcinomu prsu. Tento vztah naznačuje, za předpokladu, že bude ověřen nezávislými studiemi, možné využití v prognostice onemocnění.
Klíčová slova:
karcinom prsu – kaspázy – polymorfizmy – funkční – klinický – význam
Úvod
Karcinom prsu (ICD-10, dg. C50) je po jiných zhoubných nádorech kůže nejčastěji diagnostikovaným nádorem u žen a nejčastější příčinou úmrtí žen na zhoubné onemocnění v ČR [1]. Dnes známe již řadu genů, jejichž alterace jsou spojeny s vyšším nebo středním rizikem vzniku karcinomu prsu (BRCA1, BRCA2, CHEK2, AKT1, PTEN a další). Navíc existují desítky polymorfizmů či oblastí genomu, které dle celogenomových asociačních studií (genome-wide association study – GWAS) obvykle mírně modifikují riziko vzniku karcinomu prsu [2]. Polymorfizmy v kódujících sekvencích mohou ovlivnit funkci proteinu (reparační, kontrolní funkce), alterace v nekódujících oblastech mohou měnit vazebná místa pro transkripční faktory, ovlivnit alternativní sestřih nebo stabilitu mRNA. Vliv těchto nekódujících polymorfizmů je zpravidla mnohem méně prostudován než v případě polymorfizmů nacházejících se v kódujících oblastech příslušných genů.
Kaspázy jsou intracelulární cysteinové proteázy uplatňující se v programované buněčné smrti (apoptóze), nekróze a zánětu. Kaspázy s převážně apoptickou funkcí jsou aktivační (iniciační) kaspázy 2, 8, 9, 10 a efektorové kaspázy 3, 6 a 7. Kaspázy 8 a 9 jsou hlavními iniciačními kaspázami vnější (CASP8) a vnitřní (CASP9) dráhy buněčné smrti. Kaspáza 8 je nejčastěji mutovanou kaspázou v nádorových buňkách různého typu [3,4] a některé její časté genetické alterace jsou přímo spojovány s rizikem vzniku nádorových onemocnění vč. nádorů prsu [5–10]. Mezi nejčastěji zmiňované alterace patří delece šesti nukleotidů v promotoru CASP8 (652 6N del, dbSNP: rs3834129), jednonukleotidový polymorfizmus (single nucleotide polymorphism – SNP) v exonu 10 (D302H, rs1045485) a polymorfizmy rs6435074 a rs6723097 v intronech. Dva typy polymorfizmů v promotoru CASP9, rs4645978 a rs4645981, byly také popsány v souvislosti s rizikem vzniku karcinomu prsu [11] a dalších karcinomů [3]. Alterace 652 6N del způsobuje sníženou expresi CASP8 v lymfocytech porušením vazebného místa pro transkripční faktor Sp1 [12]. Vliv ostatních alterací na expresi kaspáz v nádorových buňkách není znám.
Alternativním sestřihem CASP8 a CASP9 vznikají, kromě majoritních pro-apoptických variant, varianty alternativní. CASP8L a CASP9B postrádají katalytickou (aktivační) podjednotku, nicméně obsahují vazebné domény DED (death inducing domain, CASP8) a CARD (caspase recruitment domain, CASP9). Pomocí těchto domén se mohou kaspázy vázat, ještě ve formě neaktivních enzymů (prokaspáz), mimo jiné do kaspázových komplexů DISC (death-inducing signaling complex, CASP8) či apoptozómu (CASP9), ve kterých dochází k jejich finálnímu štěpení a aktivaci. Alternativní varianty mohou blokovat vazebná místa v aktivačních komplexech a tím negativně regulovat buněčnou smrt [13–15]. Vliv polymorfizmů v CASP8 a CASP9 spojovaných s rizikem vzniku karcinomu prsu na alternativní sestřih těchto genů není zatím objasněn.
Cílem práce bylo zjistit, zda existuje souvislost mezi výskytem vybraných polymorfizmů v CASP8 a CASP9 a expresní hladinou těchto genů v nádorových tkáních karcinomu prsu, vč. jejich alternativních sestřihových variant. Studie rovněž zkoumala potenciální vztahy polymorfizmů ke klinickým údajům pacientek. Do studie byly zařazeny polymorfizmy rs1045485, rs3834129, rs6435074 a rs6723097 (CASP8), rs464-5978 a rs4645981 (CASP9), a dále polymorfizmy vyskytující se v oblasti alternativního sestřihu CASP9 (rs4646032, rs2020902, rs2020903, rs4646034, rs6685648, rs4661636, rs4646088-91) (schéma 1). V rámci pilotní studie byly polymorfizmy stanoveny jak ve vzorcích nádorové tkáně, tak i v párových kontrolních vzorcích periferní krve od stejných pacientek. Nalezené vztahy polymorfizmů ke klinickým údajům o onemocnění pacientek byly ověřeny následnou validační studií.

Soubor pacientů a metody
Soubor pacientů
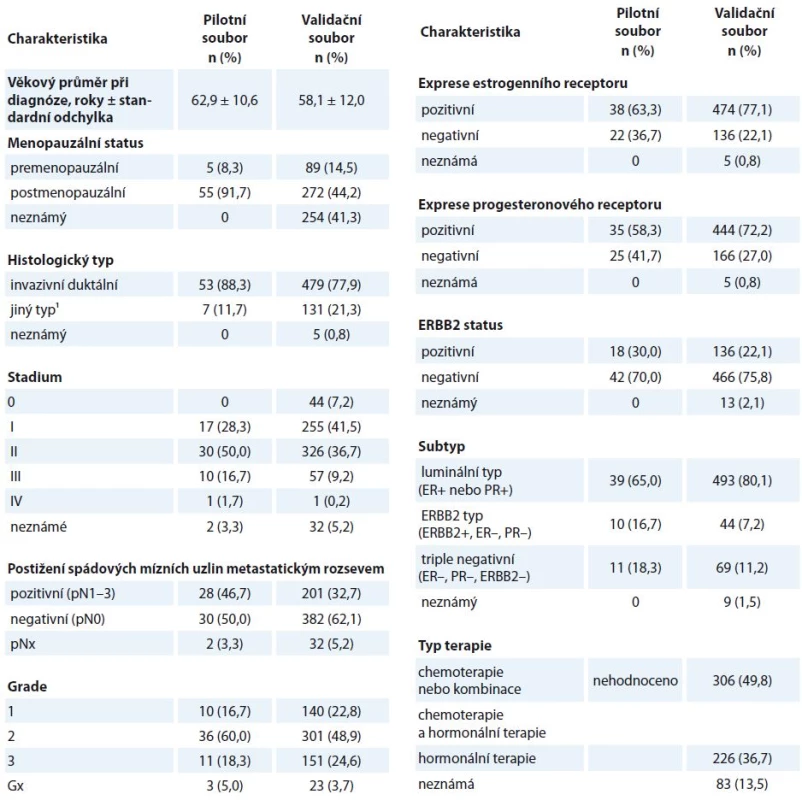
Do pilotní studie bylo zahrnuto 60 pacientek diagnostikovaných ve FN Motol (Praha) během let 2003–2007, od kterých byl získán vzorek nádorové tkáně a vzorek nesrážlivé krve. Validační studie zahrnovala 615 pacientek diagnostikovaných ve FN Motol, Ústavu pro matku a dítě, FN Královské Vinohrady (Praha) a nemocnici Atlas (Zlín), kterým byl odebrán vzorek nesrážlivé krve. Protokol odběru vzorků byl popsán již dříve [16,17]. Histologická klasifikace nádorů byla provedena dle Tavassoli et al [18]. Exprese estrogenního a progesteronového receptoru byla hodnocena jako pozitivní v případě 1% a vyšší exprese receptorů detekovaných imunohistochemicky. Exprese ERBB2 (v-erb-b2 avian erythroblastic leukemia viral oncogene homolog 2, OMIM: 164870) byla stanovena imunohistochemicky a v případě hodnocení skóre 2+ nebo 3+ potvrzena FISH (fluorescent in situ hybridisation) nebo SISH (silver in situ hybridization) analýzou. Pacientky byly pro účely statistických analýz rozděleny na prognosticky nejhorší subtyp TNBC (triple negative breast cancer, bez exprese estrogenního, progesteronového receptoru a ERBB2) a ostatní (tj. luminal A, luminal B a ERBB2-pozitivní dle [19]).
Všechny pacientky byly informovány o účelu studie a požádány o vyjádření souhlasu podpisem Informovaného souhlasu pacienta. Protokol studie a formulář Informovaného souhlasu pacienta byly schváleny Etickou komisí Státního zdravotního ústavu v Praze.
Izolace DNA z nádorových tkání a periferní krve
DNA byla izolována z tkání nádoru prsu pomocí AllPrep® DNA/RNA/Protein Mini Kitu (Qiagen, Hildesheim, Germany). DNA ze vzorků lymfocytů periferní krve byla izolována metodou fenol-chloroformové extrakce [20]. Koncentrace DNA byly kvantifikovány pomocí Quant-iT PicoGreen DNA Assay Kitu (Invitrogen, Carlsbad, CA, USA).
Izolace RNA z nádorových tkání a příprava cDNA
Celková RNA byla izolována z čerstvě zamražených nádorových tkání pomocí Trizol Reagent (Invitrogen) a kvantifikována kitem Quant-iT RiboGreen RNA Assay Kit (Invitrogen) pomocí Infinite M200 multiplate reader (Tecan Group Ltd, Männedorf, Switzerland). Integrita RNA byla ověřena na přístroji Agilent 2100 Bioanalyzer a pomocí kitu Agilent RNA 6000 Nano Assay Kit (Agilent Technologies, Inc., Santa Clara, CA, USA) a následně přepsána do cDNA pomocí random hexamer primerů [17].
Stanovení polymorfizmů
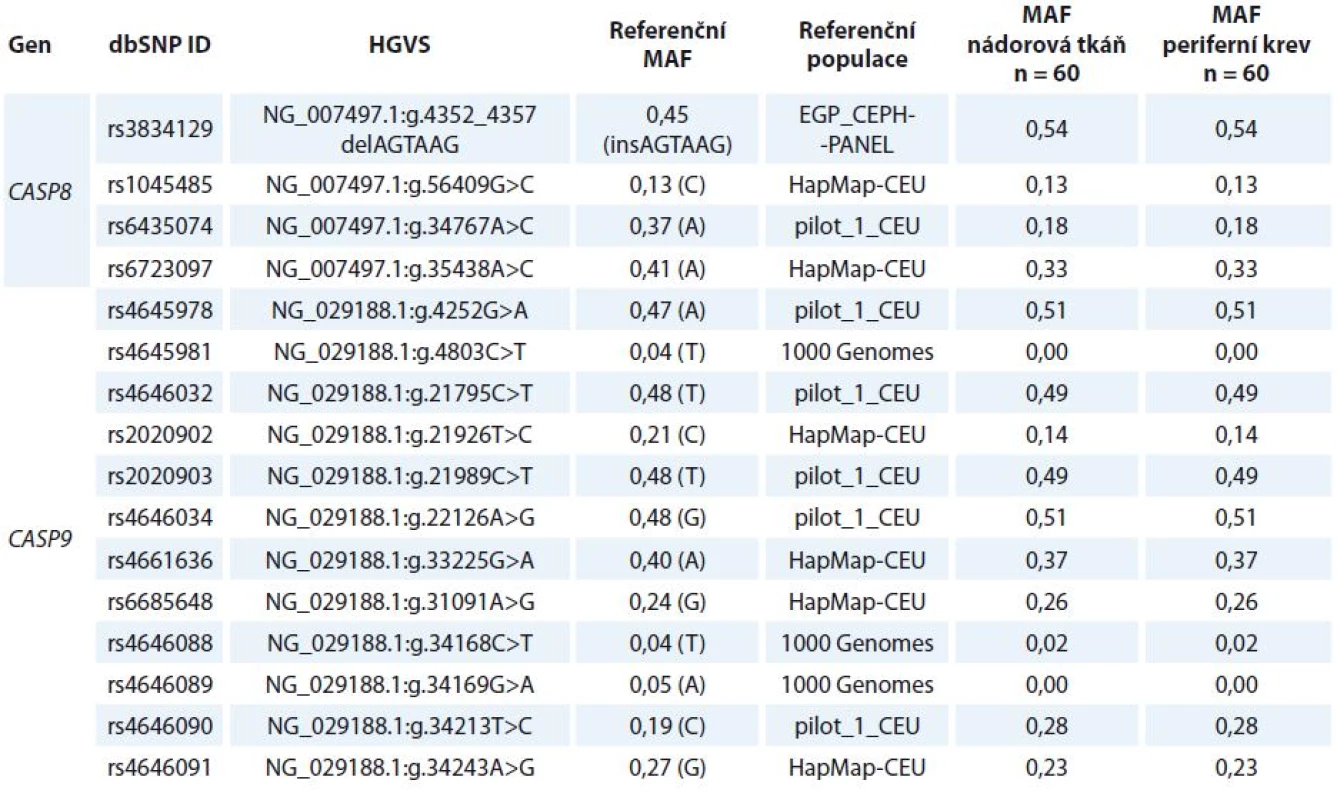
Celkem bylo analyzováno 16 polymorfizmů s MAF (minor allele frequency) > > 1 % (tab. 1) pomocí Sangerova sekvenování (rs4645981, rs4645978, rs4646032, rs2020902, rs2020903, rs4646034, rs4646088-91), HRM analýzy (high resolution melting analysis) (rs3834129, rs4661636 a rs6685648) nebo alelické diskriminace s využitím TaqMan sond (C___8823877_20 pro rs1045485, C__26112773_10 pro rs6435074, C__28993492_10 pro rs6723097, Invitrogen). Ke stanovení genotypu rs2020903 ve validační studii byla použita také TaqMan sonda (C___2845923_10). Sekvence primerů a podmínky všech stanovení jsou k dispozici na vyžádání. PCR produkty sekvenačních reakcí byly zkontrolovány na 1% agarózovém gelu a dále amplifikovány pomocí BigDye Terminator v3.1 Cycle Sequencing Kitu podle protokolu výrobce (Life Technologies, Carlsbad, CA, USA). Sekvence byly analyzovány pomocí sekvenátoru ABI3100 a softwaru Sequencing Analysis Software v5.2 (Life Technologies). Pro HRM analýzu byl využit Type-It HRM PCR kit (Qiagen) a systém RotorGene 6000 (Corbett Reseach, Sydney, Australia). ViiA7 Real-Time PCR Systém (Life Technologies) byl použit pro alelickou diskriminaci s TaqMan sondami. Opakovaně analyzováno bylo 10 % náhodně vybraných vzorků, přičemž výsledky se 100% shodovaly.
Kvantitativní real-time PCR
Pro stanovení hladin celkového transkriptu CASP8 a CASP9 a specifickou detekci proapoptické varianty CASP9A a alternativních variant CASP9B a CASP8L byla využita PCR kvantifikace v reálném čase (qPCR) na ViiA7 Real-Time PCR Systému (Life Technologies) a komerčně dostupné (CASP8 Hs01018151_m1, CASP9 Hs00154260_m1, CASP9A Hs00154261_m1) či uživatelsky navržené (CASP9B dle [21], CASP8L „in-house“) TaqMan sondy. Transkripty genů EIF2B1 (eukaryotic translation initiation factor 2B, subunit 1), MRPL19 (mitochondrial ribosomal protein L19) a IPO8 (importin 8) byly použity pro normalizaci transkripčních hladin dle předchozí studie [17]. Sekvence primerů a sond vč. podmínek všech qPCR reakcí jsou k dispozici na vyžádání. Účinnost všech TaqMan esejí byla mezi 90 a 100 %. Vzorky byly amplifikovány jako duplikáty a při rozdílu mezi duplikáty větším než 0,5 cyklu byly vzorky opakovaně analyzovány. Negativní PCR kontroly a negativní kontroly cDNA syntézy byly zahrnuty v protokolech pro kontrolu potenciální kontaminace.
Statistická analýza
Vztahy transkripčních hladin CASP8 a CASP9 k polymorfizmům byly analyzovány pomocí Mann-Whitney testu. Pro analýzy byly použity hodnoty poměru Cq (quantification cycle, odpovídá cyklu, ve kterém došlo k významnému nárůstu fluorescenčního signálu v dané reakci) testovaných genů k průměru tří referenčních genů. Vztahy polymorfizmů s klinickými údaji byly v pilotní studii analyzovány pomocí Kruskal-Wallisova testu a Pearsonova chi-kvadrát testu. K vyjádření vztahů polymorfizmů ke sledovaným parametrům ve validační studii byl použit odhad relativního rizika (odds ratio – OR, Mantel-Haenszel common odds ratio estimate) s 95% CI v kodominantním, dominantním a recesivním genetickém modelu. Potenciální funkční význam validovaných polymorfizmů byl predikován in silico pomocí HaploReg v4 [22].
Pro určení vztahu vybraných polymorfizmů s bezpříznakovým přežíváním pacientek byl použit Kaplan-Meierův plot a Log Rank test jak v celém souboru pacientek, tak v podskupinách rozdělených dle typu terapie. Medián doby sledování pacientek byl 46,5 měsíce.
Za významné byly považovány p < 0,05 v rámci oboustranných testů. Pro statické analýzy byl využit statistický software SPSS v16.0 (SPSS Inc., Chicago, IL). Korekce statistické chyby typu I dle Benjamini-Hochberga (false discovery rate – FDR) byla použita na všechny analýzy kromě analýz přežívání [23].
Výsledky
Pilotní analýza polymorfizmů CASP8 a CASP9 v nádorové a kontrolní DNA
Vybrané polymorfizmy v CASP8 a CASP9 byly stanovené v nádorové a kontrolní (lymfocytární) DNA získané od 60 pacientek (tab. 2). Rozdíly ve frekvenci alel ani v rozdělení jednotlivých genotypů mezi nádorovou a kontrolní DNA nebyly zjištěny (tab. 1).
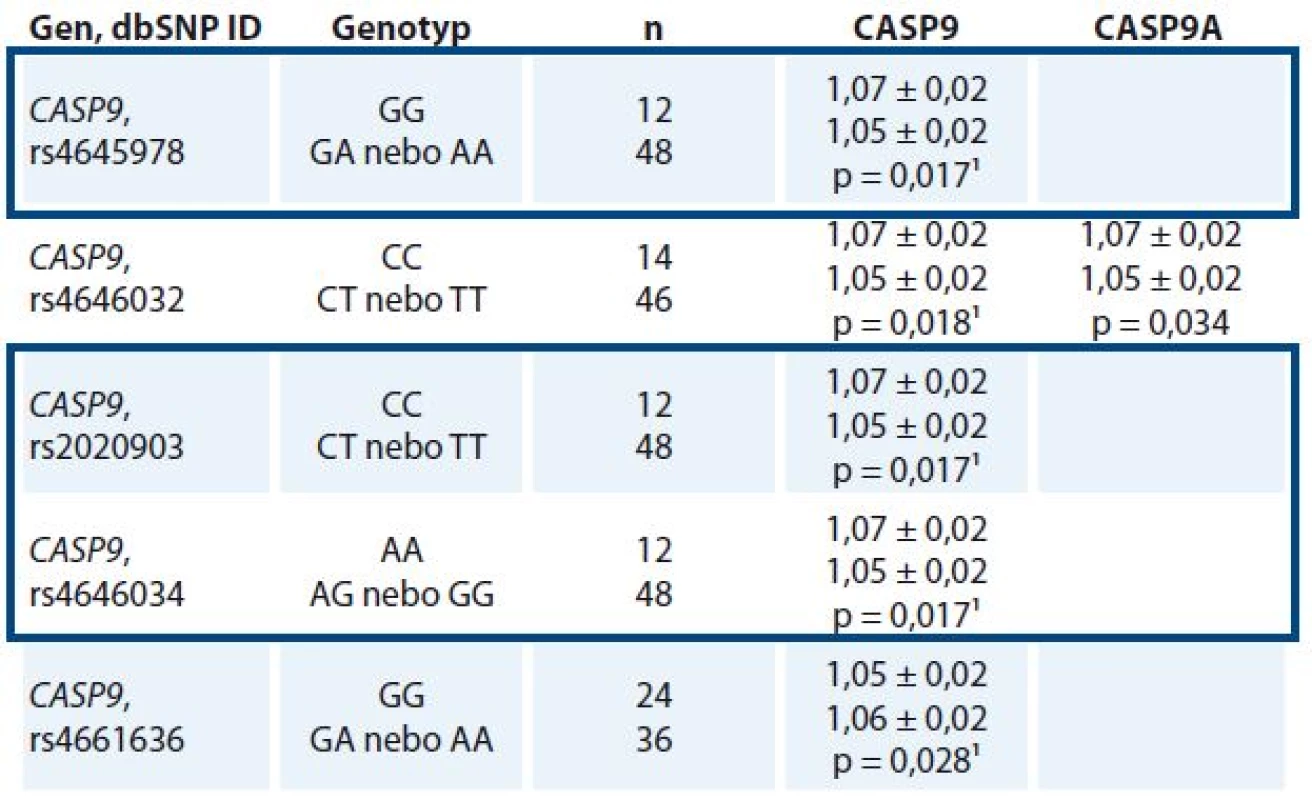
Nalezené polymorfizmy s frekvencí MAF nad 10 % byly vztaženy k míře exprese transkriptů CASP8, CASP9, CASP8L, CASP9A a CASP9B. U nosiček homozygotních genotypů CC pro polymorfizmus rs4646032, CC pro rs2020903, AA pro rs4646034 a GG pro rs4645978 v genu CASP9 byly nalezeny významně nižší exprese transkriptu CASP9 v nádorové tkáni ve srovnání s nosičkami alternativních genotypů. Genotyp GG polymorfizmu rs4661636 v CASP9 byl naopak spojen s vyššími nádorovými hladinami transkriptu CASP9 oproti nosičkám genotypů CG a CC (tab. 3). Významné vztahy polymorfizmů v CASP8 k hladinám celkového transkriptu CASP8 a k sestřihové variantě CASP8L nalezeny nebyly. Genotypy tří polymorfizmů (rs645978, rs2020903 a rs4646034) měly ve sledovaném souboru shodnou distribuci, a vytvářely tedy haplotyp.
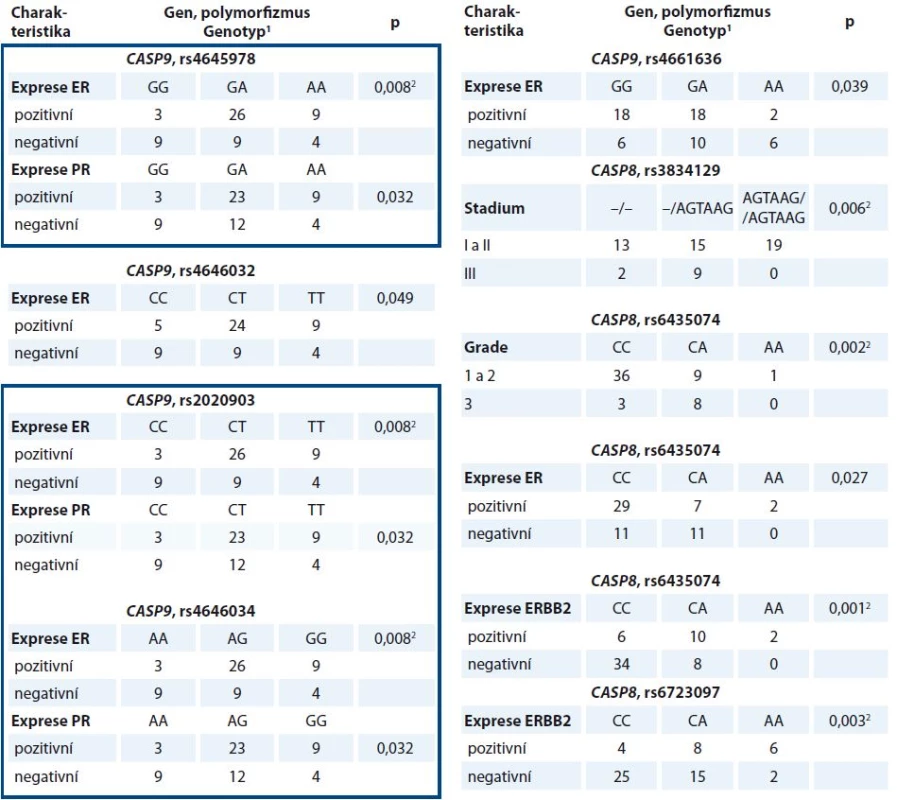
Dále byly vybrané polymorfizmy porovnány s klinickými údaji pacientek. Všechny významné výsledky jsou shrnuty v tab. 4. Mezi nejvýznamnější výsledky pilotní studie patří odhalení vztahu haplotypu CASP9 rs4645978-rs2020903-rs4646034 k expresi estrogenního a progesteronového receptoru v nádorech, vztah polymorfizmu rs3834129 v CASP8 ke stadiu onemocnění, polymorfizmu rs6435074 k expresi estrogenního receptoru, ERBB2 a ke gradu nádoru a polymorfizmu rs6723097 v CASP8 k expresi ERBB2.
Validační analýza polymorfizmů CASP8 a CASP9 v kontrolní DNA
Výše popsané vztahy haplotypu CASP9 rs4645978-rs2020903-rs4646034 a polymorfizmů CASP8 rs3834129, rs6435074 a rs6723097 ke klinickým údajům pacientek byly dále validovány ve vzorcích DNA periferních krevních lymfocytů získaných od 615 pacientek s karcinomem prsu (tab. 2).
Ve validační studii byly nalezeny vztahy haplotypu CASP9 (dále reprezentovaný polymorfizmem rs2020903) k expresi ERBB2, postižení spádových mízních uzlin metastatickým rozsevem a k výskytu subtypu TNBC, které v pilotní studii pozorovány nebyly (tab. 5). Vztah polymorfizmu rs2020903 v CASP9 k expresi estrogenního receptoru sice nebyl potvrzen, avšak významně vyšší frekvence alely C tohoto polymorfizmu u pacientek s nádory, které neexprimují progesteronový receptor, byla patrná ve všech testovaných genetických modelech (tab. 5).
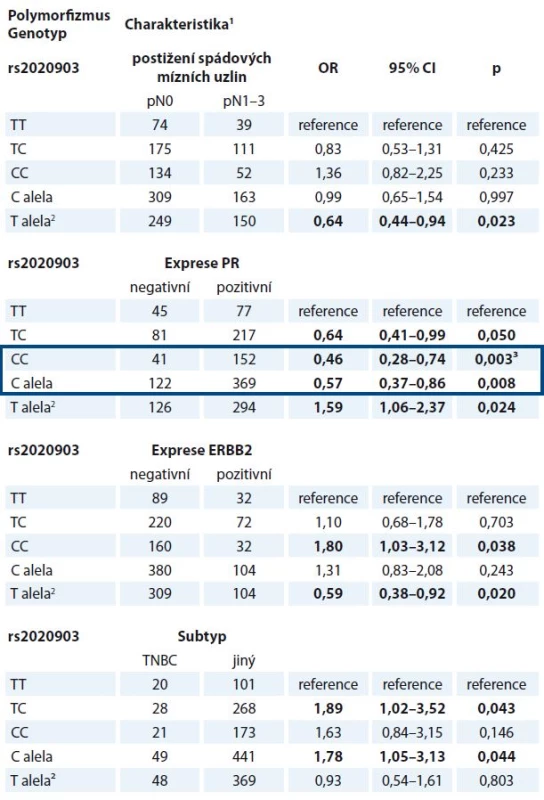
Žádný z dříve nalezených vztahů polymorfizmů CASP8 ke klinickým údajům se ve validační studii nepodařilo ověřit. Analýza přežívání však ukázala, že pacientky léčené hormonální terapií, které mají alelu A v polymorfizmu rs6723097 CASP8, vykazují delší bezpříznakové přežívání než nosičky genotypu CC (p = 0,009, Log Rank test) (graf 1).

Diskuze
Apoptóza je hlavním mechanizmem programované buněčné smrti a její změny mohou vést ke vzniku nádorového onemocnění, jeho progresi i k rezistenci nádorů na podanou terapii. Tato práce měla za úkol prostudovat genetické polymorfizmy genů kódujících dvě hlavní kaspázy iniciující apoptózu na základě stimulů různého typu. Sledované polymorfizmy byly opakovaně publikovány v souvislosti s rizikem vzniku karcinomu prsu. Cílem práce nebylo hodnotit význam těchto polymorfizmů z hlediska rizika vzniku karcinomu, ale ověřit, zda tyto polymorfizmy souvisejí s expresí genů v nádorové tkáni karcinomu, tzn. s molekulárním fenotypem, a definovat jejich možný klinický význam.
Zjistili jsme, že výskyt haplotypu složeného ze tří polymorfizmů rs4645978-rs2020903-rs4646034 ležících v oblasti promotoru (rs4645978) a intronu 3 (rs2020903 a rs4646034 ve vzdálenosti 71 a 208 bp od místa sestřihu, schéma 1) CASP9 je významně spojen s hladinou transkriptu CASP9 v nádorech, ale dále i s řadou prognosticky významných klinických parametrů (exprese progesteronového receptoru, ERBB2 a TNBC subtyp).
Alela G polymorfizmu rs4645978 byla častěji zastoupena u pacientů s nádory prsu v porovnání se zdravými kontrolami [11], ačkoli v jiných studiích se tento trend neprojevil [8,9]. V této práci byl genotyp GG-CC-AA haplotypu rs4645978-rs2020903-rs4646034 spojen s nižšími hladinami CASP9 a s absencí exprese progesteronového receptoru v nádorech. In silico analýza (HaploReg v4) navíc ukázala, že rs2020903 mění motiv pro vazbu transkripčních faktorů GATA a Nanog, které byly již dříve diskutovány v souvislosti se vznikem a progresí karcinomu prsu [24,25]. Tato data ukazují na možný klinický význam haplotypu rs4645978-rs2020903-rs4646034 v procesu vzniku a progrese karcinomu prsu, který by měl být ověřen odpovídající funkční studií.
Kaspáza 8 se spolu s kaspázou 10 uplatňuje především ve vnější dráze buněčné smrti iniciované vazbou ligandů smrti na receptory smrti (např. Fas/FasL, TNFR/TNF). Žádný ze čtyř vybraných polymorfizmů CASP8 v této studii nebyl významně spojen s expresí transkriptu CASP8 ani s expresí alternativní varianty CASP8L v nádorových tkáních karcinomu prsu. Ze studovaných polymorfizmů např. výskyt D302H (rs1045485) dříve nebyl spojen s expresí CASP8 v nádorových buňkách neuroblastomu [26], což nepřímo podporuje naše výsledky. V práci Sun et al 2007 [11] pozorovali snížení exprese kaspázy 8 v buňkách lymfocytů u nosiček delece v promotoru CASP8 (652 6N, rs3834129). V nedávno publikovaných pracích [27,28] byl nalezen vztah lokusu zahrnujícího geny CASP8 a ALS2CR12 (v oblasti 2q33) k riziku vzniku karcinomu prsu a bazocelulárního karcinomu. Zároveň variabilita v tomto lokusu významně souvisela s expresí alternativních variant CASP8, CASP8E a CASP8L v lymfocytech a vzorcích tukové tkáně [28]. V současné studii však byly detekovány velmi nízké hladiny CASP8L v tkáňových vzorcích karcinomu prsu ve srovnání s hlavním transkriptem, což nenaznačuje významnou biologickou funkci této varianty v progresi karcinomu prsu.
Polymorfizmus rs6723097 v CASP8 významně koreloval s bezpříznakovým přežíváním pacientek léčených hormonální terapií. Vztah fenotypu či genotypu CASP8 k účinnosti hormonální terapie karcinomu prsu byl zatím studován velmi omezeně [29], a měl by proto být následně ověřen nezávislou studií.
Závěr
Současná studie odhalila dosud neznámý, potenciálně (in silico) funkční vztah haplotypu CASP9, složeného ze tří polymorfizmů typu SNP, k molekulárnímu (expresi hlavního transkriptu) i klinickému (prognostické faktory) fenotypu karcinomu prsu. Tento vztah naznačuje, za předpokladu, že bude ověřen nezávislými studiemi na větších skupinách pacientek, možné využití v prognostice onemocnění.
Studie byla podpořena projektem GA Univerzity Karlovy v Praze, č. 1444313 a projektem AZV, č. 15-25618A.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Mgr. Veronika Brynychová
Oddělení toxikogenomiky
Státní zdravotní ústav
Šrobárova 48
100 42 Praha 10
e-mail: veronika.brynychova@szu.cz
Obdrženo: 3. 3. 2016
Přijato: 26. 10. 2016
Sources
1. Svod.cz [internetová stránka]. Český národní webový portál epidemiologie nádorů. Masarykova univerzita, Česká republika; [aktualizováno 6. prosince 2015; citováno 1. února 2016]. Dostupný z: www.svod.cz.
2. Michailidou K, Hall P, Gonzalez-Neira A et al. Large-scale genotyping identifies 41 new loci associated with breast cancer risk. Nature Genetics 2013; 45 (4): 353–361. doi: 10.1038/ng.2563.
3. Ghavami S, Hashemi M, Ande SR et al. Apoptosis and cancer: mutations within caspase genes. J Med Genet 2009; 46 (8): 497–510. doi: 10.1136/jmg.2009.066944.
4. Stephens PJ, Tarpey PS, Davies H et al. The landscape of cancer genes and mutational processes in breast cancer. Nature 2012; 486 (7403): 400–404. doi: 10.1038/nature11017.
5. Cox A, Dunning AM, Garcia-Closas M et al. A common coding variant in CASP8 is associated with breast cancer risk. Nature Genetics 2007; 39 (3): 352–358.
6. Shephard ND, Abo R, Rigas SH et al. A breast cancer risk haplotype in the caspase-8 gene. Cancer Research 2009; 69 (7): 2724–2728. doi: 10.1158/0008-5472.CAN-08-4266.
7. Sergentanis TN, Economopoulos KP. Association of two CASP8 polymorphisms with breast cancer risk: a meta-analysis. Breast Cancer Res Treat 2010; 120 (1): 229–234. doi: 10.1007/s10549-009-0471-5.
8. Turnbull C, Ahmed S, Morrison J et al. Genome-wide association study identifies five new breast cancer susceptibility loci. Nature Genetics 2010; 42 (6): 504–507. doi: 10.1038/ng.586.
9. Zhang B, Beeghly-Fadiel A, Long J et al. Genetic variants associated with breast-cancer risk: comprehensive research synopsis, meta-analysis, and epidemiological evidence. Lancet Oncol 2011; 12 (5): 477–488. doi: 10.1016/S1470-2045 (11) 70076-6.
10. Camp NJ, Parry M, Knight S et al. Fine-mapping CASP8 risk variants in breast cancer. Cancer Epidemiol Biomarkers Prev 2012; 21 (1): 176–181. doi: 10.1158/1055-9965.EPI-11-0845.
11. Sun T, Gao Y, Tan W et al. A six-nucleotide insertion-deletion polymorphism in the CASP8 promoter is associated with susceptibility to multiple cancers. Nat Genet 2007; 39 (5): 605–613.
12. Horiuchi T, Himeji D, Tsukamoto H et al. Dominant expression of a novel splice variant of caspase-8 in human peripheral blood lymphocytes. Biochem Biophys Res Commun 2000; 272 (3): 877–881.
13. Himeji D, Horiuchi T, Tsukamoto H et al. Characterization of caspase-8L: a novel isoform of caspase-8 that behaves as an inhibitor of the caspase cascade. Blood 2002; 99 (11): 4070–4078.
14. Theodoropoulos GE, Michalopoulos NV, Pantou MP et al. Caspase 9 promoter polymorphisms confer increased susceptibility to breast cancer. Cancer Genetics 2012; 205 (10): 508–512. doi: 10.1016/j.cancergen.2012.08.001.
15. Srinivasula SM, Ahmad M, Guo Y et al. Identification of an endogenous dominant-negative short isoform of caspase-9 that can regulate apoptosis. Cancer Research 1999; 59 (5): 999–1002.
16. Hubackova M, Vaclavikova R, Ehrlichova M et al. Association of superoxide dismutases and NAD (P) H quinone oxidoreductases with prognosis of patients with breast carcinomas. Int J Cancer 2012; 130 (2): 338–348. doi: 10.1002/ijc.26006.
17. Brynychová V, Hlaváč V, Ehrlichová M et al. Importance of transcript levels of caspase-2 isoforms S and L for breast carcinoma progression. Future Oncol 2013; 9 (3): 427–438. doi: 10.2217/fon.12.200.
18. Tavassoli FA, Devilee P eds. Pathology & genetics: tumours of the breast and female genital organs. Vol. 4. Lyon: IARC 2003.
19. Goldhirsch A, Winer EP, Coates AS et al. Personalizing the treatment of women with early breast cancer: highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2013. Ann Oncol 2013; 24 (9): 2206–2223. doi: 10.1093/annonc/mdt303.
20. Topić E, Gluhak J. Isolation of restrictible DNA. Eur J Clin Chem Clin Biochem 1991; 29 (5): 327–330.
21. Vu NT, Park MA, Shultz JC et al. hnRNP U enhances caspase-9 splicing and is modulated by AKT-dependent phosphorylation of hnRNPL. J Biol Chem 2013; 288 (12): 8575–8584. doi: 10.1074/jbc.M112.443333.
22. Ward LD, Kellis M. HaploReg: a resource for exploring chromatin states, conservation, and regulatory motif alterations within sets of genetically linked variants. Nucleic Acid Research 2012; 40: D930–D934. doi: 10.1093/nar/gkr917.
23. Benjamini Y, Hochberg Y. Controlling the false discovery rate: a practical and powerful approach to multiple testing. J R Statist Soc B 1995; 57 (1): 289–300.
24. Kouros-Mehr H, Slorach EM, Sternlicht MD et al. GATA-3 maintains the differentiation of the luminal cell fate in the mammary gland. Cell 2006; 127 (5): 1041–1055.
25. Wang D, Lu P, Zhang H et al. Oct-4 and Nanog promote the epithelial-mesenchymal transition of breast cancer stem cells and are associated with poor prognosis in breast cancer patients. Oncotarget 2014; 5 (21): 10803–10815.
26. Rihani A, De Wilde B, Zeka F et al. CASP8 SNP D302H (rs1045485) is associated with worse survival in MYCN-amplified neuroblastoma patients. PLoS One 2014; 9 (12): e114696. doi: 10.1371/journal.pone.0114696.
27. Lin WY, Camp NJ, Ghoussaini M et al. Identification and characterization of novel associations in the CASP8/ALS2CR12 region on chromosome 2 with breast cancer risk. Hum Mol Genet 2015; 24 (1): 285–298. doi: 10.1093/hmg/ddu431.
28. Stacey SN, Helgason H, Gudjonsson SA et al. New basal cell carcinoma susceptibility loci. Nat Commun 2015; 6 : 6825. doi: 10.1038/ncomms7825.
29. Nehra R, Riggins RB, Shajahan AN et al. BCL2 and CASP8 regulation by NF-κB differentially affect mitochondrial function and cell fate in antiestrogen-sensitive and-resistant breast cancer cells. FASEB J 2010; 24 (6): 2040–2055. doi: 10.1096/fj.09-138305.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2016 Issue 6
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Molekulárně genetické vyšetření u akutní myeloidní leukemie
- Molekulární genetika kolorektálního karcinomu
- Zapojení PIWI-interagujících RNA do procesů kancerogeneze prostřednictvím regulace genové exprese
- Klinický a funkční význam vybraných polymorfizmů CASP8 a CASP9 u karcinomu prsu
- Pacientka s primárním intraventrikulárním gliosarkomem s dlouhodobým přežíváním – kazuistika
- Intervenční cvičební program pro onkologické pacientky s karcinomem prsu
- Kvalita života, úzkost a deprese u pacientů s diferencovaným karcinomem štítné žlázy během krátkodobé hypotyreózy indukované vysazením levothyroxinu
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Molekulárně genetické vyšetření u akutní myeloidní leukemie
- Molekulární genetika kolorektálního karcinomu
- Pacientka s primárním intraventrikulárním gliosarkomem s dlouhodobým přežíváním – kazuistika
- Kvalita života, úzkost a deprese u pacientů s diferencovaným karcinomem štítné žlázy během krátkodobé hypotyreózy indukované vysazením levothyroxinu
