Úvod do problematiky léčby zhoubných nádorů ledvin
Treatment of Metastatic Renal Cell Carcinoma
Introduction:
Renal cell cancer accounts for approximately 2–3% of all cases of malignancy. The incidence of kidney cancer in the Czech Republic is the highest in the world. Approximately 70% of renal cell carcinomas are clear-cell renal cancer. Various treatment options for metastatic renal cell cancer (mRCC) have been developed. Treatment regimens comprise antiangiogenic drugs in combination with vascular endothelial growth factor receptor inhibitors, mTOR inhibitors, and immunotherapy.
Aim:
This review provides an overview of the current treatment options for mRCC. Patients with a good performance status and a low systemic disease burden are candidates for cytoreductive nephrectomy. Ablative methods, such as stereotactic radiotherapy, can be used in patients with oligometastatic disease. Sunitinib and pazopanib are preferred first-line treatments for mRCC and provide similar outcomes. Second-line and higher line treatments markedly changed with the development of new drugs, such as cabozantinib and the immunotherapy nivolumab. The optimal treatment sequence for mRCC is discussed. Ongoing studies are evaluating combined treatments and searching for potential biomarkers. However, the tumor heterogeneity of renal cell cancer complicates the use of biomarkers.
Conclusion:
The results of clinical trials have markedly changed the treatment guidelines for mRCC. New strategies include combinatorial approaches, which mainly incorporate immunotherapy.
Key words:
renal cancer – targeted therapy – immunotherapy – metastases – biomarkers
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted:
19. 12. 2017
Accepted:
7. 1. 2018
Authors:
Richter Igor 1,2; Dvořák Josef 2
Authors‘ workplace:
Onkologické oddělení, Krajská nemocnice Liberec
1; Onkologická klinika 1. LF UK a Thomayerova nemocnice, Praha
2
Published in:
Klin Onkol 2018; 31(2): 110-116
Category:
Review
doi:
https://doi.org/10.14735/amko2018110
Overview
Východiska:
Zhoubné nádory ledvin představují přibližně 2–3 % všech malignit. Česká republika celosvětově dosahuje prvenství v incidenci zhoubných nádorů ledvin. Nejčastější je světlobuněčný karcinom, který představuje přibližně 70 % všech renálních karcinomů. V léčbě metastatického renálního karcinomu (metastatic renal cell cancer – mRCC) došlo v poslední době k významnému rozšíření léčebných možností. Léčba zahrnuje antiangiogenní přístup inhibicí receptoru pro vaskulární endoteliální růstový faktor, inhibice dráhy mTOR (mechanistic target of rapamycin) a imunoterapii.
Cíl:
Cílem přehledového článku je pohled na aktuální léčebné možnosti mRCC. U pacientů v dobrém výkonnostním stavu a s menším rozsahem systémové diseminace lze zvážit provedení cytoredukční nefrektomie. V případě oligometastatického onemocnění lze zvážit použití ablačních metod, např. stereotaktické radioterapie. V 1. linii léčby mRCC dominuje podání sunitinibu nebo pazopanibu, které lze považovat v účinnosti za rovnocenné. K výrazné změně dochází v léčbě 2. a vyšší linie, kde se uplatňují nové léky jako kabozantinib či možnosti imunoterapie zastoupené nivolumabem. Optimální sekvence léčby mRCC je otázkou aktuální diskuze. Dále probíhá mnoho klinických studií, které hodnotí kombinovanou terapii, jiné práce se věnují hledání využitelného prediktivního biomarkeru. Problémem biomarkerů je nádorová heterogenita karcinomu ledviny.
Závěr:
Léčba mRCC aktuálně prochází významnými změnami na podkladě výsledků proběhlých klinických studií. Nové postupy budou zahrnovat kombinovanou léčbu, hlavně s využitím imunoterapie. Tato skutečnost se postupně promítá do změny léčebných standardů tohoto onemocnění.
Klíčová slova:
karcinom ledviny – cílená terapie – imunoterapie – metastázy – biomarkery
Zhoubné nádory ledvin představují přibližně 2–3 % všech malignit [1]. ČR celosvětově dosahuje prvenství v incidenci zhoubných nádorů ledvin. Incidence v ČR byla v roce 2015 28,34 a mortalita 10,94 na 100 000 obyvatel [2,3]. Renální karcinom (renal cell cancer – RCC) představuje heterogenní skupinu tumorů vycházejících z nefronu. Modernější Vancouverská klasifikace renálních tumorů vychází nejenom z patologické klasifikace, ale hodnotí i molekulární charakteristiky jednotlivých typů RCC [4]. Aktuální histopatologická klasifikace byla publikovaná v roce 2016 [5]. Přibližně 70 % zhoubných nádorů ledvin představuje světlobuněčný karcinom, který je dominantně asociován s dysfunkcí v genu von Hippel-Lindau (VHL). Tato porucha je spojena s akumulací hypoxia indukovaného faktoru (HIF), v důsledku čehož dochází k podobným metabolickým jevům jako při hypoxii. Výsledkem je indukce vaskulárního endoteliálního růstového faktoru (vascular endothelial growth factor – VEGF) s následnou stimulací angiogeneze [6]. Podobně při analýze světlobuněčného karcinomu byly zjištěny i dysfunkce v dráze mTOR (mechanistic target of rapamycin), která je spojena s tumorovou progresí [7,8]. Obě skutečnosti se staly podkladem klinického využití cílené léčby proti receptorům pro VEGF (VEGFR) a dráze mTOR. S dalším vývojem došlo v posledních letech i k rozvoji imunoterapie v klinické praxi, hlavně ovlivněním kontrolních bodů imunitní reakce [9]. Zatím nemáme k dispozici prognostické či prediktivní biomarkery použitelné v běžné klinické praxi při léčbě metastatického RCC (mRCC). Proto na podkladě klinických či laboratorních ukazatelů existují skórovací systémy, které klasifikují nemocné do prognostických skupin. Široce se v praxi používá hlavně klasifikace podle Memorial Sloan Kettering Cancer Center (MSKCC), jejíž výsledky vycházejí z klinických studií hodnotících imunoterapii založenou na cytokinech. Skupina bez rizikových faktorů (dobrá prognóza) prokázala celkové přežití (overall survival – OS) 30 měsíců, skupina nemocných s jedním až dvěma faktory (střední prognóza) dosáhla OS 14 měsíců, skupina se třemi a více faktory (špatná prognóza) měla OS jenom 5 měsíců [10]. Pro indikaci léčby temsirolimem se doporučují modifikovaná MSKCC kritéria podle Hudese [11]. Novější klasifikaci představuje Hengův model, který vychází z dat novější cílené terapie [12]. Podle této klasifikace pacienti v dobré prognostické skupině prokázali OS 43 měsíců ve srovnání s nemocnými se špatnou prognózou, kde bylo OS jenom 8 měsíců [13]. Ve výsledcích délky OS obou modelů lze pozorovat zlepšení léčebných výsledků po zavedení cílené terapie ve srovnání s léčbou cytokiny. Přehled skórovacích systémů je podrobně uveden v Modré knize České onkologické společnosti (ČOS) [14]. I v době cílené terapie a imunoterapie má své postavení provedení cytoredukční nefrektomie u pacientů s mRCC. Nemocní, kteří absolvovali cytoredukční nefrektomii, měli delší OS než pacienti bez nefrektomie (17,1 vs. 7,7 měsíce; p < 0,001) [15]. Obecně lze doporučit provedení cytoredukční nefrektomie u pacientů v dobrém výkonnostním stavu a s méně rozsáhlým metastatickým postižením [16]. Cytoredukční nefrektomii lze indikovat i s odstupem po zahájení systémové cílené terapie bez zhoršení přežití bez známek progrese (progression-free survival – PFS), jak bylo prezentováno na loňském ESMO (European Society for Medical Oncology) 2017 [17]. Další text se zabývá možnostmi systémové léčby mRCC.
Systémová léčba karcinomu ledviny
V léčebných možnostech systémové léčby mRCC došlo v posledních letech k významným změnám vycházejícím z výsledků randomizovaných klinických studií, převážně fáze III. Aktuálně představují dominantní roli cílená léčba a imunoterapie. Hormonální léčba či cytotoxická chemoterapie neprokázaly výraznější účinnost u tohoto onemocnění. Menší část pacientů s mRCC profitovala z podání vysokodávkového interleukinu 2 (IL-2). Problematická byla vysoká toxicita této léčby s nutností aplikace na jednotkách intenzivní péče [18]. Cílenou léčbu představuje skupina inhibitorů angiogeneze, kam řadíme jednak tyrozinkinázové inhibitory (TKI) jako sunitinib, sorafenib, pazopanib, axitinib, kabozantinib, lenvatinib, jednak monoklonální protilátku bevacizumab. Další představitele cílené terapie v léčbě mRCC představuje skupina inhibitorů mTOR dráhy everolimus a temsirolimus. Představitelem imunoterapie v léčebné praxi mRCC je monoklonální protilátka nivolumab. Důležitým aspektem nových léčebných možností je kromě účinnosti i toxicita terapie. Obecně se toxicita cílené terapie nebo imunoterapie liší od typických nežádoucích účinků (NÚ) chemoterapie, navíc je rozdílná i v rámci jednotlivých typů cílené léčby. Přehled nejčastějších NÚ cílené léčby a imunoterapie je uveden v tab. 1. V ČR máme aktuálně definované 3 linie léčby mRCC [14]. V léčbě 1. linie se podle nejnovějších dat uplatňují jiné preparáty než v léčbě vyšší linie. Taky je důležité zmínit, že na podkladě účinnosti 1. linie terapie nelze většinou odhadovat výsledky léčby ve 2. či vyšší linii [14].

1. linie léčby
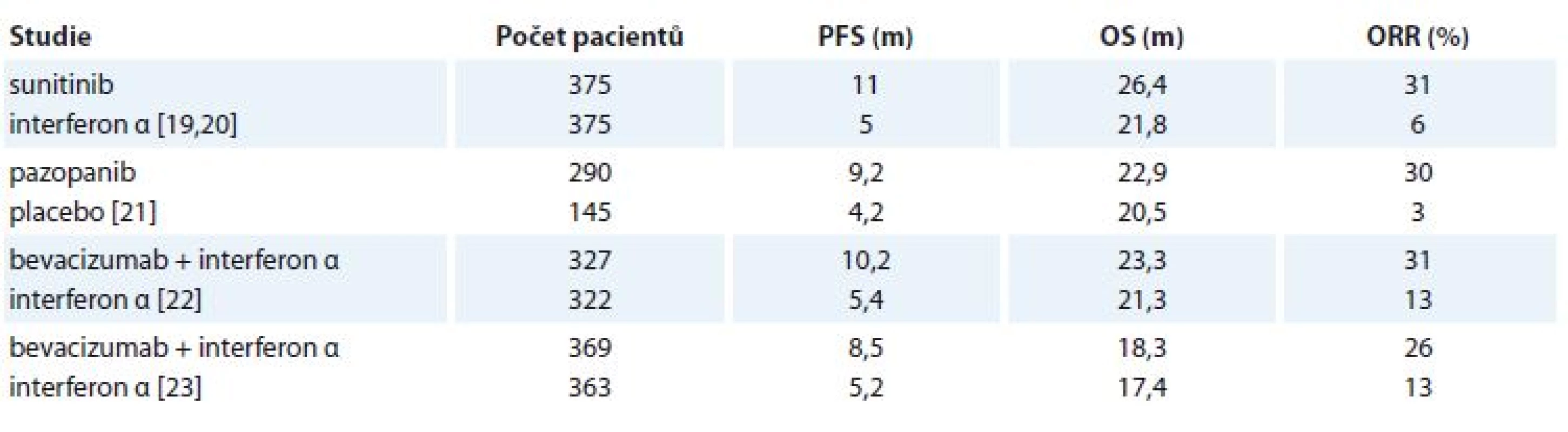
Přehled nejvýznamnějších klinických studií fáze III hodnotících 1. linii je uveden v tab. 2 [19–23]. Sunitinib je perorální inhibitor VEGFR 1–3 a dalších tyrozinkináz jako PDGFR (platelet-derived growth factor receptor), c-KIT a jiných. Podává se perorálně v dávce 50 mg/den po dobu 4 týdnů s 2týdenní pauzou. Jeho účinnost byla prokázaná v klinické studii, ve které byl srovnáván s interferonem α v 1. linii mRCC. Sunitinib prokázal významné prodloužení mediánu PFS a procenta celkové léčebné odpovědi (overall response rate – ORR). OS bylo prodlouženo na hranici statistické významnosti. Pazopanib je dalším perorálním TKI VEGFR1-3, PDGFR, c-KIT a dalších drah. V léčbě mRCC se používá kontinuálně v dávce 800 mg/den. V klinické studii prokázal v 1. linii ve srovnání s placebem významné prodloužení mediánu PFS a vyšší ORR, bez prodloužení mediánu OS. Další možností v léčbě 1. linie mRCC je monoklonální protilátka bevacizumab. V kombinaci s interferonem α prokázal bevacizumab významné prodloužení mediánu PFS ve srovnání s monoterapií interferonem α. OS nebylo významně prodlouženo. Nevýhodou je parenterální podání a toxicita interferonu α. Tato kombinace se v ČR v praxi výrazněji nepoužívá, dominantní roli léčby 1. linie mRCC představuje podávání sunitinibu a pazopanibu. Vzájemné porovnání obou preparátů hodnotila klinická studie COMPARZ, jejímž cílem bylo prokázání noninferiority pazopanibu ve srovnání se sunitinibem. Při hodnocení léčebných výsledků byla noninferiorita prokázaná jak v PFS (sunitinib vs. pazopanib – 9,5 vs. 8,4 měsíce; HR 1,05), tak i v OS (29,1 vs. 28,3 měsíce; HR 0,92) či ORR (25 vs. 31 %). Jednotlivé preparáty se ale lišily odlišným spektrem NÚ (tab. 3). Toxicita pazopanibu prokázala příznivější vliv na kvalitu života než terapie sunitinibem [24,25]. Preference pacientů či lékařů ohledně účinků sunitinibu a pazopanibu zkoumala další klinická studie PISCES. Pacienti byli léčeni 10 týdnů sunitinibem (4 týdny sunitinib, 2 týdny pauza, 4 týdny sunitinib) nebo pazopanibem (10 týdnů kontinuálně). Následně po 2 týdnech pauzy došlo k výměně terapie. Výsledkem studie byla vyšší preference pacientů pro pazopanib (70 %) než sunitinib (22 %), podobně pazopanib preferovala i větší část lékařů [26]. Na podkladě výše zmíněných dat se zdá, že léčba pazopanibem by mohla být výhodnější než podání sunitinibu. Nutno ale zmínit, že ve studii COMPARZ byla kvalita života hodnocena 28. den cyklu, kdy vrcholí NÚ sunitinibu před následnou 2týdenní pauzou. Ve studii PISCES pacienti léčení ve fázi I pazopanibem měli 2týdenní léčebnou pauzu (pazopanib se standardně používá kontinuálně), kdežto 2týdenní pauza u pacientů léčených zpočátku sunitinibem byla v podstatě součástí standardního režimu dávkování sunitinibu. Tedy pacienti léčení ve fázi I sunitinibem neměli „regulérní“ přestávku v léčbě, což mohlo ovlivnit preferenci nemocných či lékařů. Při použití pazopanibu v 1. linii léčby mRCC byla donedávna problematická definice další linie. V ČR se často používal po pazopanibu sunitinib, nicméně tato indikace nevycházela z výsledků randomizovaných studií. Aktuálně po progresi pazopanibu je další linie léčby již dobře definovaná, kdy lze podat jak kabozantinib, tak i nivolumab, podobně jako po progresi sunitinibem. V ČR na podkladě dat z registru RENIS je pazopanib vnímán spíše jako lék vhodný pro starší populaci pacientů, nicméně jeho účinnost byla prokázaná i u pacientů mladších. Další možnost, jak zlepšit toleranci léčby sunitinibem, je alternativní způsob podávaní, kdy nejvíce dat je k dispozici s takzvaným režimem 2/1 (2 týdny terapie/1 týden pauza), jak prezentovaly převážně retrospektivní klinické studie [27–29]. Některé studie dokonce prokázaly i lepší léčebné výsledky režimu 2/1 [30]. Indikace vhodného preparátu do 1. linie vychází jednak z charakteristik pacientů (komorbidity, anamnestické údaje, vliv možných NÚ na konkrétního nemocného), jednak ze zkušeností indikujících lékařů či daného onkologického pracoviště. Problematika, zda je výhodnější sunitinib, či pazopanib, je nadále široce diskutovaná. U pacientů se špatnou prognózou podle modifikovaných MSKCC kritérií lze zvážit i podání temsirolimu, který prokázal významné prodloužení nejenom mediánu PFS (HR 0,66; p < 0,001), ale i OS (HR 0,73; p = 0,008) ve srovnání s interferonem α [31]. Nevýhodou podání temsirolimu je nutnost týdenní nitrožilní infuze a nežádoucí vliv na metabolizmus lipidů a sacharidů. V klinické praxi se zřejmě častěji u této skupiny pacientů používá sunitinib nebo pazopanib, jak je to uvedeno i v doporučení ČOS [14]. Recentně byly publikovány výsledky klinické studie fáze II CABOSUN, která prokázala prodloužení mediánu PFS u pacientů se střední a špatnou prognózou léčených kabozantinibem ve srovnání se standardní léčbou sunitinibem v 1. linii [32].
![spektrum nežádoucích účinku pazopanibu a sunitinibu a podle studie COMPARZ [22].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/e7d077dde6f16b57f70b5beabb1a1319.jpg)
2. a vyšší linie
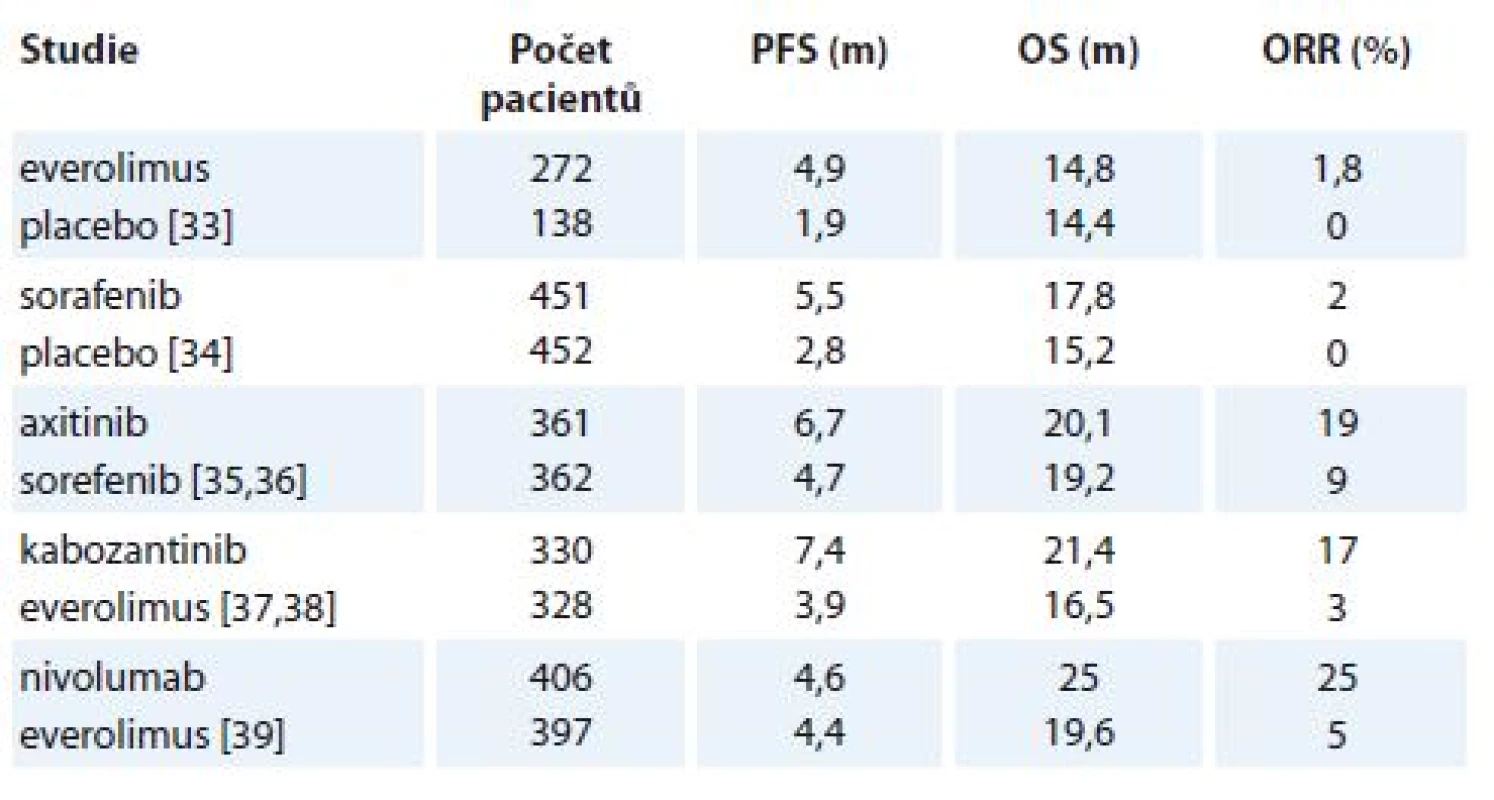
Přehled významných klinických studií hodnotících léčbu 2. a vyšší linie mRCC je uveden v tab. 4 [33–39]. Everolimus řadíme mezi perorální mTOR inhibitory se standardním dávkováním 10 mg/den kontinuálně. V klinické studii prokázal u pacientů po předchozí terapii sunitinibem nebo sorafenibem významné prodloužení mediánu PFS ve srovnání s placebem, ale bez prodloužení OS. Od léčby everolimem je nutno očekávat z hlediska hodnocení dosažení léčebné odpovědi hlavně stabilizaci onemocnění, kdy léčebná odpověď byla jenom u 1,8 % pacientů [33]. Dalším lékem, který prokázal účinnost ve 2. linii terapie mRCC po selhání cytokinové léčby, je sorafenib. Jedná se o TKI VEGFR, PDGFR a BRAF dráhy. Podává se perorálně v dávce 800 mg/den ve dvou dávkách. Sorafenib ve srovnání s placebem prokázal významné prodloužení mediánu PFS, opět bez prodloužení OS. Podobně jako everolimus ani sorafenib neprokázal větší procento ORR. Na druhé straně byla publikovaná studie fáze III INTORSECT, kde sorafenib prokázal významné prodloužení mediánu OS ve srovnání s temsirolimem po předchozí léčbě sunitinibem (16,6 vs. 12,3 měsíce; HT 1,31; p = 0,01) [40]. Novějším preparátem v léčbě 2. linie mRCC je axitinib. Axitinib řadíme mezi druhou generaci VEGFR inhibitorů s vyšší potencí a specificitou k cílové struktuře [41]. Axitinib se užívá perorálně ve dvou denních dávkách. Léčba je zahájená dávkou 2× 5 mg. V roce 2011 byly publikovány výsledky registrační prospektivní klinické studie fáze III AXIS. Do studie byli zahrnuti pacienti s mRCC po předchozí antiVEGFR léčbě převážně sunitinibem (62 %), méně po selhání cytokinů. Axitinib byl srovnáván se sorafenibem a prokázal významné prodloužení mediánu PFS. Jednalo se o první přímé srovnání dvou představitelů TKI ve 2. linii léčby mRCC [35]. V roce 2013 byla publikována nová analýza dat studie AXIS, která potvrdila významné prodloužení mediánu PFS ve skupině pacientů léčených axitinibem (8,3 vs. 5,7 měsíce; HR 0,656; p < 0,0001). Medián OS ale prodloužen nebyl (20,1 vs. 19,2 měsíce; HR 0,969; p = 0,374). V klinické studii AXIS prokázal axitinib výraznější prodloužení mediánu PFS ve srovnání se sorafenibem ve skupině nemocných, kteří byli léčení v 1. linii cytokiny (12,1 vs. 4,8 měsíce), než sunitinibem (4,8 vs. 3,4 měsíce). Jedním z nejčastějších NÚ axitinibu je arteriální hypertenze. Subanalýza studie AXIS prokázala, že zvýšení krevního tlaku v době léčby axitinibem je nezávislým prediktorem delšího OS [36]. V klinické praxi se proto doporučuje titrovat denní dávku axitinibu na podkladě zvýšení krevního tlaku. U pacientů léčených TKI VEGFR dochází časem k rozvoji rezistence. Preklinické práce prokázaly, že tato rezistence je spojena u karcinomu ledviny se zvýšením exprese genů MET a AXL [42]. Nový TKI kabozantinib inhibuje kromě angiogeneze i výše zmíněné geny. Jedná se o perorální lék s dávkováním 60 mg/den. Klinická studie METEOR hodnotila kabozantinib s everolimem u pacientů s mRCC po předchozí terapii TKI angiogeneze. Kabozantinib jako první preparát prokázal významné prodloužení všech tří ukazatelů jako PFS, OS i ORR [37,38]. Kabozantinib dále prokázal rychlý nástup léčebné odpovědi (necelé 2 měsíce), což lze využít hlavně u symptomatických pacientů s cílem dosažení časné léčebné odpovědi. Při podskupinové analýze kabozantinib prokázal účinnost i u prognosticky nepříznivé skupiny pacientů s kostním metastatickým procesem. Studie ale prokázala i vyšší výskyt toxicity kabozantinibu než everolimu s nutností častější redukce dávky (medián dávky 44 vs. 9 mg), i když procento přerušení léčby bylo v obou skupinách bez významného rozdílu. Kromě cílené terapie se aktuálně v léčbě 2. a vyšší linie mRCC začala používat i imunoterapie [9]. Nivolumab je monoklonální IgG4 protilátka proti PD-L1, která prokázala účinnost v celé řadě malignit. Aplikuje se v dávce 3 mg/kg v podobě nitrožilní infuze, 1× za 2 týdny. Nivolumab byl srovnáván s everolimem u pacientů s mRCC po předchozí terapii TKI angiogeneze v klinické studii CheckMate 025. Nivolumab významně prodloužil OS o 5,4 měsíce, což byl primární cíl studie. Medián PFS významně prodloužen nebyl. Snášenlivost imunoterapie byla lepší než ve skupině pacientů léčených everolimem [39]. Skutečnost, že nedošlo k prodloužení mediánu PFS, ale následně bylo popsáno prodloužení mediánu OS, je u pacientů léčených imunoterapií opakovaně pozorována. Souvisí to zřejmě se specifickým účinkem imunoterapie, kdy i po počáteční progresi nastává následně dlouhodobý léčebný efekt, který se může promítnout do prodloužení OS. Diskutovaným problémem imunoterapie je možný výskyt pseudoprogrese, která může vést k předčasnému ukončení potenciálně účinné léčby. Diskutovanou otázkou je hledání optimálního hodnocení léčebné odpovědi při léčbě imunoterapií. Nejčastěji se diskutuje možnost širšího využití imunitní varianty RECIST (Response Evaluation Criteria in Solid Tumours) kritérií. Dosavadní data zatím ale nejsou dostatečná pro jejich validaci. Na podkladě skutečnosti, že při léčbě nivolumabem ve výše zmíněné studii byla popsána primární progrese až u 30 % pacientů, imunoterapie nivolumabem nebude vhodná u nemocných se symptomatickým či rozsáhlejším onemocněním, kdy může v případě progrese dojít k významnému zhoršení klinického stavu. U imunoterapie je dále nutno myslet i na méně časté či neočekávané projevy toxicity, které mohou být pro pacienta i fatální, jako např. autoimunitní encefalitida.
Systémová terapie nesvětlobuněčných karcinomů
Do této skupiny řadíme papilární karcinom, který představuje přibližně 10 % všech RCC. U části papilárních karcinomů lze pozorovat alteraci již zmíněného MET genu, zatímco druhá část tohoto histologického typu je spojena s poškozením Nrf2-antioxidantu [43]. Vzácnějšími typy jsou chromofobní karcinom, medulární karcinom, karcinom z přechodných buněk aj. V léčbě těchto karcinomů máme k dispozici méně klinických dat vycházejících z randomizovaných studií. Obecně lze zmínit, že systémová léčba je méně účinná než u pacientů se světlobuněčným karcinomem. Standardy National Comprehensive Cancer Network (NCCN) doporučují zařazení pacientů do klinických studií [44]. Proběhlo několik randomizovaných studií, které prokázaly trend k delšímu PFS při terapii sunitinibem než everolimem [45–47]. U pacientů se sarkomatoidní variantou lze zvážit i podání systémové chemoterapie, nejčastěji se zmiňují data s gemcitabinem, kapecitabinem či doxorubicinem [14,48,49].
Perspektivy
Zdá se, že monoterapie standardními TKI angiogeneze již nejspíše dosáhla vrcholu své účinnosti. Dalším podkladem pro zlepšení výsledků léčby je při vzniku primární či získané rezistence na VEGFR inhibitory, inhibice dalších up-regulovaných drah (AXL, MET) [42]. Nová generace TKI představovaná kabozantinibem je podle aktuálních dat významně účinnější v porovnání se sunitinibem v 1. linii u pacientů se střední či špatnou prognózou či s mTOR inhibitory ve vyšší linii [32,37,38]. Bylo popsáno prodloužení OS u pacientů léčených sekvencí TKI – kabozantinib přibližně o 5 měsíců než u nemocných léčených sekvencí TKI – mTOR. Podobně i nivolumab prodloužil medián OS o 5 měsíců po předchozí TKI terapii ve srovnání se sekvencí TKI – mTOR. Další možností, jak dále zlepšit výsledky terapie mRCC, je kombinovaná léčba. Proběhlo několik klinických studií již s prvními výsledky. Studie fáze II hodnotila nový TKI lenvatinib. Jedná se o duální VEGFR a FGFR (fibroblast growth factor receptor) inhibitor, který v kombinaci s everolimem ve 2. linii mRCC významně prodloužil medián PFS (12,8 vs. 5,6 měsíce; HR 0,45; p = 0,003), OS (25,5 vs. 19,1 měsíce; HR 0,51; p = 0,02) ve srovnání s monoterapií everolimem. Studie dále prokázala dosud nevídané procento dosažení ORR (43 %). Tato skutečnost by mohla být využita u symptomatických pacientů s masivním metastatickým postižením [50]. Na loňské konferenci ESMO v Madridu byla publikována studie CheckMate 214, která u pacientů se střední a špatnou prognózou porovnávala kombinaci imunoterapie nivolumab + ipilimumab se standardní léčbou sunitinibem v 1. linii léčby mRCC. Kombinovaná imunoterapie prokázala významně delší medián PFS (11,6 vs. 8,4 měsíce; HR 0,82; p = 0,0331), OS (medián zatím nedosažen vs. 26,0 měsíce; HR 0,63; p < 0,000), jakož i ORR (42 vs. 27 %). Tato studie dále prokázala prediktivní vliv exprese PD-L1, kdy ve skupině pacientů s expresí ≥ 1 % byl rozdíl v PFS 22,8 vs. 5,9 měsíce (HR 0,48; p = 0,0003) [51]. Aktuálně probíhá mnoho klinických studií, převážně fáze I, které kombinují TKI a imunoterapii. Kontrolním ramenem je většinou standardní terapie 1. linie sunitinib. Problémem je kombinace pazopanibu a imunoterapie vzhledem k vysokému riziku jaterní toxicity. Další perspektivní možností je i použití protinádorových vakcín, nutno ale vyčkat na data ze studií fáze III hodnotících větší počet pacientů [52].
Biomarkery
V současné době nemáme k dispozici prediktivní biomarker pro léčbu TKI či mTOR inhibitory. V poslední době dochází na podkladě genové analýzy RCC k identifikaci mnoha mutovaných genů, které by mohly mít prognostický či prediktivní význam (PBRM1, BAP1, SETD2, KDM5C) [53]. Asi nejvíce dat máme z výzkumu genu KDM5C, který se spolupodílí na procesu transkripce a remodelace chromatinu. Mutovaná forma tohoto genu je spojena se zvýšením léčebné odpovědi na inhibitor VEGFR sunitinib ve srovnání s nemutovanou formou. Prediktivní význam mutace genu KDM5C na inhibitory mTOR nebyl prokázán [54]. Dvě retrospektivní studie prokázaly, že mutace v mTOR dráze v genech TSC1, TSC2 a MTOR jsou asociovány s odpovědí na mTOR inhibitory everolimus a temsirolimus [55,56]. Dalším hodnoceným biomarkerem byl gen MET jako cílová struktura pro kabozantinib. Subanalýza studie METEOR ale neprokázala korelaci mezi expresí MET a léčebnými výsledky. Exprese MET byla vyšetřena imunohistochemicky. Jiným potenciálním biomarkerem je exprese PD-L1. Zvýšená exprese PD-L1 a CD8 T lymfocytů byla asociovaná s kratším OS u pacientů léčených inhibitory VEGFR ve studii COMPARZ [57]. Podobně byl negativní prognostický vliv exprese PD-L1 prokázán i ve studii CheckMate 025, ale bez prediktivního působení na účinnost imunoterapie [39]. Prediktivní vliv exprese PD-L1 ≥ 1 % byl prokázán pro kombinaci nivolumab + ipilimumab ve studii CheckMate 214 [51]. Problematika nalezení optimálních biomarkerů v léčbě mRCC je výzvou pro aktuální výzkum.
Závěr
U pacientů se světlobuněčným mRCC představuje aktuálně významnou roli cílená terapie a imunoterapie. U pacientů v dobrém výkonnostním stavu a s menším rozsahem metastatického postižení lze zvážit provedení cytoredukční nefrektomie. V případě oligometastatického onemocnění lze uvažovat o chirurgické resekci metastáz nebo použití ablačních metod, jako je stereotaktická radioterapie. Podle doporučení NCCN, ESMO či ČOS lze definovat celkem 3 linie systémové terapie mRCC. V 1. linii hrají dominantní roli sunitinib a pazopanib, které lze považovat z hlediska účinnosti za rovnocenné, liší se ale spektrem NÚ. V léčbě další linie se vedou aktuální diskuze, zda pokračovat v podávání TKI, nebo indikovat imunoterapii nivolumabem. Užitečné mohou být podskupinové analýzy jednotlivých klinických studií. Léčba mTOR inhibitory po předchozí terapii TKI je méně účinná než terapie nové generace TKI či imunoterapie. V budoucnu lze na podkladě výsledků randomizovaných studií očekávat širší využití kombinace cílené terapie s imunoterapií [58].
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Obdrženo: 19. 12. 2017
Přijato: 7. 1. 2018
MUDr. Igor Richter, Ph.D.
Onkologické oddělení Krajská nemocnice Liberec
Husova 10
460 63 Liberec
Sources
1. Marenčák J, Ondrušová M, Ondruš D. Súčasný pohľad na diagnostiku a liečbu karcinómu obličky. Klin Onkol 2017; 30 (3): 175–181. doi: 10.14735/amko2017175.
2. Dušek L, Mužík J, Kubásek M et al. Epidemiologie zhoubných nádorů v České republice. [online]. Dostupné z: www: http: //www.svod.cz.
3. Dušek L, Mužík J, Malúšková D et al. Incidence a mortalita nádorových onemocnění v České republice. Klin Onkol 2014; 27 (6): 406–423. doi: 10.14735/amko2014406.
4. Srigley JR, Delahunt B, Eble JN et al. The International Society of Urological Pathology (ISUP) Vancouver classification of renal neoplasma. Am J Surg Pathol 2013; 37 (10): 1469–1489. doi: 10.1097/PAS.0b013e318299f2d1.
5. Moch H, Cubilla AL, Humprey PA et al. The 2016 WHO classification of tumours of the urinary system and male genital organs – port A: renal, penile, and testicular tumours. Eur Urol 2016; 70 (1): 93–105. doi: 10.1016/j.eururo.2016.02.029.
6. Kaelin WG Jr. The von Hippel-Lindau tumour suppressors protein: O2 sensing and cancer. Nat Rev Cancer 2008; 8 (11): 865–873. doi: 10.1038/nrc2502.
7. Cancer Genome Atlas Research Network. Comprehensive molecular characterization of clear cell renal carcinoma. Nature 2013; 499 (7456): 43–49. doi: 10.1038/nature12222.
8. Sabatiny DM. mTOR and cancer: insights into a complex relationship. Nat Rev Cancer 2006; 6 (9): 729–734. doi: 10.1038/nrc1974.
9. Büchler T. Imunoterapie renálního karcinomu. Klin Onkol 2015; 28 (Suppl 4): 4S64–4S68. doi: 10.14735/amko20154S64.
10. Motzer RJ, Bacik BA, Russi P et al. Interferon.alfa as a comparative treatment for clinical trials of new therapies against advanced renal cell carcinoma. J Clin Oncol 2002; 20 (1): 289–296. doi: 10.1200/JCO.2002.20.1.289.
11. Hudes G, Carducci M, Tomczak P et al. Temsirolimus, interferon alfa, or both for advanced renal-cell carcinoma. N Engl J Med 2007; 356 (22): 2271–2281. doi: 10.1056/NEJMoa066838.
12. Heng DY, Xie W, Regan MM et al. Prognostic factors for overall survival in patients with metastatic renal cell carcinoma treated with vascular endothelial growth factor-targeted agents: results form a large, multicenter study. J Clin Oncol 2009; 27 (34): 5794–5799. doi: 10.1200/JCO.2008.21.4809.
13. Heng DY, Xie W, Regan MM et al. External validation and comparison with other models of the International Database Consortium Prognostic Model: a population-based study. Lancet Oncol 2013; 14 (2): 141–148. doi: 10.1016/S1470-2045 (12) 70559-4.
14. Vyzula R, Adámková Krákorová D, Arenberger P et al. Zhoubný novotvar ledviny (C64). In: Modrá kniha České onkologické společnosti. Brno: Masarykův onkologický ústav 2017 : 116–119.
15. Hanna N, Sun M, Meyer CP et al. Survival analyses of patients with metastatic renal cancer treated with targeted therapy with or without cytoreductive nephrectomy: a national vancer data base study. J Clin Oncol 2016; 34 (27): 3267–3275. doi: 10.1200/JCO.2016.66.7931.
16. Heng DY, Wells JC, Rini BI et al. Cytoreductive nephrectomy in patients with synchronous metastases from renal cell carcinoma: results from the International Metastatic renal cell carcinoma database consortium. Eur Urol 2014; 66 (4): 704–710. doi: 10.1016/j.eururo.2014.05.034.
17. Bex A, Mulders P, Jewett M et al. Immediate versus deferred cytoreductive nephrectomy (CN) in patients with synchronous metastatic renal cell carcinoma (mRCC) receiving sunitinib (EORTC 30073 SURTIME). Ann Oncol 2017; 28 (Suppl 5): v605–v649. doi: 10.1093/annonc/mdx 440.
18. Allard CB, Gelpi-Hammerschmidt F, Harshman LC et al. Contemporary trends in high-dose interleukin-2 use for metastatic renal cell carcinoma in the United States. Urol Oncol 2015; 33 (11): 496. e11–e16. doi: 10.1016/j.urolonc.2015.06.014.
19. Motzer RJ, Hutson TE, Tomczak P et al. Sunitinib versus interferon alfa in metastatic renal-cell carcinoma. N Eng J Med 2007; 356 (2): 115–124. doi: 10.1056/NEJMoa065044.
20. Motzer RJ, Hutson TE, Tomczak P et al. Overall survival and updated results for sunitinib compared with interferon alfa in patients with metastatic renal cell carcinoma. J Clin Oncol 2009; 27 (22): 3584–3590. doi: 10.1200/JCO.2008.20.1293.
21. Sternberg CN, Davis ID, Mardiak J et al. Pazopanib in locally advanced or metstatic renal cell carcinoma: results of a randomized phase III trial. J Clin Oncol 2010; 28 (6): 1061–1068. doi: 10.1200/JCO.2009.23.9764.
22. Escudier B, Bellmunt J, Négrier S et al. Phase III trial of bevacizumab plus interferon alfa-2a in patients with metastatic renal cell carcinoma (AVOREN): final analysis of overal survival. J Clin Oncol 2010; 28 (13): 2144–2150. doi: 10.1200/JCO.2009.26.7849.
23. Rini BI, Halabi S, Rosenberg JE et al. Phase III trial of bevacizumab plus interferon alfa versus interferon alfa monotherapy in patients with metastatic renal cell carcinoma: final results of CALGB 90206. J Clin Oncol 2010; 28 (13): 2137–2143. doi: 10.1200/JCO.2009.26.5561.
24. Motzer RJ, Hutson TE, Cella D et al. Pazopanib versus sunitinib in metastatic renal-cell carcinoma. N Engl J Med 2013; 369 : 722–731. doi: 10.1056/NEJMoa1303989.
25. Motzer RJ, Hutson TE, McCann L et al. Overall survival in renal-cell carcinoma with pazopanib versus sunitinib. N Engl J Med 2014; 370 (18): 1769–1770. doi: 10.1056/NEJMc1400731.
26. Escudier B, Porta C, Bono P et al. Randomized, controlled, double-blind, cross-over trial assessing treatment preference for pazopanib versus sunitinib in patients with metastatic renal cell carcinoma: PISCES Study. J Clin Oncol 2014; 32 (14): 1412–1418. doi: 10.1200/JCO.2013.50.8267.
27. Najjar YG, Mittal K, Elson P et al. A 2 weeks on and 1 week off schedule of sunitinib is associated with decreased toxicity in metastatic renal cell carcinoma. Eur J Cancer 2014; 50 (6): 1084–1089. doi: 10.1016/j.ejca.2014.01.025.
28. Atkinson BJ, Kalra S, Wang X et al. Clinical outcomes for patients with metastatic renal cell carcinoma treated with alternative sunitinib schedules. J Urol 2014; 191 (3): 611–618. doi: 10.1016/j.juro.2013.08.090.
29. Bracarda S, Iacovelli R, Boni L et al. Sunitinib administered on 2/1 schedule in patients with metastatic renal cell carcinoma: the RAINBOW analysis. Ann Oncol 2015; 26 (10): 2107–2113. doi: 10.1093/annonc/mdv315.
30. Lee JL, Kim MK, Park I et al. Randomized phase II trial of sunitinib four weeks on and two weeks off versus two weeks on and one week off in metastatic clear-cell type renal cell carcinoma: RESTORE trial. Ann Oncol 2015; 26 (11): 2300–2305. doi: 10.1093/annonc/mdv357.
31. Hudes G, Carducci M, Tomczak P et al. Temsirolimus, interferon alfa, or both for advanced renal-cell carcinoma. N Engl J Med 2007; 356 (22): 2271–2281. doi: 10.1056/NEJMoa066838.
32. Choueiri TK, Halabi S, Sanford BL et al. Cabozantinib versus sunitinib as initial targeted therapy for patients with metastatic renal cell carcinoma of poor or intermediate risk: The alliance A031203 CABOSUN trial. J Clin Oncol 2017; 35 (6): 591–597. doi: 10.1200/JCO.2016.70.7398.
33. Motzer RJ, Escudier B, Oudard S et al. Efficacy of everolimus in advanced renal cell carcinoma: a double-blind, randomised, placebo-controlled phase III trial. Lancet 2008; 372 (9637): 449–456. doi: 10.1016/S0140-6736 (08) 61039-9.
34. Escudier B, Eisen T, Stadler WM et al. Sorafenib for treatment of renal cell carcinoma: final efficacy and safety results of the phase III treatment approaches in renal cancer evaluation trial. J Clin Oncol 2009; 27 (20): 3312–3318. doi: 10.1200/JCO.2008.19.5511.
35. Rini BI, Escudier B, Tomczak P et al. Comparative effectiveness of axitinib versus sorafenib in advanced renal cell carcinoma (AXIS): a randomised phase 3 trial. Lancet 2011; 378 (9807): 1931–1939. doi: 10.1016/S0140-6736 (11) 61613-9.
36. Motzer RJ, Escudier B, Tomczak P et al. Axitinib versus sorafenib as second-line treatment for advanced renal cell carcinoma: overall survival analysis and updated results from a randomised phase 3 trial. Lancet Oncol 2013; 14 (6): 552–562. doi: 10.1016/S1470-2045 (13) 700 93-7.
37. Choueiri TK, Escudier B, Powles T et al. Cabozantinib versus everolimus in advanced renal-cell carcinoma. N Engl J Med 2015; 373 (19): 1814–1823. doi: 10.1056/NEJMoa1510016.
38. Choueiri TK, Escudier B, Powles T et al. Cabozantinib versus everolimus in advanced renal cell carcinoma (METEOR): final results from a randomized, open-label, phase 3 trial. Lancet Oncol 2016; 17 (7): 917–927. doi: 10.1016/S1470-2045 (16) 30107-3.
39. Motzer RJ, Escudier B, McDermott DF et al. Nivolumab versus everolimus in advanced renal-cell carcinoma. N Engl J Med 2015; 373 (19): 1903–1813. doi: 10.1056/NEJMoa1510665.
40. Hutson TE, Escudier B, Esteban E et al. Randomized Phase III Trial of temsirolimus versus sorafenib as second-line therapy after sunitinib in patients with metastatic renal cell carcinoma. J Clin Oncol 2014; 32 (8): 760–767. doi: 10.1200/JCO.2013.50.3961.
41. Hu-Lowe DD, Zou HY, Grazzini ML et al. Nonclinical antiangiogenesis and antitumor activities of axitinib (AG-013736), an oral, potent, and selective inhibitor of vascular endothelial growth factor receptor tyrosine kinases 1, 2, 3. Clin Cancer Res 2008; 14 (22): 7272–7283. doi: 10.1158/1078-0432.CCR-08-0652.
42. Zhou L, Liu XD, Sun M et al. Targeting MET and AXL overcomes resistence to sunitinib therapy in renal cell carcinoma. Oncogene 2016; 35 (21): 2687–2697. doi: 10.1038/onc.2015.343.
43. The Cancer Genome Atlas Research Network. Comprehensive molecular characterisation of papilary renal-cell carcinoma. N Engl J Med 2016; 374 (2): 135–145. doi: 10.1056/NEJMoa1505917.
44. National Comprehensive Cancer Network. NCCN clinical practice guidelines in oncology: kidney cancer, version 2. 2018. [online]. Available from: https: //www.nccn.org/professionals/physician_gls/default.aspx¨.
45. Armstrong AJ, Halabi S, Eisen T et al. Everolimus versus sunitinib for patients with metastatic non-clear cell renal carcinoma (ASPEN): a multicentre, open-label, randomised phase 2 trial. Lancet Oncol 2016; 17 (3): 378–388. doi: 10.1016/S1470-2045 (15) 00515-X.
46. Motzer RJ, Barrios CH, Kim TM et al. Phase II randomized trial comparing sequential first-line everolimus and second-line sunitinib versus first line sunitinib and second-line everolimus in patients with metastatic renal cell carcinoma. J Clin Oncol 2014; 32 (25): 2765–2772. doi: 10.1200/JCO.2013.54.6911.
47. Tannir NM, Jonasch E, Albiges L et al. Everolimus versus sunitinib prospective evaluation in metastatic non-clear cell renal carcinoma (ESPN): a randomized multicenter phase 2 trial. Eur Urol 2016; 69 (5): 866–874. doi: 10.1016/j.eururo.2015.10.049.
48. Haas NB, Lin X, Manola J et al. A phase II trial of doxorubicin and gemcitabine in renal cell carcinoma with sarcomatoid features. ECOG 8802. Med Oncol 2012; 29 (2): 761–767. doi: 10.1007/s12032-011-9829-8.
49. Nanus DM, Garino A, Miowsky MI et al. Active chemotherapy for sarcomatoid and rapidly progressing renal cell carcinoma. Cancer 2004; 101 (7): 1545–1551. doi: 10.1002/cncr.20541.
50. Motzer RJ, Hutson TE, Glen H et al. Lenvatinib, everolimus, and the combination in patients with metastatic renal cell carcinoma: a randomised, phase 2, open-label, multicentre trial. Lancet Oncol 2015; 16 (15): 1473–1482. doi: 10.1016/S1470-2045 (15) 00290-9.
51. Escudier B. Tannir N, McDermott DF et al. CheckMate 214: Efficacy and safety of nivolumab + ipilimumab v sunitinib for treatment-naive advanced or metastatic renal cell carcinoma, including IMDC risk and PD-L1 expression subgroups. Ann Oncol 2017; 28 (Suppl 5): abstr. LBA5. doi: 10.1093/annonc/mdx440.029.
52. Amin A, Dudek AZ, Logan TF et al. Survival with AGS-003, an autologous dendritic cell-based immunotherapy, in combination with sunitinib in unfavorable risk patients with advanced renal cell carcinoma (RCC): phase 2 study results. J Immunother Cancer 2015; 3 : 14. doi: 10.1186/s40425-015-0055-3.
53. Cancer Genome Atlas Research Network Comprehensive molecular characterization of clear cell renal cell carcinoma. Nature 2013; 499 (7456): 43–49. doi: 10.1038/nature12222.
54. Hsieh J, Chen D, Wang P et al. Identification of efficacy biomarkers in a large metastatic renal cell carcinoma (mRCC) cohort through next generation sequencing (NGS): results from RECORD-3. J Clin Oncol 2015; 33 (Suppl 15): abstr. 4509. doi: 10.1200/jco.2015.33.15_suppl.4509.
55. Kwiatkowski DJ, Choueiri TK, Fay AP et al. Mutations in TSC1, TSC2 and mTOR are associated with response to rapalogs in patients with metastatic renal cell carcinoma. Clin Cancer Res 2016; 22 (10): 2445–2452. doi: 10.1158/ 1078-0432.CCR-15-2631.
56. Voss MH, Hakimi AA, Pham CG et al. Tumor genetic analyses of patients with metastatic renal cell carcinoma and extended benefit from mTOR inhibitor therapy. Clin Cancer Res 2014; 20 (7): 1955–1964. doi: 10.1158/1078-0432.CCR-13-2345.
57. Choueiri TK, Figueroa DJ, Fay AP et al. Correlation of PD-L1 tumor expression and treatment outcomes in patients with renal cell carcinoma receiving sunitinib or pazopanib: results from COMPARZ, a randomized controlled trial. Clin Cancer Res 2015; 21 : 1071–1077. doi: 10.1158/1078-0432.CCR-14-1993.
58. Poprach A, Lakomý R, Büchler T. Imunoterapie zhoubného nádoru ledviny. Klin Onkol 2017; 30 (Suppl 3): 3S55–3S61. doi: 10.14735/amko20173S55.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2018 Issue 2
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Lidský papilomavirus – role v karcinogenezi cervixu a možnosti jeho detekce
- Anogenitální HPV infekce jako potenciální rizikový faktor orofaryngeálního karcinomu
- Úvod do problematiky léčby zhoubných nádorů ledvin
- Nové možnosti testování chemosenzitivity u nádorových onemocnění
- Kvalita života pacientů s častými nádory dutiny ústní léčených pooperační brachyterapií s vysokým dávkovým příkonem pro těsné nebo pozitivní okraje
- Změny v signální dráze MAPK/ERK u pacientů s histiocytózou Langerhansových buněk
- Súčasné trendy prežívania pacientov s nádorom testis – Národná populačná štúdia
- Kožné a podkožné metastázy adenokarcinómu ako dominujúca klinická manifestácia malignity neznámeho pôvodu – opis prípadu
- Diagnostická, prognostická a prediktivní imunohistochemie při maligním melanomu kůže
- Dlouhé nekódující molekuly RNA jako regulátory mitogenem aktivované proteinkinázové dráhy (MAPK) v nádorech
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Kožné a podkožné metastázy adenokarcinómu ako dominujúca klinická manifestácia malignity neznámeho pôvodu – opis prípadu
- Změny v signální dráze MAPK/ERK u pacientů s histiocytózou Langerhansových buněk
- Dlouhé nekódující molekuly RNA jako regulátory mitogenem aktivované proteinkinázové dráhy (MAPK) v nádorech
- Lidský papilomavirus – role v karcinogenezi cervixu a možnosti jeho detekce
