Nanočásticemi modifikovaný apoferritinový nanotransportér pro cílený transport cytostatik
Nanoparticle-Modified Apoferritin Nanotransfer for Targeted Cytostatic Transport
Background: Ferritin is a globular intracellular protein that acts as the main reservoir for iron. Malignancies are associated with increased plasma ferritin concentrations. A number of studies show that tumor cells express high levels of transferrin receptors (TfR). Increased TfR expression was observed in prostate carcinoma. Apoferritin (APO) can be used as a protein nanotransporter into which a suitable medicinal substance can be encapsulated. Nanoparticles increase the permeability of tumor cells to nanotransporters and have a photothermal effect. The aim of this study was to encapsulate doxorubicin (DOX) into APO and to modify the resulting APO/DOX with gold (AuNPs) and silver nanoparticles prepared by green synthesis (AgNPsGS).
Methods: APO was characterized using 10% sodium dodecylsulphate polyacrylamide gel electrophoresis (SDS-PAGE) – 120 V, 60 min, 24 mM Tris, 0.2 M glycine, 3 mM SDS. DOX fluorescence (Ex 480 nm; Em 650 nm) was observed, with a typical absorption maximum at 560 nm. Electrochemical measurement was performed in Brdicka solution (three-electrode setup). AgNPsGS were prepared by green synthesis using clover (Trifolium pratense L.).
Results: An electrophoretic study of APO and APO/DOX (5–100 μg/mL) was performed and the behavior of APO and APO/DOX (10 μM) as a function of pH was monitored. In an acidic environment, APO forms subunits of about 20 kDa; in an alkaline medium, it forms a globular protein of about 450 kDa. A change in APO/DOX mobility (about by 10%) was observed. A film of gold nanoparticles was applied to the APO/DOX surface. APO/DOX-AuNPs were washed with ultra-pure water. pH-dependent release of DOX a was monitored. The amount of DOX analyzed was increased by up to 50%. Furthermore, an AgNPsGS-DOX complex (1 mg AgNPsGS/100 μM DOX) was generated and prepared. Subsequently, the AgNPsGS-DOX complex was encapsulated into APO. To further improve therapeutic efficacy, the APO/AgNPsGS-DOX complex was coated with an Au layer. APO/AgNPsGS-DOX/AuNPs were stable and DOX was released from the complex after physical parameters had changed.
Conclusion: APO nanocomplexes were prepared and modified to increase therapeutic efficacy against tumors. Tumor cell targeting was achieved by binding to TfR and via increased tumor cell permeability and retention. Release of the drug was made possible due to a pH change and photothermal activation that will now be tested.
This work was supported by COST European Cholangiocarcinoma Network CA18122 and International Collaboration Project of The European Technology Platform for Nanomedicine.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
Submitted: 21. 3. 2019
Accepted: 14. 5. 2019
Keywords:
apoferritin nanotransporter – transferin receptors – targeted therapy – prostate tumors – nanomedicine – silver nanoparticles – gold nanoparticles
Authors:
M. Čížek 1,2; M. Gargulák 1,2; K. Sehnal 1,2; D. Uhlířová 2; M. Staňková 2; M. Dočekalová 2; B. Ruttkay-Nedecký 1; J. Zídková 3; R. Kizek 1,2,4
Authors‘ workplace:
Ústav humánní farmakologie a toxikologie, Farmaceutická fakulta, Veterinární a farmaceutická univerzita Brno
1; Oddělení výzkumu a vývoje, Prevention Medicals s. r. o., Studénka
2; Ústav bio chemie a mikrobio logie, Vysoká škola chemicko-technologická Praha
3; Department of Biomedical and Environmental Analyses, Wroclaw Medical University, Poland
4
Published in:
Klin Onkol 2019; 32(3): 197-200
Category:
Original Articles
doi:
https://doi.org/10.14735/amko2019197
Overview
Východiska: Ferritin je globulární vnitrobuněčný protein, který slouží jako hlavní zásobárna železa. U nádorových onemocnění je plazmatická koncentrace ferritinu zvýšená. V řadě studií bylo zjištěno, že nádorové buňky exprimují ve zvýšené míře transferinové receptory (TfR). Zvýšená exprese TfR byla pozorována i u karcinomu prostaty. Apoferritin (APO) lze využít jako proteinový nanotransportér, do kterého je možné enkapsulovat vhodnou léčivou látku. Bylo zjištěno, že nanočástice zvyšují prostupnost nanotransportérů do nádorové buňky a vykazují fototermální efekt. Cílem projektu bylo enkapsulovat doxorubicin (DOX) do APO a vytvořený APO/DOX modifikovat zlatými (gold nanoparticles – AuNPs) a stříbrnými (silver nanoparticles prepared by green synthesis – AgNPsGS) nanočásticemi.
Metody: Pro charakterizaci APO byla použita 10% gelová elektroforéza (sodium dodecylsulphate polyacrylamide gel electrophoresis – SDS-PAGE) – 120 V, 60 min, 24 mM Tris, 0,2 M glycin, 3 mM SDS. Fluorescence DOX (Ex 480 nm, Em 650 nm) s typickým absorpčním maximem v 560 nm. Elektrochemické měření bylo provedeno v Brdičkově roztoku (tříelektrodové zapojení). AgNPsGS byly připraveny zelenou syntézou z jetele lučního (Trifolium pratense L.).
Výsledky: Byla provedena elektroforetická studie APO a APO/DOX (5–100 μg/ml). Bylo sledováno chování APO a APO/DOX (10 μM) v závislosti na pH. APO v kyselém prostředí tvoří subjednotky o velikosti asi 20 kDa a v neutrálním a zásaditém prostředí se zformuje na globulární protein o velikosti asi 450 kDa. U APO/DOX byla pozorována změna mobility (asi o 10 %). Na povrchu APO/DOX byl vytvořen film z AuNPs. APO/DOX/AuNPs byl následně promyt ultračistou vodou. Bylo sledováno uvolnění DOX v závislosti na pH. Množství analyzovaného DOX se zvýšilo až o 50 %. Dále byl navržen a připraven komplex AgNPsGS-DOX (1 mg AgNPsGS/100 μM DOX). Takto připravený komplex AgNPsGS-DOX byl uzavřen do APO. Pro další zlepšení terapeutické účinnosti byl připravený komplex APO/AgNPsGS-DOX pokryt vrstvou AuNPs. Vytvořený APO/AgNPsGS-DOX/AuNPs prokázal svoji stabilitu a při změně fyzikálních parametrů byl z komplexu uvolněn DOX.
Závěr: Byly připraveny a modifikovány nanokomplexy APO pro zvýšení terapeutické účinnosti protinádorové léčby. Zacílení k nádorové buňce bylo na TfR nebo efektem zvýšené propustnosti a retence. Uvolnění léčiva bylo možné změnou pH nebo fototermální aktivací, která bude nyní testována.
Klíčová slova:
apoferritinový nanotransportér – transferinové receptory – cílená terapie – nádory prostaty – nanomedicína – stříbrné nanočástice – zlaté nanočástice
Úvod
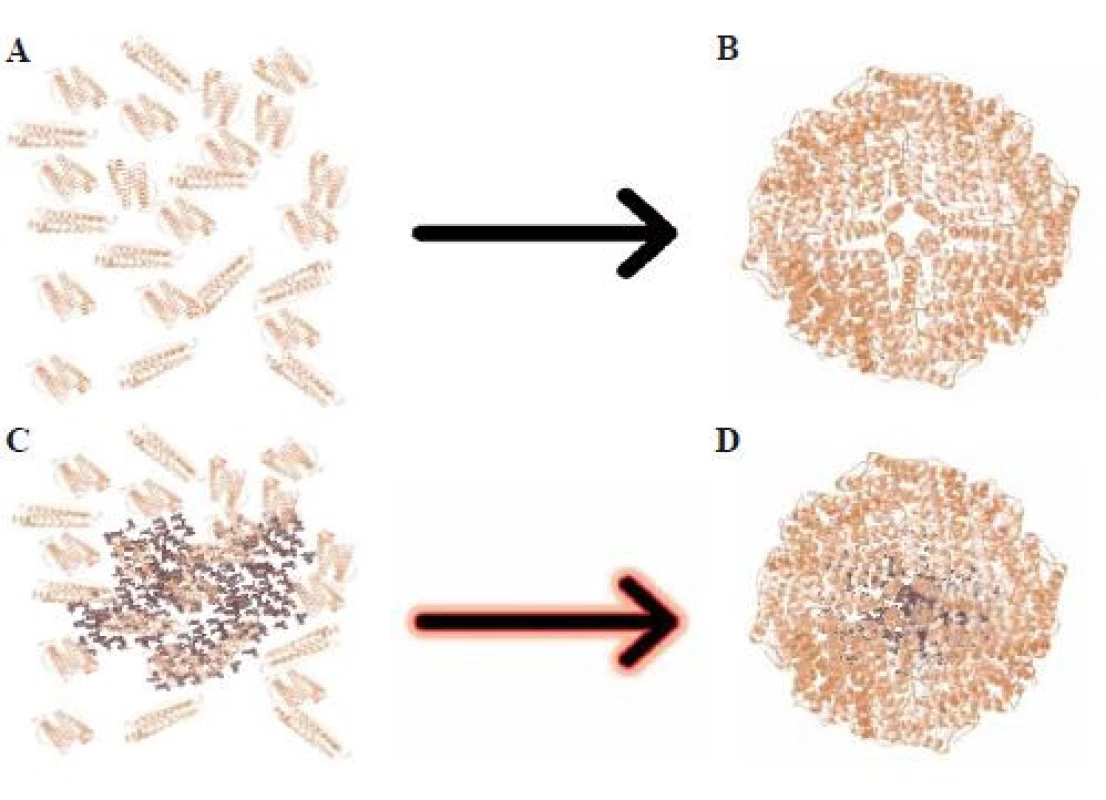
Ferritin je globulární protein, který tvoří dutinu pro fyziologické a bezpečné uchovávání železa v organizmu. V buňkách ho lze využít jako proteinový tělu vlastní nanotransportér, do kterého je možné enkapsulovat místo železa vhodné terapeutikum [1–3]. Apoferritin (APO) – tedy ferritin, jehož dutina je prázdná – v závislosti na pH mění svoji strukturu, při nízkém pH se otevírá a rozpadá na jednotlivé podjednotky, při vyšším pH se samoorganizuje (obr. 1) [2,4,5]. S výhodou je tak možné použití APO jako nanotransportéru u buněk karcinomu prostaty. Nejen u těchto nádorových buněk je známá a potvrzená výrazně zvýšená exprese transferinových receptorů (TfR) oproti buňkám nenádorovým [4,6,7]. Vedle aktivního cílení na TfR (obr. 2) umožňuje modifikovaný apoferritinový nanotransportér vzhledem ke své velikosti využití i pasivního cílení díky tzv. efektu zvýšené propustnosti a retence (enhanced permeability and retention effect – EPR efekt). Tento efekt obecně popisuje jev, kdy nádorová tkáň umožňuje snadnější prostup makromolekulárních látek a zároveň jich významně více zadržuje [8,9]. Díky těmto faktům se APO stává ideálním nanotransportérem pro možnou cílenou terapii karcinomu prostaty.
A. Apoferritin rozdělený na podjednotky v kyselém pH (pH = 2±0,1).
B. Apoferritin složený na globulární protein v zásaditém pH (pH = 8±0,1).
C. Apoferritin rozdělený na podjednotky s doxorubicinem v kyselém pH (pH = 2±0,1).
D. Doxorubicin enkapsulovaný v apoferritinu v zásaditém pH (pH = 8±0,1).
APO – apoferritin, AgNPsGS – stříbrné nanočástice
připravené zelenou syntézou,
DOX – doxorubicin, AuNPs – zlaté nanočástice,
TfR – transferinové receptory

Stříbrné nanočástice připravené zelenou syntézou (silver nanoparticles prepared by green synthesis – AgNPsGS) vykazují protinádorový potenciál díky povrchové modifikaci biomolekulami z rostlinného extraktu. K zelené syntéze byl zvolen extrakt z jetele lučního (Trifolium pratense L.). Očekávaným benefitem bylo vytvoření povrchové vrstvy z obsahových látek, kterými jsou zejména flavonoidy a isoflavonoidy. Mezi takové látky řadíme genistein, který je znám pro svůj účinek jako inhibitor angiogeneze [10].
Modifikace enkapsulovaného léčiva by měla synergicky potencovat účinek samotného protinádorového léčiva, a navíc rozšířit možnosti mechanizmů účinku pro co nejúčinnější a nejcílenější cytotoxický efekt u nádorových buněk karcinomu prostaty [11].
Vedle enkapsulace vhodné léčivé látky do „apoferritinové klece“ bylo dalším cílem provést modifikaci takovéto klece pomocí zlatých nanočástic (gold nanoparticles – AuNPs). Díky modifikaci zlatými nanočásticemi je možné získat nanokomplex s léčivem, který lépe reaguje na vnější fototermální stimul, a navíc AuNPs pozitivně ovlivňují prostoupení komplexu do nádorové buňky [12].
Mechanizmus účinku celého plně modifikovaného apoferritinového nanokonstruktu je mnohaúrovňový. Spočívá v účincích, které můžeme rozdělit na účinky zvoleného protinádorového terapeutika, které je enkapsulováno v APO, účinky AgNPsGS a případnou synergii těchto účinků. Vedle toho nesmíme opomenout působení přírodních látek, které se při zelené syntéze navážou a vytvoří obal AgNPsGS. AgNPsGS mají ověřený cytotoxický účinek [11,13]. Je potvrzeno, že AgNPs se na buněčné úrovni hromadí v mitochondriích a buněčném jádře [11]. Za hlavní cytotoxický mechanizmus je považována tvorba reaktivních forem kyslíku (reactive oxygen species – ROS), narušení buněčného dýchacího řetězce, indukce mitochondriálních apoptotických mechanizmů a poškození DNA buněk [11,13,14]. Jako cytotoxické terapeutikum byl zvolen doxorubicin (DOX), který je účinným a užívaným cytotoxickým léčivem [15].
Materiál a metody
Příprava apoferritinového konstruktu a následná enkapsulace DOX byla provedena obměnou přístupů Ruozi et al [16] a Li et al [12]. K zelené syntéze AgNPsGS byl použit Trifolium pratense L. Rostlina byla sušena (24 hod, 60 °C) a homogenizována mletím na částice o přibližné velikosti 1–2 mm. Směs byla míchána ve vodě (60 min, 80 °C). K připravenému extraktu byl přidán 0,1 M AgNO3 (1 : 1) a vše bylo mícháno (24 hod). Vzniklý roztok AgNPsGS byl vysrážen metanolem a vysušen. Pro základní charakterizační analýzu byla použita metoda gelové elektroforézy (sodium dodecylsulphate polyacrylamide gel electrophoresis – SDS-PAGE) ve vertikálním systému Shirogel (VWR, ČR). Pro separaci byly použity 10% polyakrylamidové gely. Podmínky pro elektroforézu byly 120 V, 1 hod v pufru (24 mM Tris, 0,2 M glycin, 3 mM SDS). Po dokončení elektroforézy byl gel obarven pomocí stříbra. Pro důkaz enkapsulace a úspěšného otevírání a zavírání „apoferritinové klece“ s ohledem na pH prostředí byla použita metoda měření fluorescence DOX. Do mikrotitrační destičky bylo napipetováno 100 µl vzorku s koncentrací 10 μM DOX. Byla měřena fluorescence DOX s typickým emisním maximem při 650 nm. Elektrochemická měření byla provedena pomocí analyzátoru AUTOLAB Analyzer připojeného k VA-Stand 663 (Metrohm, Švýcarsko) za použití standardního uspořádání se třemi elektrodami. Byl použit Brdičkův podpůrný elektrolyt obsahující 1 mM [Co (NH3) 6]Cl3 a 1 M amoniakální pufr.
Výsledky
Celý konstrukt byl úspěšně připraven i povrchově modifikován pomocí AuNPs. Rovněž byl úspěšně enkapsulován DOX, který byl modifikován pomocí předem připravených AgNPsGS. Jako důkaz, že samotný nanotransportér byl plně funkční, byla provedena elektroforetická studie pomocí SDS-PAGE. Výsledkem elektroforézy bylo formování APO v závislosti na pH. Samotný APO v kyselém prostředí tvoří subjednotky o velikosti asi 20 kDa a v zásaditém prostředí se zformuje globulární protein o velikosti asi 450 kDa. Výsledkem byly charakteristické „pruhy“, které dokládaly chování APO v závislosti na acidobazických podmínkách prostředí. Stejné chování bylo pozorováno i u APO s uzavřeným DOX, což potvrzuje funkčnost základního konceptu nanotransportéru.
Pro ověření úspěšnosti enkapsulace a mechanizmu otevírání konstruktu byla zvolena metoda fluorescenční analýzy, ve které bylo využito výrazných fluorescenčních vlastností DOX. Otevírání a zavírání „apoferritinové klece“ v závislosti na acidobazických podmínkách bylo znovu potvrzeno. Touto analýzou spolu s metodou kalibrační křivky bylo zjištěno, že úspěšnost enkapsulace DOX do APO se pohybovala okolo 14 % aplikované koncentrace. Výsledkem elektrochemické studie bylo potvrzení úspěšnosti povrchové modifikace APO pomocí AuNPs.
Závěr
Úspěšně byl připraven (obr. 3) a charakterizován apoferritinový nanotransportér, do jehož dutiny bylo enkapsulováno vhodné modelové terapeutikum pro cílený transport do nádorových buněk karcinomu prostaty. Charakterizace konceptu byla provedena elektroforetickou a elektrochemickou studií, funkčnost byla ověřena fluorescenčně. Nyní je testována fototermická aktivace. Povrch „apoferritinové klece“ byl modifikován AuNPs a enkapsulovaný DOX byl modifikován pomocí AgNPsGS, čímž vznikl komplexní nanotransportér APO/AgNPsGS-DOX/AuNPs. Modifikace povrchu APO i cytostatika pomocí nanočástic je možné kombinovat a event. tak zajistit účinný a mnohostranný nanotechnologický nástroj pro cílenou terapii karcinomu prostaty.
1. Navázání AgNPsGS na cytostatikum DOX a vznik AgNPsGS-DOX.
2. Uzavření modifikovaného cytostatika AgNPsGS-DOX do APO v bazickém prostředí vzniká APO/AgNPsGS-DOX.
3. Navázání zlatých nanočástic AuNPs na APO/AgNPsGS-DOX vytvoření finálního nanokonstruktu APO/AgNPsGS-DOX/AuNPs.
Popis jednotlivých částí: A. stříbrné nanočástice připravené zelenou syntézou; B. cytostatikum doxorubicin; C. apoferritin v kyselém prostředí
(pH = 2±0,1) rozdělený na podjednotky; D. modifikovaný doxorubicin stříbrnými nanočásticemi připravenými zelenou syntézou
(AgNPsGS-DOX); E. modifikované cytostatikum (AgNPsGS-DOX) uzavřené do apoferritinu v bazickém prostředí (APO/AgNPsGS-DOX);
F. zlaté nanočástice (AuNPs); G. modifikovaný apoferritinový nanokonstrukt (APO/AgNPsGS-DOX/AuNPs).
APO – apoferritin, AgNPsGS – stříbrné nanočástice připravené zelenou syntézou, DOX – doxorubicin, AuNPs – zlaté nanočástice

Práce je realizována v rámci COST European Cholangiocarcinoma Network CA18122 and International Collaboration Project of The European Technology Platform for Nanomedicine.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Obdrženo: 21. 3. 2019
Přijato: 14. 5. 2019
prof. Ing. René Kizek, DrSc.
Ústav humánní farmakologie a toxikologie
Farmaceutická fakulta
Veterinární a farmaceutická
univerzita Brno
Palackého třída 1/1946
612 42 Brno
e-mail: kizek@sci.muni.cz
Sources
1. Kawabata H. Transferrin and transferrin receptors update. Free Radic Biol Med 2019; 133 : 46–54. doi: 10.1016/j.freeradbiomed.2018.06.037.
2. Heger Z, Skalickova S, Zitka O et al. Apoferritin applications in nanomedicine. Nanomedicine 2014; 9 (14): 2233–2245. doi: 10.2217/nnm.14.119.
3. Heger Z, Eckschlager T, Stiborová M et al. Modern nanomedicine in treatment of lung carcinomas. Klin Onkol 2015; 28 (4): 245–250. doi: 10.14735/amko2015245.
4. Liang M, Fan K, Zhou M et al. H-ferritin-nanocaged doxorubicin nanoparticles specifically target and kill tumors with a single-dose injection. Proc Natl Acad Sci USA 2014; 111 (41): 14900–14905. doi: 10.1073/pnas.1407808 111.
5. Li AP, Yuchi QX, Zhang LB. Ferritin: a powerful platform for nanozymes. Prog Biochem Biophys 2018; 45 (2): 193–203.
6. Keer HN, Kozlowski JM, Tsai YC et al. Elevated transferrin receptor content in human prostate cancer cell lines assessed in vitro and in vivo. J Urol 1990; 143 (2): 381–385.
7. Niitsu Y, Kohgo Y, Nishisato T et al. Transferrin receptors in human cancerous tissues. Tohoku J Exp Med 1987; 153 (3): 239–243.
8. Maeda H, Wu J, Sawa T et al. Tumor vascular permeability and the EPR effect in macromolecular therapeutics: a review. J Control Release 2000; 65 (1–2): 271–284.
9. Fang J, Nakamura H, Maeda H. The EPR effect: Unique features of tumor blood vessels for drug delivery, factors involved, and limitations and augmentation of the effect. Adv Drug Deliv Rev 2011; 63 (3): 136–151. doi: 10.1016/j.addr.2010.04.009.
10. Krenn L, Paper DH. Inhibition of angiogenesis and inflammation by an extract of red clover (Trifolium pratense L.). Phytomedicine 2009; 16 (12): 1083–1088. doi: 10.1016/j.phymed.2009.05.017.
11. AshaRani PV, Low Kah Mun G, Hande MP et al. Cyto-toxicity and genotoxicity of silver nanoparticles in human cells. ACS nano 2009; 3 (2): 279–290. doi: 10.1021/nn800596w.
12. Li M, Wu D, Chen Y et al. Apoferritin nanocages with Au nanoshell coating as drug carrier for multistimuli-responsive drug release. Mater Sci Eng C Mater Biol Appl 2019; 95 : 11–18. doi: 10.1016/j.msec.2018.10.060.
13. Sukirtha R, Priyanka KM, Antony JJ et al. Cytotoxic effect of Green synthesized silver nanoparticles using Melia azedarach against in vitro HeLa cell lines and lymphoma mice model. Process Biochem 2012; 47 (2): 273–279.
14. Piao MJ, Kang KA, Lee IK et al. Silver nanoparticles induce oxidative cell damage in human liver cells through inhibition of reduced glutathione and induction of mitochondria-involved apoptosis. Toxicol Lett 2011; 201 (1): 92–100. doi: 10.1016/j.toxlet.2010.12.010.
15. Švihovec J, Bultas J, Anzenbacher P et al. Farmakologie. 1. vyd. Praha: Grada Publishing 2018 : 636–637.
16. Ruozi B, Veratti P, Vandelli MA et al. Apoferritin nanocage as streptomycin drug reservoir: Technological optimization of a new drug delivery system. Int J Pharm 2017; 518 (1–2): 281–288. doi: 10.1016/j.ijpharm.2016.12.038.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2019 Issue 3
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Safety and Tolerance of Metamizole in Postoperative Analgesia in Children
-
All articles in this issue
- MikroRNA v mozkomíšním moku jako biomarkery u pacientů s nádory mozku
- Sledování prognózy HPV pozitivních a negativních orofaryngeálních karcinomů v závislosti na léčebné modalitě
- Nanočásticemi modifikovaný apoferritinový nanotransportér pro cílený transport cytostatik
- Prevalence symptomů úzkosti a deprese a jejich vliv na kvalitu života u pacientů v paliativní onkologické léčbě – projekt PALINT
- Rhabdomyosarkom gluteus maximus – kazuistika, přehled literatury a terapeutické cíle
- Neoadjuvantní užití hypertermické izolované perfuze končetiny v léčbě nediferencovaného vřetenobuněčného sarkomu dolní končetiny s dosažením kompletní patologické odpovědi
- Primární intrakraniální sarkomy, myxoidní meningeální sarkom – kazuistika a přehled literatury
- Osamelosť pacientov v predterminálnom a terminálnom štádiu nádorovej choroby, sociálny rozmer zomierania
- Současný FIGO staging karcinomu děložního hrdla a léčba jednotlivých stadií
- Asociace TNF-α -308G>A polymorfizmu s citlivostí na karcinom děložního čípku a prsu – systematický přehled a metaanalýza
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Současný FIGO staging karcinomu děložního hrdla a léčba jednotlivých stadií
- Rhabdomyosarkom gluteus maximus – kazuistika, přehled literatury a terapeutické cíle
- Prevalence symptomů úzkosti a deprese a jejich vliv na kvalitu života u pacientů v paliativní onkologické léčbě – projekt PALINT
- Osamelosť pacientov v predterminálnom a terminálnom štádiu nádorovej choroby, sociálny rozmer zomierania
