Hematologická toxicita u IMRT/VMAT v kurativní léčbě análního karcinomu
Haematotoxicity in IMRT/VMAT curatively treated anal cancer
Introduction: Curative chemoradiotherapy of squamous cell carcinoma achieves long-term complete remissions in most patients and minimizing treatment toxicity becomes crucial issue. The aim of the retrospective analysis was to determine an acceptable dose to the bone marrow for radiotherapy planning not leading to increased haematological toxicity. Patients and methods: In the period 2013–2019, 40 patients with squamous cell carcinoma were curatively treated at the Department of Oncology of the University Hospital Motol using intensity modulated radiotherapy (IMRT) /volumetric modulated arc radiotherapy (VMAT) technique. Women make up 90% of the group, the average age at the time of diagnosis was 65 years (47–81). Chemotherapy mitomycin C and 5-fluorouracil was given to 68% of patients. The bone marrow was contoured in the Varian Eclipse planning system, version 15.6.
Results: Acute hematotoxicity (G3, 4, 5 according to Common Terminology Criteria for Adverse Events – CTCAE) was significantly associated with the concomitant chemoradiotherapy (P = 0.002) and the average dose to the bone marrow ≥ 27 Gy (P = 0.011). Late haematological toxicity was mild (maximum grade 1), asymptomatic, and no dependence of late haematotoxicity on any risk factor (age, gender, WHO performance status, bone marrow dose, CHT, BMI, smoking, stage) was proved. The overall survival at 5 years was 100% in stage I, 83% in stage II, 61% in stage III and 0% in stage IV. Local control at 5 years is 100% in stage I, 92% in stage II, 87% in stage III and 0% in stage IV. Local recurrence developed in 5% of radically treated patients. Distant metastases occurred in 8% of radically treated patients. Local recurrences or metastases occurred only during the first 2 years after the treatment.
Conclusion: Radical chemoradiotherapy in the treatment of squamous cell anal carcinoma is highly effective. IMRT/VMAT enabled to apply a sufficiently effective dose to the tumor and elective areas and reduced not only acute skin, GI and GU toxicity, but also acute haematological toxicity in cases with the dose Dmean to bone marrow lower than 27 Gy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical, papers.
Keywords:
bone marrow – IMRT – VMAT – anal cancer – hematologic toxicity
Authors:
R. Lohynská 1,4; A. Nýdlová 2; T. Drbohlavová 2; E. Mazaná 1; M. Jirkovská 2
; T. Veselský 3; B. Malinová 2; H. Stankušová 2
Authors‘ workplace:
Onkologická klinika 1. LF UK a Thomayerova nemocnice, Praha
1; Onkologická klinika 2. LF UK a FN Motol, Praha
2; Oddělení lékařské fyziky, FN Motol, Praha
3; Ústav radiační onkologie, 1. LF UK a Nemocnice Na Bulovce
4
Published in:
Klin Onkol 2020; 33(4): 288-294
Category:
Original Articles
doi:
https://doi.org/10.14735/amko2020286
Overview
Úvod: Kurativní chemoradioterapie dlaždicobuněčného análního karcinomu dosáhne u většiny pacientů dlouhodobé kompletní remise a do popředí vstupuje minimalizace toxicity léčby. Cílem retrospektivní analýzy bylo ověřit přijatelnou dávku na kostní dřeň pro plánování radioterapie, která nevede ke zvýšené hematologické toxicitě. Soubor pacientů a metodika: V letech 2013–2019 bylo na Onkologické klinice FN Motol kurativně léčeno technikou radioterapie s modulovanou intenzitou (intensity modulated radiotherapy – IMRT) /objemově modulovanou radioterapií kyvem (volumetric modulated arc therapy – VMAT) 40 pacientů se spinocelulárním análním karcinomem. Ženy tvoří 90 % souboru, průměrný věk v době diagnózy je 65 let (47–81 let). Chemoterapie s mitomycinem C a 5-fluorouracilem byla podána u 68 % pacientů. Kostní dřeň byla konturována v plánovacím systému Varian Eclipse, verze 15.6.
Výsledky: Akutní hematotoxicita (grade III, IV, V dle Obecných terminologických kritérií nežádoucích účinků (Common Terminology Criteria for Adverse Events – CTCAE)) byla asociována s aplikací konkomitantní chemoradioterapie (p = 0,002) a s aplikovanou průměrnou dávkou na kostní dřeň ≥ 27 Gy (p = 0,011). Pozdní hematologická toxicita byla mírná (maximálně grade I), asymptomatická a v souboru nebyla patrná závislost pozdní hematotoxicity na žádném rizikovém faktoru (věk, pohlaví, WHO performance status, dávka na kostní dřeň, chemoterapie, BMI, kouření, stadium). Celkové přežití v 5 letech od léčby u klinického stadia (KS) I 100 %, u KS II 83 %, u KS III 61 % a u KS IV 0 %. Lokální kontrola v 5 letech je u KS I 100 %, u KS II 92 %, u KS III 87 % a u KS IV 0 %. U 5 % radikálně léčených pacientů došlo k rozvoji lokální recidivy. U 8 % radikálně léčených pacientů došlo ke vzniku vzdálených metastáz. Lokální recidiva či metastázy se vyskytly během prvních 2 let od léčby.
Závěr: Radikální chemoradioterapie v léčbě spinocelulárního karcinomu anu má vysokou účinnost. IMRT/VMAT umožnil aplikovat dostatečně účinnou dávku na nádor a elektivní oblasti a zároveň redukoval nejen akutní kožní, gastrointestinální a genitourinární toxicitu, ale i akutní toxicitu hematologickou při dodržení celkové aplikované dávky na kostní dřeň Dmean < 27 Gy.
Klíčová slova:
IMRT – VMAT – kostní dřeň – anální karcinom – hematologická toxicita
Úvod
Kurativní chemoradioterapie má v léčbě nemetastatického dlaždicobuněčného análního karcinomu zásadní význam
[1–8]. Většina pacientů (klinické stadium (KS) I–III) v současnosti po léčbě dosáhne kompletní remise a do popředí vstupuje zejména požadavek na minimalizaci toxicity léčby. S implementací moderních zobrazovacích metod (pozitronová emisní tomografie/výpočetní tomografie) do diagnostického a léčebného algoritmu je možné precizně stanovit rozsah onemocnění a cílit aplikaci dostatečně vysokých dávek [9–16] pomocí moderních technik fotonové radioterapie (radioterapie s modulovanou intenzitou – intensity modulated radiotherapy (IMRT) a objemově modulovanou radioterapii kyvem – volumetric modulated arc therapy (VMAT)) s významnou redukcí akutní a pozdní toxicity (obr. 1, 2). Přínos IMRT v redukci toxicity kožní a gastrointestinální, bez zhoršení lokální kontroly prokázala studie RTOG 0529 [18,19] oproti 3D konformní technice [20]. Menší výskyt akutní toxicity zároveň přináší nižší riziko přerušení v průběhu radioterapie, což dále zvyšuje úspěšnost léčby. Při radioterapii pánve může dojít v závislosti na velikosti ozářeného objemu a aplikované dávce k projevům akutní a pozdní hematologické toxicity. Kostní dřeň se dělí na červenou (retikulární vazivo s krvetvornou tkání), žlutou (postupně vzniká přeměnou z dřeně červené a obsahuje tukové buňky) a šedou (vzniká po vymizení tukových buněk z dřeně a je typická pro pozdní věk) [21]. S narůstajícím věkem klesá kapacita hematopoézy. Kostní dřeň pánve zodpovídá přibližně za 40 % hematopoézy (kosti pánevní ve 25 %, sacrum 9 % a proximální femury 5 %), bederní páteř 16 %, hrudník s proximálními humery 37 % a lebka a krční páteř ze 7 % [22]. Denně kostní dřeň produkuje 1011–1012 krevních buněk [23]. Poškození funkce hematopoézy lze hodnotit dle periferního krevního obrazu s diferenciálním rozpočtem leukocytů na základě obecných terminologických kritérií nežádoucích účinků (Common Terminology Criteria for Adverse Events – CTCAE), pomocí průtokové cytometrie či pomocí zobrazovacích metod, které zviditelní obsah tuku či aktivitu dřeňových buněk: CT, magnetická rezonance (MR), jednofotonová emisní výpočetní tomografie (single photon emission computed tomography – SPECT) či PET. Doporučovaná průměrná dávka na celou kostní dřeň pro optimalizaci IMRT plánů při radioterapii pánve je 27 Gy, V10 < 85 %, V20 < 66 % a při užití PET je doporučen optimální limitní parametr 28,5 Gy (30 Gy akceptovatelných), V10 < 90 %, V20 < 75 % na aktivní kostní dřeň (SUV > průměr) [23,24]. Ozáření méně než 40 % z celé kostní dřeně nevede k významným klinickým projevům, které by vyžadovaly léčebnou intervenci [25]. Při radioterapii šetřící kostní dřeň (tzv. bone marrow-sparing radiotherapy) lze při IMRT u chemoradioterapie karcinomu hrdla děložního dosáhnout snížení leukopenie ≥ G3 z 27 % na 8 % [26].


Soubor pacientů a metodika
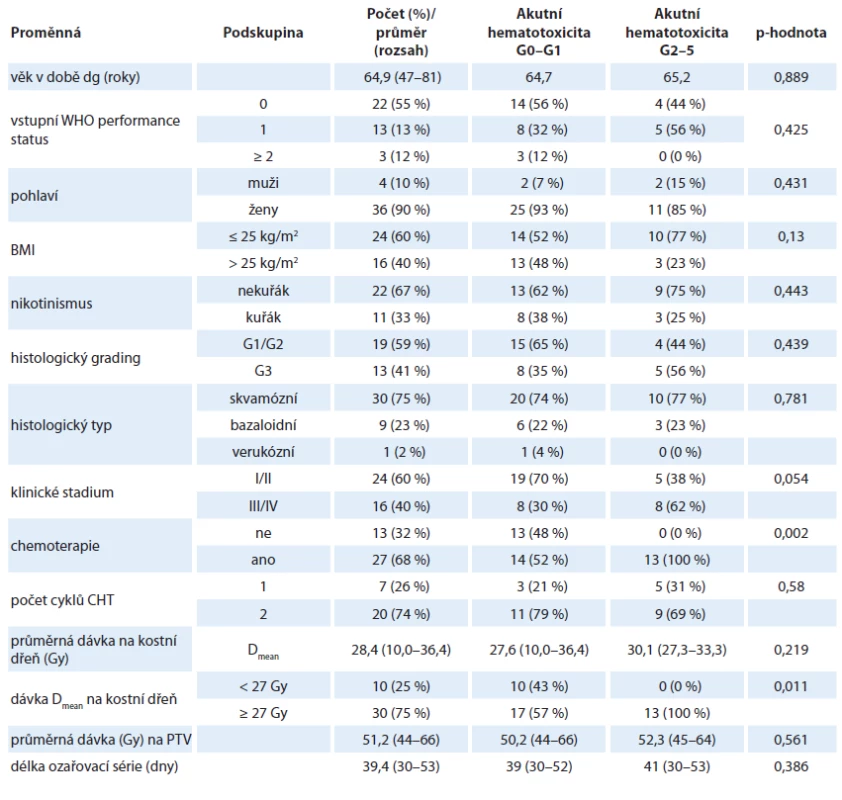
V letech 2013–2019 bylo na Onkologické klinice FN Motol kurativně léčeno technikou IMRT/VMAT 40 pacientů se spinocelulárním análním karcinomem (všichni byli p16 pozitivní a nebylo prováděno rutinní HIV testování). Stav pacientů byl hodnocen k 15. červenci 2019. Pacienti zařazení do hodnocení podepsali vstupně informovaný souhlas. Ženy tvoří 90 % souboru, průměrný věk v době diagnózy je 65 let (47–81). Charakteristika souboru pacientů je uvedena
v tab. 1.
Staging byl proveden pomocí fyzikálního vyšetření, endoskopických metod (anoskopie, rektoskopie, koloskopie) a u většiny pacientů pomocí PET s podáním fluorodeoxyglukózy – FDG-PET/CT. Všichni pacienti byli reklasifikováni dle 8. vydání TNM klasifikace (Union for International Cancer Control – UICC 2017).
U 68 % pacientů (většinou do 70 let, bez komorbidit) byla podána chemoterapie s mitomycinem C (10mg/m2 i.v. den 1 a 29) a 5-fluorouracilem (1 000 mg/m2 c.i.v. den 1–5). Plánovací CT bylo provedeno v supinační poloze. Definice objemu nádoru (gross tumor volume – GTV) byla provedena na základě klinického a endoskopického nálezu a dále byla usnadněna díky fúzi s diagnostickým PET/CT. Průměrná aplikovaná dávka ze zevní radioterapie byla 51,2 Gy (45–64 Gy). Dávky na uzlinové oblasti u cN0 onemocnění byly odstupňovány v rozmezí 30,6–45 Gy [27] v souladu s protokolem RTOG 9811 studie [1]. Určení uzlinového klinického cílového objemu (clinical target volume – CTV) bylo stanoveno dle australasijských doporučení AGITG [28]. U cN1 onemocnění byla na oblast postižených uzlin dle PET/CT s 5mm lemem aplikována dávka 50–60 Gy dle velikosti, lokalizace uzlin a blízkosti rizikových orgánů a na zbývající PET negativní uzlinové oblasti 45 Gy. Plánovací cílový objem (planned target volume – PTV) byl vytvořen přidáním 7 mm k CTV. Byla preferována technika simultánního integrovaného boostu a denní verifikace IGRT. U 55 % pacientů byl aplikován boost formou intersticiální brachyterapie při postižení méně než poloviny cirkumference análního kanálu u nádorů cT1–cT2 (2× 5 Gy v rozmezí 8 dní s odstupem 2 týdny od ukončení zevní radioterapie).
Při plánování zevní radioterapie byly užity následující dávkově limitní parametry pro optimalizaci: 98 % PTV obdrží ≥ 95 % předepsané dávky; „bowel bag“ byl konturován jako peritoneální kavita s parametry V45 Gy < 195 cm3
a V50 Gy < 50 cm3, močový měchýř s parametrem V50 Gy < 50 % [29] a hlavice femurů V50 < 5 %. Přijatelná dávka na zevní genitál byla stanovena Dmean < 30 Gy u žen a Dmean < 20 Gy u mužů [30].
Akutní hematologická toxicita byla hodnocena jako nejhorší nález v krevním obraze během chemoradioterapie (CHRT) / radioterapie (RT) do 6 týdnů po ukončení CHRT/RT (CTCAE verze 5.0). Kostní dřeň byla konturována zpětně u všech pacientů v plánovacím systému Varian Eclipse (verze 15.6) jako zevní okraj kompakty skeletu pánve distálně od L4/5 pod sedací hrboly vč. proximálních femurů (1 cm pod dolní okraj PTV). Při léčbě nebyla použita žádná optimalizace na kostní dřeň.
Pacienti po ukončení radioterapie byli sledováni týdně do odeznění akutní poradiační reakce a dále ve 3 a 6 měsících od ukončení radioterapie, kdy byla definitivně zhodnocena léčebná odpověď. Pozdní hematologická toxicita (CTCAE verze 5.0) byla hodnocena nejdříve 3 měsíce po ukončení RT. Při kompletní remisi bylo dále sledování prováděno v intervalu 3 měsíců první 2 roky a dále do 5 let od léčby po 6 měsících a později jednou ročně.
Statistická analýza
Byla analyzována závislost akutní a pozdní hematotoxicity na dávce a dalších faktorech, statistický rozdíl mezi skupinami byl kalkulován pomocí Pearson Chi-square testu pro kategorické proměnné (pohlaví, celkový stav dle WHO, CHT, nikotinismus, stadium, histologické parametry) a pomocí Studentova T-testu pro kontinuální proměnné (věk, BMI, dávka). Cílem hodnocení byla lokální kontrola (local control – LC), přežití bez nemoci (disease free survival – DFS), celkové přežití (overal survival – OS) a interval bez kolostomie (colostomy free interval – CFI) a vztah k různým proměnným (graf 1–3). Lokální kontrola byla definována jako doba od radioterapie do posledního kontrolního vyšetření (u pacientů v remisi) nebo do doby diagnózy lokální recidivy. Přežití bez nemoci bylo definováno jako čas od radioterapie do posledního kontrolního vyšetření u pacientů v remisi nebo do doby diagnózy lokální recidivy či vzdáleného relapsu nebo do smrti. OS bylo definováno jako doba od zahájení RT do poslední kontroly nebo do úmrtí z jakékoli
příčiny.



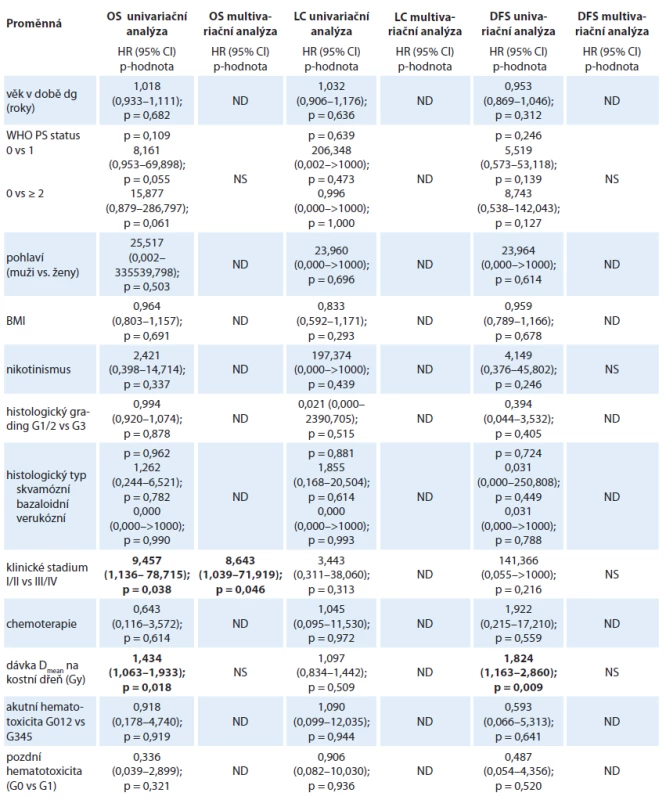
Data byla analyzována statistickým softwarem SPSS verze 19.0, p-hodnoty menší než 0,05 byly považovány za statisticky signifikantní. Univariační analýza přežití byla provedena pomocí Kaplan-Meierovy metody a k hodnocení rozdílů mezi skupinami byl použit log-rank test. Byla provedena univariační a multivariační Coxova regresní analýza rizikových faktorů se stanovením HR a konfidenčních 95% intervalů (tab. 2).
Výsledky
Medián sledování pacientů je 23 měsíců (od zahájení radioterapie do poslední kontroly nebo úmrtí pacienta). OS v 1, 2 a 5 letech bylo 92, 84 a 74 %, průměrné očekávané přežití 55 měsíců (medián nedosažen).
Lokální kontrola v 1, 2 a 5 letech byla 95, 92 a 92 %, průměrná LC 63 měsíců (medián nedosažen). U celkem 3 (7,5 %) pacientů došlo k rozvoji lokální recidivy a u 5 (12,5 %) došlo ke vzniku vzdálených metastáz. Lokální recidiva či metastázy se vyskytly v intervalu do 2 let od zahájení léčby.
Přežití bez nemoci bylo v 1, 2 a 5 letech 89, 86, 86 %, průměrná doba DFS byla 60 měsíců, medián DFS nedosažen.
Interval bez kolostomie (CFI) byl v 1 roce 98 %, ve 2 letech 91 % a v 5 letech 91 %, průměrná doba byla 63 měsíců (doba od radioterapie do poslední kontroly bez stomie nebo založení stomie), medián CFI nedosažen. Stomie byla jednou založena vstupně, jednou pro lokální recidivu a jednou pro pozdní účinky radioterapie.
Akutní hematotoxicita (leukopenie, trombocytopenie, anémie ≥ G3) se vyskytla celkem u 17 pacientů (43 %). Nejsilnější vliv na výskyt akutní hematologické toxicity má očekávaně konkomitantní chemoradioterapie s fluorouracilem a mitomycinem (p < 0,001). Konkomitantní chemoradioterapie byla podána v 68 % (z toho v 73 % byly podány oba cykly chemoterapie dle plánu, ve 12 % byla podána dvakrát redukovaná chemoterapie bez mitomycinu ve druhém cyklu a v 15 % byl podán pouze 1 cyklus chemoterapie). Akutní hematotoxicita (≥ G3) byla zaznamenána u 48 % pacientů s chemoradioterapií a u žádného pacienta se samostatnou radioterapií (graf 4). Stupeň pozdní hematologické toxicity byl mírný (maximálně G1) a nebyl na aplikaci konkomitantní chemoradioterapie závislý (35 % v obou skupinách).

Průměrná dávka aplikovaná na kostní dřeň byla 28,4 Gy. Statisticky významně nižší výskyt akutní hematologické toxicity byl při průměrné dávce do 27 Gy u 0 % pacientů vs. 43 % při dávce ≥ 27 Gy (p = 0,011) (graf 5). Pozdní hematologická toxicita v našem souboru je mírná (maximálně G1) a vyskytla se u 35 % pacientů v průběhu follow up. V souboru není patrná závislost pozdní hematotoxicity na žádném rizikovém faktoru (věk, pohlaví, dávka na kostní dřeň, CHT, BMI, kouření, stadium). Celkové přežití či lokální kontrola onemocnění nejsou výskytem akutní či pozdní hematologické toxicity ovlivněny.

Diskuze
Doporučení dávkově limitních parametrů na kostní dřeň jsou založena buď na průměrné dávce na pánevní skelet v oblasti ozáření, nebo na definici různých podobjemů (lumbosakrální oblast, ilická oblast a dolní oblast pánve [31,32], lopaty kostí kyčelních [33]). Zvolit vhodný (rychlý a reprodukovatelný) způsob konturace kostní dřeně bylo jedním z cílů našeho retrospektivního hodnocení. Stanovení přijatelné dávky pro optimalizaci v závislosti na klinickém zhodnocení akutní a pozdní hematologické toxicity bylo cílem druhým. Vyzkoušeli jsme dva způsoby konturace tohoto rizikového orgánu: vnitřní okraj kompakty (čistě kostní dřeň) a zevní okraj kompakty (celá kost). První způsob „free-hand“ konturování byl značně časově náročný (desítky minut) na rozdíl od druhého, obecně přijatého konturování zevního okraje skeletu od L5 po sedací hrboly vč. proximálních femurů, které je velmi rychlé (cca minuty), díky možnosti definovat „region of interest“ v úrovni PTV a následně využít autokonturingu pro kosti. Ve výsledku byl Dmean na kostní dřeň pro oba způsoby konturace stejný. To je zřejmým důvodem, proč tento způsob konturování kostní dřeně patří v publikacích k nejrozšířenějším [34,35]. Třetí způsob stanovení kontur je pomocí definice aktivní kostní dřeně PET/CT. Mnozí autoři přínos FDG-PET/CT jasně prokázali [36,37], jiní naopak dospěli k závěru, že hematopoetické buňky se nacházejí jak v oblasti aktivní na FDG-PET/CT, tak i mimo ni [38]. Přesnější pro definici aktivní kostní dřeně je použití PET s podání fluorotymidinu – FLT-PET/CT [23]. Ve studii
s FLT-PET/CT byl patrný vliv již 4 Gy na aktivitu kostní dřeně (50% pokles vychytávání FLT) a při dávce nad 35 Gy jsou tyto oblasti kostní dřeně suprimovány ještě 1 rok po léčbě [39].
Dle publikovaných dat je při chemoradioterapii (IMRT) s mitomycinem a fluorouracilem u análního karcinomu riziko hematologické toxicity ≥ G3 závislé na průměrné dávce, kterou obdržela kostní dřeň, při dávce < 22,5 Gy je riziko 5 %, při dávce < 25 Gy je riziko 10 %, při dávce 27,5 Gy je riziko 20 % a při dávce 31 Gy je riziko 40 % [35].
V našem souboru u pacientů s konkomitantní chemoradioterapií mitomycin C + 5-fluorouracil se akutní hematologická toxicita ≥ G3 vyskytla u 48 % pacientů (leukopenie 38 % a trombocytopenie 19 %). Hematologická toxicita ≥ G3 se vyskytla pouze u u pacientů s konkomitantní
chemoradioterapií.
Ve srovnání režimů mitomycinu s 5-fluorouracilem vs. cisplatina s 5-fluorouracilem ve studii RTOG 9811 s 3D radioterapií (převážně AP/PA pole) je patrný nižší výskyt hematologické toxicity u chemoterapie s cisplatinou 42 vs. 62 % u mitomycinu [1]. V retrospektivní studii s cisplatinou a 5-fluorouracilem byl výskyt závažné hematologické toxicity přítomen u 31 % [40].
V retrospektivní studii se 2 cykly chemoradioterapií mitomycin C a 5-fluorouracil s VMAT se vyskytla leukopenie u 36 % pacientů a trombocytopenie ≥ G3 u 13 % pacientů [41]. Při IMRT bez šetření kostní dřeně byl výskyt G4 hematologické toxicity u chemoradioterapie s mitomycinem C a 5-fluorouracilem 38 % [42]. V prospektivní studii srovnávající chemoterapii s mitomycinem C a kapecitabinem nebo fluorouracilem byl významně signifikantně nižší výskyt hematologické toxicity ≥ G3 ve skupině s kapecitabinem (4 vs. 27 %; p = 0,001) [43]. Jiná retrospektivní studie s mitomycinem C a kapecitabinem v konkomitantní chemoradioterapii (IMRT) srovnávala vliv na hematologickou toxicitu s mitomycinem C a 5-fluorouracilem a prokázala onkologickou non-inferioritu režimu s redukcí hematologické toxicity na více než polovinu u kapecitabinu. Hematotoxicita ≥ G3 byla snížena z 52 % u režimu mitomycin C + 5-fluorouracil na 20 % u režimu mitomycin C + kapecitabin [44]. Je tedy zřejmé, že při užití kapecitabinu bude možné se stejnými dávkově limitními parametry na kostní dřeň pro optimalizaci při plánování dosahovat výrazně nižší akutní hematologické toxicity.
Výsledky klinické proveditelnosti (tzv. feasibility) studie s protonovou radioterapií u análního spinocelulárního karcinomu přinesly 44% hematologickou toxicitu ≥ G3 [45], což je srovnatelné s publikovanými výsledky IMRT/VMAT technikami fotonové radioterapie.
Závěr
Radikální chemoradioterapie s využitím techniky IMRT/VMAT v léčbě spinocelulárního karcinomu anu má vysokou účinnost při příznivém profilu vedlejších účinků nejen kožních, gastrointestinálních i genitourinárních. IMRT/VMAT dále umožňují redukovat i toxicitu hematologickou. Nejjednodušší způsob konturace kostní dřeně jako rizikového orgánu na plánovacím CT je autokonturing pánevního skeletu v úrovni PTV (zevní kontura kompakty kosti). Redukce hematologické toxicity (≥ G3) lze dosáhnout reálně optimalizací dávky na celou kostní dřeň pánve za předpokladu dodržení průměrné dávky Dmean < 27 Gy během celé radikální chemoradioterapie. Hematologická toxicita je prokazatelně nižší při implementaci chemoterapeutických režimů s kapecitabinem [43,44]. Ověření redukce hematotoxicity při konturování pomocí atlasů aktivní kostní dřeně dle FDG-PET/CT [46] nebo pomocí FLT-PET/CT [23] bude potřebovat analýzu větších souborů pacientů.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Radka Lohynská, Ph.D.
Onkologická klinika
1. LF UK a Thomayerovy nemocnice
Vídeňská 800
140 59 Praha 4
e-mail: radka.lohynska@ftn.cz
Obdrženo/Submitted: 13. 5. 2020
Přijato/Accepted: 15. 6. 2020
Sources
1. Ajani JA, Winter KA, Gunderson LL et al. Fluorouracil, mitomycin, and radiotherapy vs fluorouracil, cisplatin, and radiotherapy for carcinoma of the anal canal: a randomized controlled trial. JAMA 2008; 299 (16): 1914–1921. doi: 10.1001/jama.299.16.1914.
2. James RD, Glynne-Jones R, Meadows HM et al. Mitomycin or cisplatin chemoradiation with or without maintenance chemotherapy for treatment of squamous-cell carcinoma of the anus (ACT II): a randomised, phase 3, open-label, 2 x 2 factorial trial. Lancet Oncol 2013; 14 (6): 516–524. doi: 10.1016/S1470-2045 (13) 70086-X.
3. Peiffert D, Tournier-Rangeard L, Gerard J-P et al. Induction chemotherapy and dose intensification of the radiation boost in locally advanced anal canal carcinoma: final analysis of the randomized UNICANCER ACCORD 03 trial. J Clin Oncol 2012; 30 (16): 1941–1948. doi: 10.1200/JCO.2011.35.4837.
4. Bartelink H, Roelofsen F, Eschwege F et al. Concomitant radiotherapy and chemotherapy is superior to radiotherapy alone in the treatment of locally advanced anal cancer: results of a phase III randomized trial of the European Organization for Research and Treatment of Cancer. J Clin Oncol 1997; 15 (5): 2040–2049. doi: 10.1200/JCO.1997.15.5.2040.
5. Flam M, John M, Pajak TF et al. Role of mitomycin in combination with fluorouracil and radiotherapy, and of salvage chemoradiation in the definitive nonsurgical treatment of epidermoid carcinoma of the anal canal: results of a phase III randomized intergroup study. J Clin Oncol 1996; 14 (9): 2527–2539. doi: 10.1200/JCO.1996.14.9.2527.
6. Benson AB, Venook AP, Al-Hawary MM et al. Anal Carcinoma, Version 2.2018, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw 2018; 16 (7): 852–871. doi: 10.6004/jnccn.2018.0060.
7. Glynne-Jones R, Tan D, Hughes R et al. Squamous-cell carcinoma of the anus: progress in radiotherapy treatment. Nat Rev Clin Oncol 2016; 13 (7): 447–459. doi: 10.1038/nrclinonc.2015.218.
8. Glynne-Jones R, Nilsson PJ, Aschele C et al. Anal cancer: ESMO-ESSO-ESTRO clinical practice guidelines for diagnosis, treatment and follow-up. Radiother Oncol 2014; 111 (3): 330–339. doi: 10.1016/j.ejso.2014.07.030.
9. Lohynska R, Mazana E, Novakova-Jiresova A et al. Improved survival in patients with FDG-PET/CT-based radiotherapy treatment planning for squamous cell anal cancer. Neoplasma 2020; [ahead of print]. doi: 10.4149/neo_2020_191229N1350.
10. Ciombor KK, Ernst RD, Brown G. Diagnosis and diagnostic imaging of anal canal cancer. Surg Oncol Clin N Am 2017; 26 (1): 45–55. doi: 10.1016/j.soc.2016.07.002.
11. Krengli M, Milia ME, Turri L et al. FDG-PET/CT imaging for staging and target volume delineation in conformal radiotherapy of anal carcinoma. Radiat Oncol 2010; 5 : 10. doi: 10.1186/1748-717X-5-10.
12. Cotter SE, Grigsby PW, Siegel BA et al. FDG-PET/CT in the evaluation of anal carcinoma. Int J Radiat Oncol Biol Phys 2006; 65 (3): 720–725. doi: 10.1016/j.ijrobp.2006.01.009.
13. Trautmann TG, Zuger JH. Positron emission tomography for pretreatment staging and posttreatment evaluation in cancer of the anal canal. Mol imaging Biol 2005; 7 (4): 309–313. doi: 10.1007/s11307-005-0003-6.
14. Winton E de, Heriot AG, Ng M et al. The impact of 18-fluorodeoxyglucose positron emission tomography on the staging, management and outcome of anal cancer. Br J Cancer 2009; 100 (5): 693–700. doi: 10.1038/sj.bjc.6604897.
15. Anderson C, Koshy M, Staley C et al. PET-CT fusion in radiation management of patients with anorectal tumors. Int J Radiat Oncol Biol Phys 2007; 69 (1): 155–162. doi: 10.1016/j.ijrobp.2007.02.055.
16. Nguyen BT, Joon DL, Khoo V et al. Assessing the impact of FDG-PET in the management of anal cancer. Radiother Oncol 2008; 87 (3): 376–382. doi: 10.1016/j.radonc.2008.04.003.
17. Sauter M, Vavricka SR, Keilholz G et al. Surveillance of anal carcinoma after radiochemotherapy : A retrospective analysis of 80 patients. Strahlentherapie und Onkol 2017; 193 (8): 639–647. doi: 10.1007/s00066-017-1159-0.
18. Kachnic LA, Winter K, Myerson RJ et al. RTOG 0529: a phase 2 evaluation of dose-painted intensity modulated radiation therapy in combination with 5-fluorouracil and mitomycin-C for the reduction of acute morbidity in carcinoma of the anal canal. Int J Radiat Oncol Biol Phys 2013; 86 (1): 27–33. doi: 10.1016/j.ijrobp.2012.09.
023.
19. Vuong T, Kopek N, Ducruet T et al. Conformal therapy improves the therapeutic index of patients with anal canal cancer treated with combined chemotherapy and external beam radiotherapy. Int J Radiat Oncol Biol Phys 2007; 67 (5): 1394–1400. doi: 10.1016/j.ijrobp.2006.11.038.
20. Gunderson LL, Winter KA, Ajani JA et al. Long-term update of US GI intergroup RTOG 98-11 phase III trial for anal carcinoma: survival, relapse, and colostomy failure with concurrent chemoradiation involving fluorouracil/mitomycin versus fluorouracil/cisplatin. J Clin Oncol 2012; 30 (35): 4344–4351. doi: 10.1200/JCO.2012.43.8085.
21. Čihák R. Anatomie I. 3. vyd. Praha: Grada Publishing 2011 : 76.
22. Hayman JA, Callahan JW, Herschtal A et al. Distribution of proliferating bone marrow in adult cancer patients determined using FLT-PET imaging. Int J Radiat Oncol Biol Phys 2011; 79 (3): 847–852. doi: 10.1016/j.ijrobp.2009.11.040.
23. Rancati T, Fiorino C: Modelling radiotherapy side effects. Practical applications for planning optimisation. Boca Raton: CRC Press Taylor&Francis Group 2019:
309–335.
24. Kunos CA, Andrews SJ, Moore KN et al. Randomized phase ii trial of triapine-cisplatin-radiotherapy for locally advanced stage uterine cervix or vaginal cancers. Front Oncol 2019; 9 : 1067. doi: 10.3389/fonc.2019.01067.
25. Yang FE, Vaida F, Ignacio L et al. Analysis of weekly complete blood counts in patients receiving standard fractionated partial body radiation therapy. Int J Radiat Oncol Biol Phys 1995; 33 (3): 607–619.
26. Mell LK, Sirák I, Wei L et al. Bone marrow-sparing intensity modulated radiation therapy with concurrent cisplatin for stage ib-iva cervical cancer: An international multicenter phase ii clinical trial (INTERTECC-2). Int J Radiat Oncol Biol Phys 2017; 97 (3): 536–545. doi: 10.1016/j.ijrobp.2016.11.027.
27. Lepinoy A, Lescut N, Puyraveau M et al. Evaluation of a 36 Gy elective node irradiation dose in anal cancer. Radiother Oncol 2015; 116 (2): 197–201. doi: 10.1016/j.radonc.2015.07.050.
28. Ng M, Leong T, Chander S et al. Australasian Gastrointestinal Trials Group (AGITG) contouring atlas and planning guidelines for intensity-modulated radiotherapy in anal cancer. Int J Radiat Oncol Biol Phys 2012; 83 (5): 1455–1462. doi: 10.1016/j.ijrobp.2011.12.058.
29. Marks LB, Yorke ED, Jackson A et al. Use of normal tissue complication probability models in the clinic. Int J Radiat Oncol Biol Phys 2010; 76 (3 Suppl): S10–S19. doi: 10.1016/j.ijrobp.2009.07.1754.
30. Brooks C, Hansen VN, Riddell A et al. Proposed genitalia contouring guidelines in anal cancer intensity-modulated radiotherapy. Br J Radiol 2015; 88 : 20150032. doi: 10.1259/bjr.20150032.
31. David JM, Yue Y, Blas K et al. 18F-FDG PET predicts hematologic toxicity in patients with locally advanced anal cancer treated with chemoradiation. Adv Radiat Oncol 2019; 4 (4): 613–622. doi: 10.1016/j.adro.2019.06.005.
32. Franco P, Fiandra C, Arcadipane F et al. Incorporating 18FDG-PET-defined pelvic active bone marrow in the automatic treatment planning process of anal cancer patients undergoing chemo-radiation. BMC Cancer 2017; 17 (1): 710. doi: 10.1186/s12885-017-3708-4.
33. Kachnic, Rose BS, Jee KW et al. Irradiation of FDG-PET-defined active bone marrow subregions and acute hematologic toxicity in anal cancer patients undergoing chemoradiation. Int J Radiat Oncol Biol Phys 2016; 94 (4): 747–754. doi: 10.1016/j.ijrobp.2015.12.006.
34. Kachnic LA, Tsai HK, Coen JJ et al. Dose-painted intensity-modulated radiation therapy for anal cancer: a multi-institutional report of acute toxicity and response to therapy. Int J Radiat Oncol Biol Phys 2012; 82 (1): 153–158. doi: 10.1016/j.ijrobp.2010.09.030.
35. Bazan JG, Luxton G, Mok EC et al. Normal tissue complication probability modeling for acute hematologic toxicity in patients treated with intensity-modulated radiation therapy for squamous cell carcinoma of the anal canal. Int J Radiat Oncol Biol Phys 2012; 84 : 700–706. doi: 10.1016/j.ijrobp.2011.12.072.
36. Mell LK, Sirák I, Wei L et al. Bone marrow-sparing intensity modulated radiation therapy with concurrent cisplatin for stage IB-IVA cervical cancer: An international multicenter phase ii clinical trial (INTERTECC-2). Int J Radiat Oncol Biol Phys 2017; 97 (3): 536–545. doi: 10.1016/j.ijrobp.2016.11.027.
37. Liang Y, Bydder M, Yashar CM et al. Prospective study of functional bone marrow-sparing intensity modulated radiation therapy with concurrent chemotherapy for pelvic malignancies. Int J Radiat Oncol Biol Phys 2013; 85 (2): 406–414. doi: 10.1016/j.ijrobp.2012.04.044.
38. Rose BS, Jee KW, Niemierko A et al. Irradiation of FDG-PET-defined active bone marrow subregions and acute hematologic toxicity in anal cancer patients undergoing chemoradiation. Int J Radiat Oncol Biol Phys 2016; 94 (4): 747–754. doi: 10.1016/j.ijrobp.2015.12.006.
39. McGuire SM, Bhatia SK, Sun W et al. Using [ (18) F]fluorothymidine imaged with positron emission tomography to quantify and reduce hematologic toxicity due to chemoradiation therapy for pelvic cancer patients. Int J Radiat Oncol Biol Phys 2016; 96 (1): 228–239. doi: 10.1016/j.ijrobp.2016.04.009.
40. Doci R, Zucali R, La Monica G, et al. Primary chemoradiation therapy with fluorouracil and cisplatin for cancer of the anus: results in 35 consecutive patients. J Clin Oncol 1996; 14 (12): 3121–3125. doi: 10.1200/JCO.1996.14.12.3121.
41. Franco P, Arcadipane F, Ragona R et al. Volumetric modulated arc therapy (VMAT) in the combined modality treatment of anal cancer patients. Br J Radiol 2016; 89 (1060): 20150832. doi: 10.1259/bjr.20150832.
42. Milano MT, Jani AB, Farrey KJ et al. Intensity-modulated radiation therapy (IMRT) in the treatment of anal cancer: toxicity and clinical outcome. Int J Radiat Oncol Biol Phys 2005; 63 (2): 354–361. doi: 10.1016/j.ijrobp.2005.02.030.
43. Jones CM, Adams R, Downing A et al. Toxicity, tolerability, and compliance of concurrent capecitabine or 5-fluorouracil in radical management of anal cancer with single-dose mitomycin-c and intensity modulated radiation therapy: evaluation of a national cohort. Int J Radiat Oncol Biol Phys 2018; 101 (5): 1202–1211. doi: 10.1016/j.ijrobp.2018.04.033.
44. Goodman KA, Julie D, Cercek A et al. Capecitabine with mitomycin reduces acute hematologic toxicity and treatment delays in patients undergoing definitive chemoradiation using intensity modulated radiation therapy for anal cancer. Int J Radiat Oncol Biol Phys 2017; 98 (5): 1087–1095. doi: 10.1016/j.ijrobp.2017.03.022.
45. Wo JY, Plastaras JP, Metz JM et al. Pencil beam scanning proton beam chemoradiation therapy with 5-fluorouracil and mitomycin-c for definitive treatment of carcinoma of the anal canal: a multi-institutional pilot feasibility study. Int J Radiat Oncol Biol Phys 2019; 105 (1): 90–95. doi: 10.1016/j.ijrobp.2019.04.040.
46. Li N, Noticewala SS, Williamson CW et al. Feasibility of atlas-based active bone marrow sparing intensity modulated radiation therapy for cervical cancer. Radiother Oncol 2017; 123 (2): 325–330. doi: 10.1016/j.radonc.2017.02.017.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2020 Issue 4
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Integrovaná diagnostika difúzních gliomů
- Úloha CDK12 v rozvoji nádorů
- Zhubné nádory krčka maternice v gravidite
- Role exozomů u nádorových onemocnění
- Nemoc těžkých řetězců imunoglobulinu gama
- Hematologická toxicita u IMRT/VMAT v kurativní léčbě análního karcinomu
- Atypický průběh typického karcinoidu plic
- Karcinom děložního hrdla v graviditě
- Akademická studie XR-TEMinDREC – kombinace konkomitantní neoadjuvantní chemoradioterapie následované lokální excizí operačním rektoskopem a akcelerovanou dispenzarizací u pacientů s mírně pokročilými stadii nízce sedícího adenokarcinomu konečníku a její průběh v MOÚ
- Efektivita blokády pektorálneho nervu typu II oproti torakálnej paravertebrálnej blokáde v analgézii po operácii tumoru prsníka
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Zhubné nádory krčka maternice v gravidite
- Integrovaná diagnostika difúzních gliomů
- Atypický průběh typického karcinoidu plic
- Nemoc těžkých řetězců imunoglobulinu gama
