Imunoterapia nádorových ochorení
Immunotherapy for cancer treatment
Background: Immunotherapy is an effective way to treat many diseases associated with disorders of the immune system by modulating immune response. It involves several ways of manipulating the immune system, which either suppress the immune response or, on the contrary, stimulates it. Immunotherapy is currently of immense importance not only in the context of the treatment of autoimmune diseases and immunodeficiencies, but it is also a promising method for treating cancer. Efforts to use the body‘s own anti-tumor response have led to the discovery of alternative treatments for cancer. Purpose: The aim of this paper is to provide a literature review focused on the current possibilities of cancer immunotherapy. In addition to classical procedures such as chemotherapy and radiotherapy, treatments consisting of adoptive cell therapy and blockade of immune checkpoints are being increasingly indicated. The latest form of adoptive cell therapy is the use of T-lymphocytes expressing chimeric antigen receptors. This type of treatment is indicated for hematological cancers. In recent years, a new approach to the treatment of cancer has emerged using blockade of immune checkpoints by monoclonal antibodies. At present, antitumor therapy focuses on blocking of inhibitory molecules – cytotoxic T-lymfocyte antigen 4 (CTLA-4) and programmed cell death 1 (PD-1). Administration of anti-CTLA-4 receptor specific monoclonal antibodies blocks binding between CTLA-4 receptors and B7 ligands, thereby preventing inhibition of activated cytotoxic T cells. Another type of checkpoints of the immune response include PD-1 molecules expressed on the surface of T-lymphocytes, B-lymphocytes, but also on the surface of myeloid cells. Blockade of PD-1 receptors and PD-L1 ligands prevents the inhibition of T-lymphocytes by tumor cells, leading to an increase in the immune system‘s ability to recognize tumor cells and subsequently destroy them. Blockade of PD-1 receptors and PD-L1 ligands prevents the inhibition of T-lymphocytes by tumor cells, leading to an increased immune response to the recognition of tumor cells and their subsequent destruction. An alternative form of tumor treatment is the administration of tumor vaccines and tumor-specific monoclonal antibodies (mAbs). The use of mAbs to kill tumors requires the expression of tumor-specific antigens on the surface of tumor cells. Through these receptors, mAb targets cytotoxic cells, toxins, drugs, or radioisotopes to tumor cells and thereby destroys them. Also, mAbs are able to block angiogenesis, which is crucial in tumor cell proliferation.
Keywords:
tumor – immunotherapy – Vaccines – monoclonal antibody – CTLA-4 – PD-1 – adoptive cell therapy
Authors:
K. Donátová; E. Nováková; M. Šupolíková
Authors‘ workplace:
Univerzita Komenského, Prírodovedecká fakulta, Katedra mikrobiológie a virológie, Bratislava, Slovenská republika
Published in:
Klin Onkol 2022; 35(4): 284-289
Category:
Review
doi:
https://doi.org/10.48095/ccko2022284
Overview
Východiská: Imunoterapia predstavuje efektívny spôsob liečby mnohých ochorení spojených s poruchami imunitného systému prostredníctvom modulácie imunitnej odpovede organizmu. Zahŕňa viacero možností manipulácie imunitného systému, ktoré buď imunitnú odpoveď potláčajú, alebo ju naopak stimulujú. V súčasnosti má nesmierny význam nielen v kontexte liečby autoimunitných ochorení a imunodeficiencií, ale je taktiež perspektívnou metódou liečby nádorových ochorení. Snaha vedcov využiť vlastnú protinádorovú odpoveď organizmu viedla k objaveniu alternatívnych spôsobov liečby nádorov. Cieľ: Cieľom predloženého príspevku je poskytnúť literárny prehľad zameraný na súčasné možnosti imunoterapie nádorových ochorení. Okrem klasických postupov, akými sú chemoterapia a rádioterapia, sa čoraz viac indikujú liečebné postupy spočívajúce v adoptívnej bunkovej terapii a inhibícii kontrolných bodov imunitnej reakcie. Najnovšou podobou adoptívnej bunkovej terapie je využitie T-lymfocytov exprimujúcich chimerické antigénne receptory. Tento typ liečby je indikovaný pri hematologických nádorových ochoreniach. V posledných rokoch sa do popredia dostáva nový prístup nádorovej terapie využívajúci blokáciu tzv. inhibítorov kontrolných bodov prostredníctvom monoklonálnych protilátok. V súčasnosti sa protinádorová terapia zameriava na blokáciu inhibičných molekúl – cytotoxic T-lymfocyte antigen 4 (CTLA-4) a programovej bunkovej smrti 1 (PD-1). Podaním monoklonálnych protilátok špecifických proti receptorom CTLA-4 dochádza k blokácii väzby medzi CTLA-4 receptormi a B7 ligandmi, čím sa zabráni inhibícii aktivovaných cytotoxických T-lymfocytov. K ďalšiemu typu kontrolných bodov imunitnej reakcie patria molekuly PD-1 exprimované na povrchu T-lymfocytov, B-lymfocytov, ale aj na povrchu myeloidných buniek. Blokácia receptorov PD-1 a ligandov PD-L1 zabraňuje inhibícii T-lymfocytov nádorovými bunkami, čo vedie k zvyšovaniu schopnosti imunitného systému rozpoznať nádorové bunky a následne ich deštruovať. Alternatívnou formou liečby nádorov je aj podávanie nádorových vakcín a nádorovo špecifických monoklonálnych protilátok (mAbs). Využitie mAbs k likvidácii nádorov vyžaduje expresiu tumor špecifických antigénov na povrchu nádorových buniek. Prostredníctvom týchto receptorov mAb nasmeruje cytotoxické bunky, toxíny, liečivá alebo rádioizotopy k nádorovým bunkám, a tým ich deštruuje. Taktiež sú mAbs schopné blokovať angiogenézu, ktorá je kľúčová pri množení nádorových buniek.
Klíčová slova:
nádor – imunoterapia – monoklonálna protilátka – vakcíny – CTLA-4 – PD-1 – adoptívna bunková terapia
Úvod
Nádorové ochorenia významne prispievajú k miere mortality ľudskej populácie. Klasická liečba nádorových ochorení predstavuje chirurgické odstránenie nádorov, chemoterapiu a rádioterapiu [1]. V posledných rokoch sa do popredia dostáva alternatívny spôsob liečby imunoterapia, ktorá využíva imunitné mechanizmy zodpovedné za deštrukciu nádorových buniek [2]. Účinnosť obranných mechanizmov organizmu je značne oslabená schopnosťou nádorových buniek uniknúť imunitnému dohľadu jedinca. Mechanizmus úniku nádorov je umožnený absenciou povrchových antigénov a zníženou expresiou molekúl I. a II. triedy hlavného histokompatibilného komplexu (HLA), v dôsledku čoho nedochádza k rozpoznaniu nádorových buniek efektorovými bunkami imunitného systému hostiteľa (cytotoxické T-lymfocyty, NK-bunky) [3]. Uniknutie pred obrannými mechanizmami hostiteľa je umožnené taktiež imunosupresiou indukovanou priamo nádorovými bunkami, ktoré sú schopné uvoľňovať rôzne typy solubilných molekúl (napr. indolamín 2,3-dioxygenáza) inhibujúcich efektorové mechanizmy imunity [4]. Nádorová imunoterapia zahŕňa dva základné prístupy: aktívnu a pasívnu imunoonkoterapiu. Pri pasívnej imunoonkoterapii sú pacientovi podávané nádorovo špecifické monoklonálne protilátky, T-lymfocyty, alebo cytokíny za účelom posilnenia protinádorovej imunitnej odpovede pacienta. Aktívna imunoonkoterapia stimuluje vlastnú protinádorovú odpoveď pacienta prostredníctvom protinádorovej vakcinácie, alebo blokádou kontrolných bodov imunitnej reakcie (immune checkpoint inhibitors – ICIs) [5]. Pri pasívnej imunoonkoterapii je nástup účinku signifikantne rýchlejší, avšak doba trvania vyvolanej protinádorovej reakcie je podstatne kratšia, ako pri aktívnej imunoonkoterapii [3].
Nádorovo špecifické monoklonálne protilátky
Monoklonálne protilátky (mAbs) predstavujú najčastejšie používanú formu imunoterapie nádorových ochorení, ktorá sa bežne aplikuje v klinickej praxi [5,6]. V súčasnosti je Úradom pre kontrolu potravín a liečiv (Food and Drug Administration – FDA) schválených 79 monoklonálnych protilátok, z ktorých 30 je využívaných na liečbu solídnych aj hematologických nádorov [2,7]. V oblasti imunoonkoterapie môžu byť monoklonálne protilátky aplikované samostatne, alebo v konjugácii s určitým liečivom, toxínom, prípadne rádioizotopom (obr. 1) [8]. Využitie mAbs k likvidácii nádorov vyžaduje expresiu tumor-asociovaných antigénov (TAA) na povrchu nádorových buniek, ktoré sú monoklonálnymi protilátkami rozpoznávané [5]. Pri podávaní samostatných mAbs sú k deštrukcii nádorov využívané fyziologické vlastnosti samotných mAbs, ako je aktivácia komplementového systému, opsonizácia s následnou fagocytózou a indukcia reakcie bunkovej cytotoxicity závislej na protilátke (antibody-dependent cellular cytotoxicity) [9]. Príkladom samostatne podávanej mAb je trastuzumab, ktorý je špecificky namierený proti antigénu HER2/Neu, znižuje jeho expresiu a blokuje naviazanie jeho prirodzeného ligandu. Trastuzumab je okrem svojich efektorových funkcií tiež schopný blokácie rastových signálov uplatňujúcich sa prostredníctvom receptora HER2/Neu. Indikuje sa pri liečbe karcinómu prsníka v dôsledku zvýšenej expresie tohto antigénu u pacientov trpiacich týmto ochorením [10]. Alemtuzumab predstavuje ďalšiu monoklonálnu protilátku s perspektívnym využitím v nádorovej terapii. Jeho účinok je namierený proti antigénu CD52 exprimovaného na lymfocytoch a indikuje sa pri liečbe chronickej lymfocytovej leukémie [11]. Príkladom konjugovanej mAb s naviazaným cytostatikom je konjugát brentuximab vedotin namierený proti antigénu CD30 na povrchu lymfocytov, ktorý sa využíva pri liečbe Hodgkinovho lymfómu a anaplastického veľkobunkového lymfómu [12]. Samostatné monoklonálne protilátky však ťažko penetrujú do veľkých nádorov a v niektorých prípadoch nie sú schopné efektívneho usmrtenia nádorových buniek. Účinnosť takýchto protilátok sa dá zvýšiť spojením protilátky s už spomínanými konjugátmi (obr. 1) [13].
![Deštrukcia nádorových buniek nádorovo špecifickými monoklonálnymi protilátkami a ich konjugátmi [13].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image_pdf/08af81dbd96d774e3603f87c997e4a4a.jpg)
Adoptívna bunková terapia
Atraktívny spôsob liečby hematologických, ale aj solídnych nádorov predstavuje tzv. adoptívna bunková terapia (adoptive cellular therapy – ACT). ACT zahŕňa izoláciu T-lymfocytov, ich namnoženie v podmienkach ex vivo a spätné podanie daných T-lymfocytov pacientovi [14]. Zdrojom izolovaných T-lymfocytov je periférna krv, alebo samotný nádor pacienta. Lymfocyty vyskytujúce sa v nádorovom tkanive sa nazývajú tumor-infiltrujúce lymfocyty (TIL), ktoré predstavujú heterogénnu populáciu lymfocytov pozostávajúcu najmä z cytotoxických T-lymfocytov [15]. Zvyšovanie počtu izolovaných buniek sa uskutočňuje vystavením TIL vysokým koncentráciám rastových faktorov (interleukín-2), ktoré okrem zvyšovania počtu daných lymfocytov zvyšujú aj ich protinádorovú aktivitu (obr. 2a). Pozitívne výsledky pri podávaní TIL boli zaznamenané pri liečbe pokročilého melanómu [16]. Ďalším prístupom adoptívnej bunkovej terapie je pomocou retrovírusových vektorov vniesť gény kódujúce tumor špecifické T-bunkové receptory do T-lymfocytov izolovaných z periférnej krvi pacienta [2]. Najnovšou podobou adoptívnej bunkovej terapie je využitie T-lymfocytov exprimujúcich chimérické antigénové receptory (CAR). Táto technika taktiež využíva retrovírusy na génový prenos, ale v tomto prípade sú do pacientových T-lymfocytov vnášané gény pre CAR [17]. Chimérické antigénové receptory sú fúzne receptory pozostávajúce z extracelulárnej antigén špecifickej domény a intracelulárnej domény zabezpečujúcej prenos aktivačných a kostimulačných signálov. Výsledné CAR T-lymfocyty sú následne spätne podané pacientovi (obr. 2b). Prostredníctvom svojej extracelulárnej domény rozpoznajú nádorový antigén, v dôsledku čoho dochádza k ich masívnej proliferácii [18]. Tento typ liečby je indikovaný pri hematologických nádorových ochoreniach, akými sú akútna lymfoblastová leukémia a chronická lymfatická leukémia [19,20].
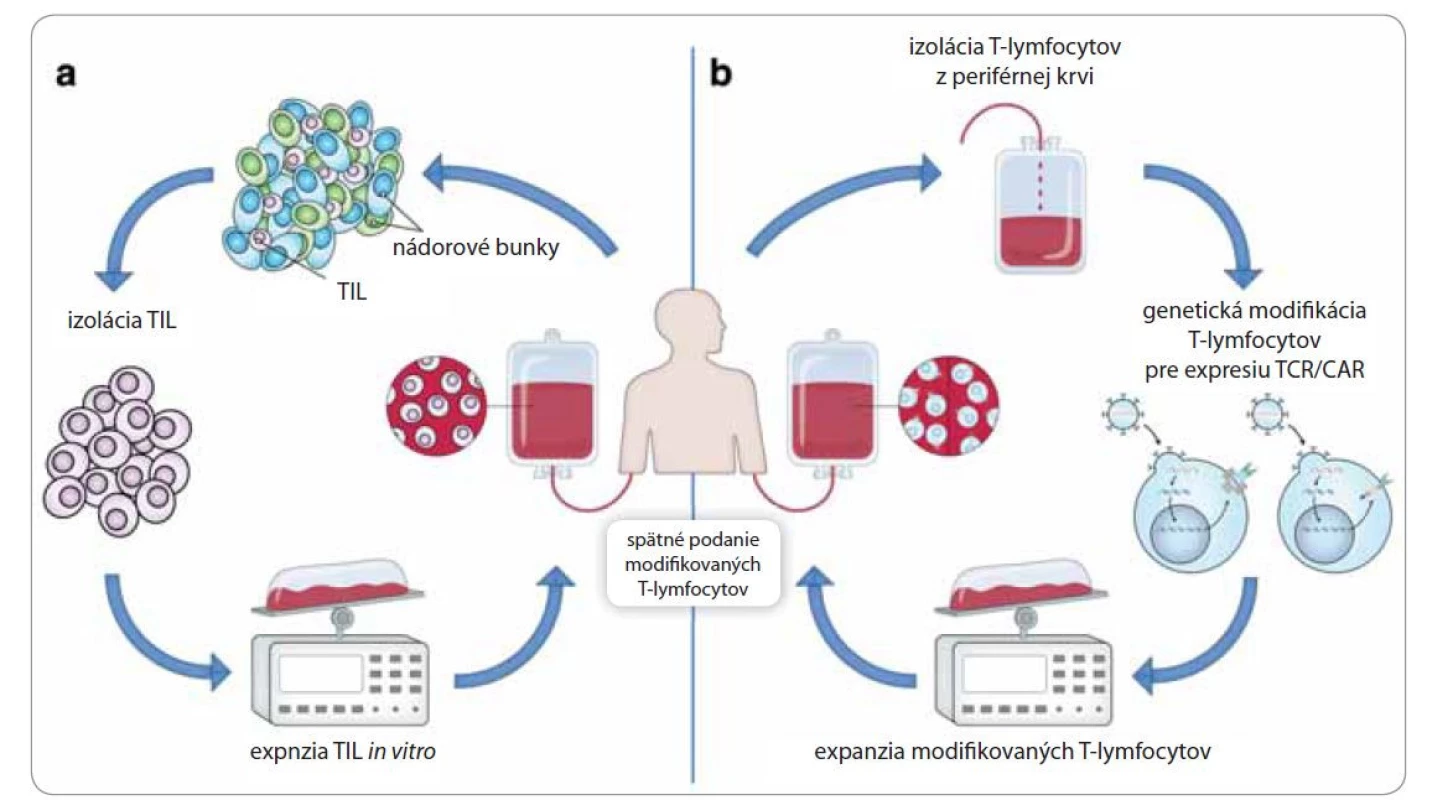
Nádorové vakcíny
Ďalšiu oblasť nádorovej imunoterapie predstavujú nádorové vakcíny, ktorých účelom je stimulovať imunitný systém pacienta k produkcii protilátok špecifických proti peptidom alebo antigénom prezentovaným na povrchu nádorových buniek [14]. Rozlišujeme vakcíny peptidové, dendritové a vakcíny obsahujúce celé nádorové bunky. Peptidové vakcíny stimulujú imunitnú odpoveď namierenú proti špecifickému antigénu exprimovanému v asociácii s HLA molekulami na povrchu nádorových buniek [21]. K pomerne často používaným vakcínam patria autológne dendritové vakcíny, ktoré k indukcii špecifickej protinádorovej imunitnej odpovede využívajú dendritové bunky pacienta. Dendritové bunky patria k profesionálnym antigén prezentujúcim bunkám, ktoré zohrajú kľúčovú úlohu v prezentácii antigénov T-lymfocytom, čím zvyšujú imunitnú odpoveď [9]. Pri ich príprave sú pacientovi z periférnej krvi odobrané monocyty, ktoré sú následne kultivované v prítomnosti faktora stimulujúceho kolónie granulocytov a makrofágov (GM-CSF) a interleukínu-4, ktoré indukujú maturáciu monocytov na myeloidné dendritové bunky [22]. V nasledujúcom kroku sú dendritové bunky vystavené TAA, alebo antigénnym peptidom derivovaným z nádoru pacienta. Takto modifikované dendritové bunky sú spätne podané pacientovi s cieľom stimulovať špecifickú T-lymfocytovú protinádorovú odpoveď [23]. Príkladom je vakcína sipuleucel-T (Provenge) indikovaná pri liečbe karcinómu prostaty. V tomto prípade sú dendritové bunky vystavené prostatickému špecifickému antigénu (PSA), ktorý je exprimovaný na väčšine buniek karcinómu prostaty [24]. V súčasnosti sú pomocou rekombinantných technológií pripravované geneticky modifikované DC schopné sekrécie rastových faktorov a interleukínov, ktoré stimulujú aktiváciu T-lymfocytov a NK-buniek [14].
Inhibítory kontrolných bodov imunitnej reakcie
V posledných rokoch sa do popredia dostáva nový prístup nádorovej terapie využívajúci blokáciu tzv. inhibítorov kontrolných bodov imunity prostredníctvom monoklonálnych protilátok. Imunitná odpoveď je kontrolovaná celým radom stimulačných a inhibičných kontrolných bodov. V súčasnosti sa protinádorová terapia zameriava na blokáciu inhibičných molekúl – cytotoxic T-lymfocyte antigen 4 (CTLA-4) a PD1[21]. Molekuly CTLA-4 predstavujú povrchové receptory T-lymfocytov, ktoré sa významne podieľajú na navodení a udržaní autoimunitnej tolerancie [25]. K expresii CTLA-4 receptorov dochádza v skorých štádiách imunitnej odpovede po mobilizovaní T-lymfocytov antigén prezentujúcimi bunkami, ku ktorým patria aj nádorové bunky [26]. Po aktivácii T-lymfocytov receptory CTLA-4 viažu svoje ligandy B7-1/ B7-2 exprimované na nádorových bunkách, čím inhibujú aktivitu cytotoxických T-lymfocytov a tým zabraňujú deštrukcii nádorových buniek. Podaním monoklonálnych protilátok špecifických proti receptorom CTLA-4 (anti-CTLA-4) dochádza k blokácii väzby medzi CTLA-4 receptormi a B7 ligandmi, čím sa zabráni inhibícii aktivovaných cytotoxických T-lymfocytov. Okrem toho sú protilátky anti-CTLA-4 schopné deštrukcie regulačných T-lymfocytov exprimujúcich receptory CTLA-4 na svojom povrchu [3,27]. K ďalšiemu typu kontrolných bodov imunitnej reakcie patria molekuly programovej bunkovej smrti 1 (programmed cell death 1 – PD-1) exprimované na povrchu T-lymfocytov, B-lymfocytov, NK buniek, ale aj na povrchu myeloidných buniek [28]. Hlavnou úlohou PD-1 receptorov je inhibovať aktivitu T-lymfocytov v periférnych tkanivách s cieľom zabrániť autoimunitným odpovediam pri zápalových reakciách počas infekcií [14]. Ligandy receptorov PD-1 a PD-2 (PD-L1, PD-L2) predstavujú povrchové molekuly exprimované na dendritových bunkách, makrofágoch, T - a B-lymfocytoch a taktiež na povrchu nádorových buniek [3]. Naviazanie receptorov PD-1 k príslušným ligandom indukuje apoptózu cytotoxických T-lymfocytov, zároveň dochádza k zníženiu produkcie cytokínov a k inhibícii proliferácie T-lymfocytov (obr. 3). Expresie ligandov PD-L1 a PD-L2 sú schopné rôzne typy nádorových buniek. Blokácia receptorov PD-1 a ligandov PD-L1 zabraňuje inhibícii T-lymfocytov nádorovými bunkami, čo vedie k zvyšovaniu schopnosti imunitného systému rozpoznať nádorové bunky a následne ich deštruovať [14,29]. Jedným z najväčších prelomov v oblasti farmakoterapie solídnych nádorov je už spomenutý a vysvetlený prístup protinádorovej imunoterapie, založenej na blokácii receptorov protilátkami proti CTLA-4, PD-1 a PD-L1. Za vysokou účinnosťou tejto terapie sú vzácne, avšak často život ohrozujúce nežiaduce účinky, ktoré sa líšia od spektra známych nežiaducich účinkov protinádorovej chemoterapie. Mechanizmy vzniku týchto imunitne podmienených nežiaducich účinkov nie sú zatiaľ dostatočne preskúmané. Avšak incidencia akýchkoľvek nežiaducich účinkov pri takomto prístupe nádorovej terapie využívajúcej blokáciu inhibítorov kontrolných bodov imunity môže dosahovať až 60 %, v prípade ťažkých stupňov (G3–4) 10–30 % [30]. K najzávažnejším vedľajším účinkom patria najmä silné autoimunitné a zápalové reakcie, ktoré sú výsledkom ovplyvňovania fyziologických mechanizmov organizmu. V kombinácii s ďalšími terapeutickými metódami sa darí spomínané vedľajšie účinky postupne znižovať, čo vedie k perspektívnemu využitiu danej terapie pri liečbe rôznych typov nádorových ochorení [3,31].
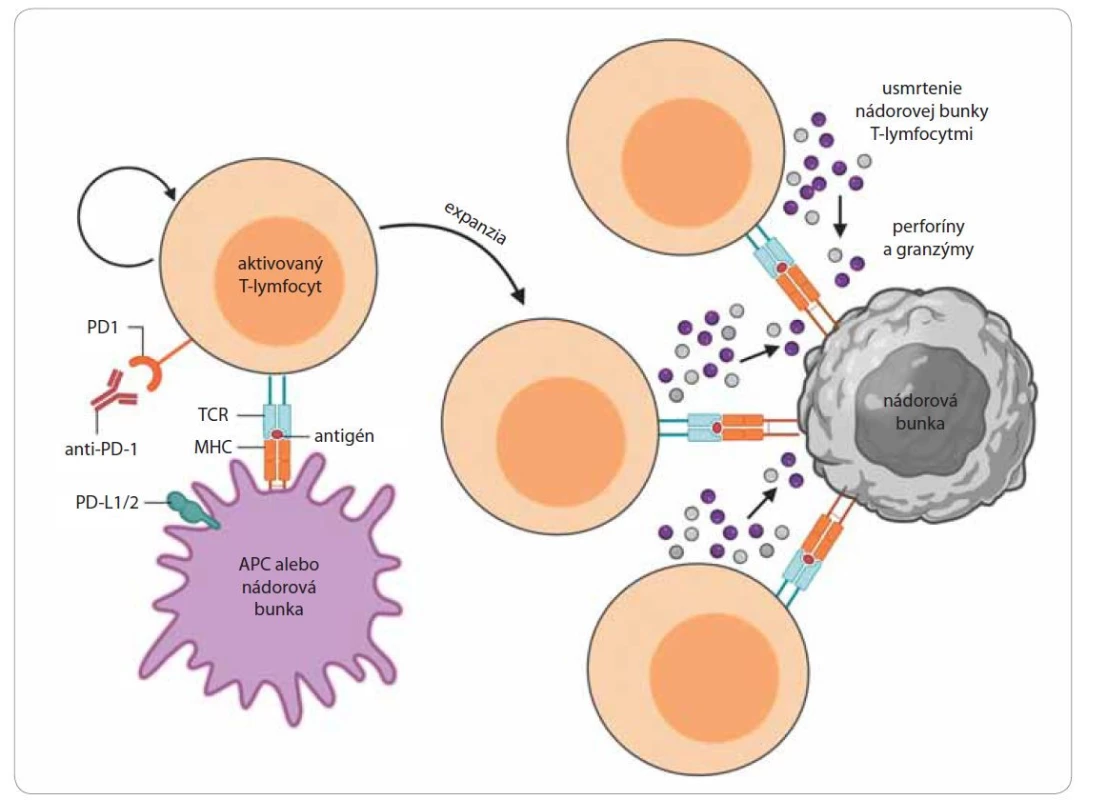
APC – antigén prezentujúca bunka, MHC – hlavný histokompatibilný komplex
Záver
V posledných rokoch je výskum v oblasti imunoterapie zameraný predovšetkým na liečbu nádorových ochorení, ktorých incidencia každým rokom narastá. Alternatívne spôsoby liečby nádorov využívajúce imunomodulačné liečivá chemickej alebo biologickej povahy majú čím ďalej väčšie zastúpenie v klinickej praxi. Mnohé z týchto liečiv sú doposiaľ v štádiu klinických skúšok, avšak poskytujú významnú perspektívu do budúcnosti. Imunoterapia a najmä použitie ICIs spôsobila v posledných rokoch revolúciu v liečbe niekoľkých typov nádorov. Od roku 2011, kedy FDA schválila prvý checkpoint inhibítor – protilátku anti CTLA-4 (ipilimumab) pre liečbu metastatického malígneho melanómu, využitie ICIs sa rozšírilo aj pre ďalšie diagnózy, a to nielen v monoterapii, ale aj ako súčasť kombinačných režimov s inými ICIs alebo s chemoterapiou. Terapia ICIs môže navodiť dlhodobú imunitnú odpoveď, avšak efektívnosť tohto prístupu je pozorovaná iba u 20–40% pacientov [32]. Využitie imunoterapie v klinickej praxi je častokrát obmedzované pomerne závažnými nežiaducimi účinkami. Mnohé imunostimulačné a imunosupresívne liečivá vykazujú vysokú toxicitu voči ľudskému organizmu, čo značne komplikuje ich indikáciu v terapii. V dôsledku toho je prioritou súčasného výskumu v oblasti imunoterapie nielen vývoj nových spôsobov modulácie imunitného systému, ale aj zdokonalenie už existujúcich imunomodulačných postupov.
Poďakovanie
Tento príspevok je podporený riešeným projektom VEGA 1/0061/18, zameraným na imunomodulačné proteíny kódované gamaherpesvírusom.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE recommendation for biomedical papers.
doc. RNDr. Miroslava Šupolíková, PhD.
Katedra mikrobiológie a virológie
Prírodovedecká fakulta
Univerzita Komenského v Bratislave
Ilkovičova 6
842 15 Bratislava
Slovenská republika
Obdŕžané/Submitted: 4. 5. 2021
Prijaté/Accepted: 12. 7. 2021
Sources
1. Tannock IF. Conventional cancer therapy: promise broken or promise delayed? Lancet 1998; 351 (Suppl 2): 9–16. doi: 10.1016/s0140-6736 (98) 90327-0.
2. Zhang H, Chen J. Current status and future directions of cancer immunotherapy. J Cancer 2018; 9 (10): 1773–1781. doi: 10.7150/jca.24577.
3. Závadová E. Onkologická imunologie. Praha: Mladá fronta 2015.
4. Weiner LM. Cancer immunology for the clinician. Clin Adv Hematol 2015; 13 (5): 299–306.
5. Galluzzi L, Vacchelli E, Pedro JMBS et al. Classification of current anticancer immunotherapies. Oncotarget 2014; 5 (24): 12472–12508. doi: 10.18632/oncotarget.2998.
6. Zahavi D, Weiner L. Monoclonal antibodies in cancer therapy. Antibodies 2020; 9 (3): 34. doi: 10.3390/antib 9030034.
7. Lu RM, Hwang YC, Liu IJ et al. Development of therapeutic antibodies for the treatment of diseases. J Biomed Sci 2020; 27 (1): 1. doi: 10.1186/s12929-019-0592-z.
8. Maleki LA, Baradaran B, Majidi J et al. Future prospects of monoclonal antibodies as magic bullets in immunotherapy. Hum Antibodies 2013; 22 (1–2): 9–13. doi: 10.3233/HAB-130266.
9. Klener Jr P, Otahal P, Lateckova L et al. Immunotherapy approaches in cancer treatment. Curr Pharm Biotechnol 2015; 16 (9): 771–781. doi: 10.2174/1389201016666150619114554.
10. Baldo BA. Safety of biologics therapy. Switzerland: Springer International Publishing 2016.
11. Fiegl M, Stauder R, Steurer M et al. Alemtuzumab in chronic lymphocytic leukemia: final results of a large observational multicenter study in mostly pretreated patients. Ann Hematol 2014; 93 (2): 267–277. doi: 10.1007/s00277-013-1966-z.
12. Chen R, Chen B. Brentuximab vedotin for relapsed or refractory Hodgkin‘s lymphoma. Drug Des Devel Ther 2015; 9 : 1729–1733. doi: 10.2147/DDDT.S82007.
13. Murphy K, Weaver C. Janeway‘s immunobiology. New York: Garland Science/Taylor & Francis Group 2016.
14. Ventola CL. Cancer immunotherapy, part 1: current strategies and agents. P T 2017; 42 (6): 375–383.
15. Wang J, Tian S, Sun J et al. The presence of tumour-infiltrating lymphocytes (TILs) and the ratios between different subsets serve as prognostic factors in advanced hypopharyngeal squamous cell carcinoma. BMC Cancer 2020; 20 (1): 731. doi: 10.1186/s12885-020-07234-0.
16. Restifo NP, Dudley ME, Rosenberg SA. Adoptive immunotherapy for cancer: harnessing the T cell response. Nat Rev Immunol 2012; 12 (4): 269–281. doi: 10.1038/nri3 191.
17. Kusabuka H, Fujiwara K, Tokunaga Y et al. Highly efficient gene transfer using a retroviral vector into murine T cells for preclinical chimeric antigen receptor-expressing T cell therapy. Biochem Biophys Res Commun 2016; 473 (1): 73–79. doi: 10.1016/j.bbrc.2016.03.054.
18. Feins S, Kong W, Williams EF et al. An introduction to chimeric antigen receptor (CAR) T-cell immunotherapy for human cancer. Am J Hematol 2019; 94 (S1): S3–S9. doi: 10.1002/ajh.25418.
19. Frey NV. Chimeric antigen receptor T cells for acute lymphoblastic leukemia. Am J Hematol 2019; 94 (S1): 524–527. doi: 10.1002/ajh.25442.
20. Mancikova M, Smida M. Current state of CAR T-cell therapy in chronic lymphocytic leukemia. Int J Mol Sci 2021; 22 (11): 5536. doi: 10.3390/ijms22115536.
21. Alatrash G, Jakher H, Stafford PD et al. Cancer immunotherapies, their safety and toxicity. Expert Opin Drug Saf 2013; 12 (5): 631–645. doi: 10.1517/14740338.2013.795944.
22. Calmeiro J, Carrascal MA, Tavares AR et al. Dendritic cell vaccines for cancer immunotherapy: the role of human conventional type 1 dendritic cells. Pharmaceutics 2020; 12 (2): 158. doi: 10.3390/pharmaceutics12020158.
23. Constantino J, Gomes C, Falcão A et al. Antitumor dendritic cell–based vaccines: lessons from 20 years of clinical trials and future perspectives. Transl Res 2015; 168 : 74–95. doi: 10.1016/j.trsl.2015.07.008.
24. Kantoff PW, Higano CS, Shore ND et al. Sipuleucel-T immunotherapy for castration-resistant prostate cancer. N Engl J Med 2010; 363 (5): 411–422. doi: 10.1056/NEJMoa1001294.
25. Romo-Tena J, Gómez-Martín D, Alcocer-Varela J. CTLA-4 and autoimmunity: new insights into the dual regulator of tolerance. Autoimmun Rev 2013; 12 (12): 1171–1176. doi: 10.1016/j.autrev.2013.07.002.
26. Perkins D, Wang Z, Donovan C et al. Regulation of CTLA-4 expression during T cell activation. J Immunol 1996; 156 (11): 4154–4159.
27. Waldman AD, Fritz JM, Lenardo MJ. A guide to cancer immunotherapy: from T cell basic science to clinical practice. Nat Rev Immunol 2020; 20 (11): 651–668. doi: 10.1038/s41577-020-0306-5.
28. Han Y, Liu D, Li L. PD-1/PD-L1 pathway: current researches in cancer. Am J Cancer Res 2020; 10 (3): 727–742.
29. ENO J. Immunotherapy through the years. J Adv Pract Oncol 2017; 8 (7): 747–753.
30. Juřica J. Mechanizmy imunitně podmíněných nežádoucích účinků checkpoint inhibitorů. Abstrakt VII/66. Klin Onkol 2021; 34 (Suppl 2): 2S37.
31. Martins F, Sofiya L, Sykiotis GP et al. Adverse effects of immune-checkpoint inhibitors: epidemiology, management and surveillance. Nat Rev Clin Oncol 2019; 16 (9): 563–580. doi: 10.1038/s41571-019-0218-0.
32. Bořilová S, Fabian P, Zdražilová Dubská L et al. Predikce odpovědi na léčbu imunoterapií checkpoint inhibitory u pacientů s pokročilými solidními nádory. Klin Onkol 2021; 34 (Suppl 2): 2S107–2S109.
Labels
Paediatric clinical oncology Surgery Clinical oncologyArticle was published in
Clinical Oncology

2022 Issue 4
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Metamizole vs. Tramadol in Postoperative Analgesia
- Spasmolytic Effect of Metamizole
- Metamizole in perioperative treatment in children under 14 years – results of a questionnaire survey from practice
-
All articles in this issue
- Onkologická léčba 21. století a Kaplan-Meierovy křivky
- Rosai-Dorfman-Destombes disease – histiocytic disorder with infl ammatory manifestation
- Patients with neuregulin 1 (NRG1) rearranged cancer are suitable for the theranostic approach and targeted therapy
- Olanzapine in oncology palliative care
- Immunotherapy for cancer treatment
- How fatigue affects return to work in breast cancer patients
- Informace z České onkologické společnosti
- Slow increase of bilirubin concentration during administration of lenalidomide, bortezomib and dexamethasone for multiple myeloma (unmasking previously undiagnosed Gilbert syndrome) and disappearance of necrobiotic xanthogranuloma after complete remission of multiple myeloma
- Regulatory network of competitively interacting RNAs and effectiveness of rectal tumors radiotherapy
- Concurrent weekly cisplatin and simultaneous integrated boost intensity-modulated radiotherapy of locally advanced squamous cell carcinoma of the head and neck
- Microwave ablation of a solitary colorectal liver metastasis complicated by stomach perforation and gastrocutaneous fistula – a case report
- Clinical Oncology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Olanzapine in oncology palliative care
- Immunotherapy for cancer treatment
- Rosai-Dorfman-Destombes disease – histiocytic disorder with infl ammatory manifestation
- How fatigue affects return to work in breast cancer patients
