Jeden rok po hluboké mozkové stimulaci pacientů s Parkinsonovou nemocí – neuropsychologické výsledky
One Year after Deep Brain Stimulation at Parkinson’s Disease Patients – Neuropsychological Results
Aim of the study:
To evaluate cognitive status one year after deep brain stimulation of the subthalamic nucleus in Parkinson’s disease patients.
Method:
Nineteen non‑demented patients underwent neuropsychological assessment before and one year after deep brain stimulation in the “ON” motor state. The Wilcoxon test for two paired samples was used for data analyses.
Results:
All the patients experienced a long‑term improvement of motor performance and alleviation of motor complications with the “ON” stimulation. Analyses revealed decline in the following tests: the “word and colour” part of the Stroop Test; a semantic and lexical verbal fluency test; a picture completion task and a “word list – delayed recall” verbal learning test.
Conclusion:
We found mild but statistically significant decline in the results of tests measuring attention, executive functions and verbal memory (free recall). Mood scores (depression) were not influenced by DBS.
Key words:
deep brain stimulation – subthalamic nucleus – cognitive symptoms – depression
Authors:
S. Telecká; M. Baláž; I. Rektorová; Z. Fanfrdlová; I. Rektor
Authors‘ workplace:
Centrum pro abnormní pohyby a parkinsonismus, I. neurologická klinika LF MU a FN u sv. Anny v Brně
Published in:
Cesk Slov Neurol N 2010; 73/106(1): 57-61
Category:
Short Communication
Overview
Cíl studie:
Zhodnotit stav kognitivních schopností rok po hluboké mozkové stimulaci subtalamického jádra u pacientů s Parkinsonovou nemocí.
Soubor a metodika:
Devatenáct pacientů bez příznaků demence podstoupilo neuropsychologické vyšetření před DBS operaci v motorickém stavu „ON“ a rok po ní. Pro datovou analýzu byl použit Wilcoxonův párový test.
Výsledky:
U všech pacientů bylo zaznamenáno dlouhodobé zlepšení motorického výkonu a motorických komplikací při stimulaci „ON“. Analýza ukázala pokles výkonu v případě Stroopova testu, části „Slova-Barvy“, verbální fluence sémantické i lexikální, Doplňování obrázků a testu slovního učení „Seznam slov – oddálené vybavení“.
Závěr:
Zjistili jsme mírný, avšak statisticky signifikantní pokles výkonu u testů měřících pozornost, exekutivní schopnosti a verbální paměť (volné vybavení); zatímco nálada (deprese) nebyla DBS nijak ovlivněna.
Klíčová slova:
hluboká mozková stimulace – subtalamické jádro – kognitivní symptomy – deprese
Úvod
Hluboká mozková stimulace (deep brain stimulation, DBS) je indikována nejčastěji k terapii pozdních hybných komplikací Parkinsonovy nemoci (PN), které neodpovídají na úpravy farmakoterapie. Nejčastějším anatomickým cílem DBS u pokročilé PN je subtalamické jádro (STN). Jde o bezpečný a účinný postup, který u pacientů výrazně zlepšuje hybné symptomy PN, pozdní hybné komplikace a zvyšuje kvalitu života [1–3].
Výtečný symptomatický efekt na třes, rigiditu a hypokinezi, spolu s možností snížení dopaminergní terapie v pooperačním období, přispěl k rozšíření této metody. DBS STN snižuje motorické fluktuace, čas trvání levodopou (L-DOPA) indukovaných dyskinezí a umožní snížit antiparkinsonskou terapii L-DOPA ekvivalentu ve srovnání s předoperačním stavem [4].
Díky výraznému efektu na motorické skóre (v UPDRS III – unified Parkinson disease rating scale III – jednotná škála k hodnocení tíže hybných symptomů PN – výrazné pooperační zlepšení), snížení motorických fluktuací (trvání dyskinezí a off stavů) a zlepšení kvality života pacientů (PDQ-39 – Parkinson disease quality of life – snížení skóre) v dlouhodobém sledování, je DBS mimořádně efektivním terapeutickým postupem u pacientů s pozdními hybnými komplikacemi PN [1].
Antiparkinsonskou medikaci je možno posléze redukovat, což vede k signifikantnímu snížení nežádoucích účinků [30].
DBS má jako každý funkční neurochirurgický výkon rizika spojená s chirurgickou intervencí (krvácení, infekce) a působením stimulace (ovlivnění okolních anatomických struktur). Další rizika přináší umístění cizího materiálu (infekce, rejekce, lokální iritace kůže) [5].
Z hlediska neuropsychologického literatura nejčastěji hovoří o snížení schopností v oblasti verbální paměti a verbální fluence [6,7].
Výraznějším nežádoucím účinkům je však možno se vyhnout přísným dodržením indikačních a vylučujících kritérií (tab. 1) [1]. Z psychologického hlediska jde především o to, nezařazovat pacienty trpící významnějším kognitivním deficitem nebo psychiatrickými symptomy (halucinace, psychóza, těžší forma deprese).
![Pacienti s vyšším rizikem kognitivního postižení po DBS STN – možné rizikové faktory [1].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/2f025a234cc79878be5ffce33d4f67ba.png)
Neuropsychologické charakteristiky pacientů s PN
Neuropsychologický deficit u PN je charakterizován progresivním „dysexekutivním“ syndromem s paměťovým deficitem a poruchou abstraktního myšlení (tab. 2) [8].

Kognitivní poruchy mírného stupně jsou časté již v rané fázi onemocnění a mohou progredovat do demence až u 78,2 % pacientů v pozdním stadiu nemoci [9]. Demence významně snižuje kvalitu života pacientů a zkracuje dobu jejich přežití, způsobuje dvojnásobný nárůst mortality [8]. Riziko rozvoje demence u pacientů s PN je 1,7–5,9krát vyšší než u běžné populace stejného věku, vzdělání a pohlaví [10].
Většina pacientů také prožívá deprese, mnohdy kombinované s úzkostí. Psychotické projevy jsou častější především u pacientů s kognitivním deficitem; celkově se však objevují u menší části nemocných, zejména jako nežádoucí efekt dopaminergní terapie.
Jeden rok po STN DBSu pacientů s PN – neuropsychologickévýsledky z našeho pracoviště
Cíl výzkumu
Zhodnotit kognitivní schopnosti a změny nálady po DBS STN u pacientů s PN.
Soubor a metodika
Devatenáct pacientů bez příznaků demence (průměrný věk 58,8 ± 8,2 roku; vzdělání 12,6 ± 2,1 roku, skóre Mattisovy škály demence 141 ± 3,8) podstoupilo neuropsychologické vyšetření před DBS operací v motorickém stavu „ON“ a po ní. (Mediánový interval mezi DBS a neuropsychologickým vyšetřením byl 11 měsíců.) Pro datovou analýzu byl použit Wilcoxonův párový test.
Testová baterie
Wechslerova inteligenční škála pro dospělé (Wechsler adult intelligence scale revised, WAIS-R, WAIS-III; [11]): Nejčastěji používaná metoda ke komplexnímu mapování intelektových schopností pacientů. V našem výzkumu jsme použili zkrácenou verzi [12] obsahující subtesty Doplňování obrázků, Počty, Symboly, Podobnosti.
Mattisova škála demence (Mattis dementia rating scale, DRS [13]): Často používaná skríningová zkouška. Obsahuje sub-testy měřicí pozornost (opakování čísel), iniciaci a perseveraci (schopnost začít a dokončit určitou činnost), konstrukci (kopírování vzorů dle předlohy), konceptualizaci (podobnosti) a verbální a nonverbální krátkodobou paměť (opakování vět, rozpoznávání obrazců).
Wechslerova paměťová škála (Wechsler memory scale, WMS‑III [14]) – část Seznam slov: Jeden z tzv. testů verbálního učení – zaměřuje se na verbální učení, organizaci a paměť. Součástí testu je také složka znovupoznání.
Test komplexní figury (Rey‑Osterrieth complex figure, R‑O [15]): Hojně využívaný test, který mapuje vizuo‑spaciální konstrukční schopnosti, vizuálně‑motorickou kontrolu a pozornost a mnestickou kapacitu – bezprostřední i oddálenou. Lze využít i část „znovupoznání“ (recall).
Stroopův test (Stroop test [16]): Měří schopnost přepínání pozornosti (shifting); je měřítkem flexibility. Je citlivý na detekci mozkových poškození, zejména ve frontální oblasti.
Londýnská věž (Tower of London, TOL[17]): Test mapuje exekutivní schopnosti, především schopnost strategického plánování a vizuálně‑prostorového řešení problému a schopnost dodržení nalezeného schématu.
Lexikální cílená verbální fluence (lexical fluency): Úkolem je za jednu minutu vytvořit co nejvíce slov začínajících na dané písmeno (neplatná jsou vlastní jména, číslice a stejná slova s rozdílnou příponou). V anglosaské literatuře jsou používána písmena F, A, S; u nás N, K, P).
Sémantická cílená verbální fluence (category fluency): v případě fluence sémantické je úkolem za jednu minutu vyjmenovat co nejvíce slov spadajících do určené kategorie – např. „zvířata“, „potraviny“ či „oblečení“.
Beckova škála deprese (Beck depression inventory, BDI [18]): Sebeposuzovací stupnice, která se používá v klinické praxi i ve výzkumu. Položky jsou zaměřeny na afektivní, kognitivní, motivační a fyziologické symptomy deprese. Dotazník měří aktuální stav, ne depresivitu jako rys osobnosti.
Škála MADRS (Montgomery‑Asberg depression rating scale [19]): Objektivní škála určená k posuzování míry deprese; je citlivá k zachycení změn v čase, je validizována pro diagnostiku deprese u PN.
Výsledky
U všech pacientů bylo zaznamenáno dlouhodobé zlepšení motorického výkonu a motorických komplikací při stimulaci „ON“.
Medián stimulačních parametrů byl 2,6 V± 0,4 V, 130 Hz a 90 usec. U všech 19 pacientů bylo zapojení stimulace monopolární (s aktivní katodou v oblasti STN).
Významné zlepšení motorického skóre (UPDRS III) bylo zjištěno u všech stimulovaných pacientů. UPDRS III při medikaci OFF/stimulaci ON pokleslo o 68,5 % a při medikaci ON/stimulaci ON o 70 % ve srovnání se stavem před operací. Medián stimulačních parametrů byl 2,6 V; 130 Hz a 90 usec.
Tab. 3 ukazuje porovnání souborů výsledků neuropsychologických testů před operací a po ní. Hodnota p je pravděpodobnost shody obou souborů; při nízké hodnotě p < 0,05 tedy hypotézu o shodě souborů zamítáme.
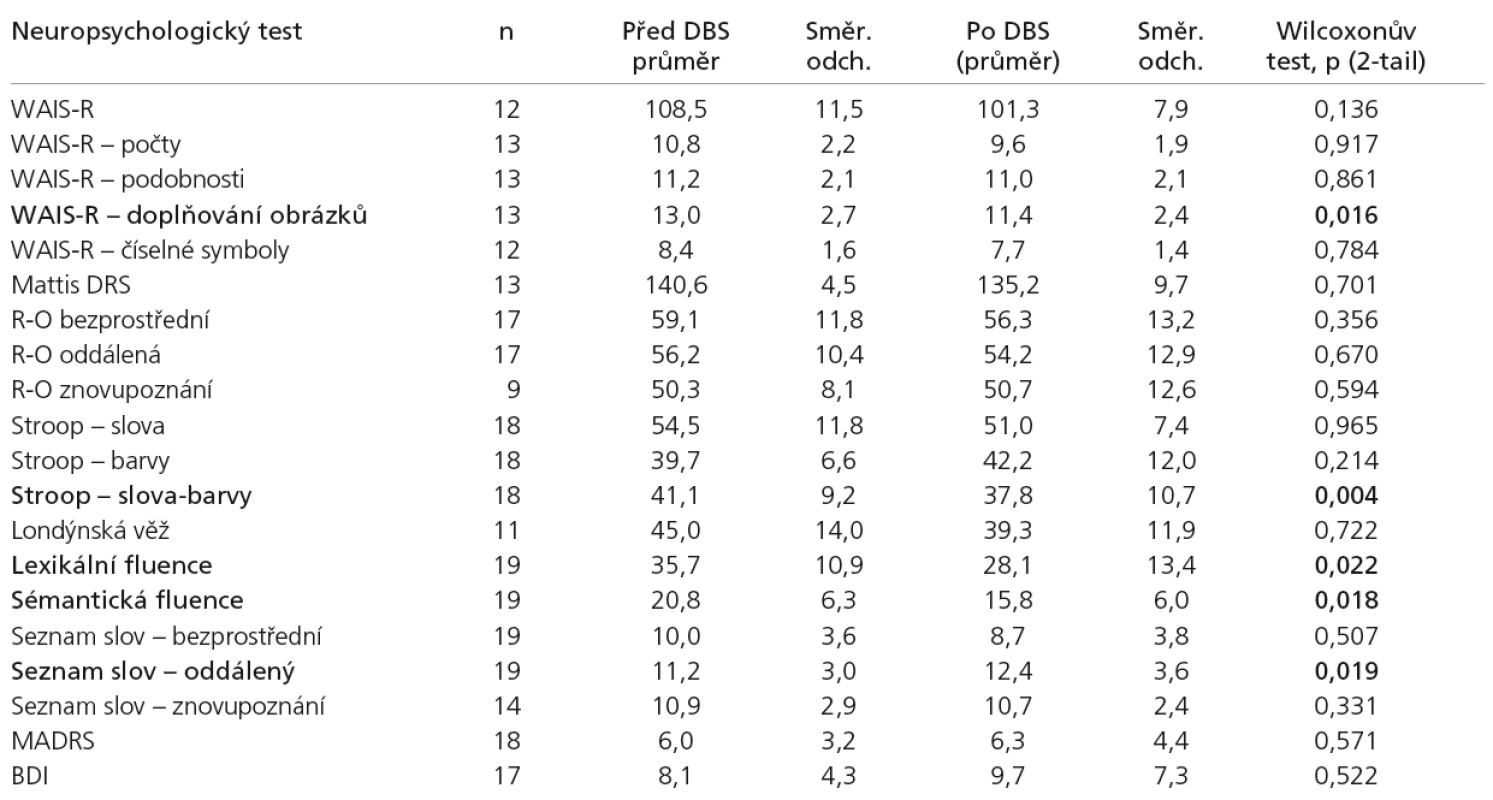
Analýza ukázala statisticky signifikantní změny u následujících testů (vždy se jednalo o pokles výkonu ve srovnání se situací před operací): Stroopův test, část „Slova‑Barvy“ (p = 0,004), Verbální fluence: sémantická (p = 0,018) a lexikální (p = 0,022), Doplňování obrázků (subtest WAIS‑R; p = 0,016); Seznam slov – oddálené vybavení (subtest WMS‑III; p = 0,019). Pokles ve výkonu u sledovaných schopností byl spíše mírný, v celkovém klinickém dojmu se výrazněji neprojevuje.
V období jednoho roku po DBS se u pacientů neprojevují žádné psychiatrické symptomy, jako jsou bludy, halucinace, porucha kontroly impulzů (patologické hráčství, neadekvátní sexuální chování, patologické nakupování, žravost), či kompulzivní nadužívání dopaminergní medikace (dopamine dysregulation syndrom). Rovněž se neobjevil statisticky signifikantní rozdíl v míře deprese.
Diskuze
U sledovaných pacientů jsme zjistili mírný, ale signifikantní pokles v oblasti pozornosti, exekutivních schopností a verbální paměti. Nepozorovali jsme žádné změny nálady.
Pokud jde o kognitivní změny po DBS STN, výsledky jednotlivých studií se liší a nejsou konzistentní.
Nejčastěji v literatuře nacházíme informace o mírných parciálních změnách kognitivních schopností, zejména u verbální fluence, verbální paměti a pozornosti [6,20,21]. York et al [7] hovoří o mírném frontostriatálním kognitivním deficitu (verbální fluence, pozornost, rychlost zpracování informací a verbální paměť). Naše výsledky jsou v souladu s výsledky těchto studií.
Podstatné je, že uváděné selektivní kognitivní změny nemívají dle literatury výraznější vliv na kvalitu života pacientů [2,22]. Nejedná se o signifikantní změny v globálním kognitivním výkonu [2,23]. Pokud se objeví demence, je to obvykle přičítáno přirozenému vývoji PN, nikoli vlivu DBS [3,20]. V naší práci jsme se však na hodnocení kvality života nezaměřovali, nemůžeme se tudíž k dopadu mírného zhoršení výkonu v některých kognitivních testech na kvalitu života našich konkrétních pacientů vyjádřit.
Witt et al [2] zjistili pokles výkonu ve Stroopově testu a verbální fluenci, zatímco verbální paměť, pracovní paměť a pozornost podle nich zůstaly beze změn. V některých studiích nebyl pozorován žádný pokles kognitivních schopností [24]. Existuje dokonce i práce, která referuje o zlepšení některých kognitivních schopností po DBS STN: např. v případě některých aspektů exekutivních schopností – pracovní paměti, řešení problémů, rychlost zpracování informace, mentální flexibility [25].
Patofyziologie selektivních kognitivních změn pozorovatelných u pacientů po STN DBS není doposud plně objasněna. Změny by mohly souviset s implantací elektrod a zejména s jejich přesným umístěním, s vlastní stimulací a použitými stimulačními parametry, nebo i se změnou dopaminergní medikace (jejím snížením) po STN DBS [2,26,27].
Recentní randomizovaná studie porovnávající kognitivní efekty STN DBS a DBS vnitřního pallida u pacientů s PN [28] prokázala po sedmi měsících sledování srovnatelný pozitivní efekt na hybné symptomy PN, avšak zhoršení v testu verbální fluence v porovnání s výkonem před DBS pouze v případě stimulace STN, a to zejména v „OFF“ stavu (po vypnutí stimulace). Autoři uzavírají, že zhoršení kognitivního výkonu v testu verbální fluence u pacientů s STN DBS souvisí pravděpodobně spíš s chirurgickým výkonem (implantací elektrod) než s vlastní stimulací.
Hypotézy o kauzálních mechanizmech těchto změn vycházejí zejména ze studií na zvířecích modelech PN nebo z výsledků studií s použitím funkčních zobrazovacích metod (PET) u pacientů s PN. Např. Campbell et al [27] zjistili pomocí vyšetření H215O PET, že pacienti s kognitivním deficitem navozeným DBS měli stimulací navozené zvýšení regionálního průtoku krve v oblasti dorzolaterálního prefrontálního kortexu a předního cingula, a naopak pacienti se zlepšením kognitivních funkcí v důsledku stimulace měli snížený průtok krve ve stejných oblastech mozku. Co je ale podkladem těchto změn na buněčné úrovni, není jasné. Autoři např. uvádějí hypotézu, že vnucená frekvence vybíjení STN na jedné straně zlepšuje motorické funkce pacientů s PN, na druhé straně může interferovat s fázickou aktivitou dopaminergních neuronů mající vztah ke kognitivním funkcím.
Pokud se týká psychiatrických potíží, Voon et al [29] popisují přechodné a terapeuticky ovlivnitelné neuropsychiatrické symptomy (přechodná zmatenost, pooperační hypománie, tranzientní apatie, zrakové halucinace); a dále epizody pooperační deprese, které mají tendenci se v průběhu dalších let postupně zmírňovat. V našem souboru jsme nezjistili žádnou výraznější změnu depresivní symptomatologie, v korelaci s jinými autory [7].
Závěr
Zjistili jsme mírný, avšak statisticky signifikantní pokles výkonu u testů měřících pozornost, exekutivní schopnosti a verbální paměť (volné vybavení); zatímco nálada (deprese) nebyla DBS nijak ovlivněna. Naše výsledky jsou srovnatelné s výsledky dalších studií publikovaných v literatuře.
Potenciální kandidáti DBS by měli být informováni o možnosti mírného poklesu některých kognitivních schopností, při současné šanci výrazné úpravy motorických obtíží.
Budoucí studie by měly být zaměřeny na detailnější studium patofyziologických mechanizmů kognitivních a behaviorálních změn u pacientů po DBS a na hledání rizikových faktorů predikujících individuální změny navozené DBS.
Seznam zkratek
DBS hluboká mozková stimulace
PN Parkinsonova nemoc
STN subtalamické jádro
Podpořeno Výzkumným záměrem MŠM 002162240
Přijato k recenzi: 17. 8. 2009
Přijato do tisku: 2. 11. 2009
PhDr. Sabina Telecká
Centrum pro abnormní pohyby a parkinsonismus
I. neurologická klinika LF MU a FN u sv. Anny v Brně
Pekařská 53
656 91 Brno
e-mail: sabina.telecka@fnusa.cz
Sources
1. Baláž M, Rektor I. Neuropsychologické a kognitivní vlivy hluboké mozkové stimulace subtalamického jádra u pacientů s Parkinsonovou nemocí. Neurol pro praxi 2008; 9(5): 305–307.
2. Witt K, Daniels C, Reiff J, Krack P, Volkmann J, Pinsker RO et al. Neuropsychological and psychiatric changes after deep brain stimulation for Parkinson’s disease: a randomised, multicentral study. Lancet Neurol 2008; 7(7): 605–614.
3. Krack P, Batir A, Van Blercom N, Chabardes S, Fraix V, Ardouin C et al. Five‑year follow‑up of bilateral stimulation of the subthalamic nucleus in advanced Parkinson’s disease. N Engl J Med 2003; 349(20): 1925–1934.
4. Houeto JL, Damier P, Bejjani PB, Staedler C, Bonnet AM, Arnulf I et al. Subthalamic stimulation in Parkinson’s disease: a multidisciplinary approach. Arch Neurol 2000; 57(4): 461–465.
5. Chrastina J, Novák Z, Baláž M, Krupa P, Říha I, Jančálek R et al. Subthalamic nucleus stimulation – surgical problems. Neurol pro praxi, 2006; 2 (Suppl B): B45.
6. Higginson CI, Wheelock VL, Levine D, King DS, Pappas CT, Sivgardt KA. The clinical significance of neuropsychological changes following bilateral subthalamic nucleus deep brain stimulation for Parkinson’s disease. J Clin and Exp Neuropsychol 2009; 31(1): 65–72.
7. York MK, Dulay M, Macias A, Levin HS, Grossmann R,Simpson R et al. Cognitive declines following bilateral subthalamic nucleus deep brain stimulation for the treatment of Parkinson’s disease. J Neurol Neurosurg Psychiatry 2008; 79(7):789–795.
8. Rektorová I. Neurodegenerativní demence. Cesk Slov Neurol N 2009; 72/105(2): 97–109.
9. Aarsland D, Andersen K, Larsen JP, Lolk A, Kragh‑Sørensen P. Prevalence and characteristics of dementia in Parkinson disease: an 8‑year prospective study. Arch Neurol 2003; 60(3): 387–392.
10. Emre M, Aarsland D, Brown R, Burn DJ, Duyckaerts C, Mizuno Y et al. Clinical diagnostic criteria for dementia associated with Parkinson’s disease. Mov Disord 2007; 22(12): 1689–1707.
11. Wechsler D. Wechslerova inteligenční škála pro dospělé. 3rd ed. Brno: Psychodiagnostika 1999.
12. Randolph C, Mohr E, Chase TN. Assessment of intellectual function in dementing disorders: validity of WAIS‑R short forms for patients with Alzheimer’s, Huntington’s, and Parkinson’s disease. J Clin Experiment Neuropsychol 1993; 15(5): 743–753.
13. Mattis S. Dementia rating scale: professional manual. Odessa: Psychological Assessment Resources 1988.
14. Wechsler D. Wechslerova paměťová škála. 3rd ed. Brno: Psychodiagnostika 1999.
15. Meyers JE, Meyers KR. Rey Complex figure test and recognition trial. Odessa, Florida, USA: Psychological Assessment Resources 1996.
16. Stroop Color and Word Test – adult version. Odessa, Florida, USA: Psychological Assessment Resources 2002.
17. Shallice T, Evans M. The involvement of the frontal lobes in cognitive estimation. Cortex 1978; 14(2): 294–303.
18. Beck AT, Steer RA. Beck depression inventory manual. San Antonio, Texas, USA: Psychological Corporation 1993.
19. Montgomery SA, Asberg M. A new depression scale designed to be sensitive to change. Brit J Psych 1979; 134 : 382–389.
20. Aybek S, Gronchi‑Perrin A, Berney A, Chiuvé SC, Villemure JG, Burkhard PR et al. Long‑term cognitive profile and incidence of dementia after STN‑DBS in Parkinson’s disease. Mov Disord 2007; 22(7): 974–981.
21. Klempírová O, Jech R, Urgosík D, Klempír J, Spačková N, Roth J et al. Deep brain stimulation of the subthalamic nucleus and cognitive functions in Parkinson’s disease. Prague Med Rep 2007; 108(4): 315–323.
22. Kleiner‑Fisman G, Herzog J, Fisman DN, Tamma F,Lyons KE, Pahwa R et al. Subthalamic nucleus deep brain stimulation: summary and meta‑analysis of outcomes. Mov Disord 2006; 21 (Suppl 14): S290–S304.
23. Parsons TD, Rogers SA, Braaten AJ, Woods SP, Tröster AI. Cognitive sequelae of subthalamic nucleus deep brain stimulation in Parkinson’s disease: a meta‑analysis. Lancet Neurol 2006; 5(7): 578–588.
24. Page D, Jahanshahi M. Deep brain stimulation of the subthalamic nucleus improves set shifting but does not affect dual task performance in Parkinson’s disease. IEEE Trans Neural Syst Rehabil Eng 2007; 15(2): 198–206.
25. Jahanshahi M, Ardouin CM, Brown RG, Rothwell JC, Obeso J, Albanese A et al. The impact of deep brain stimulation on executive function in Parkinson’s disease. Brain 2000; 123(6): 1142–1154.
26. Strafella AP, Dagher A, Sadikot AF. Cerebral blood flow changes induced by subthalamic stimulation in Parkinson’s disease. Neurology 2003; 60(6): 1039–1042.
27. Campbell MC, Karimi M, Weaver PM, Wu J, Perantie DC, Golchin NA et al. Neural correlates of STN DBS‑induced cognitive variability in Parkinson disease. Neuropsychologia 2008; 46(13): 3162–3169.
28. Okun MS, Fernandez HH, Wu SS, Kirsch‑Darrow L,Bowers D, Bova F et al. Cognition and mood in Parkinson’s disease in subthalamic nucleus versus globus pallidus interna deep brain stimulation: the COMPARE trial. Ann Neurol 2009; 65(5): 586–595.
29. Voon V, Kubu C. Krack P, Houeto JL, Tröster AI. Deep brain stimulation: neuropsychological and neuropsychiatric issues. Mov Disord 2006; 21 (Suppl 14): S305–S327.
30. NINDS Deep Brain Stimulation for Parkinson’s Disease Information Page. Dostupné z: www.ninds.nih.gov/disorders/deep_brain_stimulation/deep_brain_stimulation.htm.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2010 Issue 1
- Memantine Eases Daily Life for Patients and Caregivers
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Advances in the Treatment of Myasthenia Gravis on the Horizon
-
All articles in this issue
- Evokované odpovědi a elektromyografie v intraoperační monitoraci v neurochirurgii
- Prevence cévních mozkových příhod léčbou hypolipidemiky
- Magnetická rezonanční relaxometrie u roztroušené sklerózy – měření T2 relaxačního času v centrální šedé hmotě
- Vliv repetitivní transkraniální magnetické stimulace cerebella na motoriku horní končetiny u pacientů v iniciálním stadiu Parkinsonovy nemoci – pilotní studie
- Vyšetření čichu u neurologických onemocnění pomocí Testu parfémovaných fixů
- Diabetická neuropatia u detí a adolescentov – prospektívna 5-ročná štúdia
- Jeden rok po hluboké mozkové stimulaci pacientů s Parkinsonovou nemocí – neuropsychologické výsledky
- Kongenitální myastenické syndromy – kazuistiky
- Myoklonická epilepsie a hluchota u sourozenců s mutací 7512T>C v genu pro mitochondriální tRNASer(UCN) – kazuistiky
- Mitochondriální encefalomyopatie na podkladě deficitu proteinu Sco2 s obrazem SMA‑like neurogenní svalové atrofie – kazuistiky
- Sérový protein S100B jako molekulární marker závažnosti poranění mozku u dětí
- Hyperintenzivní léze reagující na steroidy u pacienta s Creutzfeldt‑Jakobovou nemocí
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Mitochondriální encefalomyopatie na podkladě deficitu proteinu Sco2 s obrazem SMA‑like neurogenní svalové atrofie – kazuistiky
- Vyšetření čichu u neurologických onemocnění pomocí Testu parfémovaných fixů
- Kongenitální myastenické syndromy – kazuistiky
- Evokované odpovědi a elektromyografie v intraoperační monitoraci v neurochirurgii
