Kazuistika Guillainova-Barrého syndromu u pacienta s renálním karcinomem
Guillain-Barré Syndrome in a Patient with a Renal Carcinoma – a Case Report
Guillain-Barré syndrome (GBS) is an acute autoimmune polyradiculoneuropathy with a monophasic course, the development of which takes a maximum of four weeks. Relapse is rare (approximately 3% of cases). As opposed to chronic inflammatory demyelinating polyneuropathy (CIDP), where a link to lymphoma and certain other malignancies has been described, linkage of GBS to cancer is questionable. Nevertheless, several cases occur in the literature describing the occurrence of GBS in patients with malignancies. This case report covers a patient with renal carcinoma who presented with GBS, and possible linkage to malignancy is discussed.
Key words:
Guillain-Barré syndrome – paraneoplastic syndrome – renal carcinoma
Authors:
L. Večeřa 1; J. Bednařík1 ,2
Authors‘ workplace:
Neurologická klinika LF MU a FN Brno
1; Středoevropský technologický institut (CEITEC), MU, Brno
2
Published in:
Cesk Slov Neurol N 2012; 75/108(1): 84-87
Category:
Case Report
Overview
Guillainův-Barrého syndrom (GBS) je akutní autoimunitní polyradikuloneuropatie s monofázickým průběhem, jejíž rozvoj trvá maximálně čtyři týdny a recidiva je vzácná (přibližně ve 3 % případů). Na rozdíl od chronické zánětlivé demyelinizační polyneuropatie (CIDP), u které byla popsána vazba na lymfomy a některé další malignity, je u GBS vazba na nádorové onemocnění sporná. Přesto však můžeme v literatuře nalézt několik kazuistik, které popisují výskyt GBS u pacientů s malignitami. V této kazuistice je uveden případ pacienta s renálním karcinomem, u kterého se manifestoval GBS, a je zvažována možná kauzální souvislost obou onemocnění.
Klíčová slova:
Guillainův-Barrého syndrom – paraneoplastický syndrom – karcinom ledviny
Úvod
GBS patří mezi relativně vzácná autoimunitní nervosvalová onemocnění. Přestože je jeho paraneoplastická etiologie zpochybňována, můžeme ve světové literatuře nalézt v současnosti desítky případů, které popisují souběžný výskyt GBS a maligního nádoru. Možná paraneoplastická etiologie GBS však nebyla dosud jednoznačně potvrzena ani vyvrácena. V současné literatuře je GBS řazen do skupiny neklasických, neurologických paraneoplastických syndromů a není spojen s výskytem specifických onkoneurálních protilátek. Protože nebyla prokázána jasná souvislost mezi GBS a maligními nádory, je k vyloučení falešně pozitivních případů paraneoplastické etiologie GBS arbitrárně stanoven časový limit dvou let mezi objevením se neurologické symptomaticky GBS a diagnostikováním maligního nádoru [1]. Na vzniku a rozvoji GBS u onkologických pacientů se kromě vlivu samotného nádoru může podílet chemoterapie, transplantace kostní dřeně, operační odstranění tumoru nebo infekce (např. virem Epsteina-Barrové u pacientů s Burkittovým lymfomem), což jsou další možné spouštěče GBS. V počátcích onemocnění je téměř nemožné rozlišit GBS od chronické zánětlivé demyelinizační polyneuropatie (CIDP) s akutním začátkem (A-CIDP). Rozlišení je přitom důležité nejen vzhledem k rozdílné prognóze i terapeutické strategii, ale i ve vztahu k případné malignitě.
Kazuistika
Osmapadesátiletý pacient byl přijat na neurologickou kliniku s asi týden progredující slabostí dolních končetin doprovázenou paresteziemi od třísel ke kotníkům. Při přijetí dominovalo asymetrické oslabení především flexe a extenze v kolenním kloubu, více vpravo (stupeň 4 svalového testu), méně byla oslabena dorzální a plantární flexe obou dolních končetin s akcentací vpravo. Patelární reflex byl nevýbavný oboustranně, reflex Achillovy šlachy byl zpočátku oboustranně snížený, postupně vymizel. Horní končetiny byly bez paréz a poruch citlivosti.
Pro podezření na GBS byla provedena lumbální punkce, v mozkomíšním moku byl nález proteinocytologické disociace (mononukleáry: 3,0/µl – norma do 3,0/µl, polymorfonukleáry: 0/µl – norma do 3,0/µl, erytrocyty: 0/µl, celková bílkovina v mozkomíšním moku: 0,73 g/l – norma do 0,45 g/l). Elektromyografické vyšetření (EMG) prokazovalo známky lehké demyelinizační, převážně motorické polyneuropatie: prodloužení distálních motorických latencí (DML), latencí F vln, lehké zpomalení rychlosti vedení v motorických vláknech (MCV) a hraniční parciální bloky vedení na dvou nervech horních končetin proximálně – pokles amplitudy sumačního svalového akčního potenciálu (CMAP) o 24 %. Nebyla však splněna elektrofyziologická kritéria získané multifokální demyelinizace dle Alberse a Kellyho nebo elektrofyziologická kritéria AIDP dle Hughese a Cornblatha [2].
Během dvou dnů rychle progredovala paréza dolních končetin až do středně těžkého stupně (stupeň 2 svalového testu), přidala se paréza horních končetin oboustranně lehkého stupně (stupeň 4 svalového testu). Vzhledem k pracovní diagnóze GBS byla dva dny po přijetí zahájena léčba výměnnou léčebnou plazmaferézou, během pěti dnů bylo vyměněno 17 litrů plazmy. První den po plazmaferéze došlo k velmi mírnému zlepšení potíží pacienta a v průběhu dalších osmi dnů již nedocházelo k progresi svalové slabosti. Léčba výměnnou léčebnou plazmaferézou byla ukončena 6. den od začátku hospitalizace. Od 10. dne hospitalizace dále progredoval stav pacienta až do kvadruparézy těžkého stupně, přičemž byla zachována jen minimální hybnost prstů na horních končetinách (svalový test 1–0), n. phrenicus i hlavové nervy nebyly postiženy.
S odstupem osmi dnů od přijetí k hospitalizaci došlo k dalšímu zvýšení celkové bílkoviny v mozkomíšním moku (mononukleáry: 2,0/µl, polymorfonukleáry: 0/µl, erytrocyty: 5,0/µl, celková bílkovina v mozkomíšním moku: 1,12 g/l). EMG provedené v odstupu 8 a následně 23 dnů již prokázalo přesvědčivé známky multifokální demyelinizační motorické neuropatie: došlo k poklesu amplitud CMAP na 50–75 % výchozí hodnoty, objevilo se výrazné prodloužení DML, MCV, latencí F vln a známky vícečetných parciálních bloků vedení na HKK a DKK a známky akutní motorické axonopatie v jehlové EMG. Senzitivní neurogram byl beze změny. Elektrofyziologický nález koreloval s diagnózou autoimunitní demyelinizační polyneuropatie.
Pro přetrvávání těžkého motorického deficitu a možnosti A-CIDP byla po 16 dnech od přijetí pacienta zahájena kortikoterapie pulzem solumedrolu v celkové dávce 3 gramů a následná kontinuální perorální kortikoterapie prednizonem v dávce 60 mg/den. Po 30 dnech od počátku hospitalizace došlo k výraznému a náhlému zlepšení stavu pacienta především na horních končetinách, na kterých během několika dnů téměř úplně vymizely parézy. Na dolních končetinách parézy přetrvávaly, nastalo jejich zmírnění do středně těžkého stupně (stupeň 3 svalového testu) (obr. 1). Toto zlepšení klinického stavu pacienta následovalo s dlouhou latencí od začátku kortikoterapie. Proto zůstává otázkou, zda k němu došlo v důsledku kortikoterapie, nebo se jednalo o spontánní úpravu.
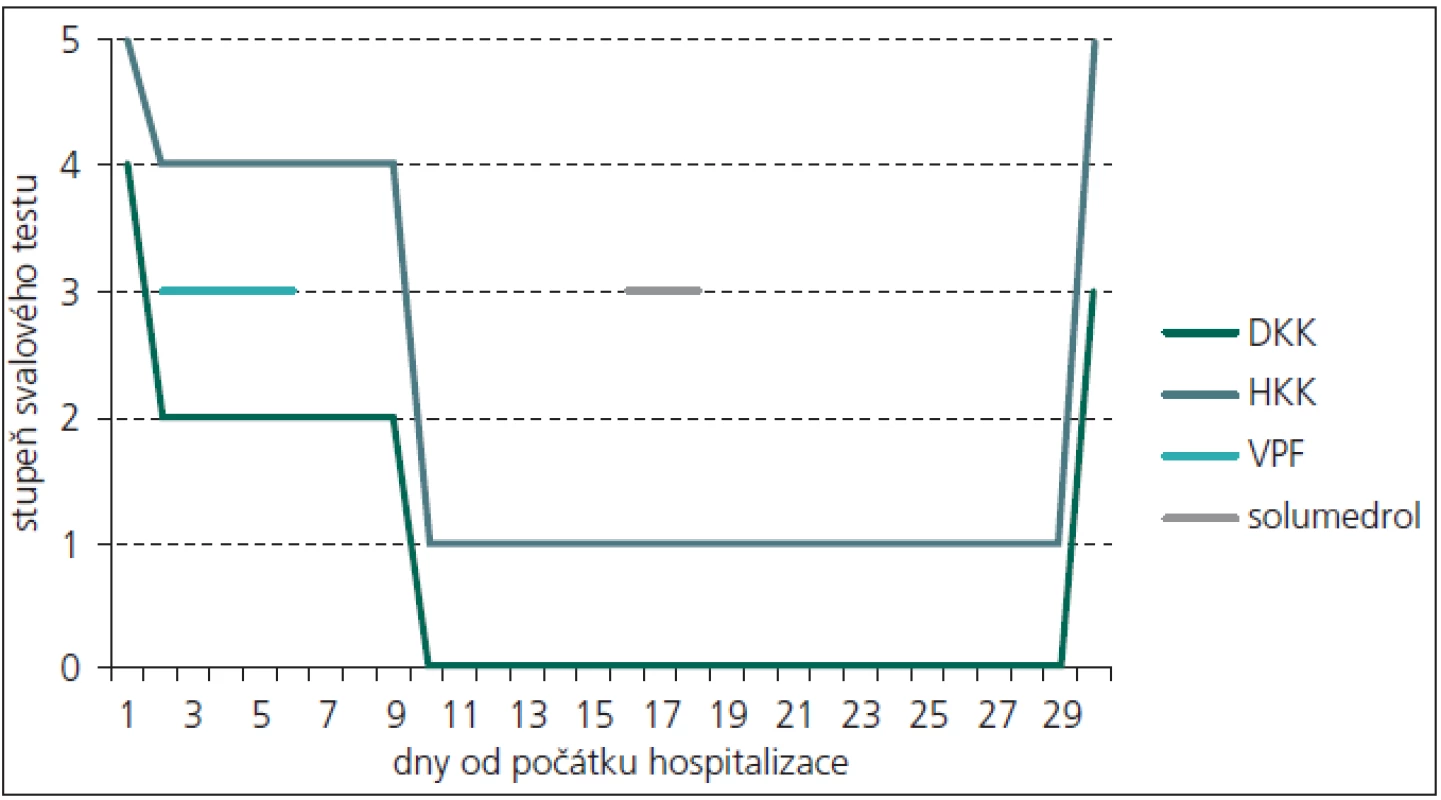
Vzhledem k ne zcela typickému průběhu, kdy jsme zvažovali i alternativní diagnózu CIDP s akutním začátkem, bylo uvažováno i o paraneoplastickém syndromu. Proto bylo provedeno onkologické skríningové vyšetření, včetně imunoelektroforetického vyšetření séra i moči, vše s negativním nálezem. Ultrazvukové vyšetření břicha rovněž neprokázalo žádnou patologii v dutině břišní ani na ledvinách. Již při vstupních odběrech byla u pacienta přítomna proteinurie a leukocyturie, které přetrvávaly po celou dobu hospitalizace, v krvi byl nález hypoproteinemie a hypalbuminemie, ostatní základní biochemické a hematologické vyšetření byla v normě. Navíc po 31 dnech od začátku hospitalizace u pacienta propukla uroinfekce, etiologickým agens byla Escherichia coli. Zajímavostí je, že začátek klinických projevů uroinfektu byl jeden den po prudkém zlepšení stavu pacienta. Uroinfekt byl přeléčen antibiotiky (Amoksiklav) a při propuštění z neurologické kliniky byl pacient bez klinických známek uroinfektu, CRP bylo v normě (hodnota 3,1 mg/l). Jeden den po překladu na rehabilitační kliniku došlo u pacienta k recidivě uroinfekce. Kontrolní ultrazvukové vyšetření břicha, které následovalo asi 1 měsíc po prvním, negativním vyšetření, již prokázalo na dolním pólu pravé ledviny extrarenálně se vyklenující asi 40 mm velké ložisko. Následně provedené CT vyšetření břicha potvrdilo tumorózní expanzi dolního pólu pravé ledviny. Byla provedena resekce dolního pólu pravé ledviny, histologické vyšetření prokázalo světlobuněčný renální karcinom Fuhrman grade I o největším průměru 46 mm.
Po propuštění z naší nemocnice proběhla intenzivní rehabilitace v jiném zdravotnickém zařízení, která trvala asi šest týdnů, dále následovala ambulantní rehabilitace. Při kontrole za šest měsíců od vzniku choroby si pacient stěžoval na přetrvávající slabost dolních končetin oboustranně, měl problémy se vstáváním z nízké židle, nezvládl dřep. Objektivně byla oslabena dorzální flexe pravé nohy (stupeň 4 svalového testu), v ostatních vyšetřených svalech horních i dolních končetin byla svalová síla v normě (stupeň 5 svalového testu). Pacient zvládl stoj na jedné dolní končetině oboustranně, zvládl stoj na špičkách oboustranně, vázl jen stoj na patě pravé dolní končetiny. Test kvantifikované chůze na 10 metrů zvládl pacient za 6,6 s. V kontrolním elektrofyziologickém vyšetření dominoval nález subakutní axonopatie na dolních končetinách oboustranně, na horních končetinách byl nález v normě. Na dolních končetinách přetrvávala prolongace až nevýbavnost F vln, chyběly však jednoznačné známky demyelinizační neuropatie: vymizely bloky vedení, téměř se normalizovaly MCV i DML. Elektrofyziologický nález odpovídal spíše stavu po proběhlé monofázické polyneuropatii s multifokální demyelinizací se sekundární subakutní axonopatií.
Diskuze
Z nádorových onemocnění bývá nejčastěji popisován výskyt GBS u hematoonkologických nádorů, především u lymfomu Hodgkinova i non-Hodgkinova typu i u akutních a chronických leukemií. Výskyt GBS byl popsán také u karcinomů, nejčastěji u pacientů s karcinomem plic, ale i u pacientů s jiným typem karcinomu [3–6]. Otázkou zůstává, zda ve všech v literatuře udávaných případech šlo o paraneoplastickou manifestaci maligního nádoru, nebo o koincidenci dvou na sobě nezávislých onemocnění.
U GBS se patofyziologicky jedná o autoimunitní reakci namířenou proti myelinu nebo axonu periferních nervů. U lymfomů odvozených z B buněk, u kterých byl GBS popsán častěji, by mohlo dojít k tvorbě monoklonálních protilátek namířených proti myelinu nebo axonu. Dalším teoretickým mechanizmem by mohla být zkřížená reakce protilátek namířených proti buňkám nádoru, které by mohly zkříženě reagovat se Schwanovými buňkami myelinových pochev nervů, popř. s glykolipidy v Ranvierových zářezech axonu a vyvolat demyelinizaci, případně axonopatii. Nicméně akutní průběh GBS by u dlouhodobě rostoucích karcinomů nebyl typický vzhledem k tomu, že u karcinomů se protilátky namířené proti nádorovým buňkám budou taktéž v organizmu vyskytovat dlouhou dobu a paraneoplastické syndromy budou mít spíše chronický charakter. Pokud by tedy GBS jako akutně probíhající syndrom byl projevem paraneoplastické manifestace, byl by pravděpodobně ve velmi časných stadiích maligního bujení a mohl by předcházet klinickým známkám nádoru i o několik let. Dalším možným mechanizmem, jak by nádor mohl indukovat GBS, je snížení imunitního dozoru (imunosurveillance) organizmu [3].
V největší retrospektivní studii, která analyzovala současný výskyt malignity u 435 nemocných s GBS [3], a to šest měsíců před určením diagnózy GBS nebo po něm, bylo nádorové onemocnění zjištěno u devíti z nich. Ve třech případech se jednalo se o nemalobuněčný karcinom plic, dále bylo popsáno po jednom případu karcinomu ledviny, jícnu, hlasivek, lymfomu Hodgkinova typu, chronické lymfocytární leukemie a neurčené metastázy. Tento výskyt více než dvojnásobně převyšoval očekávanou incidenci, odds ratio bylo 2,37–2,43. Nedostatkem studie je kromě jejího retrospektivního charakteru také příliš krátká doba sledování po vzniku GBS, a to šest měsíců. Lze předpokládat, že analogicky jako u jiných paraneoplastických syndromů by paraneoplastický GBS mohl objevení malignity předcházet i o několik let.
I v jiných studiích zaměřených na epidemiologii GBS se můžeme setkat s výskytem GBS u pacientů s maligními nádory [4–6]. Ani z těchto studií však jednoznačně nevyplývá, zda maligní nádor byl příčinou GBS, nebo se jednalo o koincidenci nádoru a GBS.
Z dostupných literárních dat i našeho sdělení jednoznačně nevyplývá, zda v případě diagnózy GBS je opodstatněné jednorázové onkologické skríningové vyšetření či dokonce dlouhodobé sledování pacienta. V publikacích, které popisují výskyt GBS jako paraneoplastického syndromu, se uvádí, že tato etiologie může tvořit 1,7–2,1 % ze všech případů GBS [3,7]. V našem případě bylo vzhledem k průběhu ne zcela typickému pro GBS s pozdní a atypicky rychlou remisí motorického deficitu i opakovaným uroinfektům provedeno onkologické skríningové vyšetření, které odhalilo renální karcinom. Lze spekulovat, zda v dalším průběhu neuropatie nebude nutné onemocnění klasifikovat jako A-CIDP, u které již asociace s malignitou není vzácná a kde onkologické skríningové vyšetření se zaměřením především na lymfom je třeba provádět rutinně [8]. Pro GBS by svědčil monofázický průběh onemocnění, po kterém došlo k úpravě neurotopického deficitu téměř do normy a ustoupily i elektrofyziologické známky multifokální demyelinizace. Pro A-CIDP by svědčil protrahovaný průběh onemocnění, který však ještě nesplnil časová kritéria pro CIDP [9], a dále možný, avšak sporný efekt kortikoterapie. Proto se v současnosti přikláníme k názoru, že se jednalo o atypický průběh GBS.
Řada publikací se věnuje problematice rozdílů mezi recidivující GBS (GBS – TRF neboli GBS Treatement Related Fluctuation) a CIDP s akutním začátkem (A-CIDP) [9–11]. V některých případech byli pacienti zpočátku vedeni pod diagnózou GBS posléze překlasifikováni na A-CIDP [11]. Za A-CIDP můžeme považovat případy, u kterých zhoršování trvá déle než osm týdnů nebo u kterých se objeví více než třikrát exacerbace choroby [9]. Z průzkumu vyplývá, že pacienti s A-CIDP většinou nemají tak závažný průběh choroby jako pacienti s GBS-TRF [9]. Existuje ojedinělé sdělení prokazující selektivní zhoršení funkce Fas-receptoru a Fas-ligandu (CD95 a CD95L) u A-CIDP oproti GBS [12]. Dle dostupných literárních zdrojů GBS-TRF tvoří asi 8–16 % ze všech případů GBS a A-CIDP tvoří asi 13 % ze všech případů CIDP [10]. V literatuře můžeme nalézt ojedinělé sdělení, že paraneoplastická etiologie tvoří 10,5 % případů CIDP [7]. Dále můžeme najít údaj, že až u 50 % pacientů s osteosklerotickou formou plazmocytomu se může vyskytnout onemocnění typu CIDP [13].
Závěrem lze shrnout, že u GBS s typickým průběhem není spolehlivě dokumentována možnost paraneoplastické etiologie, a tedy ani nutnost rutinního provedení onkologického skríningu u této diagnózy. V případě atypického průběhu ukazujícího na možnost CIDP s akutním začátkem je pravděpodobnost výskytu malignity větší, avšak diferenciální diagnostika oproti GBS není dosud spolehlivá. U CIDP byla paraneopastická etiologie prokázána především v souvislosti s hematoonkologickými malignitami, a proto případný onkologický skríning je třeba zaměřit zejména tímto směrem.
MUDr. Lubomír Večeřa
Neurologická klinika LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: lubomir.vecera@gmail.com
Přijato k recenzi: 17. 5. 2011
Přijato do tisku: 7. 6. 2011
Sources
1. Graus F, Delattre JY, Antoine JC, Dalmau J, Giometto B, Grisold W et al. Recommended diagnostic criteria for paraneoplastic neurological syndromes. J Neurol Neurosurg Psychiatry 2004; 75(8): 1135–1140.
2. Bednařík J, Voháňka S, Ehler E, Ambler Z, Piťha J, Veckovský J et al. Standard pro léčbu pacientů s autoimunitními nervosvalovými onemocněními intravenózním lidským imunoglobulinem a plazmaferézou. Cesk Slov Neurol N 2010; 73/106(5): 579–589.
3. Vigliani MC, Magistrello M, Polo P, Mutani R, Chiò A. Risk of cancer in patients with Guillain-Barré syndrome (GBS). A population-based study. J Neurol 2004; 251(3): 321–326.
4. Emilia-Romagna Study Group on Clinical and Epidemiological Problems in Neurology. A prospective study on the incidence and prognosis of Guillain--Barré syndrome in Emilia-Romagna region, Italy (1992–1993). Neurology 1997; 48(1): 214–221.
5. Kennedy RH, Danielson MA, Mulder DW, Kurland LT. Guillain-Barré syndrome: a 42-year epidemiologic and clinical study. Mayo Clin Proc 1978; 53(2): 93–99.
6. Halls J, Bredkjaer C, Friis ML. Guillain-Barré syndrome: diagnostic criteria, epidemiology, clinical course and prognosis. Acta Neurol Scand 1988; 78(2): 118–122.
7. Antoine JC, Mosnier JF, Absi L, Convers P, Honnorat J, Michel D. Carcinoma associated paraneoplastic peripheral neuropathies in patients with and without anti-onconeural antibodies. J Neurol Neurosurg Psychiatry 1999; 67(1): 7–14.
8. Viala K, Behin A, Maisonobe T, Leger JM, Stojkovic T, Davi F et al. Neuropathy in lymphoma: a relationship between the pattern of neuropathy, type of lymphoma and prognosis? J Neurol Neurosurg Psychiatry 2008; 79(7): 778–782.
9. Ruts L, Drenthen J, Jacobs B, van Doorn P. Distinguishing acute-onset CIDP from fluctuating Guillain--Barre syndrome: a prospective study. Neurology 2010; 74(21): 1680–1686.
10. Ruts L, van Koningsveld R, van Doorn PA. Distinguishing acute-onset CIDP from Guillain-Barré syndrome with treatment related fluctuations. Neurology 2005; 65(1): 138–140.
11. Hantson P, Kevers L, Fabien N, Van Den Bergh P. Acute-onset chronic inflammatory demyelinating polyneuropathy with cranial nerve involvement, dysautonomia, respiratory failure, and autoantibodies. Muscle Nerve 2010; 41(3): 423–426.
12. Comi C, Osio M, Ferretti M, Mesturini R, Cappellano G, Chiocchetti A et al. Defective Fas-mediated T-cell apoptosis predicts acute onset CIDP. J Peripher Nerv Syst 2009; 14(2): 101–106.
13. Latov N. Pathogenesis and therapy of neuropathies associated with monoclonalgammopathies. Ann Neurol 1995; 37 (Suppl 1): S32–S42.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2012 Issue 1
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Memantine Eases Daily Life for Patients and Caregivers
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
-
All articles in this issue
- Vertebroplastika – možnost léčby strukturálně narušených obratlů
- Multimodální neurozobrazování pomocí simultánního EEG-fMR
- Sonotrombolýza – mechanizmus účinku a její využití v léčbě ischemické cévní mozkové příhody
- Laboratorní disekce drah laterálního aspektu mozkové hemisféry
- Variabilita genu pro angiotenzinogen a vnímavost k roztroušené skleróze
- Karpální tunel a neurochirurg – zkušenosti po 2 200 operacích
- Zrakové funkce nedonošených dětí s perinatálním mozkovým postižením
- Neurologická profesionální onemocnění v České republice v letech 1994–2009
- Rekanalizace akutních uzávěrů mozkových tepen pomocí retrahovatelného stentu
- Paraneoplastická polymyozitida u karcinomu prostaty – kazuistika
- Kazuistika Guillainova-Barrého syndromu u pacienta s renálním karcinomem
- Diagnosticky specifické nálezy při posturografickém vyšetření – dvě kazuistiky
- Klinický standard pro farmakoterapii neuropatické bolesti
- Diabetes a schizofrenie
- Dětská intrakraniální aneuryzmata
- Správnost přednemocniční diagnózy cévní mozkové příhody
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Vertebroplastika – možnost léčby strukturálně narušených obratlů
- Karpální tunel a neurochirurg – zkušenosti po 2 200 operacích
- Kazuistika Guillainova-Barrého syndromu u pacienta s renálním karcinomem
- Klinický standard pro farmakoterapii neuropatické bolesti
