Gliom vyššího stupně kaudální oblasti míchy imitující myelitidu – kazuistika
High-Grade Glioma of the Caudal Part of the Spinal Cord Mimicking Myelitis – a Case Report
Spinal cord glioblastomas are very rare tumours constituting only about 1.5% of all primary spinal cord malignancies. This case report presents a 20-year-old man with high-grade glioma of the caudal part of the spinal cord. Progression and magnetic resonance imaging (MRI) finding were atypical with rapidly advancing secondary changes to the spinal cord. The outcome was fatal. The patient was admitted with a history of two-month progression of weakness and numbness of the lower limbs. Low-grade glioma of the spinal cord was suspected. MRI of the spinal cord had repeatedly been interpreted as myelitis. A finding of pleocytosis in the cerebrospinal fluid supported the hypothesis of inflammatory aetiology. Atypical cells with malignant characteristics were found in the cerebrospinal fluid. Antibiotics, antiviral drugs and corticosteroids were administrated. Nevertheless, clinical and MRI findings progressively deteriorated. Because intradural haematoma was suspected, surgical decompression was performed five days after admission. Histological examination of the removed tissue corresponded to anaplastic astrocytoma converted into glioblastoma. Over the next few days, the patient developed respiratory insufficiency requiring artificial lung ventilation. The patient died of septic shock resulting from ventilator-associated pneumonia two days after the diagnosis, the 11th day of hospitalization. Autopsy confirmed glioma that, however, was localized in the caudal part of the spinal cord only. Only secondary changes – oedema and segmental haemorrhage – occurred in the remaining part of the spinal cord up to the medulla oblongata. There was no confirmed meningeal infiltration despite the presence of tumour cells in the cerebrospinal fluid.
Key words:
spinal cord high-grade glioma – myelitis
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Accepted for review:
10. 5. 2012
Accepted for publication:
2. 8. 2012
Authors:
M. Škorňa 1; J. Bednařík 1,2; M. Smrčka 3; P. Štourač 1,2; C. Macháček 4; A. Šprláková-Puková 5; P. Krupa 6
Authors‘ workplace:
Neurologická klinika LF MU a FN Brno
1; CEITEC MU, Brno
2; Neurochirurgická klinika LF MU a FN Brno
3; Ústav patologie LF MU a FN Brno
4; Radiologická klinika LF MU a FN Brno
5; SurGal Clinic, Brno
6
Published in:
Cesk Slov Neurol N 2013; 76/109(1): 104-109
Category:
Case Report
Overview
Glioblastomy míchy patří mezi velmi vzácné nádory tvořící pouze kolem 1,5 % všech primárních nádorů míchy. Tato kazuistika prezentuje případ 20letého muže s high-grade gliomem kaudální oblasti míchy atypického průběhu a obrazu na magnetické rezonanci (MR) s rychle postupujícími sekundárními změnami míchy a fatálním zakončením. Pacient byl přijat pro dva měsíce se zhoršující slabost a poruchu čití dolních končetin s podezřením na míšní low-grade gliom. MR míchy byla opakovaně hodnocena jako myelitida. Nález pleocytózy v likvoru podpořil hypotézu o zánětlivé etiologii. V likvoru byly však nalezeny i atypické buňky maligního charakteru. Byla nasazena antibiotická a antivirotická medikace a kortikoidy. Klinický obraz a nález na MR nicméně dále ascendentně postupoval. Za pět dnů od přijetí byla provedena pro suspicium na intradurální hematom v rozsahu 1. bederního až přechodu 3. a 4. bederního obratle (L1–L3/4) operační revize a dekomprese, histologické vyšetření odebraných hmot však odpovídalo diagnóze anaplastického astrocytomu s přechodem do glioblastomu. V dalším průběhu došlo u pacienta postupně k rozvoji respirační insuficience s nutností umělé plicní ventilace. Dva dny od stanovení diagnózy, 11. den hospitalizace, pacient zemřel na septický šok při ventilátorové pneumonii. Pitva následně potvrdila výše zmíněný typ nádoru lokalizovaný však pouze v kaudální oblasti míchy. Ve zbylé části míchy až po oblongatu byly nalezeny pouze sekundární změny – edém a úsekovité prokrvácení. I přes nález nádorových buněk v likvoru nebyla při sekci potvrzena infiltrace mening.
Klíčová slova:
high-grade gliom míchy – myelitida
Úvod
Gliomy patří mezi neuroektodermální nádory, které se nacházejí v míšní lokalizaci poměrně vzácně. Tvoří pouze 22 % všech primárních nádorů míchy – 63 % z nich pak představují ependymomy, 25 % astrocytomy a jenom 7 % glioblastomy (tj. pouze asi 1,5 % všech primárních nádorů míchy) [1]. Ve více než 60 % případů jsou glioblastomy lokalizovány v cervikální či cervikotorakální oblasti, výjimečně se vyskytují v oblasti míšního konu [2].
Prognóza maligních gliomů CNS je obecně infaustní. U míšních maligních gliomů je medián přežití udáván okolo pouhých 10 měsíců [3–5]. Celkové pětileté přežití závisí obecně především na gradu, věku a chirurgické léčbě. Nízký grade, nižší věk a chirurgická léčba znamenají lepší prognózu. Celkové pětileté přežití je u míšních astrocytomů grade III 28 % a grade IV 14 % [4].
Kazuistika
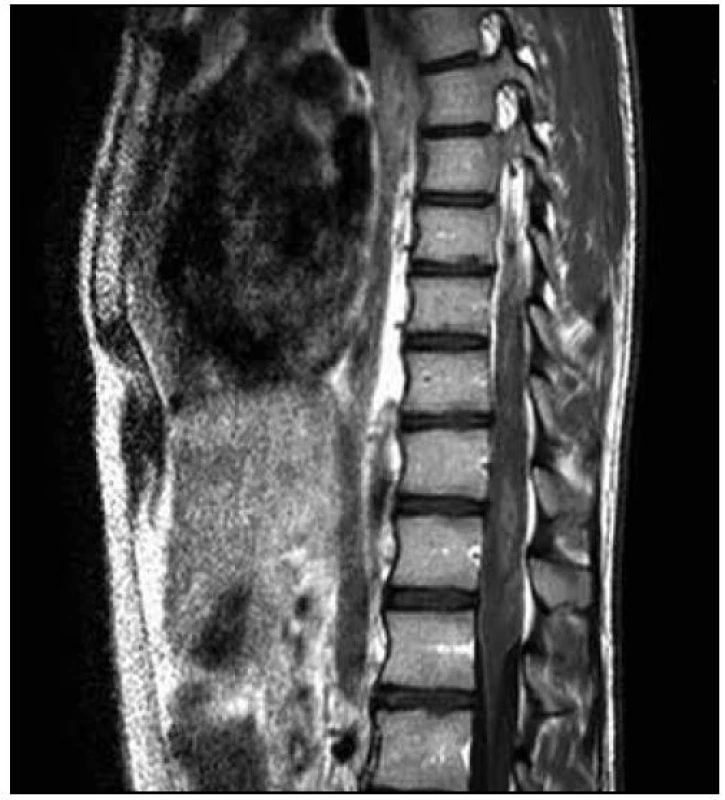
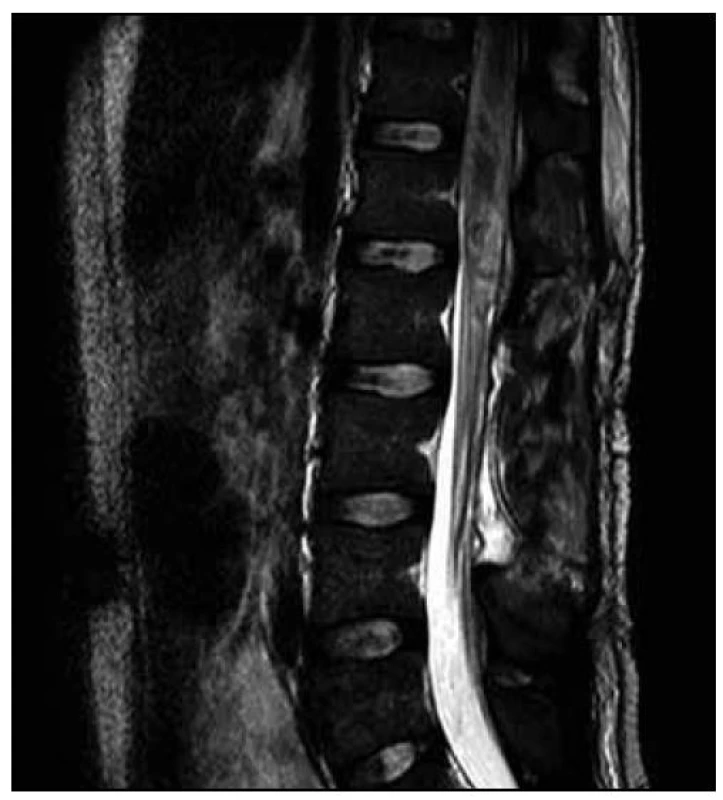
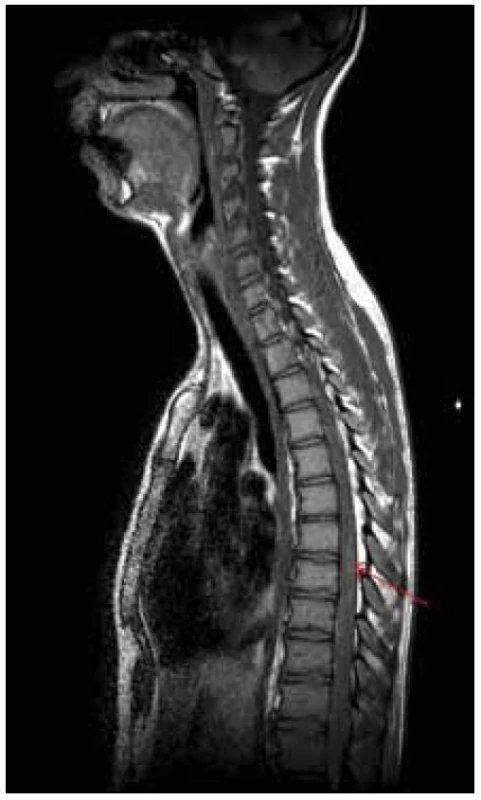
U dvacetiletého muže došlo v průběhu dvou měsíců k horšení hybnosti a čití dolních končetin. Na ambulantně provedené MR páteře v rozsahu 9. hrudního až 3. křížového obratle (Th9–S3) byl nalezen patologický signál v oblasti míšního konu (obr. 1). Následujícího dne byla doplněna MR mozku (nález v mezích normy) a MR celé páteře, kde byl patrný celý rozsah patologického T2 hyperintenzního ložiska, které sahalo od obratle Th 8 až po míšní konus (obr. 2). Po aplikaci kontrastní látky k sycení nedošlo (obr. 3). Nález byl vyhodnocen na prvním místě jako gliom prvního stupně.
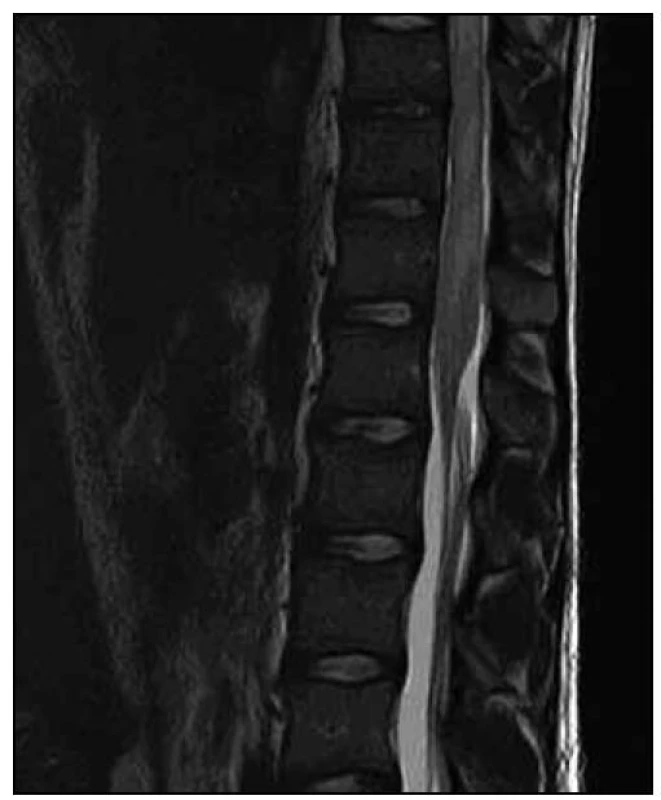
Při přijetí na Neurologickou kliniku LF MU a FN Brno byla přítomna v neurotopickém nálezu paraparéza dolních končetin těžkého stupně s levostrannou akcentací, taktilní hypestezie vpravo od Th10 kaudálně, vlevo od Th8 kaudálně, areflexie L2–L4, hyperreflexie L5–S2, patologické reflexy na dolních končetinách nebyly přítomny. Dále byly zaznamenány i sfinkterové dysfunkce (porucha iniciace močení a zácpa).
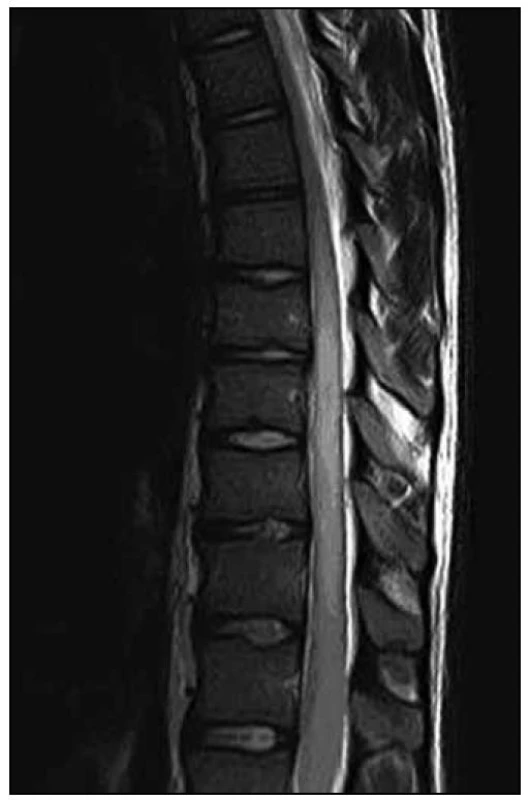
Provedli jsme další MR hrudní a bederní páteře (odstup od minulého ambulantního vyšetření byl 12 dnů), na kterém bylo nově patrno postkontrastní nesouvislé sycení od Th8 po L1. Dále bylo zachyceno výraznější sycení plen zejména v rozsahu od Th7 kaudálně. Rozsah patologických změn byl pak neměnný. Na DWI a ADC mapách nebyly nalezeny známky restrikce difuze. Tumorózní postižení jsme vzhledem k rychlé dynamice změn považovali za téměř nepravděpodobné a nález jsme hodnotili jako myelitidu (obr. 4, 5).
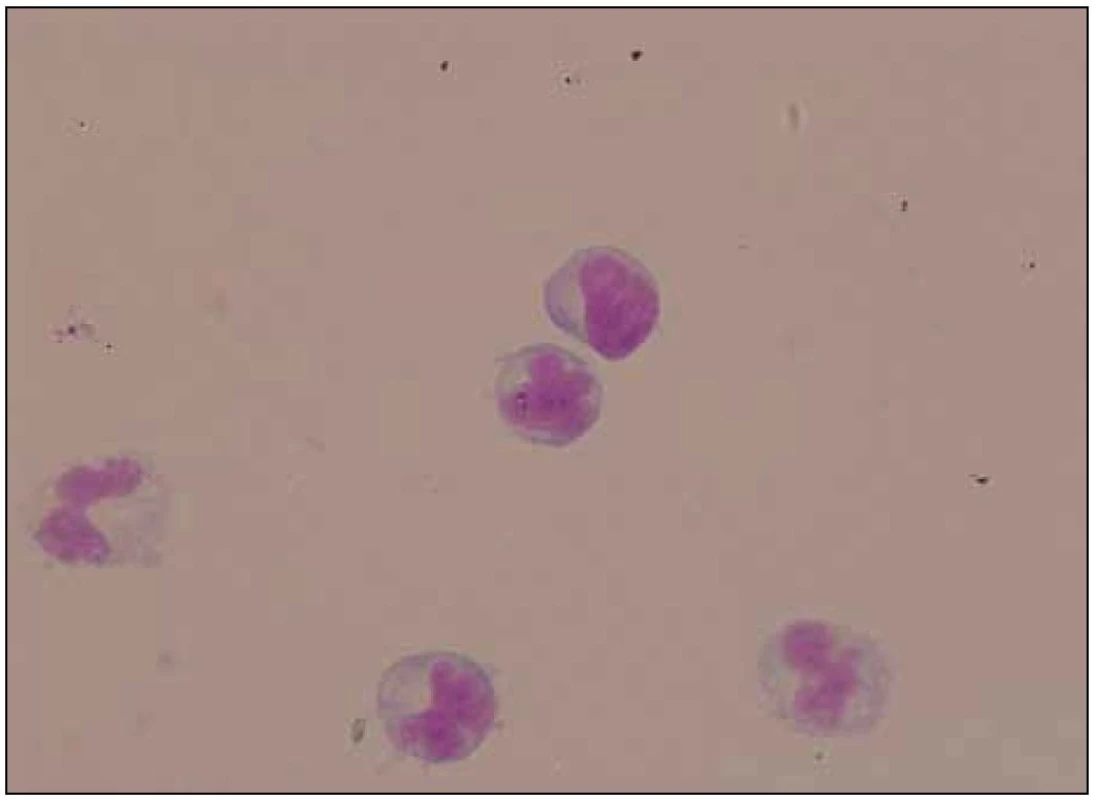
Lumbální punkce odhalila pleocytózu s nálezem 52 mononukleárů, 2 polynukleárů a 1 erytrocytu na 1 μl likvoru, byla přítomna vysoká koncentrace celkové bílkoviny (5,74 g/l) a výrazně zvýšený albuminový kvocient (109,9). Kvalitativní cytologie objevila i suspektní maligní buňky, které však byly primárně hodnoceny pouze jako atypické buňky s laločnatými jádry (obr. 6). Žádné infekční agens nebylo v likvoru, přímo či nepřímo, prokázáno.
Na základě likvorového a radiologického nálezu byla zahájena intravenózní terapie metylprednizolonem v dávce 1 g denně, aciklovirem a ceftriaxonem.
I přes zahájenou protizánětlivou a antimikrobiální terapii došlo k dalšímu nárůstu neurologického deficitu. Za čtyři dny od počátku hospitalizace byla přítomna již paraplegie dolních končetin, anestezie od Th5 distálně a došlo i ke zhoršení sfinkterových funkcí (inkontinence moči a stolice).
Pro tuto rapidní deterioraci neurologického nálezu jsme opakovali lumbální punkci a MR hrudní a bederní páteře.
V kontrolním likvoru jsme nalezli 40 mononukleárů, 220 polynukleárů a 17 000 erytrocytů na 1 μl, celková bílkovina byla 27,8 g/l a albuminový kvocient 207,4. Pro nález alfa-hemolytického streptokoka byl do medikace přidán ciprofloxacin.
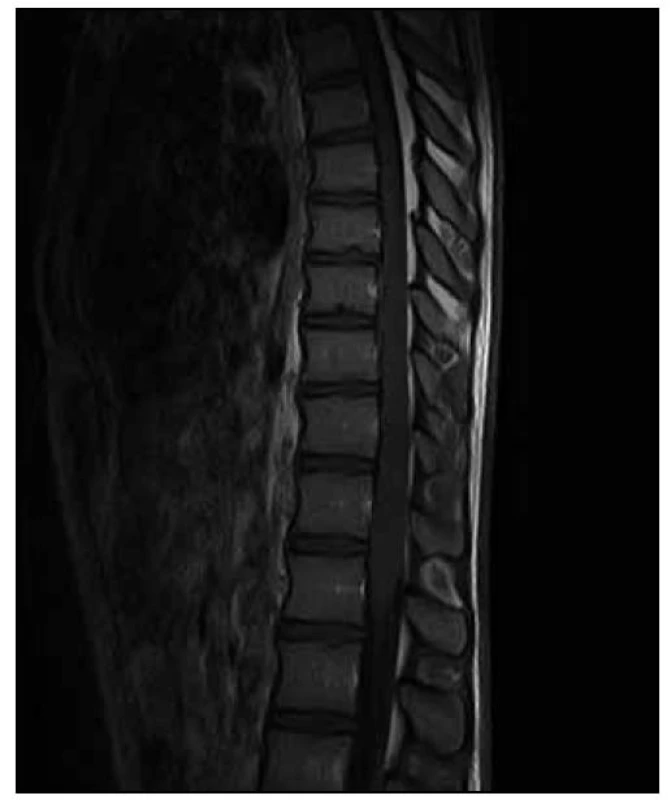
Na MR hrudní a bederní páteře byl na míše patrný (v korelaci s klinickým obrazem) posun patologických T2 a STIR signálových změn více rostrálně. V etáži L1–L3/4 dorzálně jsme nově nalezli vřetenovitou lézi velikosti 95 (kraniokaudálně) × 12 × 16 mm roztlačující kořeny a vyplňující téměř celý páteřní kanál. Tuto lézi jsme považovali za intradurální hematom (obr. 7–9).
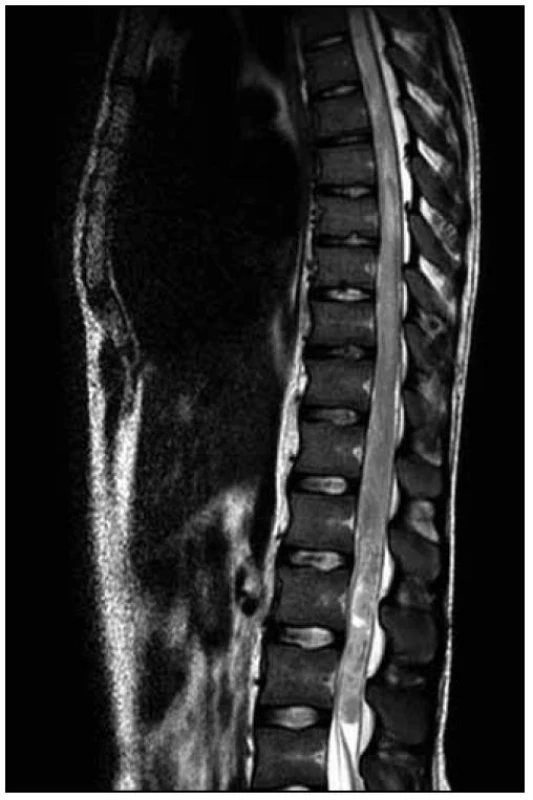
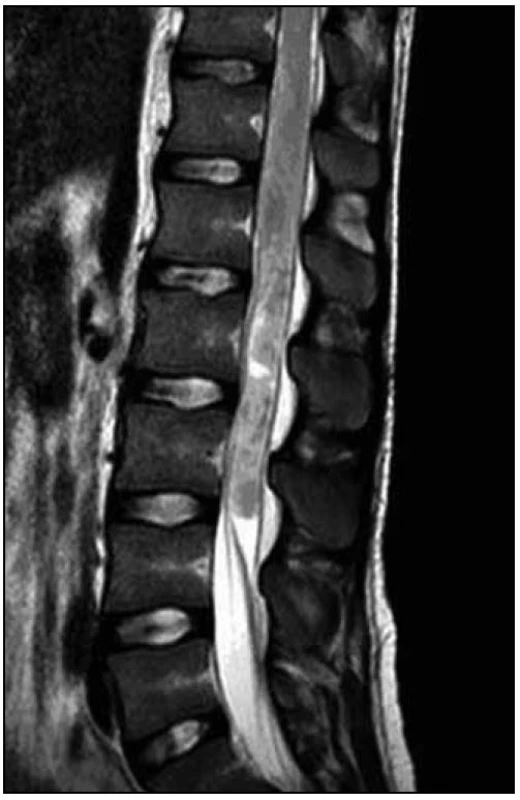
Tentýž den byla provedena dekomprese v oblasti L2–L3. Z laminektomie a durotomie v etáži L2–L3 byly odsáty masy intradurálních hmot charakteru zvláštní šedofialové masy, která místy připomínala nekrotický tumor, místy byla natolik tekutá, že připomínala hnis.
V této fázi jsme vzhledem k průběhu a klinickému obrazu zvažovali extrémně vzácný myelosarkom páteřního kanálu. Byla provedena sternální punkce k vyloučení systémové akutní hemoblastózy – akutní myeloidní leukemie, se kterou bývá myelosarkom nejčastěji asociován [6].
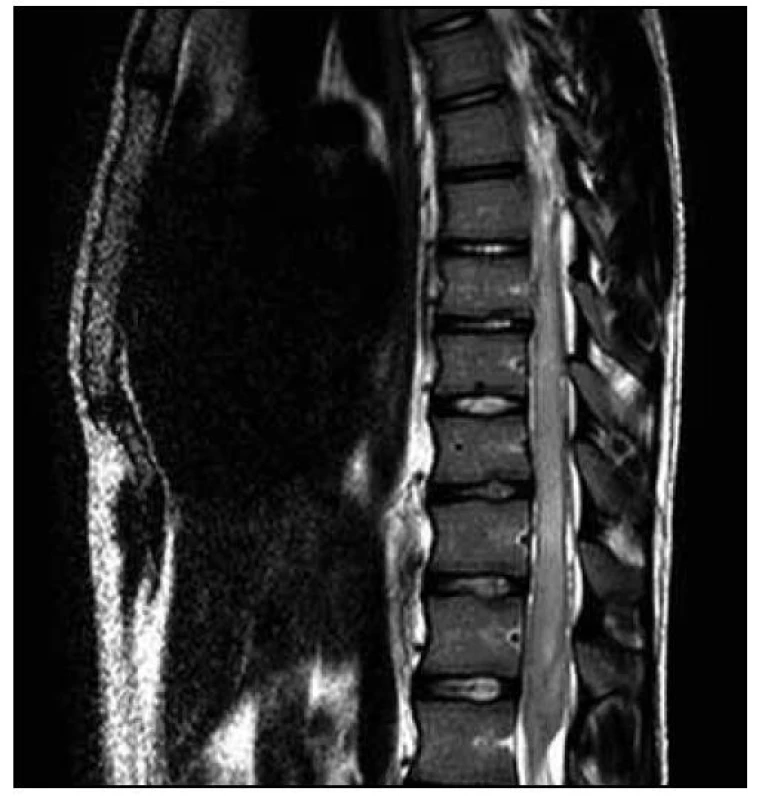
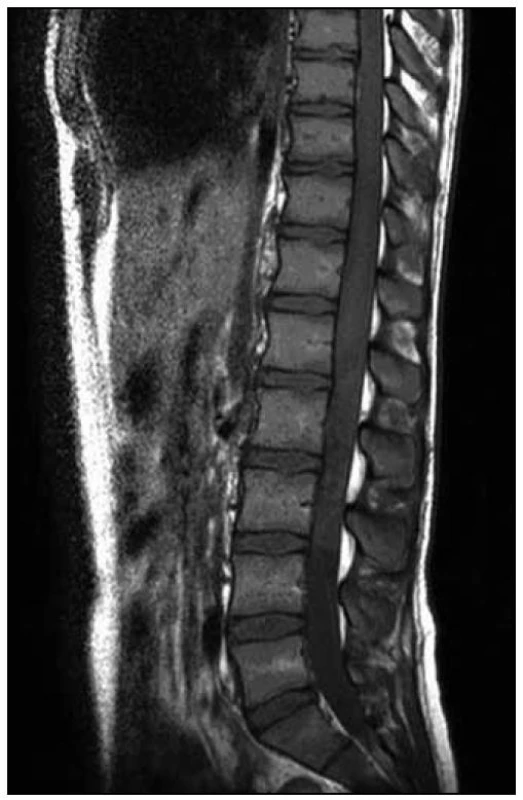
Po operaci byla provedena kontrolní MR páteře. Opět byl nalezen posun patologického signálu rostrálně – nyní od 3. krčního obratle (C3) až po konus míšní, postkontrastně se pak nesouvisle sytila oblast C3–L1. Bylo přítomno i výraznější sycení plen v rozsahu od C3 kaudálně. V etáži L1–L2 bylo patrno intraspinální reziduum patologické kolekce vřetenovitého tvaru. Patologické změny v míše byly opět hodnoceny na prvním místě jako myelitida (obr. 10–13).
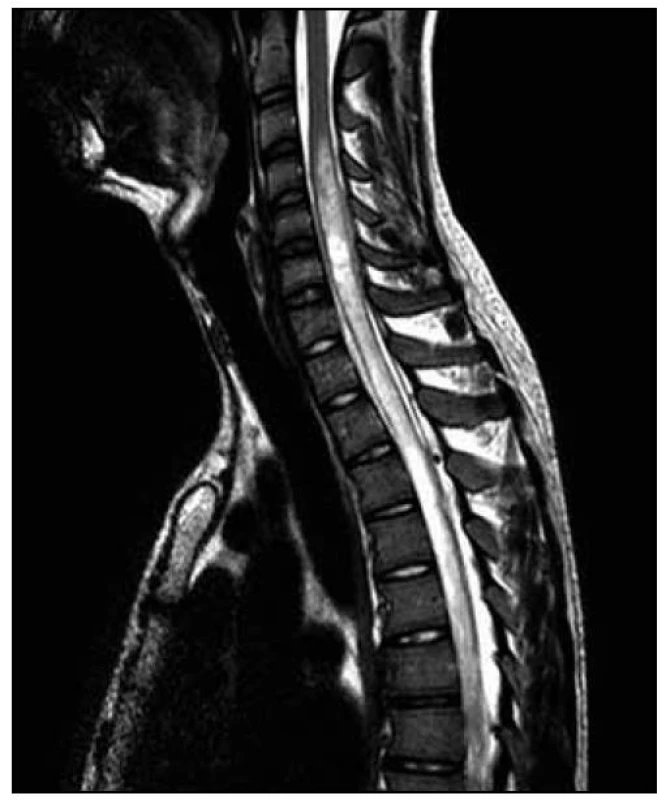

Neurologický deficit v korelaci s MR nálezem velmi rychle postupoval rostrálně. K paraplegii dolních končetin se přidala paraparéza horních končetin těžkého stupně. Došlo k rozvoji dušnosti a respirační insuficienci s nutností řízené ventilace a pacient byl přeložen k další péči na kliniku anesteziologie, resuscitace a intenzivní medicíny.
Za čtyři dny od operace byl již k dispozici výsledek histologického vyšetření se závěrem anaplastický astrocytom v přechodu do glioblastomu (tedy gradus III–IV).
I přes velmi nepříznivou prognózu (vzhledem k histologickému typu nádoru, rozsahu postižení a celkovému stavu pacienta) byla plánována radioterapie s konkomitantní chemoterapií (temozolomid). Radioterapie a chemoterapie však již neproběhly. U pacienta došlo k rozvoji ventilátorové pneumonie s rychlým postupem do septického šoku s multiorgánovým selháním (respiračním, oběhovým a renálním). Pacient zemřel 11 dnů od přijetí na neurologickou kliniku, šest dnů od operace.
Pitva potvrdila výše zmíněný typ nádoru – anaplastický astrogliální tumor s rysy glioblastomu. Nádorové ložisko bylo nalezeno pouze v oblasti míšního konu a drobný fokus nádorové tkáně ještě 2,5 cm nad míšním konem. Ve zbylém úseku míchy v celém rozsahu až po oblongatu byly nalezeny pouze sekundární změny – edém a úsekovité prokrvácení. Postižení mening tumorem, i přes nález nádorových buněk v likvoru a sycení plen na MR po podání kontrastní látky, nebylo prokázáno.
Diskuze
Výše uvedený případ poukazuje na komplikovanou diferenciální diagnostiku míšních tumorů. Nejproblematičtější pak bývá především odlišení od léze zánětlivého charakteru.
Existují četné zmínky v literatuře, kdy byly nádory CNS nesprávně diagnostikovány jako léze netumorózní. Nejčastěji byly tyto léze označeny za zánětlivé (ve vzácných případech však i nezánětlivé) a takto také léčeny. Správná diagnóza pak byla většinou stanovena až na základě dalšího postupu onemocnění i přes zavedenou léčbu, kdy byla doplněna další vyšetření (biopsie), která tumorózní charakter onemocnění ozřejmila. Nezřídka byla správná diagnóza zjištěna až post mortem při pitvě. Nejčastěji k omylům v diagnostice tumorů CNS dochází u nádorů extrémně vzácných, a to u gliomatózy míchy a mozku (s přítomností leptomeningeálních metastáz či bez nich) a u primární leptomeningeální gliomatózy.
Zde uvádíme příklady některých diagnostických omylů: maligní míšní astrocytom grade IV zaměněn za tuberkulózu [3]; gliomatóza míchy s leptomeningeálním rozsevem zaměněna za tuberkulózu [7]; míšní low-grade gliom s leptomeningeálním rozsevem zaměněn za tuberkulózu [8]; míšní pilocytický astrocytom zaměněn za demyelinizační onemocnění [9]; gliomatóza míchy a mozku zaměněna za roztroušenou sklerózu [10]; míšní fibrilární astrocytom grade III zaměněn nejdříve za benigní intrakraniální hypertenzi, následně pak za Devicův syndrom [11]; primární leptomeningeální gliomatóza mozku a míchy zaměněna za virovou encefalitidu [12]; gliomatóza míchy a mozku s leptomeningeálním rozsevem zaměněna i přes provedenou míšní biopsii za mykotickou a bakteriální infekci neznámé etiologie [7]; primární leptomeningeální gliomatóza mozku a míchy zaměněna za neurosarkoidózu [13]; mozkomíšní gliomatóza zaměněna za motor neuron disease [14]; míšní glioblastom zaměněn za herniaci disku L1/L2 [2].
Obtížná diferenciální diagnóza míšních nádorů je dána především skutečností, že výsledky vyšetření standardně prováděných při diagnostice jsou nespecifické a mnohdy nelze s jistotou usuzovat na etiologii míšní léze. Jistý podíl má i fakt, že míšní nádory jsou poměrně vzácné onemocnění a na jejich diagnózu se málo pomýšlí. Tak je tomu především však u těch, které imitují jak svým průběhem, tak i nálezem na zobrazovacích vyšetřeních netumorózní lézi.
Klinický obraz míšních nádorů je zcela nespecifický. Většinou se manifestují syndromem transverzální míšní léze – parézy, poruchy čití a sfinkterové dysfunkce, mohou být přítomny bolesti zad. Ve vzácných případech se může míšní nádor klinicky projevit pouze syndromem nitrolební hypertenze [11,15]. Při negativním nálezu na MR mozku a v likvoru pak může být nesprávně diagnostikována benigní intrakraniální hypertenze.
Vyšetření mozkomíšního moku je též nespecifické. Může být zvýšený likvorový tlak a hyperproteinorachie. Hlavní příčinou elevace celkové bílkoviny je porušená cirkulace likvoru navozená tumorem, v menší míře se mohou uplatnit i jiné mechanizmy [11]. Dále může být přítomna pleocytóza způsobená především doprovodnou zánětlivou infiltrací u nádorového onemocnění, případně krvácením z nádoru [12]. Vždy je nutno v likvoru pátrat po nádorových buňkách. Jejich výskyt může být zachycen především u sekundárního leptomeningeálního rozsevu, který je nejčastěji popisován u high-grade gliomů a leptomeningeální karcinomatózy. Sekundární leptomeningeální gliomatóza je poměrně vzácná komplikace gliomů CNS – u high-grade gliomů je udávána ve 2–7 % případů, post mortem je pak mikroskopická leptomeningeální diseminace prokázána až ve 27 % [16]. Ve vzácných případech byl leptomeningeální rozsev popsán i u míšních low-grade gliomů [8,17]. Často však bývá likvor stran nádorové cytologie negativní. Senzitivita by pak mohla být zvýšena opakováním lumbální punkce a průkazem GFAP, který by odhalil gliální původ buněk. U primární leptomeningeální gliomatózy jsou nádorové buňky zachyceny v mnohem menší míře [12,13,16].
V našem případu byla v úvodu přítomna mononukleární pleocytóza, která nás zpočátku utvrdila v zánětlivé etiologii míšní léze. Buňky podezřelé z nádorové transformace byly nalezeny, přesto nás ke správné diagnóze nedovedly. Primárně byly hodnoceny pouze jako atypické a k jejich přehodnocení na buňky nádorové došlo až zpětně po stanovení definitivní diagnózy.
Pomocí MR vyšetření též nelze definitivní diagnózu stanovit. Na MR se míšní gliomy v 95 % sytí. V našem případě se ložisko po aplikaci kontrastní látky při druhém MR vyšetření vůbec nesytilo, při následujícím MR vyšetření došlo k poměrně rozsáhlému sycení na více úrovních. Vzhledem k této dynamice sycení a rychlé deterioraci klinického stavu byl nález na MR opakovaně považován za změny zánětlivé. V tom nás ujišťoval i další rychlý vývoj změn s prokrvácením a ischemizací. Při zpětném hodnocení MR je patrný jasný rozpad míchy v oblasti míšního konu na podkladě tumoru. Tyto hmoty jsme původně považovali za krvácení – koagula.
MR obraz je nutno hodnotit velmi obezřetně a vždy zvažovat i jinou etiologii než tu, která se nabízí jako první. MR má však samozřejmě mimo jiné nezastupitelnou lokalizační roli, a umožňuje tak správné naplánování biopsie. I když ani toto neplatí ve všech případech. Je známo, že rozsah gliomatózy může být na MR podhodnocen [10].
Užitečným vyšetřením, které může pomoci diagnostikovat tumory CNS, je MR spektroskopie. V oblasti míchy je použití této metody extrémně problematické vzhledem k malému objemu, magneticky nehomogennímu prostředí a pulzatilnímu toku likvoru. Proto není možné dosáhnout takových výsledků jako u vyšetření mozku. Jsou však vyvíjeny nové metody MR spektroskopie, které se snaží minimalizovat negativní dopad těchto technických problémů a umožnit použití této metody i v diferenciální diagnostice míšních lézí [18]. Typickými spektroskopickými znaky pro neoplastické léze CNS jsou zvýšený poměr cholin/kreatin a cholin/N-acetylaspartát [10].
Rozhodující pro správnou diagnózu je biopsie. I ta však může být falešně negativní, a to i z oblastí, které jsou dle zobrazovacího vyšetření postiženy. Na možnost falešné negativity biopsie je třeba myslet obzvláště u gliomatózy mozku a míchy a primární leptomeningeální gliomatózy. Proto pokud přetrvává důvodné podezření na nádorové onemocnění, je nutno biopsii opakovat [13,16]. Správně indikovat biopsii míchy je však velmi problematické. Je nutno myslet na možnost iatrogenního poškození, jak zhoršení neurologického deficitu, tak jiných pooperačních komplikací. Autoři Cohen-Gadol et al uvádějí ve svém přehledu sice přijatelnou morbiditu (z 38 pacientů, kteří podstoupili míšní biopsii, došlo pouze u jednoho k výraznému zhoršení neurologického deficitu, u pěti pacientů k přechodnému zhoršení neurologického stavu a u dvou pacientů byla nutná reoperace pro komplikace v místě rány), ale i poměrně nízký diagnostický přínos (pouze u 26,3 % pacientů došlo k modifikaci léčby na základě výsledku míšní biopsie) [19]. Neexistují absolutní kritéria, kdy míšní biopsii indikovat. Obecně se dá říci, že provedení míšní biopsie je oprávněno v případech, kdy ostatní diagnostické přístupy jsou nekonkluzivní a dochází k další rychlé deterioraci neurologického nálezu, a to i přes zavedenou empirickou léčbu (imunosupresivní, antimikrobiální). Profitovat z provedené míšní biopsie mohou především pacienti s neoplastickou lézí, kdy následuje resekce nádoru, případně radioterapie. I pro pacienty s nenádorovou lézí může být míšní biopsie prospěšná. Jako příklad lze uvést dekompresi a výběr správné antimikrobiální léčby u pacientů s tuberkulózou a mykotickou či parazitární infekcí [19]. Dalším přínosem může být zastavení neefektivní a potenciálně škodlivé terapie. Autoři Cohen-Gadol et al popisují ukončení agresivní kortikosteroidní (u 10 z 38 pacientů) a empirické antibiotické léčby (u 3 z 38 pacientů) na základě míšní biopsie [19].
V našem případu jsme správnou diagnózu stanovili až na základě histologického vyšetření exstirpované tkáně. Vzhledem k nálezu nádorových buněk v likvoru a extrémně rychlému postupu onemocnění jsme pomýšleli na diagnózu míšní gliomatózy s přítomností leptomeningeálního rozsevu. Difuzní infiltrace celé míchy nádorovými buňkami v rámci míšní gliomatózy nemusela být na prvních MR vyšetřeních zobrazena (rozsah gliomatózy může být na MR podhodnocen) a spolu s leptomeningeálním rozsevem mohly být příčinou vzniku extrémně rychlých sekundárních změn v celé míše. Výsledek patologického vyšetření, nález nádorových buněk pouze v kaudální oblasti míchy, byl proto do značné míry překvapivý. Vysvětlení pro sekundární změny celé míchy není zcela jasné. V dostupné literatuře jsme nalezli pouze jedinou kazuistiku podobající se té naší co do rychlosti průběhu onemocnění (rozvoj paraplegie a poruchy čití od Th4 kaudálně za 5–6 týdnů) a přítomnosti výrazného doprovodného míšního edému. Jedná se o případ devatenáctiletého muže s maligním astrocytomem grade IV v rozsahu Th7–Th10 a s rostrálně lokalizovaným rozsáhlým edémem, jehož příčinou byl míšní infarkt při cévních trombózách [3]. U našeho pacienta nebyly cévní trombotizace nalezeny, nebyla přítomna ani restrikce difuze (která je pro míšní ischemii typická) při prvním MR vyšetření na našem pracovišti. Přesto se však domníváme, že příčinou výše popsaných rychle postupujících sekundárních změn míchy by mohla být právě míšní ischemizace způsobená poruchou arteriálního zásobení a zhoršením venózního odtoku.
Závěr
Diferenciální diagnóza míšních tumorů může být velmi svízelná, především odlišení od zánětlivých lézí. Diagnostiku ztěžuje nespecifický klinický obraz, likvorový a MR nález. Pro správnou diagnózu může být cenný nález nádorových buněk v likvoru a nápomocná, především v budoucnu, může být i MR spektroskopie. Zejména je ale nutno na onkologickou diagnózu myslet, i když MR nález svědčí spíše pro zánětlivou etiologii, obzvláště pak u lézí nereagujících na empirickou terapii, a při důvodném podezření včas indikovat biopsii (i opakovaně), která je pro definitivní diagnózu míšního tumoru rozhodující.
Správná a především včasná diagnostika je esenciální i přes velmi špatnou prognózu některých typů míšních tumorů, obzvláště high-grade gliomů, gliomatózy míchy a primární leptomeningeální gliomatózy. I u těchto nepříznivých typů nádorů byla však zaznamenána při včasně zahájené terapii remise [13,16,17].
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
MUDr. Miroslav Škorňa
Neurologická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: mskorna@seznam.cz
Přijato k recenzi: 10. 5. 2012
Přijato do tisku: 2. 8. 2012
Sources
1. Rodrigues GB, Waldron JN, Wong CS, Laperriere NJ. A retrospective analysis of 52 cases of spinal cord glioma managed with radiation therapy. Int J Radiat Oncol Biol Phys 2000; 48(3): 837–842.
2. Choi WC, Lee JH, Lee SH. Spinal cord glioblastoma multiforme of conus medullaris masquerading as high lumbar disk herniation. Surg Neurol 2009; 71(2): 234–237.
3. Lawson-Smith M, Samandouras G, Hinks T, Tan PL, Quaghebeur G, Mathews P et al. Spinal cord infarction caused by malignant intramedullary glioma: the traps of epidemiology and travel history. Br J Neurosurg 2004; 18(2): 199–200.
4. Milano MT, Johnson MD, Sul J, Mohile NA, Korones DN, Okunieff P et al. Primary spinal cord glioma: a Surveillance, Epidemiology, and End Results database study. J Neurooncol 2010; 98(1): 83–92.
5. Banczerowski P, Simó M, Sipos L, Slowik F, Benoist G, Veres R. Primary intramedullary glioblastoma multiforme of the spinal cord: report of eight cases. Ideggyogy Sz 2003; 56(1–2): 28–32.
6. Struhal W, Oberndorfer S, Lahrmann H, Lindeck--Pozza E, Hess B, Nussgruber V et al. Myeloid sarcoma in the central nervous system: case report and review of the literature. Acta Clin Croat 2008; 47(1): 19–24.
7. Meligonis G, Sur M, Ouma J, Grayson W, Farrell VJ. Gliomatosis of the brain and spinal cord masquerading as infective lesions. Surg Neurol 2002; 57(6): 399–404.
8. D’Haene N, Coen N, Neugroschl C, Balériaux D, Salmon I. Leptomeningeal dissemination of low-grade intramedullary gliomas: about one case and review. Clin Neurol Neurosurg 2009; 111(4): 390–394.
9. Saad A, Tuli S, Ali EN, Houtchens M, Delalle I, Kesari S. Pilocytic astrocytoma of the spinal cord in an adult. J Neurooncol 2008; 88(2): 189–191.
10. Yaguchi M, Nakasone A, Sohmiya M, Saitoh F, Ohya N, Yoshida T et al. Gliomatosis cerebri involving the lumbosacral spinal cord. Intern Med 2003; 42(7): 615–618.
11. Porter A, Lyons MK, Wingerchuk DM, Bosch EP. Spinal cord astrocytoma presenting as “idiopathic” intracranial hypertension. Clin Neurol Neurosurg 2006; 108(8): 787–789.
12. Riva M, Bacigaluppi S, Galli C, Citterio A, Collice M. Primary leptomeningeal gliomatosis: case report and review of the literature. Neurol Sci 2005; 26(2): 129–134.
13. Ko MW, Turkeltaub PE, Lee EB, Gonatas NK, Volpe NJ, Moster ML et al. Primary diffuse leptomeningeal gliomatosis mimicking a chronic inflammatory meningitis. J Neurol Sci 2009; 278(1–2): 127–131.
14. Schmidbauer M, Müller C, Podreka I, Mamoli B, Sluga E, Deecke L. Diffuse cerebrospinal gliomatosis presenting as motor neuron disease for two years. J Neurol Neurosurg Psychiatry 1989; 52(2): 275–278.
15. Vassilyadi M, Michaud J. Hydrocephalus as the initial presentation of a spinal cord astrocytoma associated with leptomeningeal spread. Pediatr Neurosurg 2005; 41(1): 29–34.
16. Knox MK, Ménard C, Mason WP. Leptomeningeal gliomatosis as the initial presentation of gliomatosis cerebri. J Neurooncol 2010; 100(1): 145–149.
17. Perilongo G, Gardiman M, Bisaglia L, Rigobello L, Calderone M, Battistella A et al. Spinal low-grade neoplasms with extensive leptomeningeal dissemination in children. Childs Nerv Syst 2002; 18(9–10): 505–512.
18. Henning A, Schär M, Kollias SS, Boesiger P, Dydak U. Quantitative magnetic resonance spectroscopy in the entire human cervical spinal cord and beyond at 3T. Magn Reson Med 2008; 59(6): 1250–1258.
19. Cohen-Gadol AA, Zikel OM, Miller GM, Aksamit AJ, Scheithauer BW, Krauss WE. Spinal cord biopsy: a review of 38 cases. Neurosurgery 2003; 52(4): 806–816.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2013 Issue 1
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Memantine Eases Daily Life for Patients and Caregivers
-
All articles in this issue
- Použití botulotoxinu v neurologii
- Národní registr cévních mozkových příhod (registr IKTA) – je potřebný?
- Gliom vyššího stupně kaudální oblasti míchy imitující myelitidu – kazuistika
- Proměnlivá tvář parkinsonské neurodegenerace
- Tetanus – staronová diagnóza? Kazuistika
- Snížená denzita kostního minerálu u žen s roztroušenou sklerózou
- Posttraumatická transdurální herniace míchy – kazuistika
- Mapování mozkové aktivity pomocí funkční magnetické rezonance během plnění močového měchýře
- Vztah deprese a rozeznávání emocí z výrazu tváře u pacientů s mírnou kognitivní poruchou
- Kvalita života u pacientů s demencí
- Použití transcerebelárního přístupu s obrácenou montáží stereotaktického rámu pro biopsii lézí zadní jámy lební
- Časná chirurgická léčba spontánního intracerebrálního krvácení
- Častý výskyt lymeské neuroboreliózy u dětí v České republice
- Hydrocefalus jako komplikace subarachnoidálního krvácení
- Bezpečnost a účinnost nového schématu dávkování trombolýzy – pilotní studie
- Atlantookcipitální dislokace – soubor šesti pacientů a přehled problematiky
- Může souviset úzký páteřní kanál s tvorbou granulomu na konci katétru uloženém v intratékálním prostoru? Kazuistika
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Použití botulotoxinu v neurologii
- Častý výskyt lymeské neuroboreliózy u dětí v České republice
- Tetanus – staronová diagnóza? Kazuistika
- Hydrocefalus jako komplikace subarachnoidálního krvácení
