Bezpečnost a účinnost nového schématu dávkování trombolýzy – pilotní studie
Safety and Efficacy of a New Thrombolysis Dosing Regimen – Pilot Study
Objective:
The main limitations of the treatment with tissue plasminogen activator (tPA) include low recanalization efficacy and the risk of intracerebral hemorrhage. The aim of this study was to test new dosing of intravenous tPA.
Methodology:
This is a prospective, non-randomized open-label study with 3 groups of patients (n = 12) with acute ischemic stroke due to artery occlusion. Three dosing regimes of tPA were: 0.8 mg/kg/60 min; 1.0 mg/kg/90 min, and 1.2 mg/kg/120 min. During treatment, recanalization was monitored with transcranial color-coded sonography (TCCD). Thrombolytic treatment was to be if full recanalization was diagnosed. The primary safety endpoint was the incidence of sICH within 36 hours. The main efficiency endpoint was the rate of complete recanalization at 120 minutes after treatment initiation.
Results:
In the 0.8 mg/kg dose group, no recanalization was achieved in the first six patients and, therefore, recruitment was stopped due to a lack of efficacy. In the 1.0 mg/kg/90 min and 1.2 mg/kg/120 min groups, 12 patients were enrolled. In each of these cohorts, one complete recanalization was achieved and one sICH was diagnosed. In two patients (in the 1.2 mg/kg group), treatment was terminated after recanalization within 30 minutes but reocclusion occurred in one of them. Favorable outcome at three months was predicted by the baseline NIHSS (OR 0.6, 95% CI 0.4–0.9) and systolic flow velocity in the affected artery at 120th minute (OR 1.1, 95% CI 1.01–1.2).
Conclusions:
The aim of tPA treatment is to achieve adequate flow velocity in the affected artery but this objective was not achieved by a different tPA dosing.
Key words:
mozkový infarkt – cévní mozková příhoda – trombolýza – rekanalizace
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Authors:
R. Mikulík 1; M. Reif 1; M. Bar 2; D. Goldemund 1; J. Brichta 1; D. Školoudík 2; M. Kuliha 2; M. Roubec 2
Authors‘ workplace:
Mezinárodní centrum klinického výzkumu, Neurologická klinika FN u sv. Anny v Brně
1; Neurologická klinika FN Ostrava
2
Published in:
Cesk Slov Neurol N 2013; 76/109(1): 76-80
Category:
Original Paper
Overview
Cíl:
Limitací léčby tkáňovým aktivátorem plazminogenu (tPA) je omezená rekanalizační schopnost a riziko intracerebrálního krvácení. Cílem práce bylo testovat nová dávkovací schémata tkáňového aktivátoru plazminogenu (tPA).
Soubor a metodika:
Práce představuje prospektivní, nerandomizovanou, nezaslepenou klinickou studii se třemi skupinami pacientů (každá n = 12) s akutním mozkovým infarktem a prokázanou okluzí tepny. Tři dávkovací schémata tPA byly: 0,8 mg/kg/60 min; 1,0 mg/kg/90 min a 1,2 mg/kg/120 min. Během léčby byl stav uzavřené tepny monitorován pomocí transkraniální barevně kódované sonografie (TCCD) a v případě plné rekanalizace v průběhu podávání tPA byla infuze zastavena. Primárním bezpečnostním kritériem byl výskyt symptomatických intracerebrálních krvácení (sICH) do 36 hodin. Hlavním kritériem účinnosti byl počet kompletních rekanalizací do 120 minut od počátku léčby.
Výsledky: Závěry:
U prvních šesti pacientů s dávkou 0,8 mg/kg nedošlo k žádné rekanalizaci, a proto byl nábor z důvodů nedostatečné účinnosti zastaven. Do druhé a třetí kohorty bylo zařazeno plánovaných 12 pacientů. Ve druhé i třetí kohortě byla dosažena jedna kompletní rekanalizace. Ve 2. a 3. kohortě byl detekován jeden sICH. U dvou pacientů (ve skupině 1,2 mg/kg) byla léčba ukončena při rekanalizaci do 30 minut, ale u jednoho došlo k reokluzi. Faktory predikujícími příznivý výsledný stav po třech měsících bylo NIHSS při přijetí (OR 0,6; 95% CI 0,4–0,9) a hodnota systolické rychlosti v postižené tepně ve 120. minutě (OR 1,1; 95% CI 1,01–1,2).
Klíčová slova:
mozkový infarkt – cévní mozková příhoda – trombolýza – rekanalizace
Úvod
V současné klinické praxi jsou pacienti s akutním mozkovým infarktem léčeni tkáňovým aktivátorem plazminogenu (tPA) v dávce 0,9 mg/kg s 10 % dávky podanými jako bolus a zbytek v hodinové infuzi [1,2]. Toto dávkovací schéma bylo prokázáno jako bezpečné a účinné v klinických studiích NINDS a ECASS III [1,3]. Hlavním cílem léčby tPA je sice dosáhnout tepenné rekanalizace [4], ale při současném dávkování se podaří kompletní rekanalizace docílit v méně než 20 % případů za současného cca 7% rizika symptomatického krvácení [1,5]. Vzhledem ke skutečnosti, že současné dávkovací schéma je používáno na základě výsledků dvou eskalačních studií s velmi omezeným počtem pacientů [6,7], je možné, že existuje dávkování tPA, které bude účinnější a/nebo bezpečnější než současná dávka 0,9 mg/kg. Proto cílem naší práce bylo prospektivně testovat alternativní dávkovací schémata tPA u pacientů s akutním mozkovým infarktem. Tento cíl je v souladu s vytyčenými výzkumnými prioritami v Evropě [8].
Soubor a metodika
Tato pilotní eskalační studie se třemi novými dávkovacími schématy intravenózního podávání tPA byla designovaná jako otevřená, prospektivní, nerandomizovaná a nezaslepená. Cílem studie bylo zjistit bezpečnost a rekanalizační potenciál tří navržených dávkovacích schémat u pacientů s akutním mozkovým infarktem v terapeutickém okně 3 hodiny (resp. 4,5 hodiny po zveřejnění výsledků studie ECASS III [3]). Do každé terapeutické skupiny bylo plánováno zařadit 12 pacientů.
Ve všech třech dávkovacích schématech byli pacienti léčeni bolusem 10 mg tPA intravenózně. Následovala 30minutová infuze 0,6 mg/kg/30 min podobně jako ve studii IMS [9]. Po skončení 30minutové infuze byla 1. skupina léčena dávkou 0,2 mg/kg/30 min, druhá skupina 0,4 mg/kg/60 min a třetí skupina 0,6 mg/kg/90 min. Celková doba podávání tPA tedy činila od 60 minut (pro dávku 0,8 mg/kg) do 120 minut (pro dávku 1,2 mg/kg) a maximální možná dávka byla 110 mg. Přechod na vyšší dávkování byl možný až poté, co byla prokázána bezpečnost předchozí, nižší dávky.
Pro zařazení do studie musel pacient splňovat obecně platná kritéria pro léčbu intravenózní trombolýzou [2] a mít okluzi mozkové tepny diagnostikovanou pomocí transkraniálního ultrazvuku (TCCD). Okluze tepny byla diagnostikována v případě nálezu „Transcranial in Brain Ischemia“ (TIBI) stupně 0–3 [5,10]. Dále všichni pacienti museli být schopni poskytnout informovaný souhlas s navrhovaným terapeutickým postupem. Vyloučeni byli pacienti, kteří měli neprostupné akustické temporální okno.
Při přijetí pacienti podstoupili nativní CT mozku a CT angiografii mozkových tepen, standardní klinické vyšetření (včetně NIHSS škály), laboratorní vyšetření, EKG a neurosonologické vyšetření. Těsně před podáním léčebné infuze byl stav tepenného řečiště znovu neurosonologicky zkontrolován, zda nedošlo k případně rekanalizaci.
Během trombolýzy byl stav tepny sledován pomocí TCCD vyšetření ve 30., 60., 90. a 120. minutě po zahájení léčby. Nález TIBI 4 nebo 5 ve 120. minutě byl považován za průkaz kompletní rekanalizace, zvýšení TIBI o ≥ 1 stupeň (ale maximálně na 3) bylo hodnoceno jako parciální rekanalizace, naopak snížení o ≤ 1 stupeň svědčilo pro reokluzi [5,11]. K minimalizaci potenciálního sonotrombolytického efektu byla snaha o co nejkratší (max. 5 minut) expozici pacienta ultrazvukem [5]. Pokud v průběhu podávání došlo ke kompletní rekanalizaci tepny, byla infuze tPA ukončena. Všechny bezpečnostní údaje byly přezkoumány nezávislou komisí. Přechod na vyšší dávku byl možný až poté, co bezpečnostní komise přezkoumala veškeré nežádoucí události předchozí kohorty.
Hlavním bezpečnostním kritériem byl výskyt symptomatického intracerebrálního krvácení (sICH) dle kontrolního CT vyšetření, popř. výskyt závažných systémových krvácivých komplikací. Symptomatický ICH byl definován jako parenchymové krvácení typu II, spojené s odpovídajícím klinickým zhoršením ≥ 4 bodů NIHSS [12]. Účinnost léčby byla hodnocena dle počtu dosažených rekanalizací na základě TIBI kritérií do 120 minut od zahájení. Příznivý klinický výsledek byl definován jako dosažení skóre 0–1 dle modifikované Rankinovy stupnice (mRS) za 3 měsíce. Všechna CT vyšetření byla hodnocena nezávislou bezpečnostní komisí (DSMB), která dávala souhlas k dalšímu zvyšování dávky tPA.
Statistika
Výsledky jsou prezentovány pomocí popisných statistik. Rozdíly ve skupinách byly hodnoceny testy chí-kvadrát, ANOVA a Kruskal-Wallis. Nebylo provedeno formální testování potřebné velikosti souboru – počet 12 osob na jednu skupinu byl vybrán v souladu s obdobnými studiemi testujícími různé dávky léčiva. Asociace mezi parametry byla stanovena pomocí logistické a lineární regrese.
Tato studie byla schválena etickými komisemi FN u sv. Anny v Brně a FN Ostrava a Státním ústavem pro kontrolu léčiv České republiky (SÚKL) v souladu s etickými normami. Je také registrována u Evropské agentury pro léčivé přípravky (EMEA) pod registračním číslem EudraCTnumber 2008-003371-53.
Všichni pacienti před vstupem podepsali informovaný souhlas.
Výsledky
Studie probíhala v období od března 2009 do srpna 2011. Během této doby bylo zařazeno a dle protokolu léčeno 30 pacientů místo plánovaných 36. Důvodem bylo, že při dávce tPA 0,8 mg/kg žádný z prvních šesti pacientů nedosáhl rekanalizace, a proto byl z etických důvodů nábor do této kohorty ukončen. Do skupin s dalšími dvěma dávkovacími schématy (1,0 mg/kg a 1,2 mg/kg) byl zařazen plánovaný počet 12 pacientů. Základní charakteristiky všech tří kohort (n = 6, 12, 12) jsou zobrazeny v tab. 1. Mezi kohortami nebyly žádné statisticky významné rozdíly (kromě dávky tPA), i když medián vstupní hodnoty NIHSS se numericky lišil.
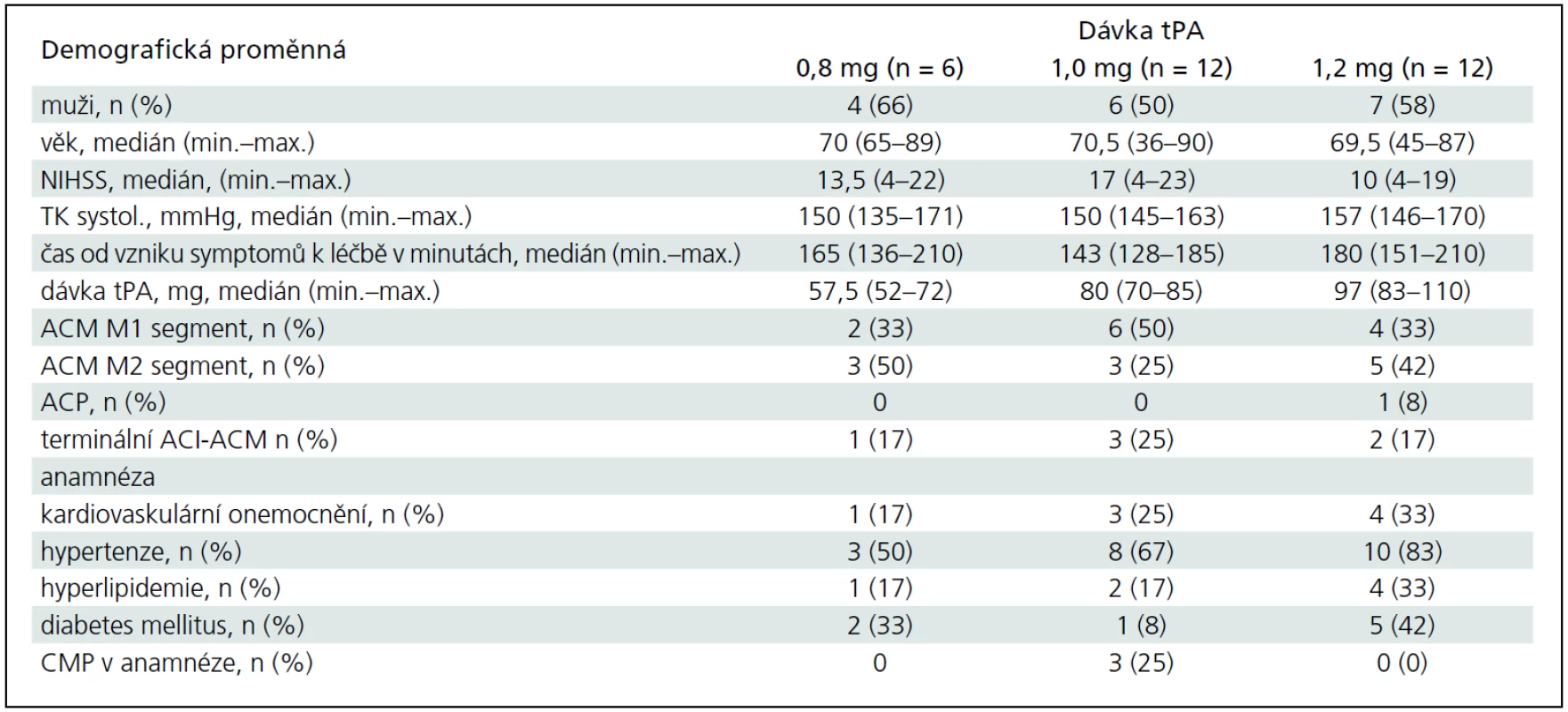
Hlavní výsledky jsou v tab. 2. Ve druhé i třetí skupině pacientů léčených celkovou dávkou 1,0 mg/kg a 1,2 mg/kg bylo dosaženo jedné trvalé kompletní (ve 120., resp. ve 30. minutě) rekanalizace a 1, resp. 2 trvalých parciálních rekanalizací do 120. minuty. U další jedné parciální (ve 2. skupině) a jedné kompletní (ve 3. skupině) rekanalizaci došlo k časným reokluzím. V každé z kohort se vyskytlo jedno symptomatické krvácení. Statisticky nebyly zjištěny žádné rozdíly ve výsledcích mezi skupinami. MRS 0–1 za 3 měsíce dosáhlo 60 % procent pacientů s parciální či kompletní rekanalizací a pouze 20 % pacientů bez rekanalizace (p = 0,06).
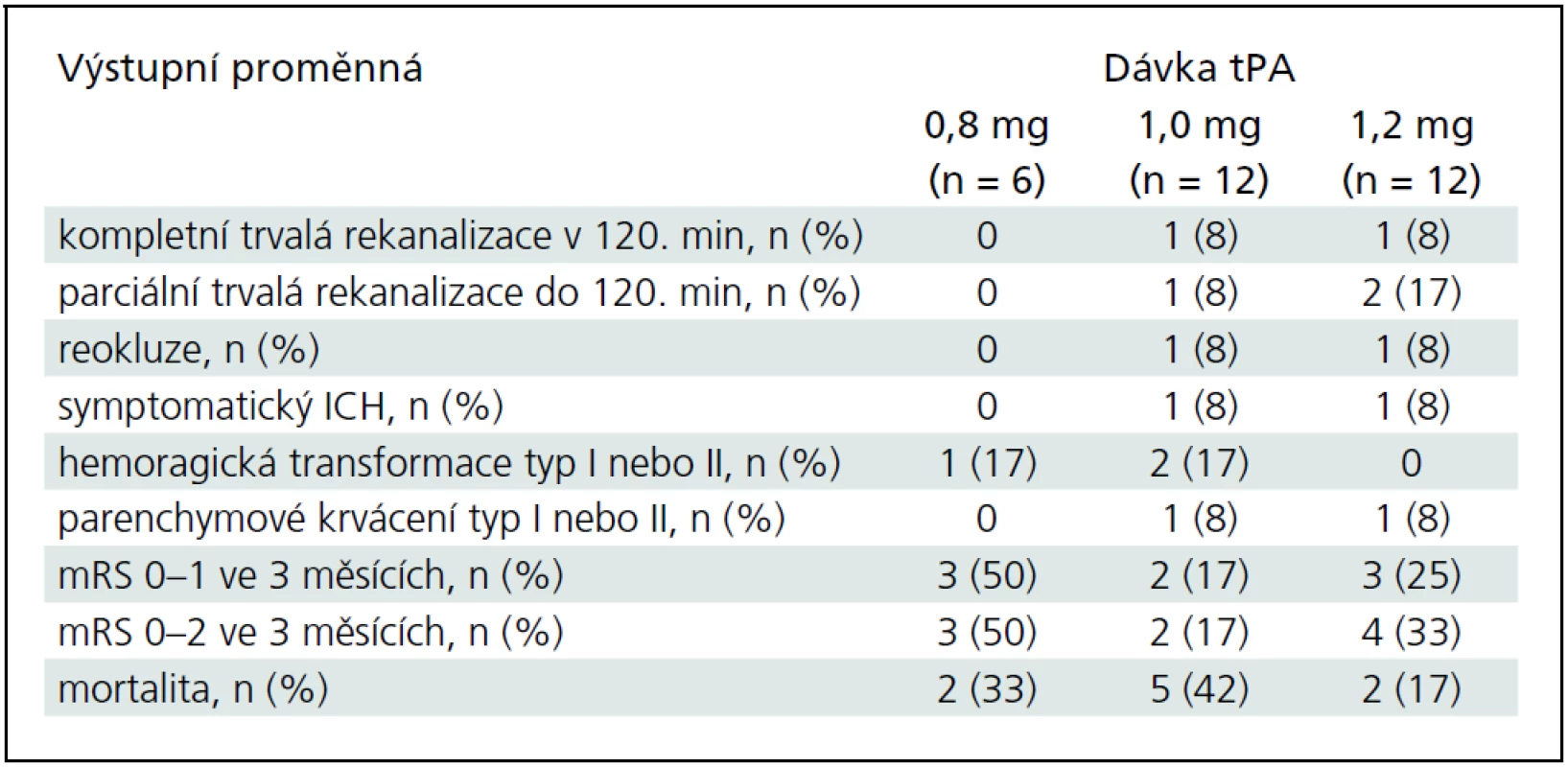
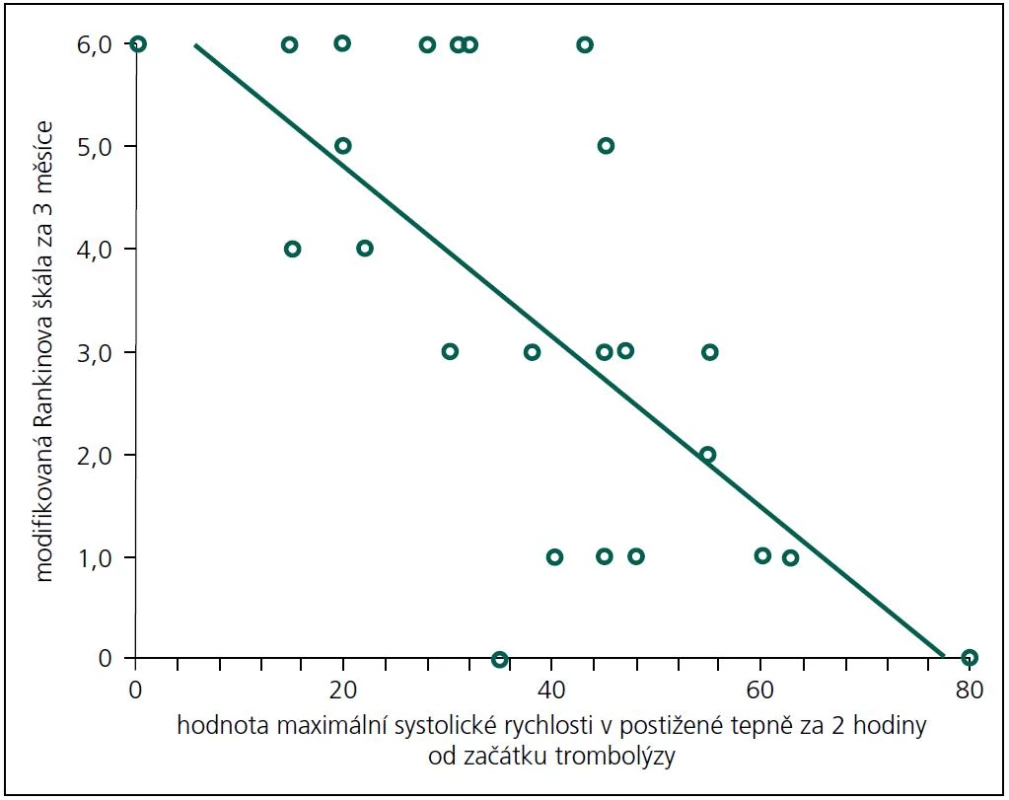
Příznivý výsledný stav (mRS 0–1) byl predikován NIHSS při přijetí (OR 0,6; 95% CI 0,4–0,9) a hodnotou systolické rychlosti v postižené tepně ve 120. minutě (OR 1,1; 95% CI 1,01–1,2). Věk a rekanalizace měly tendenci predikovat příznivý výsledný stav (p = 0,07; resp. 0,8). Graf 1 ukazuje závislost mezi hodnotou systolické rychlosti v postižené tepně a mRS za 3 měsíce. Rekanalizaci nepredikoval žádný ze vstupních parametrů na signifikantní hladině významnosti.
Diskuze
Naše studie vycházela z předpokladu, že použití nižší dávky (0,8 mg/kg) tPA může mít obdobný rekanalizační potenciál jako dávka vyšší, avšak s nižším rizikem intracerebrálního krvácení. Analogicky vyšší dávka tPA by mohla zvýšit počet rekanalizací [9,13], avšak bez vyššího rizika krvácení, neboť bylo ukázáno, že přetrvávající arteriální okluze je nezávislým rizikovým faktorem sICH [14,15]. Při volbě vyšší bolusové dávky jsme vycházeli ze zkušeností kardiologických, kde se jeví akcelerované podávání tPA efektivnější (dřívější dosažení vyšší hladiny po zahájení infuze) [16]. Poslední naší hypotézou bylo, že když infuze tPA bude ukončena po dosažení rekanalizace, pacient bude vystaven menšímu riziku případných nežádoucích účinků.
Dávka 0,8 mg/kg ale nevedla k žádné rekanalizaci u prvních šesti pacientů. Další pokračování náboru pacientů do této kohorty proto bylo považováno v roce 2009 za neetické, a nábor do této kohorty byl proto ukončen. V roce 2010 ale byly publikovány tři studie z Japonska, Vietnamu a Taiwanu, které dokumentovaly lepší profil dávek 0,6 mg/kg tPA [17–19]. Přestože jedním z důvodů dobrého účinku dávek 0,6 mg/kg by mohlo být odlišné působení tPA u Asiatů, nebylo naše rozhodnutí zastavit nábor pacientů léčených dávkou 0,8 mg/kg při retrospektivním hodnocení nejvhodnější, i když v té době opodstatněné. V japonské studii dosáhlo rekanalizaci při dávce 0,6 mg/kg celkem 52 % pacientů. Tato rekanalizace byla hodnocena po 6 hodinách pomocí MR angiografie [18]. Velmi rozdílné procento rekanalizací mezi naší a japonskou studií může být (alespoň) částečně vysvětleno rozdílným způsobem hodnocení rekanalizace (TCCD vs MR) a rozdílným časem hodnocení rekanalizace (2 vs 6 hodin od začátku léčby).
I ve skupinách s dávkou 1,0 a 1,2 mg/kg bylo dosaženo malého počtu rekanalizací jak absolutně, tak ve srovnání s některými dříve publikovanými studiemi s využitím standardní dávky 0,9 mg/kg [20,21]. Hodnocení rekanalizací je však významně závislé na způsobu jejího posuzování. V tomto kontextu jiné studie měly obdobně nízký počet rekanalizací, např. v Calgary (22 % rekanalizací dle CT angiografie) [22] a ještě méně ve studii CLOTBUST (13 % rekanalizací dle ultrazvuku) [5]. Vzhledem k nízkému procentu rekanalizací v naší studii (pouze u dvou pacientů došlo k plné rekanalizaci během infuze a u jednoho po skončení infuze) nebylo možné validně zhodnotit, zdali zastavení infuze tPA po dosažení rekanalizace může být prospěšné. Nicméně skutečnost, že jedna reokluze nastala po zastavení infuze tPA po podání dávky 0,6 mg/kg v prvních 30 minutách, naznačuje, že delší dávkování tPA může zabránit případné reokluzi. Platnost našich závěrů týkajících se rekanalizace, případně reokluze je omezena malým počtem pacientů.
V naší studii všechny tři skupiny pacientů neměly vyšší riziko sICH ve srovnání s pacienty léčenými standardními dávkami tPA [1,3]. Neutrální efekt různých dávek tPA na bezpečnost a účinnost v naší studii je významně podporován i předchozími retrospektivními studiemi, které vyhodnocovaly vztah mezi chybným dávkováním tPA a účinností/bezpečností tPA [23,24]. Např. ve studii NINDS nižší nebo vyšší dávky tPA v důsledku chybného odhadu hmotnosti pacienta neovlivnily výsledný klinický stav pacienta či riziko symptomatického ICH [24]. Výsledky naší práce tak nepřímo svědčí pro skutečnost, že dojde-li k chybnému dávkování tPA (v důsledku špatného odhadu hmotnosti pacienta), pacient nebude ohrožen menší účinností trombolýzy nebo vyšším rizikem krvácení.
Zajímavým zjištěním, které je v kontrastu s výsledkem rekanalizací, je, že pacienti, kteří byli léčeni dávkou 0,8 mg/kg, měli lepší klinický stav po třech měsících ve srovnání se skupinou pacientů léčených vyššími dávkami tPA. Asociace mezi dobrým klinickým stavem a nižšími dávkami tPA byla dokumentována v již zmíněných asijských studiích [17–19]. Nicméně, v naší studii jsou nejpravděpodobnější příčinou lepšího klinického stavu ve skupině léčené dávkou 0,8 mg/kg výhodnější vstupní charakteristiky pacientů, jako nižší NIHSS nebo distálnější lokalizace uzávěrů oproti skupinám léčeným vyšší dávkou tPA. Kromě toho pacienti léčení dávkou 0,8 mg/kg byli léčeni rychleji a také se zde vyskytlo méně pacientů s kardiovaskulárními onemocněními, hypertenzí nebo diabetem než v jedné či obou skupinách s vyšší dávkou. Nízkodávková trombolýza je ale velmi aktuální téma a její účinnost a bezpečnost bude testována ve studii ENCHANTED, která plánuje nábor 5 000 pacientů [25].
Naše studie, podobně jako předchozí práce, ukázala, že tíže vstupního neurologického deficitu a stupeň rekanalizace jsou hlavní prediktory výsledného stavu [4,5,26]. Zajímavé je zjištění, že stupeň rekanalizace měřený podle systolické rychlosti v postižené tepně měl lepší předpovědní hodnotu pro výsledný stav než hodnota TIBI 4–5, která je obecně považována za dostatečný marker rekanalizace [10]. Vysvětlením je nejspíše skutečnost, že hodnota systolické rychlosti umožňuje hodnocení jakéhokoli stupně rekanalizace na numerické škále, což je přesnější (a hlavně zároveň klinicky relevantní), než je hodnocení podle TIBI na ordinární škále.
Limitací naší studie je malý počet pacientů. Nicméně tento počet byl zvolen záměrně z bezpečnostních a etických důvodů, aby neprokázané a potenciálně rizikové terapii nebyl vystaven zbytečně velký počet účastníků. Mezi silné stránky naší studie patří její prospektivní design a striktní cévní zobrazovací protokol.
Závěr
Závěrem je možné shrnout, že naše studie ukázala, že všechna nová dávkovací schémata se jeví být bezpečná. Obecně byl ale rekanalizační potenciál tPA nízký bez ohledu na dávku, což podporuje potřebu rozvíjet efektivnější rekanalizační strategie.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Tato studie byla podpořena grantem IGA MZ ČR, NS10106-4/2008. Dr. Mikulík je podporován z Evropského fondu regionálního rozvoje – Projekt FNUSA-ICRC (No. CZ.1.05/1.1.00/02.0123).
R. Mikulík1, M. Reif1, M. Bar2, D. Goldemund1, J. Brichta1, D. Školoudík2, M. Kuliha2, M. Roubec2
1 Mezinárodní centrum klinického výzkumu, Neurologická klinika FN u sv. Anny v Brně
2 Neurologická klinika FN Ostrava
MUDr. Robert Mikulík, Ph.D.
Mezinárodní centrum klinického výzkumu
Neurologická klinika FN u sv. Anny
Pekařská 53
656 91 Brno
e-mail: mikulik@hotmail.com
Přijato k recenzi: 11. 5. 2012
Přijato do tisku: 22. 6. 2012
Sources
1. The National Institute of Neurological Disorders and Stroke rt-PA Stroke Study Group. Tissue plasminogen activator for acute ischemic stroke. N Engl J Med 1995; 333(24): 1581–1587.
2. Mikulík R, Neumann J, Školoudík D, Václavík D. Standard pro diagnostiku a léčbu pacientů s mozkovým infarktem. Cesk Slov Neurol N 2006; 69/102(4): 320–325.
3. Hacke W, Kaste M, Bluhmki E, Brozman M, Davalos A, Guidetti D et al. Thrombolysis with alteplase 3 to 4.5 hours after acute ischemic stroke. N Engl J Med 2008; 359(13): 1317–1329.
4. Mikulik R, Ribo M, Hill MD, Grotta JC, Malkoff M, Molina C et al. Accuracy of serial National Institutes of Health Stroke Scale scores to identify artery status in acute ischemic stroke. Circulation 2007; 115(20): 2660–2665.
5. Alexandrov AV, Molina CA, Grotta JC, Garami Z, Ford SR, Alvarez-Sabin J et al. Ultrasound-enhanced systemic thrombolysis for acute ischemic stroke. N Engl J Med 2004; 351(21): 2170–2178.
6. Brott TG, Haley EC, jr, Levy DE, Barsan W, Broderick J, Sheppard GL et al. Urgent therapy for stroke. Part I. Pilot study of tissue plasminogen activator administered within 90 minutes. Stroke 1992; 23(5): 632–640.
7. Haley EC, jr, Levy DE, Brott TG, Sheppard GL, Wong MC, Kongable GL et al. Urgent therapy for stroke. Part II. Pilot study of tissue plasminogen activator administered 91–180 minutes from onset. Stroke 1992; 23(5): 641–645.
8. Meairs S, Wahlgren N, Dirnagl U, Lindvall O, Rothwell P, Baron JC et al. Stroke research priorities for the next decade – a representative view of the European scientific community. Cerebrovasc Dis 2006; 22(2–3): 75–82.
9. The Interventional Management of Stroke (IMS) II Study. Stroke 2007; 38(7): 2127–2135.
10. Demchuk AM, Burgin WS, Christou I, Felberg RA, Barber PA, Hill MD et al. Thrombolysis in brain ischemia (TIBI) transcranial Doppler flow grades predict clinical severity, early recovery, and mortality in patients treated with intravenous tissue plasminogen activator. Stroke 2001; 32(1): 89–93.
11. Alexandrov AV, Grotta JC. Arterial reocclusion in stroke patients treated with intravenous tissue plasminogen activator. Neurology 2002; 59(6): 862–867
12. Wahlgren N, Ahmed N, Davalos A, Ford GA, Grond M, Hacke W et al. Thrombolysis with alteplase for acute ischaemic stroke in the Safe Implementation of Thrombolysis in Stroke-Monitoring Study (SITS-MOST): an observational study. Lancet 2007; 369(9558): 275–282.
13. Kim DJ, Kim DI, Kim SH, Lee KY, Heo JH, Han SW. Rescue localized intra-arterial thrombolysis for hyperacute MCA ischemic stroke patients after early non-responsive intravenous tissue plasminogen activator therapy. Neuroradiology 2005; 47(8): 616–621.
14. Shaltoni HM, Albright KC, Gonzales NR, Weir RU, Khaja AM, Sugg RM et al. Is intra-arterial thrombolysis safe after full-dose intravenous recombinant tissue plasminogen activator for acute ischemic stroke? Stroke 2007; 38(1): 80–84.
15. Saqqur M, Tsivgoulis G, Molina CA, Demchuk AM, Siddiqui M, Alvarez-Sabin J et al. Symptomatic intracerebral hemorrhage and recanalization after IV rt-PA: a multicenter study. Neurology 2008; 71(17): 1304–1312.
16. An international randomized trial comparing four thrombolytic strategies for acute myocardial infarction. The GUSTO investigators. N Engl J Med 1993; 329(10): 673–682.
17. Chao AC, Hsu HY, Chung CP, Liu CH, Chen CH, Teng MM et al. Outcomes of thrombolytic therapy for acute ischemic stroke in Chinese patients: the Taiwan Thrombolytic Therapy for Acute Ischemic Stroke (TTT-AIS) study. Stroke 2010; 41(5): 885–890.
18. Mori E, Minematsu K, Nakagawara J, Yamaguchi T, Sasaki M, Hirano T. Effects of 0.6 mg/kg intravenous alteplase on vascular and clinical outcomes in middle cerebral artery occlusion: Japan Alteplase Clinical Trial II (J-ACT II). Stroke 2010; 41(3): 461–465.
19. Nguyen TH, Truong AL, Ngo MB, Bui CT, Dinh QV, Doan TC et al. Patients with thrombolysed stroke in Vietnam have an excellent outcome: results from the Vietnam Thrombolysis Registry. Eur J Neurol 2010; 17(9): 1188–1192.
20. Rha JH, Saver JL. The impact of recanalization on ischemic stroke outcome: a meta-analysis. Stroke 2007; 38(3): 967–973.
21. Kharitonova T, Mikulik R, Roine RO, Soinne L, Ahmed N, Wahlgren N. Association of early National Institutes of Health Stroke Scale improvement with vessel recanalization and functional outcome after intravenous thrombolysis in ischemic stroke. Stroke 2011; 42(6): 1638–1643.
22. Bhatia R, Hill MD, Shobha N, Menon B, Bal S, Kochar P et al. Low rates of acute recanalization with intravenous recombinant tissue plasminogen activator in ischemic stroke: real-world experience and a call for action. Stroke 2010; 41(10): 2254–2258.
23. Breuer L, Nowe T, Huttner HB, Blinzler C, Kollmar R, Schellinger PD et al. Weight approximation in stroke before thrombolysis: the WAIST-Study: a prospective observational “dose-finding” study. Stroke 2010; 41(12): 2867–2871.
24. Messe SR, Kasner SE, Cucchiara BL, Demchuk A, Tanne D, Ouyang B et al. Dosing errors did not have a major impact on outcome in the NINDS t-PA stroke study. J Stroke Cerebrovasc Dis 2011; 20(3): 236–240.
25. ENCHANTED study [online]. Available from: http://clinicaltrials.gov.
26. Wahlgren N, Ahmed N, Eriksson N, Aichner F, Bluhmki E, Davalos A et al. Multivariable analysis of outcome predictors and adjustment of main outcome results to baseline data profile in randomized controlled trials: Safe Implementation of Thrombolysis in Stroke--MOnitoring STudy (SITS-MOST). Stroke 2008; 39(12): 3316–3322.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2013 Issue 1
- Memantine Eases Daily Life for Patients and Caregivers
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Advances in the Treatment of Myasthenia Gravis on the Horizon
-
All articles in this issue
- Použití botulotoxinu v neurologii
- Národní registr cévních mozkových příhod (registr IKTA) – je potřebný?
- Gliom vyššího stupně kaudální oblasti míchy imitující myelitidu – kazuistika
- Proměnlivá tvář parkinsonské neurodegenerace
- Tetanus – staronová diagnóza? Kazuistika
- Snížená denzita kostního minerálu u žen s roztroušenou sklerózou
- Posttraumatická transdurální herniace míchy – kazuistika
- Mapování mozkové aktivity pomocí funkční magnetické rezonance během plnění močového měchýře
- Vztah deprese a rozeznávání emocí z výrazu tváře u pacientů s mírnou kognitivní poruchou
- Kvalita života u pacientů s demencí
- Použití transcerebelárního přístupu s obrácenou montáží stereotaktického rámu pro biopsii lézí zadní jámy lební
- Časná chirurgická léčba spontánního intracerebrálního krvácení
- Častý výskyt lymeské neuroboreliózy u dětí v České republice
- Hydrocefalus jako komplikace subarachnoidálního krvácení
- Bezpečnost a účinnost nového schématu dávkování trombolýzy – pilotní studie
- Atlantookcipitální dislokace – soubor šesti pacientů a přehled problematiky
- Může souviset úzký páteřní kanál s tvorbou granulomu na konci katétru uloženém v intratékálním prostoru? Kazuistika
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Použití botulotoxinu v neurologii
- Častý výskyt lymeské neuroboreliózy u dětí v České republice
- Tetanus – staronová diagnóza? Kazuistika
- Hydrocefalus jako komplikace subarachnoidálního krvácení
