Časná chirurgická léčba spontánního intracerebrálního krvácení
Ultra-Early Evacuation of Intracerebral Spontaneous Hematomas
Introduction:
The thrombolysis project enables patients to reach emergency departments within the first hour after a cerebrovascular event that is in 20–35% caused by intracerebral hematoma (ICH). Early diagnosis of ICH thus allows for ultra-early evacuation.
Objective:
Open microsurgery via transylvian approach and precise coagulation of bleeding sources to minimize secondary bleeding with rapid and complete decompression all types of hematoma brings positive effect on secondary brain tissue injury (hypoperfusion, metabolic changes and intracranial hypertension). Ultra-early evacuation of ICH is based on the hypothesis that the undamaged brain tissue is temporarily able to compensate for the negative changes caused by the bleeding.
Methods:
Prospective study with 2.5 years of follow up of ICH patients with data collection and final evaluation at least 6 month after stroke. The inclusion criteria: spontaneous hypertonic putaminal ICH, MR or CT scan, volume ≥ 30 ml, GCS ≥ 8, the time to surgery ≤ 5–8 hrs., treatment in neurosurgical ICU with multimodality monitoring (with invasive ICP and PBT0²).
Results:
Follow-up of 17 patients (F : M 2 : 15, age 60.6), mean time to surgery 3.8 hours, ICH volume of 73 ml (30–130 ml), mRS 3.5 and GOS 2.9 after six months. Six patients died and six reached favorable results. Volume was the most limiting factor; results were poor in the ≥ 100 ml group.
Conclusion:
The indication of surgery is still controversial. Open microsurgery is the method of choice in the ultra-early evacuation and coagulation of the primary source of bleeding is the prevention of rebleeding. Clinically significant independence is expected in patients with the initial volume of 30–80 ml and GCS ≥ 8 after stroke only.
Key words:
intracerebral hematoma – surgical treatment
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Authors:
M. Vaverka; J. Kozák; D. Šaňák; D. Krahulík
; L. Hrabálek
Authors‘ workplace:
Neurochirurgická klinika LF UP a FN Olomouc
Published in:
Cesk Slov Neurol N 2013; 76/109(1): 56-62
Category:
Original Paper
Overview
Úvod:
Trombolytický program přivádí pacienty velmi časně do cerebrovaskulárního centra – již desítky minut po mozkové příhodě, která je v ČR ve 20–35 % způsobena intracerebrálním hematomem (ICH). Díky časné diagnóze ICH je tak vytvořeno časové okno pro realizaci urgentní intervence.
Cíl:
Mikrochirurgický transsylvijský přístup a koagulace zdroje krvácení minimalizuje sekundární krvácení a vede k bezprostřední dekompresi při všech kvalitách hematomu. Příznivě je ovlivněno sekundární poškození mozku (hypoperfuze, nitrolebeční hypertenze, biochemické změny). Hypotéza urgentní evakuace ICH předpokládá dočasnou schopnost okolní přímo nedestruované mozkové tkáně kompenzovat negativní změny, rozvíjející se po krvácení.
Metodika:
Prospektivní studie sledovala 2,5 roku pacienty s ICH léčené intervencí s hodnocením výsledku minimálně po půl roce. Vstupní kritéria: spontánní putaminální ICH hypertonického typu, diagnostikovaný MR nebo CT, objem minimálně 30 ml, Glasgow Coma Scale (GCS) po příhodě ≥ 8, interval do operace ≤ 5–8 hod, následná léčba na neurochirurgické JIP s multimodálním monitoringem (včetně invazivního měření ICP a PBT0²).
Výsledky:
V souboru 17 nemocných bylo 15 mužů a dvě ženy, průměrného věku 60,6 roku, průměrný interval do operace 3,8 hod, průměrný objem hematomů byl 73 ml (30–130 ml), po půl roce dosáhli pacienti Glasgow Outcome Scale (GOS) 2,9 a modifikovaného Rankin Scale (mRS) 3,5. Zemřelo šest pacientů a šest dosáhlo uspokojivého výsledku. Objem byl hlavním prognostickým faktorem, v podskupině s objemem ≥ 100 ml byly výsledky vesměs špatné.
Závěr:
Indikace chirurgické léčby je stále kontroverzní. Mikrochirurgický transsylvijský přístup s kompletní evakuací putaminálního hematomu je metodou volby při časné intervenci a koagulace zdrojů je prevencí sekundárního krvácení. Klinicky užitečný stupeň nezávislosti lze očekávat jen v podskupině s objemem 30–80 ml a GCS ≥ 8.
Klíčová slova:
intracerebrální hematom – chirurgická léčba
Úvod
Spontánní intracerebrální krvácení (ICH) s incidencí 13–30/100 000/rok tvoří v ČR podíl 30–35 % ze všech mozkových inzultů, výsledná morbidita a mortalita má značný sociálně-ekonomický dopad. V léčbě ICH neexistuje jednotná světová klasifikace, jednoznačná doporučení chirurgické léčby ani jednotný názor na načasování. Přes některé všeobecně známé a přijímané prognostické faktory rozhodují individuální zkušenosti pracoviště i jednotlivého neurochirurga. Charcot a Bouchard již v roce 1868 popsali a. lenticulostriatae jako zdroj ICH. McEvan poprvé úspěšně operoval ICH v roce 1888. V roce 1903 popsal Cushing pozitivní vliv odstranění ICH na snížení nitrolebečního tlaku. Léta 70. a 80. proběhla ve znamení západního pesimizmu (McKissock) a východního – japonského – optimizmu pro operační léčbu ICH, podpořeného dostupností CT. V roce 1983 Beneš [1] kritizoval ve své monografii urgentní aktivity japonských autorů. Zajímavý byl jeho stereotaktický přístroj a laboratorní pokus demonstrující šíření hematomu v oblasti bazálních ganglií. V roce 1994 Smrčka et al [2] nevylučovali možnost evakuace ICH transsylvijsky do 6 hodin mikrochirurgickou technikou a zabývali se organizací péče po mozkové příhodě. Kanno et al (1984) [3] na podkladě CT zavedli používanou klasifikaci ICH. I při výkonech do 3 hodin upozornili na přísný výběr kandidátů pro dosažení příznivých výsledků. Siddiaque et al (2002) [4], Nilsson et al (2006) [5], Aronowski et al (2011) [6] prokázali tvorbu chemické penumbry kolem hematomu. Souhrn z USA 2009 přinášejí Andaluz et al [7], kteří konstatují, že poslední dekáda nepřinesla zlepšení výsledků léčby ICH – do 30 dnů zemře 35–52 %, po půl roce je jen 20 % pacientů nezávislých. Časnou evakuaci podpořili výrazně Morioka et al (2006) [8], kdy chirurgická skupina 1 010 pacientů léčených ve 45 centrech měla lepší výsledky. Design studie nedosáhl úrovně Class I. Rovněž Kaya et al (2003) [9] na souboru 66 nemocných podpořili pozitivní výsledky chirurgické skupiny, přítomnost intraventrikulárního krvácení výrazně prognózu zhoršovala. V roce 2006 Pantazis et al [10] u 108 nemocných s pokusem o randomizaci prokázali při objemu hematomu menším než 80 ml prospěšnost chirurgické léčby.
Všeobecně byl přijat význam nálezu „hot spots“, jenž významně koreluje s expanzí hematomu. Hot spot přesně definuje Boshert [11] jako okrsky detekovatelné na CTA do 3 hodin po vzniku hematomu, s minimální velikostí 1,5 mm, dvojnásobné denzity, než je denzita hematomu, lokalizované na jeho okraji bez vztahu k vnějším mozkovým cévám. Tvar může být lineární, tečkovitý nebo vlnitý a vyskytuje se asi u třetiny hematomů. Wang et al [12] při hledání optimálního načasování po rozboru dlouhodobě sledované skupiny 500 nmocných prokázali lepší výsledky ve skupině ultra-early (≤ 7 hod) a early (7–24 hod) v bezprostředním i v dlouhodobém horizontu než při konzervativní terapii. Podobně dříve i Kaneko et al [13]. Vyhodnocení mezinárodní studie STICH I (Mendelow et al [14]) neprokázalo očekávaný benefit operace, časový interval byl ale delší než 36 hodin. Selekce skupiny s lobárním hematomem vzápětí odstartovala studii STICH II. Opakovaně byly referovány výsledky difuzní tenzorové traktografie pro vyhodnocení funkce pyramidové dráhy po ICH, nepoužitelné při zvažování časné intervence [15].
Rutinně se indikační rozvaha odvíjí od lokalizace hematomu: pravo-levé, mediální-laterální, vstupního stavu vědomí a dynamiky onemocnění. Přibližně platí, že hematom objemnější než 60 ml při vstupním GCS ≤ 8 má 90% mortalitu při konzervativní léčbě a hematom ≤ 30 ml mortalitu 20 % při skóre ≥ 8. Neoperují se thalamická krvácení a při putaminálních rozhoduje velikost (operuje se při průměru hematomu více než 4 cm a stavu vědomí nad 8, středočárovém přesunu a pro zhoršování původně příznivého stavu). Chirurgická léčba má řadu variant [16–18] – minimálně invazivní kraniotomii, nejlépe naplňující principy časné léčby, používá pro krvácení putaminálního typu přístup transfrontální, transtemporální a transsylvijský, dále navigovanou punkci s odsátím tekuté části hematomu a zavedením drénu do kavity s dalším postupným odsáváním po lokální trombolýze (urokináza, tPA – tissue Plasmin Activator) [19,20]. Neuroendoskopie [21] umožňuje poměrně radikální evakuaci ICH po návrtu s výplachy nebo v kombinaci s ponechaným drénem s omezeným ošetřením zdroje krvácení. Kromě kraniotomie další postupy nejsou pro časnou evakuaci vhodné. V současné době probíhají kromě STICH II následující studie [22]:
- MISTIE – minimálně invazivní evakuace hematomu s následným zavedením katétru a lýzou koagula pomocí tPA (Zuccarello).
- INTERACT I a II (Anderson) sledující vliv významně sníženého arteriálního tlaku po krvácivé příhodě.
- ATACH I a II (Qereshi) podobě jako předchozí, zabývající se redukcí systolického tlaku pomocí nicardipinu.
- FACTOR VIIa TRIALs (Steiner) sledující vliv aplikace tří následujících dávek rekombinantního Faktoru VII především na další expanzi hematomu.
V roce 2010 vydala AHA [23] nová doporučení pro léčbu spontánního ICH, kde profit intervence je nadále nejistý kromě výjimek:
- intervence pro lobární hematom větší než 30 ml a vzdálený 1 cm od povrchu a
- komorová drenáž při hydrocefalu.
Ultra-early evakuace je pokládána stále za atraktivní zatím bez průkazu studií vyšší třídy a obavami z rebleedingu. Neurochirurgická klinika olomoucké fakultní nemocnice (FNOL) se zabývá dlouhodobě léčbou ICH [24] v souhlase s popsaným kontroverzním vývojem. Při současném stavu poznatků trombolytický program jako vedlejší produkt přinesl časnou diagnózu krvácivé mozkové příhody a nabídl možnost ověřit efekt urgentní intervence.
Soubor a metodika
Vstupní kritéria studie: spontánní putaminální ICH hypertonického typu, diagnostikovaný MR nebo CT, objem minimálně 30 ml, GCS po příhodě ≥ 8, interval do operace ≤ 5–8 hod.
Pro orientační výpočet objemu ICH v ml se obvykle používá standardní vzorec: V = a × b × c / 2, kde hodnoty a–c jsou největší rozměry hematomu měřeny v centimetrech ve třech na sebe kolmých rovinách. Pro nepravidelnosti a tvarové pestrosti ICH byl použit manuální postup měření. Pacienti byli vyšetřováni na multidetektorovém CT přístroji dle standardního vyšetřovacího protokolu: topogram bočný, oblast vyšetření od baze lební ke kalvě, vyšetřovací rovina souběžná s bazí lební (supraorbitomeatální čára), kolimace (šíře skenu) na bazi 2,5 mm, supratentoriálně 5 mm, kdy jednotlivé skeny na sebe navazovaly, bez překryvu, směr skenování kaudokraniální. Nastavení okna: šíře/střed 80–120/30–40, v zadní jámě 120–250/30–40, skelet 1 200–2 000//300–600 HU. Měření byla prováděna na diagnostických stanicích s funkcí plošného měření (mnohoúhelník).
Metodika měření spočívala v postupném manuálním měření plochy hematomu (S1–S2,S3.....Sx) v celém rozsahu hematomu. Následná sumarizace byla prováděna zvlášť infratentoriálně /Sbaze/ (skeny šíře 2,5 mm) a supratentoriálně /Skranium/ (skeny šíře 5 mm). Výsledný objem byl vyjádřen v mililitrech.
Vzorec: V = součet Sbaze/4 + součet Skranium/2.
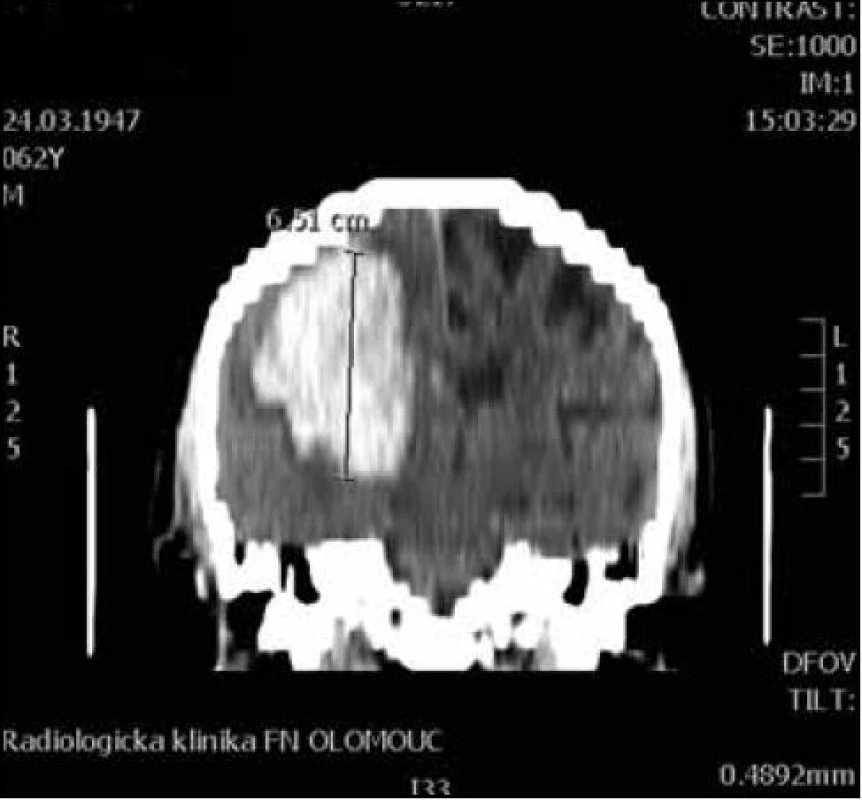
Pro MR vyšetření (obr. 1, 2) byl použit obdobný postup manuálního měření z axiálních T2 vážených obrazů z jejich následným součtem. Při šíři vyšetřované vrstvy 5 mm a distančním faktoru (vzdálenost mezi jednotlivými řezy) cca 20 % byl výsledný součet dělen dvěma a přičteno 20 % k výslednému objemu. Vzorec: V = součet S/2 × 1,2 (výsledný objem v mililitrech).
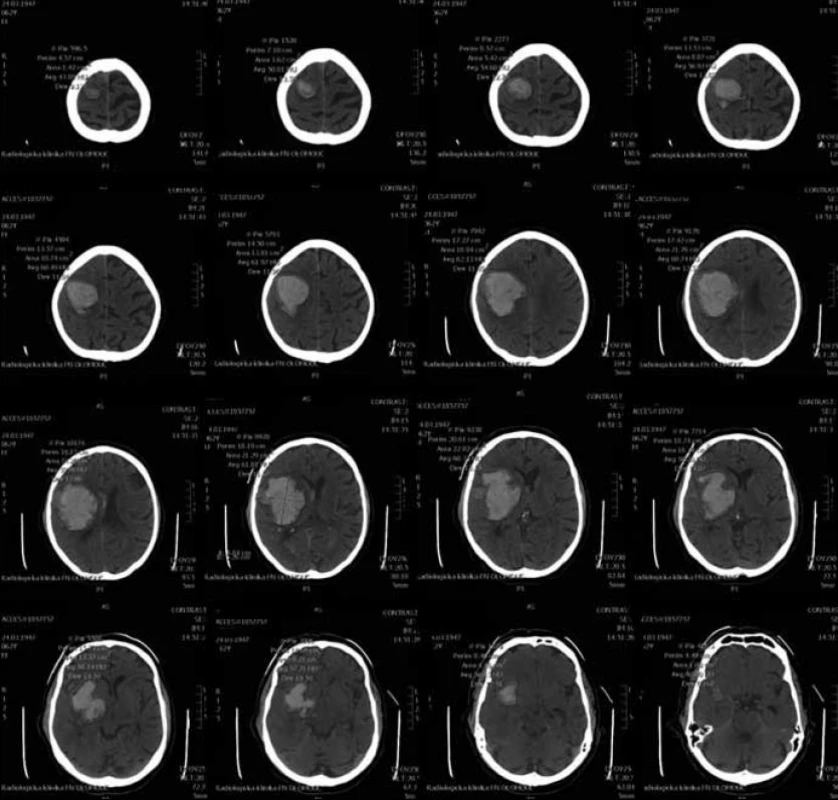
Standardní transsylvijský přístup byl prováděn malou cílenou laterální supraorbitální kraniotomií s hlavou ve svorce, v endotracheální anestezii (neuroleptanalgezie a propofol) s ATB profylaxí, s korekcí TK na hodnoty systoly 100–130 mmHg a manitolem na počátku výkonu. Po obloukovité cílené durotomii byla otevřena arachnoidea nad střední třetinou Sylviovy rýhy a vyhledány oba hlavní kmeny střední mozkové tepny (M2). Hematom byl zastižen v hloubce 10–20 mm přes minimální asi 15 mm dlouhou kortikotomii v inzule, lokalizovanou převážně frontálně. Koagula byla odsávána postupně v závislosti na jejich kvalitě řiditelným vysavačem různého průměru za hojného proplachu, někdy s použitím Yaşargilovy pinzety pro extrakci pevných části. Kavita hematomu byla prázdněna proti směru chodu hodinových ručiček s kontrolou krvácení bipolární pinzetou bez použití retraktorů. Koagulum v místě předpokládaného zdroje bylo odstraňováno jako poslední a zjištěný arteriální zdroj byl sledován a koagulován. Po opakovaném výplachu kavity a kontrole hemostázy byla dura uzavřena vodotěsně a vyšita k okrajům kosti. Záklopka byla uchycena titanovými minidlahami a výkon ukončen rekonstrukcí rány bez drenáže (obr. 3–8).
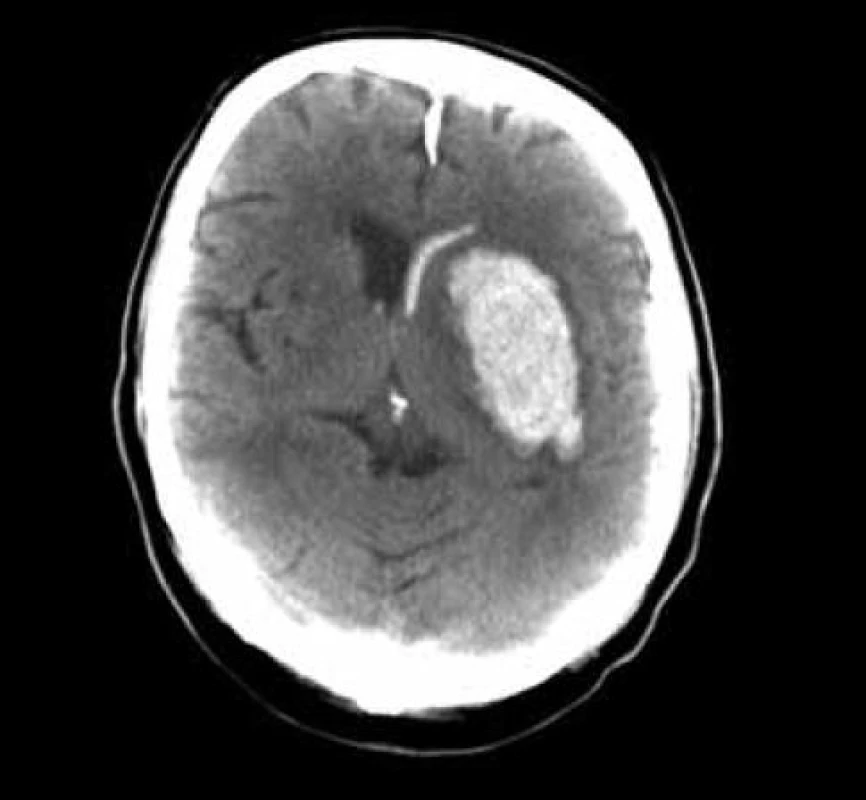
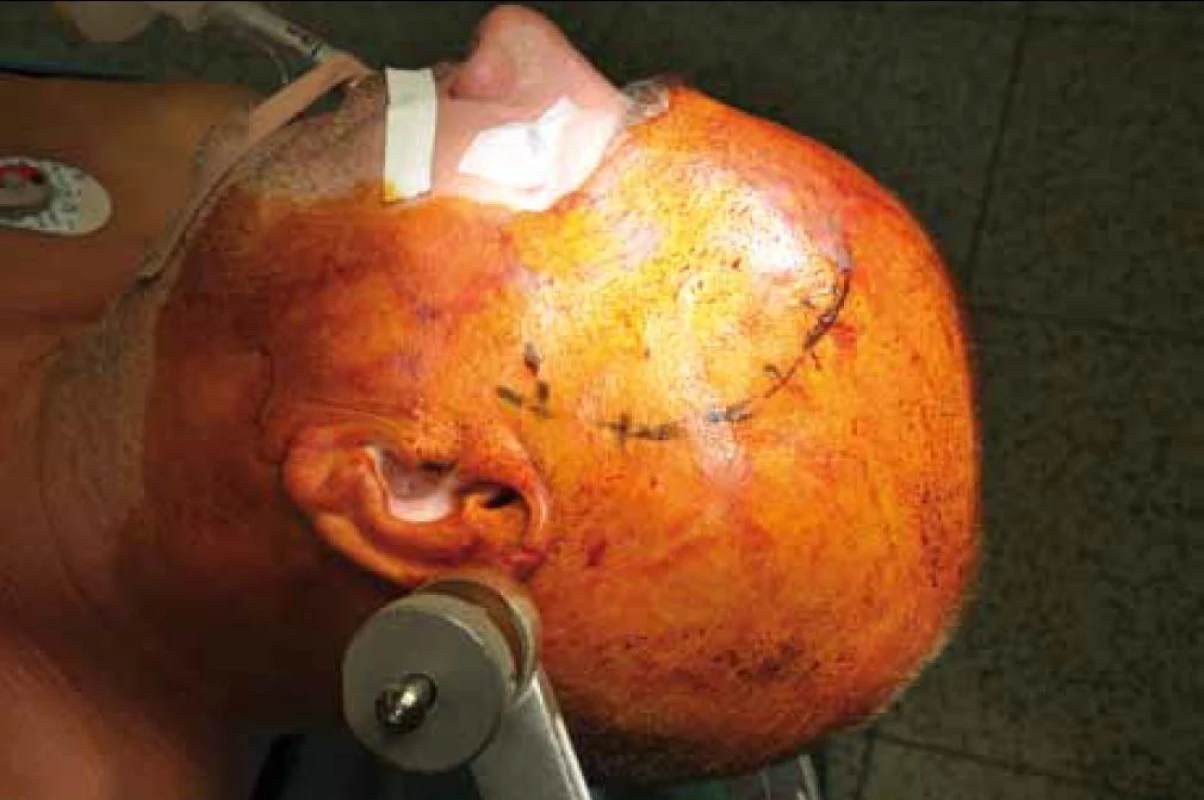
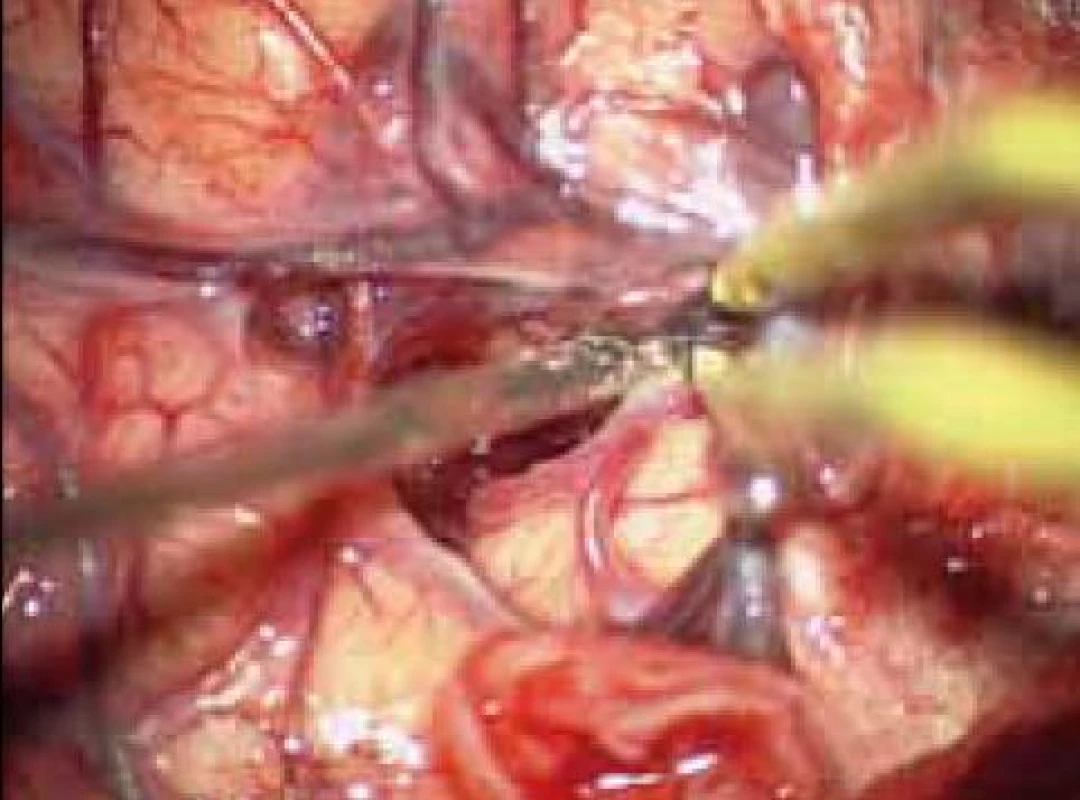
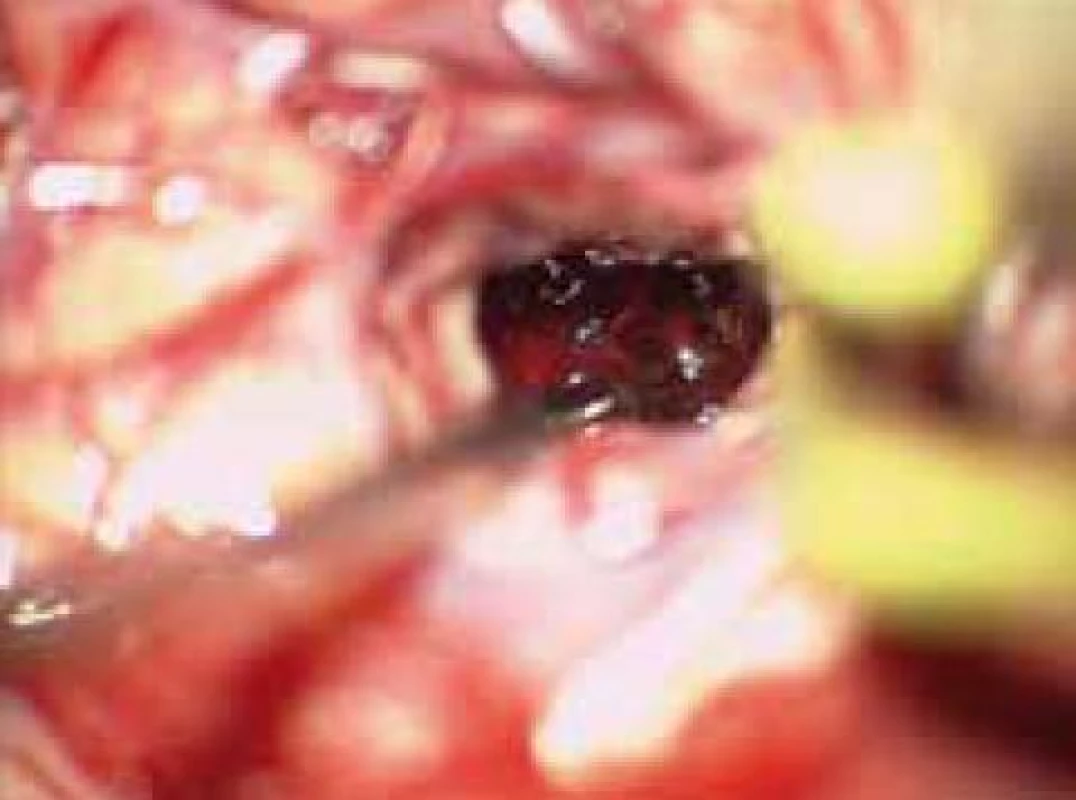
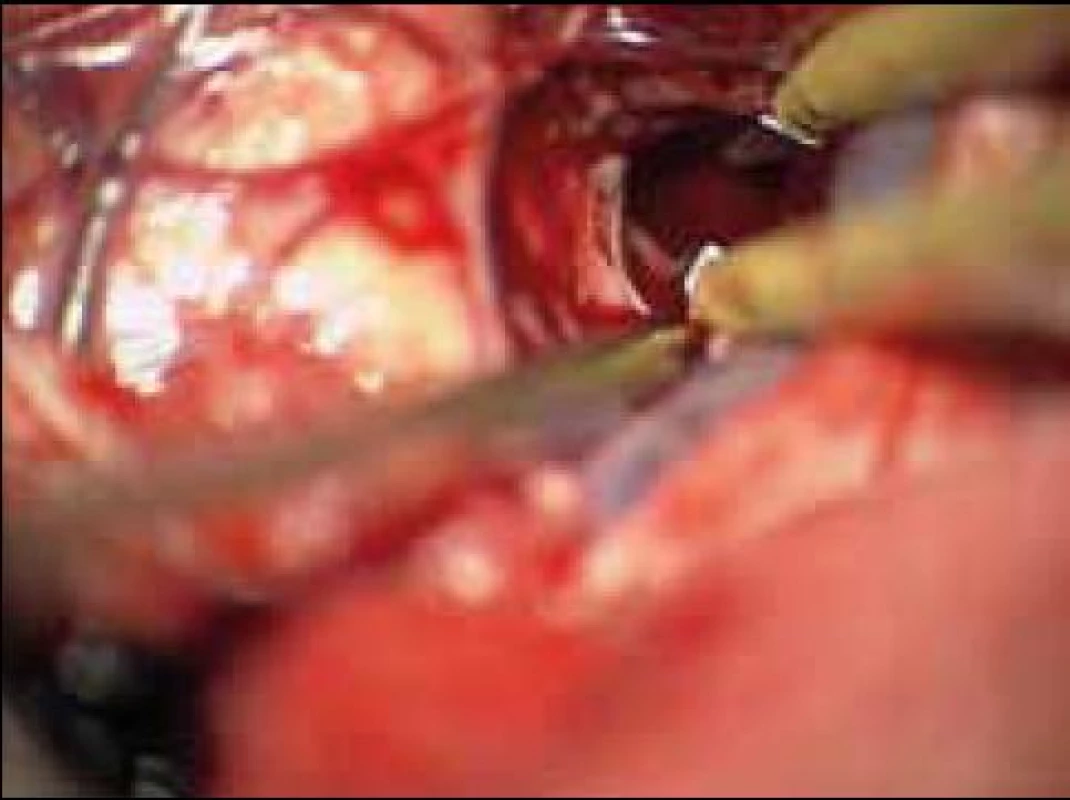
Při GCS méně než 10 bylo zaváděno kontralaterálně multimodální čidlo (ICP, PBT0²), pacient byl léčen na JIP NCH kliniky za monitorování standardních parametrů, se snahou udržet střední perfuzní tlak minimálně na hodnotách 70 mmHg. Léčba hypertenze byla vedena standardní medikací se snahou minimalizovat výkyvy TK oběma směry. V péči o vyrovnané vnitřní prostředí byl kladen důraz na normoglykemii, vyrovnání iontových dysbalancí, normovolemie atd. CT skeny byly prováděny do 12 hodin po výkonu a dále dle dynamiky pooperačního stavu a po půl roce. Další sledování nemocného bylo založeno na udržení kontaktu přímo s nemocným nebo jeho příbuznými. Hodnocení neurologického stavu bylo provedeno při propuštění a po půl roce v běžných škálách (mRS, GOS).
Autoři prohlašují, že studie na lidských subjektech popsaná v manuskriptu byla provedena v souladu s etickými standardy příslušné komise (institucionální a národní) odpovědné za provádění klinických studií a Helsinskou deklarací z roku 1975, revidovanou v r. 2000.
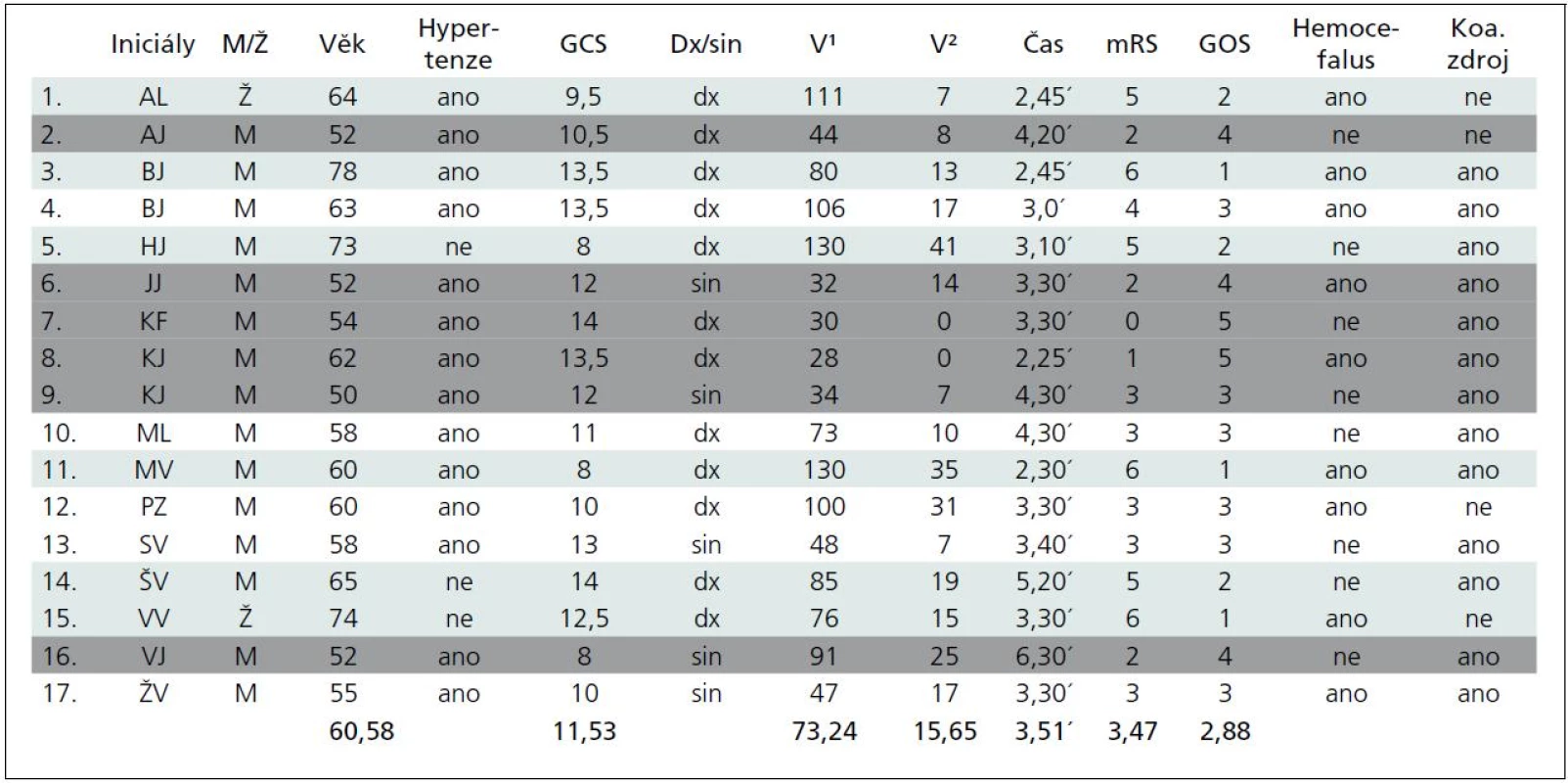
Výsledky (tab. 1)
V souboru 17 nemocných byly dvě ženy (11 %), průměrný věk souboru 60,6 roku (50–74), u 14 (82 %) se jednalo o hypertoniky léčené již před příhodou. Průměrný čas byl 3 hodiny 50 minut (rozmezí 2,5 až 6,5 hod), více než 80 % souboru bylo operováno v čase 4,5 hodiny od počátku symptomů. Vstupní stav byl průměrně 11,5 GCS (8–14), pouze u čtyř bylo vstupní GCS pod 10 (24 %). Pravolevá lokalizace byla v poměru 12 : 5 (76 : 24 %).
Průměrný objem hematomu byl 73,2 ml, ≥ 100 ml byl u pěti pacientů (29,4 %), u sedmi byl objem ≥ 50 ml (41,1 %), sedm mělo objem mezi 30 a 50 ml (41,1 %). Reziduální hematom měl v průměru objem 15 ml (0–41 ml), objem činil průměrně méně než 10 % původního hematomu, ve nejhorším případě 31 % (41 ml po evakuaci 130 ml hematomu). V žádném případě tedy nedošlo k významnému rebleedingu. Hemocefalus byl přítomen u devíti pacientů (52 %).
Koagulace významného zdroje slučitelného s původcem krvácení byla provedena 13krát (76,5 %).
Výsledný stav po půl roce hodnocený v průměru GOS byl v celém souboru 2,9 a při použití mRS 3,5. Šest (35,3 %) nemocných zemřelo buď do 30 dnů po operaci, nebo ve sledovaném půlročním intervalu (zelené označení v tabulce). Šest (35,3 %) dosáhlo stupně významné nezávislosti v denních aktivitách (označení šedé) a pět (29,6 %) přežilo v různém stupni závislosti.
Vzhledem k malé velikosti souboru nelze získat statisticky významné údaje, ale lze vyvodit pouze následující závislosti:
Objem hematomu je hlavní limit výsledku:
- a) hematomy o vstupním objemu větším než 100 ml mají velmi nepříznivou prognózu přes včasnou chirurgickou evakuaci s příznivým bezprostředním pooperačním CT nálezem (při objemu ≥ 100 ml z pěti nemocných přežil jen jeden těžce závislý),
- b) příznivého výsledku dosáhli pouze nemocní s objemem 30–50 ml, s výjimkou jednoho s objemem 91 ml (bez hemocefalu), který dosáhl stupně nezávislosti mRS 2, GOS 4.
Hemocefalus na vstupním CT je prognosticky nepříznivý faktor, vyskytl se u pěti ze šesti zemřelých a byl naopak přítomen pouze v jednom případě ve skupině nemocných s příznivým výsledkem.
Ve 13 (76,5 %) případech byl koagulován předpokládaný zdroj krvácení a v celém souboru nedošlo k významnějšímu rebleedingu, velikost reziduálního hematomu nebyla významná a byla přímo úměrná vstupnímu objemu. Tyto nálezy podporují domněnku, že vznik intracerebrálního hematomu je v počáteční fázi podmíněn jednozdrojovým a jednorázovým dějem, který je kontrolovatelný při včasné intervenci. Rozvoj sekundárního krvácení zcela vyloučit nelze a bude záviset přímo úměrně na objemu hematomu a individuálních anatomických dispozicích jedince. Na provedených CTA nebyly nalezeny ani v jednom případě „hot spots“.
Diskuze
Operační přístup pomocí malé laterální supraorbitální kraniotomie, cílené na střed Sylviovy rýhy, a inzulární 15milimetrová kortikotomie se osvědčil. V tomto časovém intervalu nebyl nikdy rozvinut mozkový edém, otevření rýhy bylo hladké a akcidentální chirurgické trauma minimální. Přístup umožnil odstranění všech kvalit hematomu, dokonalý přehled v kavitě po vyprázdnění hematomu a cílenou koagulaci všech zdrojů krvácení. U 13 pacientů (76 %) byl nalezen významný zdroj pokládaný za příčinu krvácení v oblasti lentikulostriátních perforátorů. U žádného pacienta pak nedošlo k významnějšímu rebleedingu. Časná intervence je tak prevencí rebleedingu i sekundární expanze hematomu, která bývá jinak sledována až u třetiny případů léčených konzervativně. Ve studiích upozorňujících na možnost rebleedingu při intervenci v prvních 8 hodinách po iktu se většinou jedná o jiný typ intervence než je otevřený mikrochirurgický přístup.
Ve světové literatuře je k dispozici celkem 15 randomizovaných klinických studií, které srovnávají chirurgickou a konzervativní terapii ICH, osm využívá k evakuaci hematomu kraniotomii, další pak minimálně invazivní metody s použitím drénu s aplikací trombolytických látek. Chirurgická větev studií bývá porovnávána s výsledky nejlepší možné medikamentózní léčby:
Tan et al (2001) [25] porovnávali soubor 34 nemocných s minimálním objemem hematomu 30 ml s evakuací standardní pterionální kraniotomií s použitím mikroskopu s časem do operace 8,5 hodiny. Nenašli statisticky významný rozdíl v mortalitě (47,1% : 35,3%) ani v dlouhodobém výsledku po roce.
McKissock et al v roce 1961 [26] uváděli chirurgickou mortalitu 65 %, konzervativní 51 %, těžký stupeň závislosti u přeživších byl v chirurgické skupině 80 %, v medikamentózní jen 66 %.
Morgenstern et al v roce 1998 [27] realizovali studii, ve které kombinovali časnou evakuaci hematomu s nejlepší možnou medikamentózní terapií a kontrolou nitrolebečního tlaku. Operace byla realizována do 12 hodin, měsíční mortalita byla v chirurgické skupině 23,5 %, proti 18,9 %. Bartel index byl v poměru 65 : 55 a pro malý počet pacientů nebylo možné dosáhnout statistického významu studie (41 pacientů).
Zuccarello et al (1999) [28] randomizovali 20 pacientů, které léčili do 24 hodin po příhodě při GCS větším než 4 a objemu hematomu větším než 10 ml. Operace byla realizována do 3 hodin po randomizaci, do chirurgické léčby pak ale patřila kromě kraniotomie i evakuace hematomu pomocí punkce a drenáže s trombolytiky. V chirurgické skupině byl čas od počátku symptomů do operace průměrně 8,5 hodiny. Za tři měsíce po operaci byl GOS vyšší než 3 statisticky nevýznamný – 56 : 36 %, stejně se nelišila mortalita 22 : 27 % a další indexy (BI, mRS) po tříměsíční léčbě.
Auer et al 1989 [21] v souboru 100 pacientů sledovali trend k lepším výsledkům v chirurgické skupině, kde ale převažovaly subkortikální hematomy. Celková půlroční mortalita v chirurgické skupině byla 42 %.
Juvela et al (1989) [29] referovali o 52 pacientech, s poměrem mezi chirurgickou a konzervativní skupinou v mortalitě 46 : 38 %. Pouze 20 % v obou skupinách dosáhlo stupně nezávislosti. Přikláněl se ke konzervativnímu způsobu léčby, protože u pacientů s GCS mezi 7 a 10 mohla intervence zlepšit přežití, ale kvalitu života příznivě neovlivnila.
Batjer et al 1990 [30] randomizovali 21 nemocných s putaminálním krvácením v průměru větším než 3 cm, přičemž v konzervativní skupině byla použita i komorová drenáž k dosažení kontroly nitrolebečního tlaku. Pterionální kraniotomie s inzulární kortikotomií se nejvíce blíží referované grantové studii. Po šesti měsících pouze dva z devíti pacientů v medikamentózní skupině dosáhli nezávislosti a pouze dva z osmi po evakuaci kraniotomií byli soběstační. Nemocní s komorovou drenáži zemřeli nebo zůstali ve vegetativním stavu. Studie byla vzhledem k nepříznivým výsledkům předčasně ukončena.
Hattori et al (2004) [31] popsali zkušenost s 242 nemocnými, kde v chirurgické skupině byla použita stereotaktická evakuace. Studie prokázala pro selektovanou skupinu s menším krvácením lepší chirurgické výsledky jak v mortalitě (11,8 %), tak ve funkční nezávislosti (47 %).
Wang et al (2009) [32] randomizovali 377 nemocných, evakuace byla provedena punkcí s trombolytiky a mortalita ovlivněna nebyla, příznivější výsledky byly dosaženy v chirurgické skupině při dlouhodobém výsledku ve funkční nezávislosti.
Studie STICH (2005) (Mendelow et al [14]) neprokázala v souboru 1 033 nemocných příznivý statisticky významný výsledek pro chirurgickou větev (v 75 % se jednalo o evakuaci kraniotomií). Mortalita byla v poměru 36 : 37 %. Příznivý výsledek byl dosažen v chirurgické skupině ve 26 %, proti 24 %. Metaanalýza selektovala lobární typ hematomů, kde byl příznivý vliv intervence zřejmý a posléze byla iniciována studie STICH II. Výsledky prvních 300 nemocných studie STICH II (lobární hematom) mají následující charakteristiku: 22 % pacientů zemřelo, 44 % vykázalo těžkou závislost, 18 % závislost středního stupně, jen 16 % dosáhlo stupně nezávislosti. Podobné výsledky byly v mRS, kdy mRS 3 dosáhlo 18 %, mRS 2 17 %, mRS 1 pouze 6 %. Po šesti měsících pouze 9 % nemocných žije samostatně, 80 % za různého stupně dopomoci v rodinném kruhu.
Zuccarello (2011) [22] analyzoval s podobnými výsledky řadu dalších studií [33–35]. Přestože myšlenka urgentní evakuace ICH vychází z teoreticky jednoznačných předpokladů a je podporována řadou testů na zvířatech, klinická aplikace nedosahuje očekávaných výsledků. Rovněž prezentovaný soubor v porovnání s výše uvedenými studiemi nevybočuje z řady a pro skupinu pacientů s objemem ICH mezi 30 a 80 ml mírně favorizuje chirurgickou léčbu nad konzervativním postupem.
Závěr
Cílem léčby spontánního intracerebrálního krvácení putaminálního je dosažení maximálního stupně nezávislosti. Časnou chirurgickou intervenci (2–8 hod) transsylvijským přístupem lze doporučit při objemu hematomu 30–80 ml a vstupním skóre GCS ≥ 8, kdy lze očekávat příznivý efekt pro přežití i pro dosažení funkčního výsledku. Při větším objemu hematomu a nižším GCS je dosažení užitečného stupně nezávislosti v denních aktivitách výjimečné.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Podpořeno Grantem IGA MZ ČR NS 10314-3/2009.
M. Vaverka, J. Kozák, D. Šaňák, D. Krahulík, L. Hrabálek
Neurochirurgická klinika LF UP a FN Olomouc
doc. MUDr. Miroslav Vaverka, CSc.
Neurochirurgická klinika
LF UP a FN Olomouc
I. P. Pavlova 6
772 00 Olomouc
e-mail: vaverka.miroslav@seznam.cz
Přijato k recenzi: 2. 4. 2012
Přijato do tisku: 11. 5. 2012
Sources
1. Beneš V. Mozkové krvácení hypertoniků: Chirurgické léčení. Praha: Avicenum 1983.
2. Smrčka V, Zicha J. Spontánní intracerebrální hematomy. Diagnostika, klinika, terapie. Brno: Masarykova univerzita 1994.
3. Kanno T, Sano H, Shinomiya Y, Katada K, Nagata J, Hoshino M et al. Role of surgery in hypertensive ICH. A comparative study of 305 nonsurgical and 154 surgical cases. J Neurosurg 1984; 61(6): 1091–1099.
4. Siddique MS, Fernandes HM, Wooldridge TD, Fenwick JD, Slomka P, Mendelow DJ. Reversible ischemia around intracerebral hemorrhage: SPECT study.J Neurosurg 2002; 96(4): 736–741.
5. Nilsson OG, Polito A, Säveland H, Ungerstedt U, Nordström CH. Are primary supratentorial intracerebral hemorrhages surrounded by a biochemical penumbra? A microdialysis study. Neurosurgery 2006; 59(3): 521–528.
6. Aronowski J, Zhao X. Molecular patophysiology of cerebral hemorrhage: secondary brain injury. Stroke 2011; 42(6): 1781–1786.
7. Andaluz N, Zuccarello M. Recent trends in the treatment of spontaneous intracerebral hemorrhage: analysis of a nationwide inpatient database. J Neurosurg 2009; 110(3): 404–410.
8. Morioka J, Fujii M, Kato S, Fujisawa H, Akimura T, Suzuki M et al. Japan Standard Stroke Registry Group (JSSR). Surgery for spontaneous ICH has greater remedial value than conservative therapy. Surg Neurol 2006; 65(1): 67–73.
9. Kaya RA, Türkmenoglu O, Ziyal IM, Dalkilic T, Sahin Y, Aydin Y. The effects on prognosis of surgical treatment of hypertensive putaminal hematomas through transsylvian transinsular approach. Surg Neurol 2003; 59(3): 176–183.
10. Pantazis G, Tsitsopoulos P, Mihas C, Katsiva V, Stavrianos V, Zymaris S. Early surgical treatment vs conservative management for spontaneous ICH: a prospective randomized study. Surg Neurol 2006; 66(5): 492–502.
11. Boshert S. Spot sign predict intracerebral hemorrhage growth. Family practice news digital network. Available from: http://www.medconnect.com.au/.
12. Wang YF, Wu JS, Mao Y, Chen XC, Zhou LF, Zhang Y. The optimal time-window for surgical treatment of spontaneous intracerebral hemorrhage: results of prospective randomized controlled trial of 500 case. Acta Neurochir Suppl 2008; 105 : 141–145.
13. Kaneko M, Tanaka K, Shimada T, Sato K, Uemura K. Long-term evaluation of ultra-early operation for hypertensive ICH in 100 cases. J Neurosurg 1983; 58(6): 838–842.
14. Mendelow AD, Gregson BA, Fernandes HM, Murray GD, Teasdale GM, Hope DT at al. Early surgery versus initial conservative treatment in patients with spontaneous supratentorial intracerebral hematomas in the International Trial in Intracerebral Haemorrhage (STICH): a randomised trial. Lancet 2005; 365(9457): 387–397.
15. Oiu TM, Zhang Y, Wu JS. Preliminary application of pyramidal tractography in evaluating prognosis of patients with hypertensive intracerebral hemorrhage. Acta Neurochir Suppl 2008; 105 : 165–167.
16. Adeoyne O, Woo D, Haverbusch M, Sekar P, Moomaw CJ, Broderick J et al. Surgical management and case-fatality rates of ICH in 1988 and 2005. Neurosurgery 2008; 63(6): 1113–1117.
17. Chen XG, Yang H, Czhering Z. The comparative study of the total medical and surgical treatment of hypertensive haemorrhage. Acta Academica Medicinae Shangai 1990; 19 : 234–240.
18. Chen XC, WU JS, Zhou XP, Wang YF, Mao Y, Zhang Y et al. The randomized multicentric prospective controlled trial in the standardized treatment of surgical therapeutic outcomes with conservative therapy. Chin J Clin Neurosci 2001; 9 : 365–368.
19. Hänggi D, Steiger HJ. Spontaneous intracerebral haemorrhage in adults: a literature overview. Acta Neurochir 2008; 150(4): 371–379.
20. Hosseini HC, Leguirinel C, Hariz M, Melon E, Palfi S, Beck P et al. Stereotactic aspiration of deep intracerebral hematomas under CT control: a multicentric prospective randomized trial.12th European stroke conference 2003; Spain, Valencia.
21. Auer LM, Deinsberger W, Niederkorn K, Gell G, Kleinert R, Schneider G et al. Endoscopic surgery versus medical treatment for spontaneous intracerebral hematoma: a randomized study. J Neurosurg 1989; 70(4): 530–535.
22. Zuccarello M. Intracerebral hemorrhage: surgical trial overview. Neurotrauma and vascular neurosurgery. International proceedings. Bologna: Medimond 2011 : 11–16.
23. Morgenstern LB, Hemphill JC 3rd, Anderson C, Becker K, Broderick JP, Connolly ES Jr et al. Guidelines for management of spontaneous intracerebral hemorrhage: a guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2010; 41(9): 2108–2129.
24. Hrabálek L, Houdek M, Dvořák P, Heřman M. CT řízená stereotaktická léčba intracerebrálních hematomů s použitím urokinasy. Cesk Slov Neurol N 1996; 59/92(6): 319–325.
25. Tan SH, NG PY, Yeo TT, Wong SH, Ong PL, Venketasubramanian N. Hypertensive basal ganglia hemorrhage: a prospective study comparing surgical and nonsurgical management. Surg Neurol 2001; 56(5): 287–293.
26. McKissock W, Richardson A, Taylor J. Primary intracerebral haemorrhage. A controlled trail of surgical and conservative treatment in 180 unselected cases. Lancet 1961; 2 : 221–226.
27. Morgenstern LB, Frankowski RF, Shedden P, Pasteur W, Grotta JC. Surgical treatment for intracerebral hemorrhage (STICH): a single-center, randomized clinical trial. Neurology 1998; 51(5): 1359–1363.
28. Zuccarello M, Brott T, Derex L, Kothari R, Sauerbeck T, Tew J et al. Early surgical treatment for supratentorial intracerebral hemorrhage: a randomized feasibility study. Stroke 1999; 30(9): 1833–1839.
29. Juvela S, Heiskanen O, Poranen A, Valtonen S, Kuurne T, Kaste M at al. The treatment of spontaneous intracerebral hemorrhage: a prospective randomized trial of surgical and conservative treatment. J Neurosurg 1989; 70(5): 755–758.
30. Batjer HH, Reisch JS, Allen BC, Plaizier LJ, Su CJ. Failure of surgery to improve outcome in hypertensive putaminal hemorrhage. A prospective randomized trial. Arch Neurol 1990; 47(10): 1103–1106.
31. Hattori N, Katayama Y, Maya Y, Gatherer A. Impact of stereotactic hematoma evacuation on activities of daily living during the chronic period following spontaneous putaminal hemorrhage: a prospective randomized study. J Neurosurg 2004; 101(3): 414–420.
32. Wang WZ, Jiang B, Liu HM, Li D, Lu CZ, Zhao YD et al. Minimally invasive craniopuncture therapy vs conservative treatment for spontaneous intracerebral hemorrhage: results from a randomized clinical trial in China. Int J Stroke 2009; 4(1): 11–16.
33. Teernstra OP, Evers SM, Lodder J, Leffers P, Franke CL, Blaauw G at al. Stereotactic treatment of intracerebral hematoma by means of a plasminogen activator: a multicenter randomized controlled trial (SICHPA). Stroke 2003; 34(4): 968–974.
34. Kaya A, Türkmenoglu O, Ziyal IM, Dalkilic T, Sahin Y, Aydin Y. The effects on prognosis of surgical treatment of hypertensive putaminal hematomas through transsylvian transinsular approach. Surg Neurol 2003; 59(3): 176–183.
35. Sorimachi T, Fujii Y, Morita K, Tanaka R. Predictors of hematoma enlargement in patients with ICH treated with rapid administration of antifibrinolytic agents and strict blood pressure control. J Neurosurg 2007; 106(2): 250–254.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2013 Issue 1
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Memantine Eases Daily Life for Patients and Caregivers
-
All articles in this issue
- Použití botulotoxinu v neurologii
- Národní registr cévních mozkových příhod (registr IKTA) – je potřebný?
- Gliom vyššího stupně kaudální oblasti míchy imitující myelitidu – kazuistika
- Proměnlivá tvář parkinsonské neurodegenerace
- Tetanus – staronová diagnóza? Kazuistika
- Snížená denzita kostního minerálu u žen s roztroušenou sklerózou
- Posttraumatická transdurální herniace míchy – kazuistika
- Mapování mozkové aktivity pomocí funkční magnetické rezonance během plnění močového měchýře
- Vztah deprese a rozeznávání emocí z výrazu tváře u pacientů s mírnou kognitivní poruchou
- Kvalita života u pacientů s demencí
- Použití transcerebelárního přístupu s obrácenou montáží stereotaktického rámu pro biopsii lézí zadní jámy lební
- Časná chirurgická léčba spontánního intracerebrálního krvácení
- Častý výskyt lymeské neuroboreliózy u dětí v České republice
- Hydrocefalus jako komplikace subarachnoidálního krvácení
- Bezpečnost a účinnost nového schématu dávkování trombolýzy – pilotní studie
- Atlantookcipitální dislokace – soubor šesti pacientů a přehled problematiky
- Může souviset úzký páteřní kanál s tvorbou granulomu na konci katétru uloženém v intratékálním prostoru? Kazuistika
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Použití botulotoxinu v neurologii
- Častý výskyt lymeské neuroboreliózy u dětí v České republice
- Tetanus – staronová diagnóza? Kazuistika
- Hydrocefalus jako komplikace subarachnoidálního krvácení