Periprocedurální komplikace a dlouhodobý efekt karotických angioplastik – výsledky z praxe
Periprocedural Complications and Long-term Clinical Follow-up of Carotid Artery Angioplasty – Results from Practice
Aim:
Carotid artery angioplasty is a preventive measure to decrease a risk of cerebral ischemia due to stenosis of the internal carotid artery bifurcation. To achieve this purpose, it is crucial that the procedure has a minimal risk of complications and its effect is long-lasting. The purpose of our study was to verify safety of carotid angioplasty and its long-term effect in clinical practice.
Material and method:
The study included 450 patients with 442 carotid artery stents and 8 plain carotid angioplasties since 1997. Complications occurring during the first three days after the procedure (periprocedural complications) and during long-term clinical and ultrasonographical follow-up (median 33 months) were recorded.
Results:
The risk associated with carotid angioplasty was low: in hospital mortality due to intracerebral hemorrhage was 0.5%, minor stroke occurred in 1.0%, transient ischemic attack in 2.4%. > 70% restenosis was found in 3.6% of the 76% of all patients who had long-term follow-up. Asymptomatic restenoses were 81%.
Conclusions:
Our results confirmed that carotid angioplasty is a safe method with beneficial long-term effect if it is done for appropriate indication and performed by a skilled intervention radiologist.
Key words:
carotid stenting – periprocedural complication – long-term follow-up – restenosis
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Authors:
D. Krajíčková 1,2; A. Krajina 1,2; Miroslav Lojík 1,2
; V. Chovanec 1,2; J. Raupach 1,2; I. Guňka 1,3; M. Vališ 1,2
Authors‘ workplace:
Komplexní cerebrovaskulární centrum, LF UK a FN Hradec Králové
1; Neurologická klinika, LF UK a FN Hradec Králové
2; Radiologická klinika, LF UK a FN Hradec Králové
3; Chirurgická klinika, LF UK a FN Hradec Králové
4
Published in:
Cesk Slov Neurol N 2016; 79/112(3): 317-322
Category:
Original Paper
Overview
Cíl:
Karotická angioplastika je preventivní metoda, jejímž účelem je snížit riziko mozkové ischemie způsobené stenózou odstupu vnitřní karotické tepny. K dosažení tohoto účelu je třeba, aby výkon měl nízké riziko komplikací a jeho efekt dlouho přetrvával. Cílem naší práce bylo ověřit bezpečnost karotických angioplastik a jejich dlouhodobý účinek v klinické praxi.
Materiál a metodika:
Soubor tvoří 450 angioplastik, z nichž 442 bylo s implantací stentu, které jsme provedli od roku 1997 u 414 nemocných. Zaznamenávali jsme komplikace během tří dnů po výkonu (periprocedurální) a v průběhu dlouhodobého UZ a klinického sledování (medián 33 měsíců).
Výsledky:
Riziko angioplastiky bylo nízké: hospitalizační mortalita = mozkové krvácení 0,5 %, mozková ischemie (minor stroke) 1,0 %, tranzitorní ischemická ataka 2,4 %. Restenózu > 70 % jsme v dalším průběhu zjistili u 3,6 % ze 76 % dlouhodobě sledovaných nemocných, 81 % restenóz bylo asymptomatických.
Závěry:
Naše výsledky potvrzují, že angioplastika je při správné indikaci a provedení zkušeným operatérem metoda bezpečná a její pozitivní efekt dlouho přetrvává.
Klíčová slova:
karotický stenting – periprocedurální komplikace – dlouhodobé sledování – restenóza
Úvod
Intervenční léčba stenózy odstupu vnitřní karotické tepny (ACI) – karotická endarterektomie (CEA) nebo angioplastika – je vždy spojena s rizikem periprocedurální komplikace. Aby bylo toto riziko oprávněné, nesmí být vyšší než riziko medikamentózně léčené stenózy a efekt intervenční léčby spočívající v dlouhodobé ochraně nemocného před ischemickou mozkovou příhodou by měl dlouho přetrvávat.
Úspěch endovaskulární léčby je ve srovnání s CEA více závislý na anatomii tepny [1]. Z hlediska anatomického jsou relativní kontraindikací výkonu všechny situace znesnadňující hladké zavedení instrumentária – tj. pokročilé kalcifikace působící závažnou excentrickou stenózu, elongace tepny a extrémní vinutost přívodných tepen, a pro vysoké riziko distální embolizace při manipulaci katétrem vlající trombus v místě stenózy. Zvýšeně rizikové jsou ulcerace a trombus v poststenotickém úseku [2,3]. Nevhodní k endovaskulární léčbě jsou nemocní, kteří nemohou užívat duální protidestičkovou léčbu, jež má zásadní význam pro úspěch endovaskulární léčby. Méně vhodní jsou nemocní s těžkou renální insuficiencí pro nutnost opakovaného podání jodové kontrastní látky (k. l.) během výkonu – u nich lze však snížit použité množství k. l. a výkon modifikovat technicky. K endovaskulární léčbě jsou indikovány neaterosklerotické stenózy, např. postiradiační, při fibromuskulární dysplazii nebo Takayasuově arteritidě, při disekcích, a stavy zvyšující riziko CEA – restenózy, nemocní s druhostrannou okluzí [4] a ti, u nichž by byla chirurgická léčba technicky obtížná buď pro vysoko uloženou bifurkaci karotické tepny (úroveň C2 a výše) nebo příliš distální lézi – proximální část a. carotis communis (ACC) či pro silný krátký krk [5]. Endovaskulární léčba je optimální volbou v případě tandemové stenózy, protože je schopna vyřešit obě léze. Věk > 70 let riziko endovaskulární léčby zvyšuje [6–9].
Cílem naší práce bylo ověřit bezpečnost a dlouhotrvající efekt karotických angioplastik v klinické praxi.
Materiál a metodika
Prospektivně jsme sledovali všechny nemocné, kteří od roku 1997 do konce února 2013 prodělali neurgentní angioplastiku extrakraniálního úseku ACI. Kromě osmi samotných balónkových angioplastik (PTA) byla u všech dalších výkonů dilatace tepny doplněna implantací stentu (karotický stenting; CAS). Od roku 2002 jsme u všech výkonů ke snížení rizika distální embolizace použili protektivní filtr. Jednalo se plánované výkony, u symptomatických stenóz realizované nejdříve čtyři týdny po kvalifikující příhodě. Všichni nemocní byli zajištěni duální protidestičkovou léčbou, kterou jsme začali podávat tři dny před výkonem. Indikaci k výkonu, která byla společným rozhodnutím neurologa, intervenčního radiologa a chirurga, jeho metodiku a péči po ošetření jsme již dříve publikovali [10,11].
Periprocedurální komplikace zaznamenané neurologem během třídenní hospitalizace po výkonu jsme rozdělili na závažné (mozková ischemie typu minor nebo major stroke, intrakraniální krvácení či jiné potenciálně závažné extracerebrální krvácení, srdeční selhání a úmrtí) a tranzitorní (tranzitorní ischemické ataky; TIA; a hypoxické konvulze). Zdravotní stav ve 30 dnech jsme zjišťovali aktivně prostřednictvím telefonického kontaktu s nemocným nebo s jeho praktickým lékařem.
Po propuštění byli nemocní klinicky a sonograficky (UZ) v pravidelných půlročních intervalech kontrolováni stejným neurologem.
Výsledky
Základní charakteristika souboru
Provedli jsme 450 angioplastik u 414 nemocných, jejichž průměrný věk byl 68 roků. Muži tvořili 73 % souboru (303). U obou pohlaví byla o něco častěji ošetřena levá karotická tepna (54 %). Zastoupení symptomatických a asymptomatických tepen bylo prakticky stejné (49 %/220, resp. 51 %/230). U 59 % nemocných se jednalo o polystenotické postižení, 12 % tvořily restenózy po CEA.
Periprocedurální komplikace
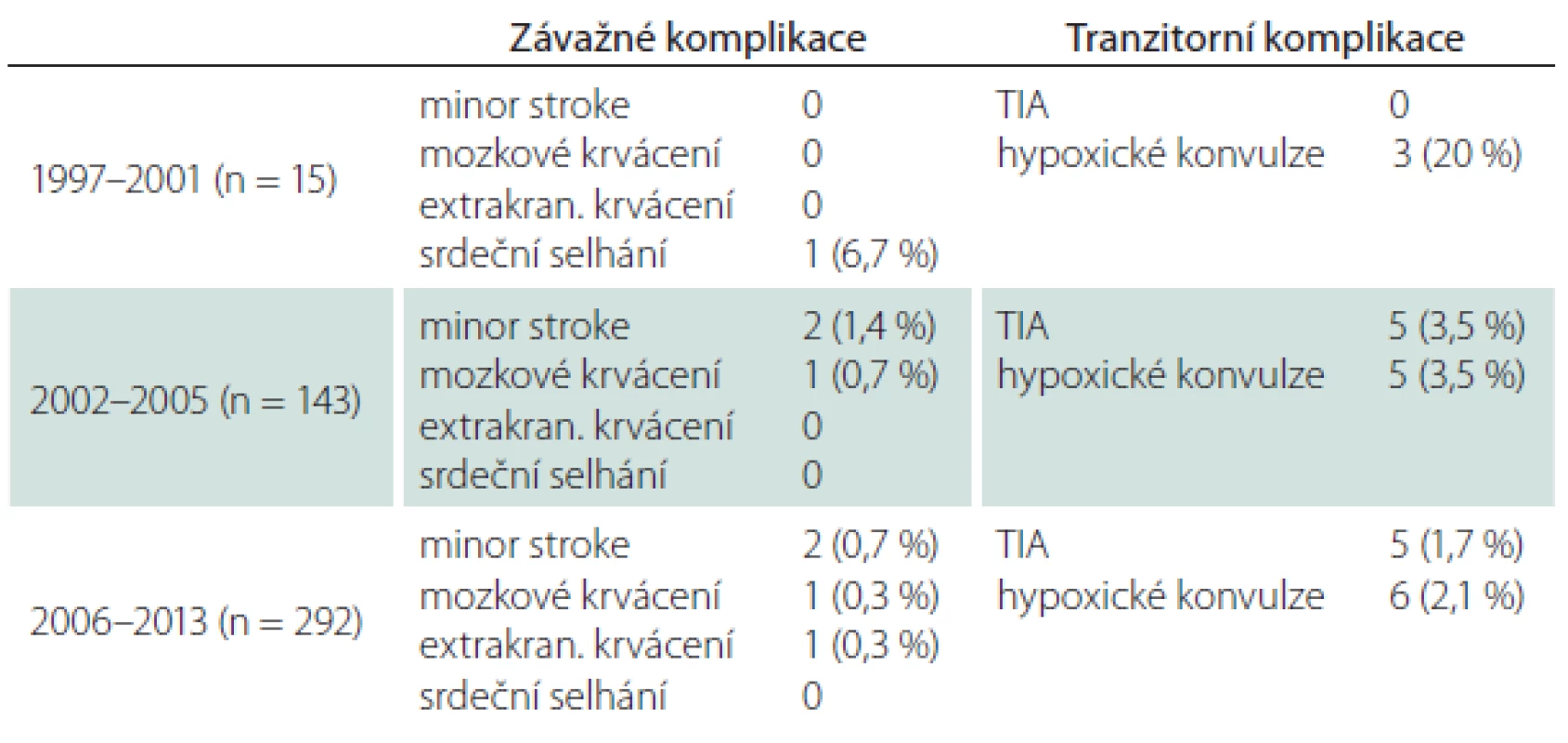
Všechny periprocedurální komplikace se manifestovaly do 48 hod od výkonu (tab. 1). Závažné mozkové komplikace se objevily u šesti CAS (1,3 %), čtyřikrát (0,9 %) se jednalo o drobnou neinvalidizující ischemickou cévní příhodu (minor stroke), u dvou nemocných (0,4 %) došlo k závažnému intrakraniálnímu krvácení, které skončilo fatálně. Jeden případ extrakraniálního krvácení spočíval v hemodynamicky nevýznamném retroperitoneálním hematomu při poranění femorální tepny. Protrahovaná hemodynamická nestabilita po výkonu vedla u jednoho nemocného k levostrannému srdečnímu selhání s nutností přechodné umělé plicní ventilace, konečný výsledek byl dobrý. Hospitalizační i 30denní M/M (morbidita/ mortalita) zahrnující závažné cerebrální a extracerebrální komplikace vztažená na počet výkonů byla 1,8 %, na počet nemocných 1,9 % (tab. 1, 2). Ošetření symptomatických stenóz nebylo ve srovnání s asymptomatickými stenózami spojeno s vyšším rizikem závažné mozkové komplikace – 1,4 vs. 1,3 % (minor stroke 0,9 vs. 0,9 %, krvácení 0,5 vs. 0,4 %).
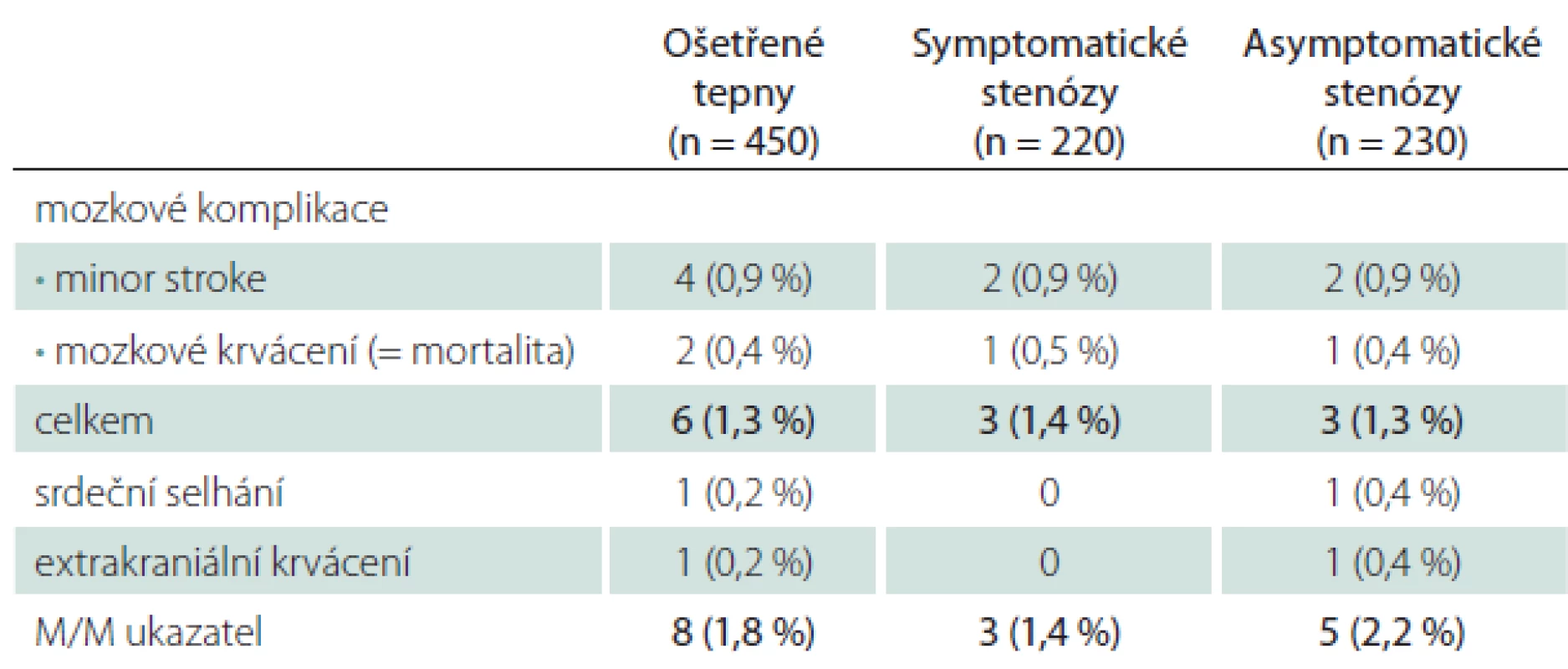
Tranzitorní komplikace jsme zaznamenali u 5,3 % CAS (TIA 2,2 %, hypoxické konvulze 3,1 %) (tab. 3). V šesti případech z celkového počtu 10 mužů s TIA vznikla komplikace intraprocedurálně, u zbývajících čtyř mužů v prvních hodinách po výkonu, v polovině případů při současných projevech hemodynamické nestability. Generalizované končetinové konvulze, které jsou projevem přechodné hypoxie mozku během dilatace tepny a rychle ustupují po desuflaci balónku, byly sice častější po ošetření symptomatických (3,6 %) než asymptomatických stenóz (2,6 %), v absolutních číslech se však jednalo o rozdíl dvou výkonů. Riziko této komplikace zvyšovalo současné ošetření dvou tepen (5,9 vs. 3,4 % v celém souboru) (tab. 4).

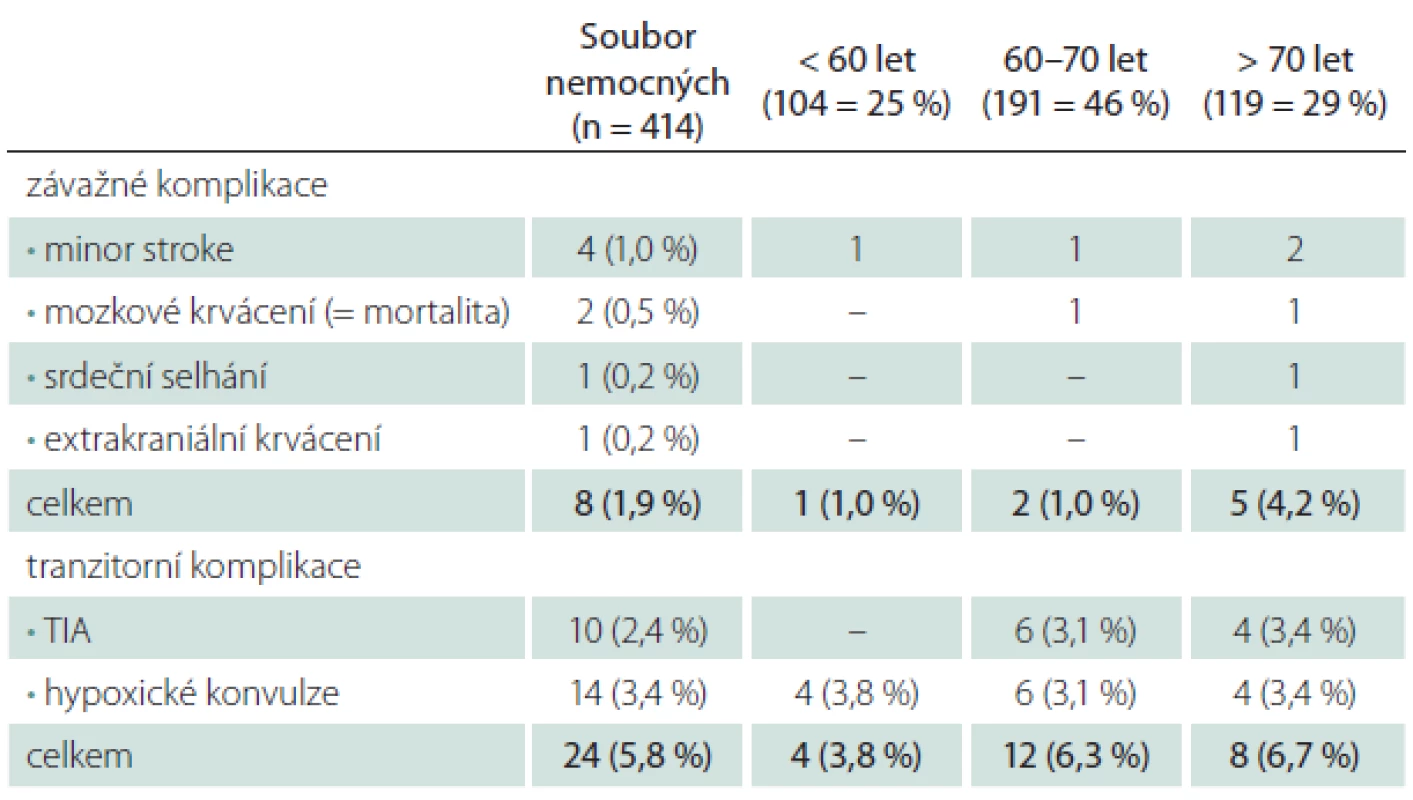
Věk > 70 let při srovnání s věkem < 70 let znamenal čtyřnásobné riziko závažné periprocedurální komplikace, výskyt tranzitorních komplikací byl věkem ovlivněn méně (tab. 2).
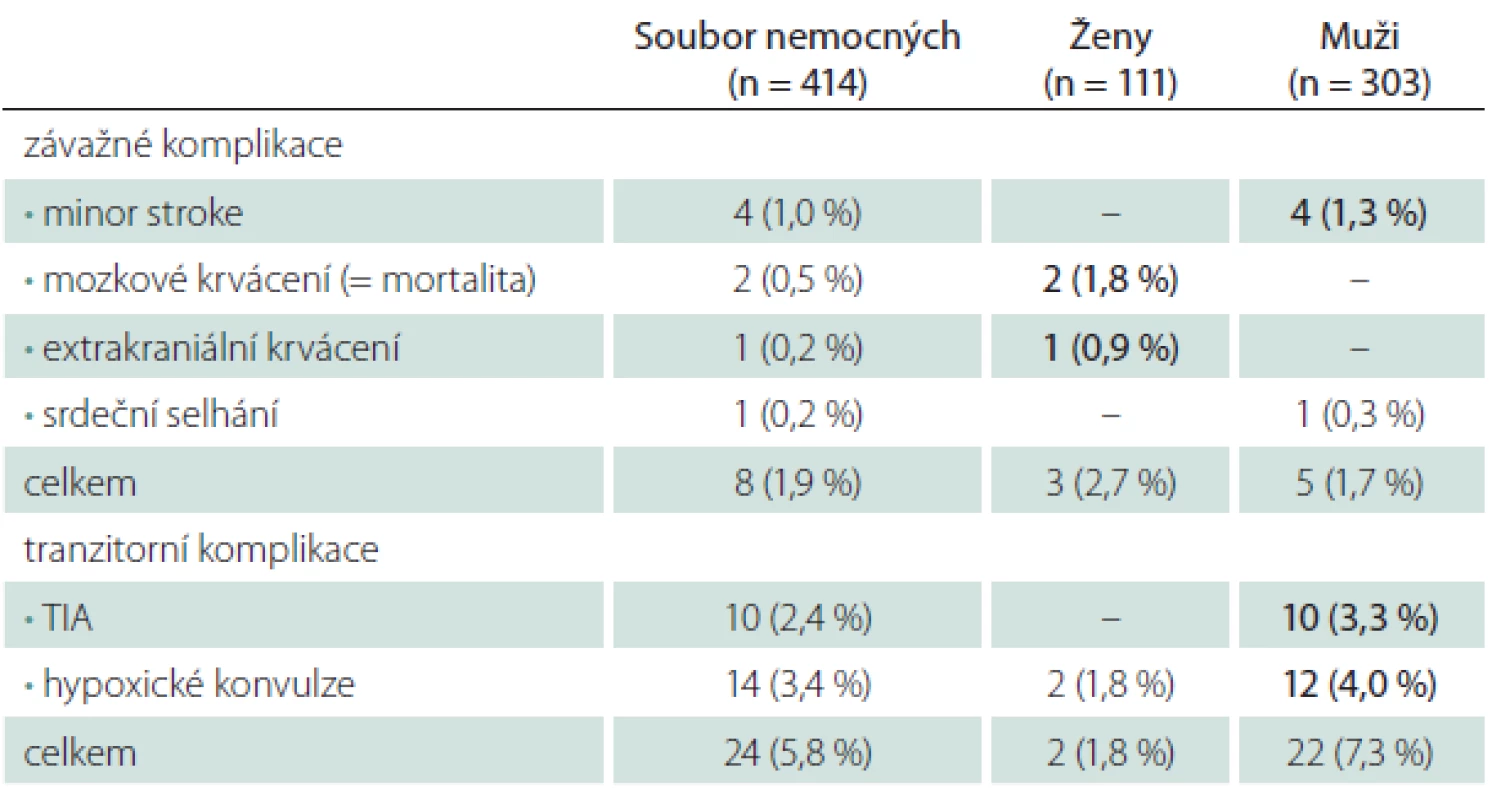
Ženy měly vyšší riziko závažných komplikací (2,7 vs. 1,7 % u mužů), týkalo se však pouze krvácivých komplikací (tab. 5). Muži měli naopak větší dispozici k ischemickým komplikacím – všechny ložiskové ischemie (minor stroke, TIA) v našem souboru postihly jenom muže. Ženy měly i menší riziko hypoxických konvulzí během dilatace tepny.
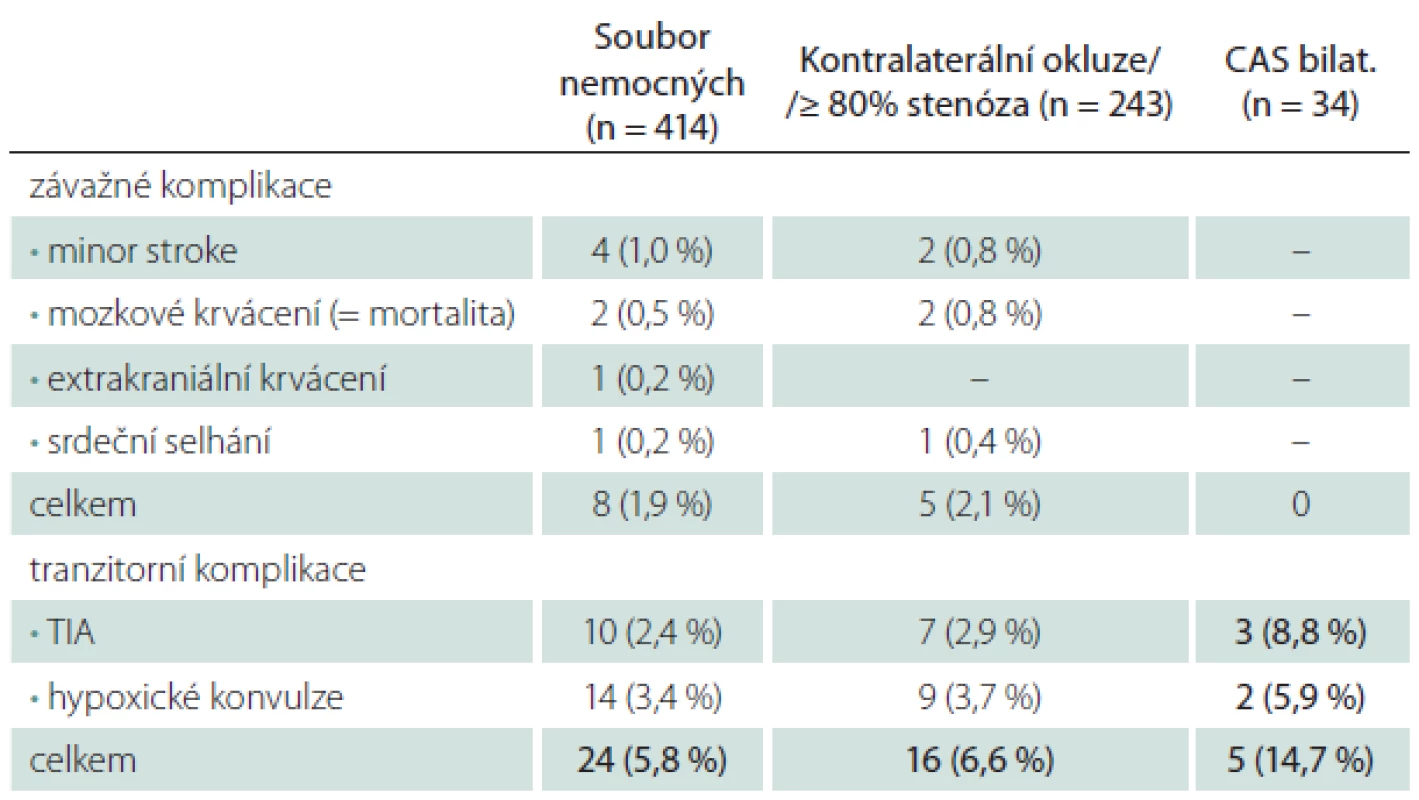
Za riziko pro CAS jsme považovali závažný polystenotický proces u 59 % nemocných a současné ošetření dvou tepen u 8 % nemocných (tab. 4). CAS v těchto skupinách byl provázen jen lehce vyšším počtem závažných periprocedurálních komplikací (M/M 2,1 vs. 1,9 % v celém souboru), u 34 případů současně oboustranného CAS se závažná komplikace nevyskytla ani jedenkrát. Tranzitorní komplikace byly jen lehce častější u polystenotického procesu (6,6 vs. 5,8 %), ale zřetelně častější při současném ošetření dvou tepen (14,7 vs. 5,8 %).
S narůstajícím počtem výkonů klesalo riziko periprocedurální komplikace. Po prvních 15 angioplastikách, které provázel větší počet hypoxických konvulzí (20 %), došlo v dalším období k významnému poklesu všech fokálních i nefokálních ischemických komplikací (minor stroke, TIA, hypoxické konvulze) a tento trend, i když již méně výrazný, dále pokračoval. Riziko mozkového krvácení rostoucí zkušeností nebylo ovlivněno (tab. 6).
Dva případy mozkového krvácení představují nejzávažnější komplikace v našem souboru, protože byly jedinými komplikacemi, které vedly ke smrti. První bylo masivní intraventrikulární krvácení u 72leté ženy v roce 2003, které se manifestovalo 2 hod po CAS a které jsme popsali již dříve [12]. Druhé, tentokrát parenchymové krvácení o čtyři roky později se manifestovalo 28 hod po nekomplikovaném CAS u 65leté ženy. Nemocná zemřela třetí den a sekce prokázala masivní tříštivé destruující hemisferální krvácení. Vedlejším zjištěním byl karcinom ledviny s metastázami do plic a hilových uzlin.
Ze čtyř drobných mozkových ischemií (všechny u mužů) s projevy trvajícími > 60 min, které se všechny manifestovaly již během ošetření, neurodeficit plně regredoval ještě během hospitalizace u tří nemocných.
Dlouhodobé výsledky
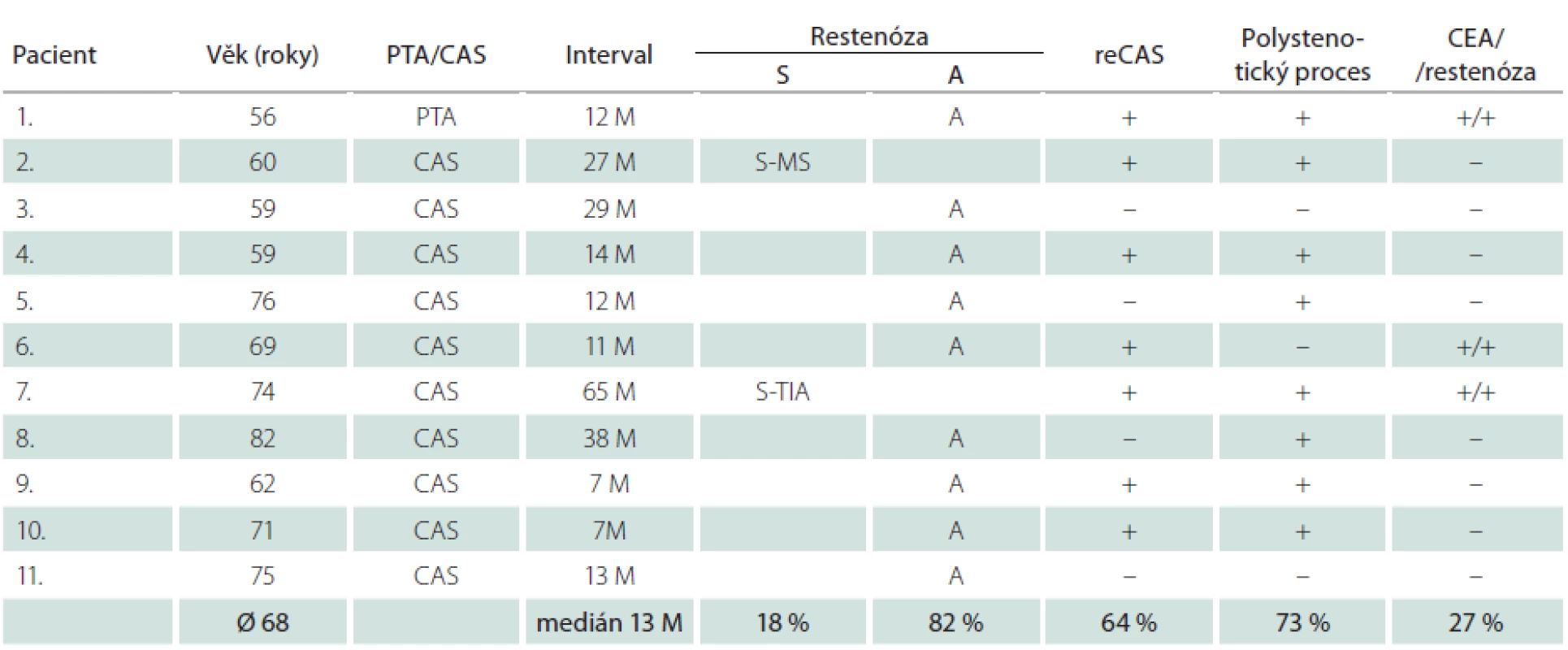
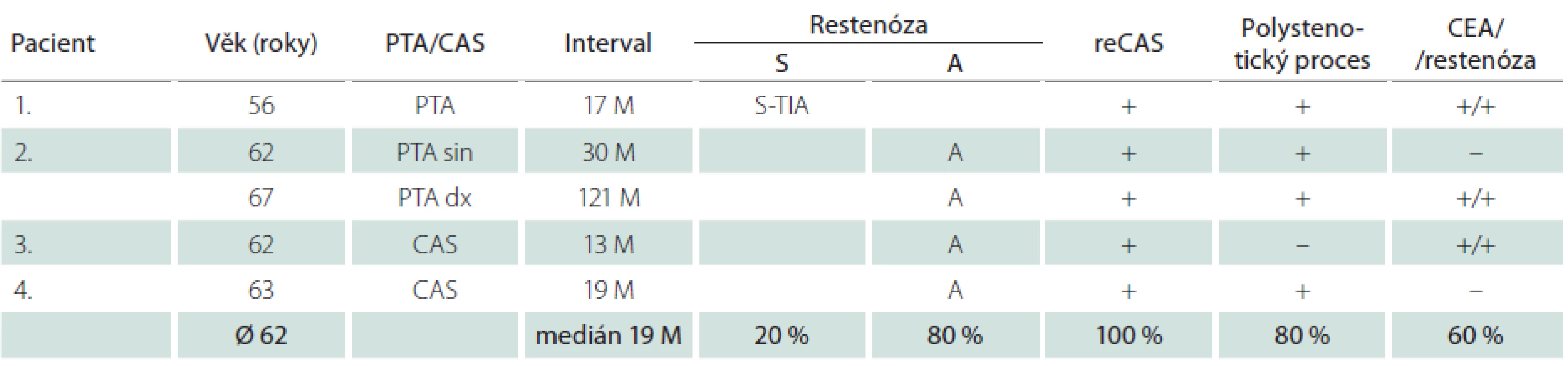
Dlouhodobě jsme sledovali 315 nemocných (76 %) – 230 mužů a 85 žen – s 342 ošetřenými tepnami. Průměrná doba sledování byla 33,2 měsíce, medián 33 měsíce. Během této doby jsme identifikovali 4,7 % restenóz ≥ 70 % (16/342), u mužů 4,4 % (11/252), u žen 5,6 % (5/90) (tab. 7, 8). Faktorem, který významně snížil pravděpodobnost vývoje restenózy, byla implantace stentu. Zatímco v souboru šesti sledovaných samotných balónkových angioplastik (PTA) jsme zjistili čtyři restenózy (67 %), v souboru zbývajících dlouhodobě sledovaných 336 CAS jsme identifikovali pouhých 12 restenóz, což je 3,6 %. Vyšší výskyt restenóz u žen souvisel s častější PTA u žen (šest z celkového poštu osmi) – ze čtyř restenóz po PTA tři postihly ženy.
Nemocní, u kterých jsme identifikovali restenózu po CAS, měli vysokou dispozici k vývoji restenóz i po CEA. Ve skupině 16 restenóz vzniklých po angioplastice u všech šesti nemocných, kteří byli předtím léčeni metodou CEA, vznikla restenóza i po chirurgické léčbě (tab. 7, 8). Okluzi nebo ≥ 80% stenózu nejméně jedné další magistrální mozkové tepny mělo 73 % těchto mužů a 80 % žen (v celém souboru 59 %). Naprostá většina restenóz (u mužů 82 %, u žen 80 %) byla asymptomatická, což je stejné jako v případě 54 restenóz po CEA v celém souboru, z nichž bylo asymptomatických 78 %. Ze tří symptomatických restenóz po angioplastice se v jednom případě jednalo o drobný ischemický inzult (minor stroke), dvakrát o TIA. K reintervenci jsme se rozhodli u 75 % restenóz (12/16). Ačkoliv medián vzniku restenóz byl 13 měsíců u mužů a 19 měsíců u žen, v některých případech vznikly restenózy podstatně později.
Diskuze
Angioplastiky v našem souboru byly provedeny s nízkým procentem komplikací – u všech 450 angioplastik/ resp. 292 CAS v posledních šesti letech: M/M ukazatel 1,8/1,3 %, mortalita 0,4/0,3 %, minor stroke 0,9/0,7 %, TIA 2,2/1,7 %. Ošetření symptomatických stenóz nebylo spojeno s větším rizikem fokálních ischemických komplikací (minor stroke, TIA). Mechanizmus vzniku hypoxických konvulzí nasvědčuje tomu, že rozdíl dvou nemocných proti skupině asymptomatických stenóz je velmi pravděpodobně náhodný. Potvrdili jsme předchozí zjištění [13,14], že CAS při okluzi druhostranné karotické tepny nebo v terénu jiného polystenotického postižení nemá vyšší riziko periprocedurální komplikace. Současné ošetření dvou tepen však bylo provázeno větším počtem TIA a hypoxických konvulzí. Potvrdili jsme výsledky randomizovaných studií (RCT), že riziko CAS není vyšší pro ženy, ale významně narůstá s věkem > 70 let [7,15–17]. Vysvětlení spočívá ve větší pravděpodobnosti distální embolizace v důsledku pokročilých kalcifikací a tortuozit aterosklerotických tepen spolu se snížením cerebrovaskulární rezervy u těchto nemocných [18]. Podobně příznivé výsledky referují i další pracoviště v České republice, vyšší věkový průměr (72 let) mohl být důvodem lehce vyššího počtu periprocedurálních komplikací souboru 363 CAS [19,20].
Naše výsledky jsou srovnatelné s výsledky velkých registrů. V registru CAPTURE 2 s 5 297 nemocnými léčenými metodou CAS ve 186 centrech USA, s 22% podílem osmdesátníků, byl v celém souboru ukazatel ischemické cévní mozkové příhody (CMP)/úmrtí 3,3 % a samotné CMP 2,7 % (major stroke 0,8 %, minor stroke 1,9 %) [8]. Při analýze 10 598 pojištěnců Medicare léčených v letech 2004 – 2006 metodou CEA nebo CAS bylo zjištěno, že počet periprocedurálních komplikací byl u obou metod podobný – CMP u CAS 1,9 %, u CEA 1,4 % (p = 0,14) a mortalita u CAS 0,9 %, u CEA 0,6 % (p = 0,20) [21].
S rostoucí zkušeností operatéra v našem souboru klesala pravděpodobnost periprocedurálních ischemických komplikací. Operatérova zkušenost má pro bezpečný průběh výkonu zásadní význam. V souboru 2 124 po sobě následujících CAS provedených v letech 2000–2009 v jednom centru byla ve 30 dnech četnost TIA 2,72 %, drobné CMP 1,55 %, závažné CMP 1,18 % a úmrtí v důsledku CMP 0,61 % (téměř polovina způsobena mozkovým krvácením). Jediným protektivním faktorem proti periproceduální komplikaci byla zkušenost s > 100 provedenými výkony (OR 0,81; 95% CI 0,67–0,95) [22]. Riziko mozkového krvácení, ke kterému přispívá nutná duální protidestičková a antikoagulační léčba a ve které je na rozdíl od CEA pokračováno i po výkonu, lze ovlivnit méně.
Procento zjištěných > 70% restenóz v průběhu dlouhodobého sledování bylo v našem souboru nízké – 3,6 %, přičemž 81 % z nich bylo asymptomatických. Procento restenóz v RCT kolísá mezi 3,3 % v EVA-3S, 6 % v CREST a 11 % v SPACE [13,23–25]. Vysoké riziko restenóz po CAS nebývá zjišťováno ani v reálné praxi. Dokumentuje to multicentrická studie z roku 2000, v jejímž souboru 3 924 nemocných byla za jeden rok od CAS zjištěna restenóza > 50 % u 3,46 % nemocných [26].
Výsledky RCT i registrů nasvědčují tomu – a naše zkušenost s tím koresponduje – že naprostá většina restenóz zůstává asymptomatická. Ve studii SPACE pouze dva nemocní s restenózou prodělali během dvouletého sledování mozkovou ischemii. Podobně nízká byla incidence rekurentních mozkových ischemií i ve studii EVA-3S. V nizozemské studii se 178 nemocnými s > 50% restenózou pouze 13 z nich (7,3 %) během dalšího sledování prodělalo mozkovou ischemii. Reintervence byla provedena pouze u 15 restenóz (8,4 %) [27].
Pro indikaci reintervence chybí důkazy založené na výsledcích RCT a rozhodnutí tak většinou vychází z méně či více všeobecného konsenzu. Přesvědčivou indikací je symptomatičnost restenózy. Další indikací, která se ve snaze zlepšit mozkovou perfuzi jeví být oprávněná, je restenóza v terénu polystenotického postižení. Většinou indikujeme také reintervenci u restenózy, která jasně progreduje v čase, z obavy z dalšího vývoje. Zda je tato obava opodstatněná, v současné době však nevíme. První zjištění jednostranné restenózy by k indikaci reintervence dostačovat nemělo.
Dosahované výsledky CAS vedly k tomu, že v roce 2011 byly American Heart Association (AHA) a American Stroke Association (ASA) a 12 dalšími americkými odbornými společnostmi formulovány společné směrnice [28] a prakticky současně NICE směrnice [29], které zmírnily předešlá indikační kritéria. Podle nich je CAS indikován pro symptomatické nemocné s > 70% stenózou, kteří mají průměrné (nové doporučení) nebo nízké riziko endovaskulární léčby a k jeho provádění stačí standardní podmínky (starší směrnice vyžadovaly „special arrangements“). Poslední AHA/ASA směrnice z roku 2014 [30] doplnily, že zatímco pro nemocné > 70 let je vhodnější metodou CEA, u mladších nemocných je CAS z hlediska rizika periproceduálních komplikací a dlouhodobého výsledku rovnocenná s CEA.
CAS musí být vždy indikován na základě individuální pravděpodobnosti komplikací a očekávaného benefitu. Analogicky s CEA je za akceptovanou horní hranici periprocedurálních komplikací (úmrtí/ CMP) u symptomatických stenóz považováno 6 %, u asymptomatických stenóz 3 % [31,32].
V poslední době se i u CAS, obdobně jako již dlouho u CEA, objevuje trend k časným výkonům ≤ 14 dnů od okamžiku, kdy stenóza začala být symptomatická. Dosud publikované soubory referují rozdílné výsledky [33,34]. Naše zkušenosti s urgentními CAS provedenými pod protokolem léčby akutní CMP u pečlivě vybraných nemocných s tandemovými stenózami nasvědčují tomu, že tento trend je oprávněný.
Závěr
Výběr optimální léčebné metody – CEA nebo CAS – by měl rozhodnout multidiscipilinární tým sestávající z neurologa vzdělaného v cerebrovaskulární problematice, cévního chirurga nebo neurochirurga a intervenčního radiologa. Doporučení musí respektovat individuální riziko nemocného a mělo by přihlédnout i k jeho preferenci.
CAS je při pečlivém výběru nemocného a v rukou zkušeného operatéra bezpečná a účinná léčebná alternativa CEA u nemocných mladších 70 let.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
doc. MUDr. Dagmar Krajíčková, CSc.
Neurologická klinika
LF UK a FN Hradec Králové
Sokolská 581
500 05 Hradec Králové
e-mail: dagmar.krajickova@fnhk.cz
Přijato k recenzi: 9. 2. 2015
Přijato do tisku: 17. 3. 2015
Sources
1. Wimmer NJ, Yeh RW, Cutlip DE, et al. Risk prediction for adverse events after carotid stenting in higher surgical risk patients. Stroke 2012;4(12):3218–24. doi: 10.1161/STROKEAHA.112.673194.
2. Rothwell PM, Slattery J, Warlow CP. Clinical and angiographic predictors of stroke and death from carotid endarterectomy: systematic review. BMJ 1997;315(7122):1571–7.
3. Frawley JE, Hicks RG, Woodforth IJ. Risk factors for perioperative stroke complicating carotid endarterectomy: selective analysis of a prospective audit of 1,000 consecutive operations. Aust NZJ Surg 2000;70(1):52–6.
4. Touzé E, Trinquart L, Chatellier G, et al. Systematic review of the perioperative risks of stroke or death after carotid angioplasty and stenting. Stroke 2009;40(12):e683–93. doi: 10.1161/STROKEAHA.109.562041.
5. Al-Mubarak N, Roubin GS, Iyer SS, et al. Carotid artery stenting. Current practice and techniques. Philadelphia: Lippincott Williams & Williams 2004.
6. Chiam PT, Roubin GS, Iyer SS, et al. Carotid artery stenting in elderly patients: importance of case selection. Catheter Cardiovasc Interv 2008;72(3):318–24. doi: 10.1002/ccd.21620.
7. Bonati LH, Dobson J, Algra A, et al. Short-term outcomes after stenting versus endarterectomy for symptomatic carotid stenosis. A preplanned meta-analysis of individual patient data. Lancet 2010;376(9746):1062–73. doi: 10.1016/S0140-6736(10)61009-4.
8. Chaturvedi S, Matsumura JS, Gray W, et al. Carotid artery stenting in octogenarians. Periprocedural stroke risk predictor analysis from the multicenter carotid ACCULINK/ACCUNET Post Approval Trial to Uncover Rare Events (CAPTURE 2) clinical trial. Stroke 2010;41(4):757–64. doi: 10.1161/STROKEAHA.109.569426.
9. Voeks JH, Howard G, Roubin GS, et al. Age and outcomes after carotid stenting and endarterectomy: the carotid revascularization endarterectomy versus stenting trial. Stroke 2011;42(12):3484–90. doi: 10.1161/STROKEAHA.111.624155.
10. Krajina A, Náhlovský J, Krajíčková D. Endovaskulární léčebné výkony v neurochirurgii. In: Náhlovský J et al. Neurochirurgie. 1. vyd. Praha: Galén, Karolinum 2005 : 229–53.
11. Krajíčková D, Krajina A, Lojík M, et al. Naše zkušenosti s angioplastikami mozkových tepen. Cesk Slov Neurol N 2005;68/101(4):241–50.
12. Krajíčková D, Krajina A, Nová M, et al. Fatal intraventricular hemorrhage after the extracranial carotid artery angioplasty and stent placement. Cardiovasc Intervent Radiol 2005;28(4):502–5.
13. Eckstein HH, Ringleb P, Allenberg JR, et al. Results of the stent-protected angioplasty versus carotid endarterectomy (SPACE) study to treat symptomatic stenosis at 2 years: a multinational, prospective, randomized trial. Lancet Neurol 2008;7(10):893–902. doi: 10.1016/S1474-4422(08)70196-0.
14. Keldahl ML, Park MS, Garcia-Toca M. Does a contralateral carotid occlusion adversely impact carotid artery stenting outcomes? Ann Vasc Surg 2012;26(1):40–5. doi: 10.1016/j.avsg.2011.07.005.
15. Silver FL, Mackey A, Clark WM, et al. Safety and stenting and endarterectomy by symptomatic status in the Carotid Revascularization Endarterectomy versus Stenting Trial (CREST). Stroke 2011;42(3):675–80. doi: 10.1161/STROKEAHA.110.610212.
16. Hobson RW, Howard VJ, Roubin GS, et al. Carotid artery stenting is associated with increased complications in octogenarians: 30-day stroke and death rates in the CREST lead-in phase. J Vasc Surg 2004;40(6):1106–11.
17. Howard JV, Voeks JH, Lutsep HL, et al. Does sex matter? Thirty-day stroke and death rates after carotid artery stenting in women versus men. Results from the Carotid Revascularization Endarterectomy versus Stenting Trial (CREST) lead-in phase. Stroke 2009;40(4):1140–7. doi: 10.1161/STROKEAHA.108.541847.
18. Lam RC, Lin SC, DeRubertis B, et al. The impact of increasing age on anatomic factors affecting carotid angioplasty and stenting. J Vasc Surg 2007;45(5):875–80.
19. Přibáň V, Fiedler J, Baránková L, et al. Komplementarita stentingu a endarterektomie karotid: tříleté zkušenosti. Cesk Slov Neurol N 2008;71/104(1):75–80.
20. Beneš V, Netuka D, Charvát F, et al. Srovnání karotické endarterektomie a stentingu – výsledky jednoho pracoviště. Cesk Slov Neurol N 2008;71/104(4):400–4.
21. Wang FW, Esterbrooks D, Kuo YF, et al. Outcomes after carotid artery stenting and endarterectomy in the Medicare population. Stroke 2011;42(7):2019–25. doi: 10.1161/STROKEAHA.110.608992.
22. Setacci C, Chisci E, Setacci F, et al. Siena carotid artery stenting score. A risk modelling study for individual patients. Stroke 2010;41(6):1259–65. doi: 10.1161/STROKEAHA.110.578583.
23. Arquizan C, Trinquart L, Touboul PJ, et al. Restenosis is more frequent after carotid stenting than after endarterectomy. Stroke 2011;42(4):1015–20. doi: 10.1161/STROKEAHA.110.589309.
24. Lal BK, Breach KW, Roubin GS, et al. Restenosis after carotid artery stenting and endarterectomy: a secondary analysis of CREST, a randomized controlled trial. Lancet Neurol 2012;11(9):755–63.
25. Lanzino G, Burrows AM, Tymianski M. Advances in stroke. Vascular neurosurgery. Stroke 2013;44(2):316–7. doi: 10.1161/STROKEAHA.111.000385.
26. Wholey MH, Wholey M, Mathias K, et al. Global experience in cervical carotid artery stent placement. Catheter Cardiovasc Intervent 2000;50(2):160–7.
27. van Lammeren GW, Peeters W, de Vries JP, et al. Restenosis after carotid surgery. The importance of clinical presentation and preoperative timing. Stroke 2011;42(4):965–71. doi: 10.1161/STROKEAHA.110.603746.
28. Brott TG, Halperin JL, Abbara S, et al. 2011 ASA/ ACCF/ AHA/ AANN/ AANS/ ACR/ ASNR/ CNS/ SAIP/ SCAI/ SIR/ SNIS/ SVM/ SVS guideline on the management of patients with extracranial carotid and vertebral artery disease: a report of the American College of Cardiology Foundation; American Heart Association Task Force on Practice Guidelines; American Stroke Association; American Association of Neurological Surgeons; American College of Radiology; American Society of Neuroradiology; Congress of Neurological Surgeons; Society of Atherosclerosis Imaging and Prevention; Society for Cardiovascular Angiography and Interventions; Society of Interventional Radiology; Society of NeuroInterventional Surgery; Society for Vascular Medicine; Society for Vascular Surgery; American Academy of Neurology; Society of Cardiovascular Computed Tomography. J Am Coll Cardiol 2011;57(8):1002–44. doi: 10.1016/j.jacc.2010.11.005.
29. Carotid artery stenting for symptomatic extracranial carotid stenosis, consultation document National Institute for Health and Clinical Excellence. [online]. Available from URL: http://www.nice.org.uk/guidance/index.jsp?action=article&o-52289.
30. Kernan WN, Ovbiagele B, Black HR, et al. Guidelines for the prevention of stroke in patients with stroke and transient ischemic attack. A guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2014;45(7):2160–236. doi: 10.1161/STR.0000000000000024.
31. Paraskevas KI, Mikhailidis DP, Veith FJ. Comparison of the five 2011 guidelines for the treatment of carotid stenosis. J Vasc Surg 2012;55(5):1504–8. doi: 10.1016/j.jvs.2012.01.084.
32. Furie KL, Kasner SE, Adams RJ, et al. Guidelines for the prevention of stroke in patients with stroke or transient ischemic attack. A guideline for healthcare professionals from the American Heart Association/American Stroke Association. Stroke 2011;42 : 227–76. doi: 10.1161/STR.0b013e3181f7d043.
33. Gröschel K, Knauth M, Ernemann U. Early treatment after a symptomatic event is not associated with an increased risk of stroke in patients undergoing carotid stenting. Eur J Neurol 2008;15(1):2–5.
34. Rantner B, Goebel G, Bonati LH. The risk of carotid artery stenting compared with carotid endarterectomy is greatest in patients treated within 7 days of symptoms. J Vasc Surg 2013;57(3):619–26. doi: 10.1016/j.jvs.2012.08.107.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2016 Issue 3
- Memantine Eases Daily Life for Patients and Caregivers
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Advances in the Treatment of Myasthenia Gravis on the Horizon
-
All articles in this issue
- MikroRNA u cerebrovaskulárních onemocnění – od patofyziologie k potenciálním biomarkerům
- Současné možnosti in vivo protonové (1H) MR spektroskopie v diagnostice mozkového abscesu
- Korelace intenzity fluorescence s proporcionálním zastoupením maligních buněk ve tkáni při resekci glioblastomu s použitím 5-ALA
- Validační studie české verze Bostonského testu pojmenování
- Periprocedurální komplikace a dlouhodobý efekt karotických angioplastik – výsledky z praxe
- Baha jako možné řešení jednostranné hluchoty
- Léčba gama nožem u algických syndromů v inervační oblasti nervus glossopharyngeus
- Schwannom nejspíše z krčního sympatiku – kazuistika
- Využití zolpidemu v neurorehabilitaci pacienta ve stavu minimálního vědomí – kazuistika
- Klinický standard pro diagnostiku a léčbu pacientů s ischemickou cévní mozkovou příhodou a s tranzitorní ischemickou atakou – verze 2016
- Pre-motorické a non-motorické príznaky Parkinsonovej choroby – taxonómia, klinická manifestácia a neuropatologické koreláty
- Atypický parkinsonizmus a frontotemporální demence – klinické, patologické a genetické aspekty
- Pacient s homozygozitou mutácie E200K v rodine slovenského klastru genetickej formy Creutzfeldtovej-Jakobovej choroby
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Schwannom nejspíše z krčního sympatiku – kazuistika
- Validační studie české verze Bostonského testu pojmenování
- Klinický standard pro diagnostiku a léčbu pacientů s ischemickou cévní mozkovou příhodou a s tranzitorní ischemickou atakou – verze 2016
- Pre-motorické a non-motorické príznaky Parkinsonovej choroby – taxonómia, klinická manifestácia a neuropatologické koreláty
