Spektrum MR nálezů progresivní multifokální leukoencefalopatie u kohorty pacientů s roztroušenou sklerózou v ČR
The spectrum of MRI findings of progressive multifocal leukoencephalopathy in patients with multiple sclerosis in the Czech Republic
Aim: To show the full spectrum of MRI findings in all patients ever diagnosed with progressive multifocal leukoencephalopathy (PML), which is associated with natalizumab therapy in patients with MS in the Czech Republic.
Patients and methods: The first case was described in 2009, the last case in December 2018, with a total of 14 diagnosed cases of PML in MS patients. This paper evaluates the MRI findings that showed the presence of PML; the diagnosis was subsequently confirmed by detection of the John Cunningham virus (JCV) DNA from cerebrospinal fluid using polymerase chain reaction. All patients met the American Academy of Neurology criteria from 2013 for diagnosis of this disease. The MRI protocol used was variable, both because patients were examined at different MRI sites across the Czech Republic, and because of evolution of protocols over time. In all patients, the protocol contained fluid attenuated inversion recovery (FLAIR), which is the most sensitive sequence for early PML detection.
Results: 13 patients (92.9%) had a positive MRI finding. The most frequent finding was typical white matter involvement in the subcortical area of the frontal lobe (42.9%), followed by the parietal (28.6%) and temporal lobes (28.6%). The extent of the pathology was also very variable, from very small discrete lesions to extensive diffuse lesions affecting multiple lobes. Two patients were found to have cerebellar and pons foci (14.3%), one patient in the mesencephalon and another in the medula oblongata. There were thalamic lesions in two cases, and one case of putamen lesions. In some cases, MRI presentation of PML was very similar to the MRI presentation of MS and suspicion of PML was considered because there was new progression of MRI. One patient was completely atypical compared to the rest of the group. PML was diagnosed from a routine lumbar puncture done when therapy was changed, and the MRI finding at that time was negative. Positive findings appeared only 6 months after the PML diagnosis. This case involved the JCV-granulocytic neuronopathy with cerebellum affection subtype.
Conclusion: The Czech cohort of PML patients confirms the great variability in MRI findings and points out the importance of careful MRI monitoring to detect the disease in the subclinical phase.
The authors declare they have no potential conflicts of interest concerning drugs, products, or services used in the study.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
捷克共和国多发性硬化症患者进行性多灶性白质脑病的MRI表现谱
目的:显示所有曾被诊断为进行性多灶性白质脑病(PML)患者的MRI全谱表现,与捷克多发性硬化患者纳他利珠单抗治疗有关。
患者和方法:第一个病例描述于2009年,最后一个病例描述于2018年12月,在MS患者中总共诊断出14例PML病例。本文对显示PML存在的MRI表现进行了评价;随后使用聚合酶链反应从脑脊液中检测到约翰·坎宁安病毒(JCV) DNA,从而确诊。从2013年开始,所有患者均符合美国神经科学会诊断该病的标准。所使用的MRI方案是可变的,这既是因为在捷克共和国的不同MRI站点对患者进行了检查,又是由于随着时间的推移方案的发展。在所有患者中,该方案均包含体液衰减倒置恢复(FLAIR),这是早期PML检测最敏感的序列。
结果:13例(92.9%)的MRI阳性。最常见的发现是额叶皮层下区域典型的白质受累(42.9%),其次是顶叶(28.6%)和颞叶(28.6%)。病理范围也很不稳定,从很小的离散病变到广泛的弥漫性病变影响多个肺叶。两名患者发现小脑和桥脑病灶(14.3%),一名患者在中脑,另一名患者在延髓。有丘脑病变2例,壳核病变1例。在某些情况下,PML的MRI表现与MS的MRI表现非常相似,并且考虑到PML的怀疑是因为MRI有新的进展。与其他组相比,一名患者完全不典型。根据更换疗法后的常规腰穿检查诊断为PML,当时MRI呈阴性。 PML诊断后仅6个月才出现阳性结果。该病例涉及具有小脑情感亚型的JCV-粒细胞性神经病。
结论:捷克的PML患者队列证实了MRI表现的巨大差异,并指出了认真进行MRI监测以检测亚临床阶段疾病的重要性。
关键词:多发性硬化–进行性多灶性白质脑病 – MRI –无症状影像
Keywords:
Multiple sclerosis – progressive multifocal leukoencephalopathy – MRI – asymptomatic imaging
Authors:
M. Vaněčková 1; A. Martinková 2; R. Tupý 3; J. Fiedler 4; I. Štětkářová 5; E. Medová 5; M. Vachová 6; J. Marková 7; M. Grunermelová 7; E. Meluzínová 8; J. Adámková 9; J. Kubále 10; M. Talábová 11; D. Horáková 12
; prof. MUDr. Eva Kubala Havrdová, DrSc. 12
Authors‘ workplace:
Oddělení MR, Radiodiagnostická klinika 1. LF UK a VFN v Praze
1; MS centrum, Neurologická klinika Pardubická krajská nemocnice
2; Klinika zobrazovacích metod LF v Plzni UK a FN Plzeň
3; Neurologická klinika LF v Plzni UK a FN Plzeň
4; Neurologická klinika 3. LF UK a FN Královské Vinohrady, Praha
5; Neurologické oddělení, Krajská zdravotní, a. s. – Nemocnice Teplice, o. z.
6; Neurologická klinika 3. LF UK a Thomayerova nemocnice
7; Neurologická klinika 2. LF UK a FN Motol
8; Neurologické oddělení, Nemocnice České Budějovice, a. s.
9; Radiologické oddělení, Nemocnice České Budějovice, a. s.
10; MS centrum, Neurologická klinika FN Hradec Králové
11; RS centrum, Neurologická klinika a Centrum klinických neurověd, 1. LF UK a VFN v Praze
12
Published in:
Cesk Slov Neurol N 2019; 82(4): 381-390
Category:
Original Paper
doi:
https://doi.org/10.14735/amcsnn2019381
Overview
Cíl: Ukázat celé spektrum nálezů na MR u pacientů z ČR s progresivní multifokální leukoencefalopatií (PML) asociovanou s podáváním natalizumabu u RS.
Soubor a metodika: První případ byl popsán v roce 2009, poslední případ v prosinci 2018, celkem bylo diagnostikováno 14 případů PML u pacientů s RS. Práce hodnotí MR nález, který vykazoval známky přítomnosti PML a bylo vysloveno podezření na toto onemocnění následně konfirmované pomocí detekce DNA viru Johna Cunninghama (JCV) z mozkomíšního moku pomocí polymerázové řetězové reakce. Všichni pacienti splnili kritéria Americké akademie neurologie z roku 2013 pro diagnózu tohoto onemocnění. MR protokol se lišil, pacienti byli vyšetřeni na různých MR pracovištích z celé ČR, dále i protokol odpovídal době, kdy k vyšetření došlo.
Výsledky: Celkem 13 pacientů (92,9 %) mělo pozitivní nález na MR. Nejčastěji se jednalo o typické postižení bílé hmoty v subkortikální oblasti frontálního laloku (42,9 %), následované parietálním (28,6 %) a temporálním lalokem (28,6 %). Rozsah postižení byl také značně variabilní od drobného diskrétního ložiska až po rozsáhlé difuzní postižení postihující více laloků. U dvou pacientů byla zachycena ložiska v oblasti mozečku a pontu (14,3 %), jeden pacient ze souboru měl postižení v oblasti mezencefalon a další v oblongátě. Ve dvou případech se vyskytovala ložiska v talamech, v jednom případu v putamen. V některých případech byl nález na MR velmi podobný nálezu u RS a na možné PML ukázala především progrese nálezu MR oproti předchozím kontrolám MR, kdy byl nález stacionární. Jeden pacient se zcela vymykal skupině s pozitivním MR nálezem. PML u něho byla diagnostikována z kontrolní lumbální punkce při změně terapie a MR nález v této době byl negativní. Pozitivní nález se objevil až po 6 měsících a jednalo se o podtyp infekce JCV – granulocytární neuronopatie s postižením mozečku.
Závěr: Na českém souboru pacientů s PML byla potvrzena velká variabilita v MR nálezech, jež poukázala na důležitost pečlivé monitorace pomocí MR pro zachycení onemocnění optimálně v subklinické fázi.
Klíčová slova:
roztroušená skleróza – progresivní multifokální leukoencefalopatie – MR – asymptomatický nález
Úvod
Progresivní multifokální leukoencefalopatie (PML) je oportunní infekce způsobená John Cunnighamovým virem (JCV) patřícím k polyoma virům. JCV získal svůj název podle prvního pacienta, u něhož byl virus izolován – Johna Cunninghama. Primoinfekce probíhá nejčastěji v dětství inaparentně, poté virus perzistuje v ledvinách, kostní dřeni a lymfatické tkáni. Aby došlo k rozvoji PML, je nutná mutace viru, jejíž mechanizmus není přesně znám. Virus tak získá schopnost neurovirulence, vcestování do CNS, kde se nekontrolovaně množí v oligodendrocytech a astrocytech a způsobuje lytické léze neuronálních buněk a glie [1,2]. Poslední epidemiologická data u pacientů s RS a neuromyelitis optica udávají séroprevalenci JCV v populaci 57,1 % (rozmezí 40 – 69 %), 1 – 3 % ročně sérokonverze. Pacienti léčení natalizumabem ji mají vyšší (5 – 10 %); nejnovější práce Fragosa et al udává ještě vyšší sérokonverzi (až 22 %) [3,4].
Onemocnění bylo poprvé popsáno v roce 1958. Až do roku 1984 bylo vysoce raritní, celosvětově bylo zaznamenáno jen 230 případů. S objevením syndromu získaného selhání imunity (acquired immune deficiency syndrome; AIDS) to není tak raritní onemocnění, vyskytuje se u 4 – 10 % dospělých pacientů s AIDS. K onemocnění dále dochází u pacientů po transplantaci, chemoterapii a v posledních letech v souvislosti s podáváním monoklonálních protilátek. V roce 2005 byl popsán první případ ve vztahu k podávání natalizumabu. Byly zaznamenány i případy po podání rituximabu, efalizumabu, alemtuzumabu, infliximabu, dimetyl fumarátu a fingolimodu [5 – 9]. Onemocnění je diagnostikováno pomocí diagnostických kritérií Americké akademie neurologie (AAN) z roku 2013, kdy diagnóza je možná dvěma cestami. Jednou je kombinace detekce DNA JCV z likvoru v kombinaci s MR vyšetřením a klinickým vyšetřením, kdy se rozlišuje jistá diagnóza, pravděpodobná a možná. Druhým přístupem je mozková biopsie s následným průkazem JCV elektronovým mikroskopem, imunohistochemicky nebo kvantitativní polymerázovou řetězovou reakcí (polymerase chain reaction; PCR) [10].
V této práci se věnujeme PML asociované s podáváním monoklonálních protilátek, která má oproti „klasické PML“ odlišnou prognózu a i nález na MR. PML asociovaná s podáváním monoklonálních protilátek má letalitu výrazně nižší než klasická PML, v symptomatickém stadiu 24,6 %, v asymptomatickém stadiu téměř nulovou a jsou popsány i případy, kdy po odeznění PML onemocnění nedošlo ke zhoršení disability. Pro prognózu pacienta je vzhledem k nemožnosti kauzální léčby nejdůležitějším faktorem co nejčasnější diagnostika, optimálně v asymptomatickém stadiu [11 – 13]. Proto jsou v současnosti v ČR všichni pacienti, kteří jsou léčeni natalizumabem, zvýšeně monitorováni pomocí MR. Bylo vydáno doporučení radiologického panelu, aby pacienti z rizikové skupiny byli monitorováni v krátkém bezpečnostním protokolu MR optimálně každé 3 měsíce (max. 6 měsíců) od konce 2. roku léčby vzhledem k nárůstu rizika po 2 letech léčby natalizumabem. Bezpečnostní protokol se skládá ze sekvencí: fluid attenuated inversion recovery (FLAIR), T2 vážený obraz a difuzí vážený obraz (diffusion weighted imaging; DWI), které mají vysokou senzitivitu pro detekci lézí PML či mají význam pro odlišení od ložisek u RS [14,15]. Mimo MR vyšetření je pacientům určován index protilátek, který se ukázal jako klíčový pro stratifikaci rizika vzniku PML [16].
Ložiska PML jsou nejčastěji lokalizována subkortikálně, často zasahují i do kortexu. Bývají nepravidelného tvaru, neostře ohraničená vůči bílé hmotě, bez výraznější expanzivity. Jsou hypersignální ve FLAIR, v T2 váženém obraze můžou být vidět v blízkosti léze drobná ložiska připodobňovaná k mléčné dráze, která jsou typická pro PML. I v iniciálním stadiu může být patrný po podání kontrastní látky enhancement (udává se přibližně ve 30 %). Na rozdíl od RS bývá nepravidelného tvaru, okrajový, mohou být i drobné enhancující tečkovité léze. Onemocnění může začínat i v oblasti centrální šedi (5 %) a v mozečku (10 %), nikdy ale nepostihuje n. II. a míchu (platí jen pro PML asociovanou s podáváním monoklonálních protilátek). Nález na MR a klinické postižení během týdnů progreduje, ložiska se zvětšují, narůstá bilateralita, postižení centrální šedi, mozečku. Typické je postižení středního mozečkového pedunkulu, často poloměsíčitého tvaru. Může být infiltrováno i corpus callosum, nebývá však postiženo izolovaně. Jak onemocnění postupuje, narůstá i atrofie, ložiska se stávají více hyposignálními v T1 váženém obraze. Na rozdíl od RS zde nedochází k remyelinizaci (tab. 1) [2,5,13,14,17].
U většiny pacientů, kde je PML asociována s podáváním monoklonálních protilátek, se vyvine zánětlivý syndrom imunitní obnovy (immune reconstitution inflammatory syndrome; IRIS). IRIS je definován jako objevení se nového symptomu a/ nebo zhoršení stávajících klinických příznaků doprovázené progresí v MR obraze. Objevuje se za týdny až měsíce, nejčastěji okolo 4 týdnů od ukončení léčby natalizumabem. Na MR se po podání kontrastní látky vyznačuje častějším a rozsáhlejším enhancementem ložisek, edémem, expanzivitou, což může vést až k fatálním mozkovým herniacím. Pro jeho diagnostiku je důležitý MR nález, i když ne vždy je na MR spolehlivě rozpoznatelný [18,19].
Cílem práce je prezentovat šíři patologických nálezů, které se vyskytly v ČR, prezentovat jak nejčastější nálezy, tak i zobrazení, které bylo obtížně diferencovatelné od progrese RS. Dále ukázat typické MR znaky, které pomáhají v diferenciaci PML od progrese RS, což je nejčastější diferenciálně diagnostický problém.
Soubor pacientů a metodika
Celkem bylo do března 2019 v ČR diagnostikováno 14 pacientů s oportunní infekcí PML asociovanou s podáváním monoklonálních protilátek. Dva pacienti byli z RS centra VFN v Praze, 3 pacienti z RS centra Nemocnice Pardubice, 3 pacienti z RS centra FN Plzeň, 1 pacient z RS centra Nemocnice České Budějovice, 1 pacient z RS centra Thomayerovy nemocnice, 1 pacient z RS centra FN Královské Vinohrady, 1 pacient z RS centra FN Motol, 1 pacient z RS centra Nemocnice Teplice a poslední případ pacient z RS centra FN Hradec Králové [20]. První diagnostikovaný pacient byl v roce 2009 (FN Plzeň). Průměrný věk v době diagnózy byl 43 let (rozptyl 29 – 54), 71 % bylo žen (tab. 2).
Pacienti byli vyšetřeni na různých typech přístrojů MR o síle magnetického pole 1,5 – 3T. Všechny protokoly obsahovaly sekvenci FLAIR, která je nejvíce senzitivní pro detekci PML ložisek, dále se protokol různil, reflektoval i dobu vyšetření (rozdíl v monitoraci v roce 2009 a v současnosti, kdy je bezpečnostní MR monitorace standardem), ve většině případů obsahoval i T2 vážený obraz [14,15,21]. Především tam, kde již bylo podezření na PML z klinického obrazu, byla podána kontrastní látka na bázi gadolinia v množství 0,2 ml/ kg, celkem byla aplikována v 7 případech. Zobrazení difuze bylo provedeno u 11 pacientů. Retrospektivně byl hodnocen MR nález, který svědčil pro přítomnost oportunní infekce PML. PML byla ve všech 14 případech verifikována PCR detekcí DNA JCV z likvoru a naplnila tak diagnostická kritéria AAN 2013 (kategorie pravděpodobná, po rozvoji klinických příznaků – jistá diagnóza PML) [10]. Bylo hodnoceno, zda pacient byl již v době MR klinicky symptomatický či nikoliv. Byla postupně zjišťována pozitivita na jednotlivých sekvencích, u vyšetření difuze, i vzhledem k nejednoznačnosti hodnocení, byla klasifikace mimo základní pozitivní/ negativní, dělena i na pozitivní DWI bez hyposignálního korelátu na mapě ADC (aparentní difuzní koeficient; apparent diffision coefficient). U každého pacienta byl podrobně popsán rozsah postižení: zda je postižena pouze jedna hemisféra nebo již obě, kde všude se patologická ložiska vyskytují. U jednoho pacienta byl použit software, který umožňuje barevné označení nových ložisek. Jedná se o barevné mapování, kdy po prostorové koregistraci dojde k porovnání třech vyšetření, vstupního a posledních dvou kontrol, červeně jsou následně označena nová ložiska vzniklá od poslední kontroly [21].
Jeden případ se zcela vymykal ostatním. Došlo k prvotnímu záchytu PML při kontrolním vyšetření mozkomíšního moku z důvodu změny terapie. U pacienta bylo recentně provedeno vyšetření MR, které bylo z hlediska PML negativní. U pacienta bylo dále opakováno vyšetření MR v krátkých intervalech, pozitivní nález se objevil až po 6 měsících od diagnostické lumbální punkce.
Výsledky
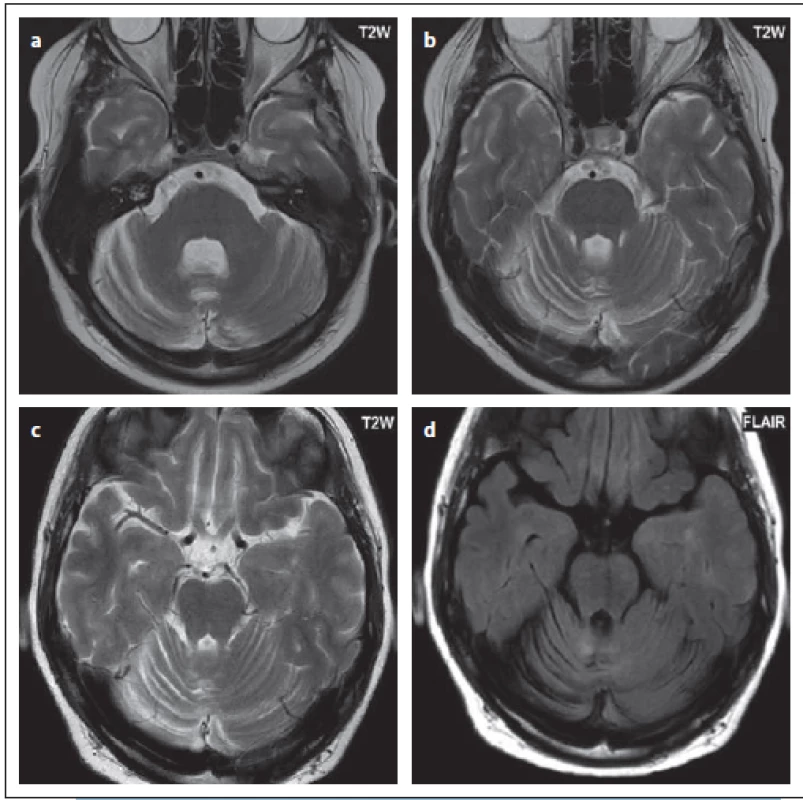
V době diagnózy, která byla verifikována následnou detekcí DNA pomocí PCR z likvoru, mělo 13 pacientů pozitivní nález na MR (92,9 %), jeden pacient měl pouze pozitivní PCR z likvoru a pozitivní MR nález byl detekován až po 6 měsících. Všech 13 pacientů mělo nález pozitivní v sekvenci FLAIR (92,9 %), T2 vážený obraz nebyl proveden u 2 pacientů, pozitivní byl celkem u 11 pacientů (91,7 %) (obr. 1). Difuzní vyšetření bylo provedeno u 11 pacientů, 8 pacientů mělo zvýšený signál na DWI (72,7 %), z toho jeden pacient i vč. hyposignálního korelátu na ADC mapě. Ostatní měli většinou různý stupeň zvýšení signálu na ADC mapě (obr. 2). Vyšetření s kontrastní látkou bylo provedeno u 6 pacientů, alespoň minimální enhancement byl detekován u 4 pacientů (66,7 %) (obr. 3). Nález svědčící pro PML byl shledán v obou mozkových hemisférách u 4 pacientů (28,6 %) (obr. 4). Postižení lokalizované supratentoriálně bylo u 11 pacientů (78,6 %). Infratentoriální postižení se zjistilo u 4 pacientů (28,6 %), z toho 2 pacienti měli jak postižení supratentoriálně, tak i infratentoriálně. Frontální lalok byl postižen u 6 pacientů (42,9 %), parietální u 4 pacientů (28,6 %), 4 × temporální lalok (28,6 %) a 2× okcipitální lalok (14,3 %) (obr. 5 – 8). U části pacientů nebylo ložisko lokalizováno jen v jednom mozkovém laloku, ale zasahovalo i do dalších laloků (obr. 2, 4). Zasahování do kortexu bylo přítomno u 6 pacientů (42,9 %). Ložiska v talamu se vyskytovala u 3 pacientů (21,4 %), vždy v kombinaci s dalšími ložisky. Jeden pacient měl ložiskové postižení putamen, také v kombinaci s dalším postižením subkortiko-kortikálně. Další pacient měl postižení splenium corporis callosi (7,1 %). Infratentoriálně u 2 pacientů bylo postižení mozečku a pontu (14,3 %) (obr. 3), jeden pacient měl ložiska v mezencefalon a jeden v oblongatě (7,1 %) (obr. 9, 10). U pacienta č. 5 byl použit software barevného mapování pro detekci ložisek, která byla patrná při barevném označení, ale bez použití tohoto softwaru byla jen obtížně diferencovatelná (obr. 4).
FLAIR – fluid attenuated inversion recovery; PML – prograsivní multifokální leukoencefalopatie
Fig. 1. Patient No. 8: FLAIR showing a hypersignal confluent lesion in the white matter,
affecting the subcortical part in the right parietal lobe – a PML lesion (arrow), as well as
small oval hypersignal lesions that correspond to MS lesions (a). T2WI; there is a non-
-homogeneous signal in the area of the PML described above, as indicated by the tiny
marks characteristic of PML (arrow) (b).
FLAIR – fluid attenuated inversion recovery; PML – progressive multifocal leukoencephalopathy
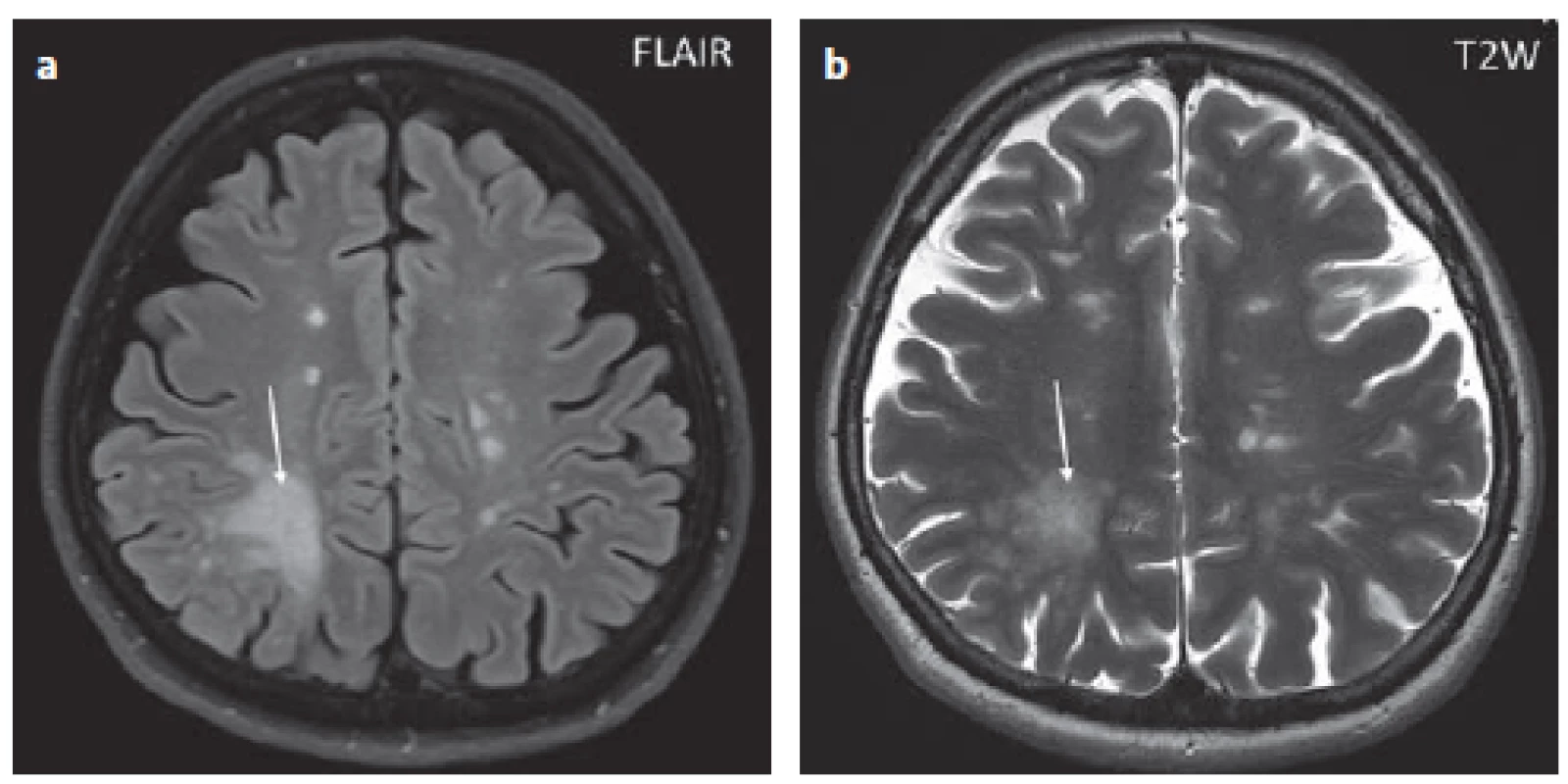
Fig. 2. Patient No. 10: a diffuse confluent hypersignal
lesion in the right occipital lobe,
and partial involvement of the temporal
lobe white matter, extending partially pariatally
and into the cortex (a), the above
lesion in T2WI with a non-homogeneous
hypersignal (b), the diffusion restriction
marginally (c), with hyposignal correlate on
the ADC map evident (d).
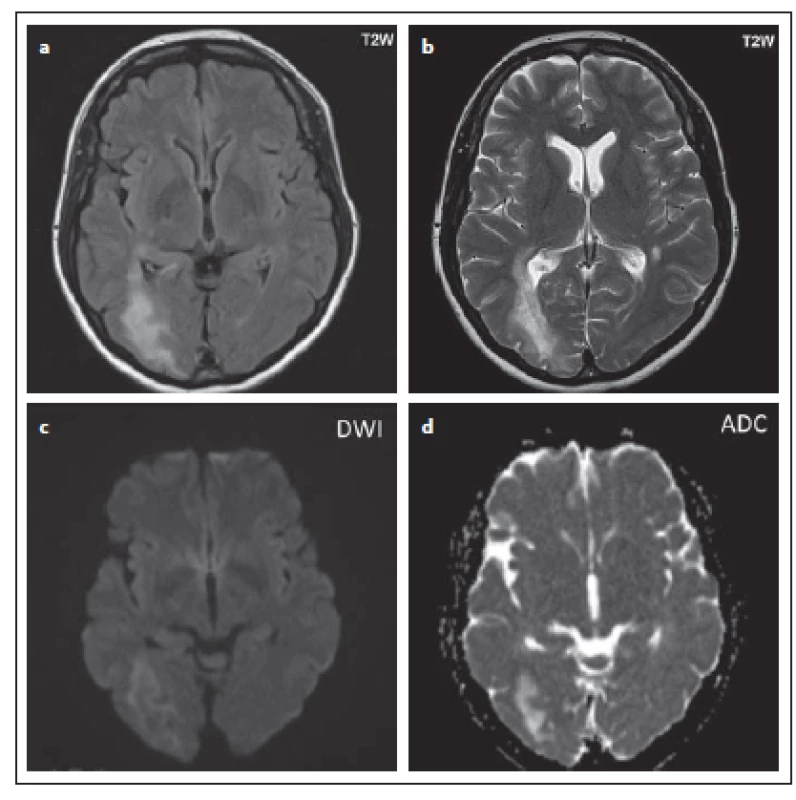
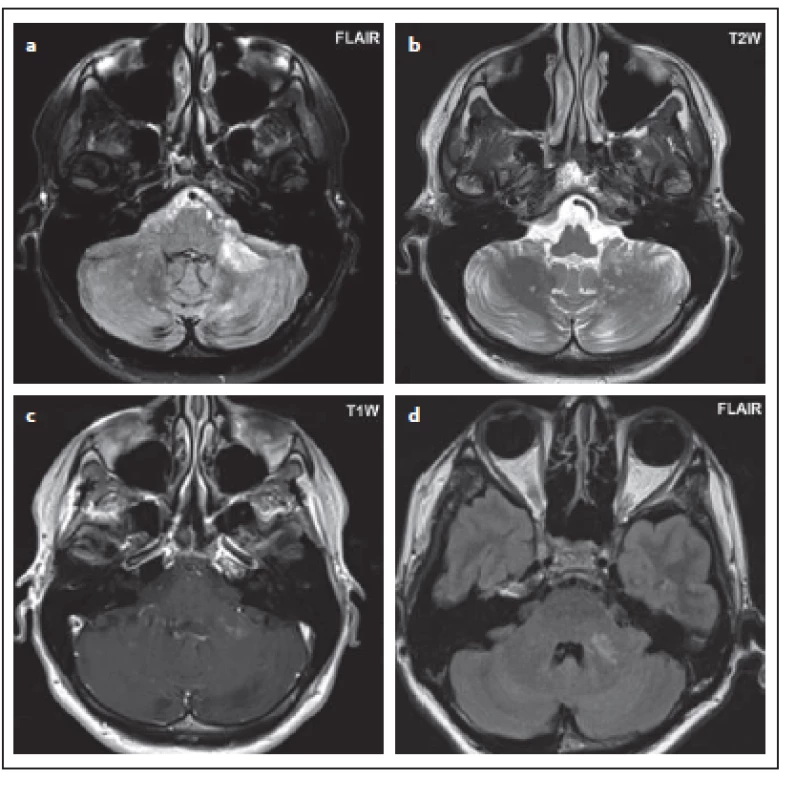
Fig. 3. Patient No. 4: small hypersignal foci
in both cerebellar hemispheres in the FLAIR
sequence, with larger focus in the left middle
cerebellar peduncle (a, d), dot hypersignal
foci in T2WI (b), enhancement is evident
after administration of contrast medium (c).
Patient No. 5: spatial co-registration, colour mapping, new leions on FLAIR sequence
are marked in red. Red in the left occipital lobe, bilaterally in the parietal lobes, and in
the right putamen – PML (a), follow-up – big lesions in occipital lobes and left temporal
a parietal lobe (b).
PML – progressive multifocal leukoencephalopathy
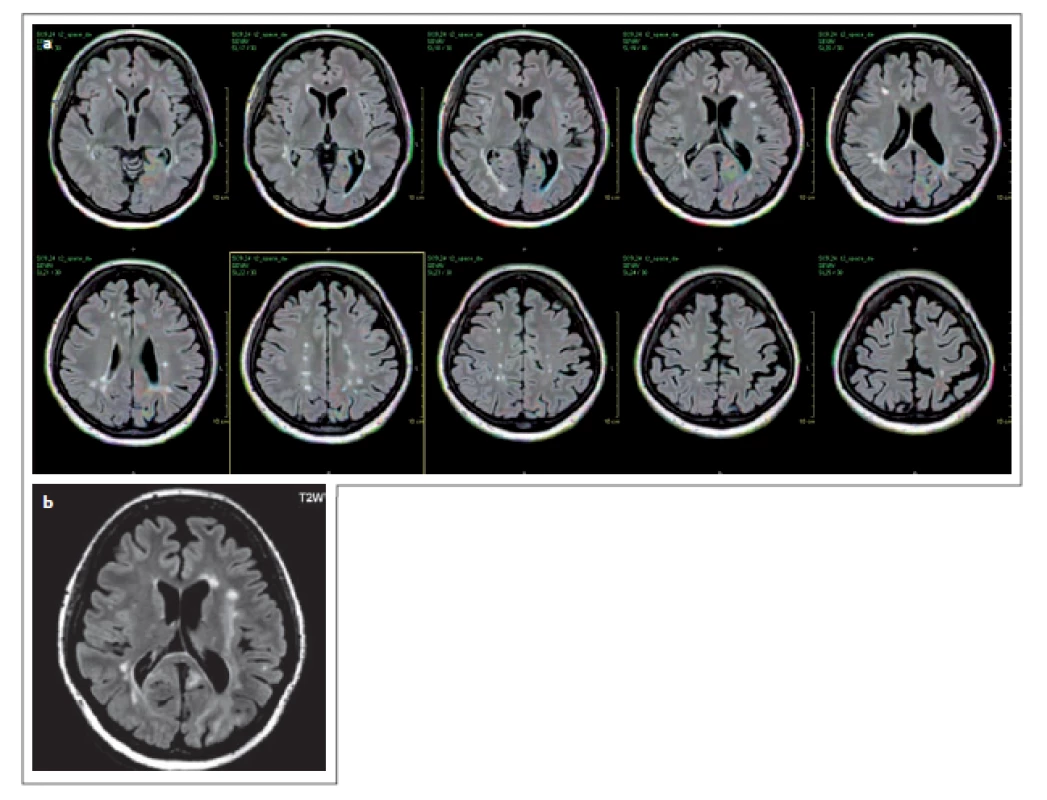
Fig. 5. Patient No. 3: typical involvement of the left frontal lobe, where the lesion is
irregular in shape and mainly subcortical (a), in T2WI, a non-homogeneous hypersignal
lesion (b).
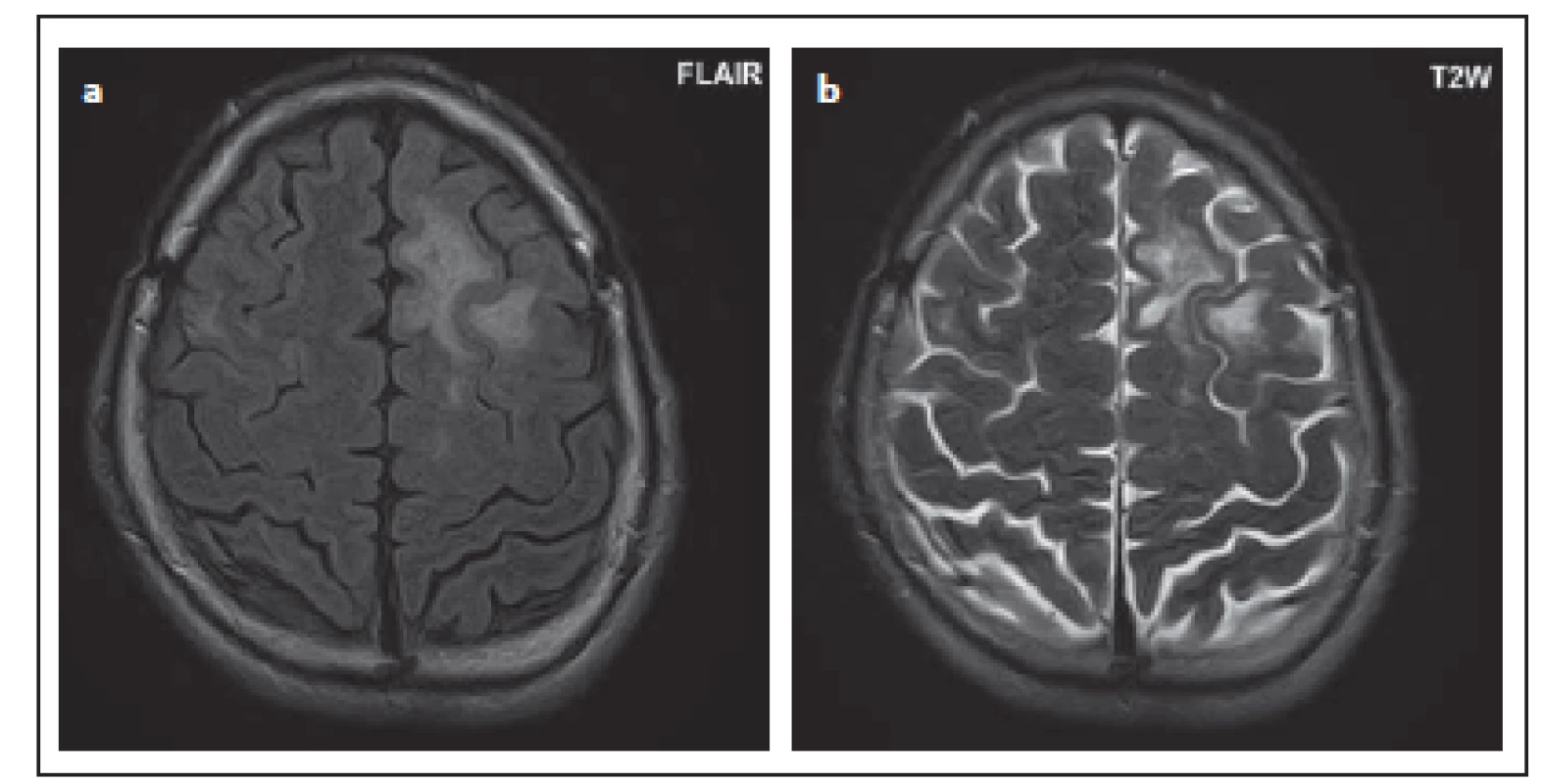
Fig. 6. Patient No 11: a discrete subcortical lesion in the right frontal lobe, incipient PML (a), MRI control after 2 and half months, when
PML was described on MRI; the lesion is enlarged (b); on T2WI see the small foci throughout the lesion (c).
PML – progressive multifocal leukoencephalopathy
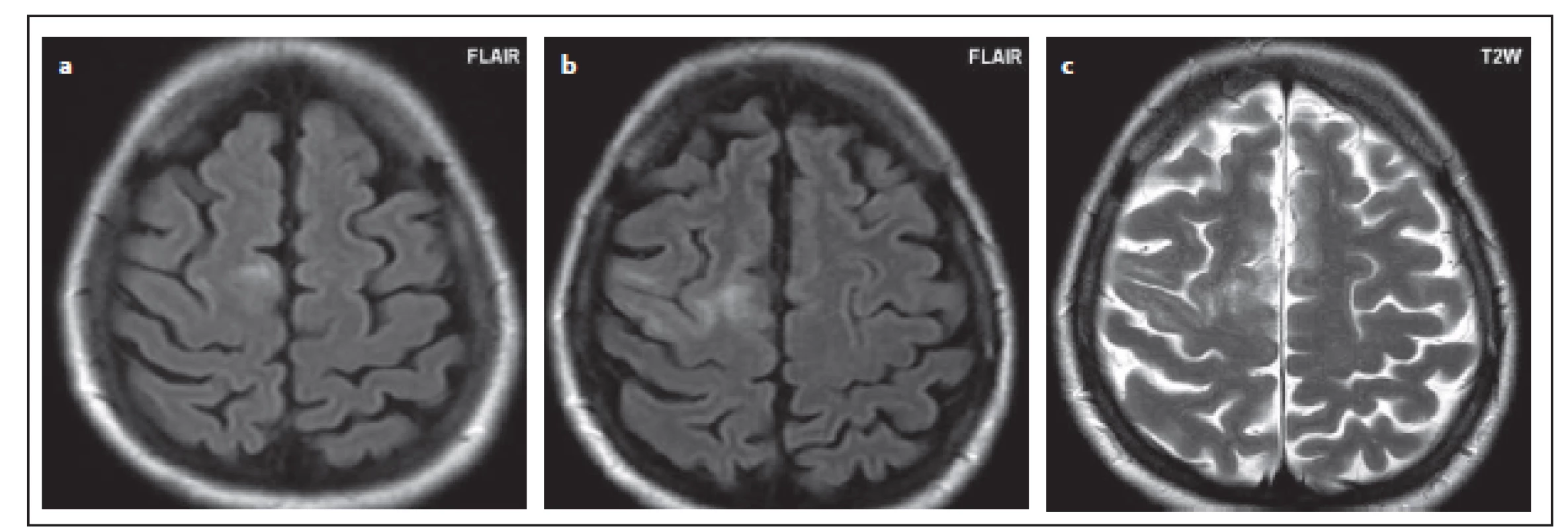
Fig. 7. Patient No. 12: in the left frontal lobe
white matter, there is an irregular hyperintensity
lesions (arrow) and also confluent
MS lesion, which are more limited to white
matter; the findings in progressive multifocal
leukoencephalopathy are only partially
different from the accompanying MS
lesions, so comparison with a previous control
was crucial for progressive multifocal
leukoencephalopathy diagnosis.
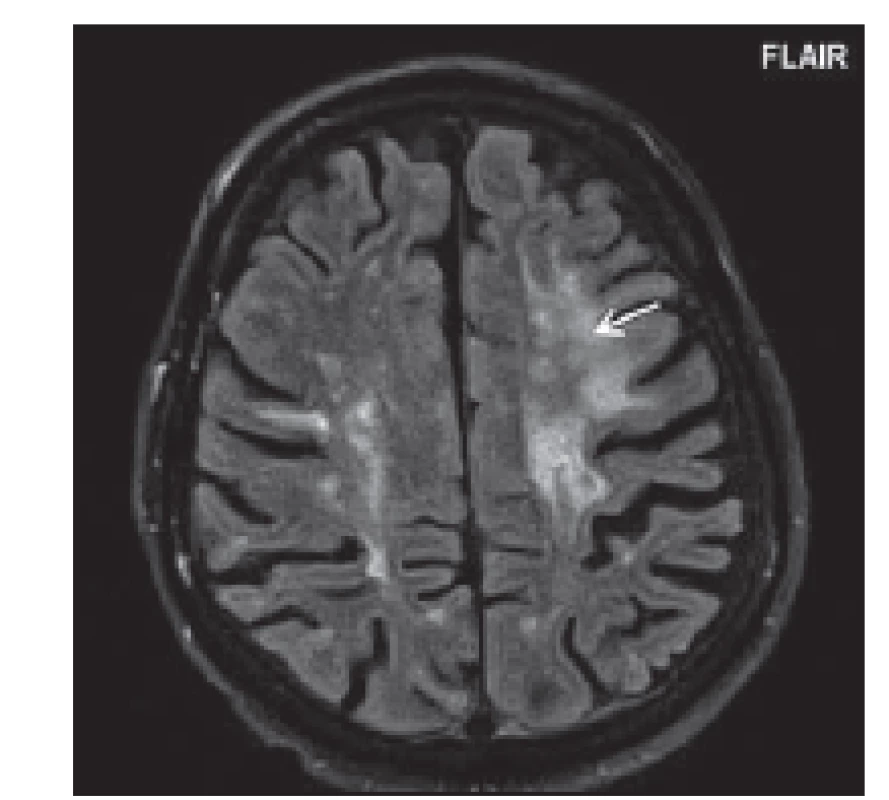
Fig. 8. Patient No. 2: FLAIR (a) and T2WI (b) showing a big hypersignal lesion in the right
temporal lobe.
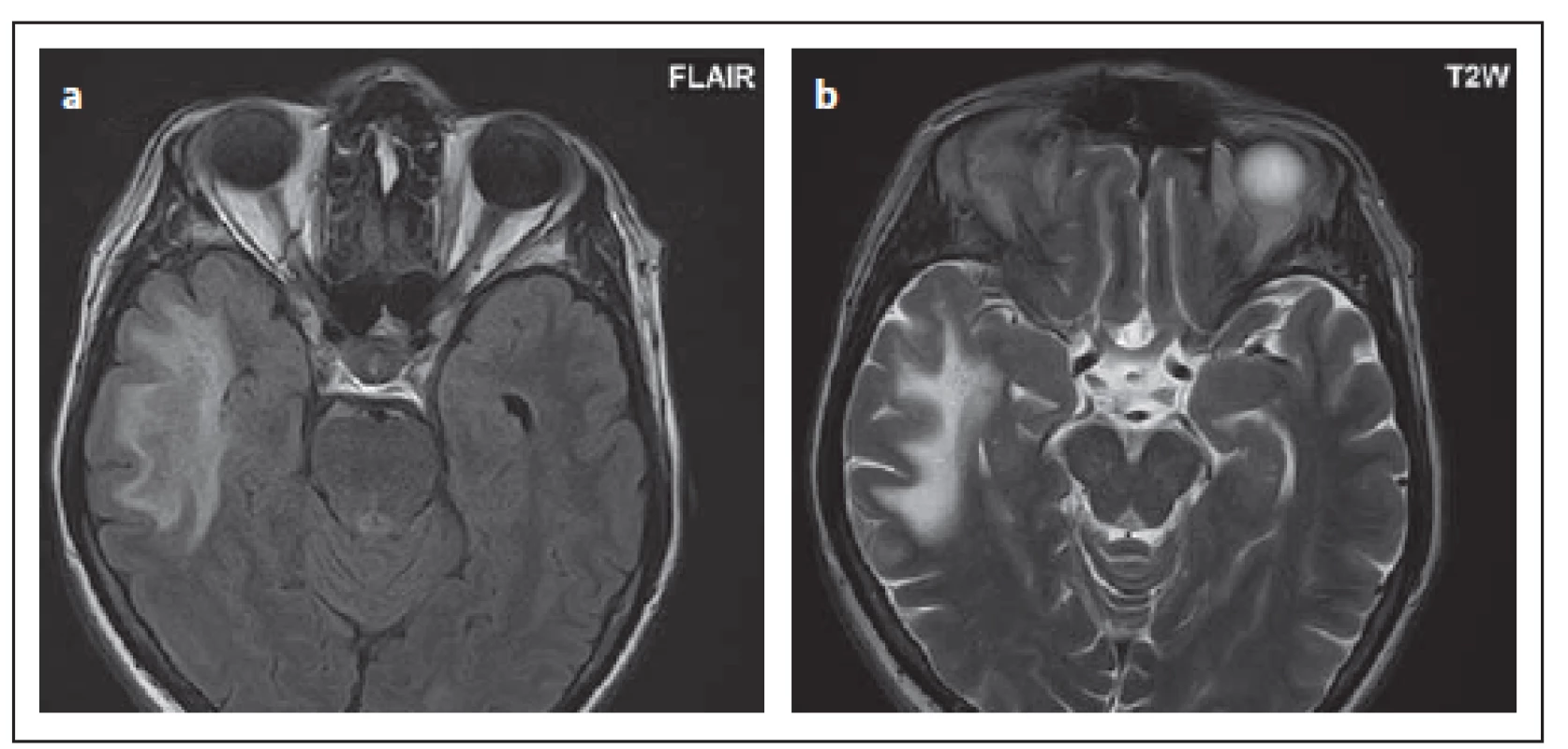
Fig. 9. Patient No. 1: a hypersignal ovoid lesion in the right thalamus (a); in the mesencephalon
(b), where elongation of the lesion in the sagittal section is evident (c). Both lesions
mimic plaques in multiple sclerosis and are sharply delineated. Lacunar infarction
is also a possible differential diagnosis of thalamic lesion. After contrast medium administration,
the enhancement of the miniscule spotted foci was observed subcortically,
mainly in the right frontal lobe (d).
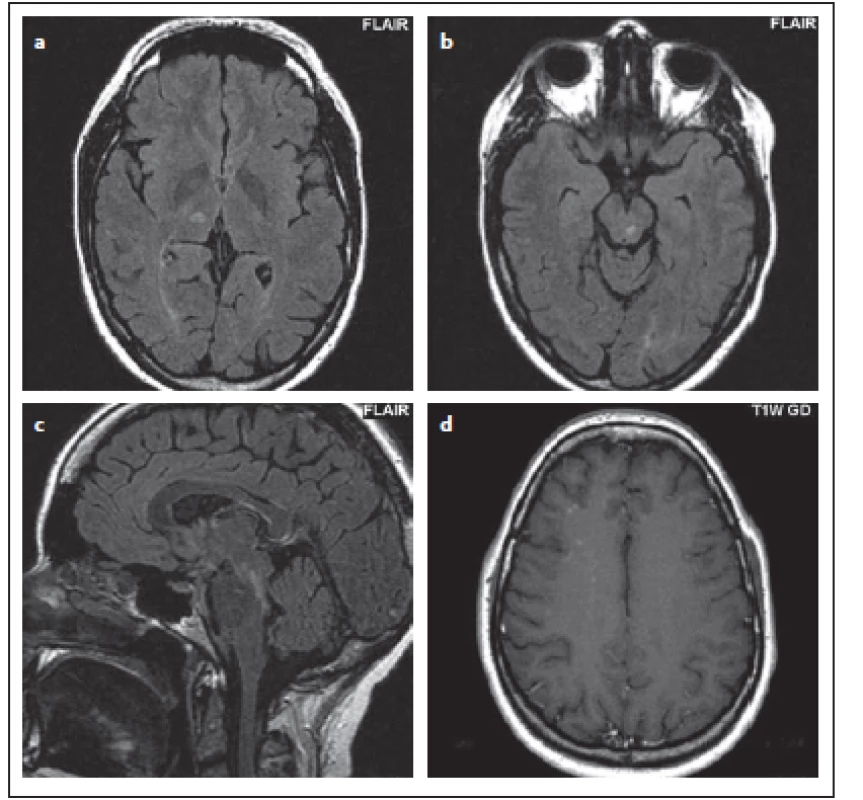
Fig. 10. Patient No. 7: a hypersignal ovoid lesion in T2WI (a), in FLAIR the extent of involvement of the medulla oblongata is evident; in this
sequence, the boundary is no longer as sharp as in T2WI (b); a hypersignal lesion in the right thalamus imitating lacunar infarction (c).
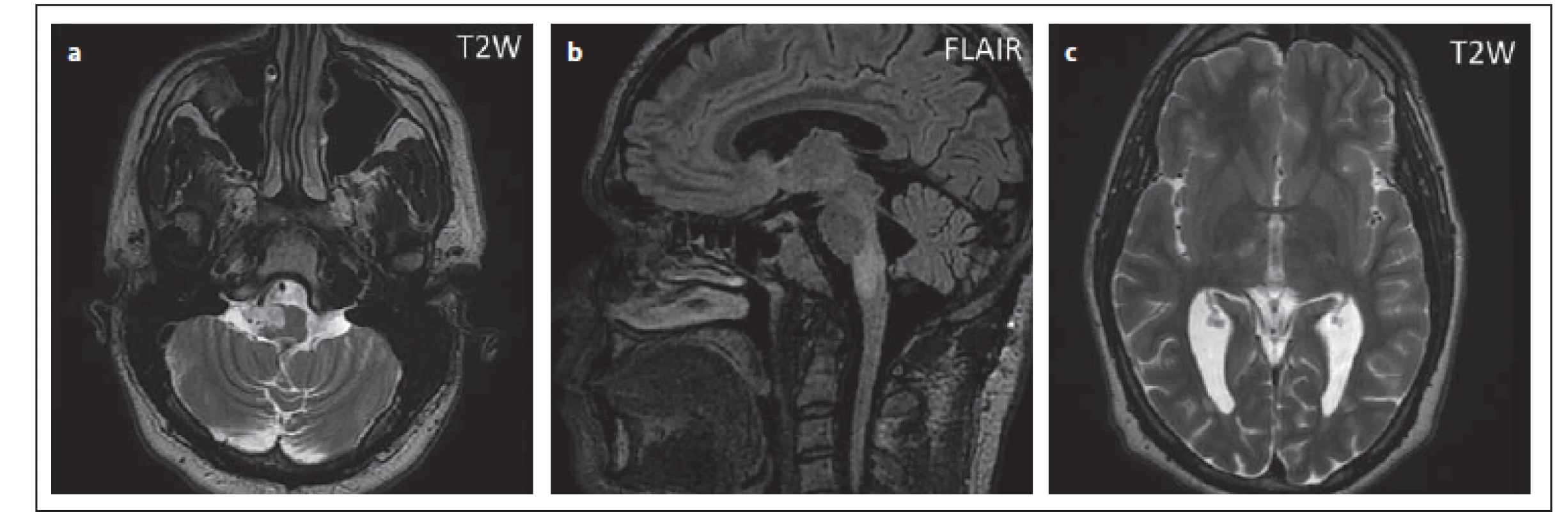
Pacient. č. 6, který měl v době diagnózy PML nález na MR negativní, po půl roce vyvinul atrofii a ložiskové postižení vermis, do statistiky nebyl zahrnut, protože bylo hodnoceno první vyšetření MR, na kterém nebyla PML patrná a které předcházelo nebo bylo ve stejnou dobu jako vyšetření PCR (obr. 11). Nález svědčící pro PML byl na vyšetření MR v 6 případech v asymptomatickém stadiu (42,9 %) (tab. 2).
Fig. 11. Patient No. 6 in whom progressive multifocal leukoencephalopathy was diagnosed
from a control lumbar puncture; simultaneous MRI and follow-up MRI were negative,
and a pathological fi nding was only evident after 6 months – cerebellar atrophy
(a, b); after another month, discreet small lesions were apparent i vermis (c, d). This was
JCV (John Cunningham virus) granulocytic neuronopathy.
Diskuze
Typickým obrazem na MR v počátečních stadiích bývá ložisko lokalizované subkortikálně, postihující U-vlákna. V asymptomatickém stadiu je postižení nejčastěji lokalizováno ve frontálním laloku, sestupně jsou dále postiženy parietální, okcipitální lalok (resp. v symptomatickém stadiu: frontální > okcipitální > parietální) [17,22]. V našem souboru bylo postižení frontálního laloku také nejčastější. Následovalo postižení v parietálním a temporálním laloku, postižení okcipitálního laloku bylo nejméně časté. V našem souboru se vyskytla jen ta odchylka oproti publikovaným studiím, že častější byla lokalizace temporálně než v okcipitálním laloku. V literatuře se udává výskyt jak v symptomatickém, tak asymptomatickém stadiu nejméně často v temporálním laloku [17,22]. Limitací naší studie i publikovaných dat jsou většinou malé soubory pacientů [2,6,13,17,22 – 25]. Ložiska PML jsou hypersignální ve FLAIR a v T2 váženém obraze. Ložiska bývají nepravidelného tvaru, mohou vyplňovat mozkový závit, nejsou ostře ohraničena vůči bílé hmotě, jsou relativně ostře ohraničena vůči šedé hmotě, nerespektují hranice mezi bílou a šedou hmotou, nebývá výraznější expanzivita [17 – 19]. Na začátku může být nález velmi diskrétní, což byl příklad pacienta č. 11. Byla zde zjištěna velmi drobná léze frontálně, na ní je patrné typické neostré ohraničení vůči bílé hmotě. To může i u takto drobné léze pomoci při odlišení od plaky u RS, pro kterou je naopak typické ostré ohraničení [17,22,23]. V oblasti centrální šedi, která je u PML iniciálně postižena v 5 %, to však neplatí. Tam bývá ložisko PML často dobře ohraničeno, oválného tvaru, stejně jako plaka u RS nebo lakunární infarkt, od nichž se při první kontrole PML obtížně odlišuje. Tato ložiska v talamu jsme v našem souboru detekovali u dvou pacientů (č. 1 a 7) a u obou byla nejednoznačná interpretace. Další vývoj ložisek již umožňuje odlišení, neboť ložiska PML se zvětšují a šíří se v průběhu kortikospinálního traktu [17,22,23].
V naší kohortě pacientů bylo zasahování subkortikálních ložisek do kortexu přítomno v 6 případech (42,9 %), což bylo méně než v publikovaných souborech, a to dokonce i v asymptomatickém stadiu, kde bylo přítomno v 72,2 % [17,22,25]. Zasahování do kortexu je také jedním z důležitých znaků, které pomáhají diferencovat PML léze od ložisek u RS [26,27].
Typická pro PML na rozdíl od RS je přítomnost drobných mikrocystických ložisek, dobře patrných v T2 váženém obraze, která jsou připodobňována k mléčné dráze. Tato ložiska jsou korelátem perivaskulárního zánětu [17,22,26]. I v našem souboru sledovaných pacientů bylo prokázáno, že přítomnost těchto drobných ložisek v blízkosti PML léze nebo nehomogenní drobnoložiskový charakter rozsáhlé léze v T2 váženém obraze mohou pomoci odlišit PML od splývajících ložisek u RS, kde toto nebývá [26,27]. Wijburg et al se zabývali nálezy na MR, které pomáhají diskriminovat PML léze v asymptomatickém stadiu od lézí u RS; a právě tečkovitá ložiska v T2 váženém obraze se ukázala být jako jedna z nejdůležitějších [27]. Tato drobná ložiska jsou v okolí léze s perivaskulárním šířením, ale nacházejí se i ve vlastním ložisku, což se v našem souboru pacientů také zvýšeně vyskytovalo [22,27]. Je to i důvod, proč bezpečnostní protokol obsahuje T2 vážený obraz, kde jsou tečkovité léze nejlépe patrné [14].
Dalším typickým znakem pro PML je ložisko tvaru půlměsíce v oblasti středního mozečkového pedunkulu [2,17,22]. Zde bylo postižení středního pedunkulu zřejmé u pacientů č. 4 a č. 9, ale nemělo poloměsíčitý tvar. U obou pacientů byl velmi podobný nález na MR, který byl popsán v literatuře jako jeden ze vzorců postižení. V oblasti mozečku začíná PML přibližně v 10 % a typický je drobnoložiskový nález mnohočetných ložisek v mozečku [22,28].
V našem souboru se zvýšený signál na DWI vyskytl u 8 pacientů (72,7 %), z nichž u jednoho pacienta byla patrná okrajově restrikce difuze s korelátem v hypointenzitě na ADC mapě. U ostatních pacientů byl na DWI zvýšený signál s proměnlivě zvýšeným signálem na ADC mapě. Zvýšený signál na ADC mapě je u PML lézí vysvětlován nárůstem extracelulárních prostor nebo extracelulární tekutiny z perivaskulární lymfocytární infiltrace a/ nebo reaktivací viru. Restrikce difuze s typickým korelátem v hypointezitě na ADC mapě je u PML lézí spíše jen na periferii ložiska, centrálně bývá vysoký signál v DWI i ADC mapě, nebo je zvýšený v rozsahu celého ložiska [22,26]. DWI pomáhá také při odlišení PML léze od chronických splývavých ložisek u RS [17]. Dále se ukázalo, že zobrazení na DWI může mít význam při sledování průběhu PML a časném odhalení IRIS [26,29].
Po podání kontrastní látky ložiska PML méně často než u RS enhancují, v časném stadiu přibližně v 30 %. Některé práce uvádějí enhancement až ve 40 %, může být přítomen v časné fázi i v pozdní [17,21,22]. Tvar enhancementu může být tečkovitý, pruhovitý, nodulární nebo okrajový, je více nepravidelný než u RS a u PML není tvar neúplného prstence [21]. Okrajový enhancement mají především rozsáhlejší léze. Práce Hodela et al poukazuje na typické tečkovité enhancující léze, které pozoroval pouze u PML, nikoliv u RS [26]. Tato ložiska patrná v obraze MR jsou korelátem perivaskulárního zánětu, vyskytují se v hluboké bílé hmotě [26]. Ve své práci Taieb et al uvádějí, že drobné tečkovité enhancující léze ve frontálním a parientálním laloku a v talamu mohou předcházet objevení se hypersignálních ložisek v T2 váženém obraze [30]. Stejný nález jsme detekovali u pacienta č. 1, který měl ložisko v mezencefalon a talamu a velmi drobná enhancující ložiska frontálně, také bez zjevného korelátu v nativní sekvenci. Taieb et al pozorovali, že tato drobná enhancující ložiska byla pouze tranzientní, vymizela po 6 týdnech, nová ložiska v T2 váženém obraze se objevila za 2 měsíce [30].
Atypickým nálezem bylo postižení oblongaty, které je u PML raritní (bylo popsáno ojediněle u klasické PML) (pacient č. 7) [31]. Tento pacient měl i nález v oblasti talamu. Další pacient, u něhož bylo obtížné určit, zda se jedná o PML léze v oblasti kmene (pacient č. 1), měl v transverzálních řezech ostře ohraničená ložiska oválného tvaru zcela imitující plaky u RS, v sagitálních řezech však byla patrná nápadnější délka ložiska. Také u toho pacienta se vyskytovalo ložisko v talamu.
Kohortě sledovaných pacientů se vymykal případ pacienta s izolovaně diagnostikovanou PML v rámci kontrolní lumbální punkce (pacient č. 6). U něho bylo MR vyšetření prvních 6 měsíců od diagnózy negativní, poté se objevila atrofie mozečku a ložiskové postižení vermis. Nález byl hodnocen jako postižení u subtypu PML – JCV granulocytární neuronopatie. Wijburg et al popsali MR nálezy u tohoto onemocnění, které jsou nejčastěji charakterizovány atrofií mozečku, ložiskovým postižením bílé hmoty především mozečku, méně často i pontu [32].
Jsou vyvíjeny softwarové aplikace, které pomáhají vizualizovat PML v preklinické fázi, což je klíčové z hlediska prognózy vývoje disability pacienta. Na MR pracovišti VFN a 1. LF byla vyvinuta technika barevného kódování/ mapování, která po prostorové koregistraci a následné subtrakci porovnává tři kontroly (vstupní vyšetření a poslední dvě kontroly), a přiřazuje ložiskové patologii barvu podle doby jejího vzniku. Primárně byla vyvinuta na vyhodnocení aktivních ložisek u RS, ale je využitelná i pro detekci PML a časné odhalení IRIS [21,22]. U pacienta č. 5 pomohlo barevné mapování vizualizovat velmi diskrétní PML ložiska, která byla bez této softwarové aplikace jen obtížně detekovatelná. Některé MR přístroje a jejich postprocesingové softwarové aplikace již umožňují porovnání většinou dvou kontrol s odečtením obrazu a zvýrazněním nových lézí nebo také s barevným odlišením [33].
Závěr
Práce ukázala značnou variabilitu MR nálezů v kohortě pacientů z ČR. Nálezy MR kopírovaly celosvětová data, kde je nejčastěji postižena subkortikální bílá hmota, z mozkových laloků frontální lalok. Pro diskriminaci PML lézí od ložisek u RS byl důležitý nález tečkovitých ložisek v T2 váženém obraze uvnitř PML léze či v jejím okolí, zasahování do kortexu a zvýšený signál na DWI. Patologická ložiska se mohou nalézat i infratentoriálně nebo v centrální šedi. Tato lokalizace se vyskytla i v souboru námi sledovaných pacientů. Odlišení je zde obtížnější, nález na MR imitoval plaky (či lakunární infarkty). Úkolem MR je pečlivá monitorace pacientů s označením nových ložisek a vyhodnocením, zda se jedná o progresi RS nebo je podezření na PML. V tom nám mohou pomoci i nové softwarové aplikace se subtrakcí obrazu a označením nových lézí, jež jsou schopny zachytit i nejčasnější stadia PML. Zcela raritní byl případ pacienta s izolovaně diagnostikovanou PML v rámci kontrolní lumbální punkce, kde vyšetření MR v době diagnózy bylo negativní a nález na MR se objevil až po 6 měsících.
Práce byla podpořena Ministerstvem zdravotnictví ČR – RVO-VFN64165, NV18-04-00168 a Ministerstvem školství – Progres Q27/LF1.
Autoři deklarují, že v souvislosti s předmětem studie nemají žádné komerční zájmy.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
prof. MUDr. Manuela Vaněčková, Ph.D.
Oddělení MR,Radiodiagnostická klinika 1. LF UK a VFN v Praze
Kateřinská 30 128 08 Praha
e-mail: man.van@post.cz
Přijato k recenzi: 25. 4. 2019
Přijato do tisku: 4. 7. 2019
Sources
1. Keen DL, Legare C, Taylor E et al. Monoclonal antibodies and progressive multifocal leukoencephalopathy. Can J Neurol Sci 2011; 38 : 565 – 571.
2. Sahraian MA, Radue EW, Eshaghi A et al. Progressive multifocal leukoencephalopathy: a review of the neuroimaging features and differential diagnosis. Eur J Neurol 2012; 19(8): 1060 – 1069. doi: 10.1111/ j.1468-1331.2011.03597.x.
3. Paz SP, Branco L, Pereira MA et al. Systematic review of the published data on the worldwide prevalence of John Cunningham virus in patients with multiple sclerosis and neuromyelitis optica. Epidemiol Health 2018; 40: e2018001. doi: 10.4178/ epih.e2018001.
4. Fragoso YD, Brooks JB, Eboni AC et al. Seroconversion of JCV antibodies is strongly associated to natalizumab therapy. J Clin Neurosci 2019; 61 : 112 – 113. doi: 10.1016/ j.jocn.2018.10.128.
5. Vaněčková M, Seidl Z. Roztroušená skleróza a onemocnění bílé hmoty v MR zobrazení. Praha: Mladá fronta 2018 : 286.
6. Yousry TA, Pelletier D, Cadavid D et al. Magnetic resonance imaging pattern in natalizumab-associated progressive multifocal leukoencephalopathy. Ann Neurol 2012; 72(5): 779 – 787. doi: 10.1002/ ana.23
676.
7. Tan CS, Koralnik IJ. Progressive multifocal leukoencephalopathy and other disorders by JC virus: clinical features and pathogenesis. Lancet Neurol 2010; 9(4): 425 – 437. doi: 10.1016/ S1474-4422(10)70040-5.
8. Honce JM, Nagae L, Nyberg E. Neuroimaging of natalizumab complications in multiple sclerosis: PML and other associated entities. Mult Scler Int 2015; 2015 : 809252. doi: 10.1155/ 2015/ 809252.
9. Rosenkrantz T, Novas M, Terborg C. PML in a patient with lymphocytopenia treated with dimethyl fumarate. N Engl J Med 2015; 372(15): 1476 – 1478. doi: 10.1056/ NEJMc1415408.
10. Berger JR, Aksamit AJ, Clifford DB et al. PML diagnostic criteria: consensus statement from the AAN Neuroinfectious Disease Section. Neurology 2013; 80(15): 1430 – 1438. doi: 10.1212/ WNL.0b013e31828c2fa1.
11. Dong-Si T, Richman S, Wattjes MP et al. Outcome and survival of asymptomatic PML in natalizumab--treated MS patients. Ann Clin Transl Neurol 2014; 1(10): 755 – 764. doi: 10.1002/ acn3.114.
12. Dong-Si T, Gheuens S, Gangadharan A et al. Predictors of survival and functional outcomes in natalizumab-
-associated progressive multifocal leukoencephalopathy. J Neurovirol 2015; 21(6): 637 – 644. doi: 10.1007/ s13365-015-0316-4.
13. Zhang Y, Wright C, Flores A. Asymptomatic progressive multifocal leukoencephalopathy: a case report and review of the literature. J Med Case Rep 2018; 12(1): 187. doi: 10.1186/ s13256-018-1727-7.
14. Vaněčková M, Seidl Z, Čáp F et al. Návrh bezpečnostní MR monitorace pacientů s roztroušenou sklerózou léčených natalizumabem. Cesk Slov Neurol N 2016; 79/ 112(6): 663 – 669.
15. Wattjes MP, Steenwijk MD, Stangel M. MRI in the diagnosis and monitoring of multiple sclerosis: an update. Clin Neuroradiol 2015; 25 (Suppl 2): 157 – 165. doi: 10.1007/ s00062-015-0430-y.
16. Ho PR, Koendgen H, Campbell N et al. Risk of natalizumab-associated progressive multifocal leukoencephalopathy in patients with multiple sclerosis: a retrospective analysis of data from four clinical studies. Lancet Neurol 2017; 16(11): 925 – 933. doi: 10.1016/ S1474-4422(17)30282-X.
17. Wattjes MP, Richert ND, Killestein J et al. The chameleon of neuroinflammation magnetic resonance paging characteristics of natalizumab – associated progressive multifocal leukoencephalopathy. Mult Scler 2013; 19(4): 1826 – 1840. doi: 10.1177/ 1352458513510224.
18. Tan IL, McArthur JC, Clifford DB et al. Immune reconstitution inflammatory syndrome in natalizumab-
-associated PML. Neurology 2011; 77(11): 1061 – 1067. doi: 10.1212/ WNL.0b013e31822e55e7.
19. Wattjes MP, Wijburg MT, Vennegoor A et al. MRI characteristics of early PML-IRIS after natalizumab treatment in patients with MS. J Neurol Neurosurg Psychiatry 2016; 87(8): 879 – 884. doi: 10.1136/ jnnp-2015-311411.
20. Štětkářová I, Medová E, Bučilová V et al. Progresivní multifokální leukoencefalopatie u nemocné s roztroušenou sklerózou léčenou natalizumabem. Ces Radiol 2013; 67(1): 577 – 583.
21. Vaněčková M, Seidl Z, Krásenský J et al. Naše zkušenosti s MR monitorací pacientů s roztroušenou sklerózou v klinické praxi. Cesk Slov Neurol N 2010; 73/ 106(6): 716 – 720.
22. Wattjes MP, Vennegoor A, Steenwijk MD et al. MRI pattern in asymptomatic natalizumab-associated PML. J Neurol Neurosurg Psychiatry 2015; 86(7): 793 – 798. doi: 10.1136/ jnnp-2014-308630.
23. Clifford DB, De Lucca A, Simpson DM et al. Natalizumab-associated progresive multifocal leukoencefalopathy in patiens with multiple sclerosis: lessons from 28 cases. Lancet Neurol 2010; 9(4): 438 – 446. doi: 10.1016/ S1474-4422(10)70028-4.
24. Sahraian MA, Radue EW, Eshaghi A et al. Progressive multifocal leukoencephalopathy: a review of the neuroimaging features and differential diagnosis. Eur J Neurol 2012; 19(8): 1060 – 1069. doi: 10.1111/ j.1468-1331.2011.03597.x.
25. Blair NF, Brew BJ, Halpern JP. Natalizumab-associated PML identified in the presymptomatic phase using MRI surveillance. Neurology 2012; 78(7): 507 – 508. doi: 10.1212/ WNL.0b013e318246d6d8.
26. Hodel J, Outteryck O, Dubron C et al. Asymptomatic progressive multifocal leukoencephalopathy associated with natalizumab: diagnostic precision with MR imaging. Radiology 2016; 278(3): 863 – 872. doi: 10.1148/ radiol.2015150673.
27. Wijburg MT, Witte BI, Vennegoor A et al. MRI criteria diffetentiating asymptomatic PML from new MS lesions during natalizumab pharmacovigilance. J Neurol Neurosurg Psychiatry 2016; 87(10): 1138 – 1145. doi: 10.1136/ jnnp-2016-313772.
28. Phan-Ba R, Lommers E, Tshibanda L et al. MRI preclinical detection and asymptomatic course of a progressive multifocal leucoencephalopathy (PML) under natalizumab therapy. J Neurol Neurosurg Psychiatry 2012; 83(2): 224 – 226. doi: 10.1136/ jnnp-2011-300511.
29. Hodel J, Bapst B, Outteryck O et al. Magnetic resonance imaging changes following natalizumab discontinuation in multiple sclerosis patients with progressive multifocal leukoencephalopathy. Mult Scler 2018 : 1352458517750765. doi: 10.1177/ 1352458517750
765.
30. Taieb G, Renard D, Thouvenont E et al. Transient punctate enhancing lesions preciding natalizumab-
-associated progressive multifocal leukoencephalopathy. J Neurol Sci 2014; 346(1 – 2): 364 – 365. doi: 10.1016/ j.jns.2014.09.007.
31. Mathew RM, Murname M. MRI in PML: bilateral medullary lesions. Neurology 2004; 63(12): 2380. doi: 10.1212/ 01.wnl.0000141860.97900.8a.
32. Wijburg MT, van Oosten BW, Murk JL et al. Heterogeneous imaging characteristics of JC virus granule cell neuronopathy (GCN): a case series and review on the literature. J Neurol 2015; 262(1): 65 – 73. doi: 10.1007/ s00415-014-7530-5.
33. Eichinger P, Schon S, Pongratz V et al. Accuracy of unenhanced MRI in the detection of new brain lesions in multiple sclerosis. Radiology 2019; 291(2): 429 – 435. doi: 10.1148/ radiol.2019181568.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2019 Issue 4
- Advances in the Treatment of Myasthenia Gravis on the Horizon
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Memantine Eases Daily Life for Patients and Caregivers
-
All articles in this issue
- Intrakraniálna stenóza – najlepšiu konzervatívnu liečbu je vhodné kombinovať so stentom - ÁNO
- Intrakraniální stenóza – nejlepší konzervativní léčbu je vhodné kombinovat se stentem - NE
- Intrakraniálna stenóza – najlepšiu konzervatívnu liečbu je vhodné kombinovať so stentom
- Multisystémová atrofie
- Dvě původní české zkoušky k vyšetření paměti za tři minuty – Amnesia Light and Brief Assessment (ALBA)
- Hypersomnia pri akútnej bitalamickej ischémii
- Postižení sluchu po spinální anestezii
- Dehiscence horního polokruhovitého kanálku
- Spektrum MR nálezů progresivní multifokální leukoencefalopatie u kohorty pacientů s roztroušenou sklerózou v ČR
- Vyšetření čichu před operací nosní polypózy a po ní
- Retrospektivní autoevaluace výsledků operací intrinsických mozkových nádorů – konsekutivní kohorta 270 operací v rámci jednoho neurochirurgického centra NOS ČOS (Neuroonkologické sekce České onkologické společnosti) z let 2015–2017
- Spina bifida v České republice – incidence a prenatální diagnostika
- Liečba ťažkej spasticity intratekálnym podávaním baklofénu – 15-ročné skúsenosti
- Profil behaviorálních projevů u idiopatické poruchy chování v REM spánku
- Vliv subkutánně podávaného interferonu β-1a na aktivitu onemocnění u pacientů s klinicky izolovaným syndromem – observační studie ATRACT
- Je nutné při operační léčbě chronického subdurálního hematomu trepanací a drenáží provádět i výplach hematomu?
- Stanovení míry shody mezi záchranáři a neurology při identifi kaci těžké hemiparézy u pacientů s akutní cévní mozkovou příhodou
- Čichová dysfunkce u české skupiny pacientů s idiopatickou poruchou chování v REM spánku
- Objemná pneumokéla frontálního sinu s rozsáhlým intrakraniálním šířením imitujícím dysfunkci lumboperitoneální drenáže u predisponovaného pacienta s Marfanovým syndromem
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Multisystémová atrofie
- Dehiscence horního polokruhovitého kanálku
- Spina bifida v České republice – incidence a prenatální diagnostika
- Postižení sluchu po spinální anestezii
