Vliv demence na trajektorie kvality života seniorů
Authors:
H. Kisvetrová 1; D. Školoudík 2; R. Herzig 3; M. Vališ 3; B. Jurašková 4; J. Tomanová 1; R. Vaverková 1; K. Langová 1
; Y. Yamada 5
Authors‘ workplace:
Centrum vědy a výzkumu, Fakulta, zdravotnických věd, UP v Olomouci, Česká republika
1; Neurologická klinika FN Ostrava, Česká republika
2; Neurologická klinika LF UK a FN Hradec Králové, Česká republika
3; III. interní gerontometabolická klinika, FN Hradec Králové, Česká republika
4; Center for Medical Education and, Internationalization, Graduate School, of Medicine, Kyoto University, Japan
5
Published in:
Cesk Slov Neurol N 2020; 83/116(3): 298-304
Category:
Original Paper
doi:
https://doi.org/10.14735/amcsnn2020298
Overview
Cíl: Zjistit hodnocení kvality života a faktory, které ji ovlivňují, u pacientů s demencí (PsD) a bez demence a zda důstojnost patří mezi tyto faktory. Definovat prediktory změny kvality života během 2 let.
Soubor a metodika: Soubor tvořilo 294 PsD (37,1 % mužů; věk 79,6 ± 7,5 let; MMSE 22,7 ± 1,7) a 329 pacientů bez demence (30,1 % mužů; věk 72,7 ± 7,0 let; MMSE 29,2 ± 1,3). Byl použit prospektivní longitudinální design (tři měření během 2 let). Dotazníkový soubor zahrnoval české verze standardizovaných nástrojů pro kvalitu života, depresi, důstojnost, postoje ke stárnutí, fyzickou zdatnost, soběstačnost, bolest a soubor sociodemografických dat. Pro statistické zpracování byly použity párový t-test, chí-kvadrát, Shapiro-Wilkovův a Durbin-Watsonův test a multivariantní lineární regrese.
Výsledky: Deprese ovlivňovala kvalitu života u obou skupin respondentů. PsD měli vyšší kvalitu života dále spojenou s pozitivnějším hodnocením důstojnosti, lepší soběstačností (u všech p < 0,001) a pozitivnějším postojem ke stárnutí (p = 0,011). Ke zhoršení kvality života došlo za 2 roky pouze u PsD (p < 0,001). Prediktory zhoršení byly mužské pohlaví (p = 0,021), samota ≥ 8 h denně (p = 0,001), život bez partnera (p < 0,001), nižší frekvence návštěv (p = 0,039) a vyšší kvalita života při vstupním měření (p < 0,001).
Závěr: Důstojnost patří u PsD mezi významné faktory kvality života. Sociální vztahy a společenské zapojení mají pro udržení kvality života v dlouhodobější perspektivě zásadní význam.
Klíčová slova:
kvalita života – demence – deprese – důstojnost – stárnutí – postoje – sociální zapojení
Úvod
V současnosti žije na světě přibližně 50 milionů osob s demencí a předpokládá se, že do roku 2050 jejich počet stoupne až na 152 milionů. Prevalence demence se exponenciálně zvyšuje ve věku nad 60 let a liší se mezi regiony. Odhady se pohybují od 4,6 % ve střední Evropě, vč. ČR, až po 8,7 % v severní Africe a na Středním východě [1,2]. Demence tak představuje globální zdravotně-sociální fenomén, který má dopad na celou společnost. Syndrom demence je způsoben neurodegenerativními poruchami (u degenerativní demence) a jinými etiologiemi (např. u posttraumatické nebo vaskulární demence), které ovlivňují kognitivní schopnosti, což vede k progresivní ztrátě soběstačnosti v každodenním životě a schopnosti zapojit se do společenských aktivit. To vše má negativní dopad na kvalitu života seniora [3]. Počáteční stadium demence je charakterizováno zhoršením paměti, což platí především pro Alzheimerovu nemoc [4], poruchami komunikace a postižením exekutivních nebo zrakově-prostorových funkcí, což je charakteristické pro demence frontotemporální, vaskulární a demenci s Lewyho tělísky. Jedinec je ale schopen uvědomovat si svou nemoc, a to často vede k nejistotě a změnám nálady (deprese, úzkost). Jistotu mu poskytuje dodržování pravidelného denního režimu a navyklých rituálů. Může být ovlivněna také výkonnost komplexních kognitivně zaměřených denních činností jedince s negativními důsledky pro kvalitu života. Podpora kvality života seniorů v počátečním stadiu demence se proto stala jedním z klíčových cílů zdravotní péče [5,6].
Kvalita života je vícerozměrný konstrukt založený na subjektivní zkušenosti jedince s vlastním životem a objektivních kritériích v kontextu kultury a hodnot společnosti, ve které žije [7]. V posledních letech se výzkumy zaměřují na sebehodnocení kvality života a faktorů, které ji ovlivňují, u seniorů s demencí i bez demence [8–11]. U seniorů s demencí je horší kvalita života často spojena se ztrátou funkční schopnosti a soběstačnosti v aktivitách denního života (activities of daily living; ADL) [12], strachem z pádů [13], omezením sociální participace [14,15], chronickou bolestí [16] a negativním postojem ke stárnutí [17]. Rovněž deprese, která se u seniorů často vyskytuje, je považována za významnou proměnnou ovlivňující kvalitu života osob s demencí [18]. Výše uvedené faktory se většinou shodují s těmi, které se vyskytují i u pacientů bez demence [19]. Dosud ale při zkoumání trajektorie kvality života nebylo mezi proměnné zařazeno hodnocení důstojnosti seniora.
Cílem naší studie bylo zjistit hodnocení kvality života a faktory, které ji ovlivňují, u pacientů v počátečním stadiu demence a bez demence a zda důstojnost patří mezi tyto faktory. Dále pak definovat prediktory změny kvality života v průběhu 2 let.
Soubor a metodika
Respondenti
Výzkumný soubor tvořily dvě skupiny respondentů. První skupinu tvořili pacienti v počáteční fázi demence, kteří splnili zařazující kritéria:
- věk ≥ 60 let;
- diagnostikovaný jakýkoliv typ demence v počátečním stadiu (diagnóza dle MSK 10: F00, F01–F03) se skóre Mini-Mental State Examination (MMSE) 20–25 bodů;
- kontakt s rodinným pečovatelem alespoň 1× týdně.
Respondenti byli osloveni prostřednictvím neurologických a geriatrických ambulancí, kde byli léčeni pro diagnózu demence.
Druhou skupinu tvořili pacienti bez demence, kteří splnili zařazující kritéria:
- věk ≥ 60 let;
- bez diagnózy demence;
- skóre MMSE 26–30 bodů.
Pacienti byli oslovení prostřednictvím ordinací praktických lékařů.
Vylučující kritéria pro obě skupiny pacientů byla:
- trvalá institucionální péče;
- úplná imobilita;
- závažná psychická porucha (schizofrenie, bipolárně afektivní porucha);
- terminální fáze nemoci.
Studie probíhala v letech 2017–2019 ve třech regionech ČR (Olomouc, Ostrava a Hradec Králové). Ve studii byl použit prospektivní longitudinální design zahrnující tři fáze měření, kdy respondenti vyplnili dotazníkový soubor samostatně nebo jako strukturovaný rozhovor s výzkumným pracovníkem při zařazení do studie a pak po 12 a 24 měsících.
Dotazníkový soubor
Baterie dotazníků obsahovala soubor českých verzí hodnotících nástrojů pro kvalitu života – Quality of Life – Alzheimer’s Disease; depresi – Geriatric Depression Scale; důstojnost – Patient Dignity Inventory; postoj ke stárnutí – Attitude to Ageing Questionnaire; strach z pádů – Falls Efficacy Scale International; fyzickou zdatnost – Short Physical Performance Battery; soběstačnost v ADL – Bristol Activities of Daily Living Scale; bolest – Horizontální vizuální analogová škála. Dále byly zaznamenány sociodemografické a klinické charakteristiky u všech respondentů: věk, pohlaví, vzdělání, sociální situace, frekvence společenských kontaktů, základní vyšetření sluchu a zraku.
Hodnotící nástroje
Quality of Life – Alzheimer’s Disease (QOL-AD) se zaměřuje na aktuální hodnocení kvality života pacienta. Obsahuje 13 položek s čtyřstupňovými Likertovými škálami. Celkové skóre QOL-AD se pohybuje mezi 13–52 body, kdy vyšší skóre ukazuje na vyšší kvalitu života [20,21].
Geriatric Depression Scale (GDS) je validní a spolehlivý nástroj pro skríning deprese využitelný i u jedinců s mírnou až střední demencí [22]. Obsahuje 15 sebehodnotících položek a celkové skóre GDS se pohybuje od 0 do 15 bodů.
Patient Dignity Inventory (PDI) obsahuje 25 položek s pětibodovými Likertovými škálami pro identifikaci problémů, které mohou vyvolávat u jedince obavy související s ohrožením důstojnosti [23,24]. Celkové skóre PDI se pohybuje od 25 do 125 bodů. Vhodnost PDI pro použití u seniorů s demencí byla potvrzena [25].
Bristol Activities of Daily Living Scale (BADLS-CZ) obsahuje základní a instrumentální ADL, od zcela nezávislých až po zcela závislé. Dotazník vyplňuje blízká osoba, která hodnotí výkon 20 činností v životě pacienta. Celkové skóre BADLS-CZ se pohybuje od 0 (zcela nezávislé) do 60 bodů (zcela závislé) [26].
Short Physical Performance Battery (SPPB) obsahuje tři funkční testy, které hodnotí rovnováhu, rychlost chůze na vzdálenost 4 m a opakované vstávání ze židle. Celkové skóre je 0–12 bodů [27]. Nástroj je validní i pro seniory s demencí [28].
Attitude to Ageing Questionnaire (AAQ) hodnotí subjektivní vnímání stárnutí. Obsahuje 24 položek rozdělených do tří domén. Celkové skóre AAQ je v rozmezí 24–120 bodů. Vyšší skóre ukazuje na pozitivnější postoj ke stárnutí a stáří [29]. Bylo potvrzeno, že i senioři s demencí jsou schopni validně odpovídat na otázky týkající se jejich postojů ke stárnutí [30].
Falls Efficacy Scale – International (FES-I) má 16 položek poskytujících informaci o míře obav z pádů pro řadu činností každodenního života [31]. Celkové skóre se pohybuje v rozmezí 16–64 bodů, kde vyšší skóre naznačuje více obav z pádu. Ve výzkumu byla použita česká verze FES-I [32], která je validní i pro seniory s demencí [33].
Horizontální vizuální analogová škála (HVAS) se skládá z 10cm úsečky, na které pacient zaznamenává úroveň subjektivně vnímané bolesti (žádná bolest až extrémní bolest). HVAS lze úspěšně použít u většiny starších pacientů s mírnou až středně těžkou demencí [34].
Statistické zpracování
Výpočet velikosti výzkumného souboru byl založen na očekávaném rozdílu 0,5 bodu v testech QOL-AD během 24 měsíců mezi pacienty s diagnózou demence a bez ní, a = 0,05 (two-tailed) a b = 0,8. Za předpokladu, že 30 % účastníků nedokončí studii, bylo třeba pro každou skupinu oslovit minimálně 290 respondentů.
Soubor byl popsán pomocí absolutních a relativních četností (průměr, směrodatná odchylka [SD] a medián). Srovnání skupin pacientů v kvantitativních znacích bylo provedeno t-testem pro nezávislé vzorky. Porovnání kvantitativních veličin prvního a třetího měření bylo provedeno párovým t-testem. V kvalitativních veličinách byly skupiny porovnány chí-kvadrát testem. Všechny testy byly provedeny na hladině statistické významnosti 0,05. Multivariantní lineární regrese krokovou metodou (stepwise) byla použita k nalezení významných prediktorů kvality života. Do modelu byly jako nezávislé prediktory zařazeny proměnné: věk, pohlaví, vzdělání, sociální podmínky (žije sám – ne), sociální aktivity (společenské akce, návštěvy, telefonický kontakt, čas strávený o samotě), postižení sluchu a zraku, kognice, bolest, fyzická zdatnost, soběstačnost v ADL, deprese, strach z pádu, postoje ke stárnutí a důstojnost. Normalita byla ověřena Shapiro-Wilkovým testem. Nezávislost reziduí ověřil Durbin-Watsonův test, kdy hodnoty blízké hodnotě 2 ukazují na nepřítomnost autokorelace. Multikolinearita byla ověřena pomocí faktoru VIF (variance inflation factor), kdy VIF > 10 indikuje možnost multikolinearity mezi závislými proměnnými. Data v naší studii splňovala předpoklady multivariabilní lineární regrese. Kvalita modelu byla zhodnocena koeficientem determinace R2 a adjustovaným R2. Ke statistickému zpracování byl použit statistický software IBM SPSS Statistics for Windows, Version 23.0. (IBM Corp., Armonk, NY, USA).
Výsledky
V první fázi se do výzkumu zapojilo 623 respondentů, z toho 294 pacientů s diagnózou demence v počátečním stadiu (109 [37,1 %] mužů; průměrný věk 79,6 ± 7,5 let; MMSE 22,7 ± 1,7) a 329 pacientů bez demence (99 [30,1 %] mužů; průměrný věk 72,7 ± 7,0 let; MMSE = 29,2 ± 1,3). Demografická data jsou uvedena v tab. 1. Pacienti s demencí byli signifikantně starší (p < 0,001), měli nižší vzdělání (p = 0,004), méně často se zúčastnili společenských aktivit (p = 0,036), měli nižší frekvenci telefonického kontaktu s přáteli a členy rodiny (p = 0,002), trávili více času o samotě (p < 0,001) a měli častěji poruchy sluchu (p = 0,026) i zraku (p < 0,001).
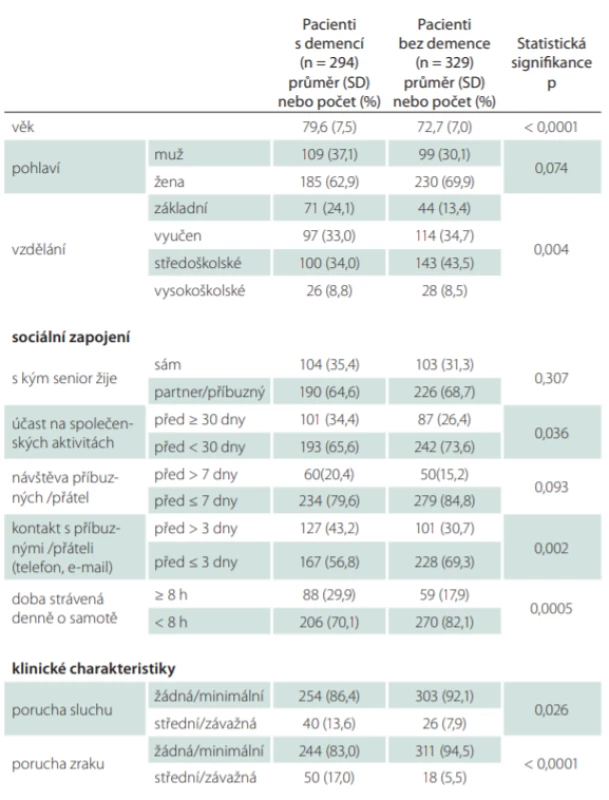
Pacienti s demencí a bez demence se významně lišili ve všech zkoumaných škálách (tab. 2). Porovnáním výsledků prvního (vstupního) a kontrolního měření po 24 měsících bylo zjištěno, že u pacientů s demencí i bez demence se signifikantně zhoršila úroveň kognice, fyzické zdatnosti a stupně soběstačnosti (u všech p < 0,0001) a zvýšil se strach z pádů (p = 0,0002 u pacientů s demencí a p < 0,0001 u pacientů bez demence). U pacientů s demencí došlo také ke zhoršení kvality života (p < 0,0001) a hodnocení bolesti (p = 0,022). U pacientů bez demence došlo k signifikantnímu zhoršení postoje ke stárnutí (p = 0,0001) a hodnocení důstojnosti (p = 0,006) (tab. 3).
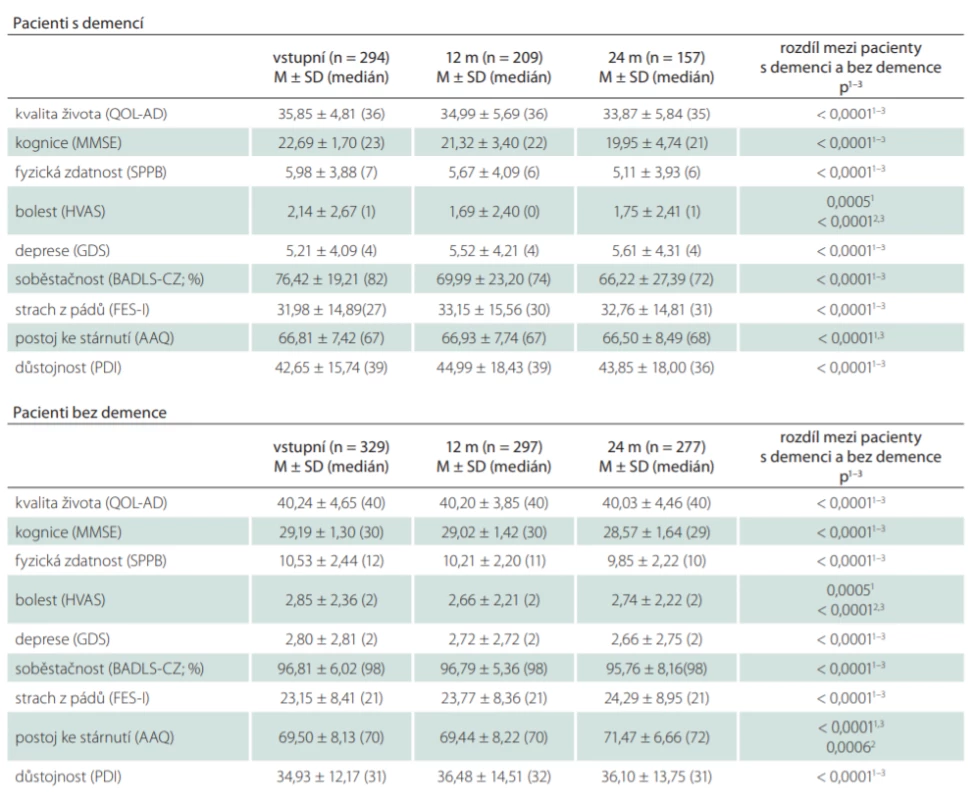
AAQ – Attitude to Ageing Questionnaire; BADLS-CZ – Bristol Activities of Daily Living Scale; FES-I – Falls Effi cacy Scale – International; GDS – Geriatric Depression Scale; HVAS – Horizontální vizuální analogová škála; M – průměr; m – měsíc; MMSE – Mini-Mental State Examination; n – počet;
PDI – Patient Dignity Inventory; QOL-AD – Quality of Life–Alzheimer’s Disease; SD – směrodatná odchylka; SPPB – Short Physical Performance
Battery

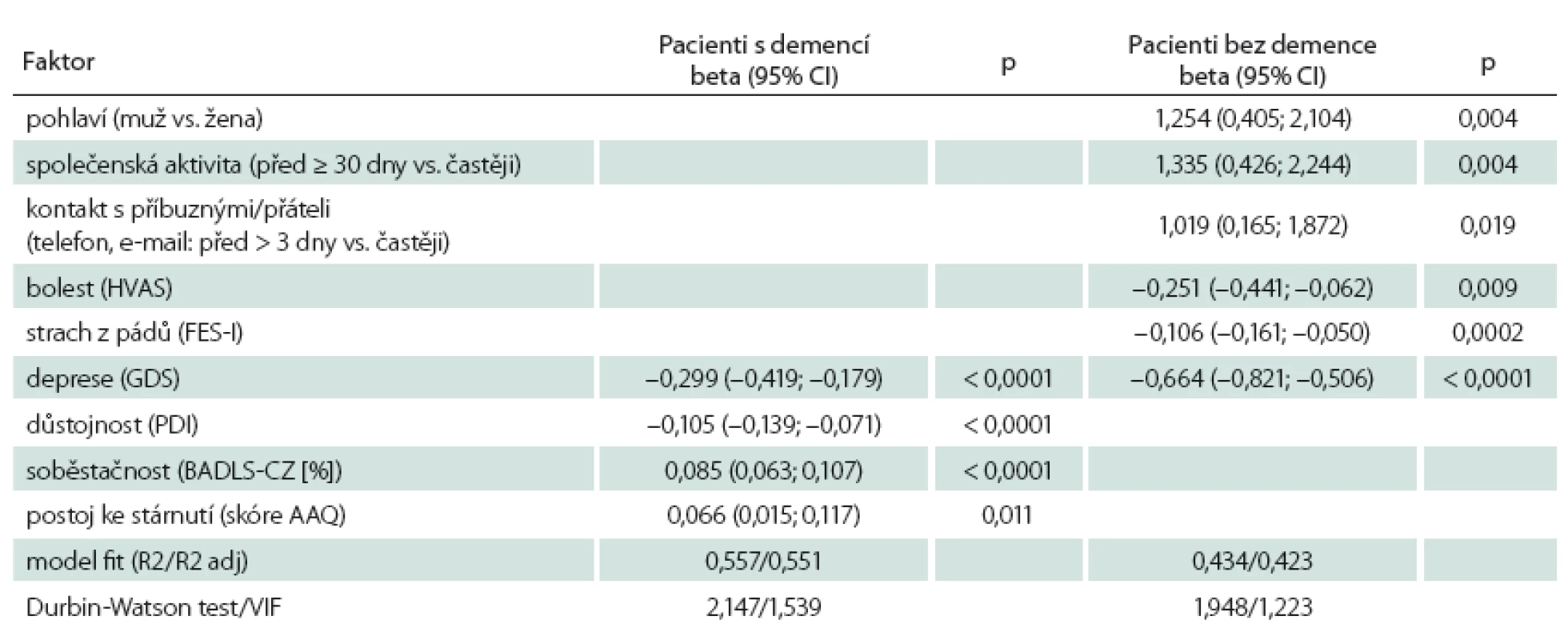
Identifikace faktorů, které ovlivňují kvalitu života, byla provedena v prvním měření. U pacientů s demencí se prokázalo, že důstojnost patří mezi faktory ovlivňující kvalitu života. Vyšší kvalitu života měli ti, kteří pozitivněji hodnotili svoji důstojnost (p < 0,0001), měli vyšší stupeň soběstačnosti (p < 0,0001), pozitivnější postoj ke stárnutí (p = 0,011) a menší úroveň deprese (p < 0,0001). Pacienti bez demence měli lepší kvalitu života spojenou s menší úrovní deprese (p < 0,0001), menším strachem z pádů (p < 0,0001), nižší intenzitou bolesti (p = 0,009), ženským pohlavím (p = 0,004), častější účastí na společenských akcích (p = 0,004) a vyšší frekvencí telefonických kontaktů (p = 0,019) (tab. 4).
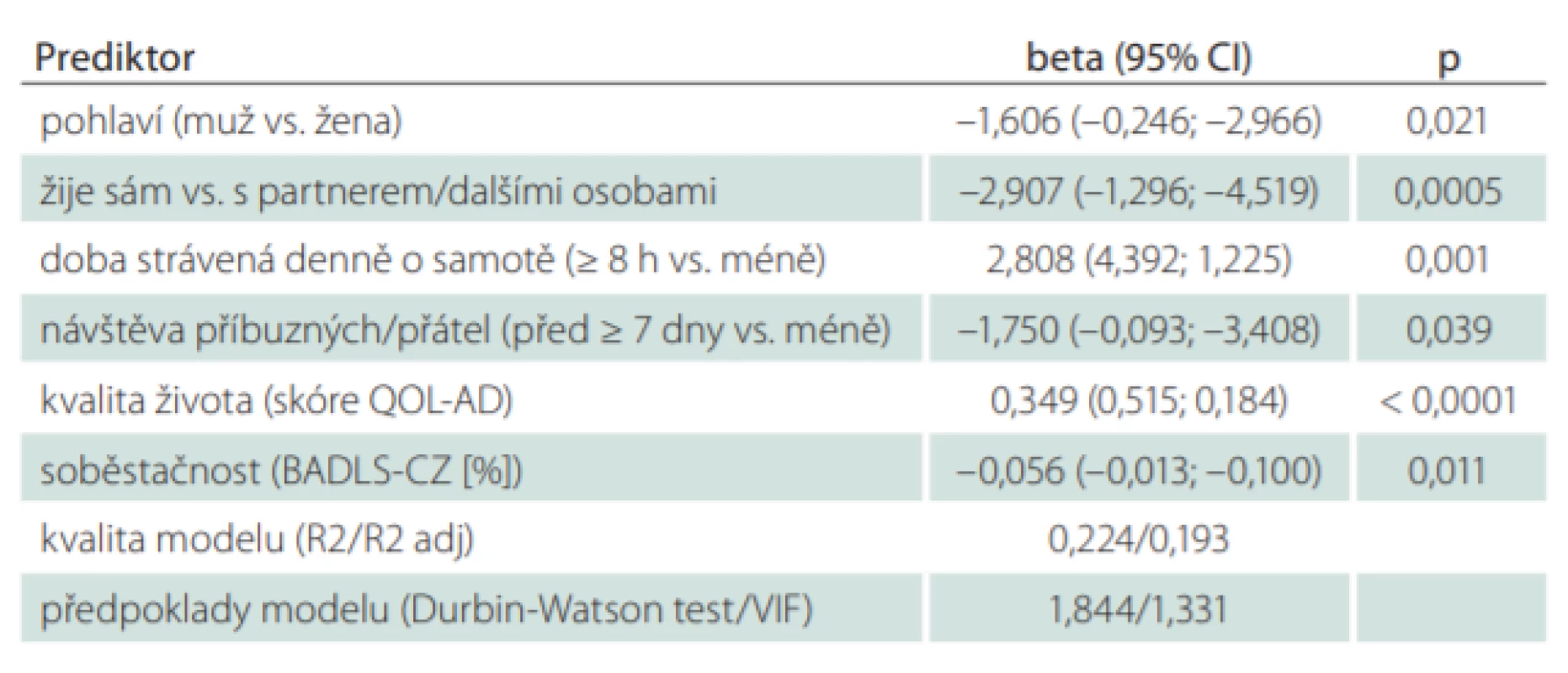
Kvalita života při kontrolním vyšetření 24 měsíců od zařazení do studie se zhoršila pouze u pacientů s demencí. Proto byly hledány faktory, které mohly způsobit tento rozdíl. Rozdíl mezi hodnotami skóre QOL-AD v prvním a třetím měření představoval závisle proměnnou v modelu mnohorozměrné lineární regrese. Vliv na velikost změny kvality života (rozdíl mezi prvním a třetím měřením) u pacientů s demencí mělo pohlaví (u mužů větší zhoršení kvality života [průměr = 2,8] než u žen [průměr = 1,8]; p = 0,021). Dále to byla doba strávená denně o samotě (u respondentů, kteří strávili o samotě < 8 h, došlo k většímu zhoršení kvality života [průměrné hodnoty = 2,6 vs. 1,1]; p = 0,001). Významnými prediktory byly i sociální situace (u respondentů, kteří žili sami, došlo k většímu zhoršení kvality života [průměrné hodnoty = 3,2 vs. 1,7]; p = 0,0005) a frekvence návštěv (u respondentů, kteří měli nižší frekvenci návštěv, došlo k většímu zhoršení kvality života [průměrné hodnoty = 3,5 vs. 1,9]; p = 0,039). Dalšími prediktory byly celkové skóry prvního měření QOL-AD a BADLS-CZ. U pacientů s demencí, kteří měli při prvním měření vyšší kvalitu života (vyšší skóre QOL-AD), došlo za 24 měsíců k větší změně (větší zhoršení kvality života; p < 0,0001). Naopak vyšší soběstačnost (BADLS-CZ) při vstupním měření korelovala s menší změnou kvality života (p = 0,011) (tab. 5).
Diskuze
V prezentované studii bylo prokázáno, že kvalita života se v průběhu 2 let zhoršila jen u pacientů s demencí, kdežto u pacientů bez demence ke změně v kvalitě života nedošlo. Faktory ovlivňující kvalitu života respondentů souvisely s depresí, důstojností, postojem ke stárnutí, strachem z pádů, bolestí, soběstačností v ADL a sociálním zapojením.
Při vstupním hodnocení (první fáze výzkumu) se prokázalo se, že důstojnost patří mezi faktory ovlivňující kvalitu života. Dále se potvrdilo, že deprese byla jediným společným faktorem ovlivňujícím kvalitu života u pacientů s demencí i bez demence. Odpovídá to dřívějším zjištěním, že závažnost deprese negativně ovlivňuje kvalitu života [18]. Včasná diagnostika a léčba deprese je proto klíčovou klinickou prioritou pro zlepšení kvality života seniorů. Důstojnost a postoje ke stárnutí ovlivňovaly kvalitu života pouze u pacientů s demencí. Důstojnost jako vícerozměrný konstrukt zahrnuje vnímání, poznání a emoce související jak s pocitem vlastní hodnoty a sebeúcty, tak i s respektem a úctou, kterou jedinci projevují ostatní. Pacienti v počáteční fázi demence si uvědomují zhoršování svých kognitivních schopností, vnímají je často jako stigma, které snižuje jejich sebeúctu [15] a s ní související osobní důstojnost, což se negativně odráží v jejich hodnocení kvality života. Průkaz, že důstojnost je významným faktorem ovlivňujícím kvalitu života u seniorů s demencí žijících v domácím prostředí, nebyl dosud v jiných studiích uveden. Rovněž negativní postoj ke stárnutí bývá u seniorů v počátečním stadiu demence spojen s uvědoměním si postupného poklesu kognitivních schopností [35], které pak významně zhoršuje kvalitu života. U pacientů s demencí kvalitu života dále ovlivňovala míra soběstačnosti v ADL, podobně jako u dalších autorů [36,37]. Vztah mezi intenzitou bolesti a kvalitou života se potvrdil pouze u pacientů bez demence. Může to souviset s horší schopností pacientů s demencí hodnotit bolest, která je často ovlivněna narušenou komunikací nebo problémy s krátkodobou pamětí [38]. Sociální zapojení (frekvence účasti na společenských aktivitách a telefonický kontakt s příbuznými a přáteli) ovlivňovalo kvalitu života pouze u pacientů bez demence. Odpovídá to výsledkům dřívější studie, ve které se uvádí, že nízká frekvence sociálních vztahů je spojena s poklesem kvality života seniorů [39].
Po 24 měsících došlo k výraznému zhoršení kvality života pouze u pacientů s demencí. Prediktory této změny byly mužské pohlaví, úroveň soběstačnosti v ADL a míra sociálního zapojení (proměnné: žije sám, doba strávená během dne o samotě a frekvence návštěv). Sociální vztahy a společenské aktivity tvoří hlavní zdroj osobní subjektivní pohody, která zahrnuje jak pozitivní hodnocení současné situace, tak rovnováhu pozitivních a negativních emocí u pacientů s demencí [39]. Rovněž Verloo et al uvádějí, že častější návštěvy přátel a členů rodiny mají pozitivní vliv na kvalitu života pacientů s demencí [40]. Na rozdíl od naší studie Ydstebø et al [36] potvrdili u pacientů s demencí pouze malé snížení kvality života pacientů po 18 měsících. Rozdíl lze vysvětlit větší heterogenitou výzkumného souboru ve vztahu k věku, kognitivnímu i funkčnímu omezení než v naší studii. Vzhledem k vysoce subjektivní povaze kvality života je také možné, že obecně pozitivní nebo negativní vnímání života některých jedinců mělo na hodnocení kvality života silnější vliv než demence.
Je třeba zmínit i několik limitací naší studie. Zaprvé, pacienti s demencí byli zařazeni bez rozlišení jednotlivých typů demence, u kterých by mohly být rozdílné faktory ovlivňující kvalitu života. Zadruhé, skupina respondentů se skládala pouze ze seniorů žijících v domácím prostředí, proto výsledky nelze zobecnit na celou seniorskou populaci. Zatřetí, při výzkumu nebyly sledovány další faktory, které by mohly mít také dopad na hodnocení kvality života, jako např. léčba depresivních projevů, ekonomické zajištění seniora nebo komorbidita.
Závěr
Výsledky naší studie ukázaly, že deprese byla společným faktorem, který ovlivňoval při vstupním hodnocení (první fáze projektu) kvalitu života u pacientů s demencí, i bez demence. U pacientů s demencí byla vyšší kvalita života dále spojena s pozitivnějším hodnocením důstojnosti. Potvrdilo se tak, že důstojnost patří mezi faktory ovlivňující kvalitu života. Dalšími faktory, které ovlivňovaly kvalitu života u seniorů s demencí tak byly postoje ke stárnutí a vyšší stupeň soběstačnosti. Pacienti bez demence měli lepší kvalitu života spojenou s menším strachem z pádů, nižší intenzitou bolesti, ženským pohlavím, častější účastí na společenských akcích a vyšší frekvencí telefonních kontaktů.
Velikost změny kvality života po 24 měsících u seniorů s demencí ovlivňovaly mužské pohlaví, doba strávená denně o samotě, život bez partnera (žije sám), frekvence návštěv a úroveň kvality života a soběstačnosti při prvním měření. Výsledky tak potvrzují zásadní význam sociálních vztahů a společenského zapojení pro udržení kvality života v dlouhodobější perspektivě u seniorů v počátečním stadiu demence. Naše zjištění mohou být užitečná při plánování komunitních strategií pro seniory s demencí jak na národní, tak na mezinárodní úrovni.
Etické principy
Studie byla provedena ve shodě s Helsinskou deklarací z roku 1975 (a jejími revizemi z let 2004 a 2008). Studie byla schválena Etickou komisí Fakulty zdravotnických věd Univerzity Palackého v Olomouci (UPOL-85361 / 1040-2015). Všichni respondenti podepsali informovaný souhlas s účastí ve studii. Studie byla registrována před zařazením prvního pacienta na: www.clinicaltrials.gov (Identified: NCT0284583).
Grantová podpora
Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. 16-28628A. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
doc. PhDr. Helena Kisvetrová, Ph.D.
Centrum vědy a výzkumu
Fakulta zdravotnických věd UP v Olomouci
Hněvotínská 3
775 15 Olomouc
e-mail: helena.kisvetrova@upol.cz
Přijato k recenzi: 18. 12. 2019
Přijato do tisku: 2. 4. 2020
Sources
1. Alzheimer’s Disease International (ADI). World Alzheimer Report 2016. Improving healthcare for people living with dementia. Available from URL: https: //www.alz.co.uk/research/WorldAlzheimerReport2016.pdf.
2. Alzheimer’s Disease International (ADI). World Alzheimer Report 2018. Available from URL: https: //www.alz.co.uk/research/WorldAlzheimerReport2018.pdf.
3. Barbe C, Morrone I, Wolak-Thierry A et al. Impact of functional alterations on quality of life in patients with Alzheimer’s disease. Aging Ment Health 2017; 21 (5): 571–576. doi: 10.1080/13607863.2015.1132674.
4. Bartoš A. Dvě původní české zkoušky k vyšetření paměti za tři minuty – Amnesia Light and Brief Assessment (ALBA). Cesk Slov Neurol N 2019; 82/115 (4): 420–429. doi: 10.14735/amcsnn2019420.
5. Rodakowski J, Skidmore ER, Reynolds CF et al. Can performance on daily activities discriminate between older adults with normal cognitive function and those with mild cognitive impairment? J Am Geriatr Soc 2014; 62 (7): 1347–1352. doi: 10.1111/jgs.12878.
6. Moniz-Cook E, Vernooij-Dassen M, Woods R et al.A European consensus on outcome measures for psychosocial intervention research in dementia care. Aging Ment Health 2008; 12 (1): 14–29. doi: 10.1080/ 13607860801919850.
7. WHO. The World Health Organization quality of life assessment (WHOQOL): position paper from the World Health Organization. Soc Sci Med 1995; 41 (10): 1403–1409.
8. Goyal AR, Bergh S, Engedal K et al. Trajectories of quality of life and their association with anxiety in people with dementia in nursing homes: a 12-month follow-up study. PLoS One 2018; 13 (9): e0203773. doi: 10.1371/journal.pone.0203773.
9. van de Beek M, van Steenoven I, Ramakers IH et al. Trajectories and determinants of quality of life in dementia with Lewy bodies and Alzheimer‘s disease. J Alzheimers Dis 2019; 70 (2): 389–397. doi: 10.3233/JAD-190041.
10. Joanovič E, Kisvetrová H, Nemček D et al. Gender differences in improvement of older-person-specific quality of life after hearing-aid fitting. Disabil Health J 2019; 12 (2): 209–213. doi: 10.1016/j.dhjo.2018.08.010.
11. Kožený J, Tišanská L, Bednařík J et al. A Rasch analysis of the Q-LES-Q-SF questionnaire in a cohort of patients with neuropathic pain. Cesk Slov Neurol N 2019; 82/115 (1): 60–67. doi: 10.14735/amcsnn201960.
12. Giebel CM, Sutcliffe C, Challis D. Activities of daily living and quality of life across different stages of dementia: a UK study. Aging Ment Health 2015; 19 (1): 63–71. doi: 10.1080/13607863.2014.915920.
13. Uemura K, Shimada H, Makizako H et al. Effects of mild and global cognitive impairment on the prevalence of fear of falling in community-dwelling older adults. Maturitas 2014; 78 (1): 62–66. doi: 10.1016/j.maturitas.2014.02.018.
14. Moyle W, Kellett U, Ballantyne A et al. Dementia and loneliness: an Australian perspective. J Clin Nurs 2011; 20 (9–10): 1445–1453. doi: 10.1111/j.1365-2702.2010.03549.
15. Burgener SC, Buckwalter K, Perkhounkova Y et al. The effects of perceived stigma on quality of life outcomes in persons with early-stage dementia: Ipongitudinal findings: part 2. Dementia (London) 2015; 14 (5): 609–632. doi: 10.1177/1471301213504202.
16. Tan E, Visvanathan R, Hilmer S et at. Analgesic use, pain and daytime sedation in people with and without dementia in aged care facilities: a cross-sectional, multisite, epidemiological study protocol. BMJ Open 2014; 4 (6): e005757. doi: 10.1136/bmjopen-2014-005757.
17. Yamada Y, Merz L, Kisvetrova H. Quality of life and comorbidity among older home care clients: role of positive attitudes toward aging. Qual Life Res 2015; 24 (7): 1661–1667. doi: 10.1007/s11136-014-0899-x.
18. Gomez-Gallego M, Gomez-Amor J, Gomez-Garcıa J. Determinants of quality of life in Alzheimer’s disease perspective of patients, informal caregivers, and professional caregivers. Int Psychogeriatr 2012; 24 (11): 1805–1815. doi: 10.1017/S1041610212001081.
19. Gobbens R, Van Assen M. The prediction of quality of life by physical, psychological and social components of frailty in community-dwelling older people. Qual Life Res 2014; 23 (8): 2289–2300. doi: 10.1007/s11136-014-0672-1.
20. Logsdon R, Gibbons L, McCurry S et al. Quality of life in Alzheimer’s disease: patients’ and caregiver’s reports. J Ment Health Aging 1999; 5 (1): 21–32.
21. Kisvetrová H, Školoudík D, Herzig R et al. Psychometric validation of the czech version of the Quality of Life – Alzheimer‘s Disease Scale in patients with early-stage Dementia. Dement Geriatr Cogn Disord 2018; 46 (1–2): 109–118. doi: 10.1159/000492490.
22. Conradsson M, Rosendahl E, Littbrand H et al. Usefulness of the Geriatric Depression Scale 15-item version among very old people with and without cognitive impairment. Aging Ment Health 2013; 17 (5): 638–645. doi: 10.1080/13607863.2012.758231.
23. Chochinov HM, Hassard T, McClement S et al. The patient dignity inventory: a novel way of measuring dignity-related distress in palliative care. J Pain Symptom Manag 2008; 36 (6): 559–571. doi: 10.1016/j.jpainsymman.2007.12.018.
24. Kisvetrová H, Školoudík D, Danielová L et al. Czech version of the Patient Dignity Inventory: translation and validation in incurable patients. J Pain Symptom Manage 2018; 55 (2): 444–450. doi: 10.1016/j.jpainsymman.2017.10.008.
25. Johnston B, Lawton S, McCaw C et al. Living well with dementia: enhancing dignity and quality of life, using a novel intervention, Dignity Therapy. Int J Older People Nurs 2016; 11 (2): 107–120. doi: 10.1111/opn.12103.
26. Bartoš A, Martínek P, Řípová D. The Bristol Activities of Daily Living Scale BADL-CZ for the evaluation of patients with dementia. Cesk Slov Neurol N 2010; 73/106 (6): 673–677.
27. Berková M, Topinková E, Mádlová P et al. Krátká baterie pro testování fyzické zdatnosti seniorů – pilotní studie a validizace testu u starších osob v České republice. Vnitř Lék 2013; 59 (4): 256–263.
28. Pitkälä K, Pöysti M, Laakkonen M et al. Effects of the Finnish Alzheimer Disease Exercise Trial (FINALEX). A randomized controlled trial. JAMA Intern Med 2013; 173 (10): 894–901. doi: 10.1001/jamainternmed.2013.359.
29. Laidlaw K, Power M, Schmidt S. The Attitudes to Ageing Questionnaire (AAQ): development and psychometric properties. Int J Geriatr Psychiatry 2007; 22 (4): 367–379.
30. Trigg R, Jones RW, Skevington SM. Can people with mild to moderate dementia provide reliable answers about their quality of life? Age Ageing 2007; 36 (6): 663–669. doi: 10.1093/ageing/afm077.
31. Yardley L, Beyer N, Hauer K et al. Development and initial validation of the Falls Efficacy Scale International (FES-I). Age Ageing 2005; 34 (6): 614–619.
32. Reguli Z, Svobodová L. Česká verze diagnostiky strachu z pádů u seniorů – FES-I (Falls Efficacy Scale International) Czech version of the diagnosis of fear of falls in seniors – FES-I (Falls Efficacy Scale International). Studia sportiva 2011; 5 (2): 5 –12.
33. Kisvetrová H, Školoudík D, Herzig R et al. Psychometric properties of the Czech version of the Falls Efficacy Scale-International in patients with early-stage dementia. Dement Geriatr Cogn Dis Extra 2019; 29; 9 (2): 319–329. doi: 10.1159/000501676.
34. Pautex S, Herrmann F, Le Lous P et al. Feasibility and reliability of four pain self-assessment scales and correlation with an observational rating scale in hospitalized elderly demented patients. J Gerontol A Biol Sci Med Sci 2005; 60 (4): 524–529.
35. Siebert JS, Wahl HW, Degen C et al. Attitude toward own aging as a risk factor for cognitive disorder in old age: 12 - year evidence from the ILSE study. Psychol Aging 2018; 33 (3): 461–472. doi: 10.1037/pag0000252.
36. Ydstebø AE, Bergh S, Selbæk G et al. Longitudinal changes in quality of life among elderly people with and without dementia. Int Psychogeriatr 2018; 30 (11): 1607–1618. doi: 10.1017/S1041610218000352.
37. Conde-Sala JL, Turro-Garriga O, Portellano-Ortiz C et al. Self Perceived quality of life among patients with Alzheimer’s disease: two longitudinal models of analysis. J Alzheimers Dis 2016; 52 (3): 999–1012. doi: 10.3233/jad-160040.
38. Jensen-Dahm C, Werner MU, Dahl JB et al. Quantitative sensory testing and pain tolerance in patients with mild to moderate Alzheimer disease compared to healthy control subjects. Pain 2014; 155 (8): 1439–1445. doi: 10.1016/j.pain.2013.12.031.
39. de Belvis AG, Avolio M, Spagnolo A et al. Factors associated with health-related quality of life: the role of social relationships among the elderly in an Italian region. Public Health 2008; 122 (8): 784–793. doi: 10.1016/j.puhe.2007.08.018.
40. Verloo H, Salina A, Fiorentino A et al. Factors influencing the quality of life perceptions of cognitively impaired older adults in a nursing home and their informal and professional caregivers: a mixed methods study. Clin Interv Aging 2018; 13 : 2135–2147. doi: 10.2147/CIA.S184329.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2020 Issue 3
- Memantine Eases Daily Life for Patients and Caregivers
- Possibilities of Using Metamizole in the Treatment of Acute Primary Headaches
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Advances in the Treatment of Myasthenia Gravis on the Horizon
-
All articles in this issue
- Primární progresivní afázie
- Jsme na dosah cílené terapie Huntingtonovy nemoci? ANO
- Jsme na dosah cílené terapie Huntingtonovy nemoci? NE
- Je cielená terapia Huntingtonovej choroby na dosah?
- Kognitivní poruchy u dětí s epilepsií
- Autoimunitní encefalitidy s negativitou neurálních protilátek – klinické charakteristiky a možnosti detekce protilátek
- APOE a BDNF jako rizikové genetické markery pro predikci nástupu a rozvoje kognitivního deficitu při Alzheimerově nemoci
- Význam nových laboratorních technik v diagnostice Niemann-Pickovy choroby typu C
- Bolesti hlavy v graviditě
- Výskyt a rizikové faktory neprovokovaných epileptických záchvatů u pacientů po ischemické cévní mozkové příhodě
- Validace dotazníku pro hodnocení dysfagie u pacientů s roztroušenou sklerózou – česká verze DYMUS
- Význam neuropaliativní péče pro zlepšení kvality života pacientů s progresivním neurologickým onemocněním – intervenční studie
- Charakteristika souboru chlapců s Duchennovou a Beckerovou svalovou dystrofií – studie z jednoho nervosvalového centra
- Epidurální aplikace kortikoidů 2. část – Kvalita života pacientů před aplikací
- Glioblastom grade IV – dlouhodobé přežití
- Stanovisko redakční rady k diskuzi o úrovni a směřování Cesk Slov Neurol N
- Erratum
- Informace vedoucího redaktora
- Recenze
- Vliv demence na trajektorie kvality života seniorů
- Metabolomika cerebrospinálneho likvoru pomocou magnetickej rezonančnej spektroskopie u pacientov so sclerosis multiplex, s klinicky izolovaným syndrómom, inými zápalovými ochoreniami mozgu a u zdravých kontrol
- Fokální epileptický záchvat u mladé ženy z Jižní Korey
- Czech and Slovak Neurology and Neurosurgery
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Glioblastom grade IV – dlouhodobé přežití
- Primární progresivní afázie
- Bolesti hlavy v graviditě
- Kognitivní poruchy u dětí s epilepsií
