Srovnání měření průtokových parametrů v oblastikarotické stenózy in vivo a in vitro – pilotní výsledky testování hemodynamického fantomu
Comparison of in vivo and in vitro measurements of flow parameters in carotid stenosis – pilot results of hemodynamic phantom testing
Aim: Atherosclerotic carotid artery disease is one of the most common causes of ischemic stroke. As the study of the progression and development of instability of atherosclerotic plaques in vivo is limited, data from in vitro studies can be used to clarify these processes. For these reasons, the authors constructed a hemodynamic model with the possibility of inserting the atherosclerotic plaque removed during carotid endarterectomy for the study of hemodynamics in the carotid bifurcation. The aim of the study was to determine whether it is possible to simulate flow parameters in the area of carotid bifurcation stenosis in the hemodynamic model comparable to the in vivo state before performing carotid endarterectomy. Intact atherosclerotic plaque was removed from the carotid artery during endarterectomy and inserted into a hemodynamic model.
Methods: The study included 13 patients with carotid stenosis ≥ 50% indicated for carotid endarterectomy. The atherosclerotic plaques were removed from the carotid artery during carotid endarterectomy and inserted into the hemodynamic model.
Results: The mean differences in the measured maximum and end-diastolic velocities in the area of stenosis in vivo before carotid endarterectomy and in vitro in the hemodynamic model after insertion of the removed atherosclerotic plaque were 18.9 cm/s (7.0%) and 8.2 cm/s (11.1%), respectively.
Conclusion: The study confirmed the functionality of the hemodynamic model and its possible use for studying the hemodynamic changes in carotid stenosis area.
Keywords:
carotid artery – Hemodynamics – model – endarterectomy – Atherosclerosis – plaque
Authors:
D. Školoudík 1,2,3; T. Hrbáč; R. Matejka 4,5; S. Forostyak 4; J. Hofmanová 4; D. Netuka 6; P. Kešnerová 7; T. Belšan 8; A. Školoudík 9
Authors‘ workplace:
Centrum vědy a výzkumu, Fakulta zdravotnických věd, UPOL, Olomouc
1; Neurochirurgická klinika FN Ostrava
2; Centrum zdravotnického výzkumu, LF OU, Ostrava
3; PrimeCell Bioscience Inc., Ostrava
4; Katedra biomedicínské techniky, Fakulta biomedicínského inženýrství, ČVUT v Praze, Kladno
5; Neurochirurgická klinika ÚVN – VFN Praha
6; Neurologická klinika, 2. LF UK a FN Motol, Praha
7; Radiologická klinika ÚVN – VFN Praha
8; Matiční gymnázium, Ostrava
9
Published in:
Cesk Slov Neurol N 2020; 83/116(6): 627-632
Category:
Original Paper
doi:
https://doi.org/10.48095/cccsnn2020627
Overview
Cíl: Aterosklerotické postižení karotických tepen patří k nejčastějším příčinám ischemické CMP. Jelikož je studium progrese a vývoje nestability aterosklerotických plátů in vivo velmi limitováno, lze k objasnění těchto procesů využít data ze studií in vitro. Z těchto důvodů autoři sestrojili hemodynamický model s možností vložení aterosklerotického plátu vyjmutého během karotické endarterektomie pro studium hemodynamiky v oblasti karotické bifurkace. Cílem studie bylo zjistit, zda lze v hemodynamickém modelu nasimulovat průtokové parametry v oblasti stenózy karotické bifurkace srovnatelné se stavem in vivo před provedením karotické endarterektomie.
Metody: Do studie bylo zařazeno 13 pacientů se stenózou karotidy ≥ 50 % indikovaných ke karotické endaterektomii. Během endarterektomie byly vyjmuty v celku aterosklerotické pláty z karotické tepny a vloženy do hemodynamického modelu.
Výsledky: Průměrný rozdíl v naměřené průtokové rychlosti v oblasti stenózy in vivo před karotickou endarterektomií a in vitro v hemodynamickém modelu po vložení vyjmutého aterosklerotického plátu byl 18,9 cm/s u maximální systolické rychlosti, což odpovídá odchylce 7,0 %, a 8,2 cm/s u konečné diastolické rychlosti odpovídající odchylce 11,1 %.
Závěr: Studie potvrdila funkčnost hemodynamického modelu a jeho možné využití při studiu hemodynamických změn v oblasti karotické stenózy.
Klíčová slova:
karotida – hemodynamika – model – endarterektomie – ateroskleróza – plát
Úvod
Ateroskleróza a její následky, především akutní koronární syndrom a CMP, představují v posledních desetiletích hlavní příčinu morbidity, mortality a invalidity ve vyspělých zemích [1]. CMP přitom zaujímá třetí místo na žebříčku příčin úmrtí a je celosvětově hlavní příčinou dlouhodobé neschopnosti. Je také druhou nejběžnější příčinou demence, nejčastější příčinou epilepsie a častou příčinou deprese u starších lidí [2].
Ischemická CMP patří v celosvětovém měřítku mezi nejběžnější typ CMP [3], přičemž jednou z hlavních příčin ischemické CMP je aterosklerotické postižení tepen, a to především v oblasti karotické bifurkace [4]. Aterosklerotický plát způsobuje zúžení tepny a postupně se s růstem plátu a nárůstem stenózy tepny zvyšuje riziko trombembolie do mozkových tepen [4–6]. Distální úsek společné karotidy (arteria carotis communis; ACC), bifurkace a proximální část vnitřní karotidy (arteria carotis interna; ACI) představují nejběžnější oblasti pro vznik aterosklerotické léze a stenózy, a to z důvodů zvýšeného namáhání epitelu na stěnách arterií v důsledku turbulentního toku v oblasti bifurkace a rozšíření v oblasti karotického bulbu [7]. Přes intenzivní výzkum v posledních letech však stále není proces růstu aterosklerotických plátů a následné nestability s trombembolizací plně objasněn [5,6,8].
Mnoho studií v posledních desetiletích prokázalo nárůst rizika CMP s nárůstem procenta stenózy karotické tepny [5,7,9]. Nicméně pouhé zhodnocení procenta stenózy není v současnosti dostatečné ke stanovení ročního rizika CMP, které se může pohybovat u daného procenta stenózy mezi 0,2 a 20,0 % [10]. Z těchto důvodů se začíná věnovat stále větší pozornost dalším parametrům, jako morfologii aterosklerotického plátu a hemodynamickým charakteristikám v oblasti stenózy, které by mohly výrazněji zpřesnit predikci rizika CMP.
Aterosklerotické pláty a hemodynamické změny v dané oblasti lze zobrazit a sledovat pomocí invazivních (klasická a DSA), semiinvazivních (CT a CTA, MR a kontrastní MRA vyšetření, PET, intravaskulární UZ vyšetření) i neinvazivních vyšetřovacích metod (duplexní sonografie, MR) [5]. Relativně stále vysoká cena vyšetření, nemožnost kontinuálního monitorování vývoje plátů v řádů měsíců a let, relativně malá rozlišovací schopnost vzhledem k velikosti buněk a struktur aterosklerotických plátů, obtížnost 3D hodnocení a potenciální artefakty při vyšetření jsou významnými limitacemi pro získání komplexních informací o dynamice změn v aterosklerotických plátech [5]. Některé z těchto limitací lze eliminovat při studiu aterosklerotických plátů in vitro.
Cílem studie bylo ověřit možnost měření hemodynamických parametrů v hemodynamickém modelu karotické bifurkace a srovnat měřené parametry s měřením in vivo u pacientů s hemodynamicky významnou stenózou v oblasti karotické bifurkace indikovanou ke karotické endarterektomii.
Materiál a metodika
Pacienti
Do studie byli zařazeni pacienti sledovaní v rámci studie ANTIQUE (Atherosclerotic Plaque Characteristics Associated with a Progression Rate of the Plaque and a Risk of Stroke in Patients with the Carotid Bifurcation Plaque Study – ClinicalTrials.gov Identifier: NCT02360137), u kterých byla při vyšetření UZ detekována stenóza v oblasti karotické bifurkace ≥ 50 % a pacienti byli indikováni dle platných kritérií [11,12] ke karotické endarterektomii. Dalšími vstupními kritérii byly věk 30–90 let, soběstačnost (modifikované Rankinovo skóre [mRS] 0–2) a podpis Informovaného souhlasu. Vylučovacími kritérii byly nedostatečné zobrazení lumina tepny v oblasti stenózy (především při kalcifikacích v oblasti plátu) a srdeční arytmie typu fibrilace nebo flutteru síní výrazně ovlivňující tok v karotické bifurkaci.
Klinické vyšetření
U všech pacientů byly provedeny standardní neurologické a fyzikální vyšetření vč. měření krevního tlaku (jedno měření v klidu po sonografickém vyšetření), měření výšky a hmotnosti (s výpočtem indexu tělesné hmotnosti [body mass index; BMI]) a zhodnocení neurologického stavu pomocí škály National Institutes of Health Stroke Scale (NIHSS) a soběstačnosti pomocí mRS. U všech pacientů byly zaznamenány také anamnestické údaje se zaměřením na vaskulární rizikové faktory a užívané léky.
Ultrazvukové vyšetření in vivo
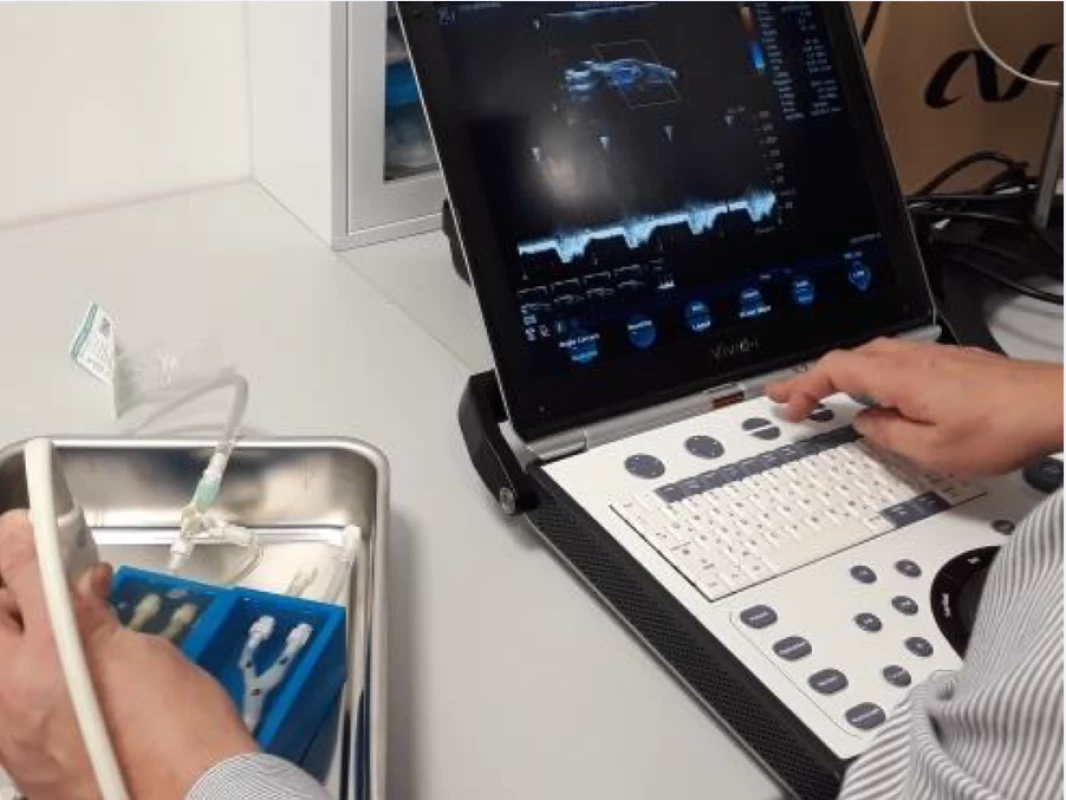
Všichni pacienti absolvovali duplexní sonografické vyšetření krčních a mozkových tepen se zobrazením aterosklerotických plátů v karotických tepnách v B-obraze v podélném a příčném řezu. V oblasti stenózy nad 50 % byly změřeny rozměry plátů (šířka, délka), šířka reziduálního lumina, šířka tepny v místě stenózy a šířka tepny za stenózou. Na straně karotické stenózy byly v dopplerovském modu zobrazeny průtokové křivky se změřením průtokových rychlostí (maximální systolické rychlosti [peak systolic velocity; PSV], konečné diastolické rychlosti [end-diastolic velocity; EDV] a střední průtokové rychlosti [Vmean]) před stenózou v ACC, ve stenóze (v oblasti karotické bifurkace a odstupu ACI), za stenózou v ACI pod lebeční bazí a v a. carotis externa (ACE) (obr. 1). Hodnota průtokových rychlostí byla získaná zprůměrováním měření během 4 srdečních cyklů. Zobrazení aterosklerotických plátů a jednotlivá měření byly uloženy ve formátu jpg a videosekvence ve formátu avi.
Fig. 1. Duplex sonography – measurement
of fl ow velocities in internal carotid artery
origin stenosis in vivo.
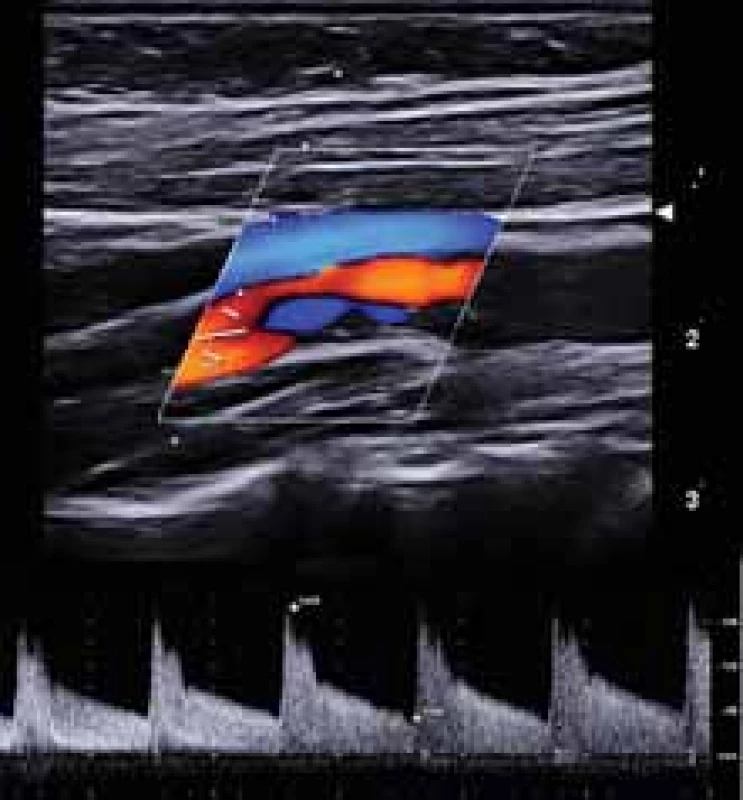
Neurosonologické vyšetření bylo provedeno u všech pacientů za standardních podmínek v tiché temné místnosti vleže na zádech. Pacienti byli instruováni, aby minimálně 48 h před vyšetřením nepili alkohol a nekouřili. K vyšetření byl použit duplexní sonografický stroj Mindray DC8 (Mindray, Shenzen, Čína). Karotické tepny byly vyšetřovány pomocí lineární sondy 3–12 MHz (L12-3E), průtokové rychlosti ve středním úseku ACI pod lebeční bazí byly měřeny pomocí duplexní transkraniální sondy 1–5 MHz (SP5-1e) v hloubce 40–50 mm. Stupeň karotické stenózy byl hodnocen podle dříve publikovaných kritérií [18]. Všechna sonografická vyšetření byla provedena zkušeným certifikovaným neurosonografistou.
Vyšetření CT a CTA
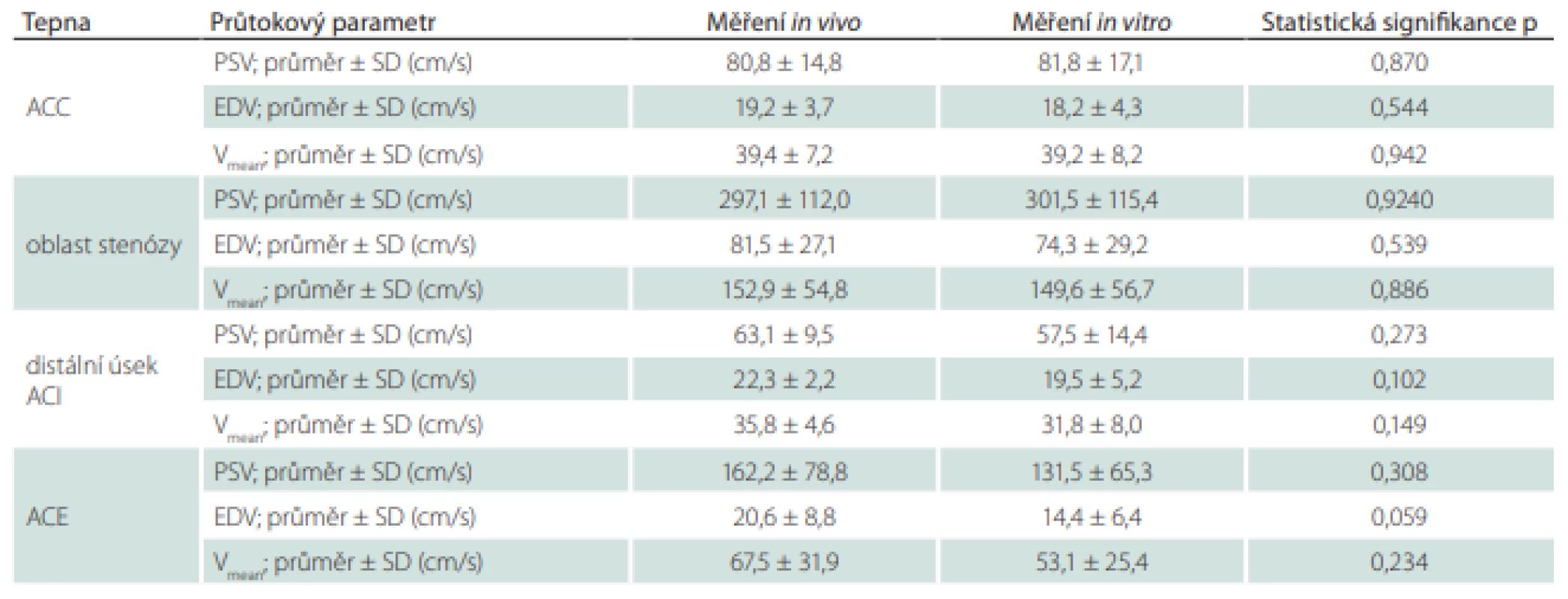
U všech pacientů bylo před karotickou endarterektomií provedeno standardní vyšetření CTA na CT přístroji Siemens Somatom Sensation 16 (Siemens Healthcare, Forchheim, Německo) s intravenózní aplikací jodové kontrastní látky (Iomeron 400, Bracco Imaging, Milán, Itálie) v dávce 50–100 ml podle hmotnosti pacienta, a to automatizovaným injektorem prostřednictvím 20G kanyly v kubitální žíle. CT skeny u všech pacientů standardně pokrývaly oblast od kraniálního oblouku aorty až nad Willisův kruh. Surová data byla uložena jako 1mm multiplanární rekonstrukce. Rekonstrukce projekcí maximální intenzity (MIP) byly pro vizuální analýzu vypočítány radiologem. Ze skenů CTA byla následně provedena 3D rekonstrukce reziduálního lumina karotických tepen (ACC, ACI a ACE) a 3D rekonstrukce stěny karotických tepen (ACC, ACI a ACE) pro následný tisk cévního řečiště.
3D tisk cévního řečiště
Ze sady transverzálních řezů snímků CTA byly vybrány snímky z oblasti 4 cm kraniálně a 4 cm distálně od karotické bifurkace, které byly s odpovídajícími vzdálenostmi vloženy do programu Blender 2.90.1 (Blender Foundation, Amsterdam, Nizozemsko). V každém snímku byla manuálně označena stěna vnitřní a zevní karotidy. Karotické řečiště bylo v oblasti karotické bifurkace rozděleno na 2 části pro možnost vložení aterosklerotického plátu do vytištěného 3D modelu. Následně byla vytvořena 3D rekonstrukce karotického řečiště a data byla přesunuta do programu pro 3D tiskárny Ultimaker Cura 4.7.1 (Ultimaker B.V., Utrecht, Nizozemsko). 3D model karotického řečiště byl vytištěn na 3D tiskárně Creality ENDER 3 (Shenzen Creality 3D Technology Co., Ltd., Schenzen, Čína) s použitím vlákna Gembird 3DP-TPE1.75-01-W (Gembird Software Ltd., Almere, Nizozemsko).
Karotická endarterektomie
Chirurgický zákrok byl proveden podle standardního protokolu [13] zkušeným neurochirurgem. Všichni pacienti byli během perioperačního období na dlouhodobé antiagregační léčbě bez přerušení. U všech pacientů byla karotická endarkterektomie prováděna bez zavedení shuntu. Minimálně 3 min před zastavením toku v karotické tepně byla podána dávka 5 000 IU nefrakcionovaného heparinu (Heparin Léčiva, Zentiva, k.s., Praha, ČR) bez vyvázání na konci operačního výkonu. Po naříznutí stěny (adventicie) karotické tepny byl u všech pacientů vyjmut aterosklerotický plát z oblasti stenózy v karotické bifurkaci a proximální části ACI z tepny bez poškození, a to vcelku jako 1 blok. Operace byla provedena s pomocí 3D mikroskopu s monitorováním průtoků v ipsilaterální a. cerebri media pomocí kontinuální transkraniální dopplerometrie. Aterosklerotický plát byl po vyjmutí vložen do perfúzního roztoku (Custodiol, Dr. Franz Köhler Chemie GMbH, Bensheim, Německo) a zchlazen na 4 °C.
Hemodynamický model
Pro testování hemodynamických parametrů v oblasti karotické bifurkace byla vytvořena sestava fantomu, skládajícího se z výše zmíněných 3D tisknutých anatomických modelů karotického povodí, do kterých byly vloženy explantované aterosklerotické pláty (obr. 2), dále z držáku anatomických modelů se simulovanými akusticko-impedančními parametry pro UZ měření a ze simulátoru pulzní průtokové vlny.
Fig. 2. Insertion of the atherosclerotic plaque removed during carotid endarterectomy
into the printed 3D model of carotid bifurcation.
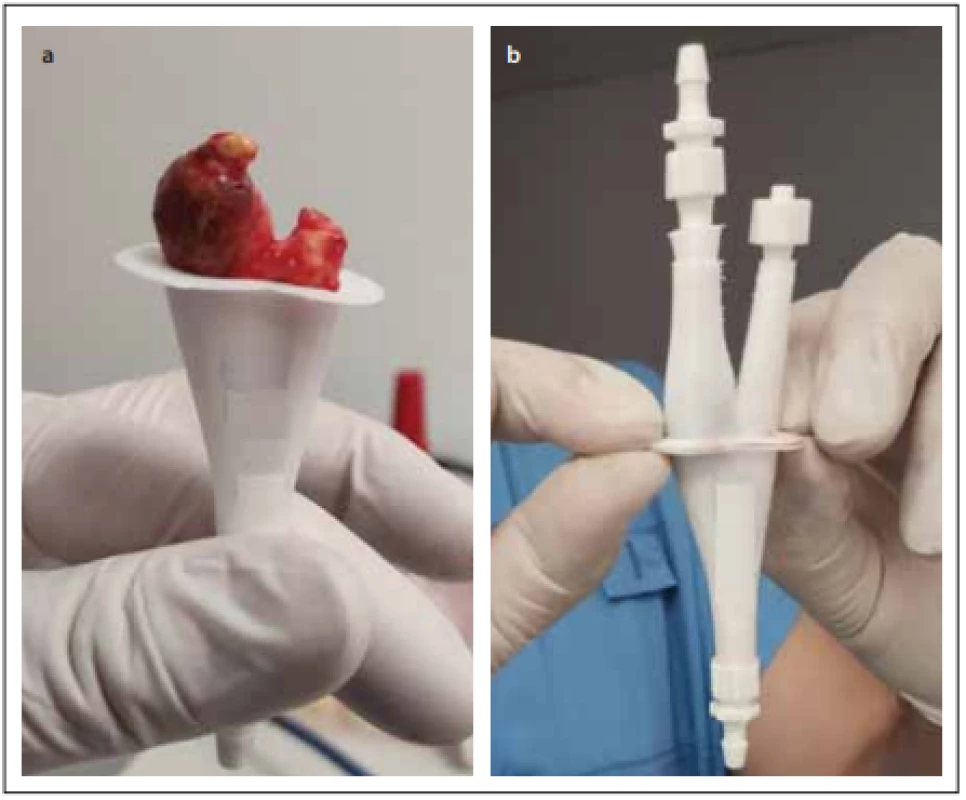
Každý tištěný karotický model byl při tisku příčně rozdělen na 2 části v oblasti karotické bifurkace tak, aby bylo možno do modelu vložit příslušný vyjmutý aterosklerotický plát (obr. 2). Ke spojení obou částí modelu karotického řečiště s fixací plátu v příslušném místě bylo použito kyanoakrylátové lepidlo. Tyto modely karotického povodí s vloženým aterosklerotickým plátem byly uchyceny na hadicové trny s koncovkou typu Luer-Lock (CPC, Roseville, MN, USA) pomocí chirurgického hedvábí. Takto připravené modely karotid byly uchyceny do 3D tisknutého držáku s připojením ke generátoru pulzatilního proudění. Celý držák s modelem cévy byl pro zajištění akusticky vhodného prostředí naplněn perfúzním roztokem (Custodiol, Dr. Franz Köhler Chemie GMbH, Bensheim, Německo).
Pro generování definovaného průtoku s modulovanou průtočnou pulzatilní vlnou byla vytvořena sestava lineárního pístového čerpadla se speciálním ovládacím softwarem. Základem pro pístové čerpadlo byl modulární lineární aktuátor s uchycenou 50ml injekční stříkačkou. Technické řešení aktuátoru je popsáno v rámci užitného vzoru [14]. Tato sestava generátoru byla pomocí silikonových hadiček propojena s 3D tištěným modelem karotidy s vloženým aterosklerotickým plátem. Pro zvýšení akustického odrazu proudící kapaliny a lepší detekci pomocí dopplerovské sondy byla jako imitace krve použita suspenze mikročástic uhlíku.
Řízení systému bylo zajištěno pomocí průmyslového kontroleru myRIO-1950 s vlastním ovládacím softwarem v LabVIEW (obojí National Instruments, Austin, TX, USA). Tento navržený ovládací software umožnuje plynulé nastavení parametrů průtočné křivky v 5 bodech (amplituda a relativní čas trvání každého bodu), mezi kterými je lineárně interpolováno nastavení pro řízení servopohonu na lineárním aktuátoru. Funkčnost modelu byla ověřena pomocí ultrazvukového vyšetření v B-obraze, barevném a dopplerovském modu. Nastavení jednotlivých bodů křivky bylo optimalizováno na základě změřených pacientských dat a korelace s testovacím ultrazvukovým měřením. Optimalizace byla provedena jak z hlediska tvaru křivky (strmost náběžných a sestupných hran), tak z hlediska periody opakování simulující tepovou frekvenci a také z hlediska rychlostního profilu měřeného pomocí dopplerovského režimu.
Ultrazvukové vyšetření v hemodynamickém fantomu
Aterosklerotický plát, extrahovaný v průběhu karotické endarterektomie, byl vložen do hemodynamického fantomu (obr. 2) do 30 min od vyjmutí. Vyšetření UZ uměle vytvořeného karotického řečiště s vloženým aterosklerotickým plátem bylo provedeno nejdříve v B-obraze v podélném a příčném řezu. Po optimalizaci průtokové křivky byly v dopplerovském modu zobrazeny průtokové křivky se změřením průtokových rychlostí (PSV, EDV a Vmean) před stenózou v ACC, ve stenóze (v oblasti karotické bifurkace a odstupu ACI), 4 cm za stenózou v ACI a v odstupu ACE (obr. 3). Hodnota průtokových rychlostí byla získaná zprůměrováním měření během 4 průtokových cyklů. Zobrazení aterosklerotických plátů a jednotlivá měření byly uloženy ve formátu jpg a videosekvence ve formátu avi. Všechna sonografická vyšetření byla provedena zkušeným certifikovaným neurosonografistou pomocí duplexního sonografického přístroje Mindray DC8 (Mindray, Shenzen, Čína) a lineární sondy 3–12 MHz (L12-3E).
Fig. 3. Duplex sonography – measurement of fl ow velocities in internal carotid
artery origin stenosis in vitro in a hemodynamic model.
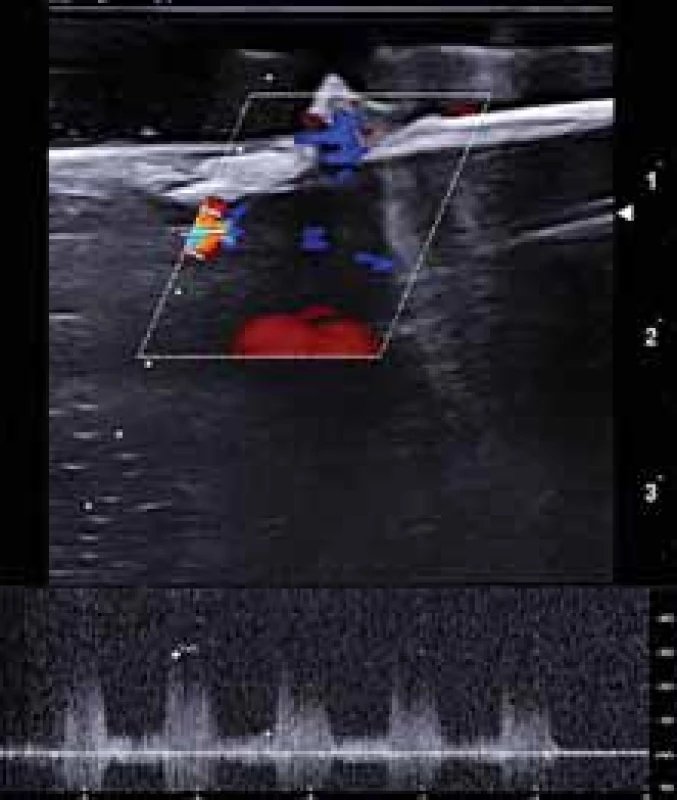
Po ukončení měření byly aterosklerotické pláty vyjmuty z 3D modelu karotických tepen, fixovány v roztoku formaldehydu a následně zpracovány pro histologické vyšetření.
Statistická analýza
Odhad minimální velikosti vzorku byl vypočten pro odhalení signifikantního rozdílu 20 % mezi naměřenými průtokovými rychlostmi in vivo a in vitro s hladinou významnosti alfa = 5 % a sílou beta = 80 %. Statistické výpočty určily, že nutná minimální velikost vzorku je 13 pacientů. Normalita rozložení dat byla testována pomocí Shapir-Wilkova testu. Demografické údaje jsou vyjádřeny jako průměr a směrodatná odchylka nebo jako číselná hodnota a procento. Pro statistické zhodnocení rozdílu mezi naměřenými průtokovými rychlostmi byl použit párový Studentův t-test. Všechny statistické testy byly provedeny na hladině významnosti p ≤ 0,05. Pro veškeré zpracování dat byl použit statistický software IBM SPSS Statistics 22 (SPSS, Chicago, IL, USA).
Výsledky
Do studie bylo během 4 měsíců zařazeno 13 pacientů (6 mužů; průměrný věk 67,3 ± 9,9 let) se stenózou karotické tepny ≥ 50 %, kteří byli indikovaní ke karotické endarterektomii. U 7 pacientů se jednalo o symptomatickou stenózu, u 6 pacientů byla stenóza asymptomatická. Demografická data pacientů jsou uvedena v tab. 1. Průměrná tíže stenózy byla 70,8 ± 9,4 %, procento stenózy se pohybovalo mezi 60 a 90 %. Čtyři stenózy byly tvořeny hypoechogenním měkkým plátem, u 2 pacientů byly pláty kalcifikované, u 7 pacientů se jednalo o heterogenní pláty. U 2 pacientů byl povrch plátu hladký, u 5 nerovný a u 6 pacientů byl plát exulcerovaný.
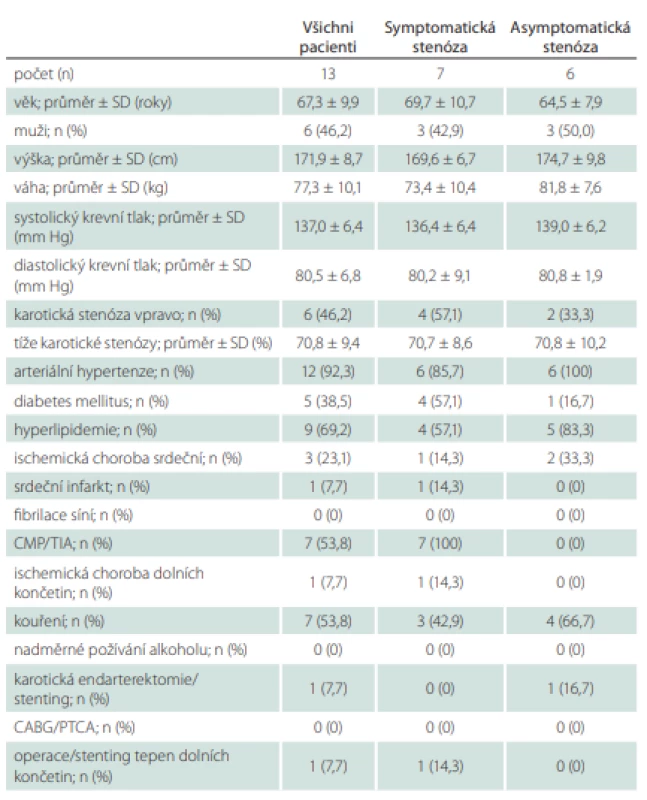
U všech pacientů bylo úspěšně provedeno ultrazvukové vyšetření karotických tepen se zobrazením aterosklerotického plátu v oblasti stenózy v B-obraze a změřením průtokových rychlostí v jednotlivých segmentech karotických tepen jak in vivo před operací, tak i in vitro v hemodynamickém modelu po vložení vyjmutého aterosklerotického plátu do 3D vytištěného karotického řečiště. Výsledky měření in vivo a in vitro jsou uvedeny v tab. 2. V žádném z měřených hemodynamických parametrů nebyly zjištěny statisticky signifikantní rozdíly mezi měřením in vivo a in vitro (tab. 2). Průměrná odchylka v naměřené PSV v oblasti stenózy byla 18,9 cm/s, což odpovídá odchylce 7 %. U EDV byla v oblasti stenózy průměrná odchylka měření 8,2 cm/s odpovídající odchylce 11,1 %.
Diskuze
Výsledky naší studie ukázaly, že v sestaveném hemodynamickém fantomu je možné dobře simulovat charakteristiky průtoku tekutiny v oblasti karotické stenózy způsobené aterosklerotickým plátem. UZ naměřené průtokové charakteristiky v hemodynamickém modelu byly srovnatelné se stavem in vivo před karotickou endarterektomií. Průměrná odchylka v naměřené PSV v oblasti stenózy byla pouze 7 %, u EDV 11 %.
Ateroskleróza je chronické degenerativně-zánětlivé onemocněni postihující cévní systém ukládáním tukových části do stěn tepen lidského organizmu s následným vznikem ateromů. Tento patologický proces obvykle začíná již v mládí a ve středním a vyšším věku postihuje většinu populace [15]. Přes intenzivní výzkum však etiopatogeneze aterosklerotického postižení tepen není zcela přesně objasněna. Především v procesu změny stabilního aterosklerotického plátu na nestabilní s následným vznikem trombu anebo embolizace do distálního řečiště je stále mnoho nejasností [5–7,16].
Proces vývoje aterosklerotického plátu lze studovat in vivo pomocí neinvazivních (např. duplexní sonografie, CT, MR), semiinvazivních (např. CTA, kontrastní MR, kontrastní duplexní sonografie, PET) nebo invazivních metod (např. intravaskulární UZ, mikrooptická koherenční tomografie, blízká infračervená spektroskopie). Nevýhodou semiinvazivních a invazivních metod, podobně jako u histologického vyšetření, je nemožnost kontinuálního sledování vývoje procesu s velmi limitovanou možností opakování daného vyšetření v čase. U neivazivních metod je sice jednodušší provádět opakované vyšetření v časových rozestupech, avšak kontinuální monitorování vývoje aterosklerotického plátu po dobu týdnů či měsíců je stále nemožné [5]. Z těchto důvodů můžeme zatím v predikci rizika vzniku nestabilního plátu a následné cévní příhody využít jen výsledky z jednorázového, výjimečně několikrát opakovaného vyšetření.
Mezi studované rizikové faktory progrese aterosklerotického postižení tepen patří různé nemoci, resp. patologické procesy v lidském organizmu (především arteriální hypertenze, diabetes mellitus, hyperlipidemie, zánět), faktory životního stylu a životního prostředí (především nedostatečný pohyb, nevhodná strava, obezita, kouření, znečištění vzduchu, stres) a také abnormní hemodynamické síly v jednotlivých tepenných úsecích [2,17].
Ačkoli je přímé měření hemodynamických parametrů v lidských tepnách proveditelné, jedná se o invazivní výkon, který je spojen s nezanedbatelným rizikem embolizace do distálního řečiště [18,19]. Z těchto důvodů je snaha nahradit toto invazivní přímé měření matematickými modely, které pracují s daty z neinvazivních nebo semiinvazivních metod (CT, MR, vyšetření UZ) [20–24] nebo měřením v arteficiálních modelech [25,26]. Nicméně všechny tyto hemodynamické modely vytvářejí nejen cévní řečiště, ale také aterosklerotické hmoty tvořící stenózu tepny pomocí 3D tisku. Hlavní limitací těchto modelů je, že deformační vlastnosti vytištěné stenózy se liší od stavu in vivo, tedy deformačních vlastností aterosklerotických plátů. Tyto limitace jsme v námi sestrojeném hemodynamickém modelu překonali vložením reálného aterosklerotického plátu, který byl vyjmut vcelku z oblasti karotické bifurkace. Po úspěšném ověření funkčnosti a možnosti modelovat reálné průtokové tlaky a rychlosti v oblasti karotické stenózy jsou v další fázi projektu plánovaná přímá měření průtokových charakteristik pomocí čidel umístěných v modelu. Sestrojený hemodynamický model umožňuje srovnání přímo měřených průtokových parametrů s měřením hemodynamických parametrů pomocí neinvazivních metod, např. duplexní sonografie nebo kvantitativní MRA [27], nebo s daty z matematických modelů, což je plánováno v další fázi projektu.
Na závěr je potřeba zmínit limitace měření hemodynamických parametrů v sestaveném 3D fantomu karotického řečiště. Průtokové křivky mohly být ovlivněny jak materiálem pro 3D tisk, který neměl shodné elastické vlastnosti s lidskou cévní stěnou, tak reologickými vlastnostmi kapaliny použité v hemodynamickém modelu, které nebyly shodné s reologickými vlastnostmi lidské krve. První limitaci nelze do budoucna jednoduše eliminovat, protože vyjmutí aterosklerotického plátu vč. cévní stěny je u většiny pacientů nemožné bez následného použití cévní náhrady. Použití tepen ze zvířecího modelu nebo z kadaverů není možné kvůli velké variabilitě karotického řečiště a změně elastických vlastností tkání při fixaci. Naopak druhou limitaci lze v budoucích modelech jednoduše eliminovat použitím lidské nebo zvířecí krve.
Figure 1. 3D reconstruction of the carotid artery from CT angiographic images (7 patients)
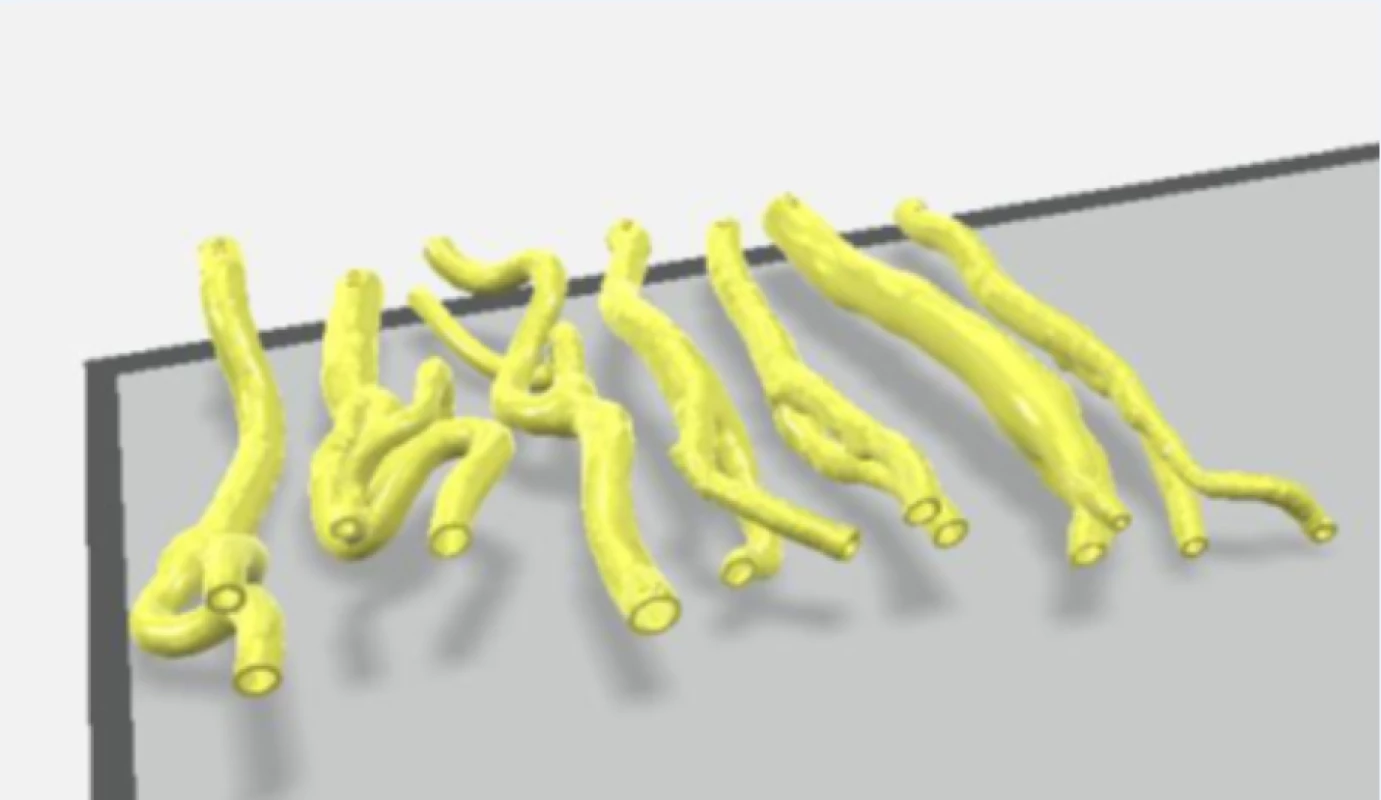
Figure 2. Printing of the carotid artery from 3D reconstruction of CT angiographic images (7 patients)
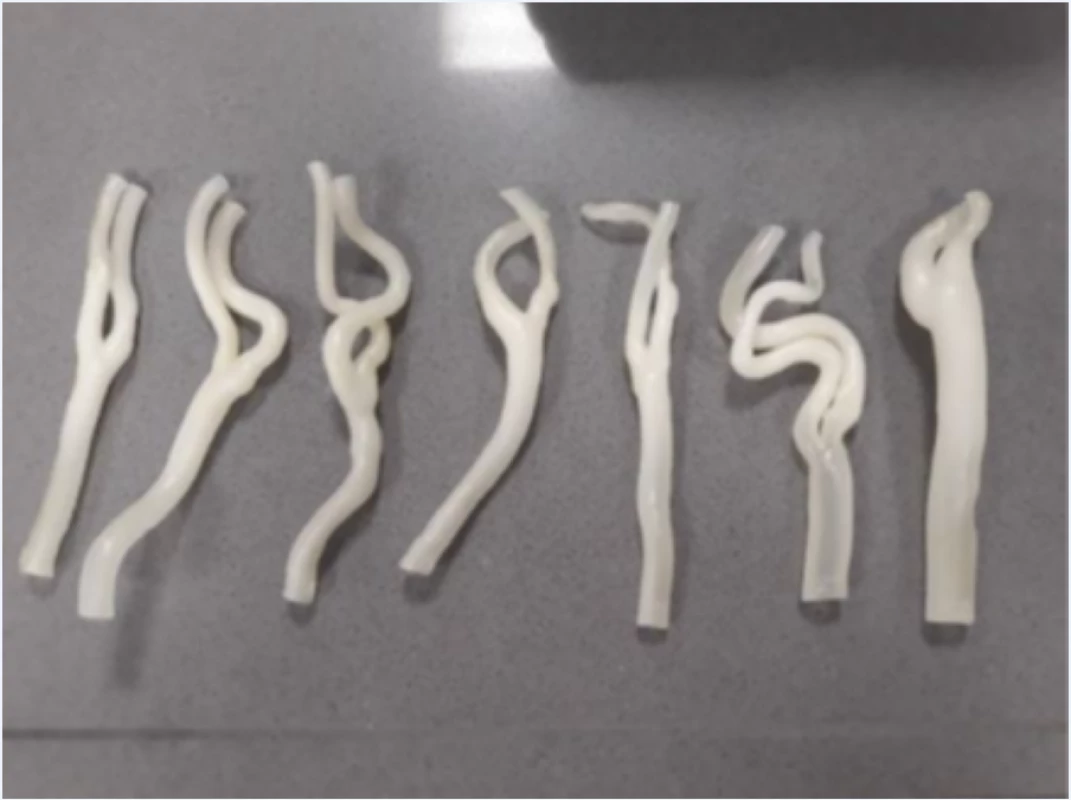
Figure 3. Insertion of a 3D model of arteries with an inserted atherosclerotic plaque into a hemodynamic model

Figure 4. Connection of a piston pump (modular linear actuator) with a 50 ml syringe attached in a hemodynamic model.

Figure 5. Graphic User Interface (GUI) of the control software for setting the pulse wave parameters
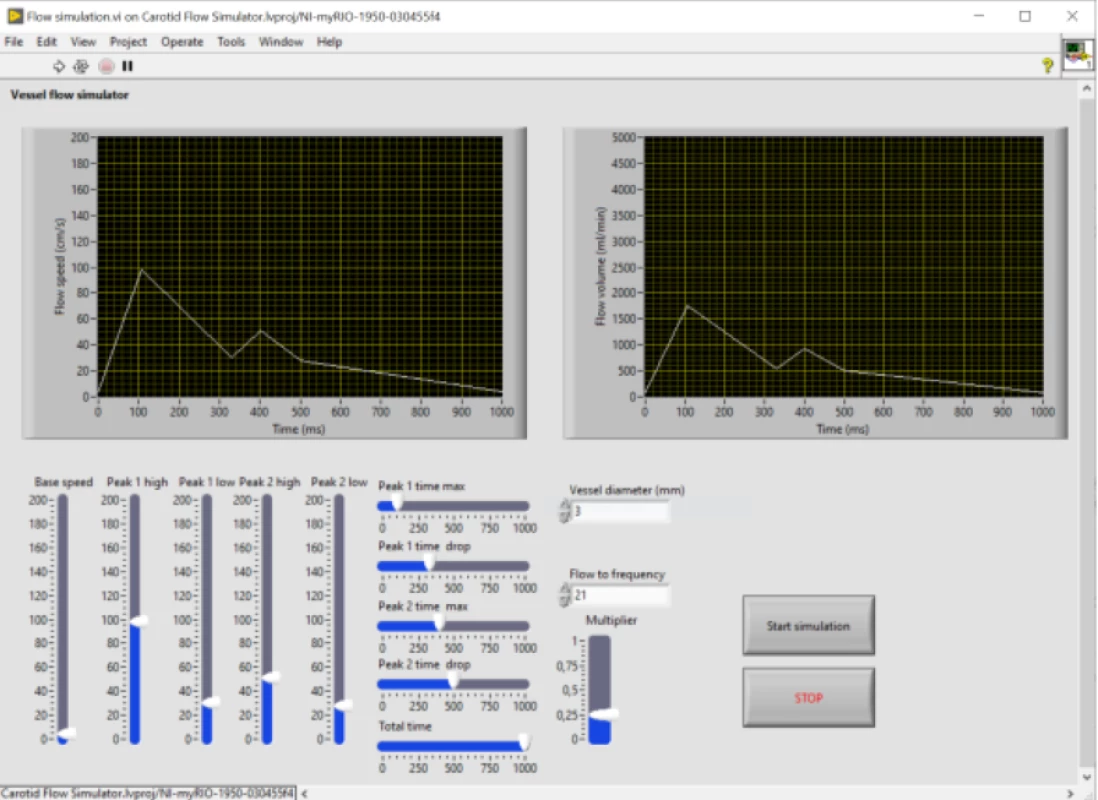
Figure 6. Sonographic examination of the flow in the carotid bifurcation with inserted atherosclerotic plaque in vitro in a hemodynamic model
Etické principy
Studie byla provedena v souladu s helsinskou Deklarací z roku 1975 (a revizemi z let 2004 a 2008). Etická komise Fakultní nemocnice Ostrava schválila studii dne 21. 6. 2018 (č. schválení 510/2018). Všichni pacienti podepsali Informovaný souhlas s účastí ve studii.
Finanční podpora
Podpořeno z programového projektu Ministerstva zdravotnictví ČR s reg. č. AZV 17-31016A, NV19-04-00270 a Operačního programu Podnikání a inovace pro konkurenceschopnost s reg. č. CZ.01.1.02/0.0/0.0/17_107/0012446. Veškerá práva podle předpisů na ochranu duševního vlastnictví jsou vyhrazena.
Konflikt zájmů
Autoři deklarují, že v souvislosti s předmětem studie nemají žádný konflikt zájmů.
prof. MUDr. David Školoudík, Ph.D., FESO, FEAN
Neurochirurgická klinika FN Ostrava
17. listopadu 1790
708 52 Ostrava
e-mail: skoloudik@email.cz
Přijato k recenzi: 19. 10. 2020
Přijato do tisku: 5. 11. 2020
Sources
1. Celermajer DS, Chow CK, Marijon E et al. Cardiovascular disease in the developing world: prevalences, patterns, and the potential of early disease detection. J Am Coll Cardiol 2012; 60 (14): 1207–1216. doi: org/10.1016/j.jacc.2012.03.074.
2. Kalvach P (ed). Mozkové ischemie a hemoragie. 3. vyd. Praha: Grada 2010.
3. Benjamin EJ, Blaha MJ, Chiuve SE et al. Heart disease and stroke statistics – 2017 update: a report from the American Heart Association. Circulation 2017; 135 (10): e146–603. doi: 10.1161/CIR.0000000000000485.
4. Touzé E. Natural history of asymptomatic carotid artery stenosis. Rev Neurol (Paris) 2008; 164 (10): 793–800. doi: 10.1016/ j.neurol.2008.07.005.
5. Kešnerová P, Viszlayová D, Školoudík D. Detekce nestabilního karotického plátu v prevenci ischemické cévní mozkové příhody. Cesk Slov Neurol N 2018; 81 (4): 378–391. doi: 10.14735/amcsnn2018378.
6. Roubec M, Školoudík D, Hrbáč T et al. Krvácení do aterosklerotického plátu u symptomatické a asymptomatické progredující stenózy vnitřní karotidy – pilotní studie. Cesk Slov Neurol N 2019; 82 (6): 638–643. doi: 10.14735/amcsnn2019638.
7. Školoudík D, Škoda O, Bar M et al. Neurosonologie. Praha: Galén 2003.
8. Charvát F, Vrána J, Netuka D et al. Charakteristika aterosklerotického plátu a riziko mozkové ischemie při stentování vnitřní karotidy. Cesk Slov Neurol N 2020; 83 (1): 84–94. doi: 10.14735/amcsnn202084.
9. Norris JW, Bornstein NM. Progression and regression of carotid stenosis. Stroke 1986; 17 (4): 755–757. doi: 10.1161/01.str.17.4.755.
10. Spence JD, Hackam D. Treating arteries instead of risk factors: a paradigm change in management of atherosclerosis. Stroke 2010; 41 (6): 1193–1199. doi: 10.1161/ STROKEAHA.110.577973.
11. Brott TG, Halperin JL, Abbara S et al. ASA/ACCF/AHA/AANN/AANS/ACR/ASNR/CNS/SAIP/SCAI/SIR/SNIS/SVM/SVS guideline on the management of patients with extracranial carotid and vertebral artery disease: a report of the American College of Cardiology Foundation /American Heart Association Task Force on Practice Guidelines, and the American Stroke Association, American Association of Neuroscience Nurses, American Association of Neurological Surgeons, American College of Radiology, American Society of Neuroradiology, Congress of Neurological Surgeons, Society of Atherosclerosis Imaging and Prevention, Society for Cardiovascular Angiography and Interventions, Society of Interventional Radiology, Society of Neurointerventional Surgery, Society for Vascular Medicine, and Society for Vascular Surgery. J Am Coll Cardiol 2011; 57 (8): e16–94. doi: 10.1016/j.jacc.2010.11.006.
12. Škoda O, Herzig R, Mikulík R et al. Klinický standard pro diagnostiku a léčbu pacientů s ischemickou cévní mozkovou příhodou a s tranzitorní ischemickou atakou – verze 2016. Cesk Slov Neurol N 2016; 79/112 (3): 351–363. doi: 10.14735/amcsnn2016351.
13. Hrbáč T, Netuka D, Beneš V et al. SONOlysis in prevention of Brain InfaRctions During Internal carotid Endarterectomy (SONOBIRDIE) trial – study protocol for a randomized controlled trial. Trials 2017; 18 (1): 25. doi: 10.1186/s13063-016-1754-x.
14. Matějka R, Štěpanovská J, Kneppo P et al. Modulární lineární aktuátor pro aplikace v tkáňovém inženýrství. Užitný vzor 34123. 17. 4. 2020.
15. Berenson GS, Srinivasan SR, Freedman DS et al. Atherosclerosis and its evolution in childhood. Am J Med Sci 1987; 294 (6): 429–440. doi: 10.1097/00000441-198712000-00008.
16. Peeters W, Hellings WE, de Kleijn DP et al. Carotid atherosclerotic plaques stabilize after stroke: insights into the natural process of atherosclerotic plaque stabilization. Arterioscler Thromb Vasc Biol 2009; 29 (1): 128–133. doi: 10.1161/ATVBAHA.108.173658.
17. Gimbrone Jr, MA, García-Cardeña G. Vascular endothelium, hemodynamics, and the pathobiology of atherosclerosis. Cardiovasc Pathol 2013; 22 (1): 9–15. doi: 10.1016/j.carpath.2012.06.006.
18. Stegehuis VE, Wijntjens GW, Murai T et al. Assessing the haemodynamic impact of coronary artery stenoses: intracoronary flow versus pressure measurements. Eur Cardiol 2018: 13 (1): 46–53. doi: 10.15420/ecr.2018: 7: 2.
19. Heinen SG, de Boer SW, van den Heuvel DA et al. Hemodynamic significance assessment of equivocal iliac artery stenoses by comparing duplex ultrasonography with intra-arterial pressure measurements. J Cardiovasc Surg (Torino) 2018; 59 (1): 37–44. doi: 10.23736/S0021-9509.17.10186-2.
20. Heinen SG, Huberts W, van den Heuvel DA et al. A comparative study of geometry-based methods and intra-arterial pressure measurements to assess the hemodynamic significance of equivocal iliac artery stenoses. Vascular 2019; 27 (2): 119–127. doi: 10.1177/170853811 8805659.
21. Polanczyk A, Podgorski M, Wozniak T et al. Computational fluid dynamics as an engineering tool for the reconstruction of hemodynamics after carotid artery stenosis operation: a case study. Medicina (Kaunas) 2018; 54 (3): 42. doi: 10.3390/medicina54030042.
22. Berg P, Roloff C, Beuing O et al. The computational fluid dynamics rupture challenge 2013 – phase II: variability of hemodynamic simulations in two intracranial aneurysms. J Biomech Eng 2015; 137 (12): 121008. doi: 10.1115/1.4031794.
23. Hejčl A, Švihlová H, Sejkorová A et al. Computational fluid dynamics of a fatal ruptured anterior communicating artery aneurysm – a case report. J Neurol Surg 2017; 40 (2): 329–338. doi: 10.1055/s-0037-1604286.
24. Duanmu Z, Chen W, Gao H et al. A one-dimensional hemodynamic model of the coronary arterial tree. Front Physiol 2019; 10: 853. doi: 10.3389/fphys.2019.00853.
25. Yang Y, Liu X, Xia Y et al. Impact of spatial characteristics in the left stenotic coronary artery on the hemodynamics and visualization of 3D replica models. Sci Rep 2017; 7 (1): 1–13. doi: 10.1038/s41598-017-15620-1.
26. Zhou H, Meng L, Zhou W et al. Computational and experimental assessment of influences of hemodynamic shear stress on carotid plaque. Biomed Eng Online 2017; 16 (1): 92. doi: 10.1186/s12938-017-0386-z.
27. Fiedler J, Reiser M, Košťál P et al. Blood flow volume measurement in cervical and intracranial arteries using quantitative magnetic resonance angiography and duplex sonography (Bocaccia) – a prospective observational study. [In press]. Ultraschall Med 2020. doi: 10.1055/a-1113-7343.
Labels
Paediatric neurology Neurosurgery NeurologyArticle was published in
Czech and Slovak Neurology and Neurosurgery

2020 Issue 6
- Metamizole vs. Tramadol in Postoperative Analgesia
- Memantine in Dementia Therapy – Current Findings and Possible Future Applications
- Memantine Eases Daily Life for Patients and Caregivers
- Metamizole at a Glance and in Practice – Effective Non-Opioid Analgesic for All Ages
- Advances in the Treatment of Myasthenia Gravis on the Horizon
Most read in this issue
- Progresivní supranukleární obrna
- Supraskapulární neuropatie
- Endoskopické vs. skríninkové vyšetření polykání a jejich vliv na výsledný stav u pacientů po akutní cévní mozkové příhodě
- Encefalopatie při infekci COVID-19 s odezvou na léčbu intravenózními imunoglobuliny
