Syntéza a základné fyzikálno-chemické vlastnosti 1-[3-(Y-alkoxyfenylkarbamoyl-oxy)-2-hydroxypropyl]-4-(2-metylfenyl)-piperazíniumchloridov
Synthesis and basic physicochemical properties of 1-[3-(Y-alkoxyphenylcarbamoyloxy)-2--hydroxypropyl]-4-(2-methylphenyl)piperazinium chlorides
1-[3-(Y-Alkoxyphenylcarbamoyloxy)-2-hydroxypropyl]-4-(2-methylphenyl)piperazinium chlorides (labelled as 7a–7d) were prepared within a complex study of the relationships between the chemical structure, physicochemical properties and biological (antiarrhythmic, antihypertensive) activity of dual acting compounds. Chemical structures of basic forms (labelled as 7a2C–7d2C) and appropriate monochlorides (labelled as 7a–7d) were confirmed by 1H-NMR, 13C-NMR, MS and IR spectral and elemental analysis. The estimated physicochemical parameters included the melting point data, solubility profile in various media, purity checking (adsorption thin-layer chromatography), surface activity determination (Traube stalagmometric method), acidobasic characteristics (pKa value determination by alkalimetric titration) as well as the log ε values estimation by UV/VIS spectrophotometry. Other experimental values under consideration were lipohydrophilic characteristics using reversed-phase thin-layer chromatography (RM readouts) RP-HPLC (log k’ data) and the log Pexps estimated in octan-1-ol/phosphate buffer medium.
Key words:
dual acting α- and ß-blockers – N-phenylpiperazine – spectral characteristics – acidobasic properties – lipophilicity
:
Ivan Malík 1; Eva Sedlárová 1; Fils Andriamainty 1; Jana Gališinová 1; Jozef Csöllei 2; Ján Vančo 2
:
Univerzita Komenského Bratislava, Farmaceutická fakulta, Katedra farmaceutickej chémie
1; Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta, Ústav chemických léčiv
2
:
Čes. slov. Farm., 2011; 60, 137-143
:
Original Articles
V rámci komplexného štúdia vzťahov medzi chemickou štruktúrou, fyzikálno-chemickými vlastnosťami a biologickou (antiarytmickou, antihypertenzívnou) aktivitou duálne pôsobiacich zlúčenín boli pripravené 1-[3-(Y-alkoxyfenylkarbamoyloxy)-2-hydroxypropyl]-4-(2--metylfenyl)piperazíniumchloridy s pracovným označením 7a–7d. Chemická štruktúra príslušných bázických foriem (7a2C–7d2C) a monochloridov (7a–7d) bola potvrdená 1H-NMR, 13C-NMR, MS a IR spektrálnou ako aj elementárnou analýzou. Medzi stanovené základné fyzikálno-chemické charakteristiky patrilo určenie teploty topenia, rozpustnosti v spektre rozpúšťadiel, overenie čistoty (adsorpčná chromatografia na tenkej vrstve), určenie povrchovej aktivity (Traubeho stalagmometrická metóda), acidobázických charakteristík (hodnoty pKa pomocou alkalimetrickej titrácie) a určenie hodnôt log ε s využitím spektrofotometrie v UV/VIS oblasti. Medzi ďalšie experimentálne stanovené parametre patrili lipohydrofilné charakteristiky pomocou chromatografie na tenkej vrstve s obráteným systémom fáz (RM), RP-HPLC (log k’), shake flask metódou stanovené hodnoty rozdeľovacích koeficientov Pexp (resp. log Pexp) v systéme oktán-1-ol/tlmivý fosforečnanový roztok.
Kľúčové slová:
duálne α- a ß-blokátory – N-fenylpiperazín – spektrálna charakteristika – acidobázické vlastnosti – lipofilita
Úvod
V terapii hypertenzie sa uplatňujú a kombinujú liečivá s rôznym mechanizmom pôsobenia; redukcia krvného tlaku (KT) určitou kaskádou reakcií však veľmi často spúšťa aktiváciu iných procesov, ktoré sa manifestujú zvýšením hodnoty KT. Používaním vazodilatačne pôsobiacich liečiv sa môže následne objaviť reflexná stimulácia myokardu, ktorá je spojená so zvýšením kardiálneho outputu 1). Kombinácia viacerých antihypertenzívne aktívnych substancií však môže priniesť komplikácie, ktoré súvisia s rozdielnym nástupom a trvaním účinku jednotlivých liečiv alebo s ich vzájomnými interakciami. Preto sa v terapii hypertenzie uplatňujú liečivá s duálnym pôsobením, ktorým sa vyznačujú niektoré klasické antagonisty ß-adrenergných receptorov arylaminoetanolového alebo aryloxyaminopropanolového typu, ako napríklad labetalol typický antagonistickou aktivitou proti α1- ako aj ß1 a ß2-adrenoceptorom 2, 3), celiprolol, ktorý pôsobí ako selektívny antagonista ß1- a α2-adrenoceptorov a vazodilatátor – prostredníctvom aktivácie ß2-adrenoceptorov v hladkej svalovine ako aj uvoľňovania oxidu dusnatého z endotelu a atriálneho natriuretického peptidu 4). Karvedilol je neselektívnym ß-blokátorom s vazodilatačnou aktivitou nastupujúcou po blokáde vaskulárnych α1-adrenoceptorov 4–6). Výrazné ovplyvnenie α–adrenoceptorového systému je príznačné aj pre štruktúry s inkorporovaným (substituovaným) fenylpiperazínovým fragmentom. Pre naftopidil je charakteristické vazodilatačné pôsobenie determinované okrem iného aj selektívnou blokádou α1-adrenoceptorového podtypu bez tzv. first-dose fenoménu, ktorý je typický napríklad pre prazosín 7). Postsynaptickou α1-adrenoceptorovou antagonistickou aktivitou sa vyznačuje ďalšie liečivo fenylpiperazínového typu, urapidil, ktorého pôsobením dochádza k poklesu KT znížením periférnej vaskulárnej rezistencie 8, 9). Cieľom práce bola príprava, spektrálna charakterizácia a stanovenie základných fyzikálno-chemických parametrov nových originálnych potenciálne antihypertenzívne účinkujúcich zlúčenín, 1-[3-(Y-alkoxyfenylkarbamoyloxy)-2-hydroxypropyl]-4-(2-metylfenyl)piperazíniumchloridov (Y-alkoxy = 3- alebo 4-metoxy-, resp. etoxyskupina) s pracovným označením 7a–7d, s potenciálnou multireceptorovou aktivitou.
POKUSNÁ ČASŤ
Syntetická a spektrálna časť
Rozpúšťadlá a chemikálie boli dodané od spoločností Sigma-Aldrich Chemie (Mníchov, SRN) a Lach-Ner (Neratovice, ČR) a boli použité bez ďalšej purifikácie.
Zlúčeniny 7a–7d boli pripravené reakciou príslušného 2,3-epoxypropán-1-ylesteru kyseliny 3- alebo 4-alkoxyfenylkarbámovej (alkoxy = metoxy alebo etoxy; 0,1 mol), príprava a spektrálna charakteristika epoxyzlúčenín (EZ) je detailne uvedená v práci 10), a bázickej zložky, 1-(2-metylfenyl)piperazínu (MFP; 0,1 mol). EZ boli rozpustené v minimálnom množstve etanolu, a potom bolo pridané ekvimolárne množstvo MFP. Reakčná zmes bola zahrievaná pri teplote varu rozpúšťadla pod spätným chladičom na olejovom kúpeli 9 h. Po vychladnutí bol etanol vákuovo oddestilovaný, surový produkt bol po rozpustení v chloroforme pretrepaný s vodou a dôkladne vysušený s bezvodým uhličitanom horečnatým. Po odfiltrovaní uhličitanu a oddestilovaní chloroformu boli vzniknuté bázy s pracovným označením 7a2C–7d2C prečistené kryštalizáciou z propán-2-olu. Totožnosť a čistota pripravených báz bola potvrdená 1H-MNR a 13C-NMR spektrometriou ako aj chromatografiou na tenkej vrstve v sústave S1: acetón : petroléter (φ = 2 : 3), hodnoty Rf sú uvedené v tabuľke 1. Finálne látky boli pripravené pridaním nasýteného éterového roztoku chlorovodíka a boli prečistené kryštalizáciou z propán-2-olu.
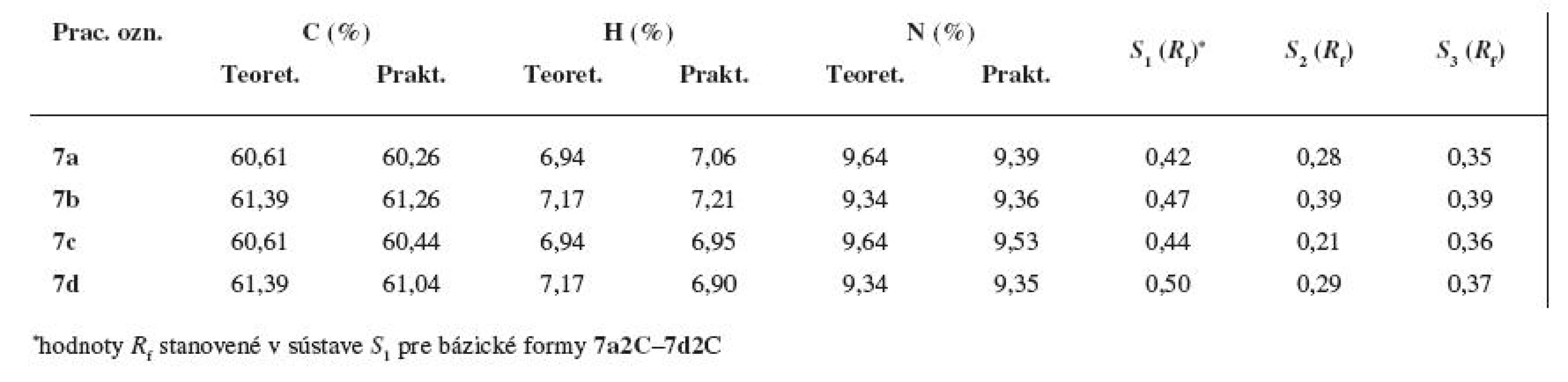
Totožnosť a čistota konečných zlúčenín 7a–7d bola potvrdená elementárnou analýzou, chromatografiou na tenkej vrstve silikagélu (Silica gel 60 F254, Merck, Darmstadt, SRN) v sústavách S2: petroléter : dietylamín (φ = 8 : 3) a S3: chloroform : cyklohexán : dietylamín (φ = 6 : 3 : 1) ako aj hmotnostnou spektrálnou analýzou a IR spektrami (tab. 2).
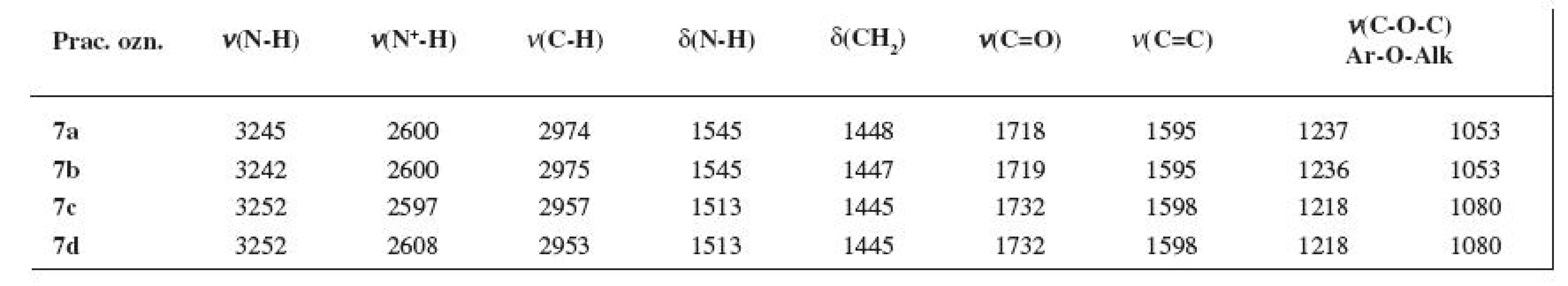
Teplota topenia zlúčenín 7a–7d (tab. 3) bola stanovená na prístroji STUART SMP 11 (Lennox Laboratory Suppliers, Dublin, Írsko) po 24-h sušení v exsikátore nad P2O5 pri tlaku 10 kPa (membránová výveva KNF Laboport N810FT.18) a laboratórnej teplote, jej hodnota nie je korigovaná.
![Základná charakteristika 1-[3-(Y-alkoxyfenylkarbamoyloxy)-2-hydroxypropyl]-4-(2-metylfenyl)piperazíniumchloridov](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/be20fa6d5f7ad8c7cffcef65b42d8083.jpg)
1H-NMR spektrá (tab. 4) bázických foriem 7a2C–7d2C boli zmerané na prístroji FT-NMR spektrometer Varian Gemini 2000 (Varian, Palo Alto, USA) s pracovnou frekvenciu 200 MHz v CH2Cl3, ako vnútorný štandard bol použitý tetrametylsilán (TMS, δ = 0,0 ppm).

13C-NMR spektrá (tab. 5) bázických foriem 7a2C–7d2C boli merané na rovnakom prístroji ako 1H NMR pri pracovnej frekvencii 50 MHz. Vzorky boli merané v CH2Cl3, štandardom bol signál CH2Cl3 (77,0 ppm).

Hmotnostné spektrá (MS) látok 7a–7d boli zmerané na prístroji Agilent 1100 LC/MSD VL Trap (Agilent Technologies, Santa Clara, USA). Ich metanolové roztoky boli aplikované do hmotnostného spektrometra lineárnou mechanickou pumpou (KD Scientific, Holliston, USA) rýchlosťou 200 μl . min-1, prietok nebulizačného plynu (N2) bol 5 l . min-1, tlak 40 psi. Teplota sušiaceho plynu v nebulizátore bola 200 °C, napätie na kapiláre malo hodnotu 3,5 kV. Meranie sa vykonalo v pozitívnom móde za ionizácie elektrosprejom (ESI-MS) pri atmosférickom tlaku. Snímané rozpätie hmôt bolo v intervale od 15 – 800 m/z.
Spektrá v IR oblasti (viz tab. 2) zlúčenín 7a–7d boli zmerané na prístroji FT-IR spektrofotometer Nicolet Model Impact 410 (Nicolet Instrument, Madison, USA) v tabletách KBr v koncentrácii 2–3 mg látky na 200 mg KBr v strednej oblasti IR spektra v intervale 4000–400 cm-1.
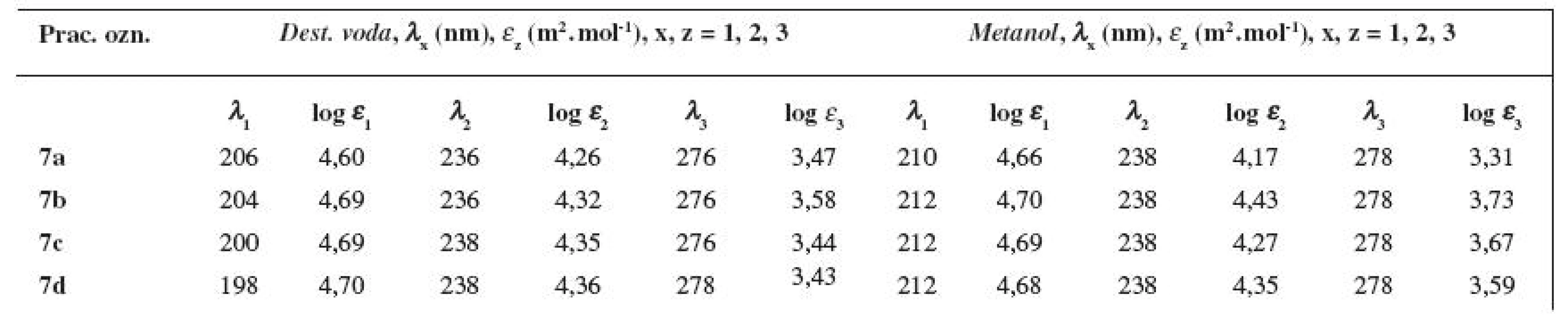
Elektrónové absorpčné spektrá (tab. 6) substancií 7a–7d sa zaznamenali na UV/VIS spektrofotometri (8452 A, Diode Array Spectrophotometer, typ Vectra 286/12, Hewlett Packard, Bratislava – pobočka spoločnosti, SR) vo vodnom (c = 2 × 10-5 mol . l-1) a v metanolovom (c = 5 × 10-5 mol.l-1) prostredí v oblasti 190 až 350 nm.
Analytická časť
Elementárna analýza finálnych látok 7a–7d (viz tab. 1) bola vykonaná na prístroji Elemental Analyser EA1108 (Carlo Erba Instruments, Wigan, Veľká Británia). Po aplikovaní vzorky nastalo jej spálenie v kolóne pri teplote 1800 °C na katalyzátore WO3 za vzniku NOx, CO2 a H2O, ktoré boli unášané nosným plynom do redukčnej časti kolóny. Plyny boli po redukcii nesené na kolónu, kde sa eluovali v poradí: N2, CO2, H2O. Po výstupe z kolóny sa detegovali tepelno-vodivostným detektorom.
Rozpustnosť pripravených zlúčenín 7a–7d bola hodnotená v destilovanej vode, v metanole p.a. (CentralChem, Bratislava, SR), v liehu 96 % (Lachema, Brno, ČR) a v chloroforme p.a. (CentralChem, Bratislava, SR) podľa 11).
Povrchové napätie pripravených látok 7a–7d (vodné roztoky s c = 1 × 10-3 mol . l-1) bolo stanovené podľa práce 12) nepriamou stalagmometrickou metódou počítania kvapiek formovaných z konštantného objemu roztokov hodnotených látok pri teplote 21 °C (tab. 7). Použitý bol sklenený Traubeho stalagmometer (Kavalier, Sázava, ČR). Ako referenčná kvapalina sa použila destilovaná voda, ktorej povrchové napätie pri teplote t = 21 °C je γ = 0,07259 N . m-1.
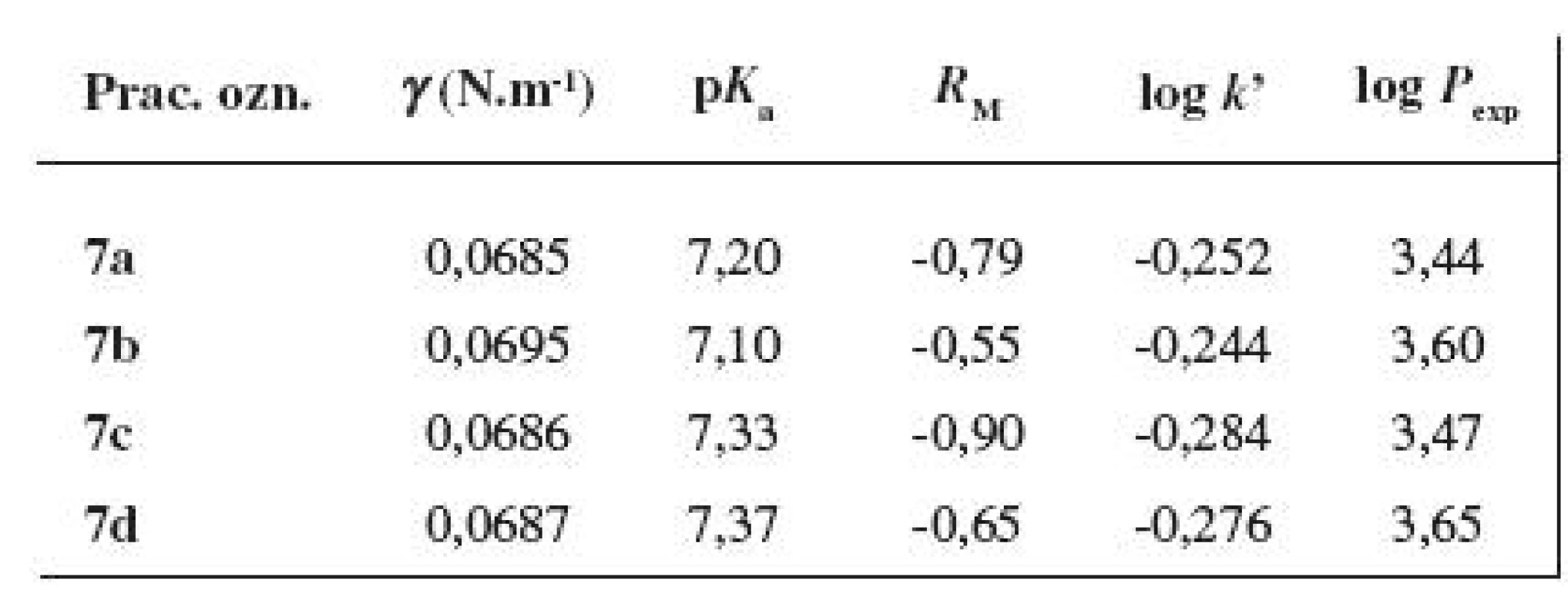
Disociačná konštanta zosyntetizovaných zlúčenín 7a–7d bola stanovená potenciometricky alkalimetrickou titráciou pomocou automatickej byrety OP 930 spojenej s digitálnym pH-metrom (Hanna Instruments, Kiel, SRN). Konštantný prídavok odmerného roztoku hydroxidu sodného s c = 0,1 mol . l-1 predstavoval 0,005 ml. Roztoky hodnotených látok boli pripravené navážením 0,05 g príslušnej substancie a rozpustením v 20,0 ml metanolu a boli doplnené destilovanou vodou na objem 50,0 ml. Titrácia prebiehala pri teplote 21 °C. Zaznamenali sa hodnoty pH titrovaného roztoku, resp. roztokov v závislosti od pridaného množstva hydroxidu sodného. Po ukončení titrácie sa interpolačným stupňom podľa Hahna zistila presná spotreba odmerného roztoku a hodnota pri polovičnej spotrebe 13). Z priebehu potenciometrickej titrácie sa podľa vhodnej polynomickej funkcie v programe Statistica 8.0 (Stat Soft, Tulsa, USA) pomocou V1/2 vypočítala disociačná konštanta. Výsledná hodnota pKa zosyntetizovaných substancií po vykonaní korekcie na objem metanolu v titračnom prostredí ( 0,14) je prezentovaná ako priemer troch paralelných stanovení (tab. 7).
Pre chromatografickú analýzu pripravených látok 7a–7d na tenkej vrstve založenej na rozdeľovacom princípe sa použili komerčne vyrábané platne Silica gel 60 F254 (Merck, Darmstadt, SRN) s vrstvou silikagélu s rozmermi 200 × 200 mm (nastrihané na vhodne veľké prúžky), ktoré boli vopred impregnované postupne 3%, 5% alebo 7% roztokom silikónového oleja v heptáne (Lachema, Brno, ČR). Po vysušení platní pri laboratórnej teplote počas 20 min prebiehal chromatografický proces v komorách sýtených 5 min vyvíjacou sústavou S4 RP-TLC: kyselina chlorovodíková s c = 1 mol . l-1 : acetón (φ = 4 : 1). Z látok sa pripravili 1% roztoky v metanole, na platne sa nanášali mikrokapilárou (Hamilton Bonaduz AG, Bonaduz, Švajčiarsko) 2 μl roztoku. Detekcia škvŕn na chromatograme bola vykonaná nad parami jódu. Najvhodnejšie hodnoty Rf, resp. RM boli získané s použitím 5% silikónového oleja v heptáne (tab. 7).
![Schéma prípravy 1-[3-(Y-alkoxyfenylkarbamoyloxy)-2-hydroxypropyl]-4-(2-metylfenyl)piperazíniumchloridov (7a–7d); číslovanie skeletu zlúčenín 7a2C–7d2C z hľadiska <sup>1</sup>H-NMR spektrometrie](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/bba0ed70e4a09935e9df0663c3cdf95c.jpg)
Hodnota(-y) retenčného faktora k’ (v literatúre uvádzaný aj ako kapacitný faktor k’) zlúčenín 7a–7d bola(-li) stanovená(-né) na kvapalinovom chromatografe s vysokotlakovou pumpou Delta Chrom SDS 030 (Watrex, Bratislava, SR) so slučkovým dávkovačom s 20 μl slučkou (Watrex, Bratislava, SR), kolónou s nepolárnou chemicky viazanou fázou Separon SGX C18 7 μm, 250 × 4 mm (Lachema, Brno, ČR) a prietokovým UV detektorom Delta Chrom UVD 200 (Watrex, Bratislava, SR). Pre pripravené látky boli použité postupne tri rôzne mobilné fázy s rozdielnym percentuálnym zastúpením metanolu – 98 %, 95 %, 90 % (pripraveného z metanolu p.a. a destilovanej vody). Ako vhodná sa ukázala mobilná fáza s 95% zastúpením metanolu.
Chromatografické podmienky: mobilná fáza (pH = 6,0) – 95% metanol upravený vodným roztokom nátriumacetátu, prietoková rýchlosť – 0,6 ml/min, tlak – 6,4 MPa, vlnová dĺžka – 248 nm, pracovná teplota – 21 až 22 °C.
Mŕtvy čas kolóny (t) sa stanovil roztokom dusitanu sodného s c = 0,1 mol . l-1, ktorý mal v použitom systéme nulovú retenciu. Hodnoty log k’ (viz tab. 7) boli vypočítané zo vzťahu: log k’ = log [(tR – t)/t], kde t je retenčný čas roztoku dusitanu sodného 0,1 mol.l-1 a tR je retenčný čas roztoku vzorky a sú priemernou hodnotou z troch stanovení 13). Roztoky študovaných látok boli pripravené rozpustením 0,0050 g konkrétnej zlúčeniny v metanole a upravené na objem 25,0 ml. Po odvzdušnení mobilnej fázy bol chromatografický systém premývaný približne 20 min. Prvé dva nástreky bol roztok dusitanu sodného, potom sa aplikovali roztoky hodnotených látok 7a–7d (20 μl). Každá vzorka bola aplikovaná dvakrát, pre výpočet sa použila priemerná hodnota tR.
Rozdeľovací koeficient Pexp študovaných zlúčenín 7a–7d bol stanovený experimentálne klasickou shake flask metódou ich vytrepávaním medzi dve nemiešateľné fázy (tab. 7). Lipofilnú fázu reprezentoval oktán-1-ol (Merck, Darmstadt, SRN), ako vodná fáza bol použitý tlmivý fosforečnanový roztok (TFR) s pH = 7,2 pripravený z hydrogenfosforečnanu disodného, p.a. (Slavus, Bratislava, SR) s c = 0,2 mol . l-1 a z kyseliny citrónovej čistej (Chemapol, Praha, ČR) s c = 0,1 mol . l-1.
Pracovalo sa so základnými roztokmi zlúčenín 7a–7d, ktoré boli pripravené rozpustením 0,0020 g príslušnej látky v odmernej banke s obsahom 50,0 ml vo TFR. Z 10,0 ml základného roztoku študovaných látok sa do 10-ml odmernej banky odpipetovalo 1,0 ml a doplnilo sa TFR po značku, nakoniec bolo po zmeraní absorbancie A1 pridané 0,1 ml oktán-1-olu. Po vytrepaní a ustálení fáz sa spektrofotometricky vyhodnotila koncentrácia hodnotených substancií vo vodnej vrstve v ultrafialovej oblasti spektra pri vlnovej dĺžke druhého absorpčného maxima (zmeranie absorbancie A2). Experimentálne rozdeľovacie koeficienty študovaných látok Pexp sa počítali z molaritných koncentračných údajov vodnej vrstvy 13).
VÝSLEDKY A DISKUSIA
V rámci štúdia vzťahov medzi chemickou štruktúrou, fyzikálno-chemickými vlastnosťami a biologickou (antiarytmickou, antihypertenzívnou) aktivitou duálne pôsobiacich zlúčenín boli pripravené 1-[3-(Y-alkoxyfenylkarbamoyloxy)-2-hydroxypropyl]-4-(2-metylfenyl)piperazíniumchloridy (Y-alkoxy = 3- alebo 4 metoxy-, resp. etoxyskupina) s pracovným označením 7a–7d. V porovnaní so sériou látok, ktoré boli spektrálne a fyzikálno-chemicky charakterizované v publikáciách 10, 13, 14), bol ako bázický reaktant pri syntéze použitý 1-(2-metylfenyl)piperazín (MFP). Výťažnosť chemických reakcií prípravy finálnych zlúčenín 7a–7d bola relatívne uspokojivá (67–75 %). Chemická štruktúra ich príslušných bázických foriem s pracovným označením 7a2C–7d2C bola potvrdená 1H-NMR a 13C NMR spektrálnou analýzou (pozri schému prípravy), hmotnostné spektrá konečných látok 7a–7d potvrdili prítomnosť molekulového iónu príslušného monochloridu a pomocou IR-spektrometrie boli identifikované jednotlivé funkčné skupiny.
Vzhľadom k tomu, že pripravené bázy 7a2C–7d2C obsahovali dve disubstituované aromatické jadrá, bolo možné pozorovať signály protónov v oblasti 6,72 až 7,15 ppm. Nakoľko je aromatický skelet substituovaný v meta-, resp. v para-polohe, signály boli štiepené interakciou so susednými protónmi. Signály piperazínu a metylénová skupina na C9 boli súčasťou širokého multipletu, ktorý bol indikovaný v rozmedzí 2,49–4,33 ppm (viz tab. 4). Vodíku H-8 (pozri schému prípravy) prislúchal pre jednotlivé štruktúry 7a2C–7d2C posun v oblasti 4,05–4,14 ppm; vodíku hydroxylovej funkčnej skupiny posun v intervale 6,70–7,30 ppm. Metylová skupina viazaná na aromatické jadro v bázickej časti molekuly mala posun 2,30 ppm. Zároveň boli identifikované aj vodíky metylových a metylénových skupín postranného alkoxylového reťazca (3,79–3,81 ppm, resp. 4,04–4,09 ppm). Predpokladaná štruktúra substancií 7a2C–7d2C bola potvrdená aj analýzou 13C-NMR spektier. Uhlíkom aromatických jadier prislúchali signály v rozmedzí 110,0–160,2 ppm. V intervale 51,9–67,3 ppm sa nachádzali signály pre uhlíky piperazínu a 2-hydroxypropán--1,3-diylového spojovacieho reťazca. Uhlíku oxoskupiny karbamátu bol priradený signál s chemickým posunom 153,2–153,4 ppm. Narastaním vzdialenosti uhlíka od kyslíka v alkoxylovom reťazci dochádzalo k znižovaniu hodnôt chemického posunu signálov prislúchajúcich uhlíkov. Metylová skupina v bázickej časti molekuly mala posun 17,6–17,7 ppm (viz tab. 5).
Analýza hmotnostných spektier pripravených látok 7a–7d poukázala na existenciu zodpovedajúceho molekulového iónu [M + H+]+ – 7a: m/z = 400,2; 7b: m/z = 414,3; 7c: m/z = 400,2; 7d: m/z = 414,3.
Prítomnosť charakteristických funkčných skupín študovaných molekúl 7a–7d sa prejavila aj v priebehu IR spektier. NH-Skupine, ν(N-H), bol priradený interval 3242–3252 cm-1, resp. pre δ(N-H) to bolo rozpätie 1545–1513 cm-1. Kľúčové skupiny, resp. fragmenty hodnotených látok, t. j., karbonylová skupina ako aj aromatický skelet, mali interval príslušného typu vibrácií 1730–1718 cm-1, resp. 1598–1595 cm-1. Hodnoty vibrácií pre karbonylovú skupinu ν(C=O) sa so stúpajúcou Mr prakticky nemenili (viz tab. 2).
Pripravené finálne látky 7a–7d vykazovali, ako deriváty benzénu 15), vo vodnom aj v metanolovom prostredí tri absorpčné pásy (viz tab. 6). Druhý lokálne excitačný pás bol pri študovaných zlúčeninách vo vodnom prostredí pozorovaný v časti 198–206 nm (λ1max; pri 210 až 212 nm v metanole), charge-transfer pás (C-T) v oblasti 236–238 nm (λ2max; pri 238 nm v metanole) a prvý lokálne excitačný pás v intervale 276–278 nm (λ3max; pri 278 nm v metanole).
Percentuálne zastúpenie uhlíka, vodíka a dusíka sa pri substanciách 7a–7d nelíšilo o viac ako Ī 0,4 % v porovnaní s teoretickými hodnotami (viz tab. 1). Z experimentálne stanovených údajov vyplynulo, že finálne zlúčeniny boli pripravené vo forme monochloridov.
Nekorigované hodnoty teploty topenia (viz tab. 3) látok 7a–7d, stanovené po 24-h sušení v exsikátore nad P2O5 pri tlaku 10 kPa a laboratórnej teplote, sa pohybovali v relatívne úzkom intervale.
Pri určení rozpustnosti predstavoval, vzhľadom na obmedzené množstvo zlúčenín, návažok študovaných látok 0,10 g pre stanovenie rozpustnosti v destilovanej vode a 0,01 g pre určenie rozpustnosti v liehu 96 % a v chloroforme. Hodnotené látky 7a–7d boli v destilovanej vode veľmi ťažko rozpustné. V prostredí liehu 96 % vykazovali miernu rozpustnosť, v chloroforme boli prakticky nerozpustné. Relatívne ťažkú rozpustnosť pripravených solí vo vode je možné vysvetliť prítomnosťou (substituovaného) aromatického jadra v bázickej časti molekuly.
Na orientačné hodnotenie čistoty konečných substancií 7a–7d bola použitá adsorpčná chromatografia na tenkej vrstve; z mnohých vyskúšaných dvoj- a trojzložkových vyvíjacích sústav boli optimálne hodnoty Rf získané v sústave S2: petroléter : dietylamín (φ = 8 : 3), resp. S3: chloroform : cyklohexán : dietylamín (φ = 6 : 3 : 1). V obidvoch vyvíjacích systémoch s nárastom hodnôt Mr došlo aj k nárastu Rf (viz tab. 1). Polohová izoméria postranného alkoxylu sa prejavila v sústave S2 – meta-deriváty mali vyššie hodnoty Rf ako para-štruktúry.
Povrchové napätie bolo študované nepriamou Traubeho stalagmometrickou metódou počítania kvapiek. Hodnotené zlúčeniny 7a–7d boli mierne povrchovo aktívne (viz tab. 7), pričom neboli pozorované prakticky žiadne rozdiely medzi meta- a para-substituovanými polohovými izomérmi.
Na štúdium acidobázických vlastností bola využitá alkalimetrická titrácia pri potenciometrickej indikácii bodu ekvivalencie. Keďže v molekule hodnotených látok 7a–7d je substituované aromatické jadro viazané priamo na atóm dusíka piperazín-1,4-diylového skeletu, nastáva konjugácia voľného elektrónového páru atómu dusíka s aromatickým kruhom, čím dochádza k zníženiu zásaditosti. Pri reakcii s nasýteným éterovým roztokom chlorovodíka došlo k protonizácii len jedného atómu dusíka, podobne ako pri látkach študovaných v prácach 13, 14). Hodnotené zlúčeniny, príslušné monochloridy, mali v podstate neutrálny charakter, hodnota pKa sa pohybovala v rámci študovanej série v intervale 7,10–7,37 (viz tab. 7); prejavil sa mierny rozdiel v hodnotách pKa meta- a para-substituovaných polohových izomérov. Látky, v ktorých štruktúre bol substituent 2’-CH3 v bázickom fragmente nahradený 2’-F, 4’-F alebo 3’-CF3 skupinou10, 13, 14) pri identickej lipofilnej časti molekuly (Y-alkoxyfenylkarbamoyloxylový skelet), mali nižšie hodnoty pKa.
Ako experimentálne stanovené parametre lipofility finálnych substancií 7a–7d boli určené hodnoty RM z chromatografie na tenkej vrstve s obráteným systémom fáz, retenčné faktory k’ z RP-HPLC a rozdeľovacie koeficienty log Pexp stanovené shake flask metódou v systéme oktán-1-ol/TFR. So stúpajúcou Mr došlo k nárastu hodnôt RM, log k’ ako aj log Pexp (viz tab. 7). Podľa RM- a log k’-výstupov boli meta-deriváty mierne lipofilnejšie ako para-substituované zlúčeniny, údaje log Pexp indikovali približne rovnakú lipofilitu zodpovedajúcich polohových izomérov. Pri porovnaní lipofility látok 7a–7d so štruktúrami hodnotenými v publikáciách 13, 14) sa ukázalo, že vyššie hodnoty RM, log k’ a log Pexp boli podľa očakávania získané, pri rovnakom prístrojovom vybavení a pri rovnakých experimentálnych podmienkach, pre substancie s 2’-F, 4’-F ale najmä s 3’-CF3 skupinou viazanou na aromatickom jadre v bázickej časti molekuly.
Prezentované spektrálne a fyzikálno-chemické parametre 1-[3-(Y-alkoxyfenylkarbamoyloxy)-2-hydroxypropyl]-4-(2-metylfenyl)piperazíniumchloridov (7a–7d) rozširujú spektrum poznatkov o zlúčeninách s potenciálnou schopnosťou ovplyvňovať funkcie kardiovaskulárneho systému prostredníctvom (možného) pôsobenia na α a súčasne ß-adrenergný receptorový systém. Po predpokladanom budúcom farmakologickom hodnotení sú získané údaje využiteľné v rámci komplexných QSAR-analýz.
Adresa pre korešpondenciu:
PharmDr.
Ivan Malík, PhD.
Katedra
farmaceutickej chémie FaF UK
Odbojárov
10, 832 32 Bratislava, Slovenská republika
e-mail:
malik@fpharm.uniba.sk
Sources
1. Louis, W. J., McNeil, J. J., Drummer, O. H.: The pharmacology of combined alpha – beta-blockade I. Drugs 1984; 28, 16–34.
2. Cope, D. H. P., Crawford, M. C.: Labetalol in controlled hypotension. Administration of labetalol when adequate hypotension is difficult to achieve. Br. J. Anaesth. 1979; 51, 359–365.
3. Mehvar, R., Brocks, D. R.: Stereospecific pharmacokinetics and pharmacodynamics of beta-adrenergic blockers in humans. J. Pharm. Pharmaceut. Sci. 2001; 4, 185–200.
4. Toda, N.: Vasodilating ß-adrenoceptor blockers as cardiovascular therapeutics. Pharmacology & Therapeutics 2003; 100, 215– 234.
5. Ruffolo, R. R., Gellai, M., Hieble, J. P., Willette, R. N., Nichols, A. J.: The pharmacology of carvedilol. Eur. J. Clin. Pharmacol. 1990; 38, 82–88.
6. Nichols, A. J., Gellai, M., Ruffolo, R. R.: Studies on the mechanism of arterial vasodilatation produced by the novel antihypertensive agent, carvedilol. Fund. Clin. Pharmacol. 1991; 5, 25–38.
7. Farthing, M. J. G., Alstead, E. M., Abrams, S. M. L., Haug, G., Johnston, A., Hermann, R., Niebch, G., Ruus, P., Molz, K. H., Turner, P.: Pharmacokinetics of naftopidil, a novel anti-hypertensive drug, in patients with hepatic dysfunction. Postgrad. Med. J. 1994; 70, 363–366.
8. Kirsten, R., Nelson, K., Molz, K.-H., Haerlin, R., Steinijans, V.W.: Pharmacodynamics and pharmacokinetics of urapidil in hypertensive patients: a crossover study comparing infusion with an infusion-capsule combination. Eur. J. Clin. Pharmacol. 1987; 32, 61–65.
9. Wacker, J. R., Wagner, B. K., Briese, V., Schauf, B., Heilmann, L., Bartz, C., Hopp, H.: Antihypertensive therapy in patients with pre-eclampsia: A prospective randomised multicentre study comparing dihydralazine with urapidil. Eur. J. Obstet. Gynecol. Reprod. Biol. 2006; 127, 160–165.
10. Malík, I., Sedlárová, E., Račanská, E., Čižmárik, J., Kurfürst, P.: Synthesis, physico-chemical properties and biological activity of 1-(4-fluorophenyl)-4-[3-(2-,3- and 4‑alkyloxyphenylcarbamoyloxy)-2-hydroxypropyl]pi-perazinium chlorides. Sci. Pharm. 2004; 72, 283–291.
11. Slovenský liekopis, zväzok 1. 1. vyd. Bratislava: Herba 1997; s. 22.
12. Malík, I., Sedlárová, E., Csöllei, J.: Analytické hodnotenie 1-(dipropylamino-3-piperidino-propán-1-yl)--3-pentyloxyfenylkarbamátu (CK-3635). Čes. a Slov. Farm. 2004; 53, 256–260.
13. Malík, I., Sedlárová, E., Čižmárik, J., Andriamainty, F., Csöllei, J.: Štúdium fyzikálno-chemických vlastností derivátov kyseliny 4-alkoxyfenylkarbámovej s bázickou časťou tvorenou substituovaným N-fenylpiperazínom. Farm. Obzor 2005; 74, 211–215.
14. Malík, I., Sedlárová, E., Čižmárik, J., Andriamainty, F., Csöllei, J.: Štúdium fyzikálno-chemických vlastností derivátov kyseliny 2-, 3-, 4-alkoxyfenylkarbámovej s bázickou časťou tvorenou substituovaným N‑fenylpiperazínom. Čes. slov. Farm. 2005; 54, 235–239.
15. Silverstein, R. M., Webster, F. X., Kiemle, D. J.: Spectrometric identification of organic compounds. 7. vyd. Hoboken: John Wiley and Sons 2005; 502 s.
Labels
Pharmacy Clinical pharmacologyArticle was published in
Czech and Slovak Pharmacy

2011 Issue 3
Most read in this issue
- Clinical significance of cytochrome P450 genetic polymorphism – Part I. Enzymatic system of cytochrome P450 and cytochrome P450 1A2
- Influence of membranes on alaptide permeation from hydrogels
- Farmaceutické aspekty živočíšnej lipoxygenázy
- Synthesis and basic physicochemical properties of 1-[3-(Y-alkoxyphenylcarbamoyloxy)-2--hydroxypropyl]-4-(2-methylphenyl)piperazinium chlorides
