Efekt troch rôznych elicitorov na produkciu sanguinarínu suspenznými kultúrami nízko-morfínovej odrody maku siateho (Papaver somniferum L.)
The effect of three different elicitors on sanguinarine production in suspension cultures of a low-morphine variety of the opium poppy (Papaver somniferum L.)
This paper is focused on the evaluation of the effect of three different elicitors on sanguinarine production in suspension cultures derived from a low-morphine variety of the opium poppy. The elicitors CdCl2, methyl jasmonate and a homogenate from the phytopathogenic fungus Botrytis cinerea have been administered into the growth media of 11-day-old suspension cultures. Their effect on the production of sanguinarine was monitored after 24, 48 and 72 h of exposure. The highest sanguinarine production was observed after 48 h of exposure to the biotic elicitor Botrytis cinerea, which increased the sanguinarine production 5.3-times. In the presence of CdCl2 at a concentration of 1 mmol.l-1 the content of sanguinarine increased linearly in suspension cultures and after 72 h of elicitation it was 2.3-times higher than in the non-elicited cultures. Opium poppy suspension cultures responded to methyl jasmonate elicitation by a moderate increase in sanguinane production after 24 and 48 h. A significant increase in the production of this secondary metabolite in cell suspension cultures was observed after 72 h of exposure and it was 3-times higher than the production of sanguinarine in non-elicited cultures.
Key words:
sanguinarine – methyl jasmonate – Botrytis cinerea – CdCl2 – elicitation – opium poppy
Authors:
Andrea Balážová; Víťazoslava Blanáriková; František Bilka; Andrea Bilková; Hana Kiňová Sepová
Authors‘ workplace:
Univerzita Komenského v Bratislave, Farmaceutická fakulta, Katedra bunkovej a olekulárnej biológie liečiv, Slovenská republika
Published in:
Čes. slov. Farm., 2011; 60, 237-240
Category:
Original Articles
Overview
Práca sa orientuje na hodnotenie efektu troch rôznych elicitorov na produkciu sanguinarínu suspenznými kultúrami odvodenými z nízko-morfínovej odrody maku siateho. Ako elicitory sa použili CdCl2, metyljazmonát a homogenát z fytopatogénnej huby Botrytis cinerea, ktoré sa aplikovali do živného média 11-dňových suspenzných kultúr. Efekt elicitorov na tvorbu sanguinarínu sa monitoroval po 24, 48 a 2 h ich pôsobenia. Najvyššia produkcia sanguinarínu sa pozorovala po 48 h expozícii biotickým elicitorom z Botrytis cinerea, ktorý zvýšil tvorbu sanguinarínu v suspenzných kultúrach 5,3-krát. V prítomnosti 1 mmol.l-1 CdCl2 sa obsah sanguinarínu v suspenzných kultúrach zvyšoval lineárne a po 72 h bol 2,3-krát vyšší ako v neelicitovaných kultúrach. Suspenzné kultúry maku po elicitácii metyljazmonátom reagovali miernym nárastom produkcie sanguinarínu po 24 a 8 h. Výrazné zvýšenie tvorby tohto sekundárneho metabolitu sa v bunkách suspenzných kultúr zistilo až po jeho 72 h pôsobení a produkcia sanguinarínu bola 3-krát vyššia ako v neelicitovaných kultúrach.
Kľúčové slová:
sanguinarín – metyljazmonát – Botrytis cinerea – CdCl2 – elicitácia – mak siaty
Úvod
Alkaloidy sú rôznorodou skupinou sekundárnych metabolitov, obsahujúcich dusík a nachádzajúcich sa v asi 20 % rastlinných druhov. Väčšina biochemického výskumu v oblasti rastlinných sekundárnych metabolitov sa zameriava hlavne na šesť skupín alkaloidov, a to benzylizochinolínové, monoterpénové indolové, tropánové, purínové, pyrolizidínové a chinolizidínové alkaloidy 1). Vďaka ich výrazným biologickým účinkom sú alkaloidy dlho využívané ako liečivá, stimulanty, narkotiká a jedy. Najmä farmakologické atribúty a sociálno-ekonomický význam alkaloidov maku siateho (Papaver somniferum L.) boli ocenené už dávnymi civilizáciami 2). Rastlina maku siateho zostáva aj v súčasnej dobe jediným komerčným zdrojom pre izoláciu analgetického morfínu, antitusického kodeínu a ebaínu, používaného na prípravu semi-syntetického oxykodónu 3). Globálny dopyt po opiátoch na báze morfínu sa z roka na rok zvyšuje 4), čo vedie k hľadaniu nových zdrojov pre ich izoláciu. Sľubnými sa ukazovali in vitro kultúry maku siateho. Veľkým sklamaním však bolo zistenie, že dediferencované bunky maku siateho nie sú schopné tvoriť morfín 5), a preto sú ako zdroj pre izoláciu morfínových alkaloidov nevyužiteľné.
In vitro kultúry maku siateho produkujú iný farmakologicky významný alkaloid – sanguinarín, ktorý našiel svoje uplatnenie aj v terapeutickej praxi 6, 7). Až na výnimky, charakteristickým problémom rastlinných in vitro kultúr je nízka produkcia sekundárnych metabolitov. Podmienky zabezpečujúce zvýšenie produkcie sekundárnych metabolitov (alkaloidov, terpenoidov, fenolických látok) in vitro kultúrami, možno regulovať rôznymi spôsobmi ako napr. zmenou zloženia rastového média, úpravou pH, teploty, svetelného režimu a tiež využitím elicitorov 8). Elicitácia je jedným z efektívnych biotechnologických postupov na zvýšenie produkcie sekundárnych metabolitov. Okrem biotechnologického významu, našla elicitácia využitie aj pri štúdiu obranných a signalizačných dráh pri interakciách rastlina – stresor v podmienkach in vitro 9).
Cieľom našej práce bola evaluácia efektu vybraných typov elicitorov na produkciu sanguinarínu suspenznými kultúrami nízko-morfínovej odrody maku siateho s použitím spektrofluorometrie.
POKUSNÁ ČASŤ
Príprava a kultivácia suspenzných kultúr maku siateho
Kalusové kultúry sme odvodili zo stonkových častí sterilne vyklíčených klíčnych rastlín maku siateho cv. Gerlach. Semená sme po odmastení 70% etanolom sterilizovali 15% roztokom prípravku Savo (20 min) a o viacnásobnom opláchnutí sterilnou destilovanou vodou sme ich umiestnili na agarové živné médium podľa Murashige a Skoog 10) (MS) bez rastových regulátorov. Po dosiahnutí primeranej veľkosti sme rezky použili na odvodenie kalusu. Kalusy sme kultivovali na modifikovanom živnom médiu MS obohatenom o inetín (0,3 mg.l-1) a kyselinu α-naftyloctovú (2,0 mg.l-1).
Suspenzné kultúry sme pripravili z alusových kultúr, ktoré sme za aseptických podmienok preniesli do tekutého živného média MS rovnakého zloženia na akom sa kultivovali kalusy. Kultiváciu sme realizovali v kultivačnej miestnosti na trepacom zariadení (150 kmitov.min-1) pri teplote 24–26 °C, relatívnej vlhkosti vzduchu 75–80 % a difúznom osvetlení.
Aplikácia elicitorov do živného média
Na elicitáciu sme použili 11-dňové suspenzné kultúry, ktoré sme elicitovali CdCl2, metyljazmonátom (MJ) a hydrolyzátom z mycélia fytopatogénnej huby Botrytis cinerea. Výsledná koncentrácia elicitorov v živnom médiu bola 1 mmol.l-1 CdCl2, 100 μmol.l-1 MJ a hydrolyzát z Botrytis cinerea (glukózový ekvivalent 20 μg.ml 1) sme pridávali v objeme 1 ml na 60 ml živného média. Elicitory sme aplikovali za aseptických podmienok v boxe s laminárnym prúdením vzduchu a banky sme následne umiestnili na trepacie zariadenie (150 kmitov.min-1). Dĺžka pôsobenia elicitorov bola 24, 48 a 2 h. Po ich uplynutí sme bunky filtráciou oddelili od živného média a skladovali pri -20 °C.
Izolácia, identifikácia a stanovenie obsahu sanguinarínu
Obsah sanguinarínu sme stanovili ako v neelicitovaných, tak aj v licitovaných suspenzných kultúrach. Na izoláciu, identifikáciu a kvantitatívne stanovenie sanguinarínu v bunkách suspenzných kultúr sme použili postup podľa Balažová a kol. 11).
Štatistika
Hodnoty uvádzame ako priemery z piatich paralelných experimentov s príslušnými hodnotami smerodajných odchýlok. Na vyhodnotenie experimentov sme použili Studentov nepárový t-test v programe STABEX/ EXCEL. Za hladinu štatistickej významnosti sme zvolili p < 0,05.
VÝSLEDKY A DISKUSIA
Za účelom izolácie morfínu sú pre farmaceutický priemysel zaujímavé odrody s vysokým obsahom morfínu. Odrody s nízkym obsahom morfínu sú určené pre produkciu semien a využitie v potravinárskom priemysle 12). Aj keď tieto odrody majú nízky obsah morfínu, môžu sa použiť pre experimentálne práce súvisiace s produkciou iných typov benzylizochinolínových alkaloidov, ako napr. sanguinarínu, ktoré sú tiež využiteľné vo farmaceutickej praxi. Tvorba sekundárnych metabolitov samotnými bunkami suspenzných kultúr závisí od dĺžky ich kultivácie, tiež od časti rastliny, z ktorej sú odvodené, ako aj od použitej odrody 13).
V našej práci sme použili suspenzné kultúry maku siateho cv. Gerlach, ktorý patrí medzi slovenské nízko-morfínové odrody s 0,38% obsahom morfínu v sušine toboliek 14). Na stimuláciu tvorby sanguinarínu v bunkách suspenzných kultúr maku sme použili tri rôzne elicitory, z ktorých chlorid kademnatý 15) a metyljazmonát sa radia do skupiny abiotických elicitorov, kým Botrytis cinerea je elicitorom biotickým 16). Suspenzné kultúry maku siateho po ovplyvnení rôznymi elicitormi akumulujú v bunkách benzofenantridínový alkaloid sanguinarín 7, 16, 17).
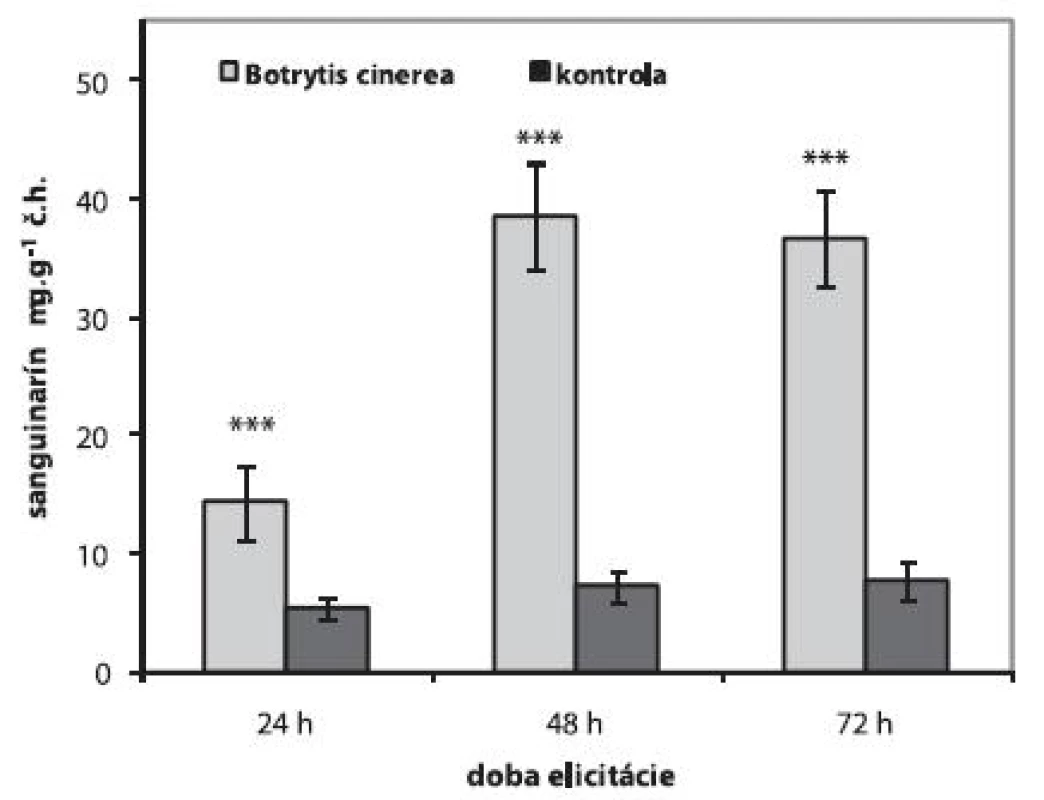
Aplikáciou 1 ml homogenátu z fytopatogénnej huby Botrytis cinerea do živného média sa zvýšila produkcia sanguinarínu suspenznými kultúrami maku siateho už po 24 h. Počas 72 h elicitácie sme najvyšší obsah sanguinarínu stanovili po 48 h (38,53 ± 4,45 μg.g-1 č.h.). Produkcia sanguinarínu sa v bunkách zvýšila 5,3-krát oproti neelicitovaným kultúram. Elicitované bunky si zvýšenú produkciu sanguinarínu zachovali aj po 72 h (36,65 ± 4,17 μg.g-1 č.h.) od aplikácie elicitora (obr. 1). V 0-dňových suspenzných kultúrach odvodených od farmaceuticky významnej odrody maku siateho Lazúr, sa po elicitácii homogenátom z Botrytis cinerea zvýšila produkcia sanguinarínu 9-krát po 48 h jeho pôsobenia 11). Avšak obsah sanguinarínu u drody Lazúr 11) bol aj po elicitácii nižší ako u testovanej odrody Gerlach. Rovnako ako suspenzné kultúry maku siateho, aj suspenzné kultúry iných rastlín z čeľade Papaveraceae (Eschscholtzia californica) zvyšujú produkciu sanguinarínu po elicitácii biotickým elicitorom 18).
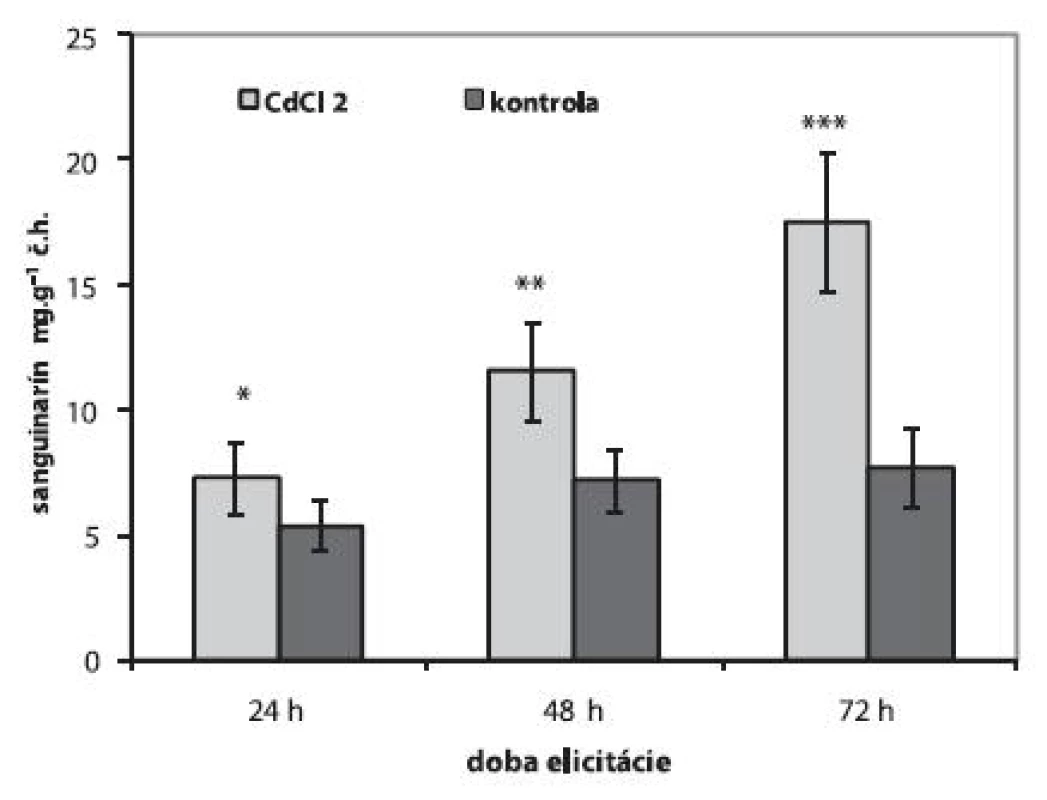
Abiotické elicitory CdCl2 a J, na rozdiel od elicitora biotického, stimulovali tvorbu sanguinarínu s rôznym časovým odstupom. V suspenzných kultúrach vystavených vplyvu 1 mmol.l-1 CdCl2 sme pozorovali lineárny vzostup produkcie sanguinarínu. Obsah tohto alkaloidu sa v licitovaných kultúrach zvýšil 1,3-násobne po 24 h, po 48 h to bol 1,6-násobok a najvyšší obsah sme stanovili po 72 h (17,52 ± 2,75 μg.g-1 č.h.), čo je 2,3-krát viac ako v neelicitovaných kultúrach (obr. 2). Podobne ako v prípade suspenzných kultúr maku siateho, aj v in vitro kultúrach Catharanthus roseus a Gloriosa superba sa zvýšila tvorba ajmalicínu 15) a kolchicínu 19) po elicitácii CdCl2. Optimálnymi koncentráciami CdCl2, ktoré stimulujú tvorby sekundárnych metabolitov v rastlinných suspenzných kultúrach sú koncentrácie do 1 mmol.l-1 15,19).
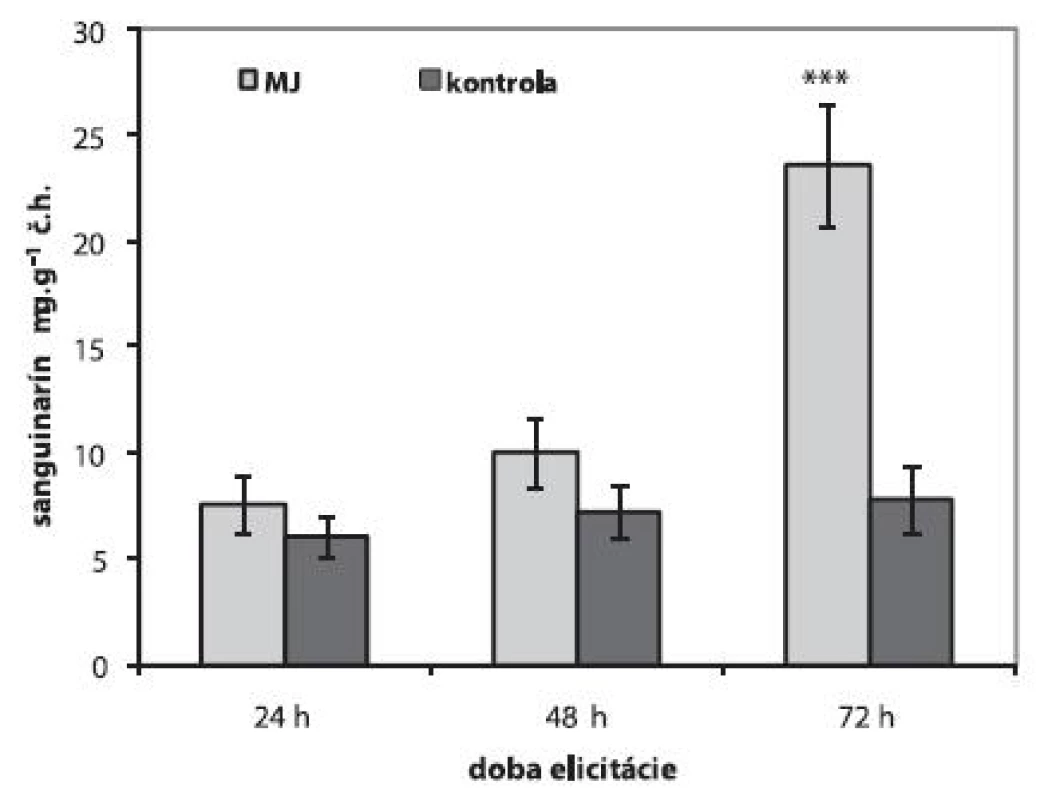
Metyljazmonát, ktorý sa spolu s kyselinou jazmónovou priamo zúčastňuje transdukčných procesov 20), sme do živného média aplikovali vo výslednej koncentrácii 100 μmol.l-1. V porovnaní s kultúrami elicitovanými CdCl2 sme v kultúrach elicitovaných metyljazmonátom pozorovali len mierne zvýšenú tvorbu sanguinarínu po 24 a 48 h jeho pôsobenia. Po 72 h elicitácie sa obsah sanguinarínu signifikantne zvýšil (23,62 ± 2,87 μg.g-1 č.h.) a celková produkcia tohto alkaloidu stúpla trojnásobne oproti tvorbe v neelicitovaných kultúrach (obr. 3). Podobný priebeh produkcie sanguinarínu sa pozoroval aj u suspenzných kultúr Eschscholtzia californica po elicitácii metyljazmonátom 18). Tento oneskorený vzostup tvorby sanguinarínu sa vysvetľuje nízkou aktivitou dihydrobenzofenantridínoxidázy (DBOX), ktorá katalyzuje konverziu dihydrosanguinarínu na sanguinarín a jej expresia nebola indukovaná v etyljazmonátom elicitovaných suspenzných kultúrach Eschscholtzia californica 18).
ZÁVER
Z použitej trojice elicitorov najefektívnejšie stimuloval tvorbu sanguinarínu v suspenzných kultúrach maku siateho homogenát z ycélia fytopatogénnej huby Botrytis cinerea. Výsledný efekt metyljazmonátu a CdCl2 na tvorbu sanguinarínu bol po 72 h ich pôsobenia porovnateľný. Nakoľko bol elicitačný účinok uvedených abiotických elicitorov slabší v porovnaní s elicitorom biotickým, sú preto tieto elicitory menej vhodné na stimuláciu sekundárneho metabolizmu v suspenzných kultúrach maku siateho. Odroda maku siateho Gerlach sa v podmienkach in vitro ukázala ako lepší producent sanguinarínu v porovnaní s odrodou Lazúr, ktorého tzv. maková slama sa používa ako priemyselná surovina pre izoláciu morfínu.
Adresa pro koresdpondenci:
PharmDr. Andrea Balažová, PhD.
Katedra bunkovej a molekulárnej biológie liečiv FaF UK
Kalinčiakova 8, 832 32 Bratislava, Slovenská republika
e-mail: balazova@fpharm.uniba.sk
Došlo 7. června 2011 / Přijato 7. července 2011
Sources
1. Facchini, P. J., Zenk, K. M., Kutchan, T. M.: Opium poppy blueprint for an alkaloid factory. Phytochemistry 2007; 23, 243–250.
2. Norn, S., Kruse, P. R., Kruse. E.: History of opium poppy and morphine. Dan. Medicinhist. Arbog. 2005; 33, 171–184.
3. Facchini, P. J., De Luka, V.: Opium poppy and Madagascar periwinkle: model non-model systems to investigate alkaloid biosynthesis in plants. Plant J. 2008; 54, 763–784.
4. http://www.incb.org/pdf/technical-reports/narcotic-drugs/2010/NAR_2010_E_Supply.pdf (5. 5. 2011).
5. Park, S. U., Facchini, P. J.: Agrobacterium rhizogenes-mediated transformation of opium poppy, Papaver somniferum L., and California poppy, Eschschotlzia californica Cham., root cultures. J. Exp. Bot. 2000; 51, 1005–1016.
6. Zdařilová, A., Malíková, J., Dvořák, Z., Ulrichová, J., Šimánek, V.: Kvartérní isochinolinové alkaloidy sanguinarin a helerythrin. Účinky in vitro a n vivo. Chem. Listy 2006; 100, 30–41.
7. Zulak, K. G., Khan, M. F., Alcantara, J., Schriemer, D. C., Facchini, P. J.: Plant Defense Responses in Opium Poppy Cell Cultures Revealed by Liquid Chromatography-Tandem Mass Spectrometry Proteomics. Mol. Cell. Proteomics 2009; 8, 86–98.
8. Collin, H. A.: Secondary product formation in plant tissue cultures. Plant Growth Reg. 2001; 34, 119–134.
9. Sánchez-Sampedro, A., Kim, H. K., Choi, Y. H., Verpoorte, R., Corchete, P.: Metabolomic alterations in elicitor treated Silybum marianum suspension cultures monitored by nuclear magnetic resonance spectroscopy, J. Biotech. 2007; 130, 133–142.
10. Murashige, T., Skoog, F.: A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol Plant 1962; 15, 473–497.
11. Balažová, A., Bilka, F., Blanáriková, V., Pšenák, M.: Zmeny obsahu sanguinarínu a ktivity polyfenoloxidázy vplyvom fungálneho elicitora v uspenzných kultúrach maku siateho Papaver somniferum L. Čes. Slov. Farm. 2002; 51, 182–185.
12. Nadaská, M.: Pletivová kultúra maku (Papaver sp.) a rodukcia alkaloidov. Farm. Obzor 1991; LX, 221–224.
13. Šramková, Z., Faragó, J.: Založenie bunkovej suspenznej kultúry chmeľu obyčajného. Nova Biotech 2006; 6, 63-75. http://fpv.ucm.sk/katedry/ biotechnolog/ journal_nova_biotechnologica/revue_nova_biotechnolo gica_6_1/sramkova2006.pdf (5. 5. 2011).
14. Ondrejčák, F: Slovenské odrody maku siateho. http://www.makovepole.sk/index.php/mak-siaty/ slovenske-odrody-maku-siateho (8. 5. 2011).
15. Zheng, Z., Wu, M.: Cadmium treatment enhances the production of alkaloid secondary metabolites in Catharanthus roseus. Plant Sci. 2004; 166, 507–514.
16. Holková, I., Bezáková, L., Bilka, F., Balažová, A., Vanko, M., Blanáriková, V.: Involvement of lipoxygenase in elicitor-stimulated sanguinarine accumulation in Papaver somniferum suspension cultures. Plant Physiol Biochem. 2010; 48, 887–892.
17. Facchini, J. P., Penzes, C., Johnson, A. C., Bull, D.: Molecular characterization of berberine bridge enzyme genes from opium poppy. Plant Physiol. 1996; 112, 1669–1677.
18. Cho, H. Y., Son, S. Y., Rhee, H. S., Yoon, S. Y. H, Lee-Parson, C. W. T, Park, J. M.: Synergistic effects of sequential treatment with methyl jasmonate, salicylic acid and yeast extract on benzophenanthridine alkaloid accumulation and protein expression in Eschscholtzia californica suspension cultures. J. Biotech. 2008; 137, 117–122.
19. Ghosh, S., Ghosh, B., Jha, S.: Aluminium chloride enhances colchicine production in root cultures of Gloriosa superba. Biotech. Letters 2006; 28, 497–503.
20. Turner, J. G., Ellis, C., Devoto, A.: The Jasmonate Signal Pathway. The Plant Cell Supp. 2002; 14, 153–164.
Labels
Pharmacy Clinical pharmacologyArticle was published in
Czech and Slovak Pharmacy

2011 Issue 5
-
All articles in this issue
- Význam genetického polymorfizmu enzýmov cytochrómu P450 – časť III. cytochróm P450 2C19
- Alzheimerova demence: aspekty současné farmakologické léčby
- Rhus hirta (L.) Sudw. – fytochemická charakteristika nejčastěji kultivovaného zástupce Anacardiaceae v České republice
- Efekt troch rôznych elicitorov na produkciu sanguinarínu suspenznými kultúrami nízko-morfínovej odrody maku siateho (Papaver somniferum L.)
- Měření viskozity a konzistence dle ČL 2009
-
Naše léčivé přípravky na konci 18. století
I. část – úvod a tekuté lékové formy
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Alzheimerova demence: aspekty současné farmakologické léčby
-
Naše léčivé přípravky na konci 18. století
I. část – úvod a tekuté lékové formy - Význam genetického polymorfizmu enzýmov cytochrómu P450 – časť III. cytochróm P450 2C19
- Měření viskozity a konzistence dle ČL 2009
