Metody farmaceutické technologie v přípravě pelet pro detekci inhibitorů acetylcholinesterasy
Methods of pharmaceutical technology in preparation of pellets for detection of acetylcholinesterase inhibitors
A variety of methods and technical equipment are currently available for checking of air contaminants. Generally, all known and sophisticated methods are based on sampling of substances in the air using different collectors or their capture in a suitable medium. However, new detection methods particularly useful in outdoor conditions are still looking for. Detection systems must be transportable, fast acting, inexpensive, sensitive and selective, and their operation should not be complicated. Such an appropriate system for the detection of carbamates and highly toxic organophosphates is detection tubes with microcrystalline cellulose pellets containing immobilized acetylcholinesterase, by which analyzed air is sucked through. The detection is based on the colorimetric Ellman reaction. Experimental work deals with the use of pharmaceutical technology methods for preparation of new variants of pellets for the detection of acetylcholinesterase inhibitors with 20% and 50% content of inorganic fillers (aluminium oxide, kaolin, colloidal silica, nalsit) produced by extrusion / spheronization. Pellets were impregnated by acetylcholinesterase after evaluating quality parameters and were tested for their activity and inhibition with Ellman’s reagent. Pellets without inorganic fillers, containing 50% of aluminium oxide and containing 20% of colloidal silica were evaluated as a suitable filling of detection tubes.
Keywords:
pellets • extrusion/spheronization • inorganic fillers • acetylcholinesterase inhibitors • detection tubes
Authors:
David Vetchý; Hana Leštinová; Ivana Tušarová
Authors‘ workplace:
Ústav technologie léků, Farmaceutická fakulta, Veterinární a farmaceutická univerzita, Brno
Published in:
Čes. slov. Farm., 2012; 61, 234-239
Category:
Original Articles
Došlo 4. září 2012 / Přijato 18. září 2012
Overview
Pro kontrolu přítomnosti cizorodých látek v ovzduší je v současné době k dispozici celá řada metod a technických zařízení. Obecně jsou všechny známé a propracované metody založené na odběru látek obsažených ve vzduchu pomocí různých kolektorů nebo využívají jejich záchyt do vhodného prostředí. Stále se však hledají nové metody detekce využitelné zejména v terénních podmínkách. Detekční systémy musí být přenosné, rychle reagující, levné, citlivé a selektivní a jejich obsluha by neměla být složitá. Takovýmto vhodným systémem k detekci karbamátů a vysoce toxických organofosfátů jsou detekční trubičky s peletami z mikrokrystalické celulosy s imobilizovanou acetylcholinesterasou, kterými je analyzovaný vzduch prosáván. Detekce je založena na kolorimetrické Ellmanově reakci. Experimentální práce se zabývá využitím metod farmaceutické technologie pro přípravu nových variant pelet pro detekci inhibitorů acetylcholinesterasy s 20% a 50% obsahem anorganických plniv (oxid hlinitý, kaolin, koloidní oxid křemičitý, nalsit) metodou extruze/sferonizace. Po zhodnocení jakostních parametrů byly pelety naimpregnovány enzymem acetylcholinesterasou a u každé šarže se zkoušela aktivita a inhibice pelet Ellmanovým činidlem. Vhodnou náplní detekčních trubiček se jevily pelety bez obsahu anorganického plniva, s obsahem 50 % oxidu hlinitého a s obsahem 20 % koloidního oxidu křemičitého.
Klíčová slova:
pelety • extruze/sferonizace • anorganická plniva • inhibitory acetylcholinesterasy • detekční trubičky
Úvod
Chemické složení ovzduší je ovlivňováno nejen přírodními procesy, ale stále ve větší míře i negativními zásahy člověka, jakými jsou např. průmyslové havárie nebo používání insekticidů v zemědělství. Ve znečištěném ovzduší jsou přítomné složky, které na kratší nebo delší dobu nepříznivě ovlivňují životní prostředí. I přes pokrok v analytické instrumentaci si svoje místo v systému technických prostředků chemického průzkumu a kontroly zachovávají takové, které jsou založeny na určité (bio)chemické reakci a které relativně rychle a citlivě určí přítomnost např. inhibitorů acetylcholinesterasy v extrémních polních podmínkách nezaškolenou obsluhou1). Takovýmto vhodným analytickým systémem jsou detekční trubičky.
Vývoj detekčních trubiček začal v roce 1934, kdy německá firma Dräger vyvinula analytickou soupravu (DS-Gerät) na bázi tzv. Drägerovy-Schröterovy trubičky pro detekci yperitu. Detektory tohoto typu prošly v následujících desetiletích značným rozvojem, který se dosud nezastavil. Detekční trubičky lze definovat jako uzavřené, většinou skleněné trubice plněné tuhým sorbentem nasyceným analytickými činidly, které se nejprve na obou koncích rozbijí a poté se jimi prosává kontrolovaný vzduch. Analytická činidla mohou být i vpravena do trubiček obvykle ve formě roztoku v zatavené ampulce1, 2). Jako náplně do detekčních trubiček k adsorpci plynů a par a jako nosič chromogenních činidel nebo detekčních roztoků se používají nejrůznější pevné, zrněné adsorbenty. Průběh detekce je ovlivněn použitým materiálem, způsobem jeho uložení a velikostí a nepravidelností zrn. Nejpoužívanějšími materiály jsou silikagel, drcené sklo, celulosa, pemza, skelná vata, porcelán, zeolity, aktivované hlinky, diatomit aj. Tyto materiály nesmí výrazněji měnit své fyzikální a chemické vlastnosti při průchodu vzduchu a vodní páry a musí být inertní i vůči materiálu trubice2).
Reakce, které probíhají v detekčních trubičkách, musí být doprovázené zřetelnou změnou, proto se využívá zejména barevných reakcí. Mohou se použít neutralizační, oxidačně-redukční, srážecí, komplexotvorné reakce nebo reakce organických činidel. Speciálním případem je využití biochemických reakcí. Reakce, jejichž výsledkem je obvykle vznik kyselin, thiolů nebo jiných produktů, které se v další fázi prokazují barevnými reakcemi1, 2), využívají schopnosti organofosfátů a karbamátů již ve velmi malých množstvích inhibovat hydrolytickou účinnost cholinesteras. Citlivost cholinesterasové reakce je velmi vysoká. Detekční limit bývá v závislosti na druhu inhibitoru 1 ×. 10-5 až 1 .× 10-7 mg/ml, na rozdíl od běžných chemických metod, jejichž citlivost se pohybuje v rozmezí 1 ×. 10-4 až 1 .× 10-2 mg/ml3). Optimální citlivost a rychlost reakce jsou dalšími požadavky, na které se klade při konstrukci detekčních trubiček velký důraz.
Nejčastěji využívanou kolorimetrickou metodou v běžné praxi je tzv. Ellmanova metoda (obr. 1). Princip metody je založen na hydrolýze acylthiocholinu. Jestliže nejsou inhibitory acetylcholinesterasy přítomny, substrát acetylthiocholin je cholinesterasou hydrolyzován za vzniku thiocholinu a kyseliny octové. Přítomnost thiocholinu se detekuje reakcí s kyselinou 5,5’-dithiobis-2-nitrobenzoovou (Ellmanovo činidlo) tím, že po reakci s thiocholinem dochází k uvolnění 5-merkapto-2-nitrobenzoátového aniontu, který se projevuje vznikem žlutého zbarvení měřitelného spektrofotometricky při 412 nm. Jestliže jsou inhibitory acetylcholinesterasy přítomny, cholinesterasa je inhibována a k hydrolýze acylthiocholinu nedochází. Ke změně zbarvení nedochází, reakční směs zůstává bílá1, 3, 4).
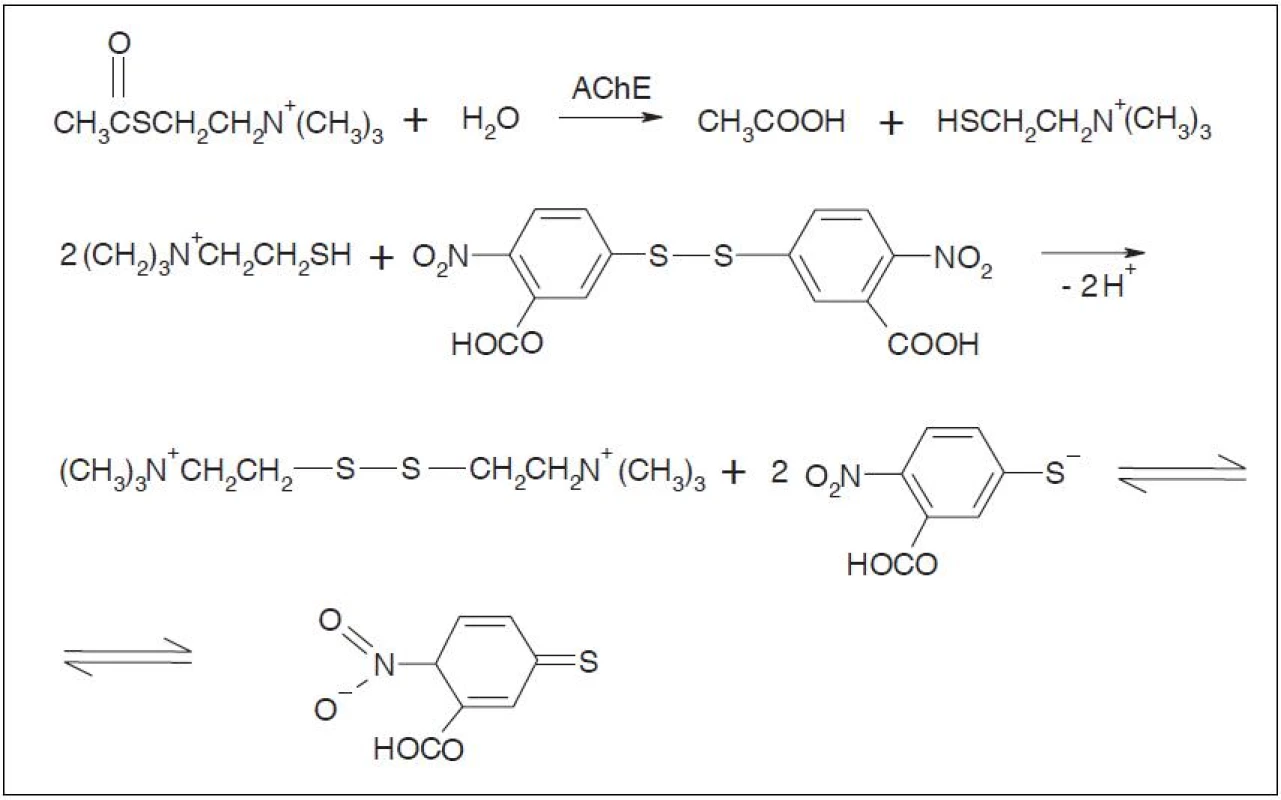
Prezentovaná experimentální práce se zabývá využitím metod farmaceutické technologie pro přípravu a hodnocení nových variant pelet s anorganickými plnivy pro detekci inhibitorů acetylcholinesterasy detekčními trubičkami. Detekce je založena na kolorimetrické Ellmanově reakci, která probíhá po kontaktu Ellmanova činidla s peletami, na nichž je imobilizovaná acetylcholinesterasa, pokud nejsou inhibitory acetylcholinesterasy přítomny.
Pokusná část
Materiál
Na přípravu pelet se použila mikrokrystalická celulosa – Avicel PH101 a Avicel RC 581 (FMC BioPolymer, Irsko), laktosa – 100 MESH (DMV International, Nizozemí), povidon – Kollidon 90 (BASF, Německo), oxid hlinitý, kaolin a oxid křemičitý – 35–60 MESH (všechno Sigma-Aldrich, USA), nalsit (Slovnaft VÚRUP, Slovensko) a čištěná voda. K impregnaci připravených pelet se použil dihydrogenfosforečnan draselný, hydrogenfosforečnan sodný dihydrát a dextran (všechno Sigma-Aldrich, USA), minerální voda Magnesia, upravená tkáň nucleus caudatus (Oritest, ČR) a Slovasol S-10 (Slovchema, Slovensko). Ke kontrole aktivity a inhibice naimpregnovaných pelet se použil tetraboritan sodný dekahydrát, kyselina boritá a isopropylalkohol (všechno Dr. Kulich Pharma, ČR), skleněné kuličky naimpregnované Ellmanovým roztokem a roztokem acetylthiocholinjodidu (součást detekčních trubiček) a fysostigmin (Sigma-Aldrich, USA).
Příprava pelet metodou extruze-sferonizace
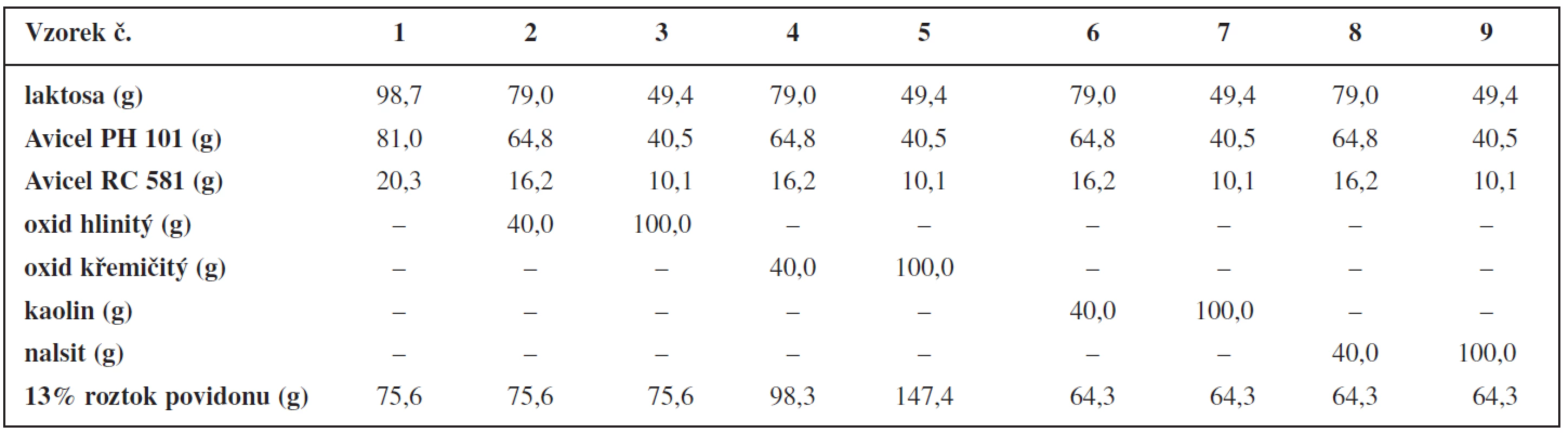
200 g práškové směsi složené z mikrokrystalických celulos, laktosy a případně anorganického plniva se homogenizovalo ve vysokoobrátkovém mixeru (Tefal Kaleo, Francie) při rychlosti 1000 otáček za minutu po dobu 5 minut. Ve stejném zařízení byla tato směs vlhčena 13% roztokem povidonu rychlostí 70 ml/min. Zvlhčená hmota se vpravila do jednošnekového axiálního extruderu Pharmex 35T (Wyss & Probst Eng., Švýcarsko) s přepážkou, jejíž průměr otvorů činil 1,25 mm a tloušťka 1,00 mm. Extruze při rychlosti 110 otáček za minutu probíhala 10 minut. Extrudát se zachytával do misky a umístil na běžící sferonizační talíř sferonizeru Pharmex 35T (Wyss & Probst Eng., Švýcarsko) s průměrem 23 cm a se šrafovaným vzorem – mřížky velikosti 1,0 mm a vzdálené od sebe 2,0 mm. Rychlost sferonizace byla 1000 otáček za minutu, doba 5 minut. Vzniklé pelety se sušily v horkovzdušné sušárně Horo (dr. Ing. A. Hofmann, Německo) při teplotě 60 °C po dobu 20 hodin. Složení jednotlivých vzorků pelet uvádí tabulka 1.
Hodnocení fyzikálních a mechanických vlastností připravených pelet
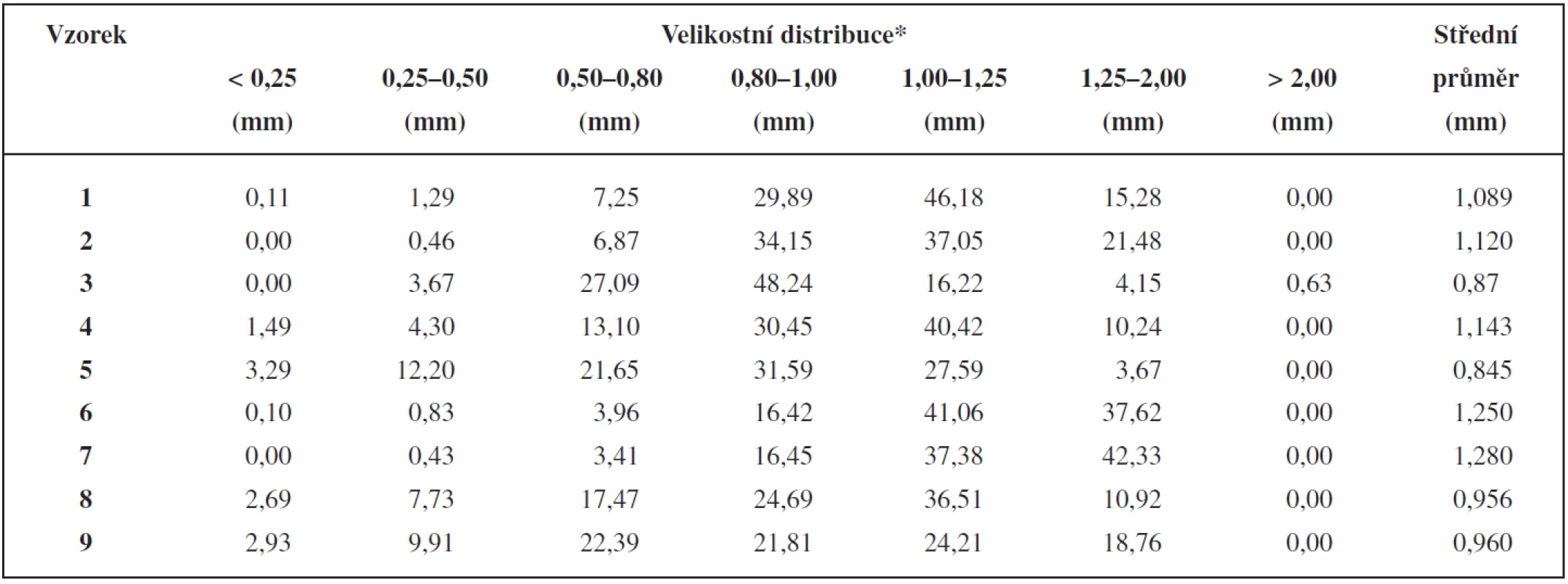
U peletových vzorků se hodnotila distribuce velikosti částic a k dalšímu hodnocení se použila frakce pelet o průměru částic 0,8–1,25 mm, která byla z hlediska velikosti optimální jako náplň detekčních trubiček. Z jakostních parametrů se sledovaly: sypná a setřesná hustota, Hausnerův poměr, tvar (kulatost), pevnost, oděr a hustota pelet.
Distribuce velikosti částic pelet se hodnotila sítovou analýzou (přístroj pro sítovou analýzu, Retsch GmbH & Co. KG, Německo) se síty o velikosti ok 0,25; 0,50; 0,80; 1,00; 1,25; 2,00 mm. Z naměřených hodnot se vypočítal střední průměr d podle vztahu:
kde xi udává aritmetický průměr velikosti ok horního a dolního síta (mm) a di je hmotnostní zastoupení částic stejné velikosti i ve vzorku (%)5).
Sypná a setřesná hustota se stanovovaly v přístroji ERWEKA (typ SVM 102, ERWEKA GmbH, Německo) třikrát, počet sklepnutí byl 12506). Z hodnot setřesné (ρ1250) a sypné (ρ0) hustoty se vypočetl Hausnerův poměr (HR) dle vzorce:
Kulatost pelet S, jako parametr tvaru částic, se vypočítala z povrchu A (mm2) a obvodu p (mm) stanoveného obrazovou analýzou minimálně 200 ks pelet (Leco IA 32, Leco Instruments, USA) podle vzorce7):
Pevnost pelet se měřila v čelisťovém přístroji (C5 Pellet Hardness and Compression Tester, Engineering System, Velká Británie). Zjišťovala se hodnota destrukční síly, která jednotlivé pelety rozdrtila (N). Hodnotilo se 10 kusů pelet, zaznamenala se průměrná pevnost se směrodatnou odchylkou8). Mechanická odolnost pelet v oděru se stanovovala třikrát v přístroji ERWEKA (typ TAR 10, ERWEKA GmbH, Německo) s upraveným bubínkem z nerezové oceli z důvodu vyloučení ovlivnění výsledků zkoušky statickou elektřinou. Hodnotilo se 10,0 g pelet zbavených prachových částic, přesně odvážených, které se v bubínku otáčely spolu s 200 kusů skleněných kuliček o průměru 4 mm po dobu 10 minut při 20 otáček/min. Za oděr se považovaly částice menší než 500 μm. Hodnota oděru, hmotnostního úbytku, se vyjádřila v % 8). Hustota pelet se měřila heliovým pyknometrem (Pycnomatic – ATC, Porotec GmbH, SRN). Objem vzorku o známé hmotnosti se stanovil po naplnění nádobky pyknometru plynem pod tlakem podle vzorce:
kde Vp je objem vzorku, Vc je objem nádobky, Vr je srovnávací objem, Pi je počáteční tlak, Pr je srovnávací tlak a Pf je konečný tlak6). Hustota pelet ρp (g.cm-3) je dána rovnicí:
mp je hmotnost pelet v pyknometru (g), Vp je objem pelet v pyknometru (cm3). Výsledky byly průměrem tří stanovení.mp
Impregnace připravených pelet
Impregnace probíhala tak, že se 150 g připravených pelet na 15 min ponořilo do 100 ml impregnačního roztoku. Poté se směs přenesla na odkapávací síta a přebytečný roztok se nechal cca po dobu 1 hod. odtékat. Impregnační roztok se získal smícháním 50 ml roztoku, který vznikl rozpuštěním 0,095 g KH2PO4, 1,068 g Na2HPO4 . 2H2O a 5 g dextranu v minerální vodě Magnesia a 50 ml roztoku, který obsahoval 60 g upravené tkáně nucleus caudatus a 60 g Slovasolu S-10 v 6% roztoku dextranu pro infuzi.
Po odkapání přebytečného roztoku se naimpregnované pelety přenesly do sušárny na sušící plochy vyložené filtračním papírem. Rozložily se do vrstev asi 1 cm silných a sušily se za občasného promíchání (s frekvencí asi jedenkrát za hodinu) při 36 ± 5 oC a nuceném oběhu vzduchu po dobu 20 ± 5 hod. Vysušené pelety se přenesly do vhodné plastové nádoby o objemu 0,5–1 l a přelily se 0,3 l minerální vody Magnesia. Směs se promíchávala po dobu 1 – 2 min. Po 5 min se pelety přenesly na odkapávací síta a znovu se sušily za stejných podmínek jako po impregnaci. Naimpregnované pelety se následně nasypaly do filtračního papírového sáčku a vysoušely se v hermeticky uzavřeném sudu nad silikagelem po dobu nejméně tří dnů. Kontrola účinnosti sušení a stavu vysoušedla se v průběhu dosoušení prováděla vizuálně kontrolou zbarvení značeného silikagelu. Takto naimpregnované pelety se uchovávaly v plastových uzavřených nádobách. Relativní vlhkost atmosféry při tomto kroku nesměla překročit 15 %.
Kontrola aktivity naimpregnovaných pelet a stanovení minimální inhibiční koncentrace
Příprava pracovních roztoků
Tlumivý roztok pH 7,09: Tlumivý roztok se připravil smícháním 6 ml vodného roztoku tetraboritanu sodného o koncentraci 19,108 g/l a 94 ml vodného roztoku kyseliny borité o koncentraci 12,404 g/l.
Roztok pro Ellmanovu reakci: Do malé kádinky se nasypala cca 10 ml vrstva skleněných kuliček naimpregnovaných Ellmanovým roztokem a roztokem acetylthiocholinjodidu a přidal se dvakrát větší objem tlumivého roztoku, než byla výška vrstvy skleněných kuliček. Směs se protřepala a nechala 10 min stát.
Roztok fysostigminu: Pro přípravu zkušebních roztoků fysostigminu se nejprve připravil zásobní roztok fysostigminu v isopropanolu o koncentraci 1 mg/ml. Z tohoto zásobního roztoku se ředěním vodou vytvořily zkušební roztoky o koncentraci 0,2 μg, 0,5 μg, 1 μg, 2 μg, 4 μg, 6 μg a 8 μg /ml.
Kontrola aktivity naimpregnovaných pelet
Skleněné trubičky s průměrem 0,5 cm se naplnily naimpregnovanými peletami do výše asi 0,5 cm. K vrstvě pelet se přidala voda v takovém objemu, aby byly pelety smočené. Voda nesměla přebývat. Po 2 min se přidalo stejné množství roztoku pro Ellmanovu reakci a organolepticky se pozorovala změna zbarvení pelet z bílé do žluté v čase 0 s, 30 s, 60 s, 90 s a 120 s, 180 s, 240 s a 360 s.
Stanovení minimální inhibiční koncentrace
Skleněné trubičky s průměrem 0,5 cm se naplnily naimpregnovanými peletami do výše asi 0,5 cm. K vrstvě pelet se přidal roztok fysostigminu o koncentraci 2 μg/ml v takovém objemu, aby byly pelety smočené. Roztok nesměl přebývat. Po 2 min se přidal roztok pro Ellmanovu reakci a organolepticky se pozoroval vznik žlutého zbarvení v čase 0 s, 30 s, 60 s, 90 s a 120 s. V případě dostatečné inhibice zůstaly pelety po dobu 2 min bílé a koncentrace roztoku fysostigminu se snižovala až do zjištění minimální inhibiční koncentrace roztoku fysostigminu. V případě nedostatečné inhibice se pelety během 2 min zbarvily žlutě a koncentrace roztoku fysostigminu se zvyšovala.
Výsledky a diskuze
Cílem experimentu bylo připravit metodou extruze a sferonizace pelety použitelné jako sorbent v detekčních trubičkách pro inhibitory acetylcholinesterasy a zjistit, jak přídavek anorganického plniva ovlivňuje vlastnosti vyrobených pelet z hlediska zamýšleného účelu. Mezi požadavky pro tento typ detekčního systému patřila vhodná velikost pelet (0,8–1,3 mm), dobré tokové vlastnosti, pravidelný, kulatý tvar, dostatečná mechanická odolnost, dostatečná aktivita a citlivost naimpregnované acetylcholinesterasy a možnost organolepticky hodnotitelného barevného přechodu bílá – žlutá.
Velikostní distribuci připravených pelety ukazuje tabulka 2. Množství přidaného vlhčiva u jednotlivých typů anorganických plniv (viz tab. 1) je v souladu s obecně platným předpokladem, že při použití rozpustnějšího plniva je k tvorbě pelet o dané velikosti zapotřebí menšího množství vlhčiva než v případě nerozpustných plniv, a že větší podíl práškových mikronizovaných částic vyžaduje díky svému velkému povrchu větší množství vlhčiva. Například k tvorbě pelet při použití ve vodě nerozpustného CaHPO4 je potřeba většího množství vlhčiva než při použití ve vodě rozpustné laktosy. Při použití škrobu, který vlivem vlhčiva bobtná, je potřeba ještě většího množství vlhčiva než v případě CaHPO4 9, 10).
Tokové vlastnosti připravených pelet se hodnotily určením sypné a setřesné hustoty a následným vypočítáním Hausnerova poměru. Hodnoty Hausnerova poměru všech připravených šarží s výjimkou šarže 3 vykazovaly podle tabulky hodnot Hausnerova poměru z ČL 2009 výborné tokové vlastnosti, šarže 3 dobré tokové vlastnosti. Všechny vyrobené šarže byly tedy z hlediska tokových vlastností vhodné pro další zpracování (plnění do detekčních trubiček).
Tokové vlastnosti částic úzce souvisí s jejich kulatostí, která se zjišťovala metodou obrazové analýzy (tab. 3). Naměřené hodnoty kulatosti byly vyšší než 0,8, a proto kulatost pelet všech vyrobených šarží byla vyhovující11, 12). Kulatost se zvyšovala se zvyšujícím se obsahem anorganického plniva. K vyšší kulatosti vedla zřejmě příprava těžších pelet, na které působila větší odstředivá síla při sferonizaci, protože pyknometrická hustota se zvyšovala s rostoucím obsahem anorganických plniv (tab. 3). Že kulatost souvisí s hustotou pelet, potvrdili i jiní autoři, kteří zjistili pravidelnější tvar u těžších pelet s větším obsahem BaSO4 oproti peletám obsahujícím lehčí CaHPO4 13).
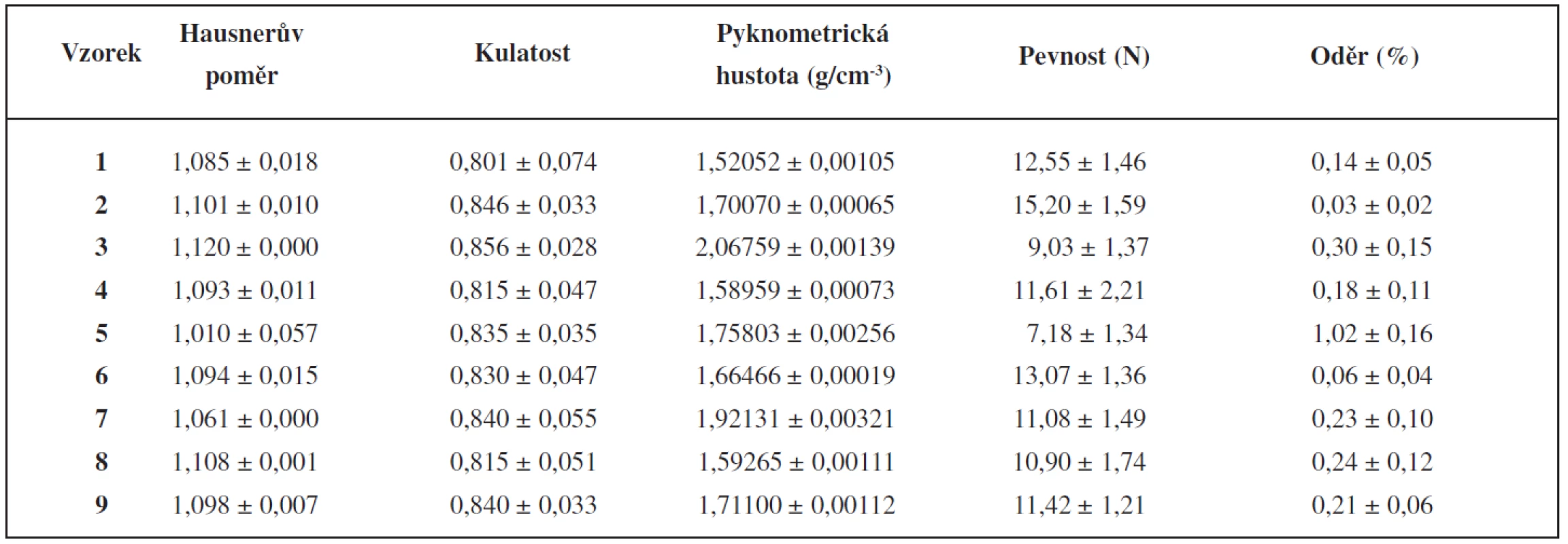
Mechanické vlastnosti pelet (pevnost, oděr) jsou důležité z hlediska další manipulace s nimi. Pevnost všech pelet byla velmi dobrá, její průměrné hodnoty se pohybovaly v intervalu 7,18–15,20 N (tab. 3). Zvyšování množství anorganických plniv v práškové směsi z 20 na 50 % pevnost pelet snižovalo, v jednom případě výrazně neměnilo, jak je popisováno i v literatuře9, 14). Vyšší pevnost pelet s ve vodě rozpustnými plnivy se vysvětluje jejich nižší pórovitostí. Rozpustná plniva se během přípravy pelet do určité míry rozpouští a následně během procesu sušení dochází k jejich rekrystalizaci vedoucí k nižší pórovitosti a větší pevnosti13). Nejnižší pevnost měly pelety s vyšším obsahem mikronizovaného oxidu křemičitého (šarže 5). Oděr pelet se má podle literatury pohybovat do 1,7 %15). Z hlediska využití připravených pelet bylo hodnocení oděru důležité proto, aby během manipulace s peletami nedošlo k jejich rozpadu a k tvorbě velmi nežádoucích malých částic. Hodnoty oděru byly vyhovující, pohybovaly se v rozmezí 0,03–1,02 % (tab. 3) a korelovaly s pevností pelet.
Kontrola aktivity a stanovení minimální inhibiční koncentrace naimpregnovaných pelet se nezkoušely u pelet s obsahem nalsitu, protože vzhledem k jejich výslednému šedému zbarvení nebyl barevný přechod bílá – žlutá dostatečně patrný. Naopak přídavek oxidu křemičitého způsobil vznik pelet s výrazně bělejším zbarvením v porovnání s ostatními vzorky, a tedy barevný přechod bílá – žlutá byl na těchto peletách patrný lépe.
Kontrola aktivity se zakládala na Ellmanově reakci. V případě dostatečné aktivity na peletách imobilizované acetylcholinesterasy se pelety zbarvily žlutě do 2 minut od přidání roztoku pro Ellmanovu reakci16). Tomuto požadavku vyhovovaly šarže bez přídavku anorganického plniva a šarže s 20 a 50% obsahem oxidu křemičitého a s 50% obsahem oxidu hlinitého (tab. 4). Ostatní šarže vykazovaly nízkou aktivitu. Z časů dosažení žlutého zbarvení se zjistilo, že přidaná anorganická plniva aktivitu enzymu snižovala.
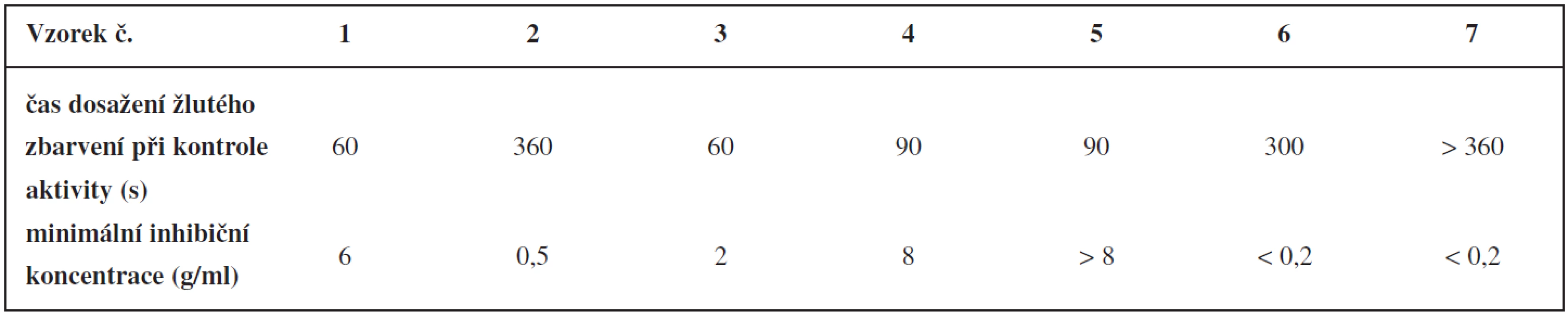
Zkoušky inhibice pelet se dělaly s použitím fysostigminu, který se ve formě roztoku přidal k testovaným peletám. Po 2 minutách se přidal roztok pro Ellmanovu reakci. Organolepticky se zjišťovala minimální koncentrace fysostigminu, která je schopná do 2 minut inhibovat acetylcholinesterasu, tedy po dobu 2 minut inhibovat barevný přechod z bílé do žluté. Maximálně se testovalo s koncentrací fysostigminu 8 μg/ml, protože vyšší koncentrace znamenala nedostatečnou citlivost detekce fysostigminu ve vodě16). Ze šarží vykazujících dostatečnou aktivitu acetylcholinesterasy byla nejnižší inhibiční koncentrace fysostigminu zjištěna u šarže s obsahem 50 % oxidu hlinitého.
Závěr
Metodou extruze/sferonizace se připravily šarže pelet bez a s obsahem anorganických plniv. Všechny připravené šarže měly vhodné fyzikálně-mechanické vlastnosti pro použití jako náplň do detekčních trubiček. Požadavek dostatečné aktivity a citlivosti naimpregnované acetylcholinesterasy splnil vzorek bez přídavku anorganických plniv a s přídavkem 50 % oxidu hlinitého a s přídavkem 20 % oxidu křemičitého. Pelety s obsahem 20 % oxidu křemičitého byly výrazně bělejší, a tedy vhodnější k organoleptickému sledování barevného přechodu bílá – žlutá. Pelety s obsahem 50 % oxidu hlinitého vykazovaly nejvyšší citlivost k detekci inhibitorů acetylcholinesterasy.
Střet zájmů: Experiment byl vypracován ve spolupráci s firmou Oritest spol s r.o.
Adresa pro korespondenci:
doc. PharmDr. et Mgr. David Vetchý Ph.D.
Ústav technologie léků, Farmaceutická fakulta,
Veterinární a farmaceutická univerzita
Palackého třída 1/3, 612 42 Brno
e-mail: vetchy@email.cz
Sources
1. Pitschmann V., Halámek E., Kobliha Z., Tušarová I. Výzkum detekčních trubiček pro bojové chemické látky v České republice. Chem. Listy 2011; 105, 334–345.
2. Pitschmann V. Analýza toxických látek detekčními trubičkami. 2. vyd. Drahelčice: Econt Consulting 2005; 194 s.
3. Halámek E., Kobliha Z., Pitschmann V. Analýza bojových chemických látek. 1. vyd. Vyškov: Univerzita obrany Brno, Ústav ochrany proti zbraním hromadného ničení 2007; 155 s.
4. Žďárová-Karasová J., Kuča K., Jun D., Bajgar J. Užití Ellmanovy metody pro stanovení aktivit cholinesteras při in vivo hodnocení účinků reaktivátorů. Chem. Listy 2010; 104, 46–50.
5. Hasznos L., Langer I., Gyamathy M. Some factors influencing pellet characteristics made by an extrusion/spheronisation process Part I.: Effects on size characteristics and moisture content decrease of pellets. Drug Dev. Ind. Pharm. 1992; 18, 409–412.
6. Kolektiv autorů: Český lékopis 2009, Praha: Grada Publishing 2009.
7. Sienkiewicz G., Pereira R., Rudnic E. M. Spheronization of theophylline-avicel combinations using a fluidized-bed rotogranulation technique. Drug Dev. Ind. Pharm. 1997; 23, 173–177.
8. Krejčová K., Rabišková M., Vetchý D., Polášek E., Tomášek V., Prokopová A. The influence of drug solubility and particle size on the pellet formulation in a rotoprocessor. Drug Dev. Ind. Pharm. 2006; 32, 585–593.
9. Thommes M., Kleinebudde P. Use of kappa-carrageenan as alternative pelletisation aid to microcrystalline cellulose in extrusion/ spheronisation. I. Influence of type and fraction of filler. Eur. J. Pharm. Biopharm. 2006; 63, 59–67.
10. Ghanam D., Hassan I., Kleinebudde P. Compression behaviour of kappa-carrageenan pellets. Int. J. Pharm. 2010; 390, 117–127.
11. Deasy P. B., Law M. F. L. Use of extrusion-spheronization to develop an improved oral dosage form of indometacin. Int. J. Pharm. 1997; 148, 201–209.
12. Law M. F. L., Deasy P. B. Use of hydrophilic polymers with microcrystalline cellulose to improve extrusion-spheronization. Eur. J. Pharm. Biopharm. 1998; 45, 57–65.
13. Sousa J. J., Sousa A., Podczeck F., Newton J. M. Factors influencing the physical characteristics of pellets obtained by extrusion-spheronization. Int. J. Pharm. 2002; 232, 91–106.
14. Costa F. O., Pais A. A. C. C., Sousa J. J. S. Analysis of formulation effects in the dissolution of ibuprofen pellets. Int. J. Pharm. 2004; 270, 9–19.
15. Vertommen J., Kinget R. The influence of five selected processing and formulation variables on the particle size, particle size distribution, and friability of pellets produced in a rotary processor. Drug Dev. Ind. Pharm. 1997; 23, 39–46.
16. http://www.oritest-group.com (14. 8. 2012)
Labels
Pharmacy Clinical pharmacologyArticle was published in
Czech and Slovak Pharmacy

2012 Issue 5
-
All articles in this issue
- Rod Bergenia – obsahové látky a biologická aktivita
- Takrin a jeho deriváty v terapii Alzheimerovy choroby
- Významné toxické a nežádoucí účinky léků u zvířat z pohledu lékárníka
- Metody farmaceutické technologie v přípravě pelet pro detekci inhibitorů acetylcholinesterasy
- Příspěvek k vývoji reklamy ve farmacii II* Historický vývoj regulace reklamy léčivých přípravků
- Ke vzniku československého lékopisu
- 76th Prague Meeting on Macromolecules
- Studium směsného suchého pojiva složeného z mikrokrystalické celulosy a glycerol monostearátu
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Významné toxické a nežádoucí účinky léků u zvířat z pohledu lékárníka
- Takrin a jeho deriváty v terapii Alzheimerovy choroby
- Metody farmaceutické technologie v přípravě pelet pro detekci inhibitorů acetylcholinesterasy
- Rod Bergenia – obsahové látky a biologická aktivita





