Standardní receptura pro přípravu léčivých přípravků v lékárnách
VI. Sbírka Neues Rezeptur-Formularium*
Standard prescriptions for extemporaneously produced medicinal preparations in pharmacies
VI. Collection Neues Rezeptur-Formularium
The paper deals with the content of the collection Neues Rezeptur-Formularium (NRF) and some prescriptions potentially usable in innovations and standardization of prescriptions for extemporaneously produced medicinal preparations in pharmacies in the Czech Republic. Another possible use of NRF in the Czech Republic consists in the revision of the National Section of the Czech Pharmacopoeia.
Keywords:
medicinal preparations • extemporaneous preparation in pharmacies • standard prescriptions • Neues Rezeptur-Formularium • Czech Pharmacopoeia
:
Jan Šubert; Jozef Kolář
:
Ústav aplikované farmacie, Brno
; Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta
:
Čes. slov. Farm., 2013; 62, 207-211
:
Review Articles
*Část V: Čes. slov. Farm. 2012; 61, 159–162.
Příspěvek se zabývá obsahem sbírky Neues Rezeptur-Formularium (NRF) a některými recepty potenciálně využitelnými při inovacích a standardizaci receptury léčivých přípravků připravovaných individuálně v lékárnách v České republice. Další možné využití NRF v České republice je při revizi Národní části Českého lékopisu.
Klíčová slova:
léčivé přípravky • příprava v lékárnách • standardní receptura • Neues Rezeptur-Formularium • Český lékopis
Úvod
Standardizace léčivých přípravků připravovaných v lékárnách v České republice (ČR) byla po vydání sbírky Praescriptiones Pharmaceuticae v roce 19721) a úvodní části Českého farmaceutického kodexu v roce 19932) zajišťována na úrovni oprávněných autorit jen nepočetnými a ne vždy plně aktuálními3) lékopisnými články. Odlišná situace je v některých zemích Evropské unie. Příkladem může být od roku 1972 vydávaná4) a každoročně systémem výměny listů aktualizovaná sbírka receptur Neues Rezeptur-Formularium (dále NRF), která ukazuje stav a míru standardizace přípravy léčivých přípravků v lékárnách v Německu. Přes více než čtyřicetiletou historii jde o zdroj informací v bývalé ČSSR i v nynější ČR téměř neznámý a dosud nedostatečně využívaný jak v lékárenské praxi, tak i na úrovni Lékopisné komise ČR. Záměrem našeho příspěvku je přiblížení obsahu aktuálního vydání NRF včetně doplňků z roku 20125), zejména v částech nadějných a perspektivních k využití v České republice. To by mohlo přispět i k zahájení standardizace dokumentace technologických aktivit a vypracování standardních operačních postupů přípravy v lékárnách v České republice po linii Lékárenské sekce Lékopisné komise ČR6), která na sebe po letech otálení už snad nenechá dlouho čekat.
Neues Rezeptur-Formularium
NRF je dosud rozděleno do tří svazků, z nichž první je věnován obecným otázkám (je v něm ale i obsah a registr) a další dva svazky pak vlastním recepturám. V současnosti5) je v NRF 241 receptur na léčivé přípravky a 31 dalších na přípravky a poloprodukty k dalšímu zpracování. Z prvního svazku NRF (ve kterém jsou mimo četné jiné informace i důvody vyřazení některých receptur) je třeba vyzvednout zejména údaje o stabilitě jednotlivých přípravků a poloproduktů NRF připravovaných do zásoby rozplněných do vhodných obalů a uchovávaných za předepsané teploty. Ty jsou alternativně uváděny i jako doba použitelnosti od prvního otevření obalu, které jsou obvykle kratší a jsou používány k označování přípravků při jejich výdeji. V příslušné tabulce NRF je souběžně uváděno také vhodné protimikrobní zajištění přípravku, či odůvodnění, proč není v daném případě potřebné. Dále jsou pravidelně uváděny změny v jakosti přípravku zapřičiňující jeho omezenou stabilitu (oxidace, fyzikální nestabilita, hydrolýza a různé další). Za zmínku stojí také délka v NRF uváděných údajů o stabilitě jednotlivých přípravků, která se (včetně doby do prvního otevření balení) nezřídka pohybuje v letech (zatímco v ČR jsou podle pokynu Státního ústavu pro kontrolu léčiv7) maximální doporučené doby použitelnosti v lékárnách připravovaných přípravků nejvýše v měsících). Receptury na léčivé přípravky v dalších svazcích NRF jsou uspořádány podle indikací do 29 skupin s různou četností, mezi nimiž jednoznačně dominují v souladu se současným uplatněním přípravků připravovaných v lékárnách dermatologika. Rozdělení receptur do skupin a jejich zastoupení v jednotlivých skupinách je následující: antirevmatika (1), analgetika (6), psychoanaleptika (1), expektorancia, antitusika (7), proktologika, antihemoroidalia (7), léčiva ovlivňující žaludek a střeva (8), léčiva ústní dutiny a hltanu (12), rhinologika (4), urologika (3), dermatologika, kožní antiseptika (108), diagnostika (4), oftalmologika (23), otologika (5), sedativa (4), vitaminy (1), antidota (8), minerální přípravky (2), antibiotika (4), psychofarmaka, neurologika (7), gynekologika (4), diuretika (4), přípravky pro stomatologii (5), léčiva štítné žlázy (1), přípravky k substituční léčbě závislosti na opiátech (3), léčba poruch látkové výměny (1), virostatika (3), imunomodulátory (2), veterinaria (2), glukokortikoidy (1). Četnost receptur v jednotlivých skupinách zřejmě odpovídá uplatnění magistraliter receptury v příslušných indikačních skupinách v Německu a může být pomůckou při budoucí standardizaci magistraliter receptury v České republice. V jednotlivých skupinách přípravků nacházíme receptury považované i v České republice za klasické. Příkladem mohou být mukosolventní mixtura ČFK 12) nebo suspenze oxidu zinečnatého v oleji, která je v České republice často předepisována8, 9), nebyla však dosud cestou oprávněných autorit standardizována, či salicylované kolodium ČsL 210) obohacené o kyselinu mléčnou. Dále přípravky zavedené do léčebné praxe až mnohem později a přesto i v České republice známé a aktuální (z nich může být příkladem roztok propranolol-hydrochloridu11, 12)). V některých případech představují články NRF alternativu lékové formy přípravku dostupného v České republice z průmyslové produkce (např. čípky obsahující paracetamol a kodein a HVLP Talvosilen tablety anebo Korylan tablety, nebo tekutý přípravek obsahující ribavirin a HVLP potahované tablety, resp. tvrdé tobolky Copegus a Rebetol). Zejména však NRF obsahuje přípravky v České republice dosud neznámé (či prakticky neznámé), včetně přípravků obsahujících látky k přípravě léčivých přípravků v lékárně vyhláškou č. 85/2008 Sb. nepovolené (cyklosporin, dinatrium-eosin, dronabinol, merkaptamin-hydrochlorid, oseltamivir-fosfát, thalidomid a další). Vysokou informační hodnotu NRF mimo rozsah a obsah samotných článků vytváří i jejich standardní uspořádání, které zahrnuje mimo složení a postup přípravy také popis balení, pokyny pro označení přípravku, údaje o jeho účinku a indikacích, použití a dávkování, možných vedlejších účincích, podrobnější farmaceutické informace (chemické a fyzikální vlastnosti, příprava, stabilita, historie apod.) a nakonec i odkazy na odbornou literaturu, ze které byly údaje čerpány. Další informace může uživatel NRF získat na webu http://dacnrf.pharmazeutische-zeitung.de/index.php?id=35 pomocí přístupového kódu. V současnosti je v této databázi zpracováno z pohledu receptury 553 hesel.
Příklady receptur z NRF
Ve skupině přípravků s analgetickým účinkem jsou mimo výše zmíněné čípky obsahující paracetamol a kodein a další přípravky, tekuté přípravky k perorální aplikaci s obsahem 1 % nebo 0,2 % morfin-hydrochloridu, anebo 5 % naproxenu (ten má použití i jako antiflogistikum a antirevmatikum). Doba použitelnosti těchto přípravků je (zde i dále v textu vždy jako doba od prvního otevření obalu) 2 týdny (uchovávání ≤ 8 °C, přípravek není konzervován), 6 měsíců a 4 týdny, u čípků s obsahem paracetamolu a kodeinu 1 rok. Z přípravků k lokální aplikaci jsou v NRF uvedeny krém a sprej s obsahem 50 % dimethylsulfoxidu, tato látka však donedávna nebyla v České republice pro magistraliter recepturu běžně k dispozici9).
Ve skupině expektorancií a antitusik NRF upoutává přípravek známý v České republice pod názvem mukosolventní mixtura, Jeho složení je analogické složení přípravku podle ČFK 12).
Z proktologických a antihemoroidálních přípravků pak v České republice zatím prakticky neznámý hydrofilní (celulosový) rektální gel anebo hydrofilní rektální krém obsahující 2 % diltiazem-hydrochloridu s dobou použitelnosti (≤ 8 °C) 6 měsíců k léčbě análních fisur (diltiazem je v ČR používán perorálně ve zcela odlišných indikacích). Obdobně tomu je s hydrofilním rektálním krémem obsahujícím 1 % isosorbid-dinitrátu anebo 0,2 % glycerol-trinitrátu (oba přípravky mají dobu použitelnosti 6 měsíců).
Mezi přípravky k aplikaci do dutiny ústní a hltanu je v NRF zařazena směs tinktur, a to myrhové tinktury s nátržníkovou tinkturou anebo s ratanhovou tinkturou (doba použitelnosti při > 15 °C 6 měsíců). Obdobná směs je v ČR oblíbena jako směs myrhové, ratanhové a duběnkové tinktury (která může obsahovat další složky)13). Dále ústní voda obsahující 0,1 % nebo 0,2 % chlorhexidin-diglukonátu s použitelností 6 měsíců, kterou lze jako 0,2 % ve složení bez dalších komponent nalézt i ve sbírce13), přestože je v České republice dostupný HVLP Corsodyl. Další přípravek, kterým je 5% roztok dexpanthenolu k výplachům úst (doba použitelnosti 6 měsíců), je k využití v České republice z NRF 13) přebrán v kompletním složení. Roztok k vytírání úst s kyselinou citronovou a glycerolem (doba použitelnosti 6 měsíců), který je v NRF s obsahem 0,5 %/1 %/2 % kyseliny citronové, v13) 1%. Glycerolový roztok jodu, který je v NRF 1,25% nebo 2,5% a obsahuje 0,2 % silice máty peprné (doba použitelnosti 6 měsíců) je v ČR standardizován Českým lékopisem14) jako 1% bez přídavku silice a s vyšším obsahem jodidu draselného. Adhezivní pasta NRF obsahující 0,1 % triamcinolon-acetonidu (použitelnost 3 měsíce) je v ČR předepisována v obdobném složení13), obdobná pasta s betamethason-valerátem (stejně jako řada dalších přípravků uvedených v NRF v této skupině) však v České republice zatím zavedena není. Roztok NRF obsahující 1 % lidokain-hydrochloridu a 5 % dexpanthenolu byl s menší úpravou obsahu glycerolu pro recepturu v České republice již přebrán13), suspenze obsahující hydrokortison-acetát, lidokain-hydrochlorid a dexpanthenol zatím nikoliv.
Ve skupině rhinologik jsou v NRF zařazeny mimo jiné nosní spray a nosní kapky a viskózní nosní spray a nosní kapky s obsahem 0,9 % nebo 1,5 % chloridu sodného. Tyto přípravky nemají v České republice v rámci registrovaných HVLP protějšky.
Perspektivním přípravkem NRF ze skupiny urologik by mohl být sterilní 0,25% roztok oxybutynin-hydrochloridu k intravezikální aplikaci, dále je zde zařazen mimo jiné sterilní izotonický 0,05% nebo 0,1% roztok ethakridin-laktátu pH 8.
Sto osm přípravků z celkového počtu 241 (tedy 45 %) je zařazených v NRF jako dermatologika a kožní antiseptika. To odpovídá současné orientaci přípravy léčivých přípravků v lékárně. Nejčastější lékovou formou této skupiny přípravků NRF jsou krémy (1/3 přípravků), na druhém místě s četností výskytu nepodstatně nižší jsou roztoky, zatímco masti, suspenze, gely a pasty jsou méně časté. Nejčastěji používanými účinnými látkami přípravků NRF pro dermatologii jsou oxid zinečnatý a kyselina salicylová, následují kortikoidy (nejčastěji triamcinolon-acetonid, který je dostupný pro přípravu i lékárnám v ČR11)) a močovina. Řada přípravků z této části NRF má v České republice protějšky v dostupných HVLP obdobného složení, proto nejsou přípravky NRF v dalším probírány a diskutovány systematicky. K zajímavějším z nich lze řadit např. roztoky ethakridin-laktátu. Přestože používání této látky je podle9) na ústupu, v NRF jsou monografie na roztok obsahující 0,05 % nebo 0,1 % ethakridin-laktátu a < 20 % ethanolu (doba použitelnosti 6 měsíců) a na 0,05%, 0,1%, 0,5% anebo 1% sterilní vodný roztok tohoto léčiva (doba použitelnosti 1 týden). V ČR je používán nejčastěji 0,1% vodný roztok9), v Českém lékopisu14) je uveden 0,1% a 1% vodný roztok s maximální doporučenou dobou použitelnosti 3 týdny7). Řadu krémů zahajuje v NRF lipofilní krém obsahující 5 %, 10 %, 20 % nebo 50 % ichthamolu (doba použitelnosti podle obalu 6 měsíců nebo 1 rok), následovaný hydrofilním krémem s obsahem 0,25 %, 0,5 % nebo 1 % hydrokortison-acetátu a hydrofilním anebo lipofilním krémem s 5 % dexpanthenolu, řadě krémů zařazených v NRF však odpovídají v České republice dostupné HVLP obdobného složení. Totéž však nelze konstatovat o 50% suspenzi oxidu zinečnatého v oleji, která v ČR byla a stále je často předepisována. Je zařazena v9), pro doplňování Českého lékopisu však zatím nebyla akceptována. V NRF je tato suspenze v olivovém oleji s dobou použitelnosti 6 měsíců, v jiné monografii NRF jsou součástí suspenze místo oleje střední nasycených triacylglyceroly a 0,5 % magnesium-stearátu, v další variantě tatáž receptura NRF obsahuje navíc nystatin. Z dalších přípravků NRF stojí za zmínku 0,5% roztok fuchsinu ve směsi ethanolu a čištěné vody (doba použitelnosti 6 měsíců), který je (a to už od roku 19965)) výsledkem delšího vývoje a postupných změn složení přípravku známého v České republice pod názvem Castellanův roztok. Česká cesta vývoje složení přípravku vedla opačným směrem a jejím výsledkem je přípravek obsahující původní složky s výjimkou fuchsinu14), přičemž jiný přípravek obsahující fuchsin v ČR standardizován nebyl. Příkladem přípravku NRF obsahujícího močovinu může být 40% pasta k léčbě onychomykóz (doba použitelnosti 6 měsíců nebo 1 rok podle použitého obalu, přípravek je v NRF rovněž ve variantě obsahující 1 % klotrimazolu). Tento přípravek je používán i v ČR, avšak v jiném pastovém základu9, 15). Obdobně tomu je s olejovými roztoky kyseliny salicylové. Ty jsou v ČR předepisovány jako 1% (nebo s jinou koncentrací kyseliny salicylové) ve slunečnicovém oleji, podle9) v olivovém oleji anebo 5% v olivovém a ricinovém oleji, v NRF jsou jako 2%, 5% v oktyldodekanolu, který je stálejší než olej, nebo 10% v ricinovém oleji a oktyldodekanolu (doba použitelnosti 6 měsíců), anebo jako smývatelné s obsahem 2 %, 5 % nebo 10 % kyseliny salicylové a 10 % nebo 15 % lauromakrogolu v oktyldodekanolu. Druhý přípravek je v NRF také ve variantě obsahující 0,1 % triamcinolon-acetonidu, stejně jako další varianta salicylového oleje v NRF, která obsahuje ve vehikulu místo lauromakrogolu 9,9 % isopropylalkoholu. Karbomerový gel NRF s obsahem 0,75 % metronidazolu byl přebrán jako 0,8% s malou úpravou gelového základu do9). Vodné 0,1% a 0,5% roztoky methylrosanilinium-chloridu NRF (doba použitelnosti 6 měsíců) jsou výsledkem tlaku na snižování používaných koncentrací této látky v zahraničí (v Českém lékopisu je nyní 0,5% a 1% roztok14)). Vodné roztoky kyseliny trichloroctové jsou v NRF jako 10%, 20%, 35%, 50% a 65% (doba použitelnosti 4 týdny), v ČR se zatím uplatňují spíše 20–40% gely kyseliny trichloroctové prodávané jako z veřejného zdravotního pojištění nehrazené zdravotnické prostředky k léčbě bradavic a kuřích ok16). Novinkou 2. doplňku NRF z roku 2012 je 0,46% chuťově korigovaný roztok propranolol-hydrochloridu (doba použitelnosti 6 měsíců). Je aktuální i v České republice11, 12) a byla o něm v textu tohoto příspěvku zmínka již dříve. V budoucnosti, podmíněně dostupností příslušných látek pro lékárny, lze v České republice očekávat uplatnění některých přípravků NRF obsahujících methoxsalen, polihexanid nebo triklosan. Přípravky s těmito účinnými látkami (s výjimkou triklosanu v HVLP Oilatum Plus) nejsou v České republice v nabídce HVLP.
K bližšímu srovnání byly ze skupiny monografií NRF na dermatologické léčivé přípravky vybrány tekuté zásypy. Jejich složení podle NRF a ČL je uvedeno v tabulce 1.
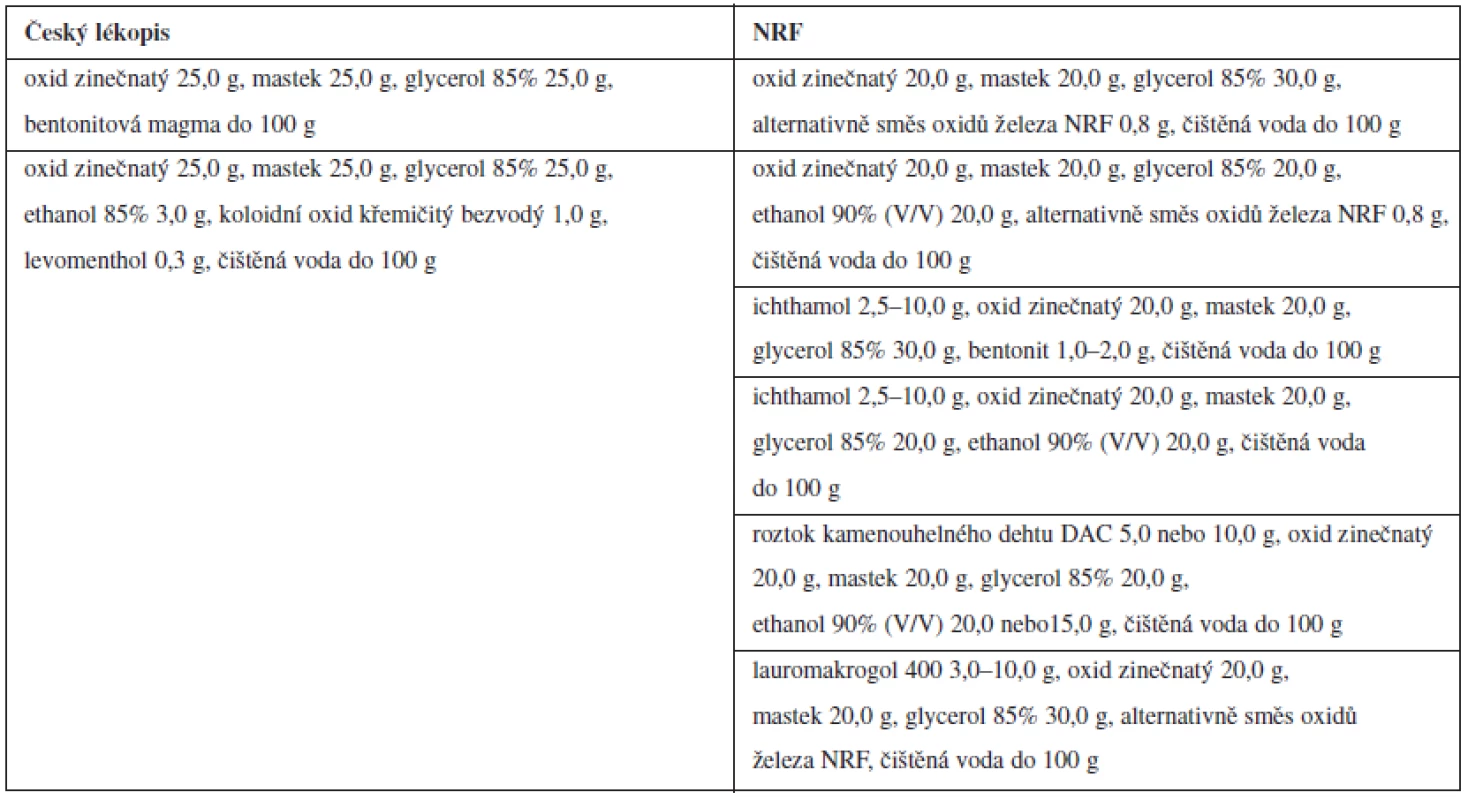
Ze srovnání složení těchto přípravků je zřejmé, že přípravky NRF obsahují ve všech případech méně pevných součástí než přípravky uvedené v Českém lékopisu, přičemž ze složení obdobných přípravků uvedených v9, 17) je zřejmé, že i v ČR existuje po přípravcích s nižším obsahem pevných součástí poptávka, kterou podobně jako poptávku po přípravcích s vyšším obsahem ethanolu9, 17) standardizace cestou oficiální autority zatím neuspokojuje. Obdobně tomu je s přípravky obsahujícími ichthamol9, 17) či tinkturu z kamenouhelného dehtu9) a ve všech těchto případech mohou být přípravky NRF v případě budoucí standardizace v ČR užitečným východiskem. Doba jejich použitelnosti po prvním otevření obalu je zpravidla 6 měsíců5) (při přípravě do zásoby je doba jejich použitelnosti podstatně delší). Přípravky uvedené NRF zatím nemohou být předlohami ke standardizaci přípravků typu tekutých zásypů s obsahem benzokainu, kloroxinu či taninu, případně síry, po nichž je v České republice podle9, 17) rovněž poptávka, což ovšem mohou další doplňky NFR změnit. V NRF dosud není přípravek typu tekutého zásypu s levomentholem, který je v ČL standardizován jako 0,3%, přičemž poptávka je podle9, 17) po 1% a s 1% obsahem levomentholu je přípravek standardizován např. i ve sbírce18).
Ve skupině oftalmologik lze v NRF nalézt mimo klasické oční kapky standardizované i Českým lékopisem14), kapkami obsahujícími 0,5 %, 1 % anebo 2 % atropin-sulfátu počínaje (přičemž 0,5% přípravek je v České republice kryt HVLP) i přípravky v ČR zatím málo běžné. K nim patří oční kapky s obsahem 1,25 %, 2,5 % nebo 5 % jodovaného povidonu (doba použitelnosti 2–4 týdny podle koncentrace účinné látky a použitého obalu), zmíněné autory19); 1,25 % téhož léčiva je obsaženo v dalším přípravku NRF, oční lázni a 2,5 % v jiném přípravku z této skupiny určeném k profylaxi HIV. Oční kapky s 1,5 % tobramycinu podle NRF obsahují pětinásobek koncentrace účinné látky v porovnání s HVLP Tobrex dostupným v České republice.
Ze sedativních přípravků v NRF je zajímavý chuťově korigovaný roztok obsahující 0,2 % midazolamu (doba použitelnosti 6 měsíců), který by mohl být alternativou k průmyslově vyráběným potahovaným tabletám či injekcím dostupným v ČR. Vedle toho zde ale lze nalézt i přípravky s obsahem chloralhydrátu považované v České republice za obsoletní.
V rámci psychofarmak a neurologik jsou v NRF zařazeny mimo v České republice nepoužívané přípravky s obsahem amfetamin-sulfátu či dexamfetamin-sulfátu také na trhu v ČR zatím nedostupné přípravky s obsahem dronabinolu (tedy ∆9-tetrahydrokanabinolu), a to tobolky 2,5 mg/5 mg/10 mg (doba použitelnosti 6 měsíců) a kapky 25 mg/ml (doba použitelnosti 3 měsíce).
Z diuretik zaujmou chuťově korigované roztoky furosemidu 2 mg a 10 mg/ml určené zejména pro pediatrii, podobně jako tobolky s obsahem 0,5–5 mg hydrochlorothiazidu a chuťově korigovaná suspenze obsahující 2 mg téhož léčiva/ml.
V oddílu virostatik jsou v NRF zařazeny mimo tekutý přípravek s 10 % ribavirinu (doba použitelnosti 6 měsíců při ≥ 15 °C), který by mohl být alternativou v České republice dostupných HVLP Copegus (potahované tablety) a Rebetol (tvrdé tobolky, obsah jako u prvního přípravku po 200 mg léčiva), dva tekuté přípravky (roztoky) s obsahem oseltamivir-fosfátu odpovídajícím 1,5 % a 1,0 % oseltamiviru, určené pro různé věkové skupiny pacientů, včetně kojenců. Doba použitelnosti těchto přípravků je podle NRF 6 týdnů. V České republice je jediným obchodovaným přípravkem HVLP Tamiflu (tvrdé tobolky) s obsahem oseltamivir-fosfátu odpovídajícím 75 mg oseltamiviru. Pro případ potřeby tekutého přípravku se v ČR počítá s přípravou suspenze z obsahu tobolek HVLP Tamiflu 75 mg20, 21). Vyvstává však otázka, zda by nebylo pro veřejné zdravotní pojištění výhodnější a z pohledu správné praxe vhodnější připravovat roztok v lékárnách ze substance oseltamivir-fosfátu s využitím poznatků uvedených v NFR. Přípravu v lékárně v lokalitě podle potřeby lze zvážit i u pevné lékové formy (tobolek). Umožnila by mimo jiné i individuální dávkování léčiva.
V oddílu nazvaném imunomodulátory jsou v NRF dva tekuté přípravky s obsahem thalidomidu, a to chuťově korigovaná a stabilizovaná suspenze obsahující 2 % thalidomidu (doba použitelnosti 6 měsíců) a tobolky s obsahem 50 mg/100 mg/150 mg/200 mg léčiva (doba použitelnosti 1 rok). V ČR je registrován, není však hrazen ani obchodován HVLP Thalidomide Celgene 50 mg a pro hematoonkologické indikace je dovážen a používán v rámci specifického léčebného programu neregistrovaný HVLP Myrin tablety 100 mg, případně 50 mg. Tekutá léková forma není z průmyslové produkce v ČR k dispozici. Proto i zde vyvstává otázka, zda by nebylo pro veřejné zdravotní pojištění levnější připravovat v ČR přípravky s obsahem thalidomidu v lékárnách vybavených a schválených k přípravě cytostatik. Předpokládá to ovšem zařazení thalidomidu mezi látky povolené v ČR k přípravě.
V NRF jsou v některých indikačních skupinách uvedeny i čajové směsi. Vzhledem k rozsahu jejich nabídky v ČR z průmyslové produkce a specifickým nárokům na jejich přípravu v lékárně však nelze očekávat obnovení jejich přípravy v lékárnách a nebyly proto v textu příspěvku zmiňovány.
Závěrem je třeba konstatovat a uvedené příklady dokládají, že NRF je hodnotným zdrojem informací. Dosud byl v ČR využíván pouze mimo aktivity oficiálních autorit, např.8, 9, 13, 19. 22), může však být dobrou pomůckou nejen pro standardizaci magistraliter receptury v ČR, ale i pro Lékopisnou komisi ČR. V situaci nedostatku prostředků a laboratorních kapacit k potřebným ověřováním by mohlo být využití obsahu NRF výhodné při doplňování a modernizaci obsahu Českého lékopisu v části týkající se přípravků připravovaných v lékárně, jak tomu již je při přípravě nového vydání Slovenského farmaceutického kodexu v SR23).
Střet zájmů: žádný.
Došlo 2. září 2013
Přijato 11. září 2013
Jan Šubert
Dušínova 1512, 664 34 Kuřim
doc. RNDr. Jozef Kolář, CSc. (∗)
Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta
Ústav aplikované farmacie
Palackého tř. 1/3, 612 42 Brno
e-mail: kolarj@vfu.cz
Sources
1. Praescriptiones Pharmaceuticae. Praha: Ministerstvo zdravotnictví ČSR 1972; 102 s.
2. Český farmaceutický kodex, vydání první. Praha: Nakladatelství X-EGEM, 1993.
3. Šubert J. K obsahu národní části Českého lékopisu z pohledu přípravy léčivých přípravků v lékárnách. Čes. slov. Farm. 2008; 57, 132–134.
4. Deutscher Arzneimittel-Codex / Neues Rezeptur Formularium.
http://www.govi.de/shop_content.php?coID=110 (30.8.2013).
5. Deutscher Arzneimittel-Codex / Neues Rezeptur-Formularium. Band 1 - 3, Stand 2012. Eschborn: Govi-Verlag, Stuttgart: Deutscher Apotheker-Verlag.
6. Janů M. Stabilita lékárenských přípravků z pohledu lékárníka – lékopisné požadavky na magistraliter přípravu. www.sukl. cz/file/73899_1_1/ 23.1.2013 (30.8.2013).
7. Pokyn SÚKL LEK-5 verze 2: Doporučené doby použitelnosti léčivých přípravků připravovaných v lékárně (platnost od 1.10.2009). http://www.sukl.cz/lekarny/lek-5-verze-2 (30.8.2013).
8. Šubert J., Kolář J., Vašková V. Standardní receptura pro přípravu léčivých přípravků v lékárnách I. Suspenze k aplikaci na kůži. Čes. slov. Farm. 2008; 57, 55–57.
9. Sklenář Z., Skořepová M., Staněk M., Jirásek R. Magistraliter receptura v dermatologii. Praha: Galén 2009.
10. Československý lékopis, vydání druhé. Praha: Státní zdravotnické nakladatelství 1954; 202.
11. Sklenář Z., Horáčková K. Možnosti inovace individuální přípravy léčivých přípravků v lékárnách v České republice. Čes. slov. Farm. 2012; 61, 11–16.
12. Klovrzová S., Zahálka L., Matysová L., Horák P., Šklubalová Z. Pediatric oral solutions with propranolol hydrochloride for extemporaneous compounding: the formulation and stability study. Čes. slov. Farm. 2013; 62, 35–39.
13. Sklenář Z., Ščigel V. Magistraliter receptura ve stomatologii. Praha: Havlíček Brain Team 2012.
14. Český lékopis 2009, Český lékopis 2009 Doplněk 2010 – Doplněk 2012. Praha: Grada Publishing 2009–2012; 8009 s.
15. Sklenář Z. Použití přípravků se 40% ureou v léčbě onychomykóz. Prakt. Lékáren. 2012; 8, 14.
16. Wartner tužka na odstranění bradavic. Wartner tužka na odstranění kuřích ok. http://www.omega-pharma.cz/wartner (30.8.2013).
17. Růžičková Jarešová L. Dermatologická externa tuhá a polotuhá. Dermatol. praxi 2009; 3, 210–2013. http://www. dermatologie propraxi.cz/pdfs/der/2009/04/13.pdf (30.8.2013).
18. Dermatologische Magistralrezepturen der Schweiz. http://www. magistralrezepturen.ch/ (30.8.2013).
19. Pavlíková J., Kavalírová L. Jodovaný povidon v magistraliter přípravě. Prakt. Lékáren. 2012; 8, 283–285.
20. Společné stanovisko k přípravě suspenze z Tamiflu. http://pandemie.mzcr.cz/Pages/390-spolecne-stanovisko-k-priprave-suspenze-z-tamiflu.html (30.8.2013).
21. TAMIFLU Aktualizace Souhrnu údajů o přípravku a Příbalové informace – dávkování Tamiflu u dětí mladších než 1 rok a nouzová příprava perorální suspenze. http://www.sukl.cz/ tamiflu-aktualizace-souhrnu-udaju-o-pripravku-a-pribalove (30.8.2013).
22. Šubert J., Dlouhý J. Stabilita, doba uchovávání a použitelnosti léčivých přípravků III. Čas. čes. Lék. 2000; 72 (10), 20–21.
23. Štátny ústav pre kontrolu liečiv Bratislava: Zápisnica zo 4. zasadania predsedníctva Liekopisnej komisie 19.02.2013. http://www. sukl.sk/buxus/docs//O_nas/PoradOrgany/Liekopis/Zapisnica.pdf (30.8.2013).
Labels
Pharmacy Clinical pharmacologyArticle was published in
Czech and Slovak Pharmacy

2013 Issue 5
Most read in this issue
-
Standard prescriptions for extemporaneously produced medicinal preparations in pharmacies
VI. Collection Neues Rezeptur-Formularium - A combination of grapefruit seed extract and concentrated cranberry juice as a potential antimicrobial preservative for the improvement of microbiological stability of hypromellose gel
- Influence of temperature and concentration of a surfactant on pharmaceutical availability
- Evaluation of liberation of caffeine from dermal semisolids drugs
