Mikroihly ako perspektíva pre transdermálne terapeutické systémy
Microneedles as a perspective for transdermal therapeutic systems
Transdermal Therapeutic Systems (TTS) improve patient compliance especially due to its simple application and long-term action with the need to exchange the system every 12 hours to several days. The advantages also include elimination of first-pass effect, avoidance of gastrointestinal adverse effects, stable drug levels in the blood and simple discontinuation of therapy by patch removing. However, most drugs do not have the appropriate physicochemical properties to achieve therapeutic levels by transdermal application, therefore only a limited amount of drugs administered by this route is available on the market. Microneedles (MI) by their painless application appear to increase drug permeation when applied transdermally. In this review work, various types of MI (solid, coated, hollow, matrix, hydrogel forming) their size, shape, grouping, but also materials and technologies used in MI production are described. Finally, the work is focused on current clinical trials in which MI have been tested. MI with their unique properties have potential to increase the range of transdermally administered drugs currently applied by another route of administration. MI can simply pave the way for transdermal delivery to poorly penetrating small molecules as well as large molecules such as vaccines, monoclonal antibodies, or siRNA.
Keywords:
clinical trials – microneedles – materials – shape – transdermal drug delivery – vaccine delivery
:
Tomáš Wolaschka
:
Čes. slov. Farm., 2019; 68, 12-26
:
Review Articles
Transdermálne terapeutické systémy (TTS) zlepšujú komplianciu pacientov hlavne pre svoju jednoduchú aplikáciu a dlhodobé pôsobenie s nutnosťou výmeny systému každých 12 hodín až niekoľko dní. Výhodou je tiež obídenie first-pass efektu, vyhnutie sa gastrointestinálnym nežiadúcim účinkom, stabilné hladiny liečiva v krvi a jednoduché prerušenie liečby odlepením náplasti. Väčšina liečiv však nemá vhodné fyzikálno-chemické vlastnosti na to, aby sa dosiahli terapeutické hladiny pomocou transdermálnej aplikácie, preto je na trhu len obmedzené množstvo liečiv aplikovaných touto cestou. Mikroihly (MI) svojou nebolestivou aplikáciou sa javia perspektívne v zvýšení permeácie liečiva transdermálnou cestou. V tejto prehľadovej práci sú opísané rôzne typy MI (pevné, vrstvené, duté, matricové, hydrogélové), ich veľkosť, tvar, zoskupenie, ale tiež materiály a technológie, ktoré sa využívajú pri výrobe MI. V závere sa práca venuje aktuálnym klinickým štúdiám, v rámci ktorých boli využité MI. Svojimi jedinečnými vlastnosťami majú MI potenciál zvýšiť paletu transdermálne podávaných liečiv, v súčasnosti aplikovaných inou cestou podania. MI tak môžu doslova raziť cestu transdermálnej aplikácii nedostatočne penetrujúcim malým molekulám, ale aj veľkým molekulám ako vakcínam, monoklonálnym protilátkam alebo siRNA.
Klíčová slova:
klinické štúdie – mikroihly – materiály – tvar – transdermálna aplikácia liečiv – transdermálna aplikácia vakcín
Úvod
Koža so svojou plochou približne 2 m2 u dospelých je najväčším orgánom v tele. Koža má rôzne funkcie, ako je ochrana vnútorného prostredia pred vniknutím exogénnych toxických látok a zabezpečenie integrity celého organizmu tak, aby voda a ostatné dôležité endogénne látky z tela nevytekali. Kvôli ochrannej funkcii kože je z farmakologického hľadiska problematický prestup liečiv cez pokožku (epidermu) v dostatočnom množstve. Rohová vrstva kože (stratum corneum) s pomerne malou hrúbkou 10 – 15 μm je najväčšou bariérou pre prestup liečiv cez pokožku. Pod rohovou vrstvou sa nachádzajú ďalšie štyri vrstvy pokožky, bunkového tkaniva bez vaskularizácie s celkovou hrúbkou 50 – 100 μm. Nedávno sa zistilo, že bunky epidermy sú spojené tesnými spojmi (zonula occludens, tight junction). Tesné bunkové spoje spolu s bunkovými lipidmi vytvárajú ďalšiu účinnú bariéru v prestupe molekúl cez pokožku1). Pod pokožkou sa nachádza 4 mm hrubá zamša (corium), ktorá je prostredníctvom papilárnej vrstvy (stratum papillare) zakliesnená do epidermy. Papilárna vrstva pozostáva z tenkých zväzkov kolagénu, elastínových vlákien, fibrocytov a je hrubá 100 – 200 μm. Hlbšie vrstvy zamše obsahujú hrubé zväzky kolagénu a hrubých elastických vlákien. V zamši sa nachádzajú cievne a lymfatické kapiláry, nervové zakončenia, potné a mazové žľazy. Iba liečivá, ktoré prekonajú vzdialenosť 160 – 315 μm z povrchu kože k cievnym a lymfatickým kapiláram, prechádzajú rohovou vrstvou, ostatnými časťami epidermy cez pevné medzibunkové spoje a papilárnu vrstvu zamše majú šancu vstúpiť do krvného riečiska a dosiahnuť systémový efekt. Pod zamšou sa nachádza podkožné väzivo (tela subcutis) hrubé niekoľko milimetrov. Obsahuje tukové tkanivo, krvné a lymfatické cievy a nervy2).
Napriek mnohým výhodám systémovej aplikácie liečiv transdermálnou cestou sa táto lieková forma v praxi využíva len u pomerne malého množstva liečiv. Pri liečbe silných bolestí sú nezastupiteľné náplasti s obsahom fentanylu alebo buprenorfínu. Okrem toho sú v Čechách a na Slovensku registrované náplasti s rotigotínom (antiparkinsonikum), rivastigmínom (liečba Alzheimerovej demencie), oxybutinínom (urologikum), granisetrónom (antiemetikum), pohlavnými hormónmi (testotestrón, estradiol, norelgestromín, estrogén, gestodén, etinylestradiol) a voľnopredajné náplasti s nikotínom na liečbu závislosti od tabaku a náplasti s diklofenakom, ktoré sú určené pre lokálne ošetrenie traumatických a reumatických bolestí a zápalov. V zahraničí sú k dispozícii náplasti s nitroglycerínom, skopolamínom, metylfenidátom, selegilínom a klonidínom. Jedným z dôvodov, prečo transdermálne náplastí nepokrývajú širšiu paletu farmakologických skupín, je problematická permeácia liečiv rohovou vrstvou kože. Ako možno zvýšiť permeáciu liečiv kožou? Je otázka, ktorou sa zaoberá súčasný výskum TTS. Jednou z možností je vývoj nových liečiv s fyzikálno-chemickými vlastnosťami vhodnými pre transdermálnu aplikáciu. Z technologického hľadiska je možností viacej. Pridaním pomocných látok tzv. enhancerov, ktoré chemicky zvyšujú permeabilitu kože, čím urýchľujú permeáciu liečiv. Využitím nosičových mikroforiem (napr. mikroemulzií, lipozómov, niozómov). Elektro-mechanické metódy, ktoré zahŕňajú iónoforézu, elektroporáciu, mechanickú alebo
laserovú mikroabráziu kože, použitie ultrazvuku, vysokorýchlostnej aplikácie liečiva stlačeným plynom3).
Ďalším spôsobom je modernizácia liekovej formy pomocou mikrovýrobných technológií.
Mikrovýrobné technológie umožňujú vyrábať miniatúrne zariadenia využívané v medicíne, ktoré dokážu snímať, čerpať, transportovať, miešať, monitorovať a kontrolovať malé objemy tekutín4). Výrazný pokrok bol v biomedicíne zaznamenaný najmä u TTS. Tieto TTS môžu pozostávať z mikroihiel (MI), mikropúmp, rezervoárov, prietokového senzora, senzora snímajúceho tlak krvi a elektrického obvodu. Pre transdermálny prívod liečiva sú atraktívne práve MI5).
Veľkosť a tvar mikroihiel
MI sú malé ihly mikroskopickej veľkosti, ktoré po aplikácií do kože porušujú stratum corneum a vytvárajú mikrokanály, ktoré umožňujú permeáciu liečiva. MI sú svojou aplikáciou minimálne invazívne a bolestivé, ak neprenikajú do hlbších častí zamše, kde sú umiestnené nervové zakončenia6). Rozmery MI a ich počet vplýva na bolestivosť pri aplikácii. Dĺžka MI má najväčší vplyv na bolestivosť aplikácie. Bolo zistené, že predĺženie MI zo 480 µm na 1450 µm zvýšilo bolestivosť aplikácie 7-násobne. 10-násobné zvýšenie počtu MI viedlo k 2-násobnému zvýšeniu bolestivosti. Uhol hrotu, šírka a hrúbka MI nemali signifikantný vplyv na bolestivosť pri aplikácii7).
Tvar a veľkosť MI musí umožňovať ľahké prepichnutie kože, preto logicky možno predpokladať, čím ostrejší hrot – tým ľahšia penetrácia. Zároveň však MI musí byť dostatočne pevná, aby odolala tlaku pri penetrácii a strihovej sile, ktorá sa pri ručnej aplikácii nedá vylúčiť. Pevnosť narastá s hrúbkou MI. Uvedené závisí aj od použitého materiálu. U MI vyrobených z pevných materiálov (kremík, kovy) viedlo zníženie priemeru hrotu k ľahšej penetrácii bez ohľadu na vzdialenosť medzi MI8). U polymérnych materiálov však zmenšenie priemeru hrotu viedlo k oslabeniu tela MI a ich ľahšiemu lámaniu, čo môže ovplyvniť ich penetráciu do kože9). Hlavné faktory, ktoré ovplyvňujú penetráciu kože a silu zlomu, sú typ materiálu, výška MI, šírka základne, polomer zakrivenia hrotu, tvar MI, celková hrúbka MI a hustota MI10).
Typické rozmery MI sú:
- dĺžka 150 – 1500 μm
- šírka základne 50 – 250 μm
- šírka hrotu 1 – 25 μm11)
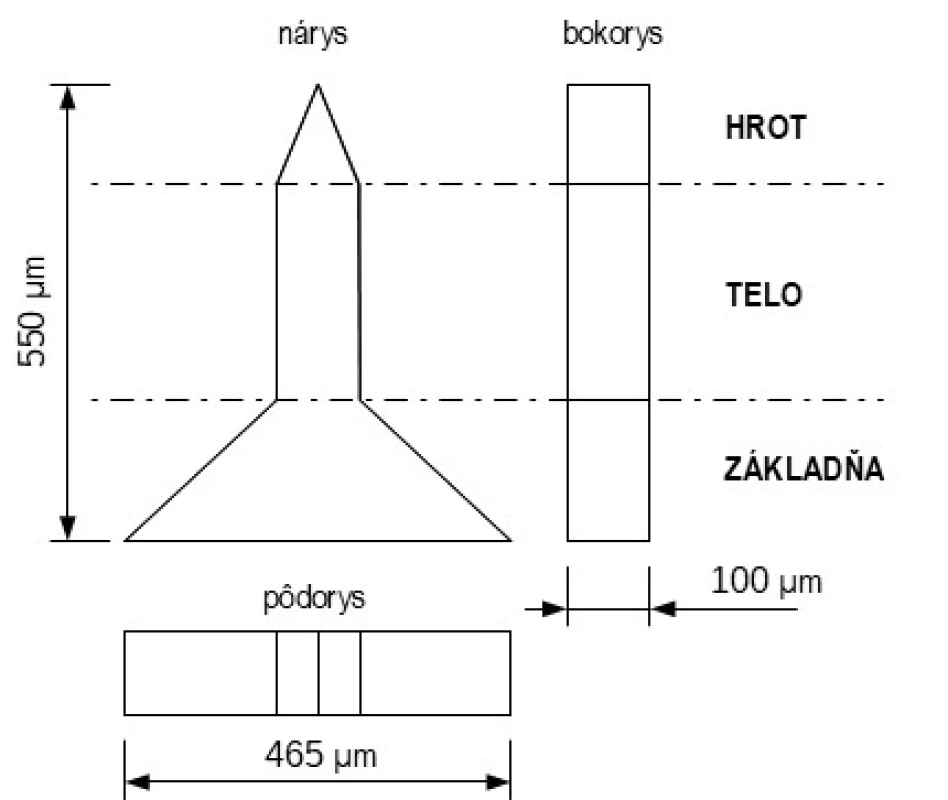
Tvar MI je rôznorodý, častokrát súvisí s použitou technológiou výroby. MI možno rozlíšiť v náryse na základňu, telo a hrot (špic) MI (obr. 1). Základňa je priamo spojená s podkladom, niekedy sa k telu zužuje v prípade kónických tvarov, alebo má rovnaký tvar v prípade valcovitých tvarov. Hrot MI sa nachádza na konci tela, kde sa postupne MI zužuje najčastejšie do stredu alebo je hrot šikmo rezaný a zužuje sa na jednu stranu MI.
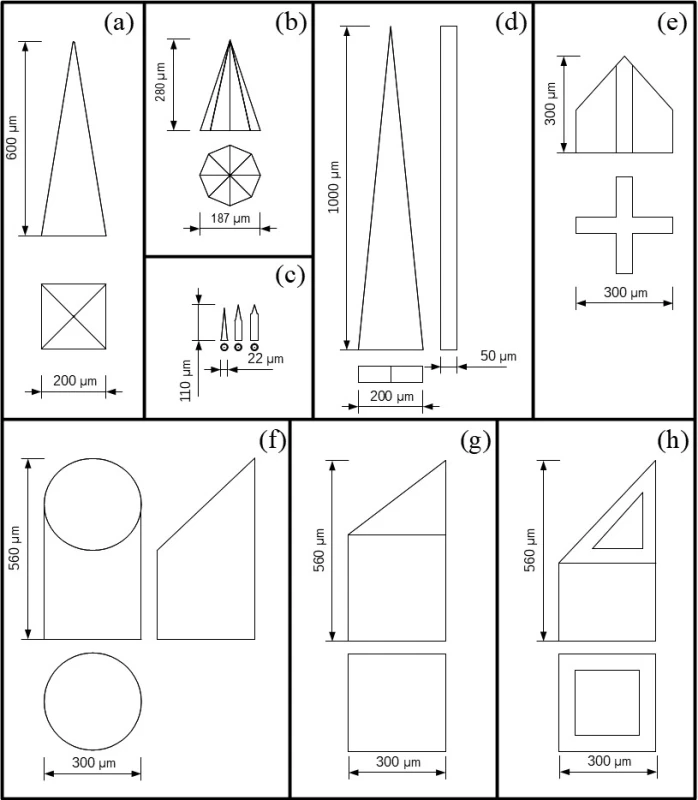
Medzi časté tvary patrí pyramidálny tvar pravidelného kvadratického ihlana (obr. 2a). Takto sú formované pevné kremíkové MI, ktoré je možné použiť samostatne pri aplikáciach, alebo slúžia ako nástroj pre výrobu foriem na mikroodlievanie matricových alebo hydrogélových MI13). Kremíkové MI boli tvarované aj do oktaédrického ihlana (obr. 2b), ale aj do tvaru veľmi malých valčekov (obr. 2c) s priemerom 22 µm s kužeľovitým hrotom14, 15). Klinovité MI (obr. 2d) boli vyrobené z nehrdzavejúceho plechu laserovým rezaním. Mimo rovinu boli ohnuté manuálne o 90 °. Bokorys klinu s hrúbkou 50 µm odpovedá hrúbke plechu po leštení16). Obdobný bokorys mali aj polykarbonátové MI (viz obr. 1), ktoré boli vyrobené mikroodlievaním12). Zaujímavé tvary boli zvolené pri výrobe pevných a dutých keramických MI s prierezom v tvare kruhu, kríža a plného alebo dutého štvorca (obr. 2e–h). Tieto MI, okrem kríža, majú skosený hrot na stranu17).
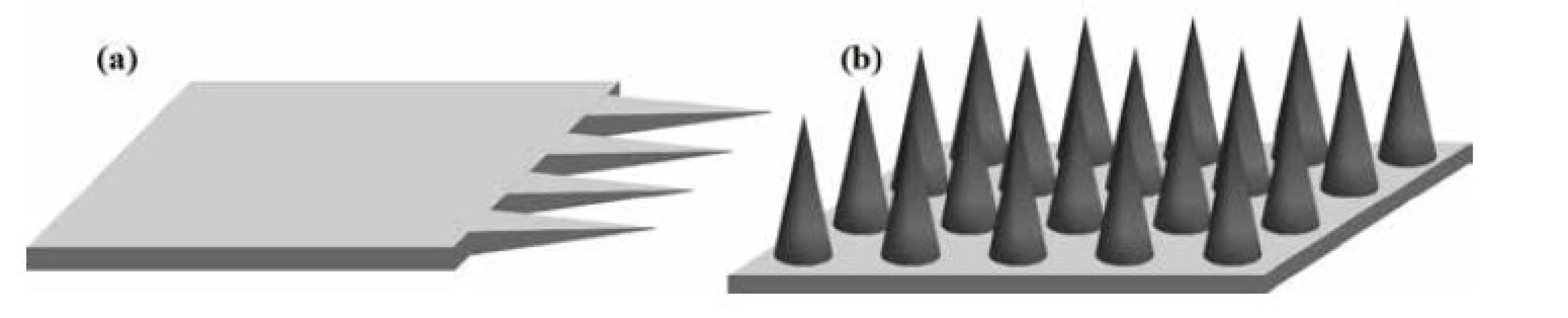
Tvar a povrchová úprava MI boli výrazne ovplyvnené aj štúdiom bodavo-cicavých orgánov hmyzu a bolo dokázané, že prítomnosť pílovitých zúbkov a vibrácie podľa živočíšnej predlohy minimalizujú silu potrebnú na vpichnutie do kože. MI sú zvyčajne vyrábané ako zoskupenia MI na podklade. MI môžu byť orientované v rovine (obr. 3a), keď je ich pozdĺžna os k podkladu rovnobežná alebo mimo rovinu (obr. 3b), keď je ich pozdĺžna os k podkladu kolmá18). Z hľadiska priestorového obmedzenia sú MI v rovine tvorené jednou až niekoľkými MI, zatiaľ čo MI mimo rovinu sú tvorené niekoľkými desiatkami až stovkami MI. Pri zoskupení viacerých ihiel je dôležitá aj vzdialenosť medzi ihlami. Ak by bola príliš krátka MI by pri injektovaní komprimovali tkanivo, čím by si bránili preniknutiu do požadovanej hĺbky. Preto sa odporúča pri 500 µm dlhých MI dodržať vzdialenosť medzi MI 350 µm, prípadne viac19).
Typy mikroihiel
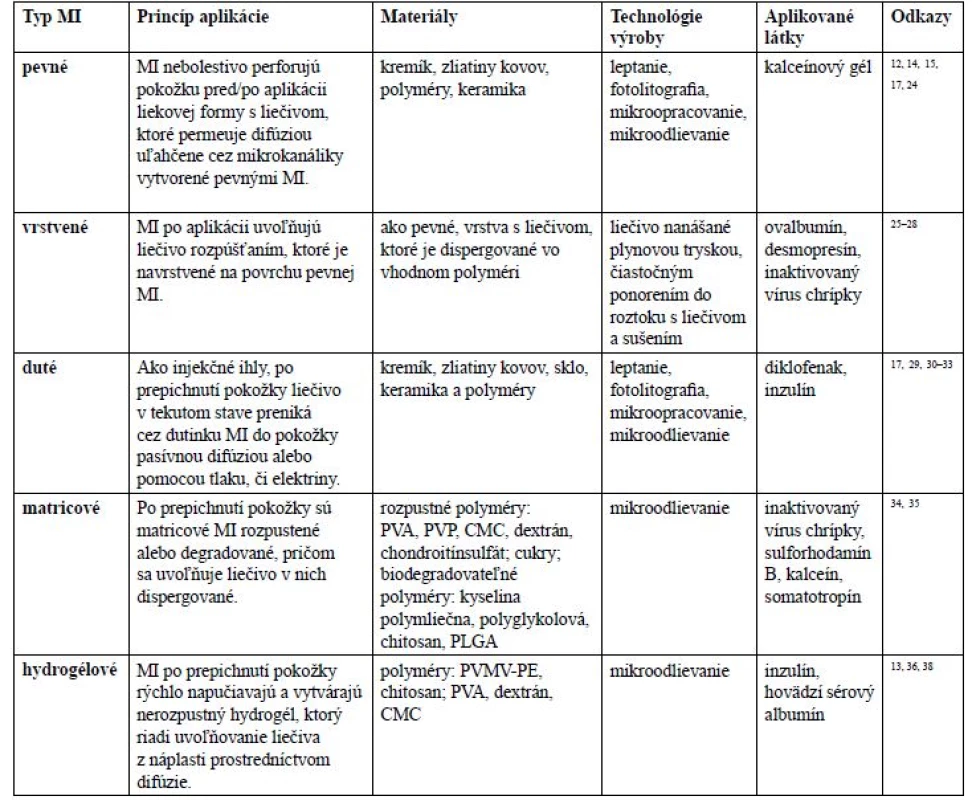
Zvolený technologický proces a použitý materiál určuje typ MI. V literatúre sa stretávame s piatimi rôznymi typmi MI: pevnými, navrstvenými, dutými, matricovými a vytvárajúcimi hydrogél (tab. 1).
V roku 1995 bola publikovaná práca Hashmi et al.22), kde využili zoskupenie kremíkových MI na prepichnutie buniek a nematód, čím bol zabezpečený zvýšený príjem molekúl a génová transfekcia. Neskôr sa objavujú práce využívajúce pevné MI na aplikáciu liečiv.
Pevné MI neobsahujú liečivo, slúžia na prepichnutie pokožky. Tým sa vytvoria v rohovej vrstve kože prestupné hydrofilné kanáliky. Následne sa pevné MI odstránia a aplikuje sa lieková forma s liečivom (transdermálna náplasť, krém, gél, pena, roztok), ktoré permeuje uľahčene cez takto vytvorené mikrokanáliky pomocou pasívnej difúzie23). Aplikačný postup môže byť aj opačný, kedy sa najprv aplikuje lieková forma s liečivom a následne sa prepichne pokožka zoskupením pevných MI24). Hlavnou nevýhodou pevných MI je relatívne komplikovanejšia aplikácia, ktorá pozostáva z dvoch krokov. Materiály, ktoré sa využívali na výrobu pevných MI, sú hlavne kremík14, 15), kovy16), keramika17) a polyméry12, 24).
Vrstvené MI sa pripravujú navrstvením liečiva na pevné MI. Po prepichnutí pokožky vrstvenými MI ostáva navrstvená časť s liečivom v pokožke, kde sa postupne rozpúšťa. Tento typ MI umožňuje jednokrokový aplikačný proces. Hlavnou nevýhodou je však obmedzený priestor na povrchu pevných MI na navrstvenie liečiva a tým aj obmedzené množstvo aplikovaného liečiva. Vrstvené MI sú preto predurčené na podávanie veľmi účinných liečiv, doteraz boli použité na rýchle podanie rôznych peptidov, proteínov a vakcín do pokožky. Keďže vrstvené MI sa vyrábajú z pevných MI, materiály použité na ich výrobu sú totožné – kremík25), kovy26, 27)a polyméry28). Vrstvu liečiva možno nanášať plynovou tryskou, ktorá rozprašuje roztok liečiva v prúde plynu, napr. dusíka pri rôznych uhloch (20 °, 70 °) za stálej rotácie zoskupenia MI, tak aby navrstvenie bolo rovnomerné. Pomocou tejto metódy dochádza k rýchlemu vysušeniu liečiva na povrchu MI25). Ďalší spôsob spočíva v namáčaní MI do roztoku liečiva a následnom vysušení26). Do roztokov boli pridávané látky, ktoré zlepšujú zmáčanie (polysorbát), alebo zvyšujú viskozitu (metylcelulóza)25, 26).
Duté MI sú analogické s tradičnými injekčnými ihlami. Po prepichnutí pokožky sa liečivo injektuje cez dutinky MI do pokožky. K permeácii liečiva dochádza buď pasívnou difúziou, alebo aktívne pomocou tlaku či elektriny. Základnou výhodou tohto systému je schopnosť aplikácie väčšieho množstva liečiva ako pri aplikácii pevných, vrstvených či matricových MI. Nevýhodou je možnosť upchania ihiel tkanivom počas aplikácie, čo je možné pravdepodobne eliminovať umiestnením otvoru ihly na bok hrotu. Ďalšou nevýhodou je odpor zhusteného tkaniva pokožky voči toku, ktoré sa komprimuje počas injektovania, čo je možné eliminovať čiastočným povytiahnutím dutých MI po inzercii. Tým sa uvoľní komprimované tkanivo okolo ihiel a uľahčí prúdenie injektovaného roztoku liečiva. Na výrobu dutých MI boli použité materiály ako kremík29), kovy30), sklo31), polyméry32) a keramika33).
Matricové MI sa vyrábajú mikroodlievaním zmesi biokompatibilného rozpustného polyméru alebo cukru a liečiva. Po aplikácii matricových MI do pokožky dochádza k postupnému rozpúšťaniu matrice v styku s intersticiálnou tekutinou a uvoľňovaniu liečiva. Uvoľňovanie liečiva je tak riadené rýchlosťou rozpúšťania matrice, ktoré je možné modifikovať zložením matrice alebo modifikáciou MI počas výrobného procesu. Hlavnou výhodou matricových MI je ich biokompatibilita, nízka cena polymérnych materiálov a relatívne ľahká výroba pomocou mikroodlievania pri izbovej teplote, a teda nekomplikovaná následná hromadná výroba vo farmaceutickom priemysle. Na ich výrobu boli použité rozpustné polyméry ako polyvinylalkohol (PVA), polyvinylpyrolidón (PVP), dextrán, karboxymetylcelulóza (CMC), chondroitínsulfát a cukry34). Aj keď ide o rozpustné a biokompatibilné materiály, ich zvyšky v pokožke najmä pri dlhodobej aplikácii môžu vyvolať podráždenie pokožky. Alternatívou sú biodegradovateľné materiály ako kyselina polymliečna, chitosan, kyselina polyglykolová alebo kopolymér kyseliny mliečnej a glykolovej (PLGA), ktoré sa po aplikácii do pokožky hydrolyzujú na menšie molekuly, čím sa uvoľňuje liečivo. Každopádne na ich výrobu sú potrebné zväčša vyššie teploty, ktoré môžu degradovať inkorporované termolabilné biomolekuly35).
MI vytvárajúce hydrogél sú jedným z nových typov MI. Sú tvorené MI bez liečiva zo zosieťovaného polyméru, ktoré sú pripevnené k náplasti s liečivom. Po inzercii do pokožky sa MI rýchlo hydratujú intersticiálnou tekutinou, napučiavajú a vytvárajú hydrogél, cez ktorý prechádza liečivo z náplasti prostredníctvom difúzie. Na ich výrobu boli použité polyméry kyseliny polymetylvinyléter-ko-maleinovej (PMVM) sieťovanej esterifikáciou pektínom36) alebo polyetylénglykolom37), chitosan13), PVA, dextrán a CMC38). Zosieťovaním polymérov tvoriacich MI sa tie stávajú nerozpustné, preto po aplikácii ostávajú neporušené a nezanechávajú žiadne rezíduá v pokožke. Zároveň sa hydratáciou stávajú natoľko zmäkčené, že ich nie možné opätovne použiť. Limitujúcim však ostáva pomerne pomalý prestup liečiva cez gélovú vrstvu napučaného polyméru a veľké množstvo liečiva, ktoré v tejto vrstve ostáva po aplikácii.
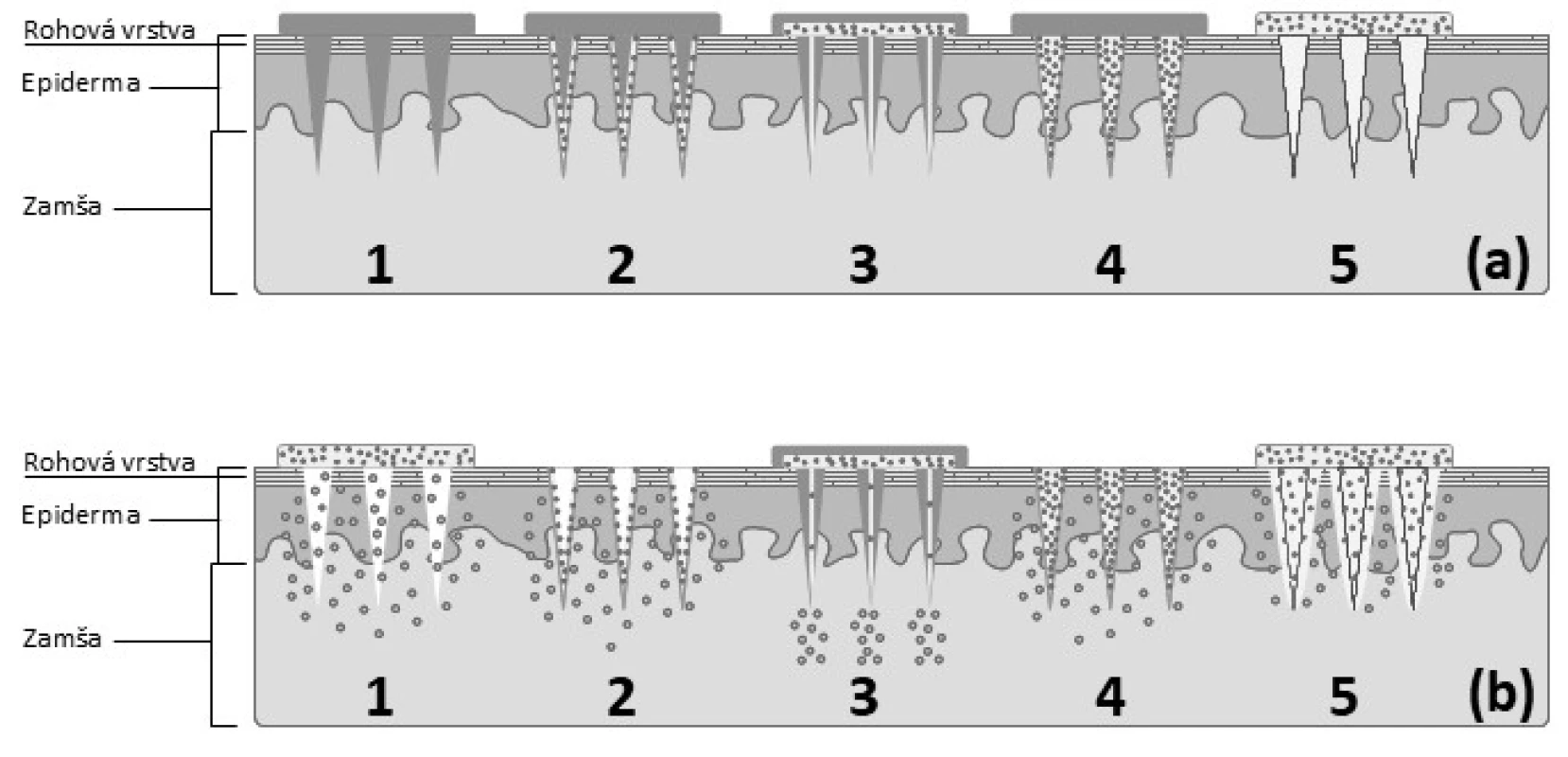
Liečivo môže byť zoskupením MI podané pomocou viacerých spôsobov zobrazených na obrázku 4:
- prepichnutím kože pomocou usporiadania pevných MI pred alebo po aplikácii TTS (náplasť, gél, sprej) na ošetrené miesto
- navrstvením liečiva na MI a ich vpichnutím do kože s následným rozpustením liečiva z vytvoreného filmu
- injikovaním liečiva pomocou dutých MI
- zapuzdrením liečiva do biodegradovateľných alebo rozpustných matricových MI a ich vpichnutím do kože na dosiahnutie riadeného účinku ich rozpadom alebo rozpustením39)
- prepichnutím kože pomocou polymérnych MI, ktoré rýchlo hydratujú, zväčšujú svoj objem, vytvárajú nerozpustných hydrogél, ktorý umožňuje pomalý prestup liečiva40)
Materiály využívané na výrobu mikroihiel
Jedným z prvých materiálov použitých na výrobu MI bol kremík, ktorý bol použitý koncom 20. storočia. Súvislosť možno nájsť s rozvojom priemyselných precíznych mikroelektronických zariadení a úspešným používaním kremíka pri výrobe mikroelektromechanických systémov. V roku 1998 vyrobili Henry et al. zoskupenie pevných kremíkových MI s dĺžkou približne 150 µm, leptaním reaktívnymi iónmi zmesi plynov fluoridu sírového (SF6) a kyslíka (O2). MI ľahko prenikali pokožkou a zvýšili biologickú dostupnosť kalceínu 4-násobne21). Hlavnou výhodou kremíka je variabilita výrobného procesu, ktorá umožňuje kremík formovať do rôznych tvarov s mikroskopickými rozmermi. Pripravené MI z kremíka boli dostatočne pevné na to, aby prepichli pokožku.
Z kremíka boli pripravené pevné14), duté29), ale aj vrstvené MI25). Nevýhodou kremíka je jeho vysoká cena, zložité viacstupňové spracovanie a z toho vyplývajúci dlhší výrobný čas. Kremík je tvrdý, ale zároveň krehký materiál, MI sa môžu v pokožke zlomiť a spôsobiť jej podráždenie21). Kremíkové MI v ďalších štúdiách často slúžili ako predforma na výrobu dutých foriem z polydimetylsiloxánu, ktoré sa odlievali pri výrobe matricových a hydrogélových MI36).
Borokremičité sklo bolo použité na výrobu dutých MI. Sklo je fyziologicky inertný materiál, umožňuje vizualizáciu toku kvapalín. Na výrobu MI bola použitá laboratórna technika ťahania skla ako pri výrobe pipiet. Hrot bol skosený brúsením, následne krátko zahriaty aby sa vyhladil povrch. Sklo je dostatočne tvrdý materiál, MI z neho vyrobené prenikali pokožkou do hĺbky 150 – 700 µm.
Základnou nevýhodou skla je však jeho krehkosť, čo môže viesť k obdobným problémom s úlomkami, ktoré ostávajú v pokožke ako pri kremíkových MI. Ručná výroba sklenených MI je časovo náročná, takéto MI sa používajú skôr pre laboratórne účely. Využitie sklenených MI na transdermálnu aplikáciu liečiv je preto málo pravdepodobné31).
Keramika bola použitá ako ďalší materiál na výrobu MI. Obdobne ako sklo je tento materiál tvrdý ale krehký. Výhodou keramiky je chemická inertnosť. Jedným z materiálov použitých na výrobu MI bol oxid hlinitý (Al2O3), ktorý sa odlieval do vopred vyrobených foriem a následne sa vypálil. Takýmto spôsobom boli vyrobené pevné a duté MI s dĺžkou 540 µm rôznych tvarov so základňou v tvare kruhu, štvorca, kríža. Počas manuálneho vpichu MI do silikónovej gumy, kedy nebola kontrolovaná strihová sila, dochádzalo k ich zlomeniu17). Cai et al. vyrobili ihlanovité keramické MI zo sadry (CaSO4 . 2H2O) a hydrogénfosforečnanu vápenatého dihidrátu (CaHPO4 . 2H2O)
s liečivom zolpidemom. Liečivo bolo pridané do biokeramickej pasty pred odliatím a vytvrdnutím42). Na výrobu MI bol použitý aj hybridný anorganicko-organický
polymérny materiál s názvom Ormocer®. Tento materiál spája pozitívne vlastnosti anorganických látok (pevnosť, tepelná a chemická stabilita) a organických látok (tuhosť, jednoduché spracovanie a funkcionalizácia pomocou
naviazania funkčných skupín)33).
Kovy sú dostatočne tvrdým, ale aj pevným materiálom, ktorý sa používa v rôznych oblastiach medicíny. Samotné injekčné ihly aplikované intravenózne či intradermálne sú z nehrdzavejúcej ocele, implantáty a protézy sa vyrábajú z titánu. Na výrobu prvých MI z nehrdzavejúcej ocele boli použité komerčné intradermálne ihly 30G, ktoré boli vložené do termoplastického plátu s vyhĺbenými dierami v rastri 4 × 4. Ihly boli vložené tak, aby z plátu pretŕčali v požadovanej dĺžke, následne boli zrezané na druhej strane plátu a zaliate lepidlom43). V súčasnosti sa používajú na výrobu MI z kovu techniky mikroopracovania, ako laserové vyrezanie z veľmi tenkého plechu27), fotochemické leptanie26) alebo galvanické pokovovanie formy požadovaného tvaru30). Na ich výrobu boli použité kovy ako nikel, zliatina nikel-železo30), titán26), paládium, zliatina paládium-kobalt44) ale aj zlato.
Z cukrov sa najčastejšie používala na výrobu MI maltóza19). Okrem nej to boli manitol, trehalóza, sacharóza, xylitol a galaktóza45, 46). Vyrobené boli odlievaním taveniny do kremíkových alebo oceľových foriem. Liečivo sa pridáva do taveniny pred odlievaním. Uvoľňovanie liečiva z cukorných MI riadi rýchlosť rozpúšťania cukrov v koži. Cukry sú lacné a bezpečné, avšak mechanické vlastnosti neboli dostatočne presvedčivé. Kombinácia s inými látkami, napr. s CMC, však môže zlepšiť niektoré vlastnosti týchto MI47). Príprava MI pri zvýšenej teplote môže spôsobovať degradáciu termolabilných látok. Okrem mikroodlievania bola použitá aj litografická tlač na výrobu maltózových MI s inkorporovanými hydrofilnými liečivami 2-glukozit kyselinou askorbovou a niacínamidom48).
Polymérne látky vo výrobe MI majú niekoľko výhod a predstavujú alternatívu v spôsobe aplikácie. Na ich výrobu sa používa najčastejšie mikroodlievanie roztoku polyméru do formy, čo je pomerne lacný a jednoduchý proces, kde techniky mikroopracovania sa používajú najmä pri výrobe formy. Polyméry používané na výrobu MI môžeme rozdeliť na biodegradovateľné, rozpustné a zosieťované.
MI z biodegradovateľných polymérov umožňujú riadené uvoľňovanie od niekoľkých hodín po niekoľko mesiacov ich postupným odbúravaním na netoxické zlúčeniny, ktoré sú z tela eliminované prirodzenými metabolickými procesmi. Vďaka týmto vlastnostiam sú biodegradovateľné polyméry vhodné na výrobu MI určených na dlhodobý prívod liečiva. Biodegradovateľné polyméry použité na výrobu MI boli prírodného alebo syntetického pôvodu. Prírodné biodegradovateľné polyméry sú hodváb49) a chitín50). Z chitínu bolo vyrobené zoskupenie MI s výškou 750 µm a priemerom základne 300 µm. MI vykazovali pevnosť v zlome viac ako 0,2 N,
pričom na prepichnutie ľudskej pokožky je požadovaná pevnosť v zlome viac ako 0,1 N. Boli použité ako alternatíva tuberkulínového kožného testu50). Na výrobu MI z hodvábu boli použité kokóny Bombyx mori priadky morušovej, z ktorých sa po spracovaní získal vodný roztok hodvábneho proteínu fibroínu, do ktorého bol pridaný ovalbumín. Samotné MI pozostávali zo základne z polyakrylovej kyseliny, ktorá sa v koži rýchlo rozpúšťala a hodvábnych fibroínových špičiek. Obe obsahovali ovalbumín, ktorý sa rýchlo uvoľňoval zo základne a hodvábne špičky zabezpečovali postupné pomalé uvoľňovanie ovalbumínu v priebehu 1 – 2 týždňov49).
Syntetické biodegradovateľné polyméry sú kyselina poly(mliečna-ko-glykolová)51), kyselina polyglykolová52), kyselina polymliečna53) z ktorých boli vyrobené zoskupenia MI s dĺžkou 380 – 750 µm a priemerom v základni 100 – 182 µm, ktorých kinetika uvoľňovania liečiva bola niekoľko hodín až mesiacov v závislosti od použitých polymérov a prípadnej predchádzajúcej
enkapsulácii liečiva s ďalšími polymérmi.
MI z rozpustných polymérov poskytujú rýchle uvoľnenie do niekoľkých minút. Tieto polyméry sú rozpustné vo vode a MI z nich vyrobené sa môžu rýchlo a kompletne rozpustiť v koži bez zanechania biologicky nebezpečného odpadu. Rýchle rozpustenie ihiel je sprevádzané prudkým uvoľnením zapuzdreného obsahu, a preto sú vhodné pre okamžité uvoľňovanie liečiva54). Väčšina rozpustných polymérov, ktoré boli použité na výrobu MI, sú polysacharidy, ktoré obsahujú veľké množstvo hydrofilných skupín, prípadne sú aj rozvetvené, čo urýchľuje ich rozpúšťanie vo vodnom prostredí. Z polysacharidov boli použité na výrobu MI CMC47), hydroxypropylcelulóza, hydroxypropylmetylcelulóza55), chondroitín sulfát sodný56), alginát sodný57), dextrán56), amylopektín58), maltóza, kyselina hyalurónová59). MI boli dostatočne pevné aby prepichli pokožku, kde sa rýchlo rozpúšťali a uvoľňovali modelové liečivá ako monoklonálny IgG, donepezil, desmopresín. Okrem polysacharidov boli použité na výrobu rozpustných MI látky ako gelatín60), poly-γ-glutámová kyselina61), PVP 62–64), polyvinylalkohol 96, PMVE/MA65).
MI zo sieťovaných polymérov po prepichnutí kože v nej napučiavajú, po vytiahnutí zostávajú intaktné a sú základom pre tzv. hydrogélové MI. Na výrobu gélových MI bol použitý polymér kyseliny polymetylvinyléter-ko-maleinovej sieťovaný pektínom36) alebo polyetylénglykolom37). MI boli dostatočne tvrdé, aby prenikali pokožkou, a tuhé, aby sa nelámali. Hroty ihiel v pokožke napučali a vytvárali priechody pre trvalú difúziu liečiva z náplasti do dermálnej mikrocirkulácie. Tieto materiály sú biokompatibilné, nedráždivé a nezanechávali žiadne reziduá v pokožke40). Ďalšie hydrogélové MI boli vyrobené zo zmesi PVA, dextránu a CMC mikroodlievaním pri zníženom tlaku s následnou lyofilizáciou, tieto MI boli 800 µm dlhé a priemer základne bol 300 µm38).
Rýchlosť uvoľňovania liečiva nezávisí len od typu polyméru, ktorý bol pri výrobe použitý, ale aj od samotného výrobného procesu. Liečivo je pri výrobnom procese zapuzdrené do štruktúrneho materiálu ihiel, opornej plochy alebo do oboch častí a difunduje v priebehu rozpustenia alebo odbúravania zoskupenia MI do kože66).
Napriek mnohým výhodám polymérov je ich použitie spojené s určitými obmedzeniami. V prípade že sa pri výrobe používa zvýšená teplota na roztopenie polyméru, môže pri inkorporácii liečiv, hlavne bielkovinovej povahy, dochádzať k denaturácii ich primárnej a sekundárnej štruktúry. Problémom je aj znižovanie mechanickej pevnosti MI, zvyšovaním podielu liečiva v štruktúrnej matrici MI. Pri podiele liečiva 10 % nemali MI dostatočnú pevnosť. Ďalšou limitáciou je odhadované maximálne množstvo liečiva do 1 mg, ktoré je možné do zoskupenia MI inkorporovať. Preto je pravdepodobné, že táto aplikácia bude vyhradená pre liečivá veľmi silno účinné, ako je erytropoetín pri anémii s dávkou 100 µg na deň, interferón α-2A pri hepatitíde, interferón β-1A pri skleróze multiplex s dávkami 33 µg a 132 µg na týždeň51).
Technológie výroby mikroihiel
Na výrobu MI sa využívajú rôzne mikro, resp. nano-elektromechanické technológie, ktoré umožňujú vyrobiť MI. Najčastejšie používanými technikami sú priama fotolitografia, leptanie, mikroodlievanie alebo mikropracovanie. Metóda priamej fotolitografie je založená na rôznej fotochemickej reakcii polymérov vplyvom UV žiarenia. Vplyvom žiarenia dochádza u pozitívne reagujúcich polymérov k rozštiepeniu hlavného alebo bočných reťazcov, čím sa stávajú viac rozpustné vo vyvíjacom roztoku, naopak u negatívne reagujúcich dochádza k zosieťovaniu polyméru, ktorý sa stáva menej rozpustný vo vyvíjacom roztoku. Vzor sa vytvára ožiarením pozitívne reagujúcich polymérov cez fotošablónu a následným odstránením rozpustnejších častí vyvíjacím roztokom66).
Leptanie je proces, pri ktorom je spracovávaný materiál odstraňovaný leptadlom. Rozlišujeme mokré leptanie, ktoré využíva silné kyseliny a žieraviny na leptanie. Pri mokrom leptaní sa využívajú šablóny z nereagujúceho materiálu, napr. chrómu. Mokrým leptaním bolo vyrobené zoskupenie pevných MI z kremíka s výškou 280 µm. Hlavnou nevýhodou tejto metódy bol malý pomer strán 3 : 2, čo limitovalo výšku a hustou vyrobených MI14). Suché leptanie využíva plazmu rôznych plynov na opracovanie materiálu. Časti, ktoré nemajú byť rozleptané, sa pred expozíciou plynov musia ošetriť ochranným filmom. Táto technika bola využitá na opracovanie dutých kremíkových MI rôzneho tvaru a výšky (30 – 140 μm). Hrúbka steny bola 70 – 110 nm a priemer kanála 2 – 5 μm.
Ihly boli spojené so striekačkou pomocou ktorej sa aplikovala dávka liečiva67).
Technológia mikroodlievaním je založená na odlievaní hlavnej formy z dostatočne tvrdého materiálu (polydimetylsiloxánu, titánu) vhodným substrátom. Substrátom môže byť prepolymér, ktorý následne vo forme polymerizuje, roztavený polymér, ktorý vo forme po ochladení tuhne, tekutý polymér s vytvrdzujúcim činidlom, ktoré vo forme chemicky reagujú za vzniku tuhého produktu. Vzhľadom na malé rozmery formy prebieha odlievanie často v špecifických podmienkach: pod vplyvom vákua, odstredivej sily centrifúgy, pomocou atomizovaného spreja. Tieto podmienky sa zabezpečujú s cieľom dokonalého vyplnenia formy a zabráneniu vzniku vzduchových bublín68).
Polymérny poloprodukt je možné aj prístrojovo mikroopracovať pomocou mikroforézy alebo laserovej ablácie. Koniec vrtáka mikroforézy má dĺžku 400 μm a šírku 200 μm. Laserové mikroopracovanie sa používa pri veľmi detailných vzoroch, ktoré sa navrhnú napr. v programe AutoCAD66).
Okrem spomenutých boli na výrobu MI použité aj iné technológie ako laserové rezanie plechu16, 27), galvanické pokovovanie30), polymerizácia UV senzitívneho materiálu femtosekundovým laserom33), ťahanie skla ako pri výrobe mikropipiet31), litografická tlač69).
Použitie mikroihiel v klinickej praxi
Mikroperforácia kože pomocou MI sa využíva z rôznych dôvodov. Akupunktúru môžeme považovať ako prvé použitie kovových MI za účelom navodenia liečebného účinku stimuláciou nervových zakončení. Pre kozmetické účely je na trhu zariadenie Dermaroller® (Dermaroller GmbH, Wofenbüttel, Nemecko) so 192 MI upevnenými na rotujúcom valčeku. Dĺžka MI je 0,5 – 3 mm a priemer 70 µm. Valcovaním po pokožke MI prenikajú až za papilárnu vrstvu kože v závislosti od vyvinutého tlaku. Okem Dermarolleru® sú na trhu aj iné kozmetické zariadenia na báze MI ako Dermapen®, Dermastamp®, DermaFrac®, BeautyMouse®. Účelom týchto zariadení je stimulácia hojenia kože, odstraňovanie jaziev, pigmentácie a vrások a zároveň zvýšiť vstrebávanie kozmetických prípravkov do kože prepichnutím epidermy. Takáto aplikácia sa nazýva aj ako kolagénová indukčná terapia. Mikroprepichnutia kože do hĺbky 0,5 – 2 mm spôsobujú minimálne krvácanie, ale indukujú prirodzené opravné mechanizmy kože spojené so zápalom, proliferáciou a remodeláciou kože. Mikroperforácie kože spojené s aplikáciou 35% kyseliny glykolovej bolo spojené s lepším hojením jaziev po akné a lepšou výslednou textúrou kože70). Rovnako dermálna aplikácia kyseliny trichlóroctovej samotnej71) alebo s plazmou bohatou na krvné doštičky v kombinácii s mikroprepichovaním kože viedla k výrazne lepšiemu hojeniu jaziev rôznych stupňov bez závažných nežiadúcich účinkov72). Okrem ošetrenia jaziev sa takáto kombinácia MI s účinnou látkou použila pri terapii alopécie. Kombinácia MI-minoxidil zvýšila počet vlasov 4-násobne oproti samotnej topickej aplikácii roztoku minoxidilu73). Obdobne bol zaznamenaný viac ako 10% nárast hustoty vlasov pri aplikácii roztoku rastových faktorov na vlasy s následnou aplikáciou MI oproti aplikácii slaného roztoku na vlasy s následnou aplikáciou MI74).
Vo februári 2019 vyhľadaním na stránke www.clinicaltrials.gov (U.S. National Library of Medicine) pomocou kľúčového slova „microneedle“ nachádzame 85 klinických štúdií. Prvá štúdia z roku 2007 hodnotila účinnosť
a bezpečnosť aplikácie lokálnej anestézie použitím zariadenia MicronJetTM s MI pred zavedením intravenózneho katétra75). Väčšina štúdií je zameraná na aplikáciu MI pri dermálnych indikáciách ako aktinická keratóza, hyperhydróza, melazma, vrásky, jazvy, starnutie kože, vitiligo, alopécia a pigmentácia kože. V nasledujúcich riadkoch sa budeme venovať štúdiám, ktoré mali publikované výsledky (tab. 2).
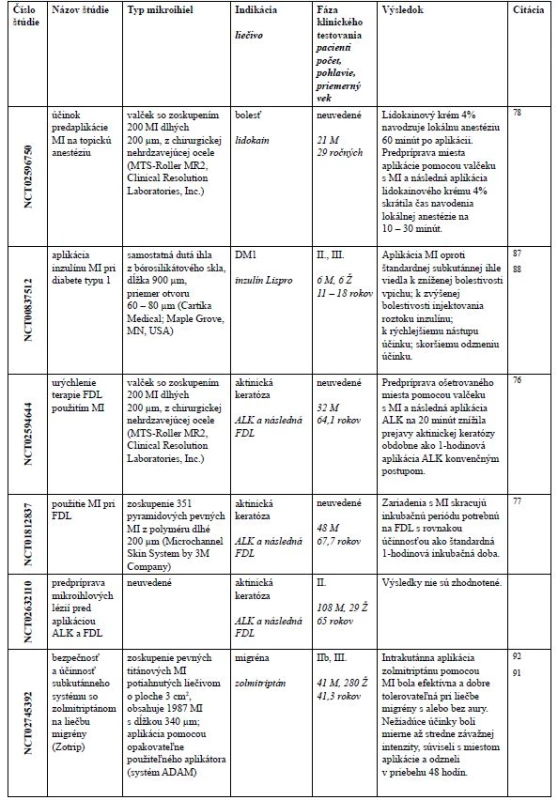

Aktinická keratóza je dysplastická lézia, ktorá sa považuje za premaligný prejav skvamocelulárneho karcinómu. Rizikovými faktormi sú chronická expozícia slnečnému žiareniu, svetlá pokožka, imunosupresia a vyšší vek. Jedným z liečebných postupov je použitie fotodynamyckej liečby (FDL), ktorá je určená pre malé až stredné aktinické keratózy pokožky tváre a hlavy. V rámci FDL sa aplikuje na lézie 20% dermálny roztok kyseliny aminolevúlovej (ALK) s následným osvetlením
modrým svetlom s intenzitou 10 J/cm2 po dobu 1000 sekúnd. Dysplastické bunky primárne absorbujú ALK, ktorú metabolizujú na protoporfyrín IX, endogénnu látku s fotosenzibilnými vlastnosťami. Modré svetlo aktivuje protoporfyrín IX, v prítomnosti kyslíka vznikajú reaktívne
formy kyslíka, ktoré spúšťajú cytotoxickú kaskádu vedúcu k usmrteniu dysplastických buniek s minimálnym poškodením zdravých buniek. ALK je hydrofilná molekula, ktorá veľmi pomaly preniká cez jednotlivé vrstvy kože, s čím je spojená dlhá 1-hodinová inkubačná doba. Použitím MI bolo možné skrátiť inkubačnú dobu na 20 minút, zároveň bola pozorovaná mierne znížená bolestivosť počas osvetlovania modrým svetlom76, 77). K obdobnému skráteniu času od aplikácie liečiva po jeho lokálny účinok viedla predperforácia kože pomocou valčeku s pevnými MI a aplikácia lidokainu. Uvedená kombinácia MI-lidokain skrátila čas navodenia účinku lidokainu na 30 – 10 minút, pričom samotný lidokainový krém 4% navodzoval lokálnu anestézu až 60 minút po aplikácii78).
Značná časť klinických štúdií bola venovaná intradermálnej aplikácií vakcín proti chrípke, ale aj proti detskej obrne. Väčšina vakcín sa aplikuje intramuskulárne pripadne subkutánne. Takáto aplikácia je bolestivá a vakcína sa dostáva do tkanív pod kožou, kde nie sú tak bohato zastúpené antigén prezentujúce bunky. Pomocou MI je možné antigény obsiahnuté vo vakcíne vpraviť do pokožky alebo zamše, ktoré sú bohato zásobené bunkami imunitného systému schopnými prezentovať antigén, dentritovými bunkami. V klinických štúdiách hodnotiacich použitie MI na očkovanie proti chrípke boli použité aplikačné zariadenia BD SoluviaTM (BD Bioscience) a MicronJetTM (Nanopass technologies) s kovovými dutými MI79). Randomizované klinické štúdie
potvrdili porovnateľnú imunogenitu intradermálne aplikovanej vakcíny (BD SoluviaTM) s nižšou dávkou hemaglutinínu 9 µg oproti intramuskulárne aplikovanej vakcíne s dávkou 15 µg hemaglutinínu u zdravých dospelých dobrovoľníkov80). U starších pacientov (60 – 85 ročných) sa porovnávala aplikácia rovnakej dávky hemaglutinínu, pričom intradermálna aplikácia pomocou MI bola spojená s vyšším titrom protilátok ako aplikácia intramuskulárna81). U imunokompromitovaných pacientov s transplantáciou obličky viedla intradermálna aplikácia chrípkovej vakcíny k vyššej imunitnej odpovedi proti všetkým vakcinačným kmeňom ako konvenčná intramuskulárna aplikácia82). Intradermálne vakcíny boli dobre tolerovateľné bez klinicky významných nežiadúcich účinkov. Chrípková vakcína s BD SoluviaTM bola na trhu dostupná pod rôznymi názvami: Intanza®, IDFlu® a Fluzone Intradermal®. V roku 2018 však boli spoločnosťou Sanofi Pasteur stiahnuté z európskeho trhu vakcíny Intanza® 83) a IDFlu® 84). Dôvodom môže byť zvýšená kožná iritácia oproti intramuskulárnym vakcínam, ale aj paradoxný fakt, že nebolestivá aplikácia intradermálnych vakcín privádzala zdravotníckych pracovníkov a pacientov po aplikácii do neistoty, či vakcína bola skutočne a správne aplikovaná. Každopádne oficiálne vyjadrenie k dispozícii nie je.
MI boli použité aj v rámci II fázy klinického testovania inaktivovanej vakcíny proti detskej obrne (polio-vakcína), na skupine 231 dospelých s HIV infekciou85). Polio-vakcína je účinným prostriedkom na dosiahnutie celosvetovej eradikácie detskej obrny, avšak rozvojové krajiny ako Afghánistán, Pakistán, Nigéria s nedostatočnými prostriedkami sú miestami s pokračujúcim endemickým výskytom divokého poliovírusu86). Snahy o zníženie nákladov znížením dávky polio-vakcíny na 20% pri zachovanej intramuskulárnej aplikácii však neviedli k uspokojivým výsledkom. V rámci uvedenej štúdie bola odpoveď na intradermálnu aplikáciu 40 % štandardnej dávky polio-vakcíny porovnateľná so štandardnou dávkou intramuskulárne aplikovanej polio-vakcíny, okrem toho bol titer protilátok porovnateľný, resp. nesignifikantne vyšší. Na mikroinjektovanie bolo použité zariadenie MicronJet600 (NanoPass), ktoré je zoskupením trojstranných dutých pyramidálnych ihiel dĺžky
600 µm85). Pri ďalšej klinickej štúdii vo fáze III, ktorá používa MicronJet600 na vakcináciu proti detskej obrne u 6 – 14 týždňových detí, môžeme očakávať zverejnenie výsledkov (NCT01813604).
Liečba diabetických pacientov s diabetom typu I a pokročilým diabetom typu II sa nezaobíde bez subkutánnej aplikácie inzulínu či už pomocou striekačky, inzulínového pera, tryskových aplikátorov (Insujet) alebo inzulínových púmp. Okrem toho si musí diabetický pacient pomocou glukomeru pravidelne kontrolovať hladinu cukru v krvi, ktorá sa získa prepichnutím bruška prsta sterilnou lancetou. Výskum v tejto oblasti sa zameral na bezbolestivú aplikáciu inzulínu a monitorovanie cukru v krvi. V súčasnosti je na stránke www.clinicaltrials.gov 10 štúdií, ktoré používali MI u diabetických pacientov, avšak len jedna malá štúdia s uverejnenými výsledkami (NCT00837512). V rámci nej bolo použité zariadenie so samostatnou dutou MI z bórosilikátového skla, dĺžkou 900 µm, priemerom otvoru 60 – 80 µm (Cartika Medical; Maple Grove, MN, USA). Na jednej strane bol samotný vpich pomocou MI menej bolestivý, avšak následné injektovanie roztoku inzulínu lispro bolo bolestivejšie. Aplikácia inzulínu lispro viedla k rýchlejšiemu nástupu účinku a skoršiemu odzneniu účinku87, 88). MI náplasti boli využité aj v štúdii na meranie hladiny inzulínu v krvi (NCT02682056). V ďalšej štúdii (NCT02459938) so 16 účastníkmi bola porovnávaná aplikácia glukagónových náplastí s MI oproti štandardnej injekcii glukagónu. Na stránke výrobcu nachádzame vyjadrenie, že obidva spôsoby aplikácie viedli k rýchlemu nástupu účinku a porovnateľnému času glukózovej odpovede89).
Abaloparatid je analóg proteínu podobnému parathormónu (PTHrP), ktorý zvyšuje kostnú hustotu a pevnosť kostí so zachovaním normálnej kvality kostí na zvieracích osteoporotických modeloch. V II. fáze klinického testovania (NCT01674621) na 231 ženách s osteoporózou bol abaloparatid aplikovaný vo forme náplasti so zoskupenými 316 vrstvenými MI. Takto aplikovaný abaloparatid v dávke 150 µg zvyšoval kostnú denzitu chrbtice o 2,9 % a bedra o 1,5 % oproti placebu90).
Zolmitriptán zo skupiny triptánov sa používa na liečbu migrény. Od roku 1992, kedy sú triptány na trhu, boli k dispozícii v rôznych liekových formách – perorálnych tabliet, orodispergovateľných tabliet, nosových sprejov, nosových práškov, rektálnych čapíkov a formy aplikované subkutánne bez ihly alebo s ihlou. V randomizovanej dvojito zaslepenej paralelnej štúdii kontrolovanej placebom (NCT02745392) bola hodnotená intradermálna aplikácia zolmitriptánu voči placebu. Celý systém (Adhesive Dermally-AppliedMicroarray – ADAM) pozostával z jednorazových náplastí tvorených vrstvou zoskupených 1987 titánových MI s dĺžkou 340 µm potiahnutých zolmitriptánom alebo nepotiahnutých (placebo) s rozmerom 3 cm2 a adhezívnej vrstvy nalepenej na zadnú stranu s rozmerom 5 cm2. Náplasti boli aplikované pomocou opakovateľne použiteľného zariadenia91). Štúdia preukázala na dávke závislú účinnosť ADAM zolmitriptanu. Pri najvyššej dávke 3,8 mg zolmitriptánu pomocou ADAM nemalo bolesti po 2 hodinách takmer 42 % pacientov oproti 10 % pri placebe. Po 24 hodinách sa počet pacientov bez bolesti zvýšil na 70 % u pacientov s aplikovaným ADAM zolmitriptánom oproti necelým 40 % pri aplikácii placeba92).
Záver
Od roku 1981, kedy spoločnosť ALZA Corp. Uviedla na trh prvé transdermálne náplasti so skopolamínom na prevenciu kinetóz (Transderm-Scop) a transdermálne náplasti s nitroglicerínom na prevenciu angíny pectoris spojenej s ochorením koronárnych ciev uplynulo takmer 40 rokov94). Počas tohto obdobia sa transdermálne náplasti stali praktickou a osvedčenou liekovou formou, ktorá má svoje prednosti najmä z pohľadu dlhodobého,
riadeného a kontrolovaného uvoľňovania liečiva, ktorého prívod je možné prerušiť v akomkoľvek čase počas aplikácie. Napriek tomu diapazón liečiv, ktorý je podávaný
transdermálnou cestou, je pomerne úzky. To súvisí jednak s obmedzením liečiv, ktorých dávka je tak veľká, že prakticky neumožňuje pripraviť liekovú formu s dlhodobým pôsobením. Ďalšou príčinou je fyzikálno-chemická vlastnosť liečiv, ktoré permeujú cez pokožku veľmi pomaly. Na zvýšenie permeácie boli použité rôzne postupy, spomenuté v úvode, ktoré sú zamerané buď na modifikáciu liečiva, alebo modifikáciu kože. MI modifikujú kožu, sú schopné prepichnúť epidermu a tak vytvoriť mikrokanály, ktorými môže akékoľvek liečivo ľahšie prestupovať do zamše, kde sa nachádzajú krvné a lymfatické cievy. Zároveň ak ich dĺžka je optimálna okolo 300 µm, nezasahujú nervové zakončenia, čím sa ich aplikácia stáva nebolestivou.
Z klinického hľadiska môžeme rozlíšiť použitie MI na urýchlenú aplikáciu liečiva transdermálnou cestou. Môže tak nahradiť topickú aplikáciu bežnými dermálnymi liekovými formami alebo injekčnú aplikáciu liečiv. Aplikované liečivo prostredníctvom MI pôsobí lokálne (lidokain, ALK), alebo systémovo (inzulín, zolmitriptán, abaloparatid, vakcíny proti chrípke, detskej obrne). Matricové a hydrogélové MI majú potenciál na aplikáciu liečiva s predĺženým uvoľňovaním liečiva. Takto aplikované liečivo môže nahradiť perorálne liekové formy s predĺženým uvoľňovaním liečiva. Súčasné klinické štúdie sa však aplikácii MI s predĺženým uvoľňovaním nevenujú. Je otázne, ako by dlhodobá perforácia kože MI pôsobila na pokožku z pohľadu jej iritácie a rizika zvýšenej kontaminácie kože. Predĺžiť pôsobenie liečiva je na druhej strane možné jeho formuláciou do mikroforiem, bez toho aby sa výrazne predlžovala doba aplikácie95).
Doteraz zverejnené klinické štúdie nepreukázali zásadné problémy z pohľadu iritácie kože. Pri aplikácii chrípkových vakcín bola pozorovaná zvýšená kožná reakcia, ktorá však súvisí skôr s farmakologickým pôsobením na antigénprezentujúce bunky, čím sa vyvolá zápal. V prípade, že materiály, ktoré budú použité na výrobu MI nebudú mať vplyv na iritáciu kože, bude prípadná iritácia kože pravdepodobne súvisieť s pôsobením liečiva.
Z výrobného hľadiska je otázne, ako budú tieto systémy klasifikované, ako intradermálne alebo transdermálne systémy? Rovnako sú otázne požiadavky na výrobu, budú sa posudzovať ako injekčné lieky, alebo ako transdermálne náplasti?
Vývoj MI pokročil míľovými krokmi od roku 1976, kedy bol popísaný prvý systém s MI96). K dispozícii sú MI rôznych typov, veľkostí, tvarov, vyrábané z rôznych materiálov a rôznymi technológiami. Vo väčšom rozsahu boli MI využívané pri aplikácia chrípkových vakcín, ktoré však boli z trhu stiahnuté v roku 2018. Na druhej strane sa celosvetovo používajú rolery s MI na kozmetické perforácie kože s prípadnou aplikáciou podporných látok. Zvyšujúci sa počet klinických štúdií, v ktorých boli použité MI na transdermálnu aplikáciu liečiv naznačuje, že v tomto smere môžeme očakávať zvyšujúci sa počet liekov uvádzaných na trh využívajúcich technológiu MI.
Stret záujmov: žiadny.
PharmDr. Tomáš Wolaschka, PhD. (*)
Katedra farmaceutickej technológie
Univerzita veterinárskeho lekárstva a farmácie v Košiciach
Komenského 73, 041 81 Košice, SR
e-mail: tomas.wolaschka@uvlf.sk
Sources
1. Kirschner N., Houdek P., Fromm M., Moll I., Brandner J. M. Tight junctions form a barrier in human epidermis. Eur. J. Cell Biol. 2010; 89(11), 839–842. https://doi.org/10.1016/j.ejcb.2010.07.010
2. Andrews S. N., Jeong E., Prausnitz M. R. Transdermal delivery of molecules is limited by full epidermis, not just stratum corneum. Pharm. Res. 2013; 30(4), 1099–1109. https://doi.org/10.1007/s11095-012-0946-7
3. Gaur P. K., Mishra S., Purohit S., Dave K. Transdermal Drug Delivery System: A Review RANSDERMAL DRUG DELIVERY SYSTEM: A REVIEW. Asian J. Pharm. Clin. Res. 2009; 2(1), 14–20.
4. Nisar A., Afzulpurkar N., Mahaisavariya B., Tuantranont A. MEMS-based micropumps in drug delivery and biomedical applications. Sensors Actuators, B Chem. 2008; 130(2), 917–942. https://doi.org/10.1016/j.snb.2007.10.064
5. Ashraf M. W., Tayyaba S., Afzulpurkar N. Micro Electromechanical Systems (MEMS) based microfluidic devices for biomedical applications. Int. J. Mol. Sci. 2011; 12(6), 3648–3704. https://doi.org/10.3390/ijms12063648
6. Ita K. Transdermal delivery of drugs with microneedles – potential and challenges. Pharmaceutics. 2015; 7(3), 90–105. https://doi.org/10.1016/j.jddst.2015.05.001
7. Gill H. S., Denson D. D., Burris B. A., Prausnitz M. R. Effect of microneedle design on pain in human volunteers. Clin. J. Pain. 2008; 24(7), 585–594. https://doi.org/10.1097/AJP.0b013e31816778f9
8. Khanna P., Luongo K., Strom J. A., Bhansali S. Sharpening of hollow silicon microneedles to reduce skin penetration force. J. Micromechanics Microengineering. 2010; 20(4), 45011. https://doi.org/10.1088/0960-1317/20/4/045011
9. Gittard S. D., Chen B., Xu H., Ovsianikov A., Chichkov B. N., Monteiro-Riviere N. A., et al. The effects of geometry on skin penetration and failure of polymer microneedles. J. Adhes. Sci. Technol. 2013; 27(3), 227–243. https://doi.org/10.1080/01694243.2012.705101
10. Davis S. P., Prausnitz M. R., Allen M. G. Fabrication and characterization of laser micromachined hollow microneedles. TRANSDUCERS 2003 – 12th International Conference on Solid-State Sensors, Actuators and Microsystems, Digest of Technical Papers, vol. 2. IEEE 2003; 1435–1438.
11. Arora A., Prausnitz M. R., Mitragotri S. Micro-scale devices for transdermal drug delivery. Int. J. Pharm. 2008; 364(2), 227–236. https://doi.org/10.1016/j.ijpharm.2008.08.032
12. Han M., Hyun D. H., Park H. H., Lee S. S., Kim C. H., Kim C. A novel fabrication process for out-of-plane microneedle sheets of biocompatible polymer. J. Micromechanics Microengineering 2007; 17(6), 1184–1191. https://doi.org/10.1088/0960-1317/17/6/012
13. Chen M. C., Ling M. H., Lai K. Y., Pramudityo E. Chitosan microneedle patches for sustained transdermal delivery of macromolecules. Biomacromolecules 2012; 13(12), 4022–4031. https://doi.org/10.1021/bm301293d
14. Wilke N., Mulcahy A., Ye S. R., Morrissey A. Process optimization and characterization of silicon microneedles fabricated by wet etch technology. Microelectronics J. 2005; 36(7), 650–656. https://doi.org/10.1016/j.mejo.2005.04.044
15. Jenkins D., Corrie S., Flaim C., Kendall M. High density and high aspect ratio solid micro-nanoprojection arrays for targeted skin vaccine delivery and specific antibody extraction. RSC Adv. 2012; 2(8), 3490–3495. https://doi.org/10.1039/c2ra20153d
16. Martanto W., Davis S. P., Holiday N. R., Wang J., Gill H. S., Prausnitz M. R. Transdermal delivery of insulin using microneedles in vivo. Pharm. Res. 2004; 21(6), 947–952. https://doi.org/10.1023/B:PHAM.0000029282.44140.2e
17. Bystrova S., Luttge R. Micromolding for ceramic microneedle arrays. Microelectron. Eng. 2011; 88(8), 1681–1684. https://doi.org/10.1016/j.mee.2010.12.067
18. Ma G., Wu C. Microneedle, bio-microneedle and bio-inspired microneedle: A review. J. Control. Release 2017; 251, 11–23.
19. Miyano T., Tobinaga Y., Kanno T., Matsuzaki Y., Takeda H., Wakui M., et al. Sugar Micro Needles as Transdermic Drug Delivery System. Biomed. Microdevices 2005; 7(3), 185–188. https://doi.org/10.1007/s10544-005-3024-7
20. Paik S. J., Byun S., Lim J. M., Park Y., Lee A., Chung S., et al. In-plane single-crystal-silicon microneedles for minimally invasive microfluid systems. Sensors Actuators, A Phys. 2004; 114(2–3), 276–284. https://doi.org/10.1016/j.sna.2003.12.029
21. Sebastien H., Mcallister D. V., ALLEN M. G., Prausnitz M. R. Microfabricated Microneedles: A Novel Approach to Transdermal Drug Delivery. vol. 87. Elsevier 1998; 1–3.
22. S H., P L., G H., M R., R G., W T. Genetic transformation of nematodes using arrays of micromechanical piercing structures. Biotechniques 1995; 19, 766–770.
23. Larrañeta E., Lutton R. E. M., Woolfson A. D., Donnelly R. F. Microneedle arrays as transdermal and intradermal drug delivery systems: Materials science, manufacture and commercial development. Mater. Sci. Eng. R Reports 2016; 104, 1–32.
24. Oh J. H., Park H. H., Do K. Y., Han M., Hyun D. H., Kim C. G., et al. Influence of the delivery systems using a microneedle array on the permeation of a hydrophilic molecule, calcein. Eur. J. Pharm. Biopharm. 2008; 69(3), 1040–1045. https://doi.org/10.1016/j.ejpb.2008.02.009
25. Ng H. I., Fernando G. J. P., Kendall M. A. F. Induction of potent CD8+ T cell responses through the delivery of subunit protein vaccines to skin antigen-presenting cells using densely packed microprojection arrays. J. Control. Release 2012; 162(3), 477–484. https://doi.org/10.1016/j.jconrel.2012.07.024
26. Cormier M., Johnson B., Ameri M., Nyam K., Libiran L., Zhang D. D., et al. Transdermal delivery of desmopressin using a coated microneedle array patch system. J. Control. Release 2004; 97(3), 503–511. https://doi.org/10.1016/j.jconrel.2004.04.003
27. Kim Y. C., Quan F. S., Compans R. W., Kang S. M., Prausnitz M. R. Formulation and coating of microneedles with inactivated influenza virus to improve vaccine stability and immunogenicity. J. Control. Release 2010; 142(2), 187–195. https://doi.org/10.1016/j.jconrel.2009.10.013
28. Han M., Kim D. K., Kang S. H., Yoon H. R., Kim B. Y., Lee S. S., et al. Improvement in antigen-delivery using fabrication of a grooves-embedded microneedle array. Sensors Actuators, B Chem. 2009; 137(1), 274–280. https://doi.org/10.1016/j.snb.2008.11.017
29. Gardeniers H. J. G. E., Luttge R., Berenschot E. J. W., de Boer M. J., Yeshurun S. Y., Hefetz M., et al. Silicon micromachined hollow microneedles for transdermal liquid transport. J. Microelectromechanical Syst. 2003; 12(6), 855–862. https://doi.org/10.1109/JMEMS.2003.820293
30. Davis S. P., Martanto W., Allen M. G., Prausnitz M. R. Hollow metal microneedles for insulin delivery to diabetic rats. IEEE Trans. Biomed. Eng. 2005; 52(5), 909–915. https://doi.org/10.1109/TBME.2005.845240
31. Wang P. M., Cornwell M., Hill J., Prausnitz M. R. Precise microinjection into skin using hollow microneedles. J. Invest. Dermatol. 2006; 126(5), 1080–1087. https://doi.org/10.1038/sj.jid.5700150
32. Bodhale D. W., Nisar A., Afzulpurkar N. Structural and microfluidic analysis of hollow side-open polymeric microneedles for transdermal drug delivery applications. Microfluid. Nanofluidics. 2010; 8(3), 373–392. https://doi.org/10.1007/s10404-009-0467-9
33. Ovsianikov A., Chichkov B., Mente P., Monteiro-Riviere N. A., Doraiswamy A., Narayan R. J. Two photon polymerization of polymer-ceramic hybrid materials for transdermal drug delivery. Int. J. Appl. Ceram. Technol. 2007; 4(1), 22–29. https://doi.org/10.1111/j.1744-7402.2007.02115.x
34. Garland M. J., Migalska K., Mahmood T. M. T., Singh T. R. R., Woolfson A. D., Donnelly R. F. Microneedle arrays as medical devices for enhanced transdermal drug delivery. Expert Rev. Med. Devices 2011; 8(4), 459–482. https://doi.org/10.1586/erd.11.20
35. Hong X., Wei L., Wu F., Wu Z., Chen L., Liu Z., et al. Dissolving and biodegradable microneedle technologies for transdermal sustained delivery of drug and vaccine. Drug Des. Devel. Ther. 2013; 7, 945–952.
36. Demir Y. K., Metin A. Ü., Şatıroğlu B., Solmaz M. E., Kayser V., Mäder K. Poly (methyl vinyl ether-co-maleic acid) – Pectin based hydrogel-forming systems: Gel, film, and microneedles. Eur. J. Pharm. Biopharm. 2017; 117, 182–194.
37. Donnelly R. F., Singh T. R. R., Garland M. J., Migalska K., Majithiya R., McCrudden C. M., et al. Hydrogel-forming microneedle arrays for enhanced transdermal drug delivery. Adv. Funct. Mater. 2012; 22(23), 4879–4890. https://doi.org/10.1002/adfm.201200864
38. Yang S., Feng Y., Zhang L., Chen N., Yuan W., Jin T. A scalable fabrication process of polymer microneedles. Int. J. Nanomedicine 2012; 7, 1415–1422.
39. Gratieri T., Alberti I., Lapteva M., Kalia Y. N. Next generation intra - and transdermal therapeutic systems: Using non - and minimally-invasive technologies to increase drug delivery into and across the skin. Eur. J. Pharm. Sci. 2013; 50(5), 609–622. https://doi.org/10.1016/j.ejps.2013.03.019
40. Hong X., Wu Z., Chen L., Wu F., Wei L., Yuan W. Hydrogel Microneedle Arrays for Transdermal Drug Delivery. Nano-Micro Lett. 2014; 6, 191–199.
41. Kim Y. C., Park J. H., Prausnitz M. R. Microneedles for drug and vaccine delivery. Adv. Drug Deliv. Rev. 2012; 64(14), 1547–1568. https://doi.org/10.1016/j.addr.2012.04.005
42. Cai B., Xia W., Bredenberg S., Engqvist H. Self-setting bioceramic microscopic protrusions for transdermal drug delivery. J. Mater. Chem. B. 2014; 2(36), 5992–5998. https://doi.org/10.1039/c4tb00764f
43. Verbaan F. J., Bal S. M., van den Berg D. J., Groenink W. H. H., Verpoorten H., Lüttge R., et al. Assembled microneedle arrays enhance the transport of compounds varying over a large range of molecular weight across human dermatomed skin. J. Control. Release 2007; 117(2), 238–245. https://doi.org/10.1016/j.jconrel.2006.11.009
44. Chandrasekaran S., Brazzle J. D., Frazier A. B. Surface micromachined metallic microneedles. J. Microelectromechanical Syst. 2003; 12(3), 281–288. https://doi.org/10.1109/JMEMS.2003.809951
45. Martin C. J., Allender C. J., Brain K. R., Morrissey A., Birchall J. C. Low temperature fabrication of biodegradable sugar glass microneedles for transdermal drug delivery applications. J. Control. Release 2012; 158(1), 93–101. https://doi.org/10.1016/J.JCONREL.2011.10.024
46. Donnelly R. F., Morrow D. I. J., Singh T. R. R., Migalska K., McCarron P. A., O’Mahony C., et al. Processing difficulties and instability of carbohydrate microneedle arrays. Drug Dev. Ind. Pharm. 2009; 35(10), 1242–1254. https://doi.org/10.1080/03639040902882280
47. Loizidou E. Z., Williams N. A., Barrow D. A., Eaton M. J., McCrory J., Evans S. L., et al. Structural characterisation and transdermal delivery studies on sugar microneedles: Experimental and finite element modelling analyses. Eur. J. Pharm. Biopharm. 2015; 89, 224–231.
48. Lee K., Lee C. Y., Jung H. Dissolving microneedles for transdermal drug administration prepared by stepwise controlled drawing of maltose. Biomaterials 2011; 32(11), 3134–3140. https://doi.org/10.1016/J.BIOMATERIALS.2011.01.014
49. Demuth P. C., Min Y., Irvine D. J., Hammond P. T. Implantable silk composite microneedles for programmable vaccine release kinetics and enhanced immunogenicity in transcutaneous immunization. Adv. Healthc. Mater. 2014; 3(1), 47–58. https://doi.org/10.1002/adhm.201300139
50. Jin J., Reese V., Coler R., Carter D., Rolandi M. Chitin Microneedles for an Easy-to-Use Tuberculosis Skin Test. Adv. Healthc. Mater. 2014; 3(3), 349–353. https://doi.org/10.1002/adhm.201300185
51. Park J. H., Allen M. G., Prausnitz M. R. Polymer microneedles for controlled-release drug delivery. Pharm. Res. 2006; 23(5), 1008–1019. https://doi.org/10.1007/s11095-006-0028-9
52. Zhang J., Wang Y., Jin J. Y., Degan S., Hall R. P., Boehm R. D., et al. Use of Drawing Lithography-Fabricated Polyglycolic Acid Microneedles for Transdermal Delivery of Itraconazole to a Human Basal Cell Carcinoma Model Regenerated on Mice. JOM. 2016; 68(4), 1128–1133. https://doi.org/10.1007/s11837-016-1841-1
53. Cha K. J., Kim T., Park S. J., Kim D. S. Simple and cost-effective fabrication of solid biodegradable polymer microneedle arrays with adjustable aspect ratio for transdermal drug delivery using acupuncture microneedles. J. Micromechanics Microengineering. 2014; 24(11), 115015. https://doi.org/10.1088/0960-1317/24/11/115015
54. Wang M., Hu L., Xu C. Recent advances in the design of polymeric microneedles for transdermal drug delivery and biosensing. Lab Chip. 2017; 17(8), 1373–1387. https://doi.org/10.1039/C7LC00016B
55. Kim J. Y., Han M. R., Kim Y. H., Shin S. W., Nam S. Y., Park J. H. Tip-loaded dissolving microneedles for transdermal delivery of donepezil hydrochloride for treatment of Alzheimer’s disease. Eur. J. Pharm. Biopharm. 2016; 105, 148–55.
56. Vandeweerd C., Myers J., Coulter M., Yalcin A., Corvin J. Positives and negatives of online dating according to women 50+. J. Women Aging. 2016; 28(3), 259–270. https://doi.org/10.1007/s11095-010-0097-7
57. Demir Y. K., Akan Z., Kerimoglu O. Characterization of polymeric microneedle arrays for transdermal drug delivery. PLoS One 2013; 8(10), e77289. https://doi.org/10.1371/journal.pone.0077289
58. Lee J. W., Park J. H., Prausnitz M. R. Dissolving microneedles for transdermal drug delivery. Biomaterials 2008; 29(13), 2113–2124. https://doi.org/10.14219/jada.archive.2012.0208
59. Mönkäre J., Reza Nejadnik M., Baccouche K., Romeijn S., Jiskoot W., Bouwstra J. A. IgG-loaded hyaluronan-based dissolving microneedles for intradermal protein delivery. J. Control. Release 2015; 218, 53–62.
60. Lee I. C., Lin W. M., Shu J. C., Tsai S. W., Chen C. H., Tsai M. T. Formulation of two-layer dissolving polymeric microneedle patches for insulin transdermal delivery in diabetic mice. J. Biomed. Mater. Res. – Part A. 2017; 105(1), 84–93. https://doi.org/10.1002/jbm.a.35869
61. Chen M. C., Ling M. H., Kusuma S. J. Poly-γ-glutamic acid microneedles with a supporting structure design as a potential tool for transdermal delivery of insulin. Acta Biomater. 2015; 24, 106–116.
62. Sullivan S. P., Murthy N., Prausnitz M. R. Minimally invasive protein delivery with rapidly dissolving polymer microneedles. Adv. Mater. 2008; 20(5), 933–938. https://doi.org/10.1002/adma.200701205
63. Lee I. C., He J. S., Tsai M. T., Lin K. C. Fabrication of a novel partially dissolving polymer microneedle patch for transdermal drug delivery. J. Mater. Chem. B. 2015; 3(2), 276–285. https://doi.org/10.1039/c4tb01555j
64. Quinn H. L., Bonham L., Hughes C. M., Donnelly R. F. Design of a dissolving microneedle platform for transdermal delivery of a fixed-dose combination of cardiovascular drugs. J. Pharm. Sci. 2015; 104(10), 3490–3500. https://doi.org/10.1002/jps.24563
65. McCrudden M. T. C., Alkilani A. Z., McCrudden C. M., McAlister E., McCarthy H. O., Woolfson A. D., et al. Design and physicochemical characterisation of novel dissolving polymeric microneedle arrays for transdermal delivery of high dose, low molecular weight drugs. J. Control. Release 2014; 180(1), 71–80. https://doi.org/10.1016/j.jconrel.2014.02.007
66. Ochoa M., Mousoulis C., Ziaie B. Polymeric microdevices for transdermal and subcutaneous drug delivery. Adv. Drug Deliv. Rev. 2012; 64(14), 1603–1616.
67. Rodríguez A., Molinero D., Valera E., Trifonov T., Marsal L. F., Pallarès J., et al. Fabrication of silicon oxide microneedles from macroporous silicon. Sensors Actuators, B Chem. 2005; 109(1), 135–140. https://doi.org/10.1016/j.snb.2005.03.015
68. McGrath M. G., Vucen S., Vrdoljak A., Kelly A., O’Mahony C., Crean A. M., et al. Production of dissolvable microneedles using an atomised spray process: Effect of microneedle composition on skin penetration. Eur. J. Pharm. Biopharm. 2014; 86(2), 200–211. https://doi.org/10.1016/j.ejpb.2013.04.023
69. Lee K., Jung H. Drawing lithography for microneedles: A review of fundamentals and biomedical applications. Biomaterials. 2012; 33(30), 7309–7326. https://doi.org/10.1016/J.BIOMATERIALS.2012.06.065
70. Sharad J. Combination of microneedling and glycolic acid peels for the treatment of acne scars in dark skin. J. Cosmet. Dermatol. 2011; 10(4), 317–23. https://doi.org/10.1111/j.1473-2165.2011.00583.x
71. Garg S., Baveja S. Combination therapy in the management of atrophic acne scars. J. Cutan. Aesthet. Surg. 2014; 7(1), 18. https://doi.org/10.4103/0974-2077.129964
72. Nofal E., Helmy A., Nofal A., Alakad R., Nasr M. Platelet-rich plasma versus CROSS technique with 100% trichloroacetic acid versus combined skin needling and platelet rich plasma in the treatment of atrophic acne scars: A comparative study. Dermatologic Surg. 2014; 40(8), 864–873. https://doi.org/10.1111/dsu.0000000000000091
73. Dhurat R., Sukesh M., Avhad G., Dandale A., Pal A., Pund P. A randomized evaluator blinded study of effect of microneedling in androgenetic alopecia: A pilot study. Int. J. Trichology. 2013; 5(1), 6. https://doi.org/10.4103/0974-7753.114700
74. Lee Y. B., Eun Y. S., Lee J. H., Cheon M. S., Park Y. G., Cho B. K., et al. Effects of topical application of growth factors followed by microneedle therapy in women with female pattern hair loss: A pilot study. J. Dermatol. 2013; 40, 81–83.
75. Nanopass. A Study to Assess the Safety and Efficacy of a Microneedle Device for Local Anesthesia – Full Text View – ClinicalTrials.gov. Available at: https://clinicaltrials.gov/ct2/show/NCT00539084?term=microneedle&rank=5. Accessed January 23, 2019.
76. Petukhova T. A., Hassoun L. A., Foolad N., Barath M., Sivamani R. K. Effect of expedited microneedle-assisted photodynamic therapy for field treatment of actinic keratoses: A randomized clinical trial. JAMA Dermatology 2017; 153(7), 637–643. https://doi.org/10.1001/jamadermatol.2017.0849
77. Lev-Tov H., Larsen L., Zackria R., Chahal H., Eisen D. B., Sivamani R. K. Microneedle-assisted incubation during aminolaevulinic acid photodynamic therapy of actinic keratoses: a randomized controlled evaluator-blind trial. Br. J. Dermatol. 2017; 176(2), 543–545. https://doi.org/10.1111/bjd.15116
78. Miteva M., Lima M., Tosti A. Effect of microneedle pretreatment on topical anesthesia: A randomized clinical trial association of dermatology consultation with accuracy of cutaneous disorder diagnoses in hospitalized patients: A multicenter analysis limited information exists on th. JAMA Dermatology. 2016; 152(4), 476–477. https://doi.org/10.1001/jamadermatol.2015.5545
79. Bhatnagar S., Dave K., Venuganti V. V. K. Microneedles in the clinic. J. Control. Release. 2017; 260, 164–182.
80. Leroux-Roels I., Vets E., Freese R., Seiberling M., Weber F., Salamand C., et al. Seasonal influenza vaccine delivered by intradermal microinjection: A randomised controlled safety and immunogenicity trial in adults. Vaccine 2008; 26(51), 6614–6619. https://doi.org/10.1016/j.vaccine.2008.09.078
81. Arnou R., Icardi G., De Decker M., Ambrozaitis A., Kazek M. P., Weber F., et al. Intradermal influenza vaccine for older adults: A randomized controlled multicenter phase III study. Vaccine. 2009; 27(52), 7304–7312. https://doi.org/10.1016/j.vaccine.2009.10.033
82. Morelon E., Noble C. P., Daoud S., Cahen R., Goujon-Henry C., Weber F., et al. Immunogenicity and safety of intradermal influenza vaccination in renal transplant patients who were non-responders to conventional influenza vaccination. Vaccine 2010; 28(42), 6885–6890. https://doi.org/10.1016/j.vaccine.2010.08.015
83. European Medicines Agency. Intanza Withdrawal of the marketing authorisation in the European Union. Available at: https://www.ema.europa.eu/documents/public-statement/public-statement-intanza-withdrawal-marketing-authorisation-european-union_en.pdf. Accessed January 30, 2019.
84. European Medicines Agency. IDflu Withdrawal of the marketing authorisation in the European Union. Available at: https://www.ema.europa.eu/documents/public-statement/public-statement-idflu-withdrawal-marketing-authorisation-european-union_en.pdf. Accessed January 30, 2019.
85. Troy S. B., Kouiavskaia D., Siik J., Kochba E., Beydoun H., Mirochnitchenko O., et al. Comparison of the immunogenicity of various booster doses of inactivated polio vaccine delivered intradermally versus intramuscularly to HIV-infected adults. J. Infect. Dis. 2015; 211(12), 1969–1976. https://doi.org/10.1093/infdis/jiu841
86. Seventieth World Health Assembly. Poliomyelitis. Report by the Secretariat. WHO 2017; 1–18.
87. Norman J. J., Brown M. R., Raviele N. A., Prausnitz M. R., Felner E. I. Faster pharmacokinetics and increased patient acceptance of intradermal insulin delivery using a single hollow microneedle in children and adolescents with type 1 diabetes. Pediatr. Diabetes. 2013; 14(6), 459–465. https://doi.org/10.1111/pedi.12031
88. Gupta J., Felner E. I., Prausnitz M. R. Rapid pharmacokinetics of intradermal insulin administered using microneedles in type 1 diabetes subjects. Diabetes Technol. Ther. 2011; 13(4), 451–456. https://doi.org/10.1089/dia.2010.0204
89. Glucagon Z. P., Represents P. Zosano Pharma Announces Positive Phase 2 Results for Its ZP Glucagon Patch Program for Treatment of Severe Hypoglycemia 2016.
90. Yates J., Miller P. D., Bolognese M. A., Woodson G., Valter I., Clarkin M., et al. A transdermal patch delivering the PTHrP1-34 analog, abaloparatide (BA058), dose-dependently increases spine and hip BMD compared to placebo. Endocr. Rev. 2014; 35.
91. Kellerman D. J., Ameri M., Tepper S. J. Rapid systemic delivery of zolmitriptan using an adhesive dermally applied microarray. Pain Manag. 2017; 7(6), 559–567. https://doi.org/10.2217/pmt-2017-0036
92. Spierings E. L. H., Brandes J. L., Kudrow D. B., Weintraub J., Schmidt P. C., Kellerman D. J., et al. Randomized, double-blind, placebo-controlled, parallel-group, multi-center study of the safety and efficacy of ADAM zolmitriptan for the acute treatment of migraine. Cephalalgia 2018; 38(2), 215–224. https://doi.org/10.1177/0333102417737765
93. Leung D. Y. M., Jepson B., Beck L. A., Hanifin J. M., Schneider L. C., Paller A. S., et al. A clinical trial of intradermal and intramuscular seasonal influenza vaccination in patients with atopic dermatitis. J. Allergy Clin. Immunol. 2017; 139(5), 1575–1582.e8. https://doi.org/10.1016/j.jaci.2016.12.952
94. Saroha K., Yadav B., Sharma B. Transdermal patch: A discrete dosage form. Int. J. Curr. Pharm. Res. 2011; 3(3), 98–108.
95. Donnelly R. F., Larrañeta E. Microarray patches: potentially useful delivery systems for long-acting nanosuspensions. Drug Discov. Today 2018; 23(5), 1026–1033. https://doi.org/10.1016/J.DRUDIS.2017.10.013
96. Gerstel M., VA Place – US Patent 3 964,482., 1976 undefined. Drug delivery device. Google Patents. n.d
Labels
Pharmacy Clinical pharmacologyArticle was published in
Czech and Slovak Pharmacy

2019 Issue 1
-
All articles in this issue
- Plant-derived drugs and their applicaction in the anticancer therapy
- Microneedles as a perspective for transdermal therapeutic systems
- Film wound dressing containing dexpanthenol – preparation and evaluation
- Theory and practice of pharmacopoeial control of quality of drugs and excipients VIII. End-point indication and other conditions for the titration of primary aromatic amines in the European Pharmacopoeia (Ph. Eur.)
- Czech and Slovak Pharmacy
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Plant-derived drugs and their applicaction in the anticancer therapy
- Microneedles as a perspective for transdermal therapeutic systems
- Film wound dressing containing dexpanthenol – preparation and evaluation
- Theory and practice of pharmacopoeial control of quality of drugs and excipients VIII. End-point indication and other conditions for the titration of primary aromatic amines in the European Pharmacopoeia (Ph. Eur.)
