Schisandra chinensis and its phytotherapeutical applications
Schisandra chinensis and its phytotherapeutical applications
Schisandra (Schisandra chinensis) has been used for centuries as a plant of traditional Chinese medicine. Its biological activity and pharmacological use are associated with dibenzocyclooctadiene lignans, while specific polysaccharides may also be involved. The lignans of schisandra are genus-specific. Their activity has been investigated in hundreds of studies that have confirmed adaptogenic effects, central nervous system stimulation, hepatoprotective effects and potential anticancer potential. This summary review of the literature synthesizes the current state-of-the-art in research on bioactivities of schisandra constituents, description of folk use of extracts, overview of clinical studies and additional information on in vitro tests bringing insight into mechanisms of action.
Keywords:
Schiandra chinensis – fruit – seed – lignans – polysaccharides – clinical trials
:
Michal Rybnikář; Karel Šmejkal; Milan Žemlička
:
Čes. slov. Farm., 2019; 68, 95-118
:
Review Articles
Schisandra čínská (Schisandra chinensis) je po staletí používanou rostlinou tradiční čínské medicíny. Její biologická aktivita a farmakologické využití jsou spojovány s obsahovými látkami typu dibenzocyklooktadienových lignanů a literatura zmiňuje také přítomnost specifických polysacharidů. Lignany schisandry jsou rodově specifické. Jejich aktivita byla zkoumána ve stovkách studií, které potvrdily adaptogenní účinky, stimulační vliv na centrální nervovou soustavu, hepatoprotektivní účinky a také možný protirakovinný potenciál. Předkládaná práce přináší shrnutí obsahových látek schisandry, popis lidového využití extraktů, přehled klinických studií a doplňující informace o in vitro testech vnášejících náhled do mechanismů účinku.
Klíčová slova:
Schisandra chinensis – plody – semena – lignany – polysacharidy – klinické zkoušky
Úvod
Schisandra čínská patří mezi 50 základních bylin čínské medicíny1). Původní zemí výskytu schisandry je severovýchodní Asie, kde se z divoce rostoucí rostliny sbírají plody pravděpodobně po tisíce let. První zmínky o její kultivaci pocházejí z doby pozdní dynastie Han a první popis schisandry můžeme najít už v roce 1596 v díle Peˆn T’shao Kang Mu (Soupis stromů a bylin), jehož autorem je Li Shih-Chen, jeden z nejznámějších lékařů a farmakologů čínské historie. Od poloviny minulého století se pěstuje velkým plantážním způsobem. Nejkvalitnější a největší plody údajně pocházejí ze severovýchodních provincií Číny, kterými jsou Ťi-lin, Liao-ning a Chej-lung-ťiang. Jsou nazývané také jako severní schisandra – Bei Wei Zi2). Velký počet plantáží se nachází v čínských provinciích Che-pej, Jün-nan a Šen-si, S’čchuan, a také v centrálním Mongolsku. Tyto plody jsou menší a medicínsky někdy hůře hodnocené. Bývají označovány jako jižní schisandra – Nan Wei Zi a řadí se k druhu S. sphenanthera Rehn. Kromě toho se schisandra také pěstuje v Japonsku, Koreji a Rusku (Kurily, Sachalin)2).
S. chinensis (česky klanopraška čínská, japonsky gomishi, korejsky omnia, rusky limonnik, čínsky wue wei zi) je rostlina z čeledi klanopraškovité (Schisandraceae). Je to opadavá, keřovitá, pravotočivá liána bez úponků. Dorůstá podle podmínek až 10 a více metrů. Žilnatina listů je zpeřená, se 3 až 7 páry postranních žilek. Čepel listů je 4,5–8 cm dlouhá, 2,5–6,5 cm široká, na okraji zoubkatá až pilovitá, na bázi klínovitá, na vrcholu krátce zašpičatělá. Zdřevnatělé stonky příjemně voní. Květy schisandry jsou jednotlivé, vonné, jednopohlavné a vyrůstají na bázi mladých výhonů. Okvětí je bílé, krémové nebo narůžovělé, nerozlišené, složené z 5 až 9 volných lístků. Tyčinek v samčích květech je nejčastěji 5, řidčeji méně nebo více (4 až 7). V samičích květech je 14 až 40 volných pestíků. Plodem je podlouhlé souplodí růžovočervených až červených bobulí. Bobule jsou asi 5–7,5 mm velké3).
Rozmnožuje se nejlépe vegetativně pomocí kořenových výhonků. Pro výsadbu je nejlepší časné jaro. V prvních letech po výsadbě roste pomalu. Má mělký kořenový systém, proto roste lépe tam, kde je v letních měsících dostatek vláhy. Pro pěstování jsou nevhodné těžké, málo propustné hlinité půdy, nejvhodnější jsou půdy vlhké a dobře odvodňované. Schisandra vyžaduje ke svému růstu oporu, po které se může pnout. Tři až čtyři roky po výsadbě začne nasazovat schisandra krémově bílé až narůžovělé vonné květy a posléze i plody3).
Schisandra je součásti lékopisu Čínské lidové republiky (Pharmacopoeia of the People’s Republic of China) a také lékopisu bývalého SSSR, resp. Ruska. První monografie o plodech schisandry se nachází v americkém lékopisu z roku 1999. První oficiální, mezinárodně uznávaná monografie týkající se této suroviny byla k dispozici od roku 2007 v Mezinárodním lékopisu vydaném WHO4). V šestém vydání Evropského lékopisu (2008) se schisandra poprvé objevila v dodatku 6.3 v článku Schisandrae chinensis fructus. V 8. a 9. vydání Evropského lékopisu (2013), platném od roku 2014, resp. 2016 a 2017, je monografie o S. chinensis fructus stále ve své nezměněné podobě4).
Plody a semena schisandry
Produkce plodů nebývá z počátku veliká (např. v 5. a 6. roce 70–120 g čerstvých bobulí), zatímco v období plné tvorby plodů je to 2,5–3 kg (liány stáří 15–20 let). Hmotnost semen dosahuje maxima na začátku srpna, hmotnost plodů v září5).
Z hlediska využití jsou nejdůležitější plody. Obsahují poměrně širokou paletu organických kyselin. Po přepočtu na celkovou frakci kyselin (9 % hmotnosti oplodí) byla ve šťávě oplodí nalezena 3 % kyseliny vinné, 52 % kyseliny citronové, 40 % kyseliny jablečné, zhruba 4 % kyseliny jantarové a stopová množství kyseliny šťavelové6). Dále se vyskytují kyseliny protokatechová a sorbová7). Vedle této skupiny látek obsahuje šťáva z oplodí mimo jiné i cukry, antokyany, glykosidické látky flavonoidního typu (obr. 1, deriváty kvercertinu a kempferolu), vitamín C a E a minerály jako měď, mangan, nikl a zinek8).
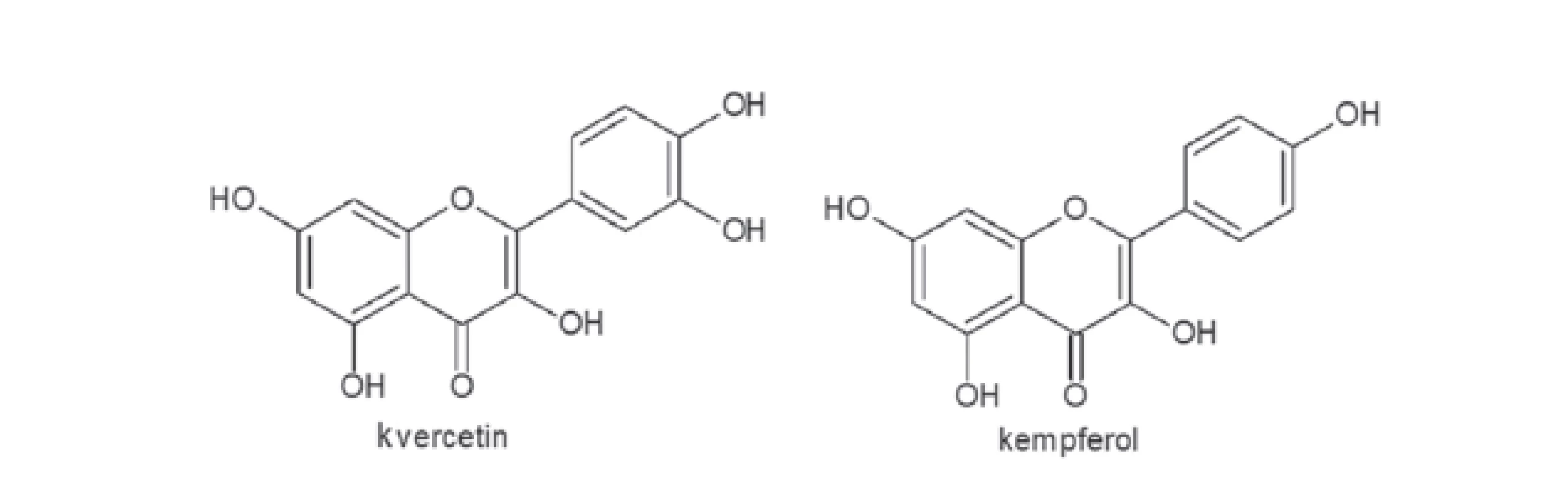
V plodech schisandry čínské je dále popisována řada specifických polysacharidů, které mohou být zodpovědné za bioaktivitu pozorovanou u vodných extraktů z plodů9).
Významnou složkou semen je olej zlatožluté barvy, mající hořkou chuť a silně pryskyřičnou vůni4). Tento olej je velmi bohatý na nenasycené mastné kyseliny, zejména α-linolenovou, β-linolenovou a olejovou10). Dále obsahuje přibližně 6 % silice a asi 14 % směsi látek, ve které byly prokázány steroly, tokoferoly a volné mastné kyseliny. Složení a obsah silice (v semenech asi 3 %, v menším množství ve stoncích a kůře) závisí jak na původu rostlin, tak na průběhu vegetace. Svou vůní, na které se podílejí terpeny ylangen, seskvikaren, α-chamigren, β-chamigren a chamigrenal (obr. 2), připomíná silice citron. Silice se ale v současnosti významně terapeuticky neuplatňuje11).
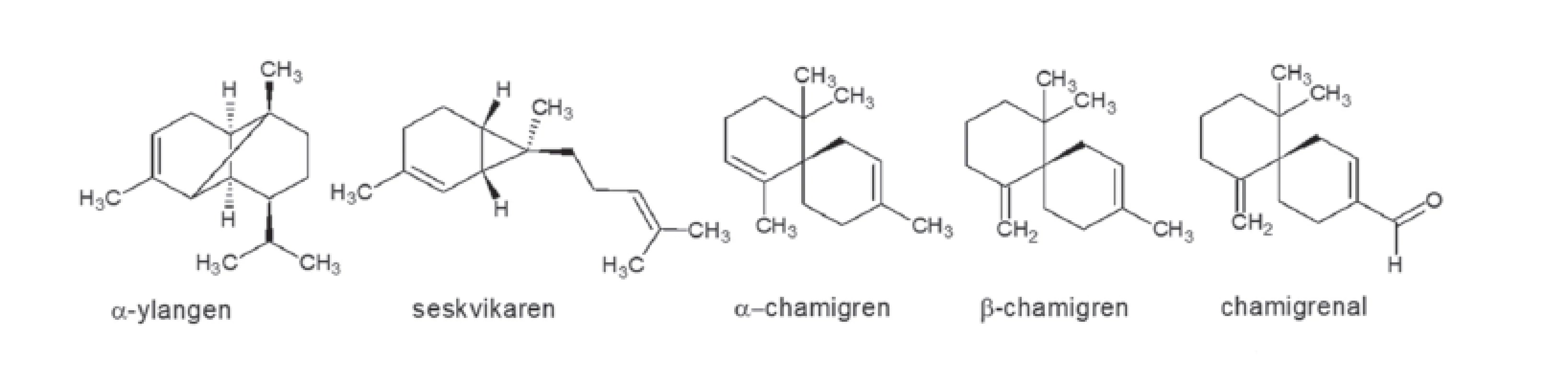
Mezi další látky izolované z plodů schisandry patří triterpeny, ačkoliv většina triterpenů S. chinensis byla popsána v extraktech listů a stonků. Velká část triterpenů schisandry čínské je základem odvozená od cykloartanu a vysoce oxidovaná12–14).
Lignany S. chinensis
Za nejvýznamnější účinné látky plodů jsou v současnosti považovány lignany. Lignany schisandry čínské jsou odvozeny od diarylbutanu, po chemické stránce jsou to dibenzo[a,c]cyklooktanové deriváty. Jejich biosyntetickými prekurzory jsou pregomisin a meso-1,4-bis-
(4-hydroxy-3-methoxyfenyl)-2,3-dimethyl-butan. Spojení dvou fenylpropanových jednotek může poskytnout čtyři stereo-chemické varianty a u lignanů dibenzocyklooktadienového typu poskytuje ještě další dvě stereostruktury. Lignany tohoto typu obsahují obvykle dva chirální uhlíky C-7 a C-8, dalším asymetrickým centrem je substituovaný bifenyl. Methoxylové skupiny, které se vážou na C-1 a C-14 (o-polohy bifenylu), ze sterických důvodů zabraňují rotaci aromatických jader kolem vazby, která spojuje obě aromatická jádra15, 16).
Schisandrin byl v krystalické formě poprvé izolován v roce 1951 Balandinem z diethyletherového extraktu získaného ze semen schisandry čínské, procedura představovala běžnou extrakci17). V současnosti je k dispozici celá řada postupů umožňující lignany získat ve velkém množství a čistotě, používá se například moderní superkritická fluidní extrakce (SFE)18).
Fytochemické práce dosud popsaly několik desítek lignanů schisandry, které se vzájemně liší jednak konformací polycyklického systému, jednak přítomností rozdílných substituentů, a to jak na bifenylu, tak na cyklooktadienovém kruhu. Názvy izolovaných lignanů vycházejí často z lidového označení drogy jednotlivými národy. Jelikož na studiu obsahových látek rodu pracovaly paralelně tři hlavní kolektivy (sovětský, japonský a čínský), mají nejdůležitější látky řadu synonym19). Pod drogou Fructus schisandrae se někdy skrývají nejen plody S. chinensis, ale také plody S. sphenanthera. Plody z těchto druhů mají jiné zastoupení jednotlivých lignanů a některé dokonce zcela chybí4, 20). Na základě různého obsahu však lze jednoduše pomocí vysokoúčinné kapalinové chromatografie (HPLC) určit původní druh20, 21).
Hlavní zastoupení v S. chinensis fructus mají schisandrin, deoxyschisandrin, deoxyschisandrin O (syn. gomisin N), gomisin A, schisandrin B, schisandrin C (syn. wuweizisu C), γ-schisandrin, schisanthenol, schisantherin A a schisantherin B. Popsáno bylo i mnoho dalších (synonyma v tab. 1).
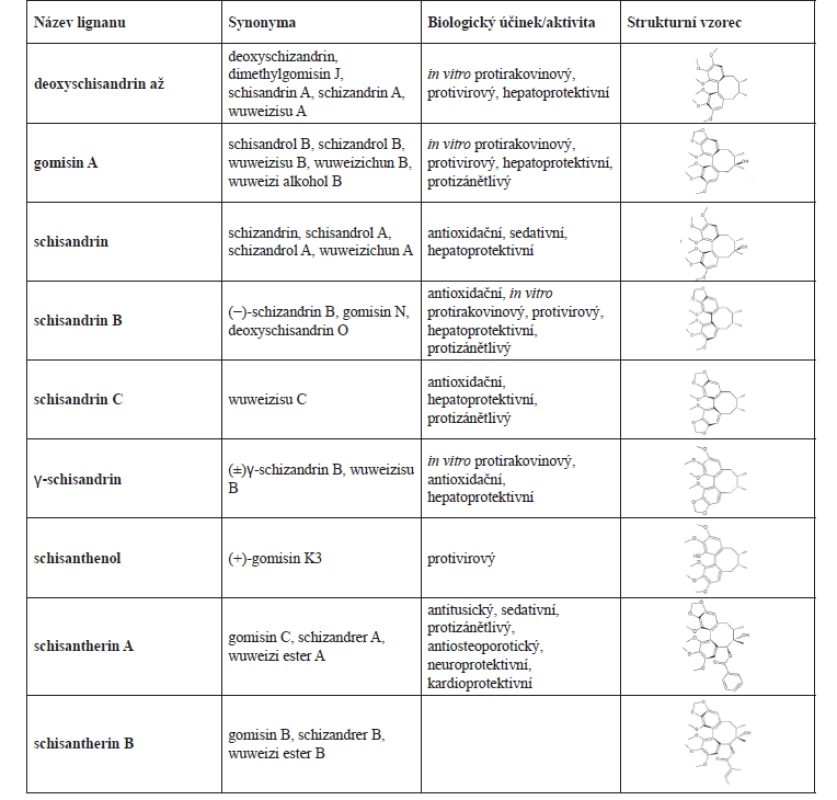
Dibenzocyklooktadienové lignany se nacházejí v celé rostlině, ovšem v různých koncentracích. V plodech a semenech je to 7,2–19,2 %, ve stonku 1,3 až 10 %. Jejich množství je nejvyšší v době, kdy jsou vyvinuta semena v nezralých plodech (červenec), s následujícím růstem plodů obsah klesá22). Pro identifikaci lignanů, stanovení množství a určení kvality drogy S. chinensis fructus se využívá tenkovrstvá chromatografie, plynová chromatografie a HPLC4). Podle Čínského lékopisu z roku 2015 jsou kontrolními markery kvality Wu wei zi lignany schisandrin a deoxyschisandrin23).
Lidové použití
V čínštině se schisandra označuje jako Wu wei zi, což znamená bylina pěti chutí. Převažuje kyselá chuť, slupka a dužnina mají chuť sladkou, zrníčka jsou ostrá a hořká a všechny její součásti jsou lehce slané2). Zároveň lidé v rámci tradiční čínské medicíny věří, že obsahuje „podstatu pěti elementů“ (dřeva, ohně, země, kovu, vody). Číňané přisuzují jednotlivým chutím účinky na lidské tělo. Kyselé a slané působí na játra a varlata, hořká a ostrá chuť ovlivňuje srdce a plíce a sladká má pozitivní účinky na žaludek24). Celkově má schisandra velmi stimulující chuť a údajně zlepšuje kvalitu a kvantitu spermií u mužů24). S. chinensis se používá v různých formách lihových extraktů, v čajovinách nebo jako samostatné sušené plody.
Účinky S. chinensis na funkci srdce a krevní oběh byly popsány v „Dong – Eui – Bo – Kam“, lékařské knize tradiční korejské medicíny. Je popisováno, že S. chinensis normalizuje arteriální krevní tlak a srdeční rytmus u hypertenzních pacientů25). Plody schisandry a látky v nich obsažené se používají jako adaptogeny pro zvýšení odolnosti proti nemocem a stresu, zvyšují fyzickou výkonnost a vitalitu, stimulují imunitní systém, urychlují zotavení po chirurgických zákrocích, mají pozitivní účinek v prevenci předčasného stárnutí, normalizují hladinu cukru v krvi. Příznivý vliv mají také proti spontánnímu pocení, premenstruačnímu syndromu, chronickému průjmu, vysoké hladině cholesterolu, depresi, podrážděnosti a ztrátě paměti, nespavosti, astmatu, kašli a tzv. slabém pulzu. Plody schisandry jsou považované za významné antioxidanty24).
S. chinensis je proslulá v Číně jako tonikum krásy a je považována za rostlinu, která pomáhá zachovat mládí. Také se říká, že je silným stimulátorem při impotenci a při léčbě erektilní dysfunkce a předčasné ejakulace. Je součástí mnoha tradičních čínských léků jako např. Sheng – Mai – Wan (Panax ginseng, Phyllosticta ophiopogonis a S. chinensis), který se používá také k léčbě chronického kašle, dušnosti při zátěži a nadměrného pocení26).
Léčivý přípravek Gyeongshingangjeehwan (GGEx), který obsahuje Aletris elata (Liliaceae), Platycodon grandiflorum (Campanulaceae), S. chinensis (Magnoliaceae) a Ephedra sinica (Ephedraceae) se používá v Koreji jako tradiční antiobezitikum.
Použití schisandry v samoléčbě
Bobule schisandry se mohou zpracovávat v čerstvém stavu anebo se suší. Doporučená denní dávka sušených plodů je 1,5–9 g, někteří autoři udávají použití až 15 g denně. Obvykle je dostačující dávka 1–3 g denně. Může se doporučit pravidlo, že na 1 kg tělesné hmotnosti připadá jedna sušená bobule denně. K usnadnění aplikace se může dvakrát denně podávat zarovnaná kávová lžička suchých bobulí, která odpovídá přibližně 3,5 g, přičemž 1 g odpovídá přibližně deseti sušeným bobulím2). Osoba s hmotností 80 kg by tak mohla konzumovat až 80 sušených bobulí denně, ale množství lze snížit až o 30 %,
protože vyšší dávky zřejmě nemají význam a mohly by dokonce způsobit nežádoucí účinky jako překyselení žaludku, říhání a průjem2). Lidem s nižší tělesnou hmotností by mělo stačit jedna a půl lžičky denně, nebo dokonce pouze jedna lžička. Uvádí se, že 1 g plodů poskytuje během 30–40 minut stimulující efekt, který trvá až 6 hodin2).
Může se připravit také tinktura, a to ze semen nebo plodů, v poměru jeden díl drogy na 3 až 5 dílů 60–70% ethanolu. Po 1–2 měsících se tento roztok přefiltruje a užívá se 20 až 30 kapek dvakrát až třikrát denně po dobu 20–30 dnů27). Připravuje se také odvar z 10 g suchých rozdrcených plodů, které se zalijí 200 ml vody a vaří 20 minut. Užívá se 1 lžíce dvakrát denně27). Je možné používat rovněž prášek ze suchých plodů, a to 0,5–1,5 g dvakrát denně. Ten je vhodný především u hepatitid ke snížení hladiny transaminas28, 29).
Klinické testy plodů schisandry
První studie na adaptogenní a antistresové účinky byly prováděny v SSSR za 2. světové války na posádkách ponorek, a to kvůli zvýšení jejich výdrže a odolnosti vůči stresujícím podmínkám30). Zajímavá je také studie provedená v jednom sanatoriu, kdy byla 95 mužům ve věku 25–35 let po dobu 28 dní podávána schisandra, což vedlo k vzestupu jejich vitality o 27 % a zvýšení jejich hladiny hemoglobinu v krvi o 6 %31). Schisandra tak velmi rychle odstranila vyčerpání a únavu a došlo také ke zvýšení duševních a tělesných schopností.
Klinické studie dále prokázaly příznivý účinek S. chinensis na nervový systém, kde pomáhá neurologickým a psychiatrickým pacientům (neuróza, psychogenní deprese, astheno-depresivní stavy, schizofrenie a alkoholismus)32–35). U zdravých jedinců S. chinensis zvyšuje odolnost a přesnost pohybu, duševní výkonnost a pracovní kapacitu. Generuje také změny bazální hladiny oxidu dusnatého (NO) a kortizolu v krvi a ve slinách s následnými účinky na krvinky, cévy a CNS36) (přehled vybraných klinických studií v tab. 2).
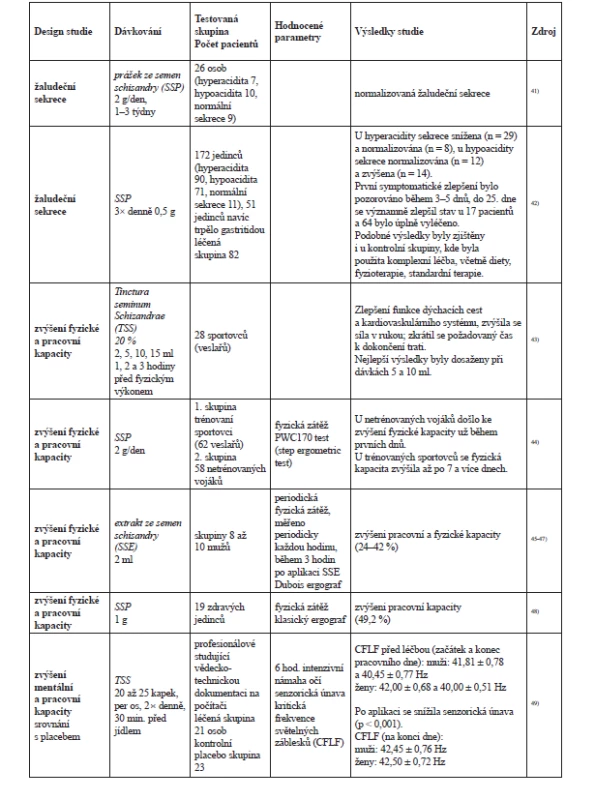
Dále byla zjištěna účinnost schisandry v epidemických vlnách chřipky, při chronických zánětech vedlejších nosních dutin, zánětech středního ucha, neuritid a otoskleróz nebo u zápalu plic37–40).
S. chinensis snižuje projevy alergické dermatitidy, ovlivňuje v gastrointestinálním systému akutní gastrointestinální onemocnění, žaludeční hyper- a hyposekreci, chronickou gastritidu, žaludeční a duodenální vředy, hojení ran a trofické vředy41, 42).
V roce 200819) a 20174) byly publikovány rozsáhlé přehledové práce shrnující informace o léčivých vlastnostech S. chinensis.
Adaptogenní účinek schisandry
Adaptogeny jsou přírodní látky, které zvyšují odolnost organismu proti stresovým situacím, jako je zranění, úzkost nebo tělesná únava. Také zlepšují schopnost odolávat změnám podmínek. Původ termínu adaptogen se datuje do roku 1947 a připisuje se sovětskému lékaři a vědci Nikolaji Lazarevovi, který adaptogen definoval jako látku nespecificky zvyšující odolnost organismu a schopnost se lépe přizpůsobit stresu a mimořádným výzvám. Velký pokrok ve výzkumu adaptogenů nastal v padesátých a šedesátých letech 20. století. Na Lazarevovy práce navázaly další generace vědců, hlavně Israel Brekhman a Igor Dardimov, kteří v roce 1969 zveřejnili následující definici:
- adaptogen vyvolává nespecifickou odpověď, tj. zvýšení odolnosti vůči několika stresujícím faktorům, jako fyzikální, chemické a biologické faktory,
- adaptogen má normalizující vliv na fyziologii bez ohledu na to, v jakém směru od normálu stresor působí,
- adaptogen nezasahuje do normálního fungování organismu více, než je nutné ke zvýšení nespecifické odolnosti.
Existují důkazy o tom, že extrakty některých rostlin mají adaptogenní vlastnosti a jsou schopné zvýšit nespecifickou odolnost lidského organismu vůči stresu57, 58). Podání jednorázové dávky takových adaptogenů umožňuje lépe zvládat napětí a stresové situace a zvyšuje mentální a fyzickou výkonnost59).
Adaptogenní účinek S. chinensis byl testován na skupině 140 vytrvalostních běžců. Všechny pokusné osoby žily ve stejných podmínkách a dostávaly stejnou stravu. Atleti byli rozděleni do tří skupin. Jedné skupině byla podávána glukóza, druhá dostávala fenamin a třetí skupina užívala schisandrin (5, 10, 20 mg). Podle očekávání překonala většina běžců (59 %) užívajících fenamin svůj osobní rekord. Zajímavý byl výsledek třetí skupiny, kdy díky užívání schisandrinu 74 % atletů překonalo své nejlepší výkony60).
Pozitivní vliv schisandry jako adaptogenu se zkoumal také při těžké fyzické práci. Standardizované výtažky S. chinensis a kořenů Bryonia alba byly aplikovány na tři skupiny sportovců (sprinteři, boxeři, cyklisté, skokani, vzpěrači, zápasníci) v placebem kontrolované dvojitě zaslepené studii36). V první skupině byla B. alba podávána 24 sportovcům (sprinteři, skokani, cyklisté, zápasníci) ve věku 15–16 let v dávce 1 tableta denně po 5 dnů, následně 2 tablety po 5 dnů. Placebo skupinu tvořilo 20 jedinců. Ve druhé skupině 19 skokanům byly podávány tablety ze S. chinensis (extrakt 91,1 mg/tbl., standardizovány na schizandrin a γ-schizandrin – 3,1 mg/tbl.) a 13 atletů dostávalo tablety z B. alba (extrakt standardizován na kukurbitacin R – 1 mg/tbl.). Ve třetí skupině 71 sportovců (boxeři, vzpěrači, zápasníci) dostávalo extrakt z S. chinensis (dvakrát denně 2 tbl., 8 dnů) a 10 sportovcům byla podávána B. alba (dvakrát denně 2 tbl., 7 dnů), placebo 28 jedincům. Při těžkém fyzickém cvičení se zvyšuje obsah NO a kortizolu v krvi a slinách. Před a po podání adaptogenu a před a po cvičení byly měřeny hodnoty NO v slinách, kortizol v krvi a slinách, hemoglobin, neutrofily, eosinofily, lymfocyty, monocyty a erytrocyty. Dále byla měřena vytrvalost, spotřeba kyslíku a fyzická kapacita. U atletů užívajících adaptogeny se při těžkém fyzickém cvičení nezvýšily hodnoty NO a kortizolu, zatímco u sportovců užívajících placebo se při těžkém fyzickém cvičení zvýšily v slinách hodnoty NO. Prokázalo se, že slinný test hodnot NO může být použit jak pro hodnocení fyzického zatížení, tak pro stresový ochranný účinek adaptogenu. U sportovců užívajících adaptogeny došlo ke zvýšení fyzické výkonnosti ve srovnání se sportovci užívajícími placebo. Dále bylo dokumentováno, že u začátečníků se po podání adoptogenů zvýšily hladiny NO i kortizolu v plazmě i ve slinách, což představuje stejný účinek jako efekt dlouhodobého těžkého cvičení. U trénovaných sportovců došlo ke snížení hladin NO a kortizolu v plazmě i ve slinách. V porovnání s kontrolní skupinou došlo k procentuálnímu snížení hladin neutofilů, lymfocytů, monocytů, eoziofilů36). Několik experimentů prokázalo, že výdechová NO produkce stoupá během cvičení úměrně s intenzitou cvičení až do vyčerpání a během odpočinku se sníží61–65). Při vyčerpání je průměrná hodnota vydechovaného NO vyšší u trénovaných mužů než u mužů, kteří vedou sedavý způsob života. Z naměřených výsledků vyplývá, že u sportovců s vyšší fyzickou kondicí se během cvičení zvyšuje množství vydechovaného NO, což může být způsobeno zvýšenou vaskulární nebo epiteliální produkcí NO65). Účinky adaptogenů jsou spojeny s osou hypothalamus-hypofýza-nadledvinky, která hraje prvotní roli při zvládání stresu a adaptaci těla. Fytoadaptogeny vykazují protistresový účinek tím, že aktivují tvorbu NO a kortizolu v krevní plazmě a slinách, touto aktivací se organismus přizpůsobuje dalšímu těžkému fyzickému zatížení. U trénovaných sportovců mají adaptogeny opačný protistresový účinek tím, že snižují hladiny NO a kortizolu36, 66–68).
Adaptogenní efekt byl testován u přípravku ADAPT-232 (obchodní název Chisan), což je standardizovaná fixní kombinace R. rosea, S. chinensis a E. senticosus. Dvojitě zaslepenou randomizovanou studií bylo dokázáno, že už 2 hodiny po podání 270 mg ADAPT-232 došlo u dobrovolníků, kteří byli vystaveni stresovým podmínkám, v porovnání s placebem ke zvýšení kognitivní aktivity, snížení chybovosti a zvýšení rychlosti plnění úkolů69).
Další studie provedená na pěti ruských kosmonautech, kteří vykonávali po dobu 90 dní v izolaci dlouhodobě monotónní práci, zjistila, že při podávání tří kapslí ADAPT-232 denně v jedné dávce (složení kapsle 3 mg salirosid, 4 mg schisandrin, 3 mg eleutherosid B) u nich už za 4 hodiny došlo ke zlepšení krátkodobé pamětí a mentální výkonnosti, zvýšení míry porozumění problému a k signifikantnímu snížení chybovosti70).
U dvou paralelních skupin pacientů trpících akutní nespecifickou pneumonií byla provedena dvojitě zaslepená, placebem kontrolovaná, randomizovaná studie. Třicet šest pacientů (muži a ženy, ve věku 18–65 let) dostalo standardní léčbu cefazolinem, bromhexinem a theofylinem. Skupina 30 pacientů dostala navíc přípravek Chisan, poslední skupině 30 pacientů byla podána standardní terapie a placebo. Aplikace probíhala dvakrát denně po dobu 10–15 dní. Během studie byla hodnocena duševní výkonnost pomocí psychometrického testu a testu sebehodnocení kvality života (QOL – pomocí dotazníků WHOQOL-Bref), a to vždy před zahájením terapie, a dále v 1. a 5. den po klinické rekonvalescenci. Bylo zjištěno, že standardní léčba pacientů v kombinaci s Chisanem zkrátila dobu léčby akutní fáze nespecifické pneumonie o 2 dny v porovnání s placebem. Pacienti, kterým byl podáván Chisan, zaznamenali vyšší skóre na počátku rehabilitačního období a významně vyšší v 5. den klinické rekonvalescence než pacienti v kontrolní skupině. Klinické a laboratorní výsledky této studie naznačují, že adjuvantní terapie s Chisanem má pozitivní vliv na zotavení pacientů, snížila se také doba trvání akutní fáze onemocnění. Došlo ke zvýšení duševní výkonnosti a ke zlepšení výsledků QOL a urychlení rekonvalescence71).
Vliv na CNS
Tinktura ze semen a plodů schisandry (1 : 5, v 90% ethanolu) působí stimulačně na nervový systém72). Tinktura byla podávána po dobu 16–40 dní skupině 40 pa-
cientům s astenií a depresemi. U všech testovaných jedinců došlo ke zvýšení aktivity nervového sytému, u 22 pa-
cientů došlo dokonce ke zlepšení fyzické aktivity, ke zvýšení pocitu dostatku energie a zmenšení únavy. Dále ke zlepšení nálady a normalizaci spánkového cyklu72).
Podávání schisandry u schizofreniků a alkoholiků, a to v denní dávce 5 až 25 kapek tinktury, vedlo ke zklidnění pacientů. Došlo u nich také ke snížení emocionálního napětí a úzkosti a celkově ke zlepšení nálady. U schizofreniků se zlepšila schopnost vyjadřování a socializace34). Extrakt S. chinensis zvyšuje reaktivitu na inzulin, sulfadiazin a apomorfin. Lze toho využít při současném podávání schisandry v kombinaci s apomorfinem ke snížení rizika závislosti na opiátech34, 35).
Schisandra může pomoci také zmírnit některé vedlejší účinky trankvilizérů a antidepresiv (např. sibazonu, amitriptylinu, relania). U kontrolní skupiny bez schisandry, kde se zvýšila dávka amitriptylinu z 50 mg na 70 mg/den, byly u 23 z 39 osob hlášeny nežádoucí účinky jako xerostomie, bolest hlavy, střevní a urinální potíže, závratě nebo ochablost. Naopak u osob, kterým byla podávána schisandra s amitriptylinem, se popisované nežádoucí účinky objevily pouze u čtyř z celkového počtu 17273).
Akutní gastrointestinální onemocnění
U dětí (ve věku od 1 do 2 let) trpících akutní dyzenterií, které byly léčeny dyzenterickým bakteriofágem a schisandrovou tinkturou, se zvýšila míra přežití na
76 %, a to ve srovnání s kontrolní skupinou (42 %), která byla léčena samotným dysenterickým bakteriofágem47, 74).
SSP byla také účinná při léčbě akutní enterokolitidy s klinickými příznaky typickými pro lehké a mírné formy akutní dyzenterie75). Při léčbě akutních infekcí gastrointestinálního traktu byly dosaženy nejlepší výsledky u skupin pacientů léčených samotnou schisandrou, případně kombinací schisandry a tetracyklinu, a to ve srovnání s pacienty, kteří dostávali jen samotnou antibiotickou léčbu75).
Alergická dermatitida
Pro léčbu alergické dermatitidy může být doporučena tinktura obsahující kombinaci schisandra, Aralia a Lagochilus76).
Léčba ran
Schisandra se osvědčila také při léčbě ran, onemocnění varixy a bércovými vředy. Nejúčinnější způsob léčby zahrnoval kombinaci chirurgického zákroku a podávání schisandry (jak topické použití 20% vodného extraktu z SSP, tak i perorálně dvakrát denně 3 g SSP po dobu 20–60 dnů), což vedlo u pacientů k 97% úspěšnosti zahojení ran. U 92,5 % pacientů se pak tvorba vředů neopakovala. Použití schisandry samotné bylo méně účinné (86,6 % pacientů trpících bércovým vředem se uzdravilo, ale pouze 50 % nemocných zůstalo stabilních)77, 78).
Pozitivní účinek na krevní tlak
Desetiprocentní tinktura schisandry podávaná v dávce 30 až 40 kapek třikrát denně po dobu 10 dnů byla účinná při léčba arteriální hypotenze u těhotných žen (n = 70)79). V současnosti se ale podávání schisandry těhotným nedoporučuje.
Studie zabývající se léčbou krevního tlaku zjistila, že podávání tinktury ze semen a plodů schisandry po dobu 15–40 dnů normalizovalo hodnoty arteriálního krevního tlaku a srdečního rytmu u hypertenzních a hypotenzních pacientů s tachykardií nebo bradykardií47, 72, 80). U zdravých jedinců však podávání nemělo žádný efekt.
Další výzkum
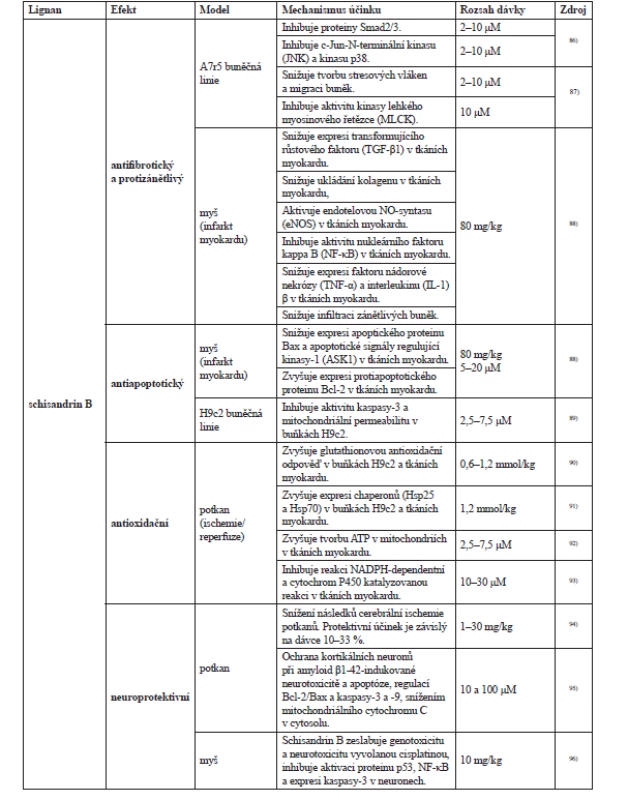
První experimenty hodnotící účinky látek obsažených v plodu schisandry se soustředily na mastné oleje19, 81), organické kyseliny19, 82, 83) a silici84, 85). Nejvíce experimentů se ale zabývalo studiem lignanů a jejich účinků, vybrané experimenty shrnuje tabulka 3. Většina byla prováděná in vitro nebo hodnotila efekt in vivo na laboratorních zvířatech.
Protistresový účinek
Podle definice, která byla přijatá na mezinárodním kongresu o stresu, je stres nespecifická reakce organismu na jakýkoliv vliv, který na organismus působí101). Adaptogeny zvyšují stav nespecifické odolnosti proti stresu a snižují citlivost na stresory, což vede ke stresové ochraně a prodlužuje fázi rezistence. Adaptogeny mají stimulační a protiúnavový účinek. Místo vyčerpání je dosažena vyšší rovnováha (homeostasa) vedoucí k heterostase. Čím vyšší je, tím lepší je adaptace na stres30). Bylo dokázáno, že příznivý ochranný protistresový účinek adaptogenů souvisí s regulaci homeostázasy prostřednictvím několika mechanismů účinku, které jsou spojeny s hypothalamo-pituitárně-adrenální osou (HPA) a regulací klíčových stresových mediátorů, jako
např. Hsp7067) a Hsp1667), stresem aktivovaná JNK166), Forkhead box O (FOXO) trasnkripční faktor DAF-16102, 103),
NO66) a kortizol66).
Laboratorním zvířatům byl podáván schisandrový extrakt v dávce 0,2 ml/kg a bylo prokázáno, že se snížily hodnoty stresových faktorů i hladiny adrenokortikoidních hormonů produkovaných nadledvinkami, a to už během 24 hodin19, 104).
Protistresové účinky kombinace plodů S. chinensis a kořenu Scutellaria baicalensis byly hodnoceny na myších, které byly vystaveny stresu. Stres byl indukován imobilizací a elektrickým šokem do tlapek, který myši dostávaly po dobu 5 dnů. Sedm dní před vystavením stresu a také během stresové situace byla myším podávána kombinace extraktů S. chinensis a S. baicalensis ve stejném poměru a v definovaných dávkách nebo extrakty samostatně105). Při dávce 200 a 400 mg/kg byl účinek kombinovaného extraktu větší než účinky S. chinensis nebo S. baicalensis podávaných samostatně (p < 0,05).
Léčba kombinovaným extraktem (100, 200 a 400 mg/kg)
významně snížila hladiny kortikosteronu v séru
(p < 0,05). Kombinace extraktů v dávce 200 mg/kg potlačovala zmenšení velikosti sleziny a pokles sérové hladiny IL-2. Z toho vyplývá, že kombinace S. chinensis a S. baicalensis extraktů může být použita k léčbě stresových poruch a zlepšení adaptace na stres105).
Účinek adaptogenů (E. senticosus, S. chinensis, R. rosea, B. alba, P. ginseng) na ovlivnění hladiny stresových mediátorů (stresem aktivovaná protein kinasa SAPK/JNK), fosforylovaná kinasa p-SAPK/p-JNK, NO, kortizol, testosteron, PGE2, leukotrien B4 (LTB4) a tromboxan B2) byl testován na králících vystavených stresu. Adaptogeny byly podávány v těchto dávkách jeden krát denně po dobu 7 dnů (srovnáváno s placebem):
E. senticosus extrakt 6,5 mg/kg, R. rosea extrakt 1 mg/kg,
S. chinensis extrakt 22 mg/kg (standardizovaný na schisandrin a γ-schizandrin), B. alba extrakt z kořene 15 mg/kg, P. ginseng extrakt z kořene 6 mg/kg, a rhodiolosid 0,5 mg/kg. Bylo zjištěno, že u placebo skupiny byly významně zvýšeny hodnoty p-SAPK/p-JNK, NO a kortizolu (o 200–300 %), zatímco u králíků, kterým byl aplikován adaptogen, zůstaly hodnoty NO a kortizolu prakticky nezměněny. Rhodiolosid a extrakt S. chinensis a R. rosea byly nejaktivnějšími inhibitory SAPK
/p-JNK. E. senticosus, B. alba, P. ginseng vykazovaly malý vliv na hladiny p-SAPK/p-JNK. Předpokládá se, že inhibiční účinky R. rosea a S. chinensis na p-SAPK
/p-JNK mohou být spojeny s jejich antidepresivní aktivitou a pozitivními účinky na duševní výkon ve stresových podmínkách66).
Antistresová aktivita schisandry (konkrétně schisandrinu B) je pravděpodobně také spojena s indukcí Hsp25 a Hsp7091). Antistresová aktivita adaptogenů na indukci Hsp70 a Hsp72 byla zkoušena na myších také pomocí přípravku ADAPT-232 forte, který je fixní kombinací E. senticocus (eleutherosid E a B 0,17 %), S. chinensis (schisandrin a γ-schisandrin 0,85 %), R. rosea (rosavin 0,37 % a salidrosid 0,33 %, tirosol 0,07 %, triandrin 0,01 %), pantotenátu vápenatého 42,8 %, a vitaminu B5. Myším byl podáván ADAPT-232 forte v dávce 30, 90, 180 mg/kg po dobu 7 dnů. Po podání adaptogenu byl prováděn plovací test. Sérová hladina Hsp72 byla měřena jak za normálních podmínek, tak i ve stresu (před a po plavání). Bylo zjištěno, že po opakovaném podání adaptogenů (v závislosti na dávce) se sedmkrát zvýšil čas potřebný k vyčerpání (od 3,0 ± 0,5 do 21,1 ± 1,7 min).
Také se zvýšila sérová bazální hladina Hsp72 (od 0,8–1,5 do 5,5–6,3 pg/ml). Účinek adaptogenu na stres byl pozorován také po úpravě dávky adaptogenu a provedeném testu plaváním, kdy se zvýšila sérová hladina Hsp72 na 15,1 ± 1 pg/ml a zůstala na téměř stejné úrovni po dobu 7 dnů67). To potvrzuje, že adaptogeny indukují zvýšení sérové hladiny Hsp72 a zvyšují toleranci ke stresu, která je spojená se stimulací exprese Hsp70 a částečně Hsp7267).
Antioxidační účinek
Studie provedené na izolovaných tkáních, buňkách a enzymech ukázaly, že S. chinensis a přípravky z ní ukazují silné antioxidační účinky a mají vliv na hladké svalstvo, uvolňování kyseliny arachidonové, syntézu LTB4 v leukocytech, faktor aktivující destičky (PAF faktor), metabolismus sacharidů a fosforu, tkáňové dýchání a spotřebu kyslíku19, 106–109). Antioxidační účinek lignanů schisandry je spojen zejména s inhibicí lipoperoxidace. Nejvyšší antioxidační účinek v testu inhibice Fe3+/cysteinem indukované lipoperoxidace vykázal gomisin K3 (silnější než tokoferol)110).
Hepatoprotektivní účinek
Schisandra je využívána jako hepatoprotektivum a v léčbě onemocnění jater. Hlavní hepatoprotektivní a léčebný účinek vykazují schisandrin A, schisandrin B, schisandrin C a gomisin A. Nejvíce zkoumavé a perspektivní jsou schisandrin B a schisandrin C111, 112). Schisandrin B byl používán jako hepatoprotektivum112) a jeho hepatoprotektivní účinek je spojen se zvýšením hladiny jaterního mitochondriálního glutathionu a proteinů tepelného šoku113). U myší trpících hypercholesterolemií, které byly léčeny schisandrinem B (50 až
200 mg/kg, i.g.) po dobu 4 nebo 6 dní, došlo k poklesu celkového jaterního cholesterolu a snížení hladiny triglyceridů (až o 50 %, resp. 52 %), také se zvýšila hmotnost jater. Léčba fenofibrátem (100 mg/kg) přinesla podobné výsledky114).
U myší trpících steatózou jater, které byly léčeny schisandrinem B, došlo ke snížení exprese a aktivity syntézy mastných kyselin. Došlo i ke snížení hladiny kyseliny palmitové, která podporuje vznik steatózy. Schisandrin B může v budoucnu hrát důležitou úlohu při léčbě nealkoholické steatózy jater115). Také došlo k redukci jaterní fibrózy díky aktivaci transkripčního faktoru Nrf2, který pomáhá snížit rozvoj fibrózy. Je zajímavé, že vysoká jednotlivá dávka u skupiny hladovějících myší vyvolala přechodné zvýšení lipolýzy a zvýšení exprese adiposa triglycerid lipasy (ATGL) a fosforylaci hormonálně-senzitivní lipasy. Aplikací se zvýšila také hladina celkového cholesterolu a VDLD/LDL v plazmě a došlo k poklesu aktivity HMG-CoA reduktasy a také snížení LDL receptorů. Při dlouhém hladovění může schisandrin B metabolismus lipidů ovlivnit i nepříznivě115).
Schisandrin B působí proti jaternímu poškození způsobeným chloridem uhličitým (CCl4)106), proti myokardiální ischemii způsobené reperfuzí90).
Dimethyl-4,4´-dimethoxy-5,6,5´,6´-dimethylendioxybifenyl-2,2´-dikarboxylát (syn. DDB, dimethylbikarboxylát) je syntetický derivát schisandrinu C116). DDB je nejaktivnější hepatoprotektivní látkou z dibenzocyklooktadienových lignanů117), spolu se schisandrinem B redukuje aktivitu jaterní alaninaminotransferasy (ALT)118). Schisandrin B a DBB jsou užívány pro zlepšení funkce jater a také jako antioxidant volných radikálů a proti lipoperoxidaci111, 118–120).
In vitro došlo k významnému poklesu buněčné ALT u hepatocytů léčených DDB, což dokazuje, že DDB ovlivňuje syntézu a nebo degradaci ALT v jaterních buňkách111, 118, 121, 122). Má se za to, že normalizace ALT působením DDB neukazuje reálnou terapeutickou účinnost, a proto DDB se nedoporučuje pro běžnou léčbu chronických onemocnění jater123). Během léčby hepatitidy B (HVB) se DDB používá jako pomocné hepatoprotektivum. DDB může stimulovat Jak/Stat signalizaci i zároveň indukovat expresi interferonem alfa (IFN-α) stimulovaných genů, zejména 6-16 a ISG12. DDB, podává-li se v kombinaci s amantadinem, může přímo inhibovat IFN-α signalizaci zprostředkovanou replikací HVB v infikovaných hepatocytech, což ukazuje možný potenciál v léčbě chronické HVB123, 124).
Hepatoprotektivní účinky gomisinu A lze vysvětlit stabilizací buněčných membrán buněk jaterního parenchymu a snížením uvolňování cytotoxických faktorů z aktivovaných jaterních adherentních buněk125). Experiment využívající jaterní selhání u myší, a to navozené pomocí kombinace D-galaktosaminu (700 mg/kg) a LPS (10 µg/kg), prokázal hepatoprotektivní účinek gomisinu A (100 a 200 mg/kg). Došlo ke snížení jaterní nekrózy a apoptózy hepatocytů a snížení hladiny ALT. Předpokládá se, že aplikace D-galaktosaminu a LPS zvyšuje aktivitu kaspasy-3 a počet apoptických hepatocytů následně vedoucí k úmrtí zvířete. Bylo prokázáno, že gomisin A upravuje a zeslabuje zvýšenou aktivitu kaspasy-3 a má antioxidační účinek126). Gomisin A inhibuje rozvoj fulminantního jaterního selhání pomocí inhibice produkce TNF-α126).
Studie na potkanech s přípravkem GGEx prokázala snížení hmotnosti a hladiny břišního tuku a také hladiny triacylglycerolů a omezení ukládání tuku v játrech potkanů127).
Antimikrobiální účinek schisandry
Vodný a methanolový extrakt z plodů schisandry vykazoval antibakteriální aktivitu proti 16 kmenům salmonely patřících do šesti rozdílných sérotypů s minimální inhibiční koncentrací (MIC) extraktu v rozmezí 15,6–125 μg/ml. Methanolový extrakt měl mírně vyšší aktivitu. Devět z 16 testovaných kmenů salmonely mělo hodnoty MIC < 31,3 μg/ml pro methanolový extrakt128). Antibakteriální aktivita extraktu plodů schisandry byla také zkoumána in vivo na myších infikovaných S. typhimurium. Extrakt významně snižoval počet životaschopných S. typhimurium nacházejících se v myších výkalech a snižoval úmrtnost myší. U myší, kterým byl extrakt podáván, ukázala histologická analýza menší poškození orgánů (střeva, játra, ledviny)128).
Antibakteriální vlastnosti schisandrinu, schisandrinu A, schisandrinu B, schisandrinu C, schisandrolu C a schisantherinu byly studovány na dvou příbuzných intracelulárních parazitech Chlamydia pneumoniae a C. trachomatis in vitro v lidských epiteliálních buňkách. Všech šest testovaných lignanů inhibovalo růst bakterií a také se u C. pneumoniae snížila schopnost tvorby inkluzí. Schizandrin B (MIC > 50 μm) inhiboval tvorbu inkluzí C. pneumoniae i při léčbě 8 hodin po infekci. Výsledky naznačují, že antichlamydiová aktivita není způsobena pouze antioxidačními vlastnostmi lignanů129). Přítomnost methylendioxy, methoxy- a hydroxylových skupin lignanů měla výrazný efekt na antichlamydiovou aktivitu129, 130).
Schopnost plodů schisandry inhibovat růst patogenních bakterií v potravinách byla zkoumána na grampozitivních (Listeria monocytogenes, Staphylococcus aureus, Bacillus cereus, B. subtilis) a gramnegativních bakteriích (Salmonella enterica sérovar Typhimurium, Enterobacter aerogenes) a také u Pseudomonas aeruginosa a Escherichia coli. Plody schisandry byly extrahovány jedním ze tří různých rozpouštědel (50% ethanol, 100% ethanol a destilovaná voda). Pomocí každého rozpouštědla byly připraveny jednotlivé extrakty o koncentracích 1 %,
5 % a 10 %. Extrakty vykazovaly antimikrobiální účinnost proti všem testovaným bakteriím, ethanolové extrakty měly nejsilnější aktivitu v závislosti na koncentraci. Antimikrobiální aktivita plodů S. chinensis je způsobena zejména organickými kyselinami, jako jsou kyselina citronová a kyselina jablečná. Desetiprocentní extrakt (zejména pomocí 100% ethanolu) významně snížil životaschopnost a tepelnou odolnost spor B. cereus. Vyšší účinnost byla pozorována proti grampozitivním bakteriím. Ethanolové extrakty významně inhibovaly L. monocytogenes a S. aureus131). Extrakty z plodů schisandry by mohly být používány jako přírodní konzervanty a dezinfekční činidla, vedoucí ke snížení kontaminace patogeny131).
Antikarcinogenní účinek schisandry
Protikarcinogenní účinek schisandrinu C byl in vitro zkoumán ohledně cytotoxicity a vlivu na tři lidské rakovinné buněčné linie: hepatocelulární karcinom (Bel-7402), karcinom prsu (Bcap37) a nazofaryngeální karcinom (KB-3-1), buňky Bel-7402 byly nejcitlivější132). Intracelulární koncentrace schisandrinu C byla zjišťovaná pomoci HPLC a ukázalo se, že prochází přes buněčnou membránu do buňky. Schisandrin C (100 μM) vyvolává apoptózu buňky Bel-7402, tento fakt by mohl představovat významnou roli při léčbě karcinomu. Schisandrin C je bezpečný, toxicita pro zdravé buňky je nízká a je aktivní proti hepatocelulárnímu karcinomu, což by v budoucnu mohlo vést ke klinickému využití132). Přesný mechanismus schisandrinu C v inhibici tumoru při apoptóze není objasněn. Předpokládá se, že může ovlivnit signální trans-
dukci a způsobovat změny při expresi genů. Schisandrin C má také inhibiční aktivitu proti transkripci nukleárního faktoru aktivovaných T-lymfocytů (NFAT)133).
Inhibice P-glykoproteinu
Za mnohočetnou rezistenci k lékům (multi-drug resistance – MDR) je zodpovědný gen, který kóduje expresi membránového neselektivního kanálu, tzv. glykoproteinu P (P-gp), kterým se buňka může zbavovat cizorodých látek. MDR může zodpovídat za odolnost buněk k protinádorové léčbě tím, že se snižuje akumulace cytostatik v buňkách a jejich cytotoxický účinek. Podobně jako u syndromu MDR nádorových buněk i fyziologicky se P-gp chová jako efluxní pumpa, které aktivně pumpuje molekuly léčiva ven z buňky. Jednosměrný přenos substrátu, vždy z intracelulárního prostředí do extracelulárního, je pro tento druh přenašečů typický134, 135).
Schisandrin B byl zkoušen na buněčných liniích rezistentních k adriamycinu: leukemické (K562/Adr), karcinomu prsu (MCF-7/Adr), a karcinomu kůže (KBv200 a Bcap37/Adr), s testováním citlivosti k doxorubicinu136). K testování účinku schisandrinu B na ovlivnění rezistence P-gp – léčivo, byly vybrány tři kategorie léčiv: substráty P-gp (taxol, doxorubicin, vinkristin), „chudý“ substrát P-gp (mitoxantron) a non-MDR léčivo (tedy léčivo, které není substrátem P-gp a u kterého akumulace a cytotoxická aktivita nezávisí na expresi P-gp, methotrexát). Schisandrin B byl zkoušen v dávce 10 µg/ml. Výsledky ukázaly, že schisandrin B zvrátil rezistenci u buněčných linií K562/Adr, KBv200 a MCF-7/Adr k taxolu, anthracyklinu, vinkristinu, ale ne k methrotrexátu. Dále zvýšil citlivost MDR buněk na mitoxantron. Léková rezistence byla potlačena u všech čtyř linií136).
Protizánětlivé účinky
Schisandrin u myší vykazoval protizánětlivý účinek a snižoval plazmatickou koncentraci NO stimulovanou LPS. Také inhiboval edém tlapky a ovlivnil vaskulární permeabilitu indukovanou poleptáním kyselinou octovou (schisandrin 200 mg/kg). Vykazoval též ochranný účinek proti sepsím vyvolaným aplikací LPS. Protizánětlivé účinky schisandrinu (100 mg/kg) jsou výsledkem inhibice produkce NO, PGE2, COX-2 a exprese iNOS. Schisandrin vykazuje antioxidační účinek in vivo137).
Protizánětlivá aktivita schisandrin A, schisandrol, schisantherin A, schisandrin B, schisandrol B, schisandrin C, schisanhenol v dávce 2,5 a 5 µg/ml, byla hodnocena na buňkách SH-SY5Y lidského neuroblastomu vystavených poškození sérovými a glukózovými deprivacemi (SGD). K vyhodnocení velikosti poškození buněk byla stanovena jejich životnost, uvolňování laktátu dehydrogenasy a přítomnost proteinů související s apoptózou a zánětem. Schisantherin A, schisandrin C a schisandrol B mají silnější ochranné účinky proti poškození SGD než schisandrin A, schisandrin B a schisanhenol. Schisantherin A a schisanhenol snižoval hladiny NLRP3, kaspasu-1, IL-1β , NF-κB, pIkB/IκB. Schizandrin A a schizandrol B významně regulovaly hladiny NLRP3, kaspasy-1 a pIκB/IκB. Schisandrin B a schisandrin C také snižovaly hladiny NLRP3, kaspasy-1 a pIκB/IκB. Uvedené lignany vykazovaly protizánětlivý účinek. Schisandrol reguloval kaspasu-3, ale nevykazoval významný protizánětlivý účinek. Pro účinky lignanů může být důležitý počet a umístění hydroxylových a methylendioxy skupin138).
Gomisin A byl zkoumán z hlediska zásahu do kaskády tvorby kyseliny arachidonové a s cílem objasnit jeho efekt při některých jaterních onemocněních. Gomisin A potlačuje tvorbu leukotrienů, aktivity 5-lipoxygenasy a fosfolipasy A2 ovlivněny nebyly. Uvolňování kyseliny arachidonové z makrofágů stimulovaných fMet-Leu-Phe nebo Ca-lonofor A23187 bylo působením gomisinu A potlačeno108).
Sedativní a hypnotický efekt
Studie na myších, která byla provedena za účelem zjištění sedativních a hypnotických účinků extraktu S. chinensis získaného pomocí SFE, zjistila, že extrakt měl sedativní účinek a ovlivnil pohybovou aktivitu myší v závislosti na dávce (10–200 mg/kg). Intragastricky podaný extrakt vykazoval silný hypnotický účinek v synergii s pentobarbitalem, ovlivnil spánkovou aktivitu a omezil nespavost indukovanou kofeinem, p-chlorfenylalaninem a flumazenilem. Extrakt měl také synergický účinek s 5-hydroxytryptofanem (2,5 mg/kg, intraperitoneálně)139).
Schisandrin B (1,25 mg/kg, 2,5 mg/kg a 5 mg/kg) významně snížil pohybovou aktivitu myší a zlepšil index kvality spánku. Zkrátil u nich délku usínání a prodloužil délku spánku. Schisandrin B může výrazně zvýšit hladinu kyseliny γ-aminomáselné (GABA) a zároveň snížit hladinu kyseliny glutamové (Glu) v periferní krvi myší, stejně jako v mozkové kůře, hipokampu a hypothalamu potkanů, což vede ke zvýšení poměru GABA/Glu. Pikrotoxin jako inhibitor GABA receptoru může antagonizovat účinek schisandrinu B na latenci a trvání spánku u myší ošetřených prahovou dávkou pentobarbitalu sodného. Navíc schisandrin B up-reguluje expresi genů GABAA Rα1 a GABAA Rγ2 v mozkové kůře, hipokampu a hypothalamu. Tyto výsledky dokazují sedativní a hypnotický účinek schisandrinu B140).
Interakce a vedlejší účinky
Molekula schisandrinu B neobsahuje atom dusíku a zároveň má methoxyfenolovou skupinu, která je u inhibitorů P-gp pozorována. Z toho vyplývá, že schisandrin B může představovat strukturně nový typ inhibitoru P-gp136).
Inhibiční účinek extraktu schisandry na cytochrom P450 3A4 (CYP3A4) a cytochrom P450 3A5 (CYP3A5) představuje jeden z nejdůležitějších faktorů zodpovědných za možné lékové interakce. Inhibiční účinek na cytochrom P450 vykazují také gomisin G a gomisin C. Gomisin C s methylenedioxy skupinou v poloze 12 a 13 má téměř stejnou inhibiční aktivitu k CYP3A4 a CYP3A5. Gomisin G s methylendioxy skupinou v poloze 2 a 3 vykazoval silnější inhibici k CYP3A5 než CYP3A4. Rozdíl v interakci: π-π interakce mezi CYP3A4 a gomisinem C a interakce vodíkových vazeb mezi CYP3A5 a gomisinem G mohou vést k jejich různým inhibičním účinkům141). Tato zjištění naznačují, že oba lignany vykazují vysokou možnost, tzv. herb-drug interakce141), což je interakce mezi bylinami a konvenčními léky142). Výsledky studie na myších ukázaly, že třídenní podávaní schisandrinu B může zvýšit koncentraci a perorální biologickou dostupnost léčiva metabolizovaného přes CYP3A143). U mužů schisandrin B může výrazně zvýšit koncentraci midazolamu v krvi a jeho perorální biologickou dostupnost144).
Intragastrické podání vysoké dávky schisandrinu B (1 g/kg) myším dokázalo jeho bezpečnost a nízkou toxicitu, která je také potvrzena dlouhodobým používáním v tradiční čínské medicíně136).
Schisandra může zvýšit účinek warfarinu145), schisandrin A je antagonistou PAF-receptorů107).
Plody schisandry a shoseiryuto (přípravek obsahující plod schisandry, nať chvojníku, skořicovou kůru) vykazují silný inhibiční účinek na CYP3A419, 146, 147).
Pacienti se žlučovými kameny nebo trpící blokádou žlučových cest by schisandru neměli užívat, protože zvyšuje tok žluči. Opatrnost je nutná také při epilepsii, žaludečních vředech a vysokém krevním tlaku. Užívání schisandry v těhotenství není v současnosti doporučováno pro stimulující účinek na dělohu. Její podávání by mohlo ohrozit těhotenství148).
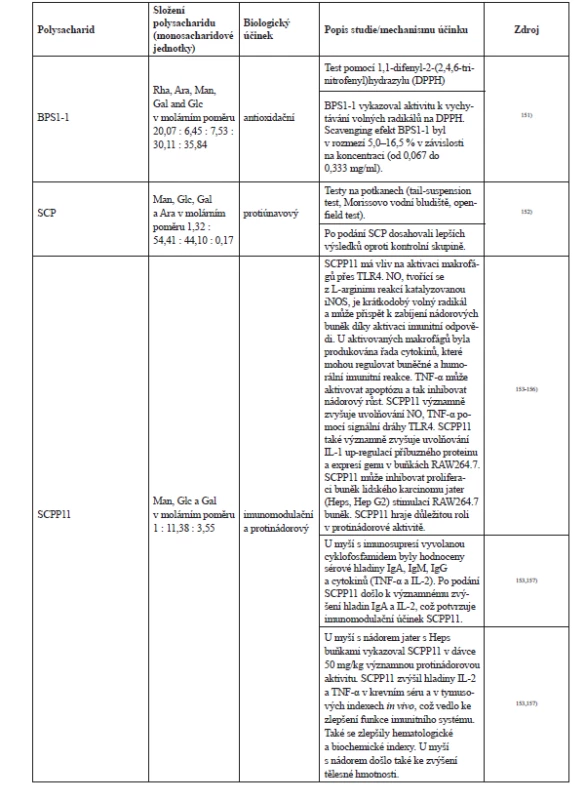
Polysacharidy schisandry
Polysacharidy patří mezi složky S. chinsensis, které se poslední dobou staly zájmem vědeckého bádání. Poznatky ohledně polysacharidů shrnuje článek z roku 20189). Polysacharidy se z plodů získávají tak, že se plody usuší, rozdrtí a přesejí. Surové polysacharidy se získají pomocí extrakce vroucí vodou a vysrážením absolutním ethanolem, posléze se odstraní lipidy a proteiny a poté proběhne lyofilizace149). Surové polysacharidy se rozpustí ve vodě a centrifugací se odstraní nerozpustné nečistoty. Čištěné polysacharidy se získávají iontově výměnnou a gelovou chromatografií149). Ultrasonická extrakce je nová metoda izolace polysacharidů. Síla a doba působení ultrazvuku může významně ovlivnit extrakci, což je prokázáno vyšší antioxidační aktivitou takových polysacharidových extraktů150). V současnosti je známo přibližně 24 polysacharidů S. chinensis, ale u některých není ještě známý jejich přesný účinek a struktura. Stručný přehled polysacharidů schisandry a jejich účinků (tab. 4).
Závěr
S. chinensis se používá po staletí v tradiční čínské a asijské medicíně. V posledních desetiletích byly rozsáhle studovány její farmakologické účinky i chemické složení obsahových látek. S. chinensis a hlavně její dibenzocyklooktadienové lignany mohou hrát důležitou roli jako významné adaptogeny, antioxidanty, hepatoprotektiva a v budoucnu i v protinádorové léčbě. Efekt schisandry může být způsoben i přítomností poměrně velkého množství polysacharidů. Výsledky celé řady experimentálních studií ukazují příznivý vliv S. chinensis na různá onemocnění, což naznačuje i její možné budoucí použití v klasické medicíně.
Střet zájmů: žádný.
doc. PharmDr. Karel Šmejkal, Ph.D.
M. Rybnikář
Veterinární a farmaceutická univerzita Brno, Farmaceutická fakulta
Ústav přírodních léčiv
Palackého tř. 1946/1, 612 42 Brno
e-mail: karel.mejkal@post.cz
M. Žemlička
Univezita veterinárskeho lekárstva a farmácie. Košice, SR
Katedra farmakognózie a botaniky
Sources
1. Wong M. La Médecine chinoise par les plantes. Le Corps a Vivre series (1976). Éditions Tchou.
2. Sharamon S., Baginski B. J. Schizandra plod pěti živlů-léčivá roslina s povzbuzujícími účinky pro dobré zdraví. Ikar 2011.
3. Nianhe X., Yuhu L., Saunders R. M. K. Schisandreae. Law Yuwu, ed., Fl. Reipubl. Popularis Sin. 1996; 30(1), 231–269, 271–273.
4. Szopa, A., Ekiert, R., Ekiert, H. Current knowledge of Schisandra chinensis (Turcz.) Baill (Chinese magnolia vine. as a medicinal plant species: a review on the bioactive components, pharmacological properties, analytical and biotechnological studies. Phytochem. Rev. 2017; 16, 195–218.
5. Opletal L., Křenková M., Havlíčková P. Fytoterapeutické aspekty onemocnění oběhového systému 8. Magnolka čínská (Schisandra chinensis (Turcz.) Baill) Produkce drogy a jejich hodnocení, léčivé a dietetické přípravky. Česká a slovenská farmacie 2001; 50, 219–224.
6. Valíček P., Horák V. Schizandra čínská. Remedia 1995; 5, 223–226.
7. Opletal L., Křenková M., Havlíčková P. Fytoterapeutické aspekty onemocnění oběhového systému 7. Magnolka čínská (Schisandra chinensis (Turcz.) Baill) Obsahové látky a jejich biologická aktivita. Česká a slovenská farmacie 2001; 50, 173–180.
8. Hancke J. L., Burgos R. A., Ahumada F. Schisandra chinensis (Turcz.) Baill. Fitoterapia 1999; 70, 451–471.
9. Li Z., He X., Wang J., Feng J. A review of polysaccharides from Schisandra chinensis and Schisandra sphenanthera: properties, functions and applications. Carbohydr. Polym. 2018; 184, 178–190.
10. Lee K. S., Lee B. H., Seong B. J., Kim S. I., Han S. H., Kim G. H., Park S. B., Kim H. H., Choi T. Y. Chemical Components Composition on Different Parts of Fruit in Schisandra chinensis Baillon. J. Korean Food Sci. Nutr. 2016; 45, 851–858.
11. Chen, X., Zhang, Y., Zu, Y., Fu, Y., Wang, W. Composition and biological activities of the essential oil from Schisandra chinensis obtained by solvent-free microwave extraction. LWT Food Sci. Technol. 2011; 44, 2047–2052.
12. Xue Y. B., Zhang Y. L., Yang J. H., Du X., Pu J. X., Zhao W., Sun H. D. Nortriterpenoids and lignans from the fruit of Schisandra chinensis. Chem. Pharm. Bull. 2010; 58(12), 1606–1611.
13. Huang S. X., Yang J., Huang H., Li L. M., Xiao W. L., Li R. T., Sun H. D. Structural characterization of schintrilactone, a new class of nortriterpenoids from Schisandra chinensis. Org. Lett. 2007; 9(21), 4175–4178.
14. Song Q. Y., Jiang K., Zhao Q. Q., Gao K., Jin X. J., Yao X. J. Eleven new highly oxygenated triterpenoids from the leaves and stems of Schisandra chinensis. Org. Biomol. Chem. 2013; 11(7), 1251–1258.
15. Harmatha J., Dinan L. Biological activities of lignans and stilbenoids associated with plant-insect chemical interactions. Phytochem. Rev. 2003; 2, 321–330.
16. Harmatha J.Strukturní bohatství a biologický význam lignanů a jim příbuzných rostlinných fenylpropanoidů. Chem. Listy 2005; 99, 622–632.
17. Balandin D. A. Schizandrin-a new stimulant from Schizandra fruits. In: Lazarev N. V. (ed.) Materials for the Study of Stimulants and Tonics from Ginseng and Schizandra Roots. Vladivostok: Far East Branch of USSR Academy of Science 1951; 45–50.
18. Lin C. H., Lin H. W., Wu J. Y., Houng J. Y., Wan H. P., Yang T. Y., Liang M. T. Extraction of lignans from the seed of Schisandra chinensis by supercritical fluid extraction and subsequent separation by supercritical fluid simulated moving bed. J. Supercritic. Fluids 2015; 98, 17–24.
19. Panossian A., Wikman G. Pharmacology of Schisandra chinensis Bail. an overview of Russian research and uses in medicine. J. Ethnopharmacol. 2008; 118, 183–212.
20. Lu Y., Chen D. F. Analysis of Schisandra chinensis and Schisandra sphenanthera. J. Chromatogr. A 2009; 1216, 1980–1990.
21. Gao J. P. Comparative studies on Schisandra chinensis and Schisandra sphenanthera, Ph.D. Thesis. Shanghai: Fudan University 2003.
22. Nakajima K., Taguchi H., Ikeya Y., Endo T., Yosioka I. The Constituents of Schizandra chinensis BAILL. XIII. Quantitative Analysis of Lignans in the Fruits of Schizandra chinensis BAILL. by High Performance Liquid Chromatography. Yakugaku Zasshi 1983; 103, 743–749.
23. Chinese Pharmacopoeia Commission. Pharmacopoeia of the People’s Republic of China, first ed. Beijing: Chinese Med. Scien.Technol. Press 2015.
24. Fil’kin A. M. About Schizandra chinensis (historical-literary information.. Aptechnojje Delo 1952; 2, 46–48.
25. Chun J. N., Cho M., So I., Jeon J. H. The protective effects of Schisandra chinensis fruit extract and its lignans against cardiovascular disease: a review of the molecular mechanisms. Fitoterapia 2014; 97, 224–233.
26. Yuezhong H., Jinwen T., Zhaoguo L. Science of prescriptions. Shanghai: Publishing House of Shanghai University of Traditional Chinese Medicine 2002.
27. Mlčoch Z. https://www.bylinkyprovsechny.cz/byliny-kere-stromy/182-schizandra-cinska-magnolka-cinska-ucinky-na-zdravi-pouziti-uzivani-vyuziti-co-leci. Datum citace: 18. 12. 2018.
28. Turova A. D. Medicinal Plants of the USSR and Their Use. 2nd ed. Moscow: Meditsina Publishing House 1974; 29–34.
29. Turova A. D., Sapozhnikova E. N. Medicinal Plants of the USSR and their Use. 3rd ed. Moscow: Meditsina Publishing House 1982, 31–33.
30. Panossian A., Wikman G. Effects of adaptogens on the central nervous system and the molecular mechanisms associated with their stress protective activity. Pharmaceuticals 2010; 3, 188–224.
31. Avery G. The research on the health and athletic benefit adaptogens. Peak Running Perfomance 1995; 5, 3–7.
32. Farutina M. V. Clinical investigation of tonic effects of pantocrine, and Ginseng and Schizandra tinctures. In: Lazarev N. V. (ed.) Materials for the Study of Stimulants and Tonics from Ginseng Roots and Schizandra. Vladivostok: Far East Branch of USSR Academy of Science 1951; 131–136.
33. Galant I. B., Kuznetsova A. I., Suvorina N. A., Shikhova S. S., Gutschina I. S. Experience in using Schizandra chinensis in psychiatric practise. In: Abstract Book of the Conference on Clinical Development and Therapy of Mental Diseases and Organization of Psychoneurological Assistance 1957. Ministry of Health of USSR, Moscow; 112–113.
34. Romas R. S. About the effect of Schizandra chinensis on higher brain structures of schizophrenia patients and chronic alcoholics. PhD Thesis. Vinnitsa, USSR: Faculty of Medicine, Pirogov’s Medical Institute 1967; 1–19.
35. Romas R. S. Effect of Schizandra chinensis on reactivity of patients to some drugs. Vopr. Psykhonevrol. 1962; 30, 435–440.
36. Panossian A., Oganessian A., Ambartsumian M., Gabrielian E., Wagner H., Wikman G. Effects of heavy physical exercise and adaptogens on nitric oxide content in human saliva. Phytomedicine 1999; 6, 17–26.
37. Lebedev A. A. The effect of Schisandra seed tincture on morbidity rate among workers of Chirick shoe factory during the 1969 influenza epidemic.In: Brekhman I. I., Fruentov N. K. (eds.) Medicinal Products of the Far East. Far East Branch of the USSR Academy of Science. Khabarovsk: Medical Institute 1970; 115–119.
38. Konoplev O. I. Combined use of Schizandra chinensis and decaris in the treatment of chronic sinusitis.1989. In: Proceedings of the 7th Congress of Otorhinolaringologists of Ukraine, Ministry of Health of Ukrainian SSR, Kiev, May 26–27, 1989; 227–228.
39. Rokhlin N. N. Schizandra chinensis effect on the function of acoustic and vestibular analyzers under normal conditions and in cases of pathology. In: Belikov I. F., Brekhman I. I., Bykov V. T., Lazarev N. V., Serebryannik B. E., Sorokhtin G. N. (eds.) Materials for the Study of Ginseng and Schizandra Roots. Leningrad: Far East Branch of USSR Academy of Science 1958; 181–183.
40. Pavlushchenko E. V. Pneumonia in aged and old people in conditions of the monsoon climate of the southern Primorskij region. In: Bulanov A. E., Dardimov I. V., Li S. E. (eds.) New Data on Eleutherococcus and other Adaptogens. Vladivostok: Far East Branch of the USSR Academy of Science, Institue of Marin Biology 1981; 119–122.
41. Amitina R. Z., Vodianova I. I. Schizandra chinensis effect on the stomach secretion. In: Belikov I. F., Brekhman I. I., Bykov V. T., Lazarev N. V., Serebryannik B. E., Sorokhtin G. N. (eds.) Materials for the Study of Ginseng and Schizandra Roots. Leningrad: Far East Branch of USSR Academy of Science 1958; 184–186.
42. Lapajev I. I. The experience of treating patients with chronic gastritis using the Far East Schizandra. Clin. Med. 1958; 34, 109–112.
43. Eglit N. Y., Zhukova V. V., Kuznetsova V. F., Kravchenko A. N. About the stimulating effect of Schizandra chinensis and its use under physical loads. In: Materials of Scientific Meetings of Khar’kov Scientific Medical Society Zdirovya. Kiev 1965; 829–830.
44. Lupandin A. V. The use of adaptogens in sports. Modern problems of sport medicine. In: Proceedings of the 24th All-Union Conference on Sport Medicine. Moscow: Ministry of Health of USSR 1990; 56–61.
45. Karo V. I. The ergographic study of Schizandra stimulating effect. Scientific Papers of 3rd Year Students of the Naval Medical School 1945; 3, 30–33.
46. Lazarev N. V. Experimental data for the evaluation of the Far East Schizandra as a stimulant. In: Proceedings of the scientific medical board at the administration of medical-sanitary department of the USSR navy. Leningrad: Military Press of the Ministry of Armed Forces of USSR 1946; 1. 5. 17, 62–69.
47. Lupandin A. V., Lapajev I. I. Schizandra. In: Konovalov (ed.). Khabarovsk: Khabarovskoye Knizhnoye Izdatelstvo 1981; 127.
48. Andrejev I., Georgijev V. Ergographic study of Schizandra chinensis stimulating effect. In: Petkov V. V. (ed.) The study of Gin Seng and Schizandra chinensis in Bulgaria. Sophia: Bulgarian Academy of Science 1958; 78–82.
49. Negoda V. I., Dogadova L. P., Syromyatnikova T. Y. The effect of adaptogens on visual fatigue ability of operators. In: Abstract Book of the International Symposium on Nutrition of the 21st Century, Medical and Biological Aspects,Ways of Optimization: 7–9 October 1999. Vladivostok: Far East Branch of USSR Academy of Science 1999; 187–188.
50. Berdyshev V. V. Some specific effects od single doses of adaptogens. In: Valeology : Diagnosis, Means and Practise in Health care, Breckman II (ed.). Int. Collection Scien. Papers 2. Vladivostok, Dalnauka 1995; 105–117.
51. Lapajev I. I. Schizandra and its Curative Properties, 3rd ed. Khabarovsk: Khabarovskoye Knizhnoye Izdatelstvo 1998; 48.
52. Lupandin A. V., Lapajev I. I. Schizandra. In: Konovalov P. F. (ed.). Khabarovsk: Khabarovskoye Knizhnoye Izdatelstvo 1981; 1–89.
53. Gubchenko P. P., Fruentov N. K. A comparative study of effectiveness of Eleutherococcus and other plant adaptogens as agents for enhancing the working capacity of the flying personnel. In: Brekhman I. I., Dardimov I. V., Li S. E., Dobryakova A. I. (eds.) New Data on Eleutherococcus: Proceedings of the 2nd International Symposium on Eleutherococcus (Moscow 1984). Vladivostok: Far East Centre of Academy of Science of the USSR 1984; 171–178.
54. Kormosh N., Laktionov K., Antoshechkina M. Effect of a combination of extracts fromseveral plants on cell-mediated and humoral immunity of patients with advanced ovarian cancer. Phytotherapy Res. 2006; 120, 424–425.
55. Lupandin A. V. Schisandra chinensis seed effect on the development of the skin thermal reaction induced by local application of phenol in man. In: Brekhman I. I., Golikov P. P., Grinevich M. A., Dardimov I. V., Oranskaya A. N. (eds.) Eleutherococcus and other Adaptogens from Far East Plants. Materials of Studies of Ginseng and other Herbal Preparations of the Far East. Far East Branch of the Academy of Science of USSR. Vladivostok: Vladivostok Book Publishing 1966; 271–274.
56. Trusov M. S. The effect of Far East Schizandra chinensis on some visual functions. Voyenno-Medotsinskij Zhurnal 1953; 10, 57–62.
57. Farnsworth N. R., Akerele O., Bingel A. S., Soejarto D. D., Guo Z. Medicinal plants in therapy. Bull. WHO 1985; 63, 965.
58. Szołomicki S., Samochowiec L., Wójcicki J., Droździk M. The influence of active components of Eleutherococcus senticosus on cellular defence and physical fitness in man. Phytother. Res. 2000; 14, 30–35.
59. Panossian A., Wagner H. Stimulating effect of adaptogens: an overview with particular reference to their efficacy following single dose administration. Phytotherapy Res. 2005; 19, 819–838.
60. Lebedev A. A. Schizandra. Tashkent: Meditsina Publishing House of USSR 1971.
61. Bodis S., Haregewoin A. Evidence for the release and possible neural regulation of nitric oxide in human saliva. Biochem. Biophysic. Res. Commun. 1993; 194, 347–350.
62. Persson M. G., Wiklund N. P., Gustafsson L. E. Endogenous nitric oxide in single exhalations and the chazige during exercise. Am. Rev. Respir. Dis. 1993; 148, 1210–1214.
63. Iwamoto J., Pendergast D. R., Suzuki H., Krasney J. A. Effect of graded exercise on nitric oxide in expired air in humans. Respir. Physiol. 1994; 97, 333–345.
64. Chirpaz-Oddou M. F., Favre-Juvin A., Flore P., Eterradossi J., Delaire M., Grimbert F., Therminarias A. Nitric oxide response in exhaled air during an incremental exhaustive exercise. J. Appl. Physiol. 1997; 82, 1311–1318.
65. Maroun M. J., Mehta S., Turcotte R., Cosio M. G., Hussain S. N. Effect of physical conditioning on endogenous nitric oxide output during exercise. Appl. Physiol. 1995; 79, 1219–1225.
66. Panossian A., Hambardzumyan M., Hovhanissyan A., Wikman G. The adaptogens Rhodiola and Schizandra modify the response to immobilization stress in rabbits by suppressing the increase of phosphorylated stress-activated protein kinase, nitric oxide and cortisol. Drug Target Insights 2007; 2, 39–54.
67. Panossian A., Wikman G., Kaur P., Asea A. Adaptogens exert a stress-protective effect by modulation of expression of molecular chaperones. Phytomedicine 2009; 16, 617–622.
68. Olsson E. M. G., von Schéele B., Panossian A. G. A randomized double-blind placebo controlled parallel group study of SHR-5 extract of Rhodiola rosea roots as treatment for patients with stress related fatigue. Planta Med. 2009; 75, 105–112.
69. Aslanyan G., Amroyan E., Gabrielyan E., Nylander M., Wikman G., Panossian A. Double-blind, placebo-controlled, randomised study of single dose effects of ADAPT-232 on cognitive functions. Phytomedicine 2010; 17, 494–499.
70. Bogatova R. I., Shlykova L. V., Sal’nitskiĭ, V. P., Vikman G. Evaluation of the effect of a single dose of phytoadaptogen on human’s working ability during long-term isolation. Aviakosmicheskaia i ekologicheskaia meditsina 1997; 31, 51–54.
71. Narimanian M., Badalyan M., Panosyan V., Gabrielyan E., Panossian A., Wikman G., Wagner H. Impact of Chisan® (ADAPT-232. on the quality-of-life and its efficacy as an adjuvant in the treatment of acute non-specific pneumonia. Phytomedicine 2005; 12, 723–729.
72. Leman M. F. Treatment of reactive and asthenic states of exogenous etiology using the Far East Schizandra. J. Neuropathol. Psych. 1952; 52, 67–70.
73. Sudakov V. N., Savinykh A. B., Agapov Y. K. The role of adaptogens in the psychoprophylaxis of patients with borderline states of exogenous organic genesis. In: Goldsberg E. D., ed. Modern problems of pharmacology and search for new medicines. Vol 2. Tomsk: Tomsk State University Press 1986; 61–64.
74. Zuzanova V. I., Bakhtina Z. D. Dysentery treatment in children using Schizandra chinensis. Pediatria 1954; 3, 62–65.
75. Pelishenko G. P. A clinical study of Schizandra chinensis on treating patients with acute gastric and intestinal diseases. Medicinal Products of the Soviet Far East. Vladivostok: Far East Branch of the Academy of Sciences of the USSR 1972; 149–151.
76. Golysheva M. A., Iroshnikova Y. S., Ado V. A. Phytotherapy of patients with allergic dermatoses. Vestnik Dermatologii i Venerologii 1991; 12, 24–30.
77. Walter V. G. Preliminary data on the treatment of slowly granulating wounds and trophic ulcers using Schizandra chinensis. Transactions of the Khabarovsk Medical Institute 1955; 14, 124–128.
78. Walter V. G. Schizandra chinensis in a complex therapy of non-healingwounds and trophic ulcers. Dissertation for a Degree in Medicine. Khabarovsk: Khabarovsk Medical University 1956; 16.
79. Gaistruk A. N., Taranovskij K. L. The treatment of arterial hypotension in pregnant women using Schizandra chinensis. In: Urgent Problems of Obstetics and Gynecology. Lvov: Ministry of Health of Ukrainian SSR 1968; 183–186.
80. Agejenko A. S., Komissarenko B. T. Schizandra and its Therapeutic Administration. Sakhalinsk Book Press, Yuzhno-Sakhalinsk, 1960; 38.
81. Balandin D. A. Fatty oil from Schizandra seeds. Doclady Academii Nauk SSSR 1940; 26, 592–594.
82. Pereslegin N. V. About the essence of Schizandra chinensis effect. Farmakologiya i Toksikologiya 1944; 7, 11–13.
83. Varlakov M. N. On the stimulating effect of Schizandra chinensis. Pharmacia 1944; 6, 31–34.
84. Senov P. I. Materials on pharmacological and chemical analysis of some medicinal formulations produced from different parts of Schizandra chinensis. Aptechnoje Delo 1952; 3, 5–8.
85. Tikhonova K. G. The use of Schizandra chinensis cultivated in the Ukraine. In: Abstract Book of the Ukrainian Scientific Pharmacological Conference. Lvov: Ministry of Health of Ukrainian SSR 1957; 76–77.
86. Park E. J., Chun J. N., Kim S. H., Kim C. Y., Lee H. J., Kim H. K., Jeon J. H. Schisandrin B suppresses TGFβ1 signaling by inhibiting Smad2/3 and MAPK pathways. Biochem. Pharmacol. 2012; 83, 378–384.
87. Chun J. N., Kim S. Y., Park E. J., Kwon E. J., Bae D. J., Kim I. S., So I. Schisandrin B suppresses TGFβ1-induced stress fiber formation by inhibiting myosin light chain phosphorylation. J. Ethnopharmacol. 2014; 152, 364–371.
88. Chen P., Pang S., Yang N., Meng H., Liu J., Zhou N., Tao Z. Beneficial effects of schisandrin B on the cardiac function in mice model of myocardial infarction. PLoS One 2013; 8, e79418.
89. Chiu P. Y., Luk K. F., Leung H. Y., Ng K. M., Ko K. M. Schisandrin B stereoisomers protect against hypoxia/reoxygenation-induced apoptosis and inhibit associated changes in Ca2+-induced mitochondrial permeability transition and mitochondrial membrane potential in H9c2 cardiomyocytes. Life Sci. 2008; 82, 1092–1101.
90. Yim T. K., Ko K. M. Schisandrin B protects against myocardial ischemia-reperfusion injury by enhancing myocardial glutathione antioxidant status. Mol. Cell. Biochem. 1999; 1–2, 151–156.
91. Chiu P. Y., Ko K. M. Schisandrin B protects myocardial ischemia-reperfusion injury partly by inducing Hsp25 and Hsp70 expression in rats. Mol. Cell. Biochem. 2004; 266, 134–144.
92. Ko K. M., Chiu P. Y. Structural determinants of schisandrin B which enhance mitochondrial functional ability and glutathione status as well as heat shock protein expression in rat hearts and H9c2 cells. Mol. Pharm. Biochem. 2005; 276, 227–234.
93. Chen N. A., Ko M. Schisandrin B-induced glutathione antioxidant response and cardioprotection are mediated by reactive oxidant species production in rat hearts. Biol. Pharm. Bull. 2010; 33, 825–829.
94. Chen N., Chiu P. Y., Ko K. M. Schisandrin B enhances cerebral mitochondrial antioxidant status and structural integrity, and protects against cerebral ischemia/reperfusion injury in rats. Biol. Pharm. Bull. 2008; 31, 1387–1391.
95. Wang B., Wang X. M. Schisandrin B protects rat cortical neurons against Aβ1–42-induced neurotoxicity. Pharmazie 2009; 64, 450–454.
96. Giridharan V. V., Thandavarayan R. A., Bhilwade H. N., Ko K. M., Watanabe K., Konishi T. Schisandrin B, attenuates cisplatin-induced oxidative stress, genotoxicity and neurotoxicity through modulating NF-κB pathway in mice. Free Rad. Res. 2012; 46, 50–60.
97. Xu L., Grandi N., Del Vecchio C., Mandas D., Corona A., Piano D., Tramontano E. From the traditional Chinese medicine plant Schisandra chinensis new scaffolds effective on HIV-1 reverse transcriptase resistant to non-nucleoside inhibitors. J. Microbiol. 2015; 53, 288–293.
98. Casarin E., Dall’Acqua S., Šmejkal K., Šlapetová T., Innocenti G., Carrara M. Molecular mechanisms of antiproliferative effects induced by Schisandra-derived dibenzocyclooctadiene lignans (+.-deoxyschisandrin and (−.-gomisin N in human tumour cell lines. Fitoterapia 2014; 98, 241–247.
99. Wang X., Hu D., Zhang L., Lian G., Zhao S., Wang C., Yang J. Gomisin A inhibits lipopolysaccharide-induced inflammatory responses in N9 microglia via blocking the NF-κB/MAPKs pathway. Food Chem. Toxicol. 2014; 63, 119–127.
100. Song F., Zeng K., Liao L., Yu Q., Tu P., Wang X. Schizandrin A inhibits microglia-mediated neuroninflammation through inhibiting TRAF6-NF-κB and Jak2-Stat3 signaling pathways. PloS One 2016; 11, e0149991.
101. Geist B. Psychologický slovník, 2. vydání. Praha: Vodnář 2000.
102. Wiegant F. A., Surinova S., Ytsma E., Langelaar-Makkinje M., Wikman G., Post J. A. Plant adaptogens increase lifespan and stress resistance in C. elegans. Biogerontology 2009; 10, 27–42.
103. Samuel S. M., Thirunavukkarasu M., Penumathsa S. V., Paul D., Maulik N. Akt/FOXO3a/SIRT1-mediated cardioprotection by n-tyrosol against ischemic stress in rat in vivo model of myocardial infarction: switching gears toward survival and longevity. J. Agric. Food Chem. 2008; 56, 9692–9698.
104. Varlakov M. N. On the stimulating effect of Schizandra chinensis. Pharmacia 1944; 6, 31–34.
105. Lee S., Kim D. H., Jung J. W., Oh J. H., Park H. J., Park C., Ryu J. H. Schizandra chinensis and Scutellaria baicalensis counter stress behaviors in mice. Phytother Res. 2007; 21, 1187–1192.
106. Ip S. P., Poom M. K. T., Wu S. S., Che C. T., Ng K. H., Kong Y. C., Ko K. M. Effect of schisandrin B on hepatic glutathione antioxidant system in mice: protection against carbon tetrachloride toxicity. Planta Med. 1995; 61, 398–401.
107. Jung K. Y., Lee I. S., Oh S. R., Kim D. S., Lee H. K. Lignans with platelet activating factor antagonist activity from Schizandra chinensis (Turcz.) Baill. Phytomedicine 1997; 4, 229–231.
108. Ohkura Y., Mizoguchi Y., Morisawa S., Takeda S., Aburada M., Hosoya E. Effect of gomisin A (TJN-101. on arachidonic acid cascade in macrophages.Japanese J. Pharmacol. 1990; 52, 331–336.
109. Wang J. P., Raung S. L., Hsu M. F., Chen C. C. Inhibition by gomisin C (a lignan from Schizandra chinensis) of the respiratory burst of rat neutrophils. British J. Pharmacol. 1990; 113, 945–953.
110. Lu H., Liu G. T. Anti-oxidant activity of dibenzocyclooctene lignans isolated from Schisandraceae. Planta Med. 2007; 58.04, 311–313.
111. Wang C., Xu Y. Q. Dimethyl bicarboxylate in the treatment of viral hepatitis, adjuvant or curative? Gastroenterol. Res. 2008; 1, 2–7.
112. Kiso Y., Tohkin M., Hikino H., Ikeya Y., Taguchi H. Mechanism of antihepatotoxic activity of wuweizisu C and gomisin A. Planta Med. 1985; 51, 331–334.
113. Chiu P. Y., Tang M. H., Mak D. H., Poon M. K., Ko K. M. Hepatoprotective mechanism of schisandrin B: role of mitochondrial glutathione antioxidant status and heat shock proteins. Free Rad. Biol. Med. 2003; 35, 368–380.
114. Pan S. Y., Dong H., Zhao X. Y., Xiang C. J., Fang H. Y., Fong W. F., Ko K. M. Schisandrin B from Schisandra chinensis reduces hepatic lipid contents in hypercholesterolaemic mice. J. Pharm. Pharmacol. 2008; 60, 399–403.
115. Kwan H. Y., Niu X., Dai W., Tong T., Chao X., Su T., Yu H. Lipidomic-based investigation into the regulatory effect of Schisandrin B on palmitic acid level in non-alcoholic steatotic livers. Sci. Rep. 2015; 5, 9114.
116. Xie J. X., Zhou J., Zhang C. Z., Yang J. H., Jin H. Q., Chen J. X. Synthesis of schizandrin C analogs. II. Synthesis of dimethyl-4, 4‘-dimethoxy-5, 6, 5‘, 6‘-dimethylenedioxybiphenyl-2,2‘-dicarboxylate and its isomers (author’s transl). Yao xue xue bao= Acta Pharm. Sin. 1982; 17.1, 23.
117. Li X. Y. Bioactivity of neolignans from fructus Schizandrae. Memorias do Instituto Oswaldo Cruz 1991; 86, 31–37.
118. Ip S. P., Yiu H. Y., Ko K. M. Differential effect of schisandrin B and dimethyl diphenyl bicarboxylate (DDB) on hepatic mitochondrial glutathione redox status in carbon tetrachloride intoxicated mice. Mol. Cell. Biochem. 2000; 205, 111–114.
119. Li X. J., Zhao B. L., Liu G. T., Xin W. J. Scavenging effects on active oxygen radicals by schizandrins with different structures and configurations. Free Rad. Biol. Med. 1990; 9, 99–104.
120. Zhang T. M., Wang B. E., Liu G. T. Effect of schisandrin B on lipoperoxidative damage to plasma membrane of rat liver in vitro. Acta Pharmacol. Sin. 1992; 13, 255–258.
121. Kim S. N., Kim S. Y., Yim H. K., Lee W. Y., Ham K. S., Kim S. K., Kim Y. C. Effect of dimethyl-4,4‘-dimethoxy-5,6,5‘,6‘- dimethylenedioxybiphenyl-2,2‘-dicarboxylate (DDB. on chemical-induced liver injury. Biol. Pharm. Bull. 1999; 22.1, 93–95.
122. Fu T., Liu G. Protective effects of dimethyl-4,4‘-dimethoxy-5,6,5‘,6‘-dimethylene dioxybiphenyl-2,2‘-dicarboxylate on damages of isolated rat hepatocytes induced by carbon tetrachloride and D-galactosamine. Biomed. Environ. Sci. 1992; 5, 185–194.
123. Huber R., Hockenjos B., Blum H. E. DDB treatment of patients with chronic hepatitis. Hepatology 2004; 39, 1732–1733.
124. Joo S. S., Won T. J., Kim M. J., Hwang K. W., Lee D. I. Interferon signal transduction of biphenyl dimethyl dicarboxylate/amantadine and anti-HBV activity in HepG2 2.2.15. Arch. Pharm. Res. 2006; 29, 405–411.
125. Matsuzaki Y., Matsuzaki T., Takeda S., Koguchi S., Ikeya Y., Mitsuhashi H., Oyama T. Studies on the metabolic fate of gomisin A (TJN-101). I. Absorption in rats. Yakugaku zasshi. J. Pharmaceutic. Society Japan 1991; 111, 524–530.
126. Kim S. H., Kim Y. S., Kang S. S., Bae K., Hung T. M., Lee S. M. Anti-apoptotic and hepatoprotective effects of gomisin A on fulminant hepatic failure induced by D-galactosamine and lipopolysaccharide in mice. J. Pharmacol. Sci. 2008; 106, 225–233.
127. Shin S. S., Jung Y. S., Yoon K. H., Choi S., Hong Y., Park D., Yoon M. The Korean traditional medicine Gyeongshingangjeehwan inhibits adipocyte hypertrophy and visceral adipose tissue accumulation by activating PPARα actions in rat white adipose tissues. J. Ethopharmacol. 2010; 127, 47–54.
128. Lee M. H., Kwon H. A., Kwon D. Y., Park H., Sohn D. H., Kim Y. C., Lee J. H. Antibacterial activity of medicinal herb extract against Salmonella. Int. J. Food Microbiol. 2006; 111, 270–275.
129. Hakala E., Hanski L., Uvell H., Yrjönen T., Vuorela H., Elofsson M., Vuorela P. M. Dibenzocyclooctadiene lignans from Schisandra spp. selectively inhibit the growth of the intracellular bacteria Chlamydia pneumoniae and Chlamydia trachomatis. J. Antibiot. 2015; 68, 609–614.
130. Yim T. K., Ko K. M. Methylenedioxy group and cyclooctadiene ring as structural determinants of schisandrin in protecting against myocardial ischemia-reperfusion injury in rats. Biochem. Pharmacol. 1999; 57, 77–81.
131. Bai X., Park I. B., Hwang H. J., Mah J. H. The ability of Schisandra chinensis fruit to inhibit the growth of foodborne pathogenic bacteria and the viability and heat resistance of Bacillus cereus spores. Int. J. Food Sci. 2015; 50, 2193–2200.
132. Lu Y. H., Liang X. H., Wei D. Z., Wang Z. T. Activity of Schisandrin C Isolated from Schisandra chinensis against Human Cancer Cell Lines. Pharm. Biol. 2008; 46, 906–913.
133. Lee H. K., Dat N. T., Lee M. S., Kim J. W., Na D. S., Kim Y. H. Lignans with inhibitory activity against NFAT transcription from Schisandra chinensis. Planta Med. 2003; 69, 63–64.
134. Lehne G. P-glycoprotein as a drug target in the treatment of multidrug resistant cancer. Curr. Drug Targets 2000; 1, 85–99.
135. Ficková D., Vlček J., Topinková E. Role P-glykoproteinového transportu v klinicky významných lékových interakcích. Remedia 2002; 3, 207–213.
136. Qiangrong P., Wang T., Lu Q., Hu X. Schisandrin B-a novel inhibitor of P-glycoprotein. Biochem. Biophys. Res. Commun. 2005; 335, 406–411.
137. Guo L. Y., Hung T. M., Bae K. H., Shin E. M., Zou H. Y., Hong Y. N, Kim Y. S. Anti-inflammatory effects of schisandrin isolated from the fruit of Schisandra chinensis Baill. Eur. J. Pharmacol. 2008; 591, 293–299.
138. Tang M., Zhang X., Shi Y., Wang D., Gu Y., Li S., Wang C. Protection of seven dibenzocyclooctadiene lignans from Schisandra chinensis against serum and glucose deprivation injury in SH-SY5Y cells. Cell Biol. Int. 2015; 9, 1418–1424.
139. Zhu H., Zhang L., Wang G., He Z., Zhao Y., Xu Y., Zhang L. Sedative and hypnotic effects of supercritical carbon dioxide fluid extraction from Schisandra chinensis in mice. J. Food Drug Anal. 2016; 24, 831–838.
140. Li N., Liu J., Wang M., Yu Z., Zhu K., Gao J., Li H. Sedative and hypnotic effects of Schisandrin B through increasing GABA/Glu ratio and upregulating the expression of GABA A in mice and rats. Biomed. Pharmacother. 2018; 103, 509–516.
141. Zhao J., Sun T., Wu J. J., Cao Y. F., Fang Z. Z., Sun H. Z., Yin J. Inhibition of human CYP3A4 and CYP3A5 enzymes by gomisin C and gomisin G, two lignan analogs derived from Schisandra chinensis. Fitoterapia 2017; 119, 26–31.
142. Fugh‐Berman A., Ernst E. Herb-drug interactions: review and assessment of report reliability. Br. J. Clin. Pharmacol. 2001; 52, 587–595.
143. Li W. L., Xin H. W., Yu A. R., Wu X. C. In vivo effect of Schisandrin B on cytochrome P450 enzyme activity. Phytomedicine 2013; 20, 760–765.
144. Xin H. W., Wu X. C., Li Q., Yu A. R., Xiong L. Effects of Schisandra sphenanthera extract on the pharmacokinetics of midazolam in healthy volunteers. Br. J. Clin. Pharmacol. 2009; 67, 541–546.
145. Mu Y., Zhang J., Zhang S., Zhou H. H., Toma D., Ren S., Xie W. Traditional Chinese medicines Wu Wei Zi (Schisandra chinensis Baill) and Gan Cao (Glycyrrhiza uralensis Fisch) activate pregnane X receptor and increase warfarin clearance in rats. J. Pharmacol. Exp. Ther. 2006; 316, 1369–1377.
146. Makino T., Mizuno F., Mizukami H. Does a kampo medicine containing Schisandra fruit affect pharmacokinetics of nifedipine like grapefruit juice? Biol. Pharm. Bull. 2006; 29, 2065–2069.
147. Iwata H., Tezuka Y., Kadota S., Hiratsuka A., Watabe T. Identification and characterization of potent CYP3A4 inhibitors in Schisandra fruit extract. Drug Metab. Dispos. 2004; 32, 1351–1358.
148. Balch P. A. Prescription for herbal healing: A practical A-Z reference to drug free remedies using herbs and herbal preparation. Avery Health Guides 2003; 121–122.
149. Chi A., Zhang Y., Kang Y., Shen Z. Metabolic mechanism of a polysaccharide from Schisandra chinensis to relieve chronic fatigue syndrome. Int. J. Biol. Macromol. 2016; 93, 322–332.
150. Wang Y., Meng X. Effect of ultrasonic treatment on antioxidant activity of polysaccharides from mature fruits of Schisandra chinensis. Food Sci. 2016; 37, 66–70.
151. Chen S. H., Chen H. X., Wang Z. S., Tian J. G., Wang J. Structural characterization and antioxidant properties of polysaccharides from two Schisandra fruits. Eur. Food Res. Technol. 2013; 237, 691–701.
152. Chi A., Zhang Y., Kang Y., Shen Z. Metabolic mechanism of a polysaccharide from Schisandra chinensis to relieve chronic fatigue syndrome. Int. J. Biol. Macromol. 2016; 93, 322–332.
153. Zhao T., Feng Y., Li J., Mao R., Zou Y., Feng W., Wu X. Schisandra polysaccharide evokes immunomodulatory activity through TLR 4-mediated activation of macrophages. Int. J. Biol. Macromol. 2014; 65, 33–40.
154. Lee S. J., Rim H. K., Jung J. Y., An H. J., Shin J. S., Cho C. W., Lee K. T. Immunostimulatory activity of polysaccharides from Cheonggukjang. Food Chem. Toxicol. 2013; 59, 476–484.
155. Kim H. S., Kim Y. J., Lee H. K., Ryu H. S., Kim J. S., Yoon M. J., Han S. B. Activation of macrophages by polysaccharide isolated from Paecilomyces cicadae through toll-like receptor 4. Food Chemic. Toxicol. 2012; 50.9, 3190–3197.
156. Wang J., Zuo G., Li J., Guan T., Li C., Jiang R., Chen D. Induction of tumoricidal activity in mouse peritoneal macrophages by ginseng polysaccharide. Int. J. Biol. Macromol. 2010; 46, 389–395.
157. Zhao T., Mao G., Mao R., Zou Y., Zheng D., Feng W., Chen Y. Antitumor and immunomodulatory activity of a water-soluble low molecular weight polysaccharide from Schisandra chinensis (Turcz.) Baill. Food Chem. Toxicol. 2013; 55, 609–616.
158. Jin D., Zhao T., Feng W. W., Mao G. H., Zou Y., Wang W., Wu X. Y. Schisandra polysaccharide increased glucose consumption by up-regulating the expression of GLUT-4. Int. J. Biol. Macromol. 2016; 87, 555–562.
159. Zhao T., Mao G. H., Zhang M., Li F., Zou Y., Zhou Y., Wu X. Y. Anti-diabetic effects of polysaccharides from ethanol-insoluble residue of Schisandra chinensis (Turcz.. Baill on alloxan-induced diabetic mice. Chem. Res. Chinese Universities 2012; 29, 99–102.
160. Xu C. L., Li Y. H., Dong M., Wu X., Wang X. C., Xiao Y. S. Inhibitory effect of Schisandra chinensis leaf polysaccharide against L5178Y lymphoma. Carbohydr. Polym. 2012; 88, 21–25.
161. Zhong S., Liu X. D., Nie Y. C., Gan Z. Y., Yang L. Q., Huang C. Q., Zhong N. S. Antitussive activity of the Schisandra chinensis fruit polysaccharide (SCFP-1) in guinea pigs models). J. Ethnopharmacol. 2016; 194, 378–385.
Labels
Pharmacy Clinical pharmacologyArticle was published in
Czech and Slovak Pharmacy

2019 Issue 3
Most read in this issue
- Schisandra chinensis and its phytotherapeutical applications
- Theory and practice of pharmacopoeial control of quality of drugs and excipients IX. The problem of tolerance limits for the content of active substances and excipients in the European Pharmacopoeia (Ph. Eur.)
- XLI. pracovní dny Radiofarmaceutické sekce České společnosti nukleární medicíny ČLS JEP
- Selection of technological parameters for the preparation of the combined oral solution Maglycimet™







