Orální mukositida jako vedlejší účinek myeloablativní chemoterapie u hematoonkologických pacientů
Oral Mucositis as a Side Effect of Myeloablative Chemotherapy in Hemato-oncological Patients
The group of 20 patients treated for non-Hodgkin lymphomas and multiple myeloma was examined by stomatologists before planned autologous transplantation of stem cells. After tooth sanation and removal of the sources of local irritation and potential foci of odontogenic focal infection the patients were observed in the course of 4 to 5 weeks after transplantation for the occurrence of oral mucositis. Oral mucositis of 1st to 2nd degree (according to NCI-CTC classification) became manifest in the course of hemato-oncological treatment in all patients in relation to the type of chemotherapy. After successful termination of hemato-oncological treatment a spontaneous disappearance of oral mucositis developed. Low seriousness of oral complications of hemato-oncological therapy confirms the importance of careful stomatological preparation of the patient before planned autologous transplantation.
Key words:
autologous transplantation - oral mucositis - hemato-onkological patient - chemotherapy
Authors:
R. Pink 1; J. Pazdera 1; J. Vondráková 2; E. Faber 2; I. Skoumalová 2
Authors‘ workplace:
Klinika ústní, čelistní a obličejové chirurgie LF UP a FN, Olomouc
přednosta prof. MUDr. J. Pazdera, CSc.
1; Hemato-onkologická klinika LF UP a FN, Olomouc
přednosta prof. MUDr. K. Indrák, DrSc.
2
Published in:
Česká stomatologie / Praktické zubní lékařství, ročník 108, 2008, 1, s. 9-13
Overview
Soubor 20 pacientů léčených pro ne – Hodgkinské lymfomy a mnohočetný myelom byl stomatologicky vyšetřen před plánovanou autologní transplantací kmenových buněk. Po sanaci chrupu a odstranění zdrojů místního dráždění a potenciálních ložisek odontogenní fokální infekce byli nemocní v průběhu 4 – 5 týdnů po transplantaci sledováni s ohledem na výskyt orálních mukositid. U všech nemocných se v průběhu hematoonakologické léčby manifestovaly orální mukositidy I. – II. stupně (podle klasifikace NCI - CTC) v závislosti na typu chemoterapie. Po úspěšném ukončení hematoonkologické léčby orální mukositidy spontánně odezněly. Malá závažnost orálních komplikací hematoonkologické léčby potvrzuje význam pečlivé stomatologické přípravy pacienta před plánovanou autologní transplantací.
Klíčová slova:
autologní transplantace - orální mukositida - hematoonkologický pacient - chemoterapie
ÚVOD
Vysoce dávkovaná chemoterapie s podporou autologního štěpu periferních krvetvorných buněk je zavedenou standardní léčebnou metodou u řady hematologických malignit. Závažným problémem je výskyt těžkých orálních mukositid, které často vedou k několikadennímu diskomfortu ústní dutiny, který má dopad na omezený příjem léků, výživy per os a psychiku pacienta. V závislosti na stadiu pokročilosti se orální mukositida klinicky projevuje lehkým edémem sliznic, erytémem až těžkými ulceracemi krytými pablánami, které jsou pacientem vnímané velice bolestivě. U imunosuprimovaných pacientů představuje orální mukositida vstupní bránu infekce s rizikem vyvolání bakteremie či sepse. V prevenci jejich vzniku je nezbytná intervence stomatologa, jež před provedením transplantace spočívá v sanaci všech potenciálních infekčních ložisek, odstranění devitalizovaných zubů a v edukaci nemocného o správné péči o dutinu ústní během výkonu. V léčbě už rozvinuté orální mukositidy jsou dosavadní léčebné metody většinou omezeny na symptomatickou léčbu. Ukazuje se, že významnou roli zde sehrává dokonalá příprava pacienta před autologní transplantací ze stomatologického hlediska a péče o ústní dutinu po převodu kostní dřeně.
MATERIÁL A METODIKA
Do studie bylo zařazeno celkem 20 pacientů (8 mužů a 12 žen) léčených na Hematoonkologické klinice Fakultní nemocnice Olomouc v roce 2006. Všichni nemocní byli léčeni dle ustanovených léčebných protokolů pro ne – Hodgkinské lymfomy a mnohočetný myelom. Před zařazením do studie podepsali písemný souhlas s léčebným protokolem, který byl předem schválen etickou komisí.
Minimálně 3 týdny před zahájením myeloablativní chemoterapie bylo provedeno standardní stomatologické vyšetření (včetně zhotovení OPG), parodontologické vyšetření a odstranění potenciálních zdrojů mechanického dráždění sliznic (obroušení ostrých hran zubů a zubních náhrad). Součástí přípravy pacienta před transplantací byl nácvik Stillmanovy metody čištění zubů a poučení o škodlivosti kouření, alkoholu a konzumaci dráždivé stravy v průběhu terapie. V rámci odstranění možné odontogenní fokální infekce jsme přistoupili k extrakcím gangrenózních zubů, zubů s rentgenologicky prokazatelnými periapikálmi nálezy, částečně prořezaných třetích molárů s klinickými projevy perikoronitidy a zubů s viklavostí II. – III. stupně s aktivními parodontálními choboty. Zuby nedokonale endodonticky ošetřené, klinicky nereagující na poklep a testy vitality, které měly negativní RTG nález, jsme neextrahovali. Součástí vstupního stomatologického vyšetření bylo také stanovení PBI, CPITN a odstranění zubního kamene ultrazvukem. Pacienti s klinickými projevy orální mukositidy zařazení do studie absolvovali před zahájením chemoterapie týdenní léčebnou kůru (2x denně výplachy orálním antiseptikem Listerine). Do studie nebyli zařazeni pacienti s těžkými parodontitidami, kteří odmítali extrakce zubů a nemocní se špatnými hygienickými poměry v ústní dutině, kteří neměli zájem spolupracovat.
Bezzubým pacientům jsme doporučili nepoužívat po převodu periferních krevních buněk totální zubní náhrady a konzumovat měkkou stravu, aby bylo vyloučeno mechanické dráždění sliznice zubní náhradou s možností sekundární infekce.
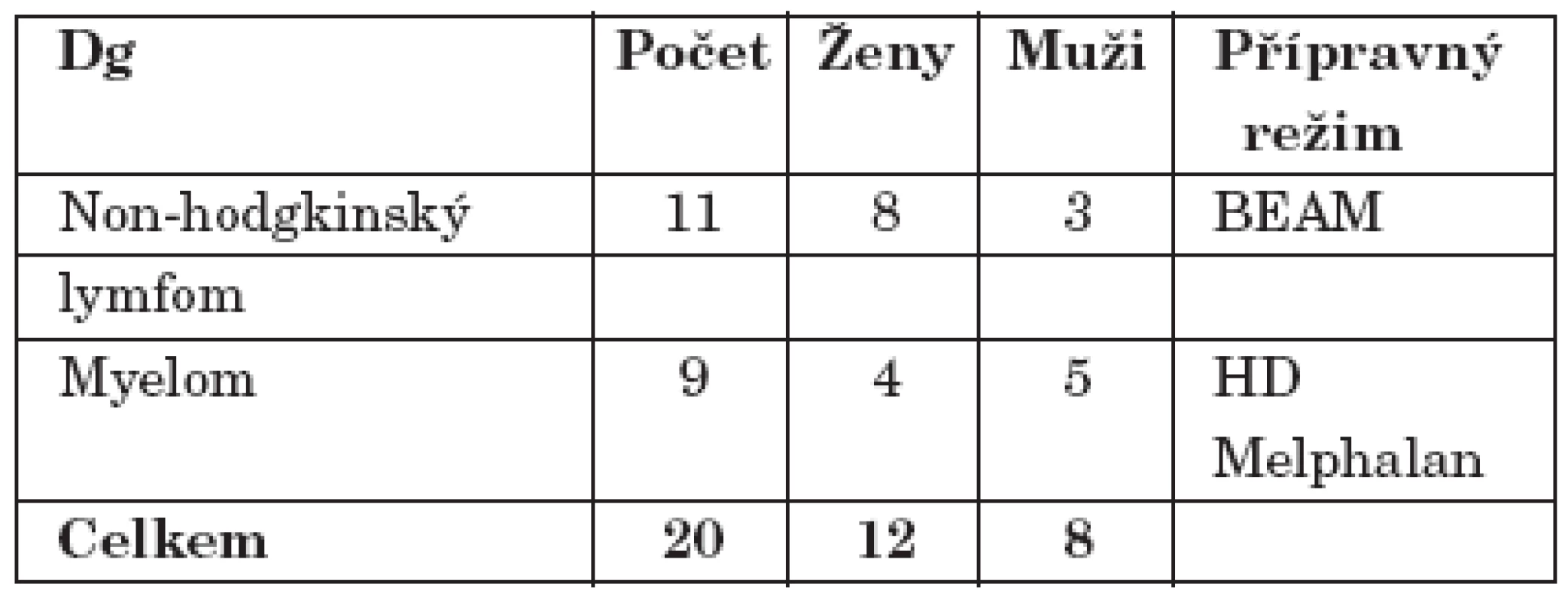
Z hematoonkologického hlediska byli všichni naši pacienti léčeni pro ne – Hodgkinské lymfomy a mnohočetný myelom dle ustanovených léčebných protokolů (tab. 1). V případě ne – Hodgkinských lymfomů se jednalo o kombinovanou myeloablativní chemoterapii BEAM ve složení BCNU, Cytosar (Cytarabin), Vepesid (Etoposid), Alkeran (Melphalan). V případě mnohočetného myelomu se jednalo o monoterapii vysoce dávkovaným Alkeranem (Melphalan). 24 hodin po aplikaci myeloablativní chemoterapie byl u všech pacientů (v podmínkách reverzní izolace a selektivní dekontaminace GIT) proveden převod vlastních periferních kmenových buněk. K urychlení přihojení štěpu byly nemocným podávány růstové faktory (G – CSF). Úspěšnost přihojení byla hodnocena na základě vyšetření krevního obrazu (včetně diferenciálního) a stanovení hladiny neutrofilů a trombocytů v krvi. Součástí podpůrné léčby bylo preventivní podávání antimykotik, antibiotik, chemoterapeutik a virostatik. Standardně byla aplikována kombinace fluconazolu, fluorochinolonů, cotrimoxazolu a acykloviru (tab. 1).
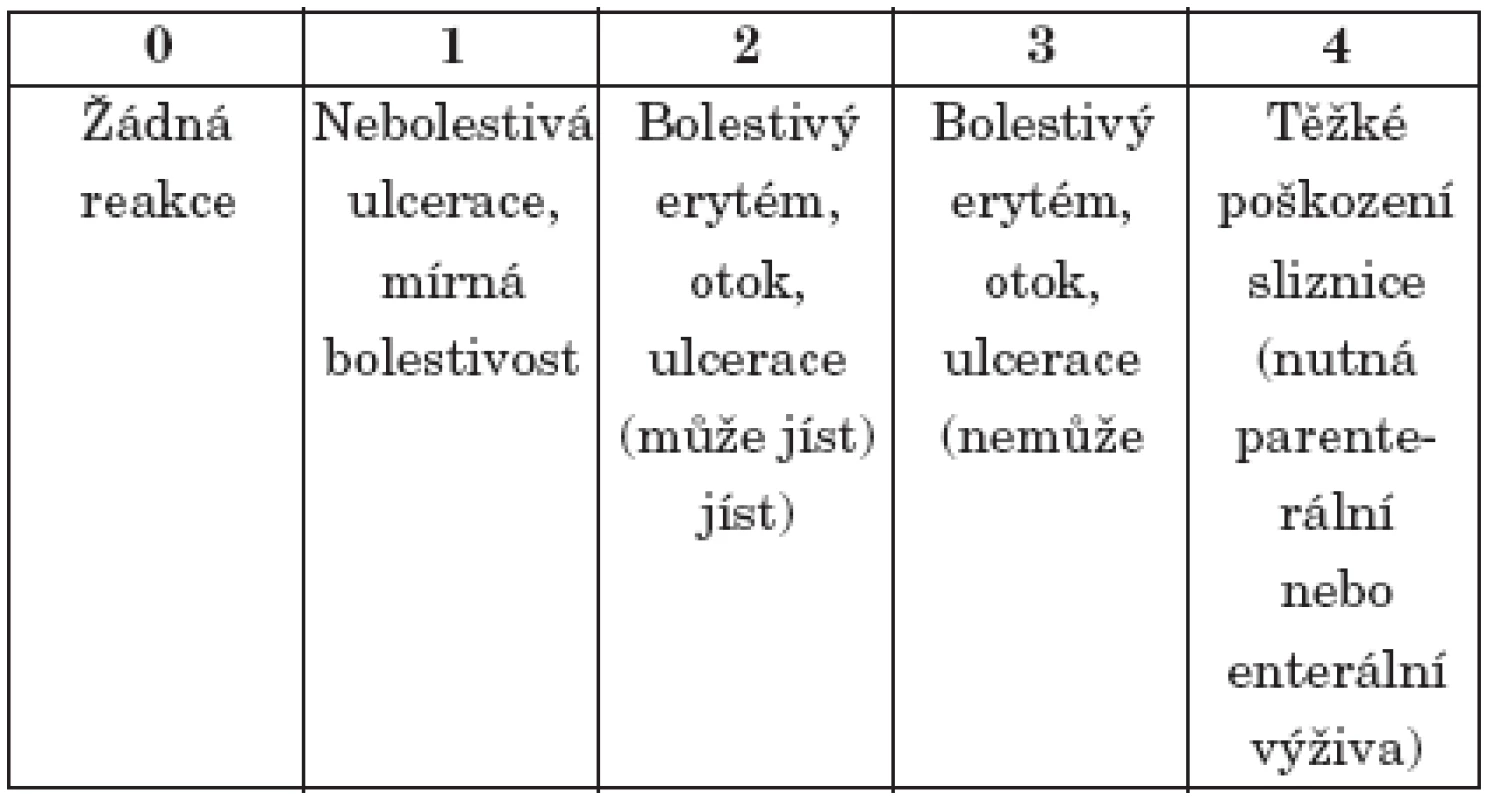
Intraorální vyšetření k posouzení vývoje slizničních změn v průběhu chemoterapie a po jejím ukončení bylo prováděno každý den.. V tabulce 2 uvádíme příklad schématu NCI - CTC založeného na objektivním vyhodnocení stavu orálních sliznic, které jsme v praxi využívali. V prevenci rozvoje orální mukositidy v průběhu léčby cytostatiky se vedle výplachů slizničním antiseptikem Listerine (Pfizer), prováděných 2x denně u nemocných s mnohočetným myelomem, osvědčila kryoterapie podávaná v průběhu chemoterapie melphalanem. Podstatou protektivního účinku této metody je navození vazokonstrikce krevních kapilár. V důsledku správně načasované krátkodobé ischemizace ústní sliznice dochází ke snížení nežádoucích účinků cytostatik na buňky sliznice ústní dutiny [12, 13, 14, 26. Kryoterapie byla prováděna oblými kostkami ledu, které pacient vkládal do úst 15 minut před, 15 minut v průběhu aplikace cytostatika a 30 minut po ukončení infuze melphalanu. Zmíněnou profylaxi stomatitidy nemocní vesměs velmi dobře snášeli. Jen u několika pacientů jsme museli přípravek Listerine pro nepříjemný pocit pálení v ústech ředit sterilní vodou v poměru 1 : 1 (tab. 2).
VÝSLEDKY
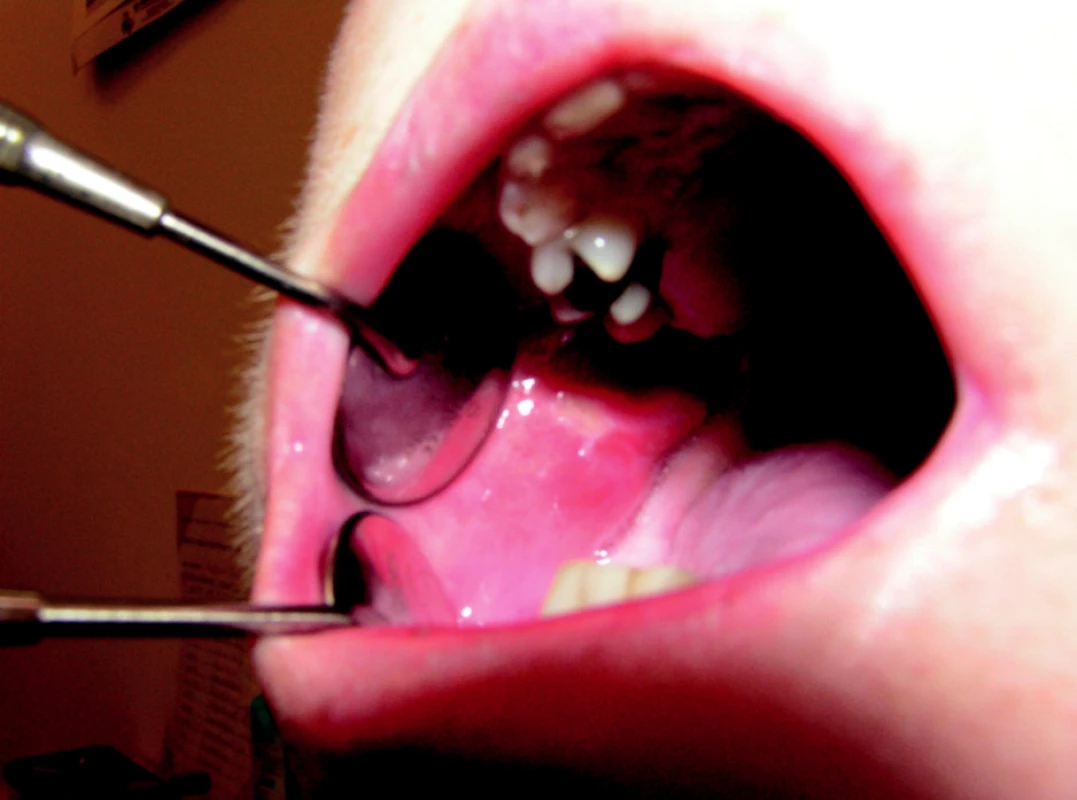
V průběhu chemoterapie jsme u 20 nemocných, zařazených do studie, pozorovali nejčastěji I. stupeň orální mukositidy. U pěti pacientů léčených kombinovanou chemoterapií pro ne – Hodgkinské lymfomy jsme zaznamenali mezi 6. – 9. dnem II. stupeň slizničních změn, při nízkých hodnotách hladin neutrofilů v krvi (obr. 1). Během léčby jsme u žádného z nemocných zařazených do souboru nepozorovali orální mukositidy III. a IV. stupně. U jednotlivých pacientů jsme zaznamenali postupný vývoj orální mukositidy v časovém horizontu 14 dnů, s gradací klinických projevů okolo sedmého dne po převodu štěpu periferních kostních buněk. Klinické projevy orální mukositidy vyjádřené graficky připomínají pyramidu (graf 2). U většiny nemocných orální mukositidy ustoupily několik dnů před přihojením štěpu, které signalizoval vzestup hodnot neutrofilů v krvi < 0,5x10/9/l.

Větší agresivita a toxicita kombinované chemoterapie, působící na buňky sliznice ústní dutiny, nepříznivě ovlivnila závažnost orální mukositidy s ohledem na její časový průběh (graf 1). Potvrdila se skutečnost, že na vznik a rozsah orální mukositidy má vliv mechanické dráždění sliznice zuby. Svědčí o tom kratší trvání a nižší stupeň závažnosti orálních mukositid u bezzubých pacientů.

DISKUSE
Orální mukositidy, jako komplikace vyvolané myeloablativní chemoterapií, se nejčastěji manifestují na bukální sliznici a na spodině ústní dutiny a jazyka. Sliznice tvrdého patra a gingivy jsou vůči toxickému působení cytostatik relativně odolné. Vyvolávajícím momentem ohraničených slizničních lézí může být také mechanické dráždění ostrými okraji zubů, jejich kořeny nebo zubními náhradami. Významnou roli hraje samozřejmě i sekundární infekce bakteriálního, virového nebo mykotického původu. Sanace chrupu a odstranění potenciálních zdrojů odontogenní fokální infekce je proto nezbytností u všech hematoonkologických pacientů před plánovanou transplantací kostní dřeně.
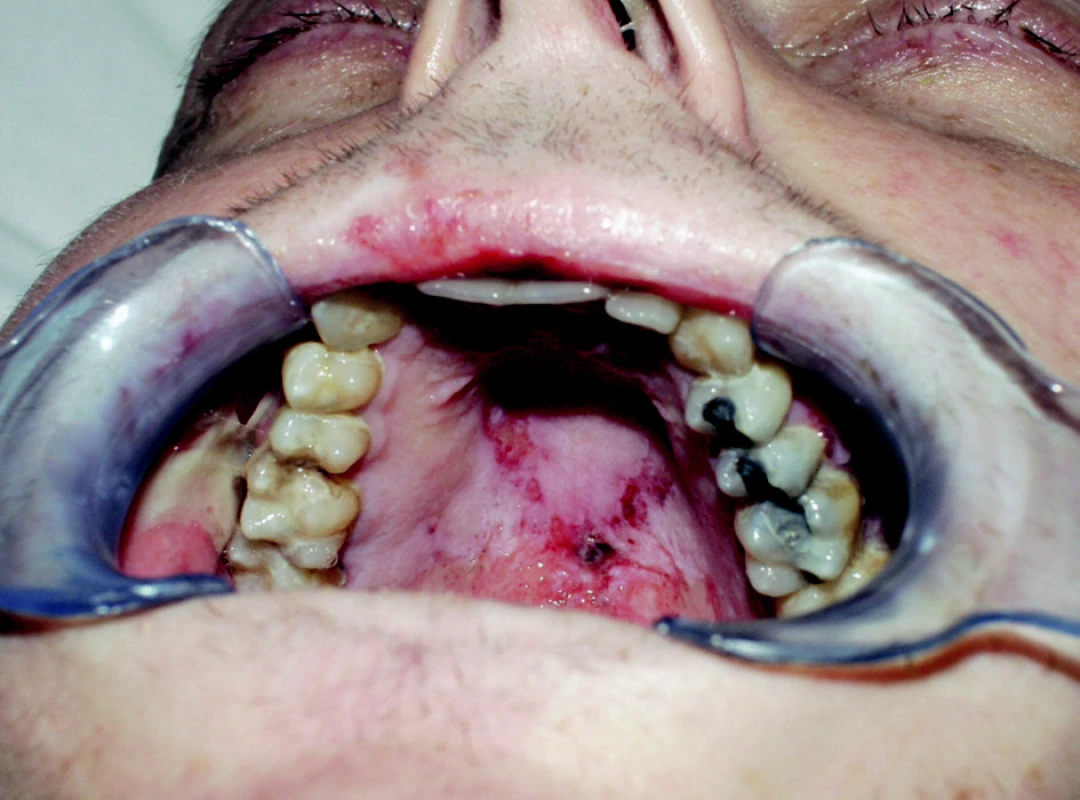
Reakce štěpu proti hostiteli (GVHD) může být závažnou komplikací alogenní transplantace kmenových buněk.. Pro reakci štěpu proti hostiteli (GVHD) jsou typické těžké slizniční léze, lokalizované na gingivě, tvrdém i měkkém patře a hřbetu jazyka (nekrotická gingivostomatitis) (obr. 2). Tyto změny bývají spojeny s xerostomií a mají v chronickém stadiu často až lichenoidní charakter [15].
Zdá se, že z hlediska patogeneze má orální mukositis v průběhu chemoterapie pět biologických stadií [1, 2, 3]:
- iniciální stadium
- stadium primárního poškození
- stadium progrese
- stadium ulcerace
- stadium hojení.
Značná nejednotnost hodnotících schémat při klasifikaci slizničních lézí neumožňuje přesné srovnávání toxicity režimů myeloablativní chemoterapie a efektivity léčby. Nejčastěji užívaná jsou schémata WHO a NCI – CTC [4, 5, 6] (tab. 2).
Standardní součástí prevence a léčby orálních mukositid je použití orálních antiseptik. V literatuře byla na toto téma publikována řada prací, jejichž závěry nejsou zcela jednoznačné. Např. Vokurka a spol. [7] nenalezli rozdíly mezi použitím jodidových preparátů jako orálních antiseptik ve srovnání s fyziologickým roztokem. Preparát Listerine, který jsme použili u našich pacientů, je antiseptikum složené z esenciálních olejů (thymol, eucalyptol, methyl salicylát, mentol) a alkoholu. Antibakteriální mechanismus jeho účinku je založen na blokádě buněčného metabolismu orálních patogenů [8]. K tomu přistupuje ještě účinek antimykotický a antivirotický [9]. Listerine má velice dobrý účinek na prevenci vzniku a odstranění již vzniklého zubního kamene. Přitom nenarušuje rovnováhu bakteriální flóry ústní dutiny a nezabarvuje sklovinu zubů při dlouhodobém užívání [10, 11]. Má také velice dobrý terapeutický vliv na zánětlivá onemocnění parodontu.
Rovněž využití zkráceného cyklu kryoterapie v prevenci orálních mukositid, prováděnou oblými kostkami ledu 15 minut před zahájením chemoterapie, 15 minut v průběhu a 30 minut po ukončení chemoterapie, se ukázalo být dostatečně účinné. Je tedy možno souhlasit s názorem, že prolongovaná kryoterapie by byla pro pacienta zbytečně zatěžující [26].
Komplementární možností léčby orálních mukositid jsou měkké lasery [17, 18], aplikované na oblast slizničních lézí, případně podávání vitaminů A a E, které jsme u našich pacientů nevyužili. V zahraničí se v poslední době osvědčilo také systémové podání Paliferminu, (růstového faktoru keratinocytů). Ten má, bohužel, také významné negativní vedlejší účinky, jako je možnost indukce karcinomu tlustého střeva u familiární polypózy [15, 16]. Navíc jeho použití je v současné době finančně neúnosně náročné.
Z výsledků studie je zřejmé, že hematoonkologičtí pacienti trpěli v průběhu chemoterapie převážně lehkými orálními mukositidami. Druhý stupeň orální mukositidy podle NCI-CTC se vyskytoval výhradně u pacientů léčených kombinovanou chemoterapií a při nulových hladinách neutrofilů v krvi. Právě u pacientů léčených kombinovanou chemoterapií pro ne – Hodgkinský lymfom byla doba trvání orálních mukositid až trojnásobná. Závažnost slizničního poškození je tedy úměrná toxicitě myeloablativní chemoterapie, jak vyplývá z grafu 1.
Otevřenou kapitolou zůstává radikalita stomatologické přípravy pacientů před transplantací kmenových buněk a chirurgickými výkony. Zdá se, že při jejím plánování by měl být zohledněn typ transplantace a agresivita předpokládané chemoterapie. Striktně radikální postup lze doporučit u pacientů před alogenní transplantací. Naše zkušenosti potvrzují názor Starosty a Fabera [23, 24], že před autologní transplantací kmenových buněk je možno postupovat s menší radikalitou: není tedy nutné extrahovat zuby, byť endodonticky ne zcela dokonale ošetřené, pokud nemají rentgenologicky prokazatelná periapikální zánětlivá ložiska. V každém případě je důležité vyloučit rizika mechanické iritace měkkých tkání ostrými hranami zubů, protéz, popřípadě zubním kamenem a předejít tak vzniku slizničních dekubitů. Výsledky naší studie prokázaly význam stomatologické prevence pro redukci výskytu a závažnosti orálních komplikací chemoterapie
ZÁVĚR
Výsledkem dobré spolupráce mezi stomatologem a hematoonkologem je nejen snížení frekvence a závažnosti výskytu orálních mukositid, ale i eliminace rizika potenciálních odontogenních komplikací léčby. Orální zdraví může i v této souvislosti sloužit jako indikátor celkového zdravotního stavu pacienta. Pro stanovení obecně platných závěrů a doporučení bude nicméně nutné v práci pokračovat a soubor dále rozšířit.
Věnováno k životnímu jubileu doc. MUDr. Jiřího Kozáka, CSc.
MUDr. Richard Pink
Klinika ústní, čelistní a obličejové chirurgie LF UP a FN
I. P. Pavlova 6
775 20 Olomouc
Sources
1. Sonis, S., Oster,G., Fuchs, H. et al. Oral mucositis and the clinical and economic outcomes of hematopoeitic stem – cell transplantation. Oncol., 2001, č.19, s. 2201-2205.
2. Sonis, S.: The pathology ofmucositis. Nat. Rev. Cancer, 2004, č. 4, s. 227-284.
3. Blijlevens, N., Donelly, J. P., De Pau, B. E.: Mucosal barrier injury: biology pathology clinical counterparts and consequences ofintensive treatment for haematological malignancy: an overwiev. Bone Marrow Transplant., 2000, č. 25, s. 1269–1278.
4. Stone, R., Quinn, B., McCann, S. et al.: Improving oral care in transplantation quality control of oral mucositis (OM) assesment in the EBMT prospective oral mucositis audit (POMA). Bone Marrow Transplantation, 2006, č. 37, Suppl. 1, s. N966.
5. Stockman, M. A., Sonis, S. T., Dijkstra, P. U. et al.: Assesment oforal mucositis in clinical trials: impact oftraining on avaluators in multi-centre trial. Eur. J. Cancer, 2005, č. 41, s. 1735-1738.
6. Rubenstein, E., Peterson, D., Schubert, M. et al.: Clinical practice guidelines for prevention and treatment of cancer therapy – induced oral and gastrointestinal mucositis. Cancer, 2004, č. 100, s. 2026-2046.
7. Vokurka, S., Bystřická, E., Koza, V. et al.: The comparative effects of providone-iodine and normal saline mouthwashes on oral mucositis in patiens after high-dose chemotherapy and APBSCT – results of a randomized multicentre study. Support Care Cancer, č. 13, s. 554-558.
8. Fine, D. H.: Mouthrinces as adjunct for plaque and gingivitis management. A status report for the American Journal of Dentistry, 1998, č. 1, s. 259-263.
9. Miller, T. F., Silva, A., Ferreira, S. M., Jabra-Rizk, M. A., Kelley, J. I., DePaola, L. G.: Efficacy of Listerine antiseptic in reducing viral contamination of saliva. J. Clin. Periodontol., 2005, č. 32, s. 341-346.
10. Walker, C., Clark, W., Tyler, K., Ross, N., Dill, S.: Evaluation of microbial shifts following long-term antiseptic mouthrinse use. Journal of Periodontology, 1997, č. 48., s. 646-649.
11. Minah, G. E., DePaola, L. G., Overholser, C. D., Miller, T. F., Niehaus, C., Lamm, R. A., Ross, N. M., Dills, S. S.: Effects of 6 months use of an antiseptic mouthrinse on supragingival dental plaque microflora. Journal of Clinical Periodontology, 1989, č. 15, s. 347-352.
12. Mahood, D. J., Dose, A. N., Loprinzi, C. L. et al.: Inhibition offluorouracil – induced stomatitis by oral cryotherapy. J. Clin. Oncol., 1991, č. 9, s. 449-452.
13. Cascinu, S., Fedeli, A., Fedeli, S. L. et al.: Oral cooling (cryotherapy), and effective treatment for prevention of5 - fluorouracil induced stomatitis. Eur. J. Cancer B. Oral Oncology, 1994, č. 30B, s. 234-236.
14. Roche, L. K., Loprinzi, C. L., Lee, J. K. et al.: A randomized clinical trial of two different durations oforal cryotherapy for prevention of 5 - fluorouracil – related stomatitis. Cancer, 1993, č. 72, s. 2234 - 2238.
15. Krijanovski, O., Hill, G., Cooke, K. et al.: Keratinocyte growth factor separates graft - versus - leukemia effects from graft – versus - host - disease. Blood, 1999, č. 94, s. 825 - 831.
16. Spielberger, R., Stiff, P., Bensinger, W. et al.: Palifermin for oral mucositis after intensive therapy for hematologic cancers. N. Engl. J. Med., 2004, č. 351, s. 2590-2598.
17. Barasch, A., Peterson, D. E., Tanzer, J. M. et al.: Helium - neon laser effects on conditioning induced oral mucositis in bone marrow transplantation patients. Cancer, 1995, č. 76, s. 2550-2556.
18. Cowen, D., Tardieu, C., Schubert, M. M. et al.: Low energy helium-neon laser in prevention oforal mucositis in patients undergoing bone marrow transplantation - results of double blind randomized trial. Ind. J. Radiad. Oncol. Biol. Phys., 1997, č. 38, s. 367-703.
19. Starosta, M., Faber, E.: Stomatitis u nemocných po autologní transplantaci hemopoetických kmenových buněk. Praktické zubní lékařství, roč. 48, 2000, č. 5, s. 131-136.
20. Bartáková, V.: Problémy stomatologického ošetřování u vybraných skupin rizikových pacientů, Čs. Stomat., 1986, roč. 86, č. 4, s. 255-260.
21. Mori, T., Yamazaki, R., Aisa, Y., Nakazato, T., Ikeda, Y., Okamoto, S.: Brief oral cryoterapy for the prevention of high-dose melphalan-induced stomatitis in allogeneic hematopoietic stem cell transplant recipients. Support Care Cancer 13, 2005, s. 266-269.
Labels
Maxillofacial surgery Orthodontics Dental medicineArticle was published in
Czech Dental Journal

2008 Issue 1
- What Effect Can Be Expected from Limosilactobacillus reuteri in Mucositis and Peri-Implantitis?
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Blokáda nervus alveolaris inferior u 284 pacientů se semiretinovanými a retinovanými dolními zuby moudrosti: Naše zkušenosti
- Orální mukositida jako vedlejší účinek myeloablativní chemoterapie u hematoonkologických pacientů
- Příspěvek ke studiu chrupu brněnských obyvatel v druhé polovině 18. a v 19. století
- Volné radikály a antioxidanty (Souborný referát)
- Temporomandibulární kloub a jeho 2D a 3D modely
- Stomatologické ošetření dětských pacientů v celkové anestezii
- Czech Dental Journal
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Temporomandibulární kloub a jeho 2D a 3D modely
- Stomatologické ošetření dětských pacientů v celkové anestezii
- Blokáda nervus alveolaris inferior u 284 pacientů se semiretinovanými a retinovanými dolními zuby moudrosti: Naše zkušenosti
- Orální mukositida jako vedlejší účinek myeloablativní chemoterapie u hematoonkologických pacientů
