Mikrobiologické vyšetření a stanovení rizika vzniku zubního kazu u pacientů s jícnovou refluxní nemocí
Microbiological Examination and Determination of the Risk of Caries Development in a Patient with Esophageal Reflux Disease
The main oral manifestation of gastroesophageal reflux disease is dental erosion. The very few studies have evaluated the damage and changes of soft, periodontal tissues and microbial flora. The aim of this study was to measure mutant streptococci and lactobacilli counts as predisposing factors to dental caries using Dentocult SM® and Dentocult LB® tests.
The results showed lower counts of Streptocococcus mutans and lactobacilli, that means lower predisposing factor to dental caries. These results suggest that demineralization of hard dental tissues is without cariogenic plaque.
Key words:
dental erosion - gastroesophageal reflux disease - dental pellicle
:
K. Filipi; Z. Halačková
:
Oddělení záchovné stomatologie, Stomatologická klinika LF MU a FNuSA, Brno
:
Česká stomatologie / Praktické zubní lékařství, ročník 110, 2010, 5, s. 68-73
:
Hlavním projevem refluxní nemoci jícnu v ústní dutině je poškození tvrdých zubních tkání erozemi. Poškození měkkých tkání, parodontu a změně mikrobiální flóry je všeobecně věnováno málo pozornosti. Kyselý refluxát dosahuje hodnot pH 1-2, což může svým účinkem přímo poškodit měkké tkáně a umožnit nárůst acidogenní flóry. Cílem studie bylo vyhodnocení rizika vzniku zubního kazu stanovením počtu kariogenních kmenů Streptococcus mutans a laktabacilů pomocí testů Dentocult SM® a Dentocult LB®.
Výsledky ukazují na nižší hodnoty počtů kariogenních kmenů, a tím na snížené riziko vzniku zubního kazu. Navíc potvrzují, že demineralizace tvrdých zubních tkání, na rozdíl od zubního kazu, se děje bez účasti kariogenní flóry.
Klíčová slova:
eroze zubů - refluxní nemoc jícnu - pelikula
ÚVOD
Prevalence refluxní choroby jícnu v České republice není známa. Ve všeobecné populaci západní Evropy a USA je odhadována na 5 až 10 %. Dle údajů České gastroenterologické společnosti, incidence onemocnění refluxní nemocí jícnu v České republice stoupá [17].
Gastroezofageální reflux je zpětný tok žaludečního obsahu do jícnu, případně do ústní dutiny. Když je reflux provázen symptomy nebo extraezofagálními komplikacemi, mluvíme o refluxní nemoci jícnu (v angl. literatuře GERD Gastroesofageal Reflux Disease, případně GORD Gastro-oesophageal Reflux Disease). Často onemocnění zůstává nerozpoznáno, když nejsou symptomy příliš výrazné, nebo když se reflux objevuje převážně v noci [1, 3, 4, 14, 24, 29].
Projevem refluxní choroby v ústní dutině je především poškození tvrdých zubních tkání erozemi. Eroze zubů mnoho autorů považuje za jeden z prvních extraezofageálních projevů jícnové nemoci, a proto zubní lékaři jsou často první odborníci, kteří objeví manifestaci gastroezofageálního refluxu v ústní dutině [3, 5, 10, 29]. Eroze zubů je chemické poškození a je provázeno ztrátou tvrdých zubních tkání bez účasti kariogenních bakterií. Na závažnosti poškození se podílí množství sliny, pufrační kapacita, přítomnost pelikuly na povrchu zubu, exogenní příjem kyselých látek, hygiena ústní dutiny, pH refluxátu a čas, kdy a jak dlouho reflux přetrvává [3, 7, 32].
Z důvodu multifaktoriálního původu erozí je důležitá včasná klinická diagnóza primárního onemocnění s důsledným plánováním ošetření v ústní dutině. Poškození zubů způsobuje estetický i funkční problém ztrátou tvrdých zubních tkání a citlivost zubů k vnějším podnětům.
U pacientů s jícnovou refluxní nemocí však není úplně objasněn vliv kyselého prostředí na poškození měkkých tkání, parodontu a na změnu ústní mikrobiální flóry. Poškození sliznice jícnu při opakovaném styku se žaludeční kyselinou a pepsinem je prokázáno, proto se očekává i možné poškození měkkých tkání ústní dutiny [15].
Cílem práce autorů je přiblížit problematiku patologického gastroezofageálního refluxu se zaměřením na měkké tkáně ústní dutiny a objasnění rizika vzniku zubního kazu stanovením počtu kmenů laktobacilů a Streptococcus mutans.
TEORETICKÁ ČÁST
Refluxní nemoc jícnu
Gastroezofageální reflux vzniká nekontrolovaným pohybem žaludečních šťáv ze žaludku přes dolní ezofageální svěrač do distálního jícnu. Tím převáží agresivní faktory nad obrannými mechanismy a kyselý žaludeční obsah prostupuje přes dolní ezofageální svěrač do jícnu a úst, kde může dojít k poškození všech přítomných tkání [4, 21, 22, 25].
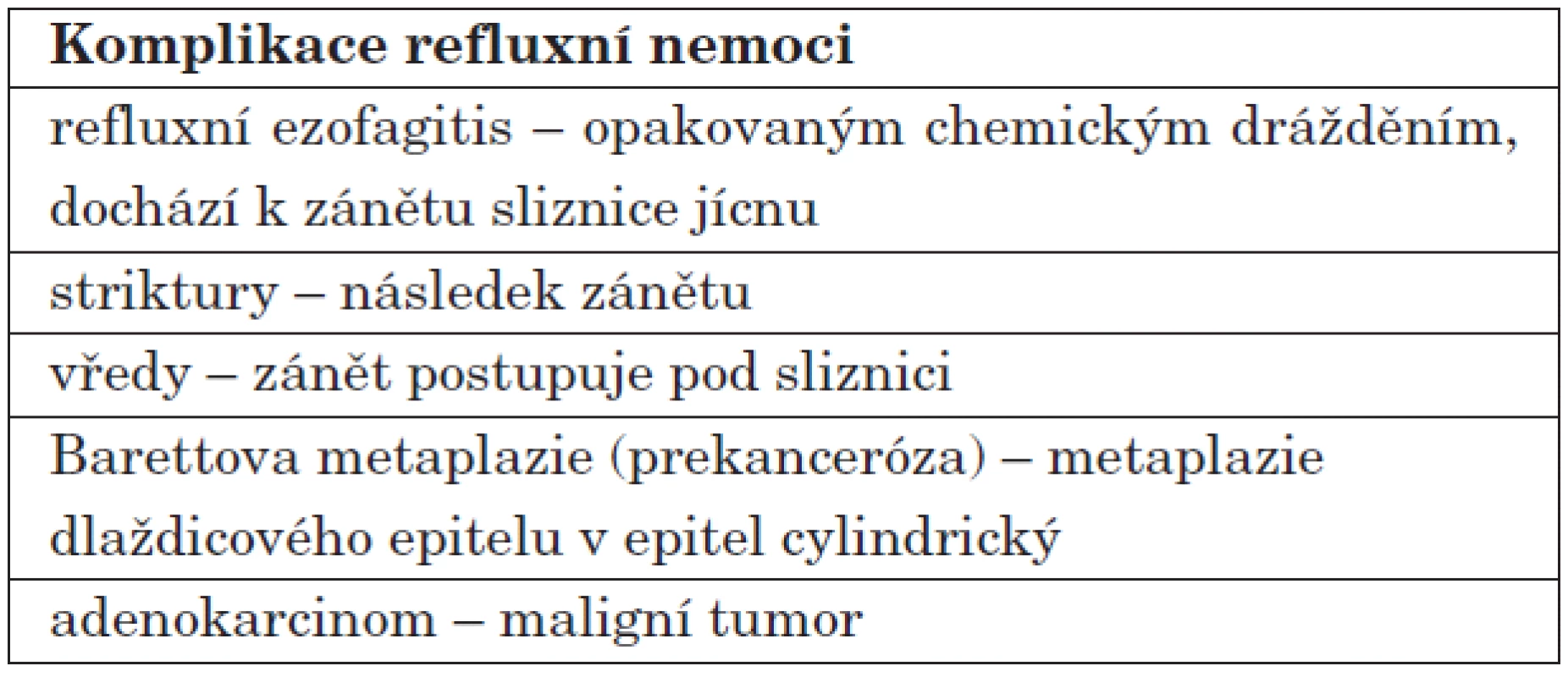
Agresivně působící refluxát může být tvořen žaludeční kyselinou, pepsinem, solemi žlučových kyselin, pankreatickými štávami. Když se jedná o duodenální reflux, může být i alkalický. Fyziologický reflux se objevuje po jídle, zvláště po fyzické námaze, při zvýšené náplni žaludku, nebo při horizontální poloze. Na rozdíl od fyziologického refluxu, patologický reflux trvá dlouhodobě a vyvolává uvedené příznaky a extraezofageální komplikace (tab. 1, tab. 2).
![Typické a atypické příznaky refluxní nemoci [17].](https://www.prelekara.sk/media/cache/resolve/media_object_image_small/media/image/548ca8fb17a1fc6208b39b2e47a60893.png)
Slina
Slina hraje velmi důležitou roli v ochraně tvrdých a měkkých tkání ústní dutiny. Je schopna omývat, ředit, neutralizovat a pufrovat kyseliny, tvoří ochrannou pelikulu a obsahuje ionty, které jsou schopné remineralizovat poškozené zubní tkáně. Omývací činnost sliny umožňuje odstranění zbytků potravy a kyselých látek z jícnu a žaludku. Obsah HCO3 pufruje slinu na pH přibližně 6,5, zabraňuje poklesu pH pod 5,5, které je kritické pro demineralizaci zubní skloviny. Slouží jako rezervoár vápenatých, fosfátových a fluoridových iontů [19]. Množství sliny v průběhu dne není konstantní, závisí na cirkadiánních rytmech i na dalších faktorech [31].
Normální ústní flóra a zubní plak
Normální mikrobiální flóra poskytuje sliznicím ústní dutiny i zubům ochranu před invazivními patogenními organismy. Mikroflóru ústní dutiny dělíme na stálou a přechodnou. Za normálních okolností nevyvolává stálá mikroflóra patologický stav. Za změněných podmínek jsou však fakultativní patogeny ústní dutiny schopné vyvolat onemocnění tvrdých zubních tkání, sliznic nebo parodontu.
Rod Streptococcus (S.)
Streptokoky jsou fakultativně anaerobní, katalázanegativní grampozitivní koky, seřazené do dvojic až řetízků. Streptoky dělíme podle hemolýzy na krevním agaru na beta, alfa a gama hemolytické streptokoky. Kromě typu hemolýzy se streptokoky rozdělují i podle toho, zda obsahují specifický polysacharid C (sérologické skupiny A-Z). Specifický polysacharid C chybí pneumokokům a většině streptokoků v ústní dutině. Streptokoky skupiny mutans jsou považovány za nejdůležitějšího mikrobiálního původce zubního kazu [13, 26, 33].
Ústní streptokoky dělíme do skupin :
Skupina mitis : Streptococcus mitis, sanguinis, gordonii, oralis, peroris.Vyskytují se na povrchu sliznic ústní dutiny a v zubním plaku.
Skupina salivarus : Streptococcus salivarius, vestibularis. Vyskytují se ve slinách, na povrchu sliznic a jazyka [33].
Skupina mutans : Streptococcus mutans, sobrinus, cricetus, rattus. Jsou předpokládanými původci zubního kazu. Streptokoky skupiny mutans štěpí svými enzymy sacharózu a pevně adherují na povrchu zubu. Tyto produkty štěpení sacharózy tvoří základní mezibuněčnou hmotu zubního plaku. Streptokoky tvoří kyseliny a odolávají i poklesu pH. Při nepřítomnosti sacharidů v potravě jsou schopné syntetizovat intracelulární polysacharidy. Organické kyseliny spolu s dalšími faktory mohou způsobit vznik zubního kazu. Zubní kaz je multifaktoriální přenosné infekční onemocnění. Pro jeho vznik je potřebný vnímavý zubní povrch, sacharidy v potravě, přítomnost kariogenních bakterií a čas [13, 33]. Za hlavního bakteriálního původce zubního kazu je považován Streptococcus mutans a Streptococcus sobrinus [26].
Rod Lactobacillus (L.)
Grampozitivní tyčinky Lactobacillus casei, L. acidophilus, L. oris se v ústní dutině vyskytují běžně v malém počtu. Zvýšení počtu laktobacilů poukazuje na zvýšené množství sacharidů v potravě, nebo je nalezneme na okraji zubního kazu. Jsou vysoce acidogenní. Tvoří kyselinu mléčnou a jsou schopné se množit při nižším pH než 5. Ze sacharózy tvoří extra i intracelulární polysacharidy. Přítomnost laktobacilů poukazuje na progresi kariogenní léze. Neúčastní se vzniku samotného kazu. Vyšetření přítomnosti kariogenních kmenů S. mutans a Lactobacillus spp. ve slinách se používá k vyhodnocení rizika vzniku zubního kazu. Vysokou kariogenní aktivitu předpokládáme u nálezů počtu streptokoků u více než 106 a více než 105 laktobacilů v 1 ml stimulované sliny [33].
Pelikula
Jedním z důležitých faktorů ovlivňujících poškození zubů demineralizací, erozemi nebo zubním kazem je přítomnost pelikuly na povrchu zubní skloviny nebo cementu. Pelikula je tenká vrstva glykoproteinů pocházejících ze sliny s tloušťkou 1 až 10 µm, která usnadňuje adhezi mikrobů a tvorbu biofilmu. Tvoří se již několik sekund po očištění zubů. Obsahuje albumin, amylázu, lysozym, glukosyltransferázu, imunoglubuliny IgA a IgG [13]. Slouží jako difuzní bariéra, která umožňuje prostup iontů ze sliny do skloviny a naopak, i jako zásobárna kalciových, fosfátových a fluoridových iontů. Hraje důležitou roli u demineralizace kariézních nebo erozivních procesů [12, 19, 20]. Adheze mikrobů je umožněna slabými fyzikálně-chemickými (van der Waalsovými) a elektrostatickými silami.
Pelikula obsahuje receptory, na které se vážou adheziny grampozitivních koků a tyčinek (streptokoky, aktinomycety, laktobacily) [16]. Prvotními kolonizátory jsou grampozitivní koky, nejčastěji streptokoky (S. mitis, S. sanguinis, S. oralis, S. gordonii), které kolonizují na zubním povrchu již během prvních čtyř hodin po vyčištění zubů. Během dalších dvanácti hodin k nim agregují další bakterie, především aktinomycety, dále například zástupci rodů Capnocytophaga, Haemophilus, Prevotella, Propionibacterium či Veillonella, které umožní adhezi i jiným druhům. Dosažením kritického bodu v množství plaku dojde ke tvorbě exopolysacharidů, které tvoří základní mezibuněčnou hmotu plaku. Zrání plaku je urychleno za přítomnosti sacharózy v potravě. Kumulace plaku nastává dělením, růstem a odstraňováním mikroorganismů. Časným stadiem plaku je nazýváno období 4 - 48 hodin s kondenzovanou vrstvou a menším počtem mikrobů. Vývoj plaku závisí na pH a oxidoredukčním potenciálu prostředí. V průběhu tvorby zubního plaku dochází ke zvyšování podílu anaerobních mikroorganismů nad aerobními důsledkem snížené difuze kyslíku do vrstev plaku a vytvořením anaerobního prostředí. Při akumulaci bakterií na zubním povrchu a rozvoji zubního plaku produkují bakterie různé organické kyseliny, především kyselinu mléčnou, čímž dochází ke snižování pH ve vrstvách biofilmu. Bakterie, které jsou metabolicky aktivní i při pH nižším než 5,5, jsou Streptococcus mutans a laktobacily. Jejich kyselé metabolické produkty způsobují demineralizaci a narušení zubního povrchu, a tím vznik zubního kazu [33]. Demineralizace bez účasti kariogenních bakterií vede k rozpouštění tvrdých zubních tkání a ke vzniku erozí zubů. Pozdními kolonizátory jsou většinou gramnegativní bakterie (Veilonelly, Fusobacterium, Spirochety, Prevotella, Bacteroides, Actinobacillus) [13].
Pokusy in vitro dokazují, že nejtlustší pelikula se tvoří lingválně u dolních frontálních zubů, protože muciny pocházející ze slin jsou produkovány hlavně podjazykovou a podčelistní žlázou. Nejtenčí pelikula se podle Amaecchi a spol. nachází palatinálně na horních frontálních zubech, kde se uplatňuje abrazivní činnost jazyka [2]. Proto dochází u pacientů s regurgitací k největšímu poškození palatinálních ploch horních frontálních zubů.
MATERIÁL A METODY
Bylo vyšetřeno 50 pacientů v období od ledna 2006 do dubna 2008. Každý pacient byl obeznámen se způsobem vyšetření a souhlasil s ním. Studie byla schválena etickou komisí Lékařské fakulty Masarykovy univerzity.
Pacienti, kteří se léčili s refluxní nemocí jícnu (Gastroesophageal Reflux Disease - GERD) byli odesláni z FN Brno Bohunice. U každého byla potvrzena refluxní nemoc jícnu 24hodinovou pH metrií. Všichni byli po chirurgickém odstranění refluxu, nebo na operaci čekali. 20 pacientů mělo aktivní onemocnění a u nich jsme provedli mikrobiologický odběr pro stanovení rizika vzniku zubního kazu stanovením kmenů Streptococcus mutans a laktobacilů. U mikrobiologického vyšetření jsme zvolili testovací proužky firmy Oriondiagnostica pro stanovení rizika vzniku zubního kazu: Dentocult LB® pro přítomnost kmenů laktobacilů a Dentocult SM® pro stanovení kmenů Streptococcus mutans. Vzorky pro stanovení Streptococcus mutans byly odebrány z mezizubních prostorů horních řezáků, dolních řezáků, prvních molárů, pokud byly přítomné. Postupovali jsme dle doporučení výrobce. Vzorky byly naneseny na políčka testovacího proužku. Pak jsme pacienta nechali žvýkat parafínovou kuličku, aby se uvolnil Streptococcus mutans z povrchu zubů do slin. Druhým testovacím proužkem jsme obtiskli jazyk pacienta. Vzorky byly vloženy do kultivačního média. Inkubace trvala 96 hodin při pokojové teplotě. Po inkubaci je Streptococcus mutans patrný jako modré vyvýšené kolonie na testovacím proužku. Výsledky byly porovnány s modelovou tabulkou výrobce. Vzorky pro kmeny laktobacilů jsou založeny na detekci aerobních bakterií, produkujících kyselinu močovou ve stimulovaných slinách. Nasbírané stimulované sliny jsme aplikovali na kultivační plochy a inkubovali 7 dní při pokojové teplotě. Přítomnost bakterií se jeví jako bílé vyvýšené kolonie. Výsledky byly vyhodnoceny a porovnány s modelovou tabulkou. Pro objektivizaci vyhodnocoval výsledky jeden vyšetřující.
VÝSLEDKY
Množství kolonií Streptococus mutans a laktobacilů u pacientů s jícnovou refluxní nemocí ukazují tabulky 3 a 4. Vysokou kariogenní aktivitu předpokládáme u nálezů počtu Streptococcus mutans >106 a >105 laktobacilů v 1 ml stimulované sliny. Výsledky ukazují, že jenom tři pacienti měli vysoké riziko vzniku zubního kazu vzhledem k počtu kolonií laktobacilů a dva pacienti vzhledem k počtu Streptococcus mutans. Vysoké riziko kazu dle počtu laktobacilů nebo streptokoků nebylo u stejných pacientů.


DISKUSE
Velmi málo autorů se u pacientů s patologickým refluxem zabývá poškozením měkkých tkání nebo mikrobiologickým vyšetřením jejich ústní dutiny. Mnoho autorů poukazuje na zvýšený výskyt kazu a počet extrahovaných zubů. Otázkou však zůstává, jestli za zvýšeným počtem extrakcí jsou komplikace zubního kazu nebo eroze zubů [17, 25, 29]. Změna mikrobiální flóry ústní dutiny vlivem změněného pH u pacientů trpících refluxní nemocí se dá předpokládat. Proto jsme stanovili riziko vzniku zubního kazu dle přítomnosti kariogenních bakterií rodu Streptococcus (S.) mutans a laktobacilů. Vyšetřený počet pacientů je nízký, protože jsme vyšetřili pouze pacienty s aktivním onemocněním refluxní nemocí. Ostatní pacienti už byli po chirurgickém ošetření. Námi uváděné výsledky jsou však zajímavé i z toho důvodu, že byly zjištěny nízké počty kolonií kariogenních bakterií.
Mikrobiologické vyšetření
Linnett a spol. odebírali vzorek z jazyka pro stanovení výskytu Streptococcus mutans u dětí s patologickým refluxem. Zaznamenali výskyt kolonií s více než 106 CFU/ml S. mutans u 42 % pacientů s patologickým refluxem, což znamená vysoké riziko zubního kazu. U kontrolní skupiny byl výskyt >106 CFU/ml S. mutans u 25 % [17]. E. A. O´Sullivan a M. E. J. Curzon sledovali výskyt Streptococcus mutans u dětí s erozemi zubů v porovnání s kontrolní skupinou, která byla rozdělena na jedince s aktivním kazem a na jedince bez kazu. Nejvyšší počet kmenů Streptococcus mutans byl u pacientů s erozemi zubů, pak u jedinců s aktivním kazem a nejméně u jedinců bez kazu. Nízké hodnoty pH u skupiny s erozemi umožňují nárůst kmenů Streptococcus mutans, které jsou aktivní i při pH pod 4,2. Kyseliny však nepochází z produkce kariogenních kmenů, ale z exo - nebo endogenního příjmu. V porovnání s kontrolní skupinou měly děti s erozemi výskyt kazu podobný jedinci bez kazu, ale riziko vzniku zubního kazu z důvodu vysokého výskytu S. mutans jako jedinci s aktivním kazem. To potvrzuje fakt, že jsou eroze na svých okrajích bez kazu, protože zde chybí přítomnost kariogenního plaku. Za nejdůležitější okolnost pro vznik zubního kazu považují pufrační kapacitu slin [27]. Hölttä a spol. předpokládali zvýšený výskyt kmenů Streptococcus sobrinus u pacientů trpících patologickým refluxem. Zkoumali kolonizaci jednotlivých serotypů Streptococcus mutans (c, f) a sobrinus (g, d). Zjistili, že není rozdíl v počtech Streptococcus sobrinus v porovnání s kontrolní zdravou skupinou a že všichni, kteří mají kolonie Streptococcus sobrinus, jsou infikováni i kmenem Streptococcus mutans [11].
Projevy onemocnění na měkkých a tvrdých tkáních ústní dutiny
Hlavním projevem patologického refluxu v ústní dutině je poškození tvrdých zubních tkání erozemi. Mnozí autoři považují přítomnost erozí zubů za jeden z prvních extraezofageálních příznaků onemocnění [3, 4, 10, 15]. Pacienti často uvádějí subjektivní pocity pálení na jazyku, změny chuti, pocit kyselé pachuti v ústech, hlavně po probuzení [15]. Na sliznici úst je nutno pátrat po projevech xerostomie [7, 31]. Pokud se týká halitózy, di Fede a spol. uvádějí, že 49,2 % pacientů s patologickým refluxem trpí foetorem ex ore. Dle jejich názoru styk žaludeční kyseliny s měkkými tkáněmi způsobuje erytém sliznice měkkého patra a uvuly, a tvrdí, že je to příznak, který se neobjevuje u žádného jiného onemocnění [6]. Někteří autoři píší, že mezi papilami jazyka zůstávají zbytky kyseliny, které mohou poškozovat orální plochy horních frontálních zubů i v čase, kdy k regurgitaci nedochází [30, 33]. Jiní považují poškození palatinálních ploch frontálních zubů za následek abrazivního působení jazyka na erozemi poškozené zuby. In vitro studie tuto hypotézu potvrzují. Výsledky pokusů Gregga a spol., kteří měřili ztrátu tvrdých zubních tkání působením jazyka, potvrdily, že ztráta skloviny byla větší v porovnání se skupinou, u které došlo ke vzniku erozí bez abrazivního působení jazyka [8]. Na druhou stranu, vyústění submandibulárních a sublinguálních žláz, ale i samotný jazyk chrání dolní frontální zuby před erozemi. Postižení erozemi u dolních frontálních zubů se projevuje až v pokročilých stadiích onemocnění. U dolních zubů převládá patologická atrice [32].
Změna mikrobiální flóry je v mnoha pracích uvedena taktéž jako skutečnost, že erozivní defekty jsou na svých okrajích bez kazu, zatímco kazy na jiných zubech jsou přítomné. Problematické je i posouzení kazu samotného, neboť za kaz je považována i nevyhovující výplň, protože musí být nahrazena novou výplní [20, 27].
Poškození tvrdých i měkkých tkání ústní dutiny je velmi často spojeno s kvalitou a množstvím sliny. Nízká pufrační kapacita sliny se projeví na tvrdých zubních tkáních erozemi, zatímco na poškození měkkých tkání má vliv množství sliny. Kyselý refluxát může mít pH 1-2. Snížené množství sliny není schopné zneutralizovat kyselé látky, což se může projevit pálením na jazyku, změnou chuti, povleklým jazykem nebo foetorem ex ore.
Meurman a spol. se dotazovali pacientů s patologickým refluxem na subjektivní projevy jícnové nemoci v ústní dutině. Uváděli pocit sucha nebo pocit pálení a kyselé chuti na jazyku. Tyto příznaky byly bez statistické významnosti, takže se nepovažují za typický projev tohoto onemocnění v ústní dutině [23]. Cheung a spol. sledovali vliv pelikuly na ochranu skloviny před demineralizací za použití roztoku kyseliny chlorovodíkové (HCl), pro simulaci působení žaludeční kyseliny u regurgitace. Zjistili, že způsobuje hydrolýzu plaku i glykoproteinů pelikuly a eliminuje většinu bakterií [12]. Námi vyšetření pacienti si spíš stěžovali na zvýšenou citlivost zubů, i když u tří z nich byly výrazně suché sliznice a vyhlazený jazyk.
ZÁVĚR
Je mnoho pacientů s refluxní nemocí jícnu, u kterých onemocnění není diagnostikováno, i když symptomy jsou přítomny. Poškození tvrdých zubních tkání erozemi je jev, který je spojován s patologickým refluxem. Poškození měkkých tkání, změna mikrobiální flóry nebo vnímavost ke vzniku zubního kazu nejsou dostatečně prozkoumány. Proto jsou nutné další výzkumy pro posouzení poškození tvrdých zubních tkání erozemi, zubním kazem, poškození měkkých tkání a parodontu u pacientů s jícnovou refluxní nemocí.
Práce vznikla za podpory SVC: 1M 0528.
MUDr. Kristína Filipi
Oddělení záchovné stomatologie
Stomatologická klinika LF MU a FNuSA
Pekařská 53
656 91 Brno
e-mail: kika.hl@mail.muni.cz
Sources
1. Ali, D. A., Brown, R. S., Rodriguez, L. O. et al.: Dental erosion caused by silent gastroesophageal reflux diseas. J. Am. Dent. Assoc., 133, 2002, s. 734-737.
2. Amaechi, B. T., Higham, S. M., Edgar, W. M., Milosevic, A. et al.: Thickness of acquired salivary pellicle as a deterinant of the sites of dental erosion. J. Dent. Res., 78, 1999, 12, s. 1821-1828.
3. Barron, R. P., Carmichael, R. P., Marconet, M. A. et al.: Dental erosion in gastroesophageal reflux disease. J. Can. Dent. Assoc., 69, 2003, 2, s. 84-89.
4. Bartlett, D. W., Evans, D. F., Anggiansah, A. et al.: A study of the association between gastro-oesophageal reflux and palatal dental erosion. Brit. Dent. J., 181, 1996, 4, s. 125-131.
5. Bartlett, D. W., Evans, D. F., Smith, B. G.: The relationship between gastroesophageal reflux disease and dental erosion. J. Oral Rehabil., 23, 1996, s. 289-297.
6. Di Fede, O., Di Liberto, Ch., Occhipinti, G. et al.: Oral manifestation in patiens with gastro-oesophageal reflux disease: a single case-control study. J. Oral Pathol. Med., 37, 2008, s. 336-340.
7. Gandara, B. K., Truelove, E. L.: Diagnosis and management of dental erosion. J. Contemporary Dent. Praktice, 1, 1999, 1, s. 1-16.
8. Gregg, T., Mace, S., West, N. X. et al.: A study in vitro of the abrasive effect of the tongue on enamel and dentine softened by acid erosion. Caries Res., 38, 2004, s. 557-560.
9. Hara, A. T., Ando, M., González-Cabezas, C. et al.: Protective effect of the dental pellicle against erosive challenges in situ. J. Dent. Res., 85, 2006, 7, s. 612-616.
10. Holbrook, W. P., Furuholm, J., Gudmundsson, K. et al.: Gastric reflux is a significant causative factor of tooth erosion. J. Dent. Res., 88, 2009, 5, s. 422-426.
11. Hölttä, P., Aine, L., Mäki, M. et al.: Mutans streptococcal serotypes in children with gastroesophageal reflux disease. J. Dent. Child, 64, 1997, 3, s. 201-204.
12. Cheung, A., Zid, Z., Hunt, D. et al.: The potential for dental plaque to protect against erosion using an in vivo-in vitro model – A pilot study. Aust. Dent. J., 50, 2005, 4, s. 228-234.
13. Kilián, J. et al.: Prevence ve stomatologii. 2. vydání, Galén, Praha, 1999, s. 36.
14. Kukletová, M.: Zubní tkáně. In Stejskalová, J. a kol.: Konzervační zubní lékařství. 1. vydání, Galén, Praha, 2003, s. 5-7.
15. Lazarchik, D., Filler, D. S.: Effects of gastroesophageal reflux on the oral cavity. Am. J. Med., 103, 1997, 5A, s. 107S-113S.
16. Lenander-Lumikari, M., Loimaranta, V.: Saliva and dental caries. Adv. Dent. Res., 14, 2000, s. 40-47.
17. Linett, V., Seow, W. K., Connor, F. et al.: Oral health of children with gastroesophageal reflux disease: a controlled study. Aust. Dent. J., 47, 2002, s. 156-162.
18. Lukáš, K., Bureš, J., Drahoňovský, V. et al.: Refluxní choroba jícnu. Standardy České gastroenterologické společnosti dostupné na http://www1.lf1.cuni.cz/~kocna/ginet/ texty/st_rchj.rtf.
19. Lussi, A.: Dental erosion from diagnosis to therapy. Karger, Basel, 2006, Monographs in oral science: 89, 2006, s. 201, 205, 211.
20. Lussi, A.: Erosive tooth wear: Diagnosis, risk factors and prevention. Am. J. Dent., 19, 2006, 6, s. 19-325.
21. Malfertheiner, P., Hallerbäck, B.: Clinical manifestations and complications of gastroesophageal reflux disease (GERD). Int. J. Clinical Praktice, 59, 2005, 3, s. 346-355.
22. Meurman, J. H., Rytömaa, I., Kari, K. et al.: Salivary pH and Glucose after consuming various beverages, including sugar-containing drinks. Caries Res., 21, 1987, s. 353-359.
23. Meurman, J. H., Toskala, J., Nuutinen, P. et al.: Oral and dental manifestations in gastroesophageal reflux disease. Oral Surg. Oral Med. Oral Pathol., 78, 1994, s. 583-589.
24. Moazzez, R., Anggiansah, A., Bartlett. D. W.: The association of acidic reflux above the upper oesophageal sphincter with palatal tooth wear. Caries Res., 39, 2005, s. 475-478.
25. Muñoz, J. V., Herreros, B., Sanchiz, V. et al.: Dental and periodontal lesions in patients with gastro-oesophageal reflux disease. Dig. Liver Dis., 35, 2003, 7, s. 461-467.
26. Napimoga, M. H., Höfling, J. F., Klein, M. I. et al.: Transmission, diversity and virulence factors of Streptococcus mutans genotypes. J. Oral Sci., 47, 2005, 2, s. 59-64.
27. O´Sullivan, E. A., Curzon, M. E. J.: Salivary factors affecting dental erosion in children. Caries Res., 34, 2000, s. 82-87.
28. Shaw, L., O´Sullivan, E. A.: Diagnosis and prevention of dental erosion in children. Int. J. Pediatric Dent., 10, 2000, s. 356-365.
29. Schroeder, P. L., Filler, S. J., Ramirez, B. et al.: Dental erosion and acid reflux disease. Ann. Int. Med., 122, 1995, 11, s. 809-815.
30. Střeštíková, H., Kukletová, M.: Prosthodontic treatment of erosive-abrasive defect of teeth. Scripta Medica, Brno, 76, 2003, 1, s. 29-38.
31. Trojan, S. a kol.: Lékařská fyziologie. Grada Avicenum, Praha, 1994, s. 189.
32. Valena, V., Young, W. G.: Dental erosion patterns from intrinsic acid regurgitation and vomiting. Aust. Dent. J., 47, 2002, 2, s. 106-115.
33. Votava, M., Broukal, Z., Vaněk, J.: Lékařská mikrobiologie pro zubní lékaře. Neptun, Brno, 2007, s. 469-479.
Labels
Maxillofacial surgery Orthodontics Dental medicineArticle was published in
Czech Dental Journal

2010 Issue 5
- What Effect Can Be Expected from Limosilactobacillus reuteri in Mucositis and Peri-Implantitis?
- The Importance of Limosilactobacillus reuteri in Administration to Diabetics with Gingivitis
-
All articles in this issue
- Streptococcus Mutans in Oral Cavity and Tooth Decay Rate
- Microbiological Examination and Determination of the Risk of Caries Development in a Patient with Esophageal Reflux Disease
- Teeth Reconstruction in a Female Patient with Hypodontia and Abnormal Shape Teeth
- Fractures of Orbital Floor (Statistics)
- Czech Dental Journal
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Fractures of Orbital Floor (Statistics)
- Streptococcus Mutans in Oral Cavity and Tooth Decay Rate
- Microbiological Examination and Determination of the Risk of Caries Development in a Patient with Esophageal Reflux Disease
- Teeth Reconstruction in a Female Patient with Hypodontia and Abnormal Shape Teeth
