Hematologické malignity v graviditě
Hematologic malignancies in pregnancy
Objective:
To summarize available data concerning hematologic malignancies in pregnancy.
Desine:
Review article.
Setting:
Department of Obstetrics and Gynekology, Fakulty of Medicine, Masaryk University and University Hospital Brno.
Methods:
Compilation of published data from scientific literature.
Conclusions:
Cancer complicating pregnancy is a rare coexistence. The incidence is approximately 1 in 1,000 pregnancies. The most frequent hematologic malignant tumor is Hodgkin’s lymphoma, leukemia is less frequent and myeloproliferative diseases complicating pregnancy are sporadic coexistence. Symptoms of these deseases are often nonspecific and disguised in pregnancy, then the diagnosis can be late. It is imperative that a multidisciplinary team involving hematooncologist and obstetrician (pediatric specialist) care for patient with hematologic malignancies. Cleary, every patient have to know whole prognosis and all risk factors of treatment. Optimum timing of delivery is after 36th week of pregnancy (when chemotherapy is ended more than two weeks ago). We prefer vaginal delivery to caesarean section.
Key words:
leukemia, lymphoma, myeloproliferative diseases, pregnancy, treatment.
Authors:
R. Doubek 1; D. Petrovová 1; J. Kalvodová 1; M. Doubek 2
Authors‘ workplace:
Gynekologicko-porodnická klinika LF MU a FN, Brno, přednosta prof. MUDr. P. Ventruba, DrSc.
1; Interní hematoonkologická klinika LF MU a FN, Brno, přednosta prof. MUDr. J. Vorlíček, CSc.
2
Published in:
Ceska Gynekol 2009; 74(2): 138-143
Category:
Original Article
Overview
Cíl práce:
Shrnutí současných znalostí týkajících se problematiky hematologických malignit v graviditě.
Typ studie:
Přehledový článek.
Název a sídlo pracoviště:
Gynekologicko-porodnická klinika LF MU a FN Brno.
Metodika:
Zpracování údajů z literatury.
Závěr:
Maligní onemocnění komplikují jedno z tisíce těhotenství. Hematologické malignity tak představují třetí nejčastější onkologickou komplikaci gravidity. Převážná část maligních onemocnění krevních buněk připadá na Hodgkinovu chorobu. Výskyt leukémií je méně častý, raritně se lze setkat s myeloproliferativními nemocemi. Subjektivní příznaky všech těchto nemocí jsou mnohdy nespecifické a mohou být těhotenstvím zastřeny nebo přičítány na vrub probíhající gravidity. To může zapříčinit zpoždění stanovení diagnózy. Léčba každé gravidní pacientky s hematologickou malignitou je přísně individuální a vyžaduje interdisciplinární přístup založený především na spolupráci mezi hematoonkologem a porodníkem (pediatrem). Každá pacientka musí být seznámena s prognózou onemocnění, prognózou gravidity a potenciálními riziky plánované léčby pro plod. Z pohledu zralosti plodu je optimální porod načasovat do období po 34. týdnu gravidity, ideálně pak po 36. týdnu a to alespoň 14 dní po ukončení chemoterapie. Způsob vedení porodu je závislý na porodnické indikaci a aktuálním stavu matky. Preferovaný je vaginální porod.
Klíčová slova:
leukémie, lymfom, myeloproliferativní onemocnění, těhotenství, léčba.
ÚVOD
Maligní onemocnění komplikují přibližně jedno z tisíce těhotenství [11]. Častěji se u těhotných setkáváme s nádory solidními – a to především karcinomem děložního hrdla a karcinomem prsu. Karcinom děložního hrdla zaujímá čtvrtinu až polovinu ze všech malignit diagnostikovaných v graviditě [5, 7], podíl karcinomu prsu je třetinový [7]. Hematologické malignity tak představují třetí nejčastější onkologickou komplikaci gravidity (graf 1). Tvoří asi čtvrtinu ze všech zhoubných nádorů v těhotenství [5]. Převážná část maligních onemocnění krevních buněk připadá na lymfomy (zejména Hodgkinovu chorobu). Incidence leukémií v těhotenství je oproti lymfomům 12–15krát nižší, výskyt myeloproliferativních nemocí je pak zcela raritní.

LEUKÉMIE
Leukémie jsou heterogenní skupinou zhoubných chorob. Ve zdravé ženské populaci je incidence 9,8 případů na 100 000 za rok, přičemž postupně dochází k jejímu lehkému nárůstu. Vznik nemoci souvisí s alterací lymfoidních a myeloidních progenitorových buněk v kostní dřeni. Dochází k maligní transformaci kmenové hematopoetické buňky nebo krevních buněk na určitém stupni diferenciace. Následuje nekontrolovatelný růst nepodléhající autoregulaci a klonální expanze. Onemocnění se dělí na akutní a chronickou formu, další členění je pak založeno na morfologických, cytogenetických, imunofenotypových a molekulárně biologických charakteristikách. Základní skupiny představují akutní myeloidní leukémie (AML), akutní lymfatická leukémie (ALL), chronická myeloidní leukémie (CML), chronická lymfatická leukémie (CLL) či vlasatobuněčná leukémie (hairy-cell leukemia, HCL). Nejčastější leukémií u bělochů je CLL. Pro akutní leukémie je typickým znakem zástava diferenciace na úrovni blastů. Pro chronické leukémie je charakteristická počáteční chronická fáze nemoci (často klinicky němá), která může trvat i několik let (s následnou možností blastického zvratu - CML).
Leukémie v graviditě
Leukémie se v těhotenství vyskytuje s frekvencí 1nemocné na 75 000 – 100 000 porodů [5]. Většina leukémií v graviditě je reprezentována akutními formami choroby. Představují 90 % všech případů tohoto onemocnění u těhotných. Z pohledu postižení jednotlivých buněčných řad se ve dvou třetinách jedná o leukémie myeloidní - 61 % AML , 7 % CML, asi třetina připadá na leukémie lymfoidní – 28 % ALL, 3 % CLL [5]. Z výše uvedeného vyplývá, že pokud se v graviditě setkáme s chronickým typem onemocnění, pak se zpravidla jedná o CML. Naproti tomu v naší běžné populaci je nejčastějším typem CLL zaujímající asi 40% podíl všech onemocnění leukémií. Rozdíl v zastoupení jednotlivých variant nemoci v těhotenství a mimo něj je dán především věkem těhotných žen (graf 2).

Subjektivní příznaky nemoci jsou mnohdy nespecifické a mohou být těhotenstvím zastřeny nebo přičítány na vrub probíhající gravidity (malátnost, únava). Častěji se mohou vyskytovat infekční komplikace – nezřídka s agresivnějším průběhem a horší odpovědí na antibiotickou léčbu (angíny, infekty horních cest dýchacích). Můžeme se setkat také s teplotami nejasného původu a projevy zvýšené krvácivosti, jako jsou ekchymózy, petechie (obr. 1). Vzhledem k závažnosti onemocnění (i při jeho relativně malé četnosti) bychom nikdy neměli zlehčovat potíže pacienta. V případech neustupujících potíží, neúspěšné antibiotické terapie apod. je vhodné provést základní vyšetření krevního obrazu a diferenciální rozpočet leukocytů.
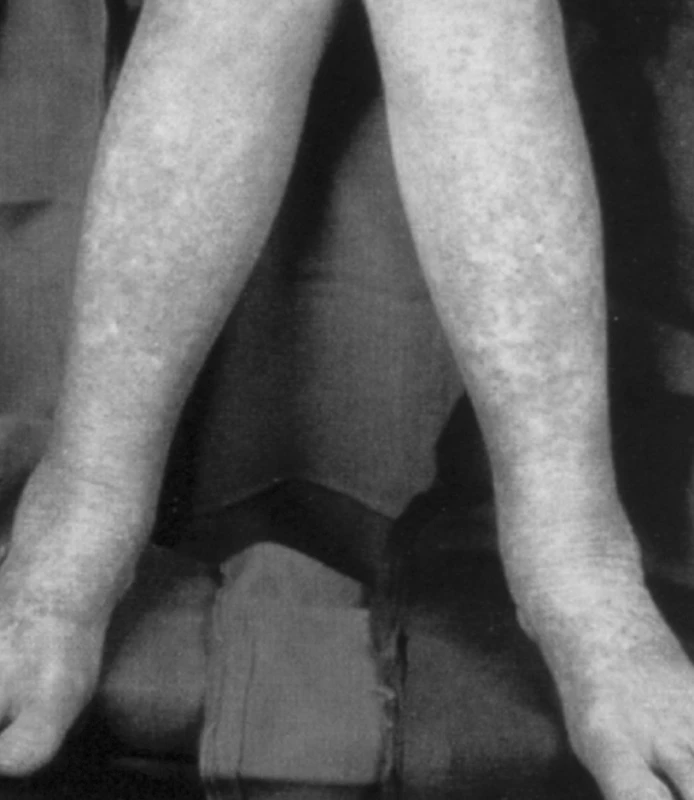
Diagnostika leukémie v graviditě se opírá o vyšetření periferní krve a kostní dřeně. V krevním obraze nacházíme anémii v kombinaci s trombocytopenií. Množství bílých krvinek je variabilní, setkat se můžeme jak s leukopenií, tak s leukocytózou (tab 1). Vzorek k vyšetření kostní dřeně je možné získat trepanobiopsií nebo sternální punkcí. Provádí se specializovaná vyšetření – cytogenetická, molekulárně genetická, cytologie a cytochemie kostní dřeně, histologie kostní dřeně a imunofenotypizace buněk periferní krve a kostní dřeně. Zobrazovací metody (ultrazvuk, magnetická rezonance) slouží především k průkazu splenomegalie (CML, CLL, HCL) nebo postižení uzlin (ALL, CLL).

Léčba leukémie v graviditě
Léčba každé gravidní pacientky s leukémií je přísně individuální a vyžaduje interdisciplinární přístup založený především na spolupráci mezi hematoonkologem a porodníkem. Základní otázky, které je nutno zodpovědět jsou – kdy začít léčit a jak léčit? V rozhodování hrají zásadní roli – typ onemocnění, týden gravidity, možné ohrožení matky oddálením léčby a potenciální ohrožení plodu zvoleným terapeutickým režimem. Každá těhotná žena nemocná leukémií by měla být seznámena s prognózou onemocnění, prognózou gravidity a potenciálními riziky plánované léčby pro plod.
V řadě případů je nutné podání chemoterapie. Bohužel neexistuje cytotoxická látka bez možného vlivu na plod ani zcela bezpečné načasování léčby v těhotenství. Za relativně bezpečné lze považovat antracykliny (využívané při léčbě AML) nebo z dalších skupin cytostatik taxany. Nejrizikovějšími preparáty jsou pak metotrexát a alkylační cytostatika. Největší teratogenní riziko představuje samozřejmě podání chemoterapie v prvním trimestru. Ve vyšších týdnech těhotenství nepříznivý vliv této léčby klesá. Může se projevit intrauterinní růstovou retardací, potratem popř. předčasným porodem. Diskutuje se o podání chemoterapie prepartálně u žen, kde byla akutní leukémie diagnostikována až ve třetím trimestru. Obecně se doporučuje načasování porodu alespoň 2 týdny po ukončení chemoterapie, kdy jsou eliminována negativa této léčby pro novorozence (především ve smyslu jeho leukopenie). Druhou možností je oddálení léčby na dobu po porodu dítěte. V literatuře jsou popsány také případy, kdy podání chemoterapie i těsně před porodem neohrozilo plod [18].
Na rozdíl od chemoterapie přestavuje interferon alfa bezpečnější léčebnou modalitu. Jeho velkou výhodou je, že neprochází přes placentu. Pouze ojediněle se - jako následek užití interferonu - může vyskytnout trombocytopenie plodu. Interferon alfa je v těhotenství lékem volby u vlasatobuněčné leukémie, využívá se i u CML.
Další skupinou farmak využitelných v léčebném režimu leukémií v těhotenství jsou kortikoidy. Je tomu tak v případech CLL a ALL. Podání kortikoidů přináší jen velmi malé riziko vzniku vývojových vad plodu (patro, srdce). Při této léčbě musíme ale počítat také s možností suprese nadledvin a intrauterinní růstové retardace.
V graviditě je možné podávat také imatinib (stabilizující protein Brc/abl v inaktivním stavu). Slouží k terapii CML a ALL. Lze jej využít u CML s progresí i v prvním trimestru. V tomto gestačním období ale zvyšuje riziko potratu. Udává se, že téměř třetina žen užívajících imatinib při početí a v prvním trimestru potratila. Z nefarmakologických postupů lze využít možnosti provedení splenektomie – zcela výjimečně u HCL nebo provedení leukaferézy a trombocytaferézy u AL či CML.
Porod
Z pohledu zralosti plodu je optimální porod načasovat do období po 34. týdnu gravidity, ideálně pak po 36. týdnu a to alespoň 14 dní po ukončení chemoterapie. Toto období vyjadřuje kompromis mezi důrazem kladeným na neprodlužování těhotenství z pohledu možnosti razantnější léčby nemoci u netěhotné a co nejlepší prognózou novorozence při příchodu na svět. Způsob vedení porodu je závislý na porodnické indikaci a aktuálním stavu matky. Preferovaný je vaginální porod. Podmínkou je bezpečná hladina trombocytů – nad 50 x 109/l. Nižší hladiny korigujeme podáním trombokoncentrátu. Po porodu by vždy měla být histologicky vyšetřena placenta na přítomnost možných metastáz. Jejich výskyt v plodovém vejci je udáván přibližně v 19 % případů leukémií a lymfomů v těhotenství [2]. Kojení se většinou nedoporučuje, popř. jen po kratší dobu v případech, které nevyžadují okamžitou poporodní terapii.
Prognóza
Prognóza gravidity je ovlivněna typem onemocnění, jeho závažností, dobou stanovení diagnózy a samozřejmě vlivem použité léčby v závislosti na týdnu těhotenství. Výborné výsledky jsou u chronických forem nemoci, kdy přežívá 96 % matek a 84 % plodů. U akutních leukémií v graviditě je udáváno 50 % předčasných porodů a 7–17% výskyt intrauterinního úmrtí plodu (za hranicí viability) [5]. K přesnějšímu hodnocení však není dostatek informací, což souvisí s malou četností leukémií v těhotenství. Malý počet onemocnění leukémií v graviditě je také důvodem, proč nemůže být nikdo považován za specialistu na tuto problematiku.
LYMFOMY
Lymfomy lze rozdělit na ne-Hodgkinovy lymfomy (NHL) a Hodgkinovu chorobu (Hodgkin disease, HD).
Hodgkinova nemoc se vyskytuje v netěhotné populaci s incidencí 2,4 na 100 000 žen za rok. Maximum výskytu je ve věkové skupině kolem 25,5 roku, druhý nárůst incidence je pak v 6. deceniu. Typická je přítomnost Reedové-Sternbergových (RS) buněk. Jedná se o maligní onemocnění lymfatického systému s potenciálem šířit se lymfogenně a následně hematogenně. Onemocnění dělíme na Hodgkinský lymfom klasický (se čtyřmi podtypy) a Hodgkinův lymfom s nodulární lymfocytární predominancí. Dělení je založeno na histologických a imunofenotypových charakteristikách.
Nehodgkinské lymfomy jsou značně různorodou skupinou chorob. Incidence v evropské populaci je udávána mezi 10 a 20 na 100 000 obyvatel a rok. Je to nejčastější malignita mezi 20-40. rokem života. Nemoc má původ v lymforetikulární tkáni a její podstatou je maligní transformace imunokompetentních buněk (lymfocytů na různých etážích vyzrávání). Na rozdíl od HD se nesetkáme s RS buňkami. Podle histogenetických, imunofenotypových a biologických charakteristik dělíme nemoc na NHL nízkého a vysokého stupně malignity s postižením B nebo T řady a celou řadou podskupin.
Lymfomy v graviditě
Hodgkinova choroba je nejčastějším maligním hematologickým onemocněním těhotných. Setkáváme se s ní v počtu 1 případu na 6000 gravidit (ve věkové skupině do 24 let je dokonce malignitou nejčastější s incidencí blížící se 1 : 1000). Výskyt nehodgkinských lymfomů v těhotenství je méně častý. Tato nemoc je popisována u 1 gravidní ze 125 000.
Nejčastějším klinickým příznakem HD je nebolestivá lymfadenopatie – nejvíce v cervikální oblasti (80 %), dále submandibulárně, axilárně a mediastinálně (obr. 2). Méně často se lze setkat s postižením jater a sleziny, teplotami, únavou a pocením. Podobně jako u leukémií mohou být některé z těchto příznaků graviditou maskovány, popřípadě nemoc může probíhat i zcela asymptomaticky. U NHL dominuje v subjektivním obraze nebolestivé postižení uzlin cervikálních, axilárních, mediastinálních či ingvinálních. Vyskytovat se však mohou i ložiska mimo lymfatické uzliny – v orbitě, kůži, gastrointestinálním traktu. Další příznaky jako teplota, noční pocení, únava apod. jsou vyjádřeny méně.
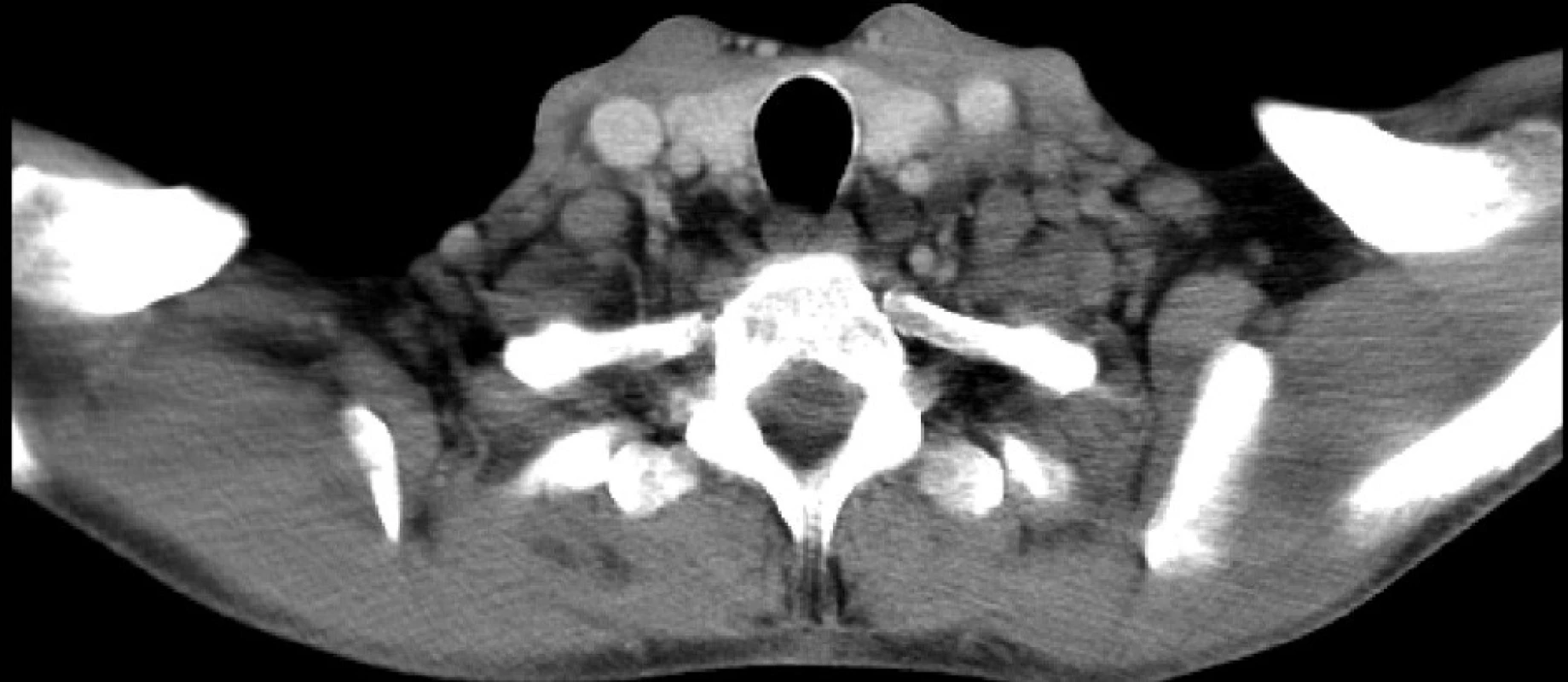
Diagnostika je postavena v obou případech HD i NHL na provedení histologického vyšetření uzlin s dalším podrobnějším došetřením (imunofenotypizace, cytogenetické metody). Ze zobrazovacích metod pomáhajících určit rozsah postižení mají v graviditě hlavní slovo ultrazvuk a magnetická rezonance. Laboratorně se můžeme setkat s atypickými hladinami lymfocytů (ať už leukopenií či lymfocytózou), zvýšenou koncentrací alfa 2 globulinů, fibrinogenu, haptoglobinu atd.
Léčba lymfomů v graviditě
Stejně jako v případě leukémií i u lymfomů v graviditě postupujeme s velkým důrazem na mezioborový přístup a individuální zhodnocení stavu každé pacientky. Základem léčby Hodgkinovy nemoci jsou radioterapie a chemoterapie.
Radioterapie představuje léčbu volby u nemocí nízkého stupně malignity ve stadiu I (popř. II). Využívá se většinou jen ozáření postižené oblasti. Hlavní léčebnou metodou však zůstává chemoterapie. Je podávána buď samostatně (stadia III, IV, prognosticky nepříznivá), nebo v kombinaci s radioterapií (stadia I, II s vyšším rizikem). Ve vyšších týdnech gravidity je možné individuálně u HD provést jen chirurgickou excizi s následným sledováním. Další terapie se odkládá po porodu.
Nejrizikovějším obdobím z pohledu léčby představuje první trimestr. Léčba započatá v této době s sebou přináší riziko vzniku malformací a potratu. Za relativně bezpečnější můžeme považovat 2. a 3. trimestr, což je dáno nejen dokončenou organogenezí plodu, ale i větším prostorem pro odložení léčby do doby po porodu. Nejčastější negativní důsledky radioterapie či chemoterapie ve 2. a 3. trimestru jsou intrauterinní růstová retardace nebo předčasný porod, popř. pancytopenie plodu. Stejné léčebné modality jako v případě Hodgkinovy nemoci jsou využívány i v terapii nehodgkinských lymfomů. Chirurgické metody se vzhledem k diseminovanému charakteru nemoci terapeuticky nevyužívají. U nemocných s časnými formami onemocnění je dostačující radioterapie (navozuje dlouhodobou remisi až ve 4/5 případů). Na rozdíl od HD se vždy ozařují i okolní lymfatické regiony (extended field). Ve většině případů NHL je léčba postavena na aplikaci kombinované chemoterapie se všemi omezeními a riziky, které již byly zmíněny. Chemoterapie může být u některých typů NHL (folikulární) kombinována s interferonem alfa. Nově se používají monoklonální protilátky anti CD20. Jejich použití je založeno na expresi znaku CD20 na řadě B-lymfocytů. Protilátka sama navozuje apoptózu buněk a dále potencuje imunitní reakci likvidující maligní buňky.
Porod
U nemocné lymfomem v těhotenství je ideální ukončení gravidity také po 36. týdnu gravidity (nebo alespoň po 34. týdnu). S nutností časnějšího plánování porodu se ale díky tomu, že většina nemocných HD v těhotenství je ve stadiích I a II, často nesetkáváme. Pokud bylo využito chemoterapie, pak platí stejné doporučení k naplánování porodu – nejméně 2 týdny po jejím ukončení. Způsob vedení porodu je opět závislý na porodnické indikaci a aktuálním stavu matky, který většinou umožní vaginální porod. Histologické vyšetření placenty se pro riziko metastáz provádí vždy. Kojení – především při onemocnění HD – je možné (s případným časovým omezením při plánované včasné poporodní léčbě). V případě HD by měla být další gravidita plánována nejdříve za 2 roky – pro riziko relapsu po primární léčbě.
Prognóza
Více než 2/3 žen s Hodgkinovou nemocí v graviditě jsou ve stadiu I a II. Z tohoto faktu rezultují velmi dobré výsledky dlouhodobého přežívání. Až 83 % těhotných s HD přežívá 8 let [12]. Vlastní průběh nemoci nebývá v případě HD graviditou ovlivněn, naopak vliv nemoci na graviditu není zcela jasně a detailně prozkoumán. Závažnější situace nastává v případě nehodgkinských lymfomů, které mají obecně špatnou prognózu. Navíc se u většiny těhotných setkáváme s agresivními formami nemoci ve vyšších stadiích. Pokud je NHL diagnostikován v 1. trimestru, doporučujeme umělé přerušení gravidity – vzhledem k závažnosti diagnózy, prognóze a pro nemožnost oddálení léčby s vysokým rizikem malformací (až 1/5 případů).
MYELOPROLIFERATIVNÍ NEMOCI
Myeloproliferativní nemoci jsou tvořeny několika nozologickými jednotkami, které jsou ne zcela přesně ohraničené (chronická myeloidní leukémie resp. její varianty, polycythaemia vera, esenciální trombocytémie, primární myelofibróza). Podkladem je transformace kmenové hematopoetické buňky se vznikem patologického klonu. Myeloproliferativní nemoci se vyskytují s incidencí 1-3 případů na 100 000 obyvatel. Zpočátku vyjádřená hypercelularita kostní dřeně je postupně vystřídána její fibrotizací a zesílením extramedulární krvetvorby. Tato vede k hepatosplenomegalii. Základem léčby a jedinou kurativní metdou je alogenní transplantace kostní dřeně nebo kmenových buněk. Pokud jí nelze využít, je cílem terapie cytoredukce. Výskyt myeloproliferativních onemocnění v těhotenství je raritní. To je také důvodem, proč neexistuje jednoznačný algoritmus pro tyto nemoci v graviditě.
Polycythaemia vera v graviditě
Polycythaemia vera je onemocnění typické klonální expanzí pluripotentní kmenové buňky do všech řad – s převahou erytrocytární. Klinicky lze pozorovat hubnutí, noční pocení, překrvení spojivek s pálením očí a svědění kůže. Objevuje se i pletorické zabarvení kůže, častější je výskyt trávicích obtíží, zvýšení krevního tlaku a zmíněná hepatosplenomegalie. Pro diagnózu je rozhodující zvýšení počtu červených krvinek, hemoglobinu i hematokritu se současnou leukocytózou, popř. i trombocytózou (v pozdějším stadiu medulární fibrotizace je přítomná anémie). Saturace krve kyslíkem zůstává v normě. Z ostatních laboratorní změn stojí za zmínku stabilně snížená hladina erytropoetinu a zvýšení hladiny kyseliny močové. Dále je provedeno taktéž vyšetření kostní dřeně. Zpočátku je dřeň hypercelulární s převahou erytropoezy, postupně dochází k její fibrotizaci. Nejvyšší riziko komplikací v graviditě představují trombembolické komplikace při polyglobulii. Nejjednodušší léčbou je venepunkce. Při ní se opakovaně odebírá asi 350–500ml krve s náhradou fyziologickým roztokem. Očekávaným výsledkem je pokles hematokritu. Moderněji se využívá erytrocytaferéza s navrácením plazmy. Při malém efektu této terapie lze v graviditě využít i interferonu alfa. Standardní součástí léčby je vždy podání antiagregancií – kyseliny acetylsalicylové (při hladinách trombocytů nad 400), tuto léčbu je možné doplnit podáním nízkomolekulárních heparinů (vždy při trombembolických komplikacích).
V souvislosti s výskytem polycythaemia vera v graviditě je popisováno 31 % ukončení gravidity spontánním abortem v prvním trimestru, těhotenství končící porodem živého dítěte tvoří 60 % [4].
Esenciální trombocytémie v graviditě
Esenciální trombocytémie je nemoc, pro niž je typické zvýšení hladiny krevních destiček. Vyšší počet trombocytů není reaktivní ani nesouvisí s jinou myeloproliferativní chorobou. Destičky mají porušenou funkci, což má za následek riziko jak trombotických, tak krvácivých komplikací. Krvácivé komplikace jsou méně časté, bývají více při hladinách destiček nad 1000 x 109/l. Ostatní příznaky zahrnují cefaleu, parestezie, synkopy, poruchu zraku apod. Po čase dochází k hepatospelomegalii. Laboratorně nacházíme zvýšenou hladinu trombocytů (nad 600 x 109/l), často bývá vyšší hladina leukocytů, elevována je hladina kyseliny močové. Kostní dřeň je hypercelulární s převahou megakaryocytů. Cílem léčby je trvale snížit hladinu destiček směrem k normě. Nejjednodušší terapie spočívá v podávání antiagregancií – tedy kyseliny acetylsalicylové. Tato léčba je prevencí trombotických komplikací, ale neřeší vlastní trombocytémii. U rizikovějších pacientů (trombóza v anamnéze) je nutná nejen antikoagulační léčba, ale i podání preparátů ke snížení počtu destiček. Relativně bezpečným preparátem je interferon alfa. Ještě efektivnější je pak léčba anagrelidem. Jde o selektivní preparát redukující velikost a ploiditu megakaryocytů (ve vyšší dávce působí i antiagregačně). Anagrelid je možné v těhotenství využít tam, kde je intolerance interferonu. Byly popsány jednotlivé případy těhotných s touto léčbou, jejichž gravidita končila úspěšně – tedy porozením zdravého dítěte [3].
Spontánní abort v prvním trimestru se vyskytuje ve 22% případů esenciální trombocytémie u těhotných, podíl živě rozených dětí je obdobný jako v případě onemocnění polycytémie vera – tvoří 58 %.
V případě myeloproliferativních nemocí je porod možno vést vaginální cestou – ideálně po dosažení zralosti plodu.
ZÁVĚR
Péče o gravidnípacientku s hematoonkologickým onemocněním je mezioborová a zohledňuje nejen stav těhotné ženy, ale ve vyšších týdnech gravidity i stav a prognózu plodu. Individuálně přistupujeme jak k vlastní volbě terapeutického režimu, tak i k načasování a způsobu vedení porodu. Tento přístup si vyžaduje fakt, že v případě hematologických malignit se jedná o značně různorodou skupinu nemocí a koincidence s těhotenstvím je navíc vzácná. Proto by byla ideální centralizace těchto případů do zařízení s perinatologickým centrem i hematoonkologickou klinikou.
MUDr. Radan Doubek
Gynekologicko-porodnická klinika
LF MU a FN Brno
Jihlavská 20
625 00 Brno
e-mail: radandoubek@seznam.cz
Sources
1. Cardonick, E., Iacobucci, A. Use of chemotherapy during human pregnancy. Lancet Oncol, 2004, 5, p. 283-291.
2. Dildy, GA., Moise, KJ., Carpenter, RJ., et al. Maternal malignance metastatic to the products of conception: a review. Obstet Gynecol Surv, 1989, 44, p. 535-540.
3. Doubek, M., Brychtova, Y., Doubek, R., et al. Anagrelide therapy in pregnancy: repost of a case of essential thrombocythemia. Ann Hematol, 2004, 83, p. 726-727.
4. Griesshammer, M., Struve, S., Harrison, CM. Essential thrombocythemia/polycythemia vera and pregnancy: the need for an observational study in Europe. Semin Tromb Hemost, 2006, 32, p. 422-429.
5. Hurley, TJ., McKinnell, JV., Irani, MS. Hematologic malignancies in pregnancy. Obstet Gynecol Clin N Am, 2005, 32, p. 595-614.
6. Hurley, TJ., Montgomery, R., Waldron, J., et al. Fatal course of malignant non-Hodgkin’s lymphoma of T-cell type during pregnancy with metastasis to the fetus. J Matern Fetal Med, 1994, 3, p. 69-74.
7. Kaiser, HE., Nawab, E., Nasir, A., et al. Neoplasms during the progression of pregnancy. In Vivo, 2000, 14, 1, p. 277-285.
8. Kantarjian, HM., Talpaz, M., Gildes, F., et al. New insights into the pathopysiology of chronic myeloid leukemia and imatinib resistence. Ann Intern Med, 2003, 145, p. 913-923.
9. Kopeć, I., Debski, R., Samsel, M., et al. Hairy cell leukemia in pregnancy. Ginekol Pol 2005, 76, p. 898-901.
10. Maruko, K., Maeda, T., Kamitomo, M., et al. Transplacental transmission of maternal B-cell lymphoma. Am J Obstet Gynecol, 2004, 191, p. 380-381.
11. Pavlidis, NA. Coexistence of pregnancy and malignancy. Oncologist, 2002, 7, p. 279-287.
12. Peleg, D., Ben-Ami, M. Lymphoma and leukemia complicating pregnancy. Obstet Gynecol Clin North Am, 1998, 25, p. 365-383.
13. Pereg, D., Koren, G., Lishner, M. The treatment of Hodgkin’s and non-Hodgkin’s lymphoma in pregnancy. Haematologica, 2007, 92, p. 1230-1237.
14. Pohlman, B., Macklis, RM. Lymphoma and pregnancy. Semin Oncol, 2000, 27, p. 657-666.
15. Riccioni, R., Galimberti, S., Petrini, M. Hairy cell leukemia. Curr Treat Options Oncol, 2007, 8, p. 129-134.
16. Shaphira, T., Pereg, D., Lishner, M. How I treat acute and chronic leukemia in pregnancy. Blood Rev, 2008, 22, p. 247-259.
17. Stiles, GM., Stanco, LM., Saven, A., et al. Splenectomy for hairy cell leukemia in pregnancy. J Perinatol, 1998, 18, p. 200-201.
18. Yucebilgin, MS., Cagirgan, S., Donmez, A., et al. Acute myeloblastic leukemia in pregnancy: a case report and review of the literature. Eur J Gynaecol Oncol, 2004, 25, 1, p. 126-128.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2009 Issue 2
-
All articles in this issue
- Randomizované srovnání dlouhého GnRH agonistického vs. GnRH antagonistického protokolu – hormonální parametry a charakteristiky cyklů – pilotní studie
- Hladiny PAPP-A ve folikulární tekutině a krvi pacientek stimulovaných k IVF s hrozícím ovariálním hyperstimulačním syndromem
- Heat shock protein 70 v plodové vodě u pacientek s předčasným odtokem plodové vody
- Interrupční chování a postoje k umělému přerušení těhotenství u českých žen: Výsledky národního výzkumu
- Vývoj vrozených vývojových vad u dvojčat v ČR v mezinárodním srovnání
- Srovnávací analýza ztráty heterozygozity (LOH) a profilu exprese v normální tkáni, DCIS a v tkáni invazivního karcinomu prsu
- Nádorová onemocnění u dětí narozených s vrozenou vadou Aktuální data v České republice
- Dlouhodobá úspěšnost tahuprosté vaginální pásky při léčbě stresové inkontinence moči
- Termoablace endometria systémem Thermachoice – 10 let zkušeností
- Sexuální funkce po laparoskopicky asistované vaginální hysterektomii (LAVH) a totální laparoskopické hysterektomii (TLH) u předoperačně asymptomatických žen
- Hematologické malignity v graviditě
- Surogátní mateřství – literární názory a praxe
- Syndrom ovariálního zbytku
- Fitz-Hugh-Curtis syndróm: kazuistika
- Czech Gynaecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Sexuální funkce po laparoskopicky asistované vaginální hysterektomii (LAVH) a totální laparoskopické hysterektomii (TLH) u předoperačně asymptomatických žen
- Termoablace endometria systémem Thermachoice – 10 let zkušeností
- Fitz-Hugh-Curtis syndróm: kazuistika
- Syndrom ovariálního zbytku
