Rizikové faktory v anamnéze těhotných žen při prenatálním screeningu vrozených srdečních vad
Risk factors in the medical history of pregnant women undergoing congenital heart defect prenatal screening
Aims:
Evaluation of the congenital heart defects (CHDs) incidence and their prenatal detection rate in the Moravian-Silesian region. Presentation of fetal echocardiography as a screening method. Investigation of the relationship between risk factor and congenital heart defects.
Methodology:
Long-term study between 1999–2009. Overall evaluation of CHDs incidence and their follow-up and analysis of their link to possible risk factors. The data were collected from medical notes of the gynecologist and pediatric cardiologist in the region. Fetal echocardiography was performed as a primary screening during the second term of pregnancy. A number of 22 43 pregnant women were included in the study. When any pregnancy pathology detected, more detailed examination followed (extracardial diseases, chromosomal aberrations).
Results:
In the observed period, there were a total of 453 significant CHD (3.55/1000 births). In prenatal phase 208 CHDs (45.9%) were diagnosed. At least one risk factor was mentioned in 15.9 % of the screened families. When compared with the group without and with any risk factor, the difference is significant (χ2=7.28, p<0.0001). Mothers younger than 35 were compared with those aged 35 and older and the difference in values was not significant. However, generally, the probability of CHDs grow with age (GLM, z=2.468, p=0.013).
Conclusions:
Prenatal detection of CHDs has the highest success rate as a rutine screening method during the second trimester of pregnancy. We confirmed the existence of a higher occurrence of the CHD in the group of pregnant women with a history of risk factors in comparison with the group without such a history. The risk families should be offered a detailed examination by paediatric cardiologist skilled in fetal echocardiography. Heart defects are the most common morphology anomalies, mostly occuring as an isolated issue.
Key words:
congenital heart defect, fetal echocardiography, risk factor.
Authors:
J. Pavlíček 1; T. Gruszka 1; L. Jabůrek 2
Authors‘ workplace:
Oddělení dětské a prenatální kardiologie FN Ostrava, primář MUDr. T. Gruszka
1; Porodnicko-gynekologická klinika FN a LF UP Olomouc, přednosta prof. MUDr. R. Pilka, Ph. D.
2
Published in:
Ceska Gynekol 2011; 76(5): 386-392
Overview
Cíl:
Hodnocení výskytu významných vrozených srdečních vad (VSV) v regionu Moravskoslezského (MS) kraje, úspěšnost jejich prenatální detekce a představení fetální echokardiografie jako screeningového vyšetření. Zkoumání výskytu rizikových faktorů v anamnéze a jejich vliv na vznik srdeční vady.
Metodika:
Plánovaná studie v letech 1999–2009, celkové hodnocení výskytu VSV ve sledovaném regionu, data využita z gynekologicko-porodnických pracovišť a ambulancí dětských kardiologií. Fetální echokardiografie jako plánovaný screening ve II. trimestru gravidity. Soubor z vlastního pracoviště, hodnocení 22 743 těhotenství. Sledování a rozbor rizikových faktorů pro vznik VSV (rizikové faktory matky, rodiny a plodu). Celkové došetření při záchytu srdeční vady (extrakardiální anomálie, genetika).
Výsledky:
Ve sledovaném období se v regionu MS kraje vyskytlo 453 významných VSV (3,55/1000 porodů). Prenatálně identifikováno bylo 208 VSV (45,9 %). Rizikový faktor v anamnéze uvedlo 15,9 % rodin. Rozdíl výskytu VSV ve skupině s rizikovými faktory proti skupině bez zátěže byl statisticky významný (χ2=7,28, p<0,0001). Věková hranice 35 let se ukázala pro výskyt VSV jako nevýznamná, celkově ale s věkem pravděpodobnost výskytu VSV rostla (GLM, z=2,468, p=0,013).
Závěry:
Prenatální detekce vrozených srdečních vad má největší význam jako plánované screeningové vyšetření, nejčastěji ve II. trimestru gravidity. Rizikové faktory v anamnéze matky zvyšují pravděpodobnost výskytu VSV a rizikové rodině je možné nabídnou vyšetření specialistou na fetální echokardiografii. Srdeční vady jsou nejčastější morfologické anomálie v populaci a vyskytují se většinou v izolované formě.
Klíčová slova:
fetální echokardiografie, rizikový faktor, screening, vrozená srdeční vada.
ÚVOD
Ultrazvukové vyšetření srdce plodu (fetální echokardiografie) je v rámci screeningového vyšetření provedeno nejčastěji ve druhém trimestru gravidity gynekologem nebo dětským kardiologem. Základní morfologii a funkci srdce může zhodnotit gynekolog v rámci péče o rodičku při pravidelných kontrolách nebo je těhotná žena odeslána na pracoviště, které provádí větší počty vyšetření a na fetální echokardiografii se specializuje. Při prenatálním záchytu vrozené srdeční vady (VSV) je těhotná odeslána na specializované pracoviště, většinou do ambulance dětské kardiologie, kde dojde k definitivní diagnostice a přesnému popisu vady. Podle nálezů jsou došetřeny extrakardiální a genetické anomálie. Rodiče jsou informováni a rozhodují o dalším průběhu gravidity. Cílem je plánování porodu patologického novorozence na adekvátním pracovišti. Část partnerů se rozhoduje pro ukončení gravidity. Prenatální diagnostika se v České republice neustále vyvíjí a úroveň detekce vrozených srdečních vad se stále zlepšuje. Při vyšetření plodu zkušeným lékařem přináší fetální echokardiografie vynikající výsledky. Porod a zabezpečení patologického novorozence na specializovaném pracovišti výrazně zlepšují prognózu dítěte, snižují výskyt komplikací a zvyšují budoucí kvalitu života.
Vrozené srdeční vady jsou nejčastější kongenitální defekty v lidské populaci. Příčina vzniku VSV je většinou nejasná a zůstáváme u pojmenování multifaktoriální etiologie. Možné jsou negativní vlivy prostředí u disponovaných jedinců, interakce a kumulativní efekt genetických a environmentálních rizikových faktorů, vedoucí ke vzniku choroby. Možnosti lékařské genetiky se neustále rozvíjí, studována je nyní řada genů, které mohou způsobit ne-syndromologické postižení srdce. Nejčastější rozmezí výskytu VSV v populaci je udáváno na 6–8 na 1000 živě narozených [45]. Přes multifaktoriální etiologii srdečních vad a nutnost plošného screeningu existuje určitá skupina rizikových faktorů, u kterých by mělo být indikováno prenatální echokardiografické vyšetření. Na uvedeném souboru těhotných žen je popsán výskyt těchto rizikových faktorů v anamnéze a jejich statistická významnost. Byly stanoveny dvě základní hypotézy, které byly následně testovány. Hypotéza 1: existuje závislost mezi výskytem VSV ve skupině těhotných s rizikovými faktory v anamnéze a skupinou těhotných s anamnézou bez zátěže. Hypotéza 2: existuje závislost mezi výskytem VSV u matek do 35 let a nad 35 let věku.
SOUBOR DAT A METODIKA
Sledovanou oblastí je Moravskoslezský kraj, data jsou hodnocena v dlouhodobé studii v letech 1999–2009. Průměrná porodnost byla 11 869 živě narozených novorozenců ročně. Autoři představují vlastní soubor 26 286 fetálních echokardiografií provedených u 22 743 těhotných žen (graf 1). Celkem 85 % žen bylo odesláno k vyšetření jako primární screening, 15 % jako konzilium při vyjádření podezření na patologii na jiném pracovišti. Určitý rizikový faktor se vyskytl v anamnéze u 3627 vyšetřovaných žen. Do hodnocení výskytu vad byly zařazeny všechny prenatální patologie a postnatálně kritické a významné VSV (operované do roku věku dítěte). V prenatální části jsou dále využity nálezy genetiků (zařazeno 917 plodů) s hodnocením výskytu chromozomálních aberací a výsledků autopsie při ukončení gravidity.

Fetální echokardiografie je provedena jako primární screening na pracovišti gynekologa nebo dětského kardiologa ideálně mezi 19. až 21. týdnem gravidity, kdy je srdce při transabdominálním vyšetření dobře přehledné. Vyšetření v nižších týdnech těhotenství je možné, včetně vaginálního přístupu, ale přináší určité množství kontrol a často je definitivní závěr stanoven až ve 20. týdnu. Srdce je hodnoceno ve standardních doporučených projekcích, dle echogenity nebo při podezření na vadu i v projekcích méně častých. Ideální je sekvenční hodnocení v rovinách podobných jako u dětí (čtyřdutinová projekce, pětidutinová projekce, zobrazení výtokových traktů a křížení velkých cév, krátká srdeční osa, rovina aortálního oblouku). Vyšetření doplňujeme dopplerovskými technikami. Při běžném screeningu postačí správné segmentární vyšetření a při podezření na morfologickou patologii odeslat těhotnou ženu na specializované vyšetření. Při podrobnějším došetření doplníme funkční hodnocení fetoplacentární cirkulace. Prenatálně lze diagnostikovat poruchy srdečního rytmu a například hodnotit dobu atrioventrikulárního převodu.
Při odebírání anamnézy těhotné ženy lze vyčlenit některé anamnestické skupiny [31], u kterých je možné předpokládat zvýšenou pozornost, indikovat prenatální vyšetření plodu a sledování gravidity. Patří sem rizikové faktory matky (chronické nebo infekční onemocnění, expozice rizikovým látkám – teratogeny, alkohol, léky, věk nad 35 let, základní revmatologické onemocnění, vrozená srdeční vada), rizikové faktory rodiny (VSV v rodinné anamnéze prvního nebo druhého stupně, opakované spontánní aborty, genetická patologie) a rizikové faktory plodu (extrakardiální nebo chromozomální patologie, zvýšená nuchální translucence, patologie nosních kůstek, ageneze jedné umbilikální arterie, patologický biochemický screening). Anamnéza je v úvodu prenatálního vyšetření odebírána komplexně se zaměřením na studované rizikové faktory, řada žen přichází k cílenému vyšetření s anamnestickým faktorem zhodnoceným již na jiném pracovišti.
Rizikové faktory byly, vzhledem k uváděným anamnézám a z praktických důvodů, roztříděny do 7 skupin (1. věk matky nad 35 let, 2. zátěž matky – základní onemocnění, trvalá medikace, vystavení toxinům, 3. jiná zátěž – opakované aborty, patologie prenatálního screeningu, jiné vrozené vývojové vady plodu, 4. in vitro fertilizace a embryotransfer byly zařazeny dodatečně, vzhledem k možnému zvýšenému výskytu VSV, 5. vrozené srdeční vady v rodinné anamnéze prvního stupně, 6. vrozené srdeční vady v rodinné anamnéze druhého stupně, 7. genetická zátěž v rodině). Největší zastoupení měl věk matky nad 35 let a při pochybnosti o jeho významu byl hodnocen i zvlášť.
Získaná data byla uložena a zpracována v programu Microsoft Excel 2003. Pro popisnou statistiku a základní grafy byl použit také MS Excel. Pro další analýzy byl použit statistický software R (R Development Core Team 2010) [34]. Základní hodnocení bylo zpracováno v tabulkách s uváděním procentuálního zastoupení. Soubory rizikových gravidit byly porovnány χ2 testem, pro možnost a eliminaci chyby při nižší četnosti frekvencí byla doplněna Yatesova korekce (standardně doporučována u čtyřpolních tabulek). Hodnocení závislosti bylo prováděno pomocí zobecněných lineárních modelů GLM pro binomická data s logitovou link funkcí. Hladina významnosti α pro pravděpodobnost chyby prvního druhu (p neboli p-value) byla u všech testů zvolena na úrovni 0,05.
VÝSLEDKY
Celkově se v regionu Moravskoslezského kraje v letech 1999–2009 vyskytlo 453 (3,55 na 1000 porodů) prenatálně poznaných nebo postnatálně významných (operovaných do roku věku) vrozených srdečních vad (tab. 1). Z výše uvedených vrozených srdečních vad bylo prenatálně diagnostikováno 208 VSV (45,9 %), 245 (54,1 %) VSV poznáno nebylo a „uniklo“ při screeningu. Srdeční vada se objevila většinou jako izolované postižení. Při hodnocení souboru postižených plodů byla VSV v izolované formě diagnostikována v 15,8 %, ve spojení s chromozomální nebo jinou morfologickou patologií v 7,0 % (VSV ve spojení s chromozomální aberací 3,4 %, VSV ve spojení s jinou extrakardiální patologií 3,6 %), u 77,2 % plodů byla popsána pouze extrakardiální anomálie. U srdečních vad mělo pouze chromozomální aberaci 1,5 % fétů.
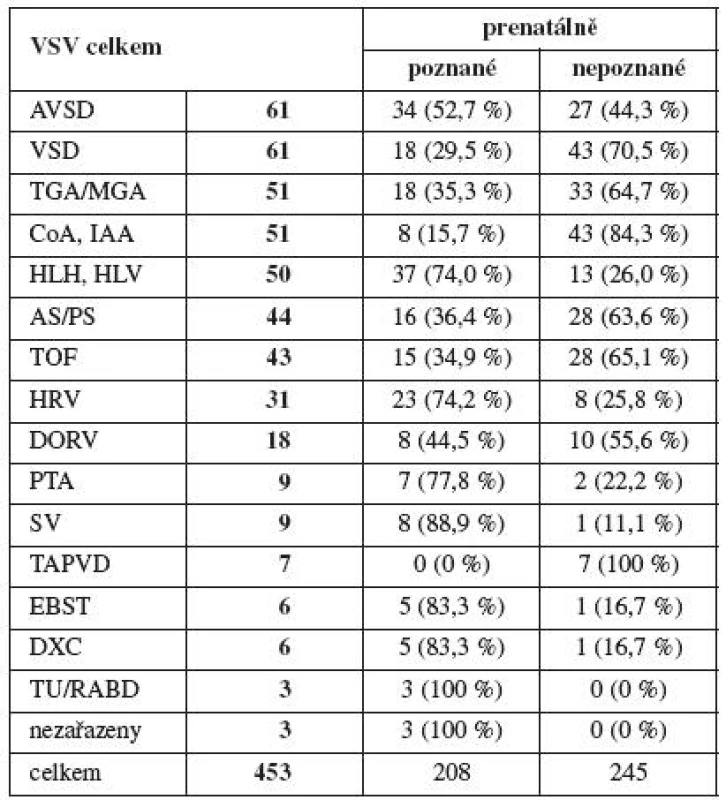
Pro navržené klinické hypotézy byly pro vlastní testování stanoveny dvě nulové hypotézy, které jsou již vázány ke konkrétním testům. H01: neexistuje závislost mezi výskytem VSV ve skupině těhotných s rizikovými faktory v anamnéze a skupinou těhotných s anamnézou bez zátěže. H02: neexistuje závislost mezi výskytem VSV u matek do 35 let a nad 35 let věku. Určitý rizikový faktor uvedlo 3627 (15,9 %) rodin (tab. 2). Vyřazeny byly matky s revmatologickou anamnézou a matky s pozitivním biochemickým screeningem s doplněním amniocentézy, která byla normální. Výsledný hodnocený soubor rizikových faktorů obsahuje 3324 těhotenství s výsledkem 44 (1,3 %) VSV (tab. 3). Při porovnání se skupinou bez RF (19 419 gravidit) a výskytem 127 VSV (0,7 %) je rozdíl významný (χ2=7,28, p<0,0001). První nulovou hypotézu, že neexistuje závislost mezi výskytem VSV mezi skupinou s rizikovými faktory a skupinou bez zátěže, zamítáme.
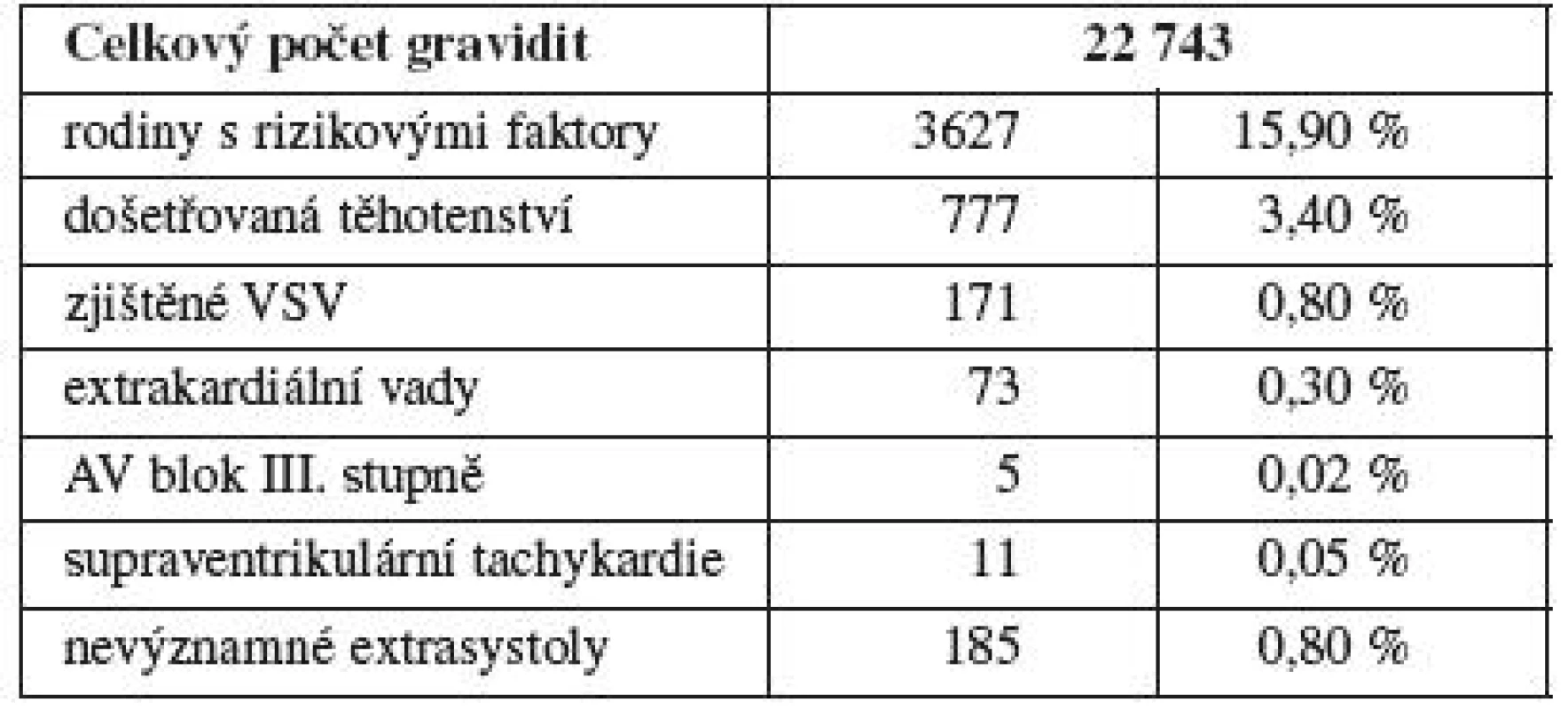
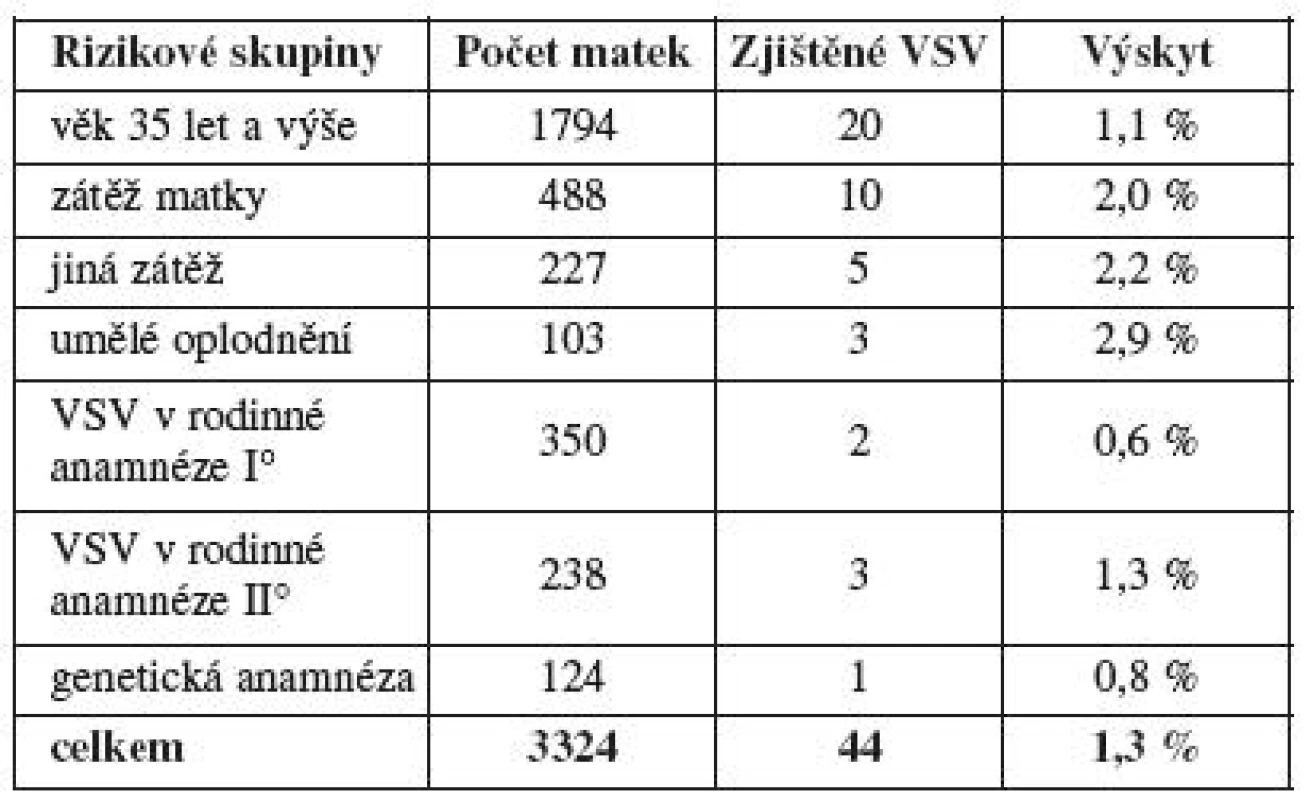
Z rizikových faktorů měl největší zastoupení věk matky nad 35 let a byl hodnocen zvlášť. Do této skupiny byly zařazeny dostupné údaje z MS kraje a bylo zde hodnoceno 22 678 gravidit s výsledkem zjištění 196 vad (tab. 4). Porovnány jsou finálně matky do 34 let (n=20 884, 176 VSV, 0,8 %) k matkám 35 let a výše (n=1794, 20 VSV, 1,1 %), i přes minimální vzestup výskytu VSV byl hodnocený rozdíl nevýznamný (χ2=1,1, p>0,2). Druhou nulovou hypotézu, že neexistuje závislost mezi výskytem VSV u matek do 35 let věku a nad 35 let věku, nelze zamítnout. Přestože neprokazujeme závislost výskytu VSV na věkové hranici matky 35 let, je průkazná pozitivní závislost výskytu VSV na věku (s věkem pravděpodobnost výskytu VSV roste, GLM, z-value = 2,468, p value = 0,013) při použití zobecněného lineárního modelu pro binomická data (graf 2).
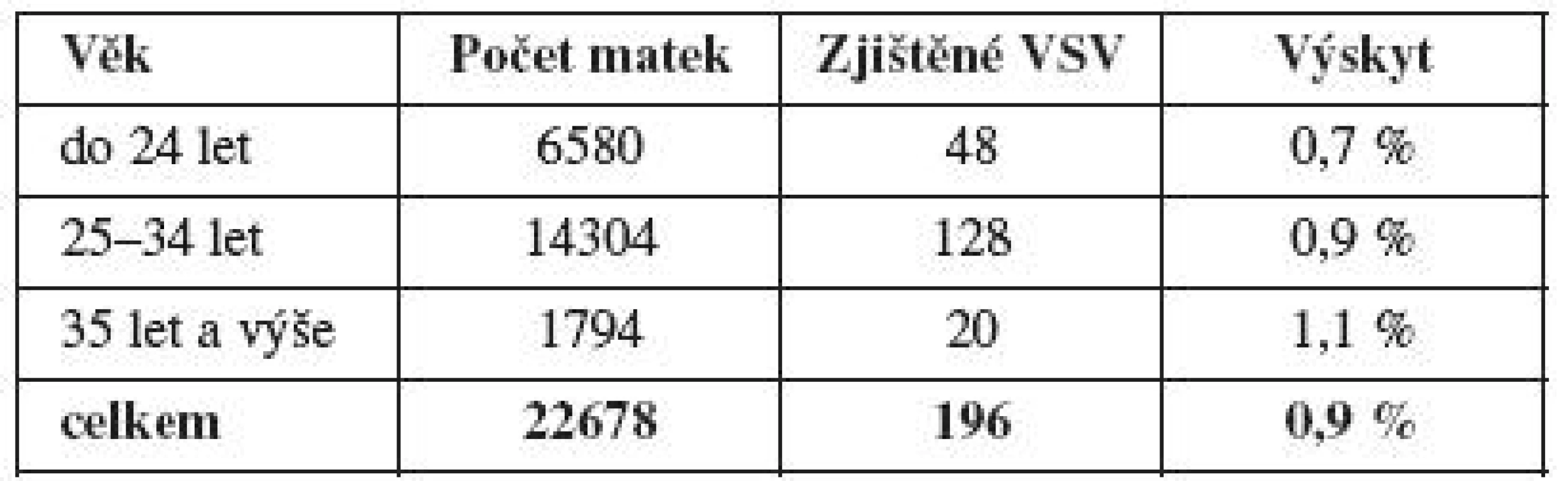

Pokud u původního souboru z tabulky 2 odstraníme první skupinu věkového rizika a porovnáme ostatní RF (n=1530, 24 VSV, 1,6 %) s původní nerizikovou skupinou (n=19 419, 127 VSV, 0,7 %), zůstává platná jejich významnost (χ2=15,47, p<0,0001). Při závěrečném hodnocení je nutno zdůraznit vyšší výskyt VSV ve skupině „umělé oplodnění“ (n=103, 3 VSV, 2,9 %), rozdíl je oproti skupině bez rizika (n=19 419, 127 VSV, 0,7 %) významný (χ2=4,89, p=0,027).
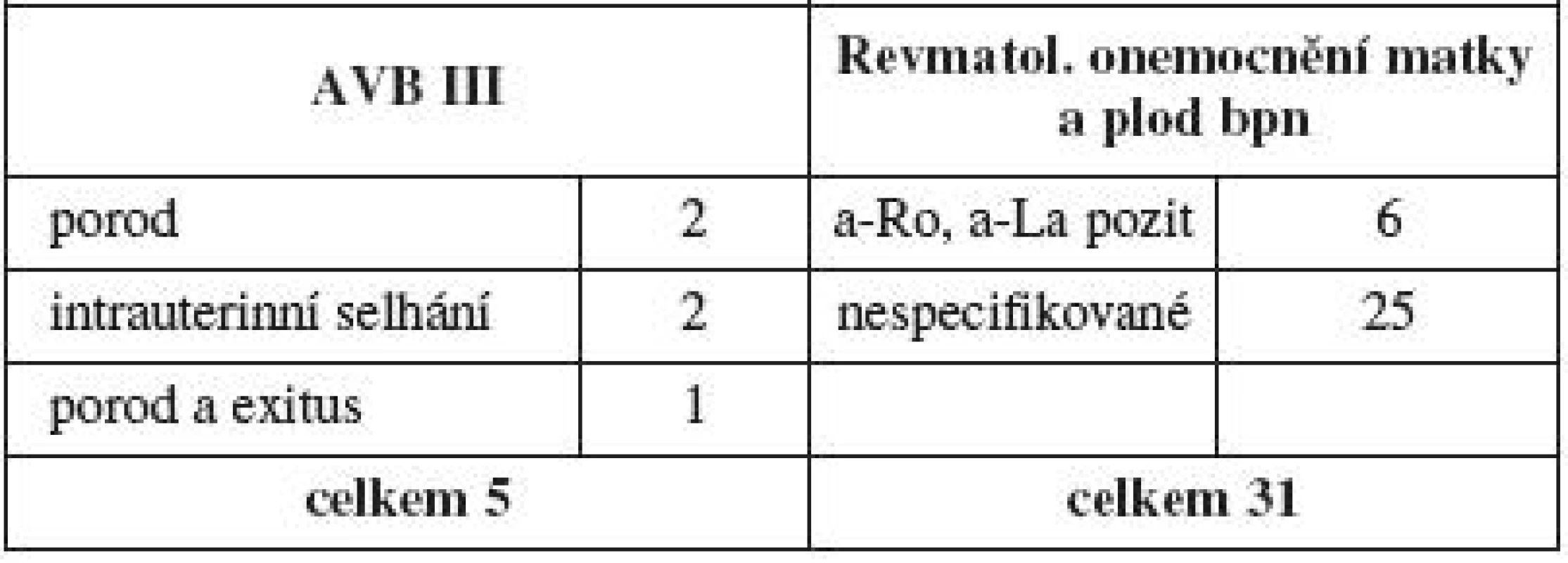
Matky s kolagenózou byly ponechány mimo hodnocení rizikových faktorů. Sledována byla těhotenství jak s plodem postiženým dysrytmií, tak i těhotenství se známou anamnézou onemocnění matky a pozitivitou nebo negativitou protilátek. V jedenáctileté studii se vyskytlo 5 kompletních AV bloků a všechny matky měly při došetření pozitivní rizikové protilátky, a naopak 31 gravidit u matek s typickým onemocněním bylo jen sledováno bez vývoje poruchy rytmu (tab. 5).
DISKUSE
Fetální echokardiografie, dnes již jako samostatný interdisciplinární obor, se neustále vyvíjí. Incidence vrozených srdečních vad je většinou uváděna v rozmezí 6 až 18 na 1000 [4, 5, 39], analýza incidence VSV v České republice 1994–2008 uvádí 12,8/1000 živě narozených, srdeční vady jsou nejčastější morfologické patologie v lidské populaci, jejich podíl na všech vrozených malformacích je 40 % [40]. Výskyt prenatálně diagnostikovaných a postnatálně významných VSV v Moravskoslezském kraji nyní kolísá okolo 50 za rok, s incidencí 3,55 na 1000 porodů. Jako nejčastější patologie se vyskytuje defekt komorového septa a defekt atrioventrikulárního septa. Nejčastější kritickou VSV byla transpozice velkých cév a koarktace aorty. Téměř stejnou četnost měl syndrom hypoplazie levé komory nebo komplexní vady s malou levou komorou. Jako méně časté srdeční vady byly identifikovány perzistující arteriální truncus a společná komora. Přes rychlý rozvoj genetiky a studování nových genů [45] zatím zůstává etiologie vzniku VSV pojmenována jako multifaktoriální a budeme očekávat další pokroky v genetické diagnostice.
Spektrum prenatálně diagnostikovaných VSV se významně liší od postnatálního, s dominancí závažných komplexních anomálií u plodů [41]. Česká republika patří k zemím s nejvyšší prenatální detekcí VSV v Evropě. Prenatální detekce všech VSV se zvýšila z 0,6 % v roce 1986 na 36,5 % v roce 2009 [42]. Prenatální detekce kritických VSV se pohybuje v posledních letech (2002–2009) od 70 do 83 % [26]. Úspěšnost této prenatální detekce v regionu MS kraje je nyní 66 %.
Práce se zaměřuje na anamnézu vyšetřovaných těhotných žen a posouzení, zda uváděné rizikové faktory mohou mít vliv na vznik srdeční vady. Rizikové faktory v anamnéze uvedlo 16 % rodin. Při celkovém hodnocení a testování hypotéz potvrzujeme existenci závislosti vzniku srdeční vady u skupiny matek s rizikovou anamnézou ve srovnání se skupinou bez zátěže. Nejčastější rizikový faktor byl věk nad 35 let a byl hodnocen zvlášť. Hranice 35 let se pro výskyt VSV ukázala jako statisticky nevýznamná, přesto při vytvoření lineárního modelu potvrzujeme závislost výskytu VSV na věku a s rostoucím věkem pravděpodobnost výskytu VSV roste. Hranice 35 let, jako věková zátěž, se postupně opouští a při normálním screeningu již není genetiky tak často indikována amniocentéza. I po odstranění „věkového“ rizikového faktoru zůstává platná statistická významnost původního souboru s anamnestickou zátěží. Fetální echokardiografie je u rizikových rodin plně indikována. Incidence srdeční patologie při přítomnosti VSV v rodinné anamnéze 1. stupně byla nízká a neodpovídala jiným souborům [21, 38, 43]. V jiných souborech nebyl zjištěn rozdíl mezi výskytem VSV v potomstvu matky nebo otce se srdeční vadou [46]. Při výskytu srdeční vady v rodině je riziko pro další těhotenství malé (2–3 %, při populačním výskytu jakékoliv jiné vady 5 %). Vyšší výskyt VSV ve skupině umělého oplodnění bude nutno podrobit dalšímu zkoumání, tato skupina již sama o sobě vykazuje další rizikové faktory a je otázkou, zda hodnocení je správné.
Maximální pozornost věnujeme matkám s pozitivní revmatologickou anamnézou. Snahou je, aby každá takováto těhotná byla vyšetřena revmatologem již v úvodu gravidity a byla stanovena přítomnost rizikových protilátek. Riziko vývoje AV bloku u sérologicky pozitivních matek je 1–2 % [6, 7], riziko opakování při předchozí patologické graviditě (AV blok plodu) stoupá až k 20 % [8, 9, 17]. Podstatnou částí prenatální péče je časné sledování tepové frekvence plodu a v pravidelných intervalech vyhodnocování „PR“ intervalu měřeného pulzní dopplerovskou technikou při snímání křivky z mitrální chlopně a výtokového traktu levé komory, prodloužení nad 150 ms hodnotíme jako AV blok 1. stupně. Při podezření na vývoj bloku je indikací podání kortikoidů (dexamethason), při pomalé frekvenci, většinou pod 55/min, nasazení betamimetik (salbutamol). Na rozdíl od znalosti rizikovosti protilátek neexistuje jasný prediktivní marker k zahájení terapie [25]. Pouhé profylaktické podání kortikoidů se u vysoce rizikových těhotných nedoporučuje [15]. Obecně se postupy léčby v různých souborech liší, některé multicentrické studie uvádějí, že kortikoidy nejsou schopny zvrátit blok vysokého stupně, jejich indikací by mělo být podání při bloku prvního stupně k prevenci vývoje vyššího stupně onemocnění [18, 30]. V našem souboru u plodů s AV blokem měly všechny matky pozitivní rizikové protilátky. Indikaci podání imunoglobulinů IVIG jsme zatím u rizikových matek (výskyt AVB u předchozího dítěte) nepoužili [17]. V uvedeném souboru se nevyskytl žádný významný AVB blok u séronegativních matek. Tento nález může být při výskytu již v prvním trimestru spojen s významnou srdeční anomálií, AV regurgitací, edémy a rozvojem srdečního selhávání plodu [2].
Fetální echokardiografii jako sreeningové vyšetření je možné posouvat do nižších týdnů gravidity, mnoho pracovišť nabízí časnou fetální echokardiografii rodinám s rizikovým faktorem v anamnéze [11, 14, 44]. Časný screening VSV je možné spojit s vyšetřením nuchální translucence (NT, šíjové projasnění), je dokázán vztah záchytu VSV s rostoucí NT i u plodů s normálním karyotypem nebo nepřítomností rizikových faktorů v anamnéze [12, 32]. Regurgitace na trojcípé chlopni, společně s dalšími „minor markery“ (hypoplazie nazální kosti, reverzní tok v ductus venosus) a s parametry biochemického screeningu (beta-hCG, PAPP-A) může sloužit k predikci nejčastějších chromozomálních aberací plodu [20, 27, 33]. Transvaginální přístup dovoluje ve 13. týdnu spolehlivé zobrazení čtyřdutinové i některých z dalších projekcí až u 90 % plodů [23, 24]. Část pracovišť využívá kombinaci transvaginálního a transabdominálního vyšetření [3, 10, 36, 37]. Obecně vyšetření srdce v prvním trimestru je více závislé na technickém vybavení pracoviště pro malé rozměry fétu a srdečních struktur. Průměr anulu semilunárních chlopní je ve 13. týdnu 1,2 mm. Ambulance dětských kardiologií většinou možnost vaginálního vyšetření nevyužívají, při transabdominálním vyšetření je při dobré viditelnosti a poloze plodu možné bezpečně posoudit srdeční morfologii a funkci zhruba od 17.–18. týdne. Transabdominální vyšetření je možné provést i okolo 14. týdne při použití moderních UZ měničů s vyšší frekvencí [19]. I při zjištění srdeční vady je při časném vyšetření mezi 11.–14. týdnem těhotenství nadále sledováno, diagnóza potvrzena mezi 14. až 16. týdnem nebo později. Z výše uvedených důvodů „zlatým standardem“ ponecháváme fetální echokardiografii, jako screeninové vyšetření, na II. trimestr gravidity, nejčastěji na období mezi 19.–21. týdnem.
Rychlý vývoj ultrazvukových technik umožní nejen posun vyšetření do prvního trimestru, ale lze očekávat i rozvoj použití metod typu 3D/4D zobrazení [1, 13, 29]. Do úvahy patří programy STIC (spatiotemporal image correlation) [22, 35] a kombinace s dalšími UZ metodami – STIC and B-Flow, STIC and HD-flow, STIC and inversion mode, STIC and TUI (tomographic ultrasound imaging). Otázkou je využití při stanovení diagnózy oproti „klasickému“ 2D zobrazení. Tyto metody je možné využít při studování cévních anomálií u plodu u některých komplexních vad. Při použití 3D/4D metod lze doplnit diagnostiku například u transpozice velkých cév, pulmonální atrézie a defektu komorového septa, interrupci aortálního oblouku, arteriálního truncus, anomálního návratu plicních žil. Na pracovišti autora se nyní tyto techniky nepoužívají, limitace je pouze technická, další celkový vývoj lze očekávat.
ZÁVĚRY
- Fetální echokardiografie, jako screeningové vyšetření, by měla být provedena plánovaně u každé těhotné ženy, v současnosti nejčastěji ve druhém trimestru gravidity. Toto vyšetření by mělo být realizováno lékařem (gynekolog, dětský kardiolog, genetik) s dostatečnými zkušenostmi, který provádí větší počet vyšetření. Podezření na srdeční patologii by mělo být došetřeno ve specializovaném centru, které je schopno nabídnout definitivní diagnostiku a celkové došetření patologické gravidity. Srdeční vada se vyskytuje většinou jako izolované postižení, celkově jsou VSV nejčastější morfologické anomálie v populaci.
- Pokud v určité oblasti nefunguje prenatální detekce vrozených srdečních vad jako plošný screening, plod u matky s rizikovou anamnézou by měl být vyšetřen specialistou vždy. Rizikové faktory, které zvyšují riziko výskytu VSV jsou jasně vyjádřeny a anamnéza těhotné by měla být odebrána pečlivě a komplexně.
- Při přítomnosti rizikových faktorů je možné se pokusit o časnou fetální echokardiografii v prvním trimestru gravidity, vyšetření je proveditelné transabdominálně nebo transvaginálně, popřípadě kombinací obou metod. Nutný je celkový pohled na graviditu, znalost ostatních možností plánovaného screeningu a vztahy jednotlivých částí. V případě patologie jednoho z vyšetření doplňujeme cílenou fetální echokardiografii.
- Přítomnost rizikového faktoru v anamnéze uvedlo 16 % rodin. Při zpracování dat a testování hypotéz potvrzujeme existenci závislosti mezi výskytem VSV ve skupině těhotných s rizikovými faktory v anamnéze a skupinou těhotných bez zátěže. Hranice 35 let se pro výskyt VSV ukázala statisticky nevýznamná a nepotvrzujeme závislost mezi výskytem VSV u matek do 35 let a nad 35 let věku. Při použití lineárního modelu ale s věkem pravděpodobnost výskytu VSV roste.
- Prenatální kardiologie a celá fetální medicína je nyní složitý interdisciplinární obor, vyjma medicínských postupů je nutno pamatovat na citlivý přístup k postižené rodině a etický a sociální rozměr celé problematiky.
MUDr. Jan Pavlíček
Oddělení dětské a prenatální kardiologie
Klinika dětského lékařství
Fakultní nemocnice Ostrava
17. listopadu 1790
708 52 Ostrava Poruba
e-mail: jan.pavlicek@fno.cz
Sources
1. Acar, P., Dulac, Y., Taktak, A., Abadir, S. Real-time three-dimensional fetal echocardiography using matrix probe. Prenat Diagn, 2005, 25, 5, p. 370-375.
2. Baschaat, AA., Gembruch, U., Knöpfle, G., et al. First - trimester fetal heart block: a marker for cardiac anomaly. Ultrasound Obstet Gynecol, 1999, 14, 5, p. 311-314.
3. Becker, R., Wegner, RD. Detailed screening for fetal anomalies and cardiac defects at the 11-13-week scan. Ultrasound Obstet Gynecol, 2006, 27, 6, p. 613-618.
4. Baspinar, O., Karaaslan, S., Oran, B., et al. Prevalence and distribution of children with congenital heart diseases in the central Anatolian region, Turkey. Turk J Pediatr, 2006, 48, 3, p. 237-243.
5. Bolisetty, S., Daftary, A., Ewald, D., et al. Congenital heart defects in Central Australia. Med J Aust, 2004, 180, 12, p. 614‑617.
6. Brucato, A. Prevention of congenital heart block in children of SSA-positive mothers. Rheumatology, 2008, 47, Suppl 3, iii35‑iii37.
7. Brucato, A., Frassi, M., Franceschini, F., et al. Risk of congenital complete heart block in newborns of mothers with anti-Ro/SSA antibodies detected by counterimmunoelectrophoresis: a prospective study of 100 women. Arthritis Rheum, 2001, 44, p. 1832-1835.
8. Brucato, A., Jonzon, A., Friedman, D., et al. Proposal for new definitive of congenital complete atrioventricular block. Lupus, 2003, 12, p. 427-435.
9. Buyon, JP., Hiebert, R., Copel, J., et al. Autoimmune-associated congenital heart block: demographics, mortality, morbidity and recurrence rates obtained from a national neonatal lupus registry. J Am Coll Cardiol, 1998, 31, p. 1658-1666.
10. Carvalho, JS. Fetal heart scanning in the first trimester. Prenat Diagn, 2004, 24, 13, p. 1060-1067.
11. Carvalho, JS. Early prenatal diagnosis of major congenital heart defects. Cuee Opin Obstet Gynecol, 2001, 13, 2, p. 155-159.
12. Clur, SA., Mathijssen, IB., Pajkrt, E., et al. Structural heart defects associated with an increased nuchal translucency: 9 years experience in a referral centre. Prenat Diagn, 2008, 28, 4, p. 347‑354.
13. Cohen, L., Mangers, K., Grobman, WA., et al. Three-dimensional fast acquisition with sonographically based volume computer-aided analysis for paging of the fetal heart at 18 to 22 weeks’ gestation. J Ultrasound Med, 2010, 29, 5, p. 751-757.
14. Comas, GC., Galindo, A., Martinez, JM., et al. Early prenatal diagnosis of major cardiac anomalies in a high-risk population. Prenat Diagn, 2002, 22, 7, p. 586-593.
15. Costedoat-Chalumeau, N., Amoura, Z., Le Thi Hong, D., et al. Question about dexamethasone use for the prevention of anti-SSA related congenital heart block. Ann Rheum Dis, 2003, 62, 10, p. 1010-1012.
16. Cullen, MT., Green, J., Whetham, J., et al. Transvaginal ultrasonographic detection of congenital anomalies in the first trimester. Am J Obstet Gynecol, 1990, 163, 2, p. 466-476.
17. Friedman, DM., Llanos, C., Izmirly, PM., et al. Evaluation of fetuses in a study of intravenous imunoglobulin as preventive therapy for congenital heart block: Results of a multicenter, prospective, open-label clinical trial. Arthritis Rheum, 2010, 62, 4, p. 1138-1146.
18. Friedman, DM., Kim, MY., Copel, JA., et al. Prospective evaluation of fetuses in the PR interval with autoimmune-associated congenital heart block followed in the PR interval and dexamethasone evaluation (PRIDE) study. J Am Cardiol, 2009, 103, p. 1102-1106.
19. Gardiner, H. Fetal echocardiography: 20 years of progress. Heart, 2001, 86 (Suppl.), ii12-ii22.
20. Geipel, A., Willruth, A., Vieten, J., et al. Nuchal fold thickness, nasal bone absence or hypoplasia, ductus venosus reversed flow and tricuspid valve regurgitation in screening for trisomies 21, 18 and 13 in the early second trimester. Ultrasound Obstet Gynecol, 2010, 35, 5, p. 535-539.
21. Gill, HK., Splitt, M., Sharland, GK., et al. Patterns of recurrence of congenital heart disease. J Am Coll Cardiol, 2003, 42, p. 923-929.
22. Goncalves, LF., Lee, W., Espinoza, J., Romero, R. Examination of the fetal heart by four-dimensional (4D) ultrasound with spatio temporal image correlation (STIC). Ultrasound Obstet Gynecol, 2006, 27, p. 336-348.
23. Haak, MC., Vugt, JM. Echocardiography in early pregnancy: review of literature. J Ultrasound Med, 2003, 22, 3, p. 271-280.
24. Homola, J., Satrapa, V. Transvaginální echokardiografie v časné diagnostice vrozených srdečních vad plodu. Čes-slov Pediat, 1992, 47, 6, s. 350-352.
25. Jaeggi, ET., Fouron, JD., Silverman, ED., et al. Transplacental fetal treatment improves the outcome of prenatally diagnosed complete atrioventricular block without structural heart disease. Circulation, 2004, 110, p. 1542-1548.
26. Jíčínská, H. Prenatální kardiologie v České republice. Čes-slov Pediat, 2010, 65, 11, s. 623-625.
27. Kagan, KO., Wright, D., Baker, A., et al. Screening for trisomy 21 by maternal age, fetal nuchal translucency thickness, free beta-human chorionic gonadotropin and pregnancy-associated plasma protein-A. Ultrasound Obstet Gynecol, 2008, 31, 6, p. 618-624.
28. Lombardi, CM., Bellotti, M., Fesslova, V., Cappellini, A. Fetal echocardiography at the time of the nuchal translucency scan. Ultrasound Obstet Gynecol, 2007, 29, 3, p. 249-257.
29. Mayer-Wittkopf, M., Hofbeck, M. Two - and free-dimensional echocardiographic analysis of congenital heart disease in the fetus. Herz, 2003, 28, 3, p. 240-249.
30. Maeno, Y., Himeno, W., Saio, A., et al. Clinical course of fetal congenital atrioventricular block in Japanese population: a multicentre experience. Heart, 2005, 91, p. 1075-1106.
31. Marek, J. Pediatrická a prenatální echokardiografie. Praha: Triton, 2003.
32. Muller, MA., Clur, SA., Timmerman, E., Bilardo, CM. Nuchal translucency measurement and congenital heart defects: modest association in low-risk pregnancies. Prenat Diagn, 2007, 27, 2, p. 164-169.
33. Nicolaides, KH. Nuchal translucency and other first trimester sonographic markers of chromosomal abnormalities. Am J Obstet Gynecol, 2004, 191, 1, p. 45-67.
34. R Development Core Team (2010). R: A language and environment for statistical computing. R Foundation for Statistical Computing. Vienna, Austria.
35. Rizzo, G., Capponi, A., Muscatello, A., et al. Examination of the fetal heart by four-dimensional ultrasound with spatiotemporal image correlation during second-trimester examination: the free-steps technice. Fetal Diagn Ther, 2008, 24, 2, p. 126-131.
36. Smrcek, JM., Berg, CH., Geipel, A., et al. Early fetal echocardiography. J Ultrasound Med, 2006, 25, p. 173-182.
37. Smrcek, JM., Berg, CH., Geipel, A., et al. Detection rate of early fetal echocardiography and in utero development of congenital heart defects. J Ultrasound Med, 2006, 25, p. 187-196.
38. Stoll, C., Alembik, Y., Roth, MP., et al. Risk factors in congenital heart disease. Eur J Epidemiol, 1989, 5, 3, p. 382-391.
39. Šamánek, M., Slavík, Z., Zbořilová, B., et al. Prevalence, treatment, and outcome of heart disease in live-born children: A prospective analysis od 91,823 live born children. Pediat Cardiol, 1989, 10, 4, p. 205-211.
40. Šípek, A., Gregor, V., Šípek, A. Jr., et al. Incidence of congenital heart defects in the Czech Republic - current data. Čes Gynek, 2010, 75, 3, p. 221-242.
41. Škovránek, J., Marek, J., Povýšilová, V. Prenatální kardiologie. Čes-Slov Pediat, 1997, 52, 6, s. 332-338.
42. Tomek, V., Marek, J., Jíčínská, H., Škovránek, J. Fetal cardiology in the Czech Republic: Current management of prenatally diagnosed congenital heart disease and arrhythmias. Physiol Res, 2009, 58 (Suppl. 2), p. S159-S166.
43. Thangaroopan, M., Wald, RM., Silversides, CK., et al. Incremental diagnostic yield of pediatric cardiac assessment after fetal echocardiography in the offspring of women with congenital heart disease: A prospective study. Pediatrics, 2008, 121, 3, p. 660-665.
44. Weiner, Z., Lorber, A., Shalev, E. Diagnosis of congenital cardiac defects between 11 and 14 weeks’ gestation in high-risk patients. J Ultrasound Med, 2002, 21, 1, p. 23-29.
45. Wessels, MW., Willems, PJ. Genetic factors in non-syndromic congenital heart malformation. Clin Genet, 2010, 78, p. 103-123.
46. Whittemore, R., Wells, JA., Castellsauge, X. A second-generation study of 427 probands with congenital heart defects and their 837 children. J Am Coll Cardiol, 1994, 23, p. 1459‑1467.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2011 Issue 5
-
All articles in this issue
- Pooperační sledování po konzervativním ošetření prekanceróz děložního hrdla
- Vybrané antropometrické parametry a jejich vztah k metabolismu sacharidů u žen s PCOS
- Vyhodnocení prvých zkušeností s bezpečností a krátkodobým efektem mini-páskových antiinkontinentních operací MiniArc a AJUST
- Reverzní mapování lymfatik v axile jako možnost prevence lymfedému u pacientek s karcinomem prsu
- Současná klasifikace zhoubných nádorů v onkogynekologii – část II
- Trombin generační test u fyziologické a rizikové gravidity
- Postavy a eponyma z italské historie gynekologie a porodnictví
- Perineální audit: důvody pro více než 1000 epiziotomií
- Rizikové faktory v anamnéze těhotných žen při prenatálním screeningu vrozených srdečních vad
- Dopplerometrie u hypotrofických plodů
- Přenos jednoho embrya (single embryo transfer): možnosti a limity
- Hormonálna antikoncepcia po prekonanej intrahepatálnej cholestáze gravidných
- Czech Gynaecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Dopplerometrie u hypotrofických plodů
- Současná klasifikace zhoubných nádorů v onkogynekologii – část II
- Přenos jednoho embrya (single embryo transfer): možnosti a limity
- Perineální audit: důvody pro více než 1000 epiziotomií
