Aktivní buněčná imunoterapie karcinomu ovaria pomocí dendritických buněk
Active cellular immunotherapy of ovarian cancer using dendritic cells
Objective:
Overview and comparison of current results of studies dealing with the development and application of anti-cancer vaccines based on dendritic cells in ovarian cancer.
Design:
Review.
Setting:
Department of Obstetrics and Gynaecology Charles University, Prague, 2nd Faculty of Medicine and University Hospital Motol, Department of Immunology 2nd Faculty of Medicine and University Hospital Motol.
Summary:
Ovarian carcinoma (OVCA) is highly sensitive to chemotherapy; however despite this results from treatment are fairly unsatisfactory. Bearing this in mind, it is important to look for new ways to better understand the immunological mechanisms which could affect reactivation of the disease. It is likely that new knowledge in the field of the immunology of ovarian carcinoma could improve monitoring of the disease and help to ameliorate prognosis of the disease. One strategy in development is creation of anti-OVCA vaccines. Theese vaccines are made by the fusion of dendritic cell (DC) and tumor cells or its parts (NA, peptides). DC are bone-marrow derived leukocytes that are critical in the initiation of T cell mediated immunity. DC are fused to patient-derived ovarian carcinoma cells. The fusion cells induces cytotoxic T cell against autologous OVCA cells.
Key words:
dendritic cells, anti-tumor vaccines, antitumor immunity, biological therapy, ovarian cancer.
Authors:
Tomáš Brtnický 1
; M. Podrazil 2; J. Bartůňková 2; R. Špíšek 2; Lukáš Rob 1
Authors‘ workplace:
Gynekologicko-porodnická klinika 2. LF UK a FN Motol, Praha, přednosta prof. MUDr. L. Rob, CSc.
1; Ústav imunologie 2. lékařské fakulty UK a FN Motol, Praha, přednostka prof. MUDr. J. Bartůňková, DrSc.
2
Published in:
Ceska Gynekol 2012; 77(3): 215-220
Overview
Cíl práce:
Přehled a srovnání aktuálních výsledků studií zabývající se vývojem a aplikací protinádorových vakcín na bázi dendritických buněk u ovariálního karcinomu.
Typ studie:
Souhrnný článek.
Název a sídlo pracoviště:
Gynekologicko-porodnická klinika 2. LF UK a FN Motol, Ústav imunologie 2. LF UK a FN Motol, Praha.
Souhrn:
I přes poměrně vysokou chemosenzitivitu jsou výsledky komplexní léčby pokročilých stadií ovariálních karcinomů neuspokojivé. To je i důvod hledání cest k lepšímu poznání imunologických mechanismů, které mohou ovlivňovat reaktivaci onemocnění. Je pravděpodobné, že nové poznatky v oblasti imunologie ovariálních karcinomů mohou zlepšovat monitorování onemocnění a pomáhat zlepšit prognózu onemocnění.
Jednou z možností je vývoj protinádorové buněčné imunoterapie ovariálního karcinomu. Principem tohoto přístupu je podávání dendritických buněk (DC), které prezentují nádorové antigeny a indukují specifickou protinádorovou imunitní odpověď. DC jsou nejúčinnější antigen prezentující buňky, vyvíjejí se v kostní dřeni a hrají zásadní roli v zahájení T buněčné imunity. Aplikace dendritických buněk vede k indukci cytotoxických lymfocytů T, které specificky rozpoznávají nádorové buňky karcinomu ovaria.
Klíčová slova:
dendritické buňky, protinádorová imunoterapie, protinádorová imunita, biologická terapie, ovariální karcinom.
ÚVOD
Incidence ovariálních zhoubných nádorů v České republice do roku 2004 stoupala a v roce 2004 dosáhla nejvyšší hodnoty 24,2 na 100 000 žen. Přestože stále dochází k prodlužování průměrného věku žen, incidence karcinomu ovarií má sestupný trend. Jeden z nejpravděpodobnějších důvodů tohoto jevu je masivní užívání hormonální antikoncepce. Mortalita je i přes pokles (za posledních 10 let poklesla asi o 10 %) stále vysoká hlavně proto, že většinu ovariálních nádorů (75–80 %) diagnostikujeme v pokročilých stadiích (III a IV). Ovariální zhoubné nádory jsou z gynekologických nádorů nejčastější příčinou smrti (v absolutních číslech). Jednou z nově diskutovaných léčebných možností nádorových onemocnění je aktivní buněčná imunoterapie, která spočívá v indukci imunitní reakce namířené proti populaci nádorových buněk. Jednou z možností jak indukovat imunitní odpověď proti antigenům nádorových buněk je podání dendritických buněk (DC), které prezentují nádorové antigeny T-lymfocytům. DC jsou klíčovými buňkami imunitní reakce, které stojí na rozhranní mezi nespecifickou a specifickou imunitou. Mají v tomto výjimečném postavení schopnost jednak rozeznat antigeny a v dalším kroku proti těmto antigenům zahájit odpovídající imunitní odpověď. Podání dendritických buněk v terapii nádorových onemocnění bylo intenzivně sledováno na zvířecích modelech a nyní se dostává do stadia možného využití v humánní medicíně.
VYUŽITÍ DENDRITICKÝCH BUNĚK V IMUNOTERAPII NÁDOROVÝCH ONEMOCNĚNÍ
Terapeutický účinek imunoterapie byl pozorován u mnoha pacientů např. s maligním melanomem, hematologickými malignitami či jinými solidními tumory [7, 22, 29, 31, 38, 43, 50]. Využití dendritických buněk v léčbě nádorových nemocí se zakládá na jejich schopnosti účinně aktivovat imunitní mechanismy [8, 12, 34, 39, 46].
Dendritické buňky jsou považovány za nejúčinnější buňky předkládající antigen (APC) a jsou hlavním spojujícím článkem mezi antigenně nespecifickou a specifickou částí imunitního systému [2, 3, 13, 23, 40]. Ve většině tkání se DC vyskytují v tzv. nezralém stavu, kdy na svém povrchu nemají molekuly nezbytné pro aktivaci T lymfocytů. Nezralé DC předávají organismu informaci o skladbě vnitřního prostředí a upozorňují včas na hrozící nebezpečí. Nezralé DC se vyskytují téměř ve všech periferních tkáních, a přicházejí tedy do kontaktu s antigenem brzy po jeho průniku do organismu. Pokud není v organismu přítomna infekce či jiný druh signálu nebezpečí, nezralé dendritické buňky pohlcují průběžně odumřelé buňky zdravých tkání a molekuly rozpuštěné v mezibuněčné tekutině následně migrují do lymfatických uzlin, pohlcené molekuly zpracují a vystaví je na svém povrchu [32]. Specifické lymfocyty T, které takový antigenní peptid rozpoznají, nejsou aktivovány, ale jsou buď zcela utlumeny, nebo se z nich vytvoří regulační lymfocyty T. Takto se nezralé dendritické buňky podílejí na zachování tolerance vůči vlastním tkáním [5, 41, 42]. Pokud však nezralé dendritické buňky rozpoznají podnět, který představuje pro organismus nebezpečí (nejčastěji jde o patogenní mikroorganismy, nekrotické, ale i maligně transformované buňky), aktivují se a stávají se z nich zralé dendritické buňky, které dokážou jako jediné aktivovat naivní T-lymfocyty [25, 26, 27]. Zralé DC se od nezralých liší expresí povrchových markerů i funkčními charakteristikami [19, 28]. Mezi funkční změny patří ztráta schopnosti fagocytovat, ale naopak se zvyšuje kapacita zpracování antigenu. Antigenní štěpy jsou pak vystaveny na povrchu spolu s molekulami MHC a předloženy lymfocytům T. Rozdíl ve složení povrchových molekul nezralých a zralých DC spočívá zejména ve vyšší expresi kostimulačních molekul na zralých DC, které zesilují signály zprostředkované dendritickou buňkou a zahajují aktivaci různých druhů lymfocytů T. Dochází také ke zvýšení exprese komplexů MHC molekul I. a II. třídy s antigeny. Během procesu zrání produkují DC řadu cytokinů, které modulují vznikající imunitní odpověď. Mezi nejdůležitější patří IL-1, IL-6, TNF a IL-12. V průběhu těchto změn se zralé DC přesouvají do lymfatických uzlin, kde se setkávají s lymfocyty specifickými pro vystavené antigeny. V následném kroku se rozvine odpovídající imunitní odpověď vůči vyvolávajícímu podnětu.
V případě některých onemocnění, zvláště nádorových, je však popsaný fyziologický sled jednotlivých stupňů rozvoje imunitní odpovědi narušen, imunitní reakce proti nádoru jsou potlačeny, a dovolí tak rozvoj nádorového onemocnění. Základním principem imunoterapie na bázi dendritických buněk je využití klíčového postavení DC v rozvoji účinné imunitní reakce. V procesu výroby vakcíny jsou DC in vitro inkubovány s nádorovými antigeny, projdou výše popsaným procesem maturace a získají schopnosti navodit účinnou imunitní odpověď.
Zásadní pro využití DC buněk pro imunoterapii nádorových nemocí je jejich dostatečné množství k přípravě vakcíny [35]. Je známo, že DC tvoří v organismu jen velmi malé procento populace buněk. V laboratorních podmínkách jsou již k dispozici protokoly výroby dendritických buněk z autologních monocytů stimulovaných v přítomnosti cytokinů GM-CSF (Granulocyte-Monocyte-Colony Stimulating Factor) a IL-4 [36]. Existuje několik způsobů jak zajistit, aby DC prezentovaly nádorové antigeny. Patří k nim inkubace DC s peptidy, nádorovými lyzáty nebo tvorba hybridů dendritických a nádorových buněk. Všechny tyto postupy vedly k žádoucímu procesu maturace DC a k použití takto připravených DC v protinádorové imunoterapii (obr. 1).
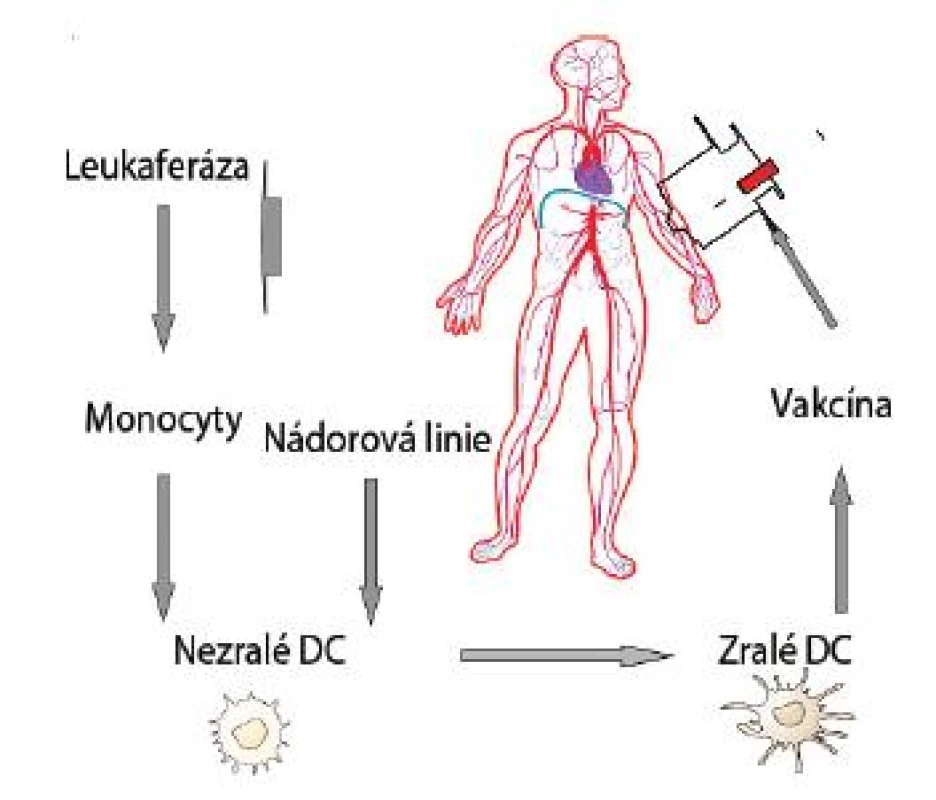
PREKLINICKÉ STUDIE
Schopnost dendritických buněk účinně aktivovat imunitní systém deklaruje mnoho provedených in vitro studií [20, 49]. V těchto studiích bylo prokázáno, že DC jsou schopny indukovat antigen specifickou imunitní odpověď proti různým typům nádorů. Vieweg a kol. ve studii s dendritickými buňkami transferovanými mRNA kódující PSA popisují indukci PSA specifických odpovědí in vitro [15]. Palucka a kol. ve svých in vitro experimentech demonstrují schopnost dendritických buněk pohltit usmrcené nádorové buňky maligního melanomu, T-buněčného lymfomu linie Jurkat nebo karcinomu prostaty s následným navozením tumor specifických odpovědí [33]. Extrapolace in vitro experimentů s DC vakcínami do zvířecích modelů přinesla další důkazy o možnosti efektivity tohoto přístupu.
Studie na myších prokázaly, že DC vystavující nádorový antigen mohou vyvolat účinnou protinádorovou imunitní odpověď, a lze tak dosáhnout vyléčení již vzniklého nádoru nebo předejít jeho vzniku. Další důkazy o tom, že DC vakcíny mohou v praxi dobře fungovat, poskytly studie ukazující imunogenicitu antigenů vystavených na DC u pacientů s nádorovým onemocněním[10] nebo pacientů s chronickou HIV infekcí [24].
Nežádoucí účinky vakcín
Provedené studie s protinádorovými vakcínami typu pulzovaných dendritických buněk prokázaly na zvířecích modelech jejich bezpečnost a dobrou toleranci. Nebyly zaznamenány toxické účinky po jednorázovém nebo opakovaném podávání. Také nebyla prokázána karcinogenita, reprodukční toxicita nebo genotoxicita použitých vakcín. Nežádoucí účinky se limitovaly na lokální kožní reakce, které se ale nijak neodlišovaly od reakcí po běžných vakcínách [4, 9, 30, 44, 45].
ÚČINKY U ČLOVĚKA
Farmakokinetika a metabolismus léčiva u člověka
Studie na pacientech a zdravých dobrovolnících ukázaly, že zralé dendritické buňky migrují do lymfatických uzlin mnohem efektivněji než nezralé dendritické buňky [1]. Po intradermálním nebo subkutánním podání do lymfatických uzlin migruje přibližně 5 % injikovaných buněk [11]. Z pilotních studií se zdá, že v lymfatických uzlinách přežívají injikované dendritické buňky déle, než se původně předpokládalo, až několik dní. Počet dendritických buněk, které dosáhnou lymfatických uzlin, koreluje s mírou indukce antigen specifické imunity. Některé studie navrhují ošetření místa vpichu injekcí prozánětlivých cytokinů, např. TNFα, pro zvýšenou migraci [6]. Zvažována je také přímá injekce dendritických buněk do lymfatických uzlin pod sonografickou kontrolou, ale zatím není dostatek studií, které by dovolovaly plně zvážit přínos tohoto technicky velmi náročného postupu [48]. Studie z poslední doby prokázala víceméně stejnou schopnost indukce imunitní reakce, ať byly DC injikovány intradermálně, subkutánně (obr. 2) nebo intranodálně. Dendritické buňky, které nemigrují z místa vpichu do uzlin, jsou během 48 hodin fagocytovány okolními makrofágy [47]. Naopak intravenózní podání se nejeví jako vhodné pro nízkou schopnost intravenózně podaných vakcín indukovat specifickou imunitní reakci [9].
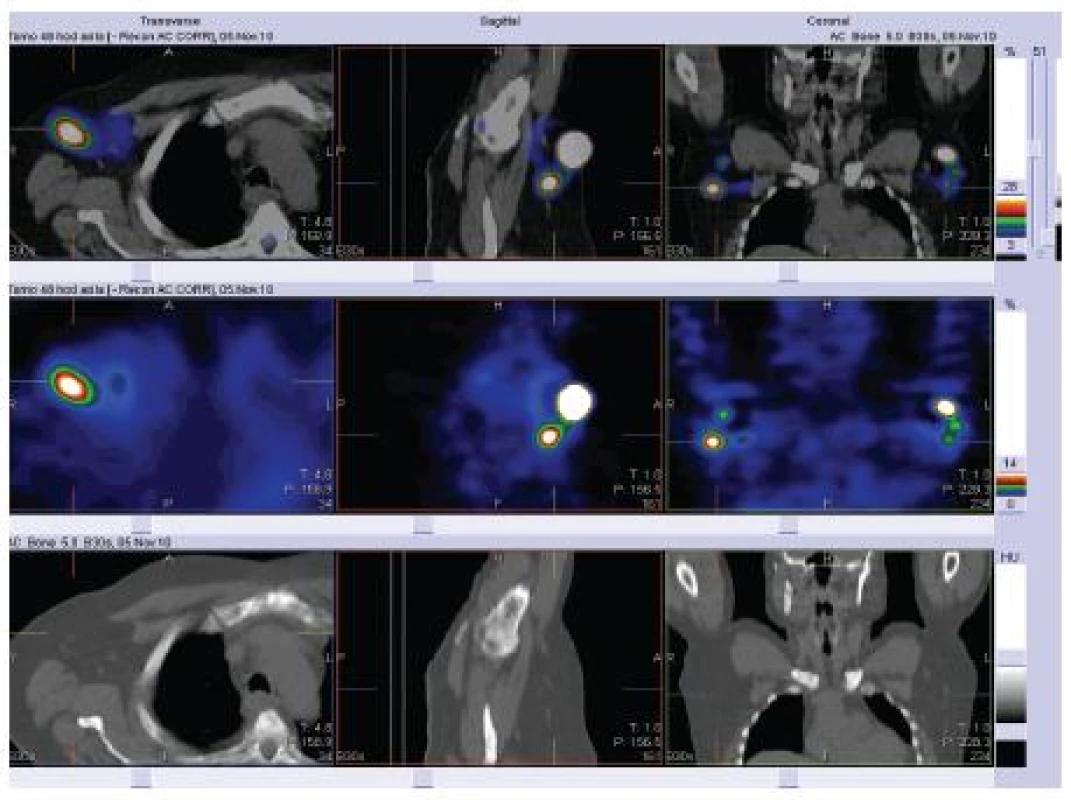
Přehled in vitro a in vivo studií u člověka
DC pulzované peptidy
Brossart P. et al. [6] publikovali studii zabývající se indukcí cytotoxické T-lymfocytární odpovědi in vivo po vakcinaci peptidy pulzovanými autologními dendritickými buňkami (DC). Do studie bylo zařazeno celkem 10 pacientek (7 pacientek s pokročilým karcinomem prsu a 3 pacientky s pokročilým ovariálním karcinomem). Pacientkám byly aplikovány DC vakcíny, které byly pulzovány buď s HER-2/neu nebo MUC1-derivovanými peptidy. DC vakcinace byla dobře tolerována, bez nežádoucích vedlejších efektů. U pěti z 10 pacientek byly detekovány peptid-specifické cytotoxické T-lymfocyty (CTLs). U jedné pacientky imunizované HER-2/neu peptidy byly zjištěny MUC1-specifické T-lymfocyty po aplikaci 7. vakcíny. Tento výsledek podporuje teorii „antigen spreading“ in vivo po aplikaci vakcíny s pouze jedním tumor antigenem. Závěry této studie potvrzují, že vakcinace DC pulzovanými pouze jedním tumor antigenem mohou indukovat imunologickou odpověď u pacientů jak s ovariálním karcinomem, tak s karcinomem prsu.
DC pulzované nukleovými kyselinami
V roce 2007 publikovali J. J. Hernando et al. v Lancet Oncology [17] kazuistiku 61leté ženy s diagnostikovaným pokročilým epiteliálním karcinomem ovaria (stadium IIIC podle FIGO klasifikace). Šlo o ovariální tumor s peritoneálním rozsevem a elevovaným CA-125 nad 3000 U/ml. Vzhledem k inoperabilnímu nálezu se přistoupilo k podání neadjuvantní chemoterapie (v kombinaci platinový derivát + taxany). Poté proveden debulking s cytoredukcí, reziduální nemoc méně než 1 cm. Po adjuvantních 3 sériích chemoterapie poklesla hladina CA-125 pod 30 U/ml. Po 12 měsících následovala recidiva onemocnění. Následoval sekundární debulking bez makroskopického rezidua. Po 2. linii chemoterapie pokles CA-125 pod 20 U/ml. Za 4 měsíce následoval opět rychlý relaps onemocnění, elevace CA-125, metastázy v paraaortálních a axilárních lymfatických uzlinách. Bulky axilární uzliny, které negativně ovlivňovaly běžnou denní činnost byly exstirpovány. Následovala vakcinace autologními DC pulzovanými mRNA (kódující folat-receptor typu alpha). Výroba vakcín zahrnovala reverzní transkripci plné délky FR-α-cDNA z total RNA z lidské ovariální nádorové linie. Zralé DC byly injikovány pod UZ kontrolou do nezvětšených ingvinálních lymfatických uzlin. Celkem bylo aplikováno 10 vakcín po 4týdenních intervalech. Výsledky CT před vakcinací a po 3 měsících po vakcinaci ukázaly částečnou odpověď. Follow up CT po 16 měsících odhalilo více než 50% regresi metastáz v lymfatických uzlinách. Hladina CA-125 se prudce snížila za 4 týdny po první vakcinaci (z 640 U/ml na 60 U/ml) a udržovala se na baseline hladině. Takto rychlá a dlouhotrvající regrese a remise onemocnění po vakcinaci je pozoruhodná.
DC pulzované nádorovými buňkami
Pennsylvanská skupina [37] zařadila do své studie 10 pacientek s ovariálním karcinomem. Autologní DC byly pulzovány s usmrcenými autologními nádorovými buňkami. Vzniklé fúzované buňky byly kultivovány za přítomnosti tumor necrosis faktoru α + TRANCE (tumor necrosis factor-related activation-induced cytosine) za účelem indukce maturace. TRANCE a CD40 ligandy byly účinné na zrání DC. Buněčné linie T-lymfocytů vytvořené in vitro byly tumor-specifické pro MHC I. třídy. Výsledky této studie demonstrují skutečnost, že zralé DC buňky prezentující tumor antigeny získané z fagocytovaných autologních nádorových buňek mohou být použity k zesílení protinádorové imunity in vitro. Závěry této studie tedy podporují vhodnost terapeutického využití vakcín u pacientek s ovariálním karcinomem.
Harvardská studie [14] se zabývá fúzí nádorových buňek ovariálního karcinomu s autologními dendritickými buňkami. Vzniklá populace buněk heterokaryonů exprimovala antigen CA 125 a DC kostimulační a adhezivní molekuly. Podobné výsledky dosáhli fúzí nádorových buněk s alogenními DC. Fúzované buňky stimulovaly proliferaci autologních T-lymfocytů. Výsledky také ukázaly schopnost fúzovaných buněk indukovat cytolytickou T-buněčnou aktivitu a lýzu autologních nádorových buněk.
V další Harvardské studii se v roce 2005 [21] zabývali hodnocením úspěšnosti fúze dendritických buněk (DC) a buněk ovariálního karcinomu (OVCA) a hodnotili schopnost těchto fúzovaných buněk stimulovat protinádorovou imunitní odpověď. Nádorové a DC buňky byly izolovány od 22 pacientů s ovariálním karcinomem. V této studii se také zabývali dopadem radiace, zmrazení a tání na fúzované buňky. Závěr studie byl následující: U všech 22 pacientů došlo k úspěšné fúzi nádorových buněk s autologními DC. Vytvořené heterokaryony exprimovaly nádorové antigeny (MUC1, CA 125 a DC odvozené MHC II. třídy a kostimulační molekuly). Fúzované buňky stimulovaly k proliferaci autologní lymfocyty T proti ovariálním nádorovým buňkám. Bylo také zjištěno, že radiace, zmrazení a tání má minimální dopad na stimulační efekt fúzovaných buněk.
Německá skupina [16] do své studie zařadila 8 pacientek s pokročilým maligním gynekologickým nádorem (2 pacientky se sarkomem dělohy a 6 pacientek s ovariálním karcinomem). Pacientky obdržely 3 až 23 vakcín podaných intrakutánně. Šlo o vakcíny s DC pulzovanými autologními nádorovými antigeny. Vzorky nádoru byly získány během primární operace a byly zpracovávány ihned po výkonu nebo zmraženy na -80 °C. Z nádorové masy byly získány lyzáty nádorových buněk. Pacientky obdržely vakcíny v 10denních až 4týdenních intervalech. Obě pacientky s diagnózou sarkomu dělohy a jedna pacientka s ovariálním karcinomem progredovaly a zemřely krátce po obdržení třetí, šesté a osmé vakcíny. U čtvrté pacientky byla zjištěna progrese onemocnění po 4. vakcíně a obdržela 3. linii chemoterapie. U páté pacientky došlo ke stabilizaci onemocnění (stable disease po dobu 45 týdnů). Poté následovala elevace hodnoty na 75 U/ml. MRI stagingem byly odhaleny lokální a vzdálené metastázy. Po cytoredukční reoperaci obdržela pacientka dalších 6 vakcín vytvořených z nádorových lyzátů z posledně excidovaného tumoru. Onemocnění bylo stabilizováno na dalších 23 týdnů. U šesté pacientky přetrvala stabilizace onemocnění 25 týdnů, poté byla zjištěna elevace CA-125 a progrese onemocnění na CT. Pacientka podstoupila cytoredukční reoperaci. Pacientky 7 a 8 měly stabilizované onemocnění bez známek recidivy po dobu 14 resp. 27 týdnů. Pacientky byly po celou dobu imunizovány v pravidelných intervalech, další data nejsou k dispozici. Léčba byla bezpečná, dobře tolerovaná, imunologicky aktivní. Bez závažných nežádoucích účinků. U dvou pacientek se objevila mírná přechodná únava a subfebrilie, které nevyžadovaly žádnou léčbu. U jedné pacientky se objevilo mírné zvětšení lymfatické uzliny. Pět pacientek mělo lehkou kožní reakci ve formě erytému v místě aplikace vakcíny. U žádné z pacientek se neobjevila celková kožní reakce ve formě vyrážky nebo lymfadenopatie. U žádné z pacientek se nerozvinulo autoimunitní onemocnění.
Japonská studie [18] zkoumala skupinu 22 pacientů s odlišnými pokročilými stadii maligního onemocnění. Děvět z těchto 22 pacientů obdrželo kromě DC vakcín (DC/tumor-fusion vaccine) také rekombinantní lidský interleukin 12 (rhIL-12). Cílem studie bylo zjistit, zda vakcinace DC buňkami, které jsou fúzované příslušnými nádorovými buňkami, mohou kromě indukované protinádorové imunitní odpovědi vyvolat nežádoucí autoimunitní reakci. K monitoraci autoimunitní odpovědi sledovali hladiny antinukleárních protilátek (ANA) v séru pacientů. U tří pacientů byly hladiny ANA zvýšené více než třikrát po léčbě. Pacient 1 (karcinom žaludku) a pacient 2 (karcinom prsu) byli imunizováni pouze DC/tumor-fusion vakcínami. Pacientka 3 (karcinom ovaria) obdržela DC/tumor-fusion vakcínu spolu s rhIL-12. U dalších 2 pacientů byla zjištěna elevace ANA méně než třikrát (pacient s karcinomem prsu a kolorektálním karcinomem). Pacientka 3 (ovariální karcinom) obdržela 4 série kombinované imunoterapie (DC/tumor-fusion vaccine + rhIL-12). Pokročilé onemocnění s mnohočetnými metastázami po peritoneu, v lymfatických uzlinách a v játrech bylo udržováno ve stabilizovaném stadiu (stable disease) po dobu 9 měsíců s přechodným snížením hladin CA-125 během imunizace. Pacientka nevykazovala žádné symptomy autoimunitního onemocnění během terapie. U nikoho z léčených pacientů se zvýšenými hladinami ANA nebyly zjištěny symptomy autoimunitního onemocnění. Pacienti se zvýšenými ANA měli signifikantně prodlouženou dobu vhodnou k podávání vakcín ve srovnání s pacienty bez elevace ANA. Zvýšené hladiny ANA po podání DC/tumor-fusion vakcín mohou být asociované se zvýšenou protinádorovou imunitní odpovědí indukovanou vakcinací.
DISKUSE
Buňky ovariálního karcinomu exprimují velké množství TAA (tumor-assiociated antigens) CA-125, HER2/neu a MUC1. Pulzace DC s tumor antigeny reprezentuje vhodnou a široce použitelnou strategii k vyvolání specifické imunitní odpovědi.
Podle výše uvedených studií se jeví aplikace DC vakcín jako bezpečná, proveditelná a klinicky velmi dobře tolerovaná léčebná modalita. Přesto se objevuje, jak ukazují klinické in vivo studie, mnoho nevyřešených otázek a problémů jak s přípravou, tak se samotným podáním DC vakcín. Je třeba optimalizovat klinické protokoly aplikace vakcín, vyhodnotit nejúčinnější zdroj antigenů z nádoru potřebných k pulzaci s DC buňkami – peptidy, proteiny, nukleové kyseliny nebo samotné nádorové buňky? Je třeba optimalizovat nejlepší cestu aplikace vakcíny do těla pacienta (intradermálně?, subkutánně?, intranodálně?). Ze závěru klinických studií však jednoznačně vyplývá, že hlavní zaměření DC vakcinace bude směrováno k pracientům s minimální reziduální nemocí nebo jako další adjuvantní léčebná modalita, neboť tito pacienti vykazují nejlepší léčebné výsledky.
Z uvedených studií také vyplývá, že aplikace DC vakcín neindukuje rozvoj autoimunitního onemocnění navzdory zjištění zvýšených hladin ANA protilátek v krvi pacientů. Tyto výsledky tak podporují tezi o snížení imunitní tolerance a s tím související posílení protinádorové imunity organismu, která však nevede k rozvoji autoimunitního onemocnění.
ZÁVĚR
V současné době se 75–80 % karcinomů ovarií diagnostikuje v pozdních stadiích, tj. ve stadiu III. a IV. (FIGO klasifikace). Jako standardní léčba se v klinické praxi používá radikální operace a následně kombinovaná chemoterapie. U pozdních stadií (stadium III. a IV.) dnes dosáhneme ve více než 70 % případů kompletní klinické remise, ale do 2 let recidivuje z této skupiny více než 50 % žen. Klinické studie s inhibitory angiogeneze zatím prokazují prodloužení disease free intervalu (bezpříznakového období), ale nezlepšují zatím celkové přežití. Velmi zajímavá a atraktivní se jeví myšlenka individualizované péče o pacienty. DC vakcína vyrobená přímo „na míru“ pacientovi z jeho vlastních nádorových buněk získaných buď přímo z primárního nádoru při operaci, nebo např. z ascitu obsahujícího nádorové buňky. DC vakcíny mohou být úspěšnou léčebnou modalitou po intenzivní high-dose chemoterapii, hlavně ve smyslu eliminace reziduální nemoci. Reziduální nemoc je chápána jako klon chemorezistentních maligních buněk, které jsou nejčastější příčinou časné či pozdní recidivy onemocnění. Tyto chemorezistentní maligní buňky nejsou detekovatelné běžnými vyšetřovacími metodami. Biologická léčba ve formě DC vakcíny, která by natrvalo eliminovala tyto buňky popř. by je udržela pod kontrolou imunitního systému je revoluční a velmi slibnou cestou k moderní onkologické léčbě. DC vakcinace by se mohla stát účinnou konsolidační terapií nejen ovariálního karcinomu, ale mnoha dalších onkologických onemocnění.
MUDr. Tomáš Brtnický
Gynekologicko-porodnická klinika
2. LF UK a FN Motol
V Úvalu 84
150 00 Praha 5
Sources
1. Adema, GJ., de Vries, IJ., Punt, CJ., Figdor, CG. Migration of dendritic cell based cancer vaccines: in vivo veritas? Curr Opin Immunol, 2005, 17, p. 170–174.
2. Banchereau, J., Briere, F., Caux, C., et al. Immunobiology of dendritic cells. An Rev Immunol, 2000, 18, p. 767–811.
3. Banchereau, J., Steinman, RM. Dendritic cells and the control of immunity. Nature, 1998, 392, p. 245–252.
4. Barrou, B., Benoit, G., Ouldkaci, M., et al. Vaccination of prostatectomized prostate cancer patients in biochemical relapse, with autologous dendritic cells pulsed with recombinant human PSA. Cancer Immunol Immunother, 2004, 53, p. 453–460.
5. Bonifaz, L., Bonnyay, D., Mahnke, K., et al. Efficient targeting of protein antigen to the dendritic cell receptor DEC-205 in the steady state leads to antigen presentation on major histocompatibility complex class I products and peripheral CD8+ T cell tolerance. J Exp Med, 2002, 196, p. 1627–1638.
6. Boullart, AC., Aarntzen, EH., Verdijk, P., et al. Maturation of monocyte-derived dendritic cells with Toll-like receptor 3 and 7/8 ligands combined with prostaglandin E2 results in high interleukin-12 production and cell migration. Cancer Immunol Immunother, 2008, 57, p. 1589–1597.
7. Brossart, P., Wirths, S., Stuhler, G., et al. Induction of cytotoxic T-lymphocyte responses in vivo after vaccinations with peptide-pulsed dendritic cells. Blood, 2000, 96, p. 3102–3108.
8. Burgdorf, SK., Fischer, A., Claesson, MH., et al. Vaccination with melanoma lysate-pulsed dendritic cells, of patients with advanced colorectal carcinoma: report from a phase I study. J Exp Clin Cancer Res, 2006, 25, p. 201–206.
9. Curti, A., Tosi, P., Comoli, P., et al. Phase I/II clinical trial of sequential subcutaneous and intravenous delivery of dendritic cell vaccination for refractory multiple myeloma using patient-specific tumour idiotype protein or idiotype (VDJ)-derived class I-restricted peptides. Br J Haematol, 2007, 139, p. 415–424.
10. Davis, ID., Jefford, M., Parente, P., Cebon, J. Rational approaches to human cancer immunotherapy. J Leukoc Biol, 2003, 73, p. 3–29.
11. De Vries, IJ., Krooshoop, DJ., Scharenborg, NM., et al. Effective migration of antigen-pulsed dendritic cells to lymph nodes in melanoma patients is determined by their maturation state. Cancer Res, 2003, 63, p. 12–17.
12. Dubsky, P., Hayden, H., Sachet, M., et al. Allogeneic tumor lysate can serve as both antigen source and protein supplementation for dendritic cell culture. Cancer Immunol Immunother, 2008, 57, p. 859–870.
13. Fujii, S., Shimizu, K., Hemmi, H., Steinman, RM. Innate Valpha14(+) natural killer T cells mature dendritic cells, leading to strong adaptive immunity. Immunol Rev, 2007, 220, p. 183–198.
14. Gong, J., et al. Fusion of Human Ovarian Carcinoma Cells with Autologous of Allogenic Dendritic Cells Induce Antitumor Immunity, 2000, 165, p. 1705–1711.
15. Heiser, A., Dahm, P., Yancey, DR., et al. Human dendritic cells transfected with RNA encoding prostate-specific antigen stimulate prostate-specific CTL responses in vitro. J Immunol, 2000, 164, p. 5508–5514.
16. Hernando, JJ., et al. Vaccination with autologous tumor antigen-pulsed dendritic cells in advanced gynaecological malignancies: clinical and immunological evaluation of a phase I trial. Cancer Immunol Immunother, 2002, 51, p. 45–52.
17. Hernando, JJ., et al. Vaccination with dendritic cells transfected with mRNA-encoded folate-receptor-α for relapsed metastatic ovarian cancer, Lancet Oncol, 2007, 8, p. 451–454.
18. Homma, S., et al. Cancer immunotherapy using dendritic/tumor-fusion vaccine induces elevation of serum anti-nuclear antibody with better clinical responses. Clin Exp Immunol, 2006, 144, p. 41–47.
19. Inaba, K., Turley, S., Iyoda, T., et al. The formation of immunogenic major histocompatibility complex class II-peptide ligands in lysosomal compartments of dendritic cells is regulated by inflammatory stimuli. J Exp Med, 2000, 191, p. 927–936.
20. Inaba, K., Young, JW., Steinman, RM. Direct activation of CD8+ cytotoxic T lymphocytes by dendritic cells. J Exp Med, 1987, 166, p. 182–194.
21. Koido, S., et al. Assessment of fusion cells from patient-derived ovarian carcinoma cells and dendritic cells as a vaccine for clinical use. Gynecol Oncol, 2005, 99, p. 462–471.
22. Kugler, A., Stuhler, G., Walden, P., et al. Regression of human metastatic renal cell carcinoma after vaccination with tumor cell-dendritic cell hybrids. Nat Med, 2000, 6, p. 332–336.
23. Liu, YJ. Dendritic cell subsets and lineages, and their functions in innate and adaptive immunity. Cell, 2001, 106, p. 259–262.
24. Lu, W., Arraes, LC., Ferreira, WT., Andrieu, JM. Therapeutic dendritic-cell vaccine for chronic HIV-1 infection. Nat Med, 2004, 10, p. 1359–1365.
25. Matzinger, P. An innate sense of danger. Semin Immunol, 1998, 10, p. 399–415.
26. Matzinger, P. Tolerance, danger, and the extended family. Ann Rev Immunol, 1994, 12, p. 991–1045.
27. Medzhitov, R., Preston-Hurlburt, P., Janeway, CA, Jr. A human homologue of the Drosophila Toll protein signals activation of adaptive immunity. Nature, 1997, 388, p. 394–397.
28. Mellman, I., Steinman, RM. Dendritic cells: specialized and regulated antigen processing machines. Cell, 2001, 106, p. 255–258.
29. Murphy, GP., Tjoa, BA., Simmons, SJ., et al. Infusion of dendritic cells pulsed with HLA-A2-specific prostate-specific membrane antigen peptides: a phase II prostate cancer vaccine trial involving patients with hormone-refractory metastatic disease. Prostate, 1999, 38, p. 73–78.
30. Murphy, GP., Tjoa, BA., Simmons, SJ., et al. Phase II prostate cancer vaccine trial: report of a study involving 37 patients with disease recurrence following primary treatment. Prostate, 1999, 39, p. 54–59.
31. Nestle, FO., Alijagic, S., Gilliet, M., et al. Vaccination of melanoma patients with peptide - or tumor lysate-pulsed dendritic cells. Nat Med, 1998, 4, p. 328–332.
32. Niess, JH., Brand, S., Gu, X., et al. CX3CR1-mediated dendritic cell access to the intestinal lumen and bacterial clearance. Science, 2005, 307, p. 254–258
33. Nouri-Shirazi, M., Banchereau, J., Bell, D., et al. Dendritic cells capture killed tumor cells and present their antigens to elicit tumor-specif/ic immune responses. J Immunol, 2000, 165, p. 3797–3803.
34. Palmer, DH., Midgley, RS., Mirza, N., et al. A phase II study of adoptive immunotherapy using dendritic cells pulsed with tumor lysate in patients with hepatocellular carcinoma. Hepatology, 2009, 49, p. 124–132.
35. Romani, N., Reider, D., Heuer, M., et al. Generation of mature dendritic cells from human blood. An improved method with special regard to clinical applicability. J Immunol Methods, 1996, 196, p. 137–151.
36. Rozkova, D., Tiserova, H., Fucikova, J., et al. FOCUS on FOCIS: combined chemo-immunotherapy for the treatment of hormone-refractory metastatic prostate cancer. Clin Immunol, 2009, 131, p. 1–10.
37. Schlienger, K., et at. TRANCE - and CD40 ligand-matured Dendritic Cells Reveal MHC Class I-restricted T Cells Specific for Autologous Tumor in Late-Stage Ovarian Cancer Patients. Clin Cancer Res, 2002, 9, p. 1517–1527.
38. Schuler-Thurner, B., Dieckmann, D., Keikavoussi, P., et al. Mage-3 and influenza-matrix peptide-specific cytotoxic T cells are inducible in terminal stage HLA-A2.1+ melanoma patients by mature monocyte-derived dendritic cells. J Immunol, 2000, 165, p. 3492–3496.
39. Spisek, R., Chevallier, P., Morineau, N., et al. Induction of leukemia-specific cytotoxic response by cross-presentation of late-apoptotic leukemic blasts by autologous dendritic cells of nonleukemic origin. Cancer Res, 2002, 62, p. 2861–2868.
40. Steinman, RM., Cohn, ZA. Identification of a novel cell type in peripheral lymphoid organs of mice. I. Morphology, quantitation, tissue distribution. J Exp Med, 1973, 137, p. 1142–1162.
41. Tarbell, KV., Yamazaki, S., Olson, K., et al. CD25+ CD4+ T cells, expanded with dendritic cells presenting a single autoantigenic peptide, suppress autoimmune diabetes. J Exp Med, 2004, 199, p. 1467–1477.
42. Tarbell, KV., Yamazaki, S., Steinman, RM. The interactions of dendritic cells with antigen-specific, regulatory T cells that suppress autoimmunity. Semin Immunol, 2006, 18, p. 93–102.
43. Thurner, B., Haendle, I., Roder, C., et al. Vaccination with mage-3A1 peptide-pulsed mature, monocyte-derived dendritic cells expands specific cytotoxic T cells and induces regression of some metastases in advanced stage IV melanoma. J Exp Med, 1999, 190, p. 1669–1678.
44. Tjoa, BA., Simmons, SJ., Bowes, VA., et al. Evaluation of phase I/II clinical trials in prostate cancer with dendritic cells and PSMA peptides. Prostate, 1998, 36, p. 39–44.
45. Tjoa, BA., Simmons, SJ., Elgamal, A., et al. Follow-up evaluation of a phase II prostate cancer vaccine trial. Prostate, 1999, 40, p. 125–129.
46. Tobiasova, Z., Pospisilova, D., Miller, AM., et al. In vitro assessment of dendritic cells pulsed with apoptotic tumor cells as a vaccine for ovarian cancer patients. Clin Immunol, 2007, 122, p. 18–27.
47. Verdijk, P., Aarntzen, EH., Lesterhuis, WJ., et al. Limited amounts of dendritic cells migrate into the T-cell area of lymph nodes but have high immune activating potential in melanoma patients. Clin Cancer Res, 2009, 15, p. 2531–2540.
48. Verdijk, P., Aarntzen, EH., Punt, CJ., et al. Maximizing dendritic cell migration in cancer immunotherapy. Expert Opin Biol Ther, 2008, 8, p. 865–874.
49. Young, JW., Steinman, RM. Dendritic cells stimulate primary human cytolytic lymphocyte responses in the absence of CD4+ helper T cells. J Exp Med, 1990, 171, p. 1315–1332.
50. Yu, JS., Wheeler, CJ., Zeltzer, PM., et al. Vaccination of malignant glioma patients with peptide-pulsed dendritic cells elicits systemic cytotoxicity and intracranial T-cell infiltration. Cancer Res, 2001, 61, p. 842–847.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2012 Issue 3
-
All articles in this issue
- Těžké krvácení rok po provedeném císařském řezu při perzistující inkretní placentě
- Souvislost psychosociálních aspektů perinatální péče s některými zákroky a zdravotními komplikacemi v průběhu porodu
- Diagnostika a léčba hyperaktivního močového měchýře v České republice před pěti lety a dnes
- Prevalence anální HPV infekce u žen a její vztah k cervikální HPV infekci
- Aktivní buněčná imunoterapie karcinomu ovaria pomocí dendritických buněk
- Operační postup mini-páskové antiinkontinentní operace AJUST, doporučení a způsoby řešení možných nestandardních situací
- Peripartálna hysterektómia – review
- Trendy operačních vaginálních porodů v Moravskoslezském regionu v letech 2002-2011
- Vliv oxidačního stresu na mužskou plodnost
- Stanovenie expresie p16INK4A mRNA transkriptu v steroch z krčka maternice s rôznymi stupňami cervikálnej dysplázie
- Mapování lymfatik v axile jako možnost prevence lymfedému u pacientek s karcinomem prsu – první výsledky anatomické studie
- Vliv věku rodičky, parity, délky trvání těhotenství a hmotnosti plodu na fetomaternální hemoragii při spontánním porodu
- Laparoskopická rekonštrukčná liečba agenézy cervixu
- Některé aspekty perinatální a mateřské úmrtnosti v Albánii
- Bezpečnost a rizika spojená se screeningem chromozomálních abnormalit během těhotenství
-
Faulty indwelling urinary catheter detection
A defective medical accessory can imitate a typical medical complication
- Czech Gynaecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Vliv oxidačního stresu na mužskou plodnost
- Peripartálna hysterektómia – review
- Vliv věku rodičky, parity, délky trvání těhotenství a hmotnosti plodu na fetomaternální hemoragii při spontánním porodu
- Těžké krvácení rok po provedeném císařském řezu při perzistující inkretní placentě
