Bronchopulmonální sekvestrace
Bronchopulmonary sequestration
Objective:
To describe the case of prenatal diagnosis of bronchopulmonary sequestration and compelete spontaneous antenatal regresion of the lesion.
Design:
Case report and review of the literature.
Setting:
Complex Cancer Center Novy Jicin, Department of Obstetrics and Gynecology Palacky University Hospital Olomouc.
Case report:
We describe the case reports about the complete regression of a quite large bronchopulmonary sequestration during pregnancy.
Conclusion:
Bronchopulmonary sequestration is usually diagnosed in mid-trimester ultrasound fetal anomaly scan. In case of other fetal abnormalities are present the counceling by medical geneticist should be completed. In most cases complete spontaneous antenatal regresion of the lesion occur and the fetal surgery should be considered in adverse prognostic findings until 30 gestational weeks.
Keywords:
bronchopulmonary sequestration, fetal hydrops, fetal therapy
Authors:
J. Bombová 1; M. Lubušký 2
Authors‘ workplace:
Komplexní onkologické centrum, Nový Jičín, primář MUDr. P. Bartoš, Ph. D., MMED
1; Porodnicko-gynekologická klinika LF UP a FN, Olomouc, přednosta prof. MUDr. R. Pilka, Ph. D.
2
Published in:
Ceska Gynekol 2016; 81(4): 289-294
Overview
Cíl práce:
Popsat případ prenatální diagnostiky bronchopulmonární sekvestrace s kompletní spontánní antenatální regresí léze.
Typ studie:
Kazuistika a přehled literatury.
Název a sídlo pracoviště:
Komplexní onkologické centrum Nový Jíčín, Porodnicko-gynenekologická klinika LF UP a FN Olomouc.
Vlastní pozorování:
Je popsána kazuistika kompletní regrese poměrně velkého bronchopulmonálního sekvestru u plodu v průběhu těhotenství.
Závěr:
Bronchopulmonální sekvestrace plodu je obvykle diagnostikována při ultrazvukovém vyšetření ve II. trimestru těhotenství. Jsou-li u plodu přítomny i jiné morfologické abnormality, měla by být doplněna konzultace klinickým genetikem. Ve většině případů může dojít prenatálně ke kompletní spontánní regresi léze. Při prognosticky nepříznivém nálezu by měla být do 30. gestačního týdne zvážena fetální chirurgická intervence.
Klíčová slova:
bronchopulmonální sekvestrace, hydrops plodu, fetální terapie
ÚVOD
Bronchopulmonální sekvestrace (BronchoPulmonary Sequestration – BPS) patří mezi patologické intratorakální struktury plodu. Je to echodenzní masa plicní tkáně, oddělená od normálního plicního cévního zásobení a od komunikace s průduškovým stromem [5]. Sekvestr je zásoben krví ze systémového řečiště, přívodní céva nejčastěji vychází z hrudní nebo břišní aorty [8]. Patologické intratorakální struktury plodu utlačují vyvíjející se plíce a struktury mediastina a mohou vést k plicní hypoplazii a/nebo hydropsu plodu.
ETIOLOGIE
BPS vzniká pravděpodobně jako nadpočetný plicní pupen kaudálně od normálního plicního pupenu [5]. Konkrétní inzult/teratogen odpovědný za vznik této anomálie není znám, ke vzniku malformace ale pravděpodobně dochází již kolem čtvrtého až pátého týdne těhotenství, kdy se zakládají bronchopulmonální pupeny na ventrální stěně předního střeva. Výskyt BPS v populaci se odhaduje na 0,8 až 1,4 % na základě nálezů při resekcích plic [9], přičemž menší asymptomatické léze můžou zůstat nepoznány nejen prenatálně, ale i v postnatálním období [32]. Souvislost BPS s chromozomálními aberacemi plodu nebyla prokázána a nebyl pozorován ani zvýšený familiární výskyt [5].
KLASIFIKACE
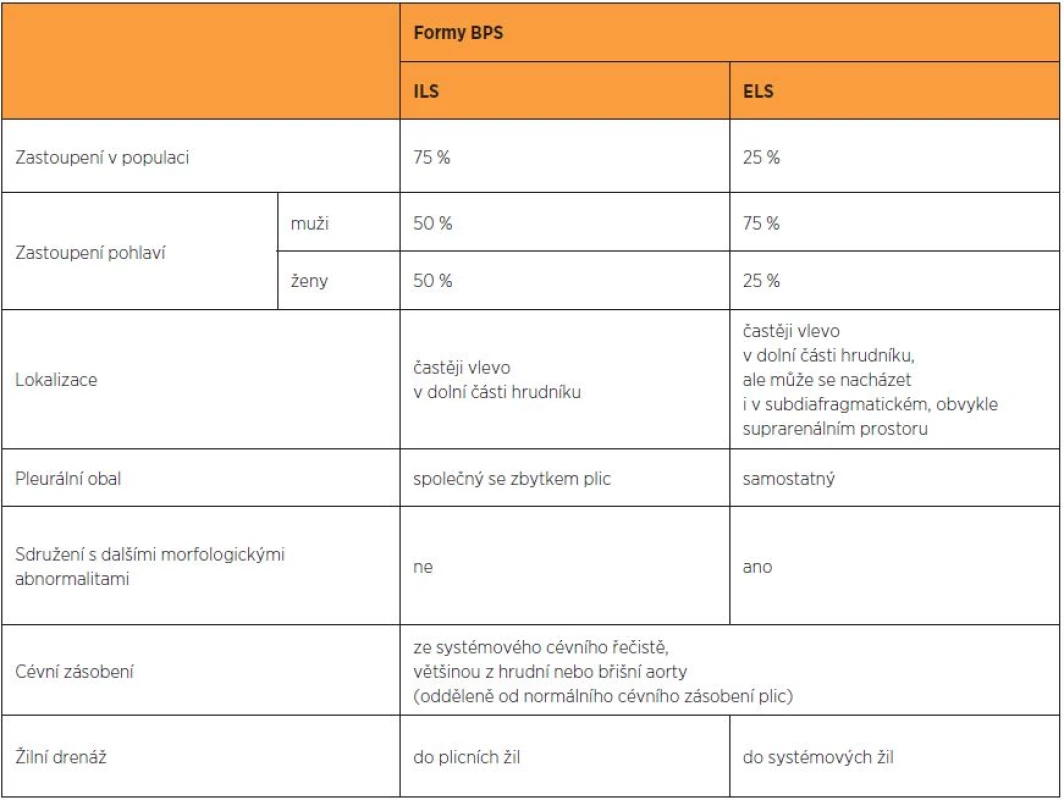
V současné době rozlišujeme dvě formy BPS – intralobární (IntraLobar Sequestration – ILS) a extralobární (ExtraLobar Sequestration – ELS). Intralobární sekvestr sdílí společný pleurální obal se zbytkem plic. Extralobární sekvestr má samostatný pleurální obal [10, 30].
ILS tvoří asi 75 % všech případů BPS [8], lokalizována je častěji vlevo v dolní části hrudníku [7, 8]. Většina autorů uvádí, že ILS má stejné zastoupení u obou pohlaví [1, 3, 8]. ILS většinou nebývá sdružena s dalšími morfologickými abnormalitami u plodu [8].
ELS tvoří 25 % všech případů BPS [8], lokalizována je rovněž častěji vlevo v dolní části hrudníku [7, 8], ale může se nacházet i v subdiafragmatickém, obvykle suprarenálním prostoru (5–10 %), kde může být zaměněna s tumorem nadledviny [24]. ELS se vyskytuje častěji u plodů mužského pohlaví (75 %) [8, 3] a v 15–60 % případů bývá sdružena s dalšími morfologickými abnormalitami u plodu [8]. Sdružené morfologické abnormality zahrnují vrozenou brániční kýlu, srdeční vady, zdvojení žaludku a střeva, anomálie krční páteře a atrézii průdušek [8]. Popsány byly také deformace hrudní stěny, obratlů a pectus excavatus [13, 29, 33].
Odkysličená krev z ILS je obvykle drénována do plicních žil, z ELS do systémových žil (v. azygos, v. cava nebo v. portae). Rozlišení ELS a ILS prenatálně při ultrazvukovém vyšetření a pomocí dopplerovského zobrazení cévního zásobení je však nesnadné, pokud se nejedná o subdiafragmatickou lokalizaci ELS [4, 5, 12].
Odlišení jednotlivých forem BPS přehledně zobrazuje tabulka 1.
DIAGNÓZA
BPS je většinou diagnostikována při ultrazvukovém vyšetření ve 20.–22. týdnu těhotenství při podrobném hodnocení morfologie plodu. Vypadá jako homogenní, echogenní masa plicní tkáně. Zvýšená echogenita je výsledkem mnohočetných odrazů od rozhraní stěn dilatovaných bronchiolů [8, 20].
Vyšetřovací metody, které lze využít k upřesnění diagnózy u plodu
1. Ultrazvukové vyšetření
Nález homogenní, echogenní masy v hrudníku plodu. V 80 % případů je BPS lokalizována vlevo. Sledujeme velikost léze a hodnotíme přítomnost/nepřítomnost hydrotoraxu, povšechného hydropsu, dislokaci mediastina a přítomnost zvýšeného množství plodové vody [7, 18]. K potvrzení diagnózy lze využít i dopplerovské zobrazení, které umožní vizualizovat samostatné systémové cévní zásobení [15, 19]. Přívodná céva nejčastěji vychází z hrudní nebo břišní aorty, ale byly popsány i případy, kdy přívodná céva odstupovala z lienální nebo gastrické tepny [8].
2. Specializované ultrazvukové vyšetření srdce plodu dětským kardiologem
3. Magnetická rezonance
V nejasných případech může upřesnit ultrazvukový nález.
4. Cytogenetické vyšetření
Jsou-li u plodu přítomny další morfologické abnormality, je vhodné stanovit karyotyp plodu a vyloučit chromozomální aberaci.
DIFERENCIÁLNÍ DIAGNÓZA
Diferenciálně diagnosticky je potřeba vyloučit jiné morfologické abnormality v hrudníku plodu. Původ patologických intratorakálních struktur může být pulmonální, gastrointestinální nebo mediastinální [8].
Intaktní bránice a normální rozložení břišních orgánů plodu odliší vrozenou brániční kýlu s přesunem břišních orgánů do oblasti hrudníku plodu.
Pulmonální původ má cystická adenomatoidní plicní malformace (Congenital Cystic Adenomatoid Malformation – CCAM). Rozlišujeme tři typy CCAM: typ I – makrocystický s cystami o velikosti 2 až 10 cm, typ II – se středně velkými cystami a typ III – mikrocystický. CCAM se odlišuje od bronchopulmonální sekvestrace tím, že je zásobována z normální plicní cirkulace. CCAM typ I a II má charakteristický cystický vzhled, typ III je však svou echogenitou podobný bronchopulmonálnímu sekvestru.
Ve fetálním hrudníku se může vyskytovat rovněž mediastinální teratom [26], který má ale obvykle vyšší echogenitu a akustický stín [17].
ELS v subdiafragmatické lokalizaci může svým vzhledem působit jako abdominální masa a je možná záměna za neuroblastom nebo mezoblastický nefrom [18].
PROGNÓZA
Prognóza závisí na více faktorech. BPS menšího rozsahu nemusí způsobovat plodu v průběhu celého těhotenství žádné potíže, může spontánně regredovat nebo je jen sledována a event. řešena postnatálně. Je-li nález většího rozsahu, je závažnější a může plod ohrožovat již prenatálně. Může vést k nitroděložnímu úmrtí nebo postnatálně u novorozence způsobit závažnou respirační insuficienci nebo kongestivní srdeční selhání [22]. Podle závažnosti nálezu a gestačního stáří se zvažuje fetální chirurgická intervence. Ke špatným prognostickým známkám patří: větší velikost léze, progresivní nárůst, velký pleurální výpotek, povšechný hydrops plodu, větší množství plodové vody a další morfologické abnormality [7, 8, 21]. Důležitým prognostickým faktorem je rovněž stupeň útlaku sousedící části plic a srdce [9]. Rozhodující bývá stupeň plicní hypoplazie. Příčinou hydropsu plodu je pravděpodobně omezení srdečního žilního návratu a zvýšení centrálního žilního tlaku při posunu mediastinálních struktur. Pokud dojde ke kompresi jícnu, což znemožňuje polykání, rozvíjí se polyhydramnion [8]. Příležitostně může být u plodu přítomen i hydrotorax. Příčinou hydrotoraxu může být torze stopky, kterou je plicní sekvestr připojen k plíci, mediastinu nebo bránici a velký hydrotorax může způsobit posun i útlak mediastinálních struktur [5, 8].
LÉČBA
Při progresi nálezu po 30. gestačním týdnu by mělo být zváženo předčasné ukončení těhotenství a nitroděložní léčba není indikována. Před 30. gestačním týdnem lze zvažovat chirurgickou fetální intervenci [5]. Fetální hydrotorax výrazně zvyšuje riziko hypoplazie plic. Menší se může v průběhu těhotenství vstřebat, velký a bilaterální výpotek s počínajícím hydropsem plodu je naopak důvodem k chirurgické fetální intervenci – punkci výpotku nebo zavedení torakoamniální drenáže [8]. Výpotek se rovněž může punktovat těsně před porodem ke zlepšení ventilace novorozence, postnatálně se výpotek léčí dny až týdny trvající hrudní drenáží [6, 27, 31].
Moderní metodou prenatální intervence k zástavě růstu sekvestru je laserová ablace. Jedná se o minimálně invazivní fetální zásah, kdy je malá jehla vložena do BPS a laserový paprsek je zacílen na abnormální krevní cévu zásobující BPS. Cílem operace je zvrátit proces, kdy rostoucí BPS zapříčiňuje srdeční selhání plodu. Po uzavření přívodné cévy přestane BPS růst a postupně zmenšuje svoji velikost [24].
V nejnovějších publikacích vyznívá srovnání léčby zavedením torakoamniální drenáže a laserové ablace ve prospěch laserové ablace. Ve stadiu těžkého pleurálního výpotku, dislokace mediastina, event. počínajícího povšechného hydropsu, vedla léčba laserovou ablací ve 100 % případů k regresi léze (20 % částečná, 80 % úplná regrese), vymizení hydrotoraxu i hydropsu a snížení potřeby chirurgického odstranění sekvestru po porodu. Žádný z novorozenců nepotřeboval ventilaci nebo mimotělní membránovou oxygenaci (Extracorporeal Membrane Oxygenation – ECMO). Naproti tomu po zavedení drenáže byla regrese výrazně méně častá, gestační stáří při porodu výrazně nižší a po této intervenci častěji docházelo k předčasnému odtoku plodové vody (Preterm Premature Rupture of Membranes (PPROM) [25].
Otevřená fetální operace s operačním vyjmutím sekvestru z plodu je dnes již obsolentní metodou. Principem bylo operační otevření dělohy, následně hrudníku plodu a odstranění BPS. Děloha se poté uzavřela [25].
Pokud fetální intervence není nutná, je dítě vyšetřeno a podle potřeby léčeno po porodu. Většinu plodů s malou BPS je možno porodit vaginálně, děti nemusí mít dechové potíže a v průběhu života jsou sledovány ambulantně u pediatra, který určí, jestli a kdy má být sekvestr chirurgicky odstraněn. Většinou se operuje v průběhu prvního roku života dítěte [5].
U dospělých pacientů a větších dětí se nediagnostikovaná BPS může projevit jako recidivující infekce dýchacích cest nebo dechové obtíže (kašel, hemoptýza, bolesti na hrudi) napodobující jiné nemoci (bronchiální astma, obstrukční plicní nemoc, zápal plic, intersticiální plicní procesy). Může však být i zcela náhodným nálezem například při vyšetření výpočetní tomografií. Angiografie upřesní cévní zásobení sekvestru [32].
Novorozenci se středně velkou BPS mohou mít po narození respirační potíže a vyžadují podání kyslíku. Komplikován může být rovněž příjem potravy a v některých případech musí být novorozenci hospitalizováni na jednotce intenzivní péče do stabilizace stavu nebo vykonání chirurgického zákroku [3, 5, 8]. Proto je snaha předvídat postnatální průběh již prenatálně. V literatuře se popisuje rovněž metoda EXIT [3], kdy v nezávažnějších prognostických případech porod probíhá císařským řezem v celkové anestezii a vyšetření plodu event. dekompresní operace jsou provedeny ihned po porodu ještě před přerušením pupečníku a odloučením placenty. Zálohou pro případ, že plíce potřebují delší dobu na dosažení optimální funkce, je mimotělní membránová oxygenace [25].
VLASTNÍ POZOROVÁNÍ
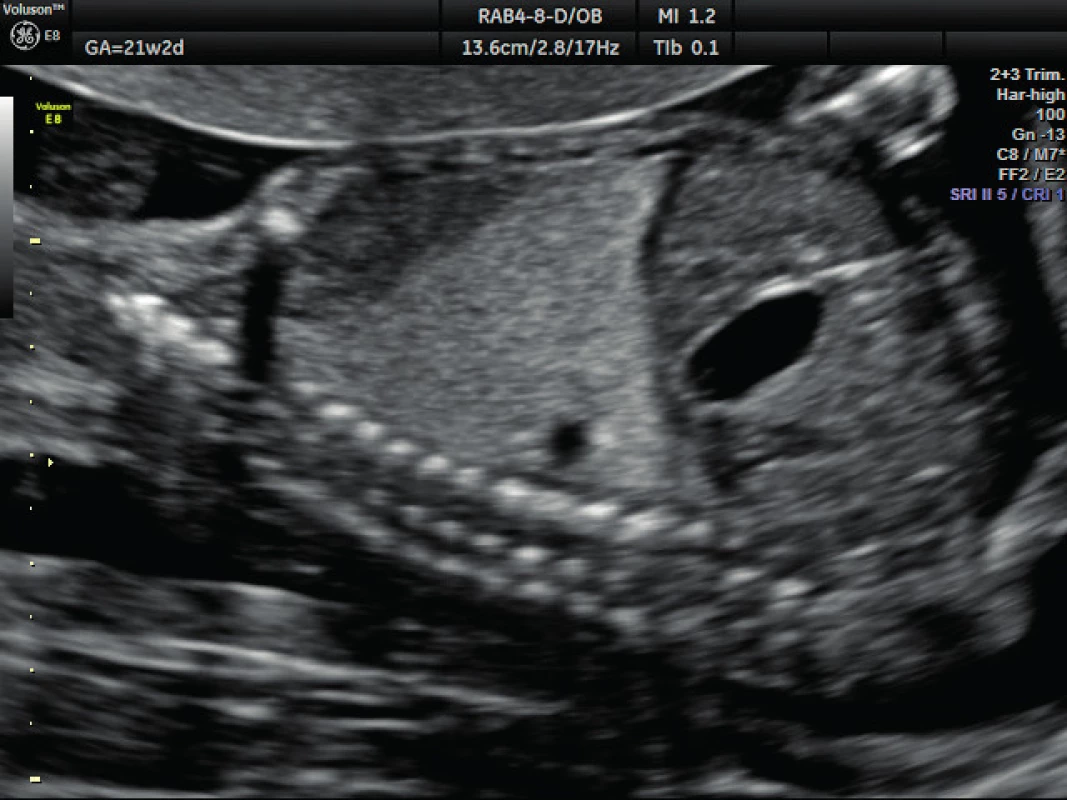
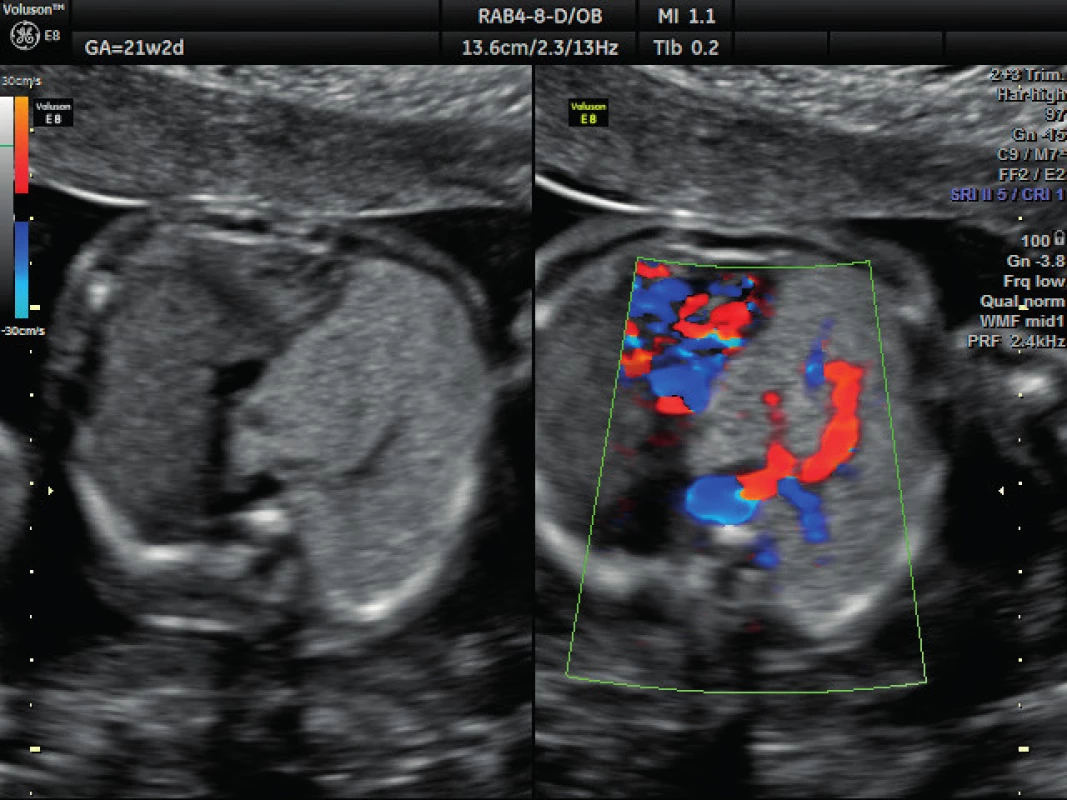
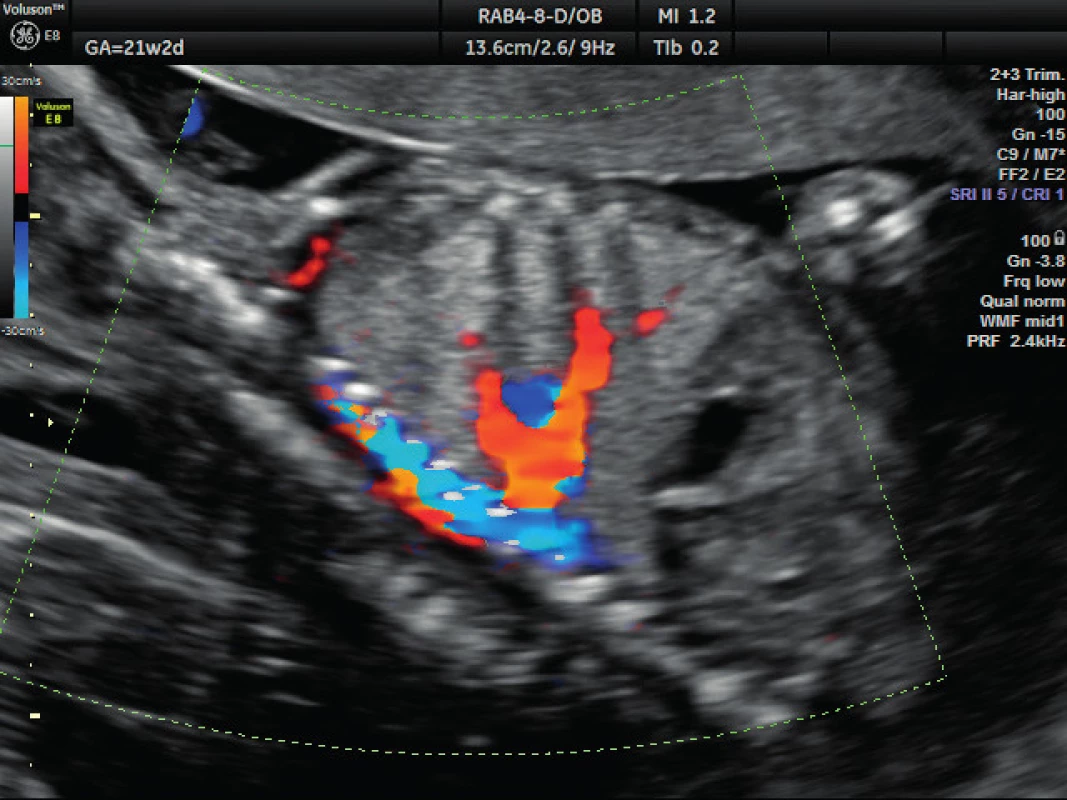
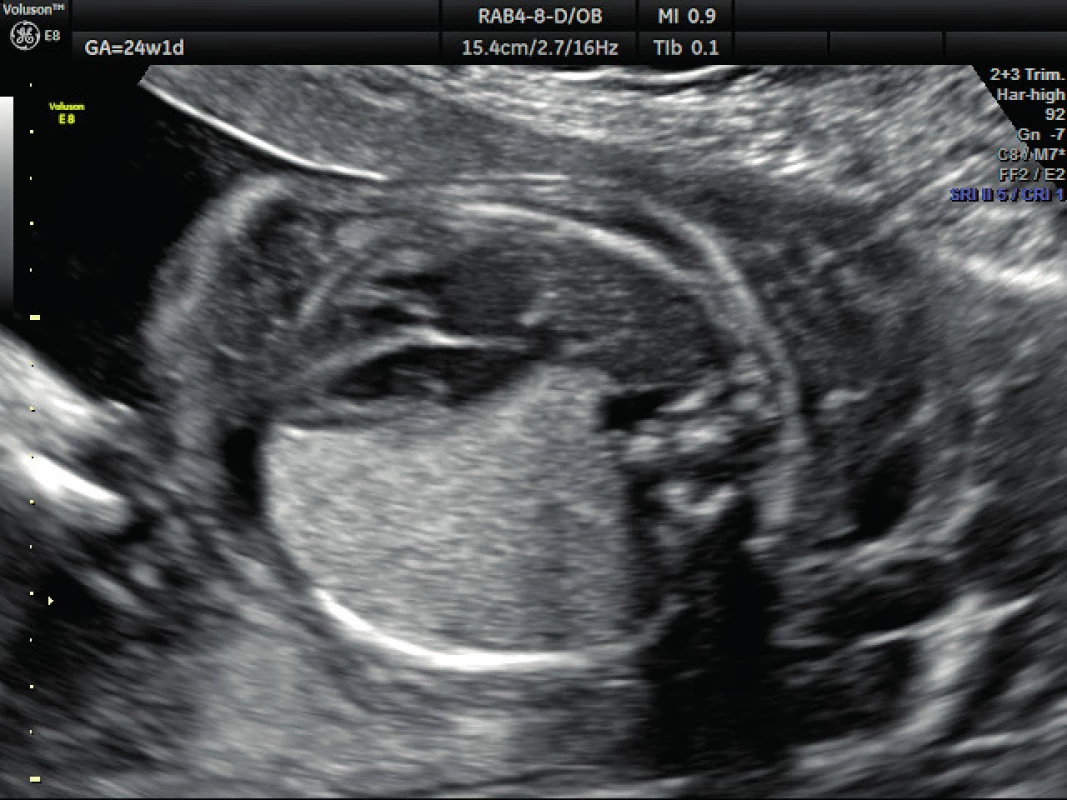
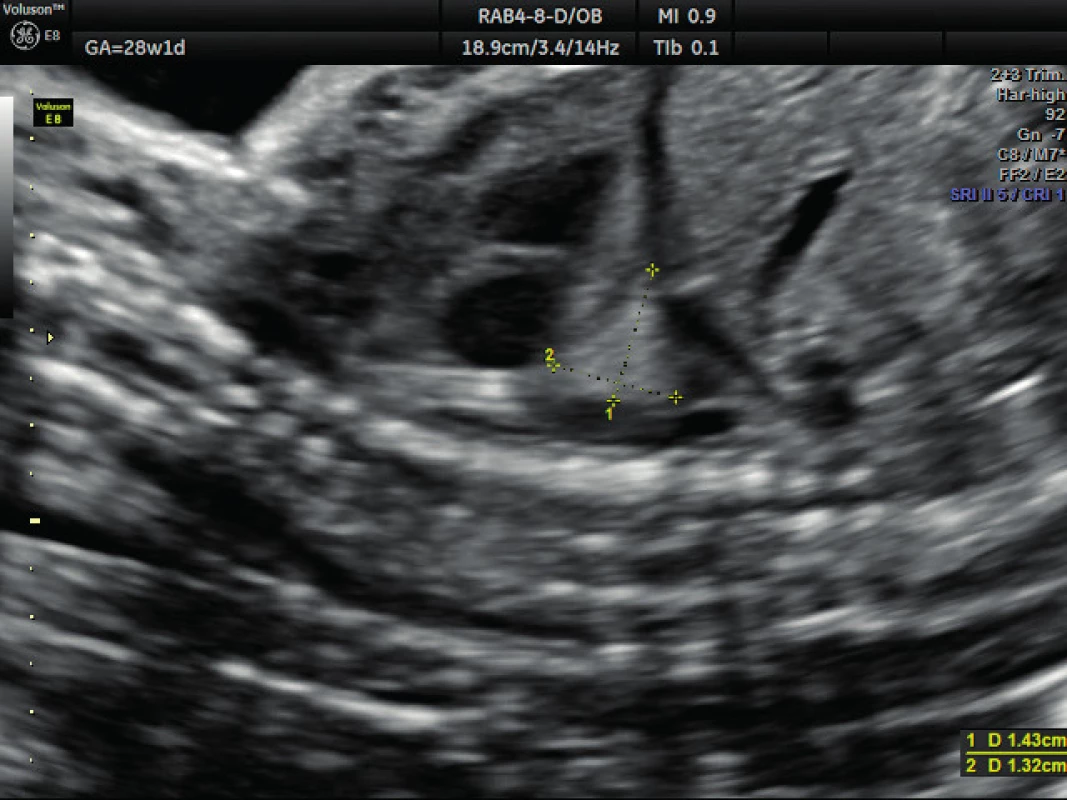
Pacientka ve věku 34 let, III. para, v I. trimestru těhotenství proveden kombinovaný screening s normálním nálezem, ve 21. týdnu těhotenství při ultrazvukovém vyšetření a podrobném hodnocení morfologie plodu diagnostikován abnormální nález v hrudníku plodu (levá kaudální část hemitoraxu je vyplněna hyperechogenním útvarem, viz obrázek 1. Při dopplerovském zobrazení přítomna aberantní přívodná céva odstupující z descendentní aorty, viz obrázky 2 a 3. Přítomna rovněž dextrokardie, levá kaudální část hemitoraxu je vyplněna trojúhelníkovým útvarem o velikosti 3–4 cm, hydrotorax ani další morfologické abnormality u plodu nejsou přítomny. Stanovena diagnóza BPS. Při ultrazvukovém vyšetření ve 24. týdnu nález prakticky beze změny, viz obrázek 4, ve 28. týdnu výrazná regrese nálezu, viz obrázek 5. Ve 35. týdnu je při ultrazvukovém vyšetření zjištěn již prakticky normální nález, došlo ke kompletní spontánní regresi sekvestru. Porod byl veden vaginálně ve 40. týdnu, porozen plod ženského pohlaví, 4110 g a 52 cm. Porod proběhl bez komplikací, novorozenec bez potíží s adaptací, při rentgenovém vyšetření plic normální nález.
DISKUSE
Přínos fetální chirurgické intervence u plodů bez významného útlaku a dislokace okolních struktur nebo přítomnosti hydrotoraxu a povšechného hydropsu je vzhledem k možnosti spontánní regrese diskutabilní. U dobře kompenzovaných plodů bez hydropsu je proto doporučována pravidelná observace a sledování vývoje. V literatuře se uvádí výskyt spontánní regrese patologických intratorakálních struktur u plodu až v 50 % případů, spontánní regrese se vyskytují jak u BPS, tak i u CCAM [8]. Opakovaně byly popsány případy spontánního zmenšení velkých lézí, a to i v případě, že způsobovaly útlak mediastina [23]. V literatuře jsou uváděny různé mechanismy vedoucí ke spontánní regresi sekvestru, například torze cévní stopky [28] nebo involuce sekvestru při relativně nedostatečném cévním zásobení následkem růstu plodu v průběhu těhotenství [2].
ZÁVĚR
Bronchopulmonální sekvestrace plodu je obvykle diagnostikována při ultrazvukovém vyšetření ve 20. až 22. týdnu těhotenství při podrobném hodnocení morfologie plodu. Pro upřesnění diagnózy je vhodné doplnit dopplerovské zobrazení aberantní přívodné cévy ze systémového řečiště. Nejsou-li u plodu přítomny jiné vrozené vady, nejedná se o indikaci k umělému přerušení těhotenství po uplynutí 12 týdnů délky těhotenství. Jsou-li u plodu přítomny i jiné morfologické abnormality, měla by být doplněna konzultace klinickým genetikem. Ve většině případů může dojít prenatálně ke kompletní spontánní regresi léze. Při prognosticky nepříznivém nálezu by měla být do 30. gestačního týdne zvážena fetální chirurgická intervence. Porod by měl být veden v perinatologickém centru.
MUDr. Jana Bombová
Gynekologicko-porodnické oddělení Komplexního onkologického centra Nový Jičín
Purkyňova 2138/16
Nový Jičín 741 01
e-mail: spanikova.jana@zoznam.sk
Sources
1. Abbey, P., Das, CJ., Pangey, GS., et al. Imaging in bronchopulmonary sequestration. J Med Imaging Radiat Oncol, 2009, p. 53.
2. Adzick, NS., Harrison, MR., Flake, AW., et al. Fetal lung lesions: management and outcome. Am J Obstet Gynecol, 1994, p. 170–399.
3. Azizkhan, RG., Crombleholme, TM. Congenital cystic lung disease: Contemporary antenatal and postnatal management. Pediatr Surg Int, 2008, p. 643–644, 651–652.
4. Baumann, H., Kiskinen, P., Hirsh, A. Prenatal ultrasonographic findings in extralobar subdiaphragmatic lung sequestration: A case report. J Perinatol, 1988, 16, p. 67–69.
5. Bianchi, DW., Crombleholme, TM., D´Alton, ME. Fetology: Diagnosis and managment of fetal patient. New York: McGraw-Hill Profesional, 2000, 36, p. 233–234.
6. Blott, M., Nicolaides, KH., Greenough, A. Pleuroamniotic shunting for decompression of fetal pleural effusions. Obstet Gynecol, 1988, 71, p. 768.
7. Boiskin, J., Brenner, JP., Jeanty, P. Lung extralobar intrathoracic sequestration, torsion. Fetus, 1991, 1, p. 74–85.
8. Calda, P., Břešťák, M., Fischerová, D. Ultrazvuková diagnostika v těhotenství a gynekologii. 2. ed. Praha, Aprofema, 2010, s. 229–238.
9. Carter, R. Pulmonary sequestration. Ann Thorac Surg, 7, 1969, p. 68–88.
10. Collin, P., Desjardins, JG., Khan, AH. Pulmonary sequestration. Pediatr Surg, 22, 1987, p. 750–753.
11. Cruz-Martinez, R., Méndez, A., Dueñas-Riaño, J., et al. Fetal laser surgery prevents fetal death and avoids the need for neonatal sequestrectomy in CASE with bronchopulmonary sequestration. Ultrasound Obstet Gynecol, 2015, p. 627.
12. Davies, RP., Ford, A., Lequesne, GW., et al. Ultrasonic detection of subdiaphragmatic pulmonary sequestration in utero and postnatal diagnosis by fine needle aspiration biopsy. J Ultrasound Med, 1989, 8, p. 47.
13. De Lorimer, AA. Congenital malformations and neonatal problems of the respiratory tract. Pediatric surgery, 1986, Year Book Medical, Chicago, p. 631.
14. Dolkhart, L., Reimer, F., Helmuth, W., et al. Antenatal diagnosis of pulmonary sequestration: a review. Obstet Gynecol Surg, 1992, 47, p. 515–520.
15. Eisenberg, P., Cohen, HL., Coren, C. Color Doppler in pulmonary sequestration diagnosis. J Ultrasound Med, 1992, 12, p. 179–183.
16. Epelman, M., Kreiger, PA., Servaes, S., et al. Current imaging of prenatally diagnose congenital lung lesions. Semin Ultrasound CT MR, 2010, p. 141.
17. Golladay, ES., Mollitt, DL. Surgically correctable hydrops. J Pediatr Surg, 1984, 19, p. 59–63.
18. Gross, GJ., Saucy, P., Martin DJ., et al. Extrathoracic pulmonary sequestration detected by antenatal ultrasonography. Pediatr Surg Int, 1992, 7, p. 382–383.
19. Heranz-Schulman, M., Stin, IM., Neblett, WW., et al. Pulmonary sequestration: with color flow sonography and a new theory of associated hydrothorax. Radiology, 1991, 180, p. 817 – 821.
20. Jaffe, MN., Bank, ER., Silver, RN., et al. Pulmonary sequestration: ultrasonic appearance. J Clin Ultrasound, 1982, 10, p. 294–296.
21. Kritstoffersen, SE., Ipsen, L. Ultrasonic real-time diagnosis of hydrothorax before delivery in an infant with extralobar lung sequestration. Acta Obstet Gynecol Scand, 1984, 63, p. 723.
22. Landing, BH. Congenital malformations and genetic disorders of respiratory, ATS J, American review of respiratory disease, Tract, 1979, 120.
23. MacGillivray, TE., Adzick, NS., Harrison, MR. Disappearing fetal lung lesions. J Pediatr Surg, 1993, 28, p. 1321–1325.
24. Maki, E., Oh, K., Rogers, S., Sohaey, R. Imaging and differential diagnosis of suprarenal masses in the fetus. J Ultrasound Med, 2014, p. 895.
25. Mallmann, MR., Geipel, A., Bludau, M., et al. Bronchopulmonary sequestration with massive pleural effusion: pleuroamniotic shunting vs intrafetal vascular laser ablation. Ultrasound Obstet Gynecol, 2014, p. 441, 443.
26. Morin L, Crombleholme, TM., Louis, F., et al. Bronchopulmonary sequestration: prenatal diagnosis with clinicopathologic correlation. Curr Opin Obstet Gynecol, 1994, 6, p. 479–481.
27. Rodeck, CH., Fisk, NM., Fraser, DI., et al. Long-term in utero drainage of fetal hydrothorax. N Engl J Med, 1988, p. 1135.
28. Rodgers, BM., Harmon, PK., Johnson, AM. Bronchopulmonary foregut malformations: The spectrum of anomalies. Ann Surg, 1986, p. 517–524.
29. Ryckman, FC., Rosenkrantz, JG. Thoracic surgical problems in infancy and childhood 1985. Surg Clin North Am, 65, p. 1423–1454.
30. Savic, B., Birtel, FJ., Thalen, W., et al. Lung sequestration: report of seven CASE and review of 540 published CASE. Torax, 1979, 34, p. 96.
31. Seeeds, JW., Bowes, WA. Results of treatment of severe fetal hydrothorax with bilateral pleuroamniotic catheters. Obstet Gynecol, 1986, 68, p. 577.
32. Tashtoush, B., Memarpour, R., Gonzalez, J., et al. Pulmonary sequestration: A 29 patient case series and review. J Clin Diagnostic Res, 2015, 9, AC05–AC08.
33. Wesley, JR., Heidelberger, KP., DiPietro, MA., et al. Diagnosis and managment of congenital cystic disease of the lung in children. J Pediater Sur., 1986, 21, p. 202–207.
34. http://search.kuleuven.be/Paginas/results.aspx?k=Jan%20Deprest
35. http://search.kuleuven.be/Paginas/results.aspx?k=fetal%20
37. http://www.sequestrationuptodate.com/contents/prenatal-diagnosis-and-management-of-bronchopulmonary-sequestration
38. http://www.uptodate.com/contents/prenatal-diagnosis-and-management-of-bronchopulmonary-sequestration
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2016 Issue 4
-
All articles in this issue
- Porovnanie perinatálnej mortality v Slovenskej republike v rokoch 2007–2009 a v rokoch 2010–2012
- Technika pánevní a paraaortální lymfadenektomie
- Současné možnosti ultrazvukové diagnostiky v urogynekologii
- Využití poměru koncentrací solubilního receptoru tyrozinkinázového typu 1 a placentárního růstového faktoru pro krátkodobou predikci a diagnostiku preeklampsie
- Závažná imunitní trombocytopenie diagnostikovaná v graviditě
- Infarkt myokardu v graviditě
- Septický šok v těhotenství na podkladě akutní pyelonefritidy
- Bronchopulmonální sekvestrace
- Hemangioblastom mozečku v těhotenství
- Aloimunitní trombocytopenie plodu u těhotné ženy s protilátkami anti-HPA-1a
- Možnosti užití selektivních modulátorů progesteronových receptorů v léčbě děložních myomů
- Praha, místo, kde byl proveden první císařský řez, kdy přežila současně matka i dítě?
- Czech Gynaecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Technika pánevní a paraaortální lymfadenektomie
- Praha, místo, kde byl proveden první císařský řez, kdy přežila současně matka i dítě?
- Současné možnosti ultrazvukové diagnostiky v urogynekologii
- Aloimunitní trombocytopenie plodu u těhotné ženy s protilátkami anti-HPA-1a
