Technika pánevní a paraaortální lymfadenektomie
Technique of pelvic and paraaortic lymphadenectomy
Objective:
Overview of classification, anatomical conditions, methods and complications of pelvic and paraaortic lymph-node dissection.
Design:
Review article.
Setting:
Department of Obstetrics and Gynecology, General Faculty Hospital and 1st Medical Faculty, Charles University, Prague.
Materials and methods:
Lymphadenectomy is classified according to its extent into sentinel lymph-node biopsy, debulking, sampling and systematic procedure and according to approach into extraperitoneal or transperitoneal procedure. The most complex variant is systematic pelvic and paraaortic lymph-node dissection, which requires removal of fatty-lymphatic tissue from anatomically strictly defined areas. Procedure can be performed from laparotomy, laparoscopically or robotically.
Results:
The main objective criterium of systematic procedure is the number of harvested nodes. The most common complications comprise bleeding and lymphocele formation.
Conclusions:
Pelvic and paraaortic lymphadenectomy represent basic component of surgical management in majority of gynecological cancers. The knowledge of extent, different techniques and ability to solve complications represents essential skill in gynecological oncology.
Keywords:
sentinel lymph-node biopsy, pelvic lymphadenectomy, paraaortic lymphadenectomy, debulking
Authors:
J. Sláma; R. Kocián
Authors‘ workplace:
Gynekologicko-porodniká klinika VFN a 1. LF UK, Praha, přednosta prof. MUDr. A. Martan, DrSc.
Published in:
Ceska Gynekol 2016; 81(4): 253-264
Overview
Cíl studie:
Přehled klasifikace, anatomických předpokladů, způsobů provedení a komplikací pánevní a paraaortální lymfadenektomie.
Typ studie:
Přehledová práce.
Pracoviště:
Gynekologicko-porodnická klinika VFN a 1. LF UK, Praha.
Materiál a metodika:
Lymfadenektomie je podle rozsahu klasifikována na biopsii sentinelové uzliny, debulking, sampling a systematický výkon a podle přístupu na výkon extraperitoneální nebo transperitoneální. Nejkomplexnější je systematická pánevní a paraaortální lymfadenektomie, která vyžaduje exstirpaci tukově-lymfatické tkáně z anatomicky přesně definovaných oblastí. Výkon lze provést laparotomicky, laparoskopicky nebo roboticky.
Výsledky:
Objektivním kritériem systematického výkonu je počet získaných uzlin. Nejčastější komplikace zahrnují krvácení a tvorbu lymfocyst.
Závěry:
Pánevní a paraaortální lymfadenektomie je základní součástí chirurgického managementu většiny gynekologických malignit. Znalost rozsahu, různých technik a schopnost řešit komplikace představují základní dovednosti v onkogynekologii.
Klíčová slova:
biopsie sentinelové uzliny, pánevní lymfadenektomie, paraaortální lymfadenektomie, debulking
ÚVOD
Hlavní cesta šíření většiny epitelových gynekologických zhoubných nádorů je prostřednictvím lymfatických cév. Zhodnocení stavu regionálních lymfatických uzlin proto hraje zásadní roli v diagnostickém procesu a v plánování další léčby. Informace o stavu lymfatik má navíc signifikantní vliv na prognózu onemocnění, umožňuje indikovat adjuvantní terapii a individualizovat radikalitu chirurgického výkonu. Terapeutický význam systematické pánevní a paraaortální lymfadenektomie je stále předmětem diskusí [2, 13]. Patologické vyšetření chirurgicky odstraněných lymfatických uzlin je zlatým standardem v diagnostice jejich stavu, neboť žádná z dostupných obrazových metod není natolik přesná, aby s jistotou vyloučila jejich metastatické postižení [12]. Systematické odstranění pánevních a paraaortálních uzlin proto patří mezi základní dovednost v onkogynekologii. S tím souvisí i schopnost ošetřit možné komplikace, mezi které patří krvácení z velkých cév, poranění střev, nervových struktur a močových cest.
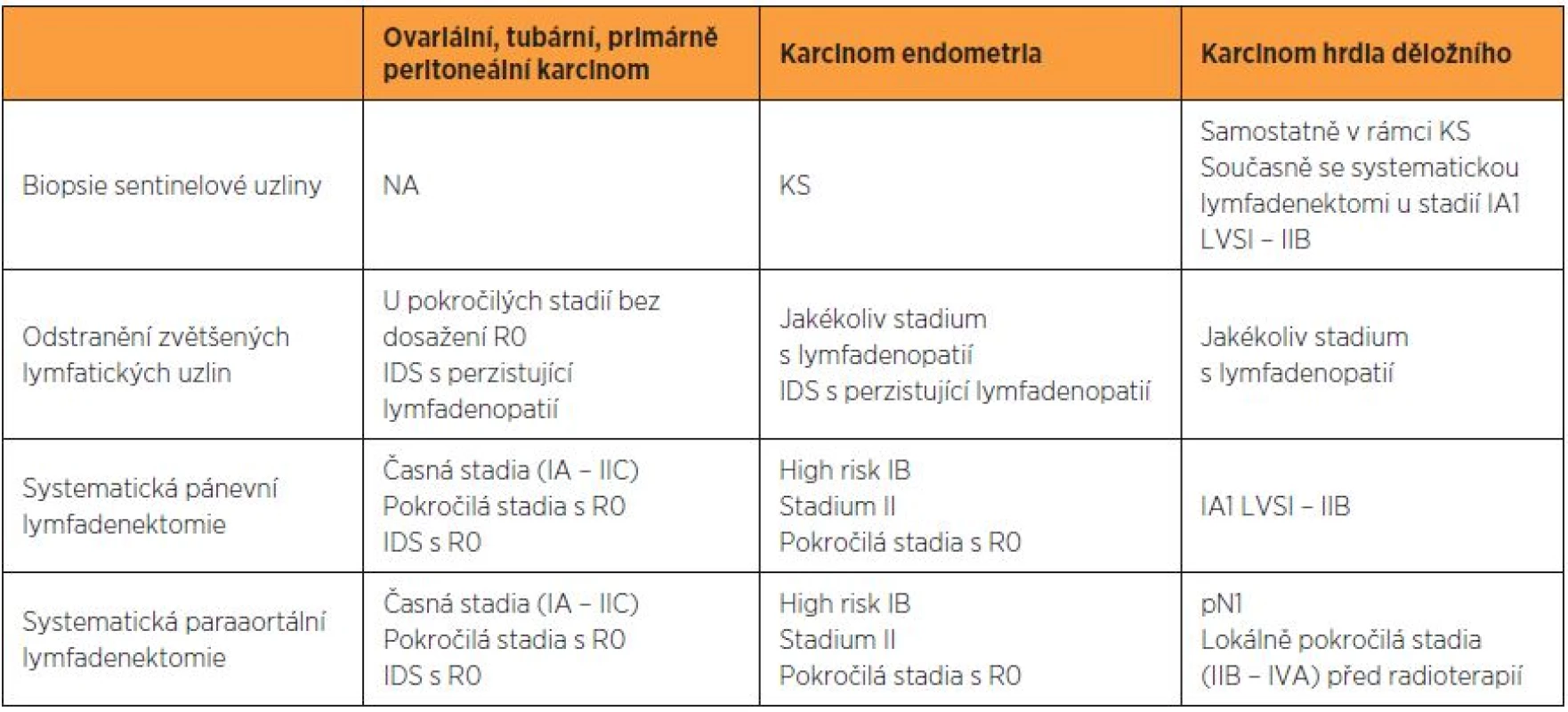
Pánevní a paraortální uzliny jsou první lokalitou metastatického šíření karcinomu endometria, ovariálního, tubárního, primárně peritoneálního karcinomu i germinálních tumorů ovaria. U pacientek s karcinomem děložního hrdla a karcinomem proximální pochvy se nádor nejprve šíří do uzlin pánevních a následně do uzlin paraaortálních. Podobně u karcinomu vulvy se nádor šíří nejdříve do uzlin ingvinálních a následně do uzlin pánevních (tab. 1).
KLASIFIKACE
Podle rozsahu je možno lymfadenektomii rozdělit na několik typů výkonů. Nejméně radikálním je biopsie sentinelové uzliny (SLNB). Tento výkon postihuje jen první spádovou uzlinu [9]. Limitovanou lymfadenektomií je odstranění zvětšených lymfatických uzlin, tzv. uzlinový debulking. Sampling lymfatických uzlin představuje takový výkon, kdy je odstraněno jen omezené množství lymfatických uzlin, náhodný vzorek, obvykle pouze z dobře chirurgicky přístupné lokality. Systematická lymfadenektomie znamená odstranění veškeré tukově-lymfatické tkáně z dané anatomické oblasti, kterou probíhají lymfatika drénující příslušný orgán [1–3, 13].
Pánevní a paraaortální lymfadenektomii lze provést laparotomicky, laparoskopicky, roboticky a to v závislosti na stadiu onemocnění, tělesné konstituci pacientky, dostupném vybavení a chirurgické zkušenosti. Podle anatomicko-chirurgického přístupu je pak pánevní a paraaortální lymfadenektomie klasifikována na transperitoneální a extraperitoneální [2, 8].
ZÁKLADNÍ ANATOMICKÉ SOUVISLOSTI
Aorta vstupuje z hrudníku do dutiny břišní diafragmatickým hiátem a je uložena nalevo od dolní duté žíly. Renální arterie odstupují z aorty v úrovni obratle L2. Pravá arteria renalis obvykle probíhá dorzálně pod vena cava inferior. Renální vény obvykle vstupují do dolní duté žíly v identické úrovni jako renální arterie. Levá vena renalis probíhá před aortou pod odstupem arteria mesenterica superior. Asi 3–4 cm nad bifurkací z aorty odstupuje arteria mesenterica inferior. Distálně od ní, ze zadní stěny aorty párově odstupují lumbální arterie. Bifurkace aorty a dolní duté žíly se nachází ve výši obratlových těl L4–L5. Větví se na komunální ilické cévy, které dále pokračují interilickou bifurkací jako externí a interní ilické cévy. Externí ilické cévy pokračují pod tříselným vazem na stehno jako vasa femoralis. Interní ilická arterie a véna se v pánevním průběhu dále dělí na své viscerální větve. Lymfatické uzliny obklopují velké cévy v celém jejich průběhu a formují jednotlivé uzlinové skupiny drénující pánevní orgány a střevní kličky. Průběh cév může být v pánevní a paraaortální oblasti variabilní a znalost těchto anatomických odchylek je pro nekomplikovaný průběh operačního výkonu důležitá. Zvláště pak variety žilních anastomóz v obturatorních fosách a rozličný průběh a větvení renálních cév. Akcesorní renální arterie vpravo může přebíhat přes dolní dutou žílu ve výši dolního pólu pravé ledviny a zde může být snadno během lymfadenektomie poraněna [2].
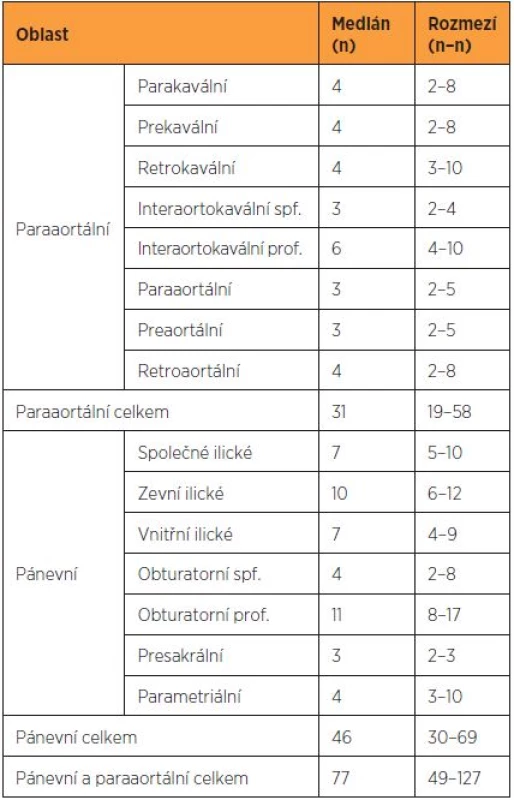
Oblast pánevní lymfadenektomie je anatomicky vymezena kraniálně bifurkací aorty a distální hranici představuje vstup velkých cév do femorálního kanálu, respektive odstup vena circumflexa ilium profunda. Materiál získaný z pánevní lymfadenektomie lze rozdělit do pěti anatomických skupin. Jsou rozeznávány lymfatické uzliny z oblasti externích, interních a komunálních ilických cév. Uzliny z oblasti obturatorní fosy, které jsou průběhem obturatorního nervu dále děleny na supraobturatorní a infraobturatorní. Poslední skupinu představují uzliny presakrální uložené nad kostí křížovou mezi komunálními ilickými žilami. Někteří autoři navíc ještě rozlišují uzliny parametriální a interilické [1, 3].
Oblast paraaortální lymfadenektomie, někdy označovaná jako suprapelvická, je vymezena kraniálně odstupem renálních cév a distálně bifurkací aorty. Lymfatika z této oblasti jsou obvykle dělena na nízkou a vysokou paraaortální oblast. Hranici představuje odstup arteria mesenterica inferior. Ve vztahu k velkým cévám jsou uzlinové skupiny suprapelvické oblasti rozděleny na parakavální, prekavální a retrokavální, uložené vpravo, před a za dolní dutou žilou, uzliny preaortální, paraaortální, retroaortální, uložené před, vlevo a za aortou, a uzliny interaortokavální, uložené mezi dolní dutou žilou a aortou, které jsou dále rozdělovány na hluboké a povrchové s ohledem na průběh lumbálních cév [2, 13].
Lymfatická drenáž pánevních orgánů je značně komplexní a vytváří hustou síť. Lymfatické cévy mají v pánvi četné spojky a rovněž přímá spojení s oblastí parakavální a paraaortální. Chirurgicko-anatomické studie rozlišují dva hlavní pánevní lymfatické kmeny běžící po stranách pánve. Zatímco povrchový probíhá ventrálně nad externími ilickými cévami, přijímá spojky z parametrií a pokračuje ventrálně nad komunálními cévami do interaortokavální a prekavální oblasti, hluboký lymfatický kmen obklopuje obturatorní nerv, získává spojky z parametrií a pokračuje laterálně mezi musculus psoas a velkými cévami. Dělí se dále na dvě větve, první směřuje do oblasti parakavální a paraaortální a druhá pokračuje do oblasti presakrální a kraniálně do oblasti interaortokavální a preaaortální [3].
Mapování lymfatické drenáže se věnovaly zejména studie hodnotící lokalizaci sentinelových uzlin. Největší práce byly provedeny u pacientek s karcinomem děložního hrdla, u kterých byla detekována drenáž především do uzlin v obturatorní fose (35–70 %), následovaná externí ilickou oblastí (5–47 %), společnou ilickou oblastí (5 %), presakrální oblastí (5 %) a mediální částí postranních parametrií (3 %). Lokalizace sentinelové uzliny v oblasti paraaortální a tříselné byla popisována vzácně, s frekvencí 1–4,3 % a 1,9 % [6, 9].
POČET LYMFATICKÝCH UZLIN
Celkový počet získaných a patologem odečtených lymfatických uzlin z pánevní a paraaortální lymfadenektomie je ovlivněn typem a rozsahem výkonu, konstitucí pacientky a kvalitou patologického zpracování. Je hlavním objektivním kritériem hodnotícím rozsah a úplnost chirurgického výkonu. Histopatologické zhodnocení stavu regionálních lymfatických uzlin (pN) je zásadní pro posouzení přítomnosti lymfogenních metastáz. Pro stadium pN0 je podle TNM klasifikace požadováno získání nejméně šesti negativních lymfatických uzlin. V onkogynekologických centrech je běžným standardem trojnásobné množství získaných uzlin a minimální uvedený počet tak odpovídá uzlinovému samplingu, nikoli systematickému výkonu.
V souboru 192 pacientek, které podstoupily radikální operaci pro karcinom děložního hrdla, byl dosažen medián 37 uzlin získaných z pánevní lymfadenektomie (rozmezí 25–104) [1]. V jiné studii věnované systematické paraaortální lymfadenektomii byl medián získaných uzlin 20 s rozmezím 14–41 uzlin (tab. 2) [2]. V případě bilaterální detekce sentinelové uzliny u pacientek s karcinomem děložního hrdla jsou zjišťovány průměrně dvě sentinelové uzliny [4, 9].
TECHNIKA VÝKONŮ
Obecné podmínky
Důležitá je adekvátní předoperační střevní příprava pacientek podstupujících pánevní a paraaortální lymfadenektomii. Skládá se z bezezbytkové diety a z podávání laxativ 48–72 hodin před výkonem. Standardem je aplikace profylaktické dávky antibiotik a antitrombotická profylaxe.
Biopsie sentinelové uzliny
Biopsie sentinelové uzliny s následným histologickým ultrastagingovým vyšetřením představuje nejméně invazivní metodu ke zhodnocení stavu lymfatických uzlin. Negativita sentinelové uzliny by v ideálním případě měla znamenat negativitu všech regionálních lymfatických uzlin. Koncept sentinelové uzliny významně zvyšuje diagnostickou senzitivitu lymfadenektomie a umožňuje detekovat metastázy v méně častých lokalitách. V pánevní a paraaortální oblasti je nadále studován jeho potenciál predikovat negativitu všech regionálních lymfatických uzlin [5, 9]. Recentně publikovaná data ukazují vysokou senzitivitu u časných stadií cervikálního karcinomu, zejména při dosažení oboustranné detekce (tab. 3). Koncept sentinelové uzliny je dále studován u karcinomu endometria, i když metodika značení není dosud zcela standardizovaná a senzitivita není adekvátní.
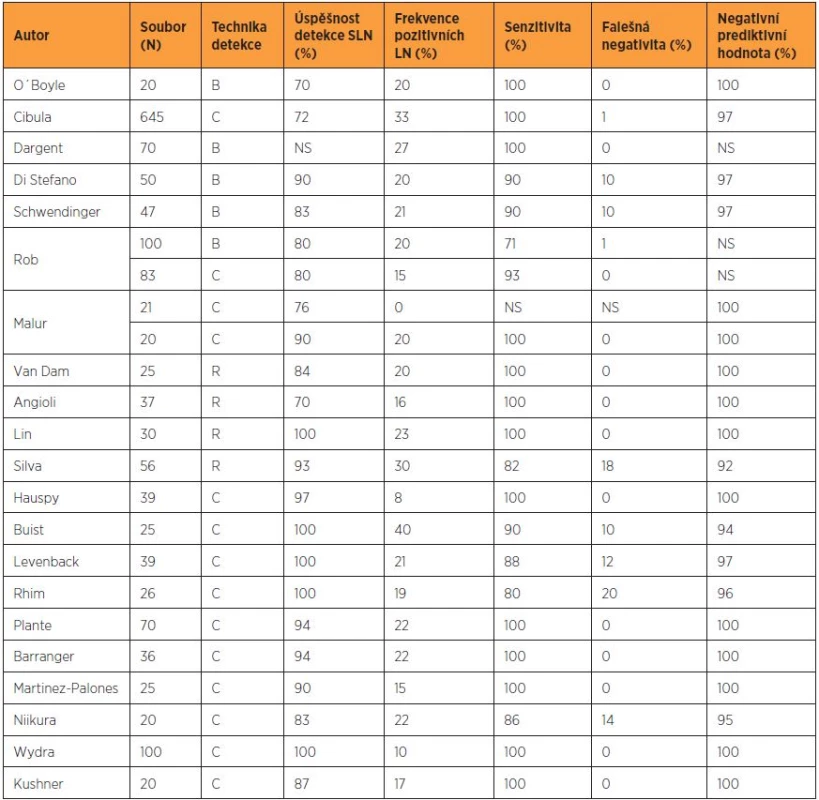
Biopsie sentinelové uzliny může být v pánvi a paraaortálně samostatným operačním výkonem, který má v současnosti využití pouze v kontrolovaných studiích, nebo je integrální součástí systematické lymfadenektomie. Nejprve je nutné sentinelovou uzlinu označit pomocí některé z technik mapování. Standardem je kombinovaná technika značení využívající aplikaci radiokoloidu a patentní modři. Radiokoloid je podle zvyklostí centra aplikován v dlouhém protokolu (den před operací) nebo v krátkém protokolu (přibližně 20 minut před otevřením retroperitonea). Předoperační lymfoscintigrafie není vyžadována, může však pomoci při vyhledávání netypicky lokalizovaných sentinelových uzlin. Modré barvivo je aplikováno peritumorózně těsně před zahájením operačního výkonu. U pacientek s časným stadiem karcinomu děložního hrdla (IA1 LVSI – IB1) nebo s časným karcinomem endometria (IA – IB) je identicky peritumorózně aplikován radiokoloid, a to do každého kvadrantu (na pozici č. 2, 4, 8 a 11) nebo na pozici č. 3 a 9 ektocervixu [4, 9]. V případě lokálně pokročilého tumoru děložního hrdla je nutná aplikace do reziduálního stromatu s přihlédnutím k rozsahu a topografii nádorového postižení. Únik patentní modři nebo radiokoloidu cervikálním kanálem je známkou nesprávného podání do nekrotické části tumoru [12]. Značení sentinelové uzliny u časných stadií karcinomu endometria probíhá rovněž pod hysteroskopickou nebo laparoskopickou kontrolou. Nově zaváděným postupem s vysokou citlivostí je využití fluorescenční detekce se značením pomocí indokyaninové zeleně. Oproti předchozím metodám není aplikace časově limitovaná a metodiku lze s vyšším úspěchem využít i u obézních pacientek.
Při tradičním značení je během operace ostře otevřeno retroperitoneum a pod kontrolou zraku sledovány modře zbarvené lymfatické cévy až k modře zbarveným sentinelovým uzlinám. Simultánně je detekce ověřena gama sondou. Za sentinelovou je považována každá signalizující a/nebo zbarvená lymfatická uzlina. Hodnota signálu snímaného ze sentinelové uzliny by měla být minimálně desetkrát větší ve srovnání s pozadím. Nepřítomnost reziduální radioaktivity potvrzuje detekci a exstirpaci všech sentinelových uzlin. Pokud se ještě před otevřením retroperitonea ihned nedaří detekovat modré lymfatické kolektory, je nutno provést standardním způsobem pečlivou exploraci všech anatomických oblastí. Při fluorescenční detekci je výkon prováděn analogicky za přímé vizuální kontroly.
Transperitoneální paraaortální lymfadenektomie
Transperitoneální přístup je nejčastěji používanou modalitou k provádění paraaortální i pánevní lymfadenektomie [2, 13]. Při laparotomickém přístupu je dutina břišní otevřena xyfopubickým řezem. Při laparoskopickém výkonu je využíván přístup pomocí čtyř nebo pěti trokarů. Kamera je umístěna do pupku a další tři porty rozmístěny do pravého a levého horního kvadrantu a suprapubicky, nebo je trokar pro kameru umístěn suprapubicky a zbylé dva porty rozmístěny v pravém a levém dolním kvadrantu. Alternativou je přístup z jednoho vstupu, tzv. single port technika. Obrazovka je umístěna na pravé straně pacientky v úrovni pravého ramene nebo za hlavou pacientky.
Technika transperitoneální paraaortální lymfadenektomie je identická pro otevřený i minimálně invazivní přístup. Pacientka je umístěna do Trendelenburgovy pozice a operatér stojí na levé straně. Prvním krokem je otevření retroperitonea nad průběhem velkých cév, obvykle z jednoho řezu v průběhu radixu mezenteria od Treitzova ligamenta do oblasti céka. Někdy mohou pomoci zpřístupnit paraaortální oblast dva další řezy. První v průběhu pravé parakolické fosy kraniálně až do oblasti hepatokolického ligamenta a druhý obdobně v průběhu levé parakolické fosy až do oblasti splenokolického ligamenta. Po mobilizaci a elevaci céka, colon ascendens a duodena je snadno identifikován přední list renální fascie. Tento manévr umožní široký přístup do oblasti retroperitonea. Mobilizované colon ascendens a kličky tenkého střeva jsou následně umístěny mimo operační pole ven z dutiny břišní a zabaleny do teplých vlhkých roušek nebo obdobně odtlačeny laterálně a kraniálně v případě laparoskopického nebo robotického přístupu. Výhodná může být dočasná fixace mezenteria stehem k přední stěně břišní. V této chvíli jsou adekvátně ozřejmeny hranice výkonu – pravá ledvina, levá renální véna, průběhy obou ureterů a oba psoatické svaly.
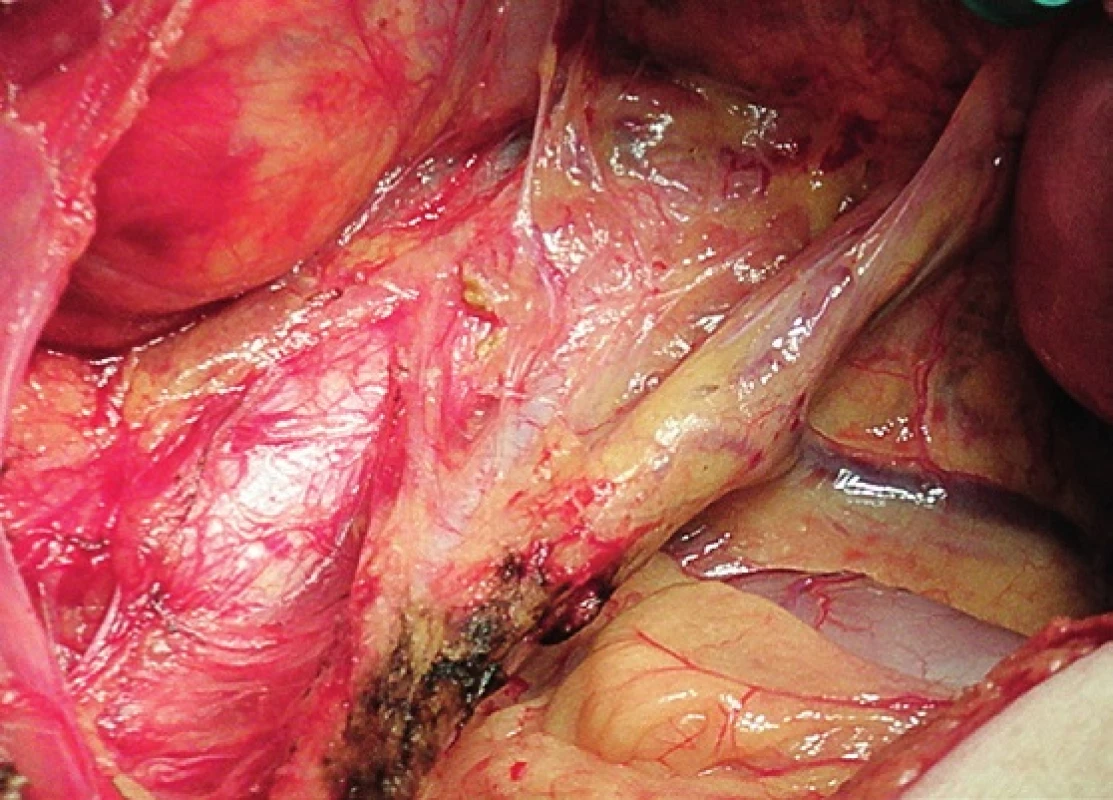
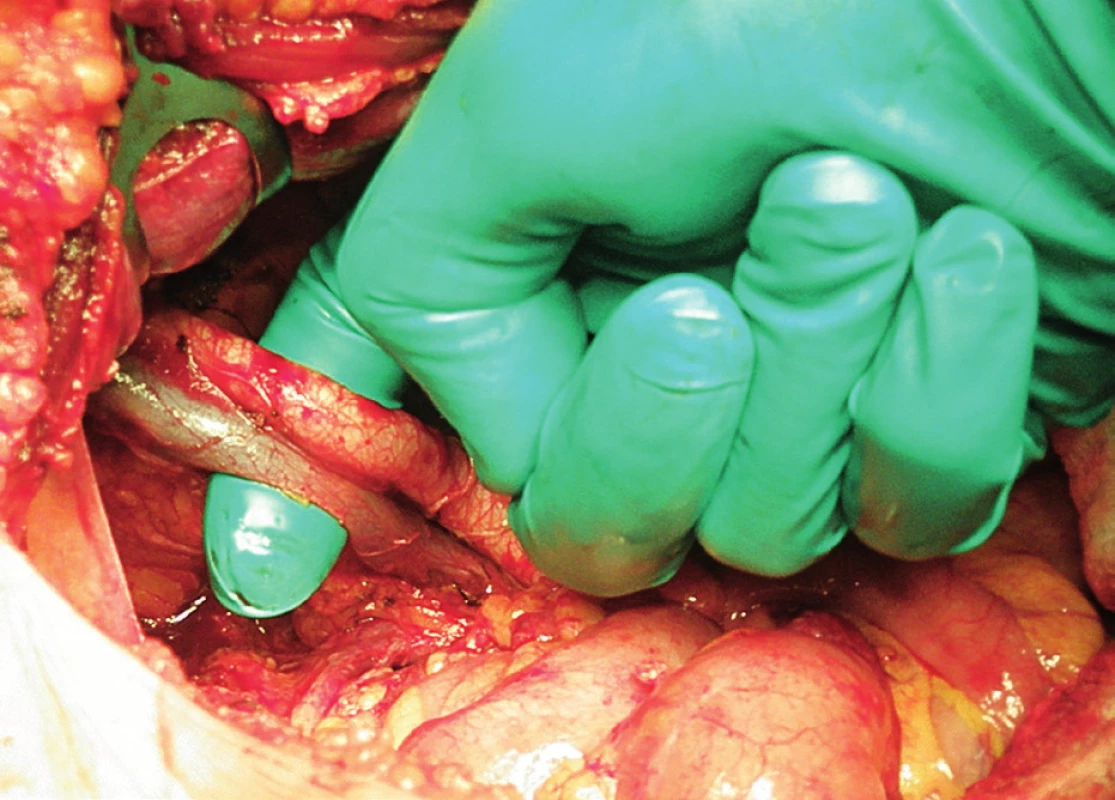
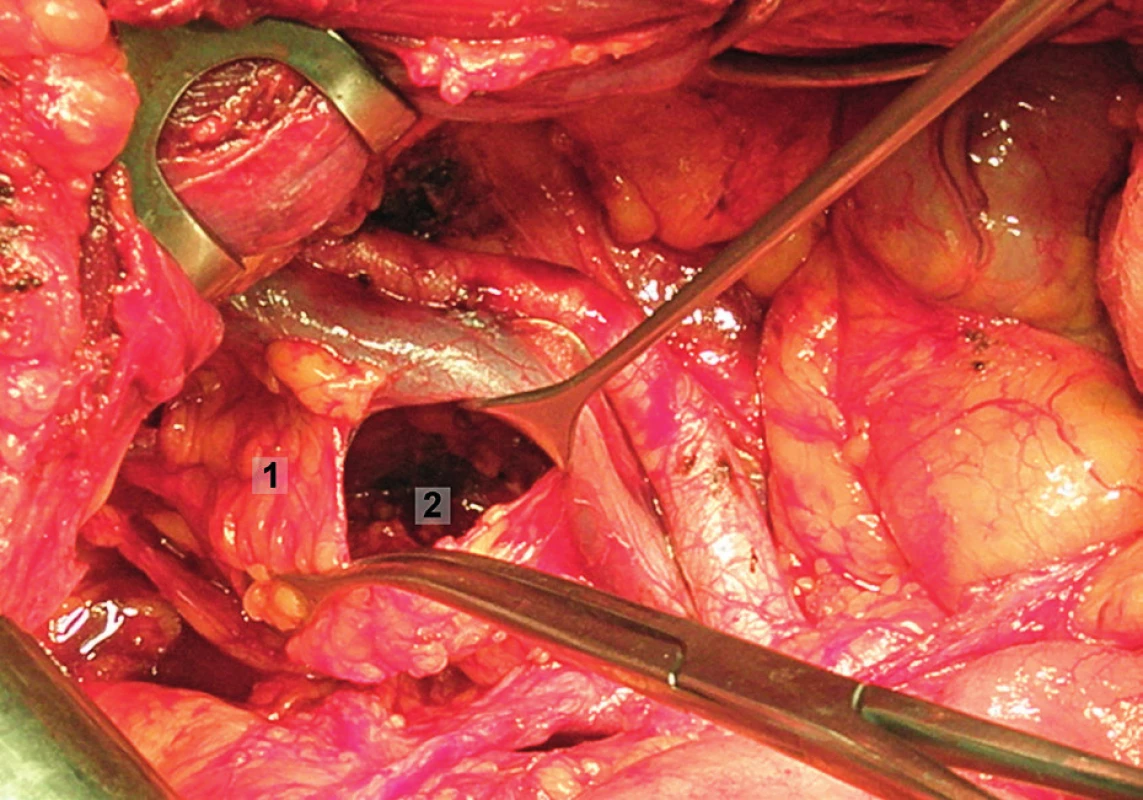
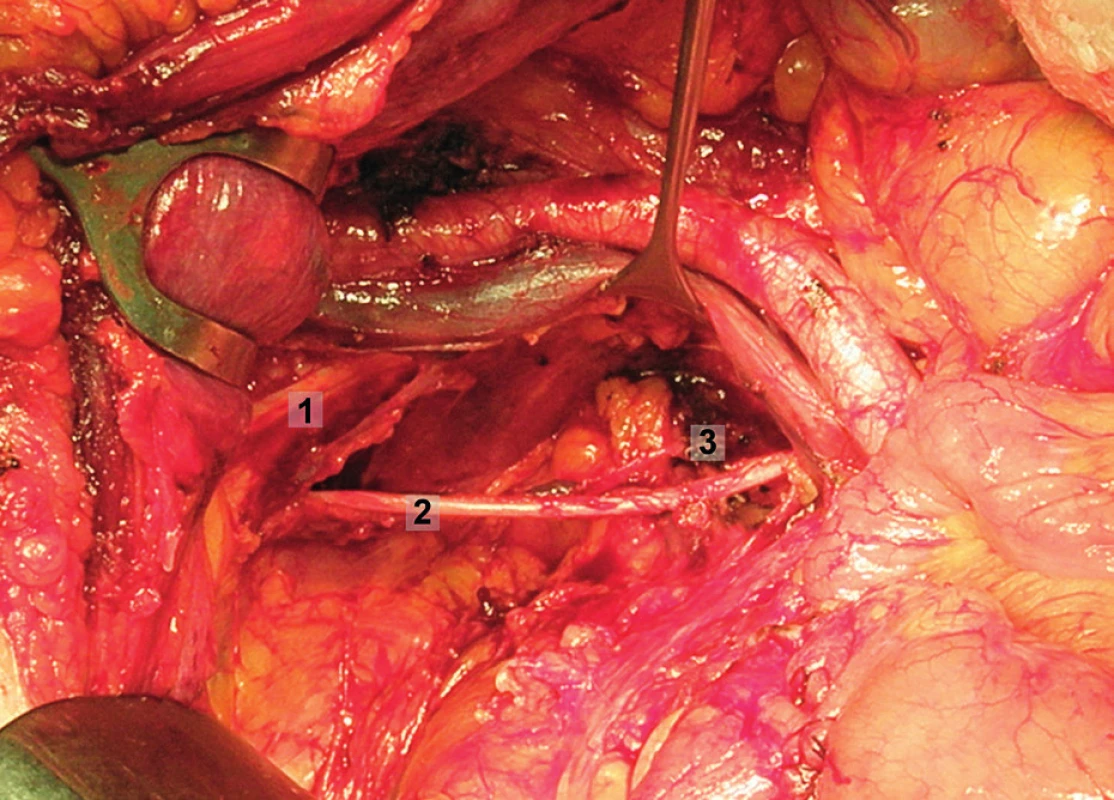
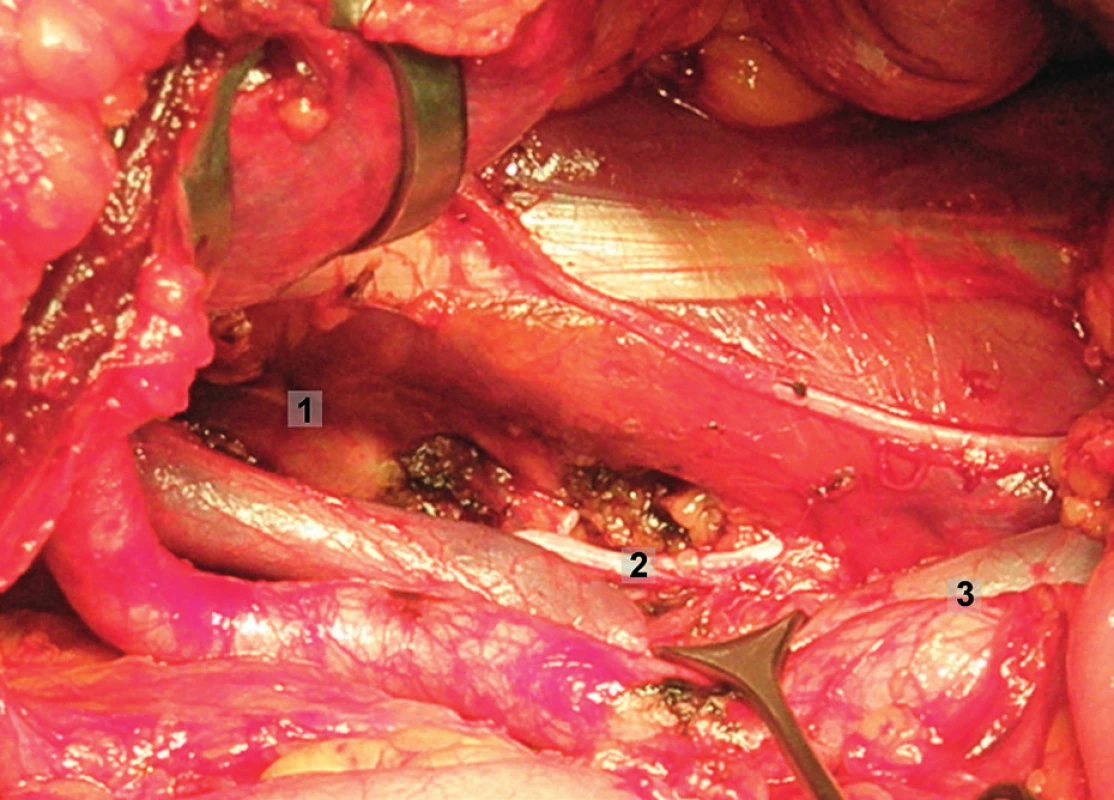
Pravá laterální hranice paraaortální lymfadenektomie je vymezena mediálně od průběhu pravého ureteru, kraniálně výkon ohraničuje levá renální véna. Hranici vlevo tvoří levý ureter a ovariální cévy, dorzálně pak musculus psoas a prevertebrální fascie. Lymfadenektomii je vhodné provádět zleva doprava, nebo výkon zahájit ve střední linii a postupovat laterálně na obě strany. Nejprve jsou exstirpovány parakavální a prekavální uzliny, při pečlivém zachování vláken nervového sympatického kmene. Následně je jemně odsunuta dolní dutá žíla a exstirpovány retrokavální uzliny. Poté jsou odděleny povrchové interaortokavální uzliny mediálně od dolní duté žíly, distálně od levé renální vény a mediálně od aorty. Při exstirpaci hlubokých interaortokaválních uzlin je zapotřebí identifikovat a případně přerušit lumbální cévy a dostatečně od sebe odsunout dolní dutou žílu a aortu. Na závěr jsou odstraněny lymfatické uzliny z oblasti preaortální a paraaortální. Zde je zapotřebí neporanit ascendentní lumbální vény a vena hemiazygos, která vstupuje do levé renální vény. S opatrností je třeba vyhledat odstup a uchovat průběh dolní mezenterické arterie. Její přerušení je rizikovější u mladších pacientek. Přesto i u nich dojde jen vzácně k ischemii colon díky běžně přítomné existenci kolaterálního zásobení střeva (obr. 1–7).
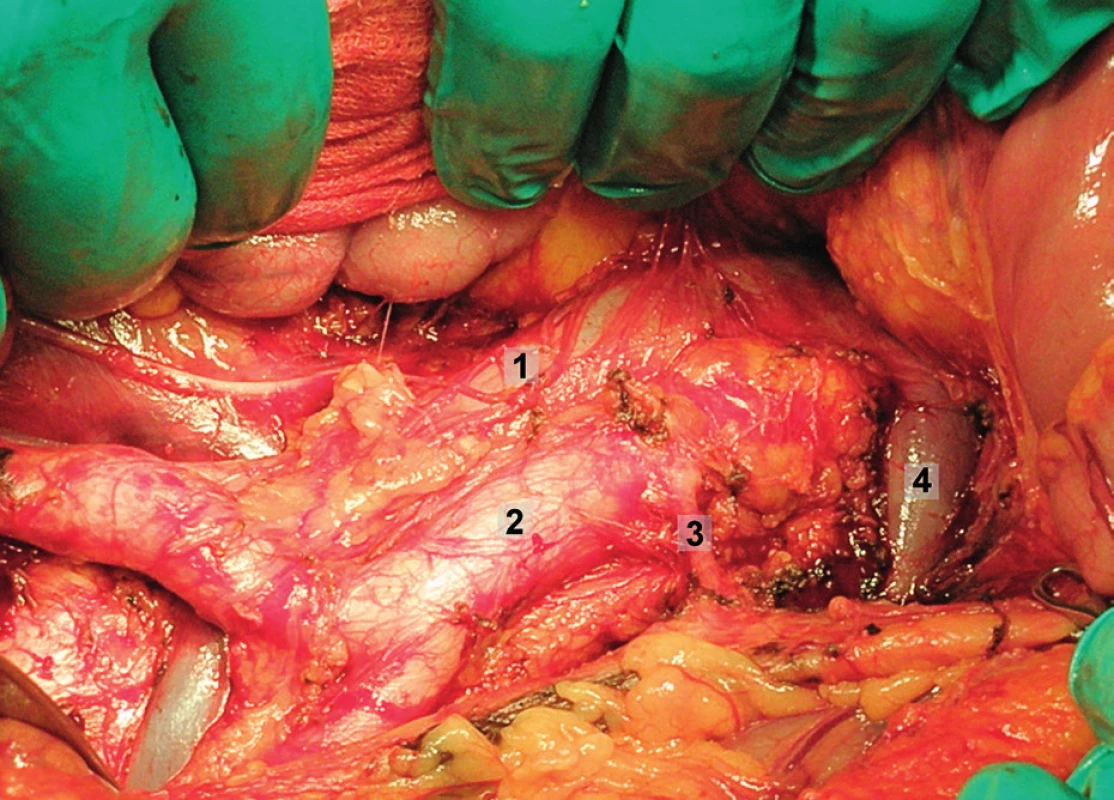
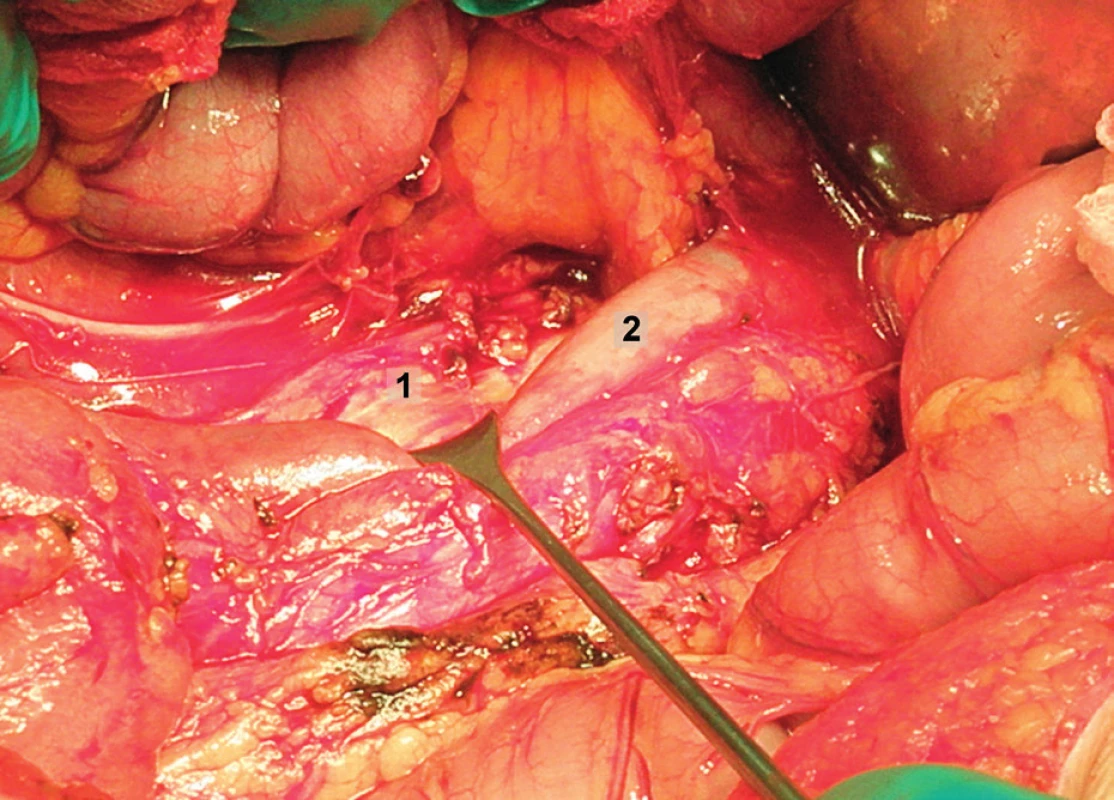
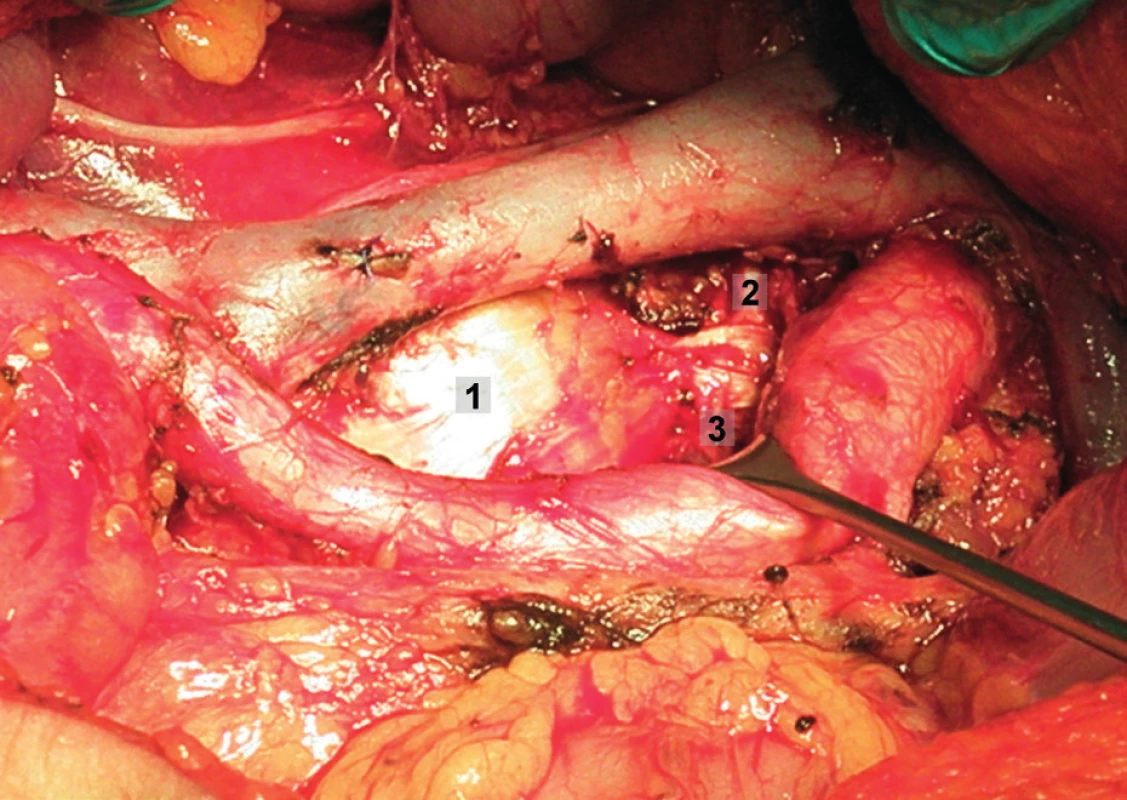
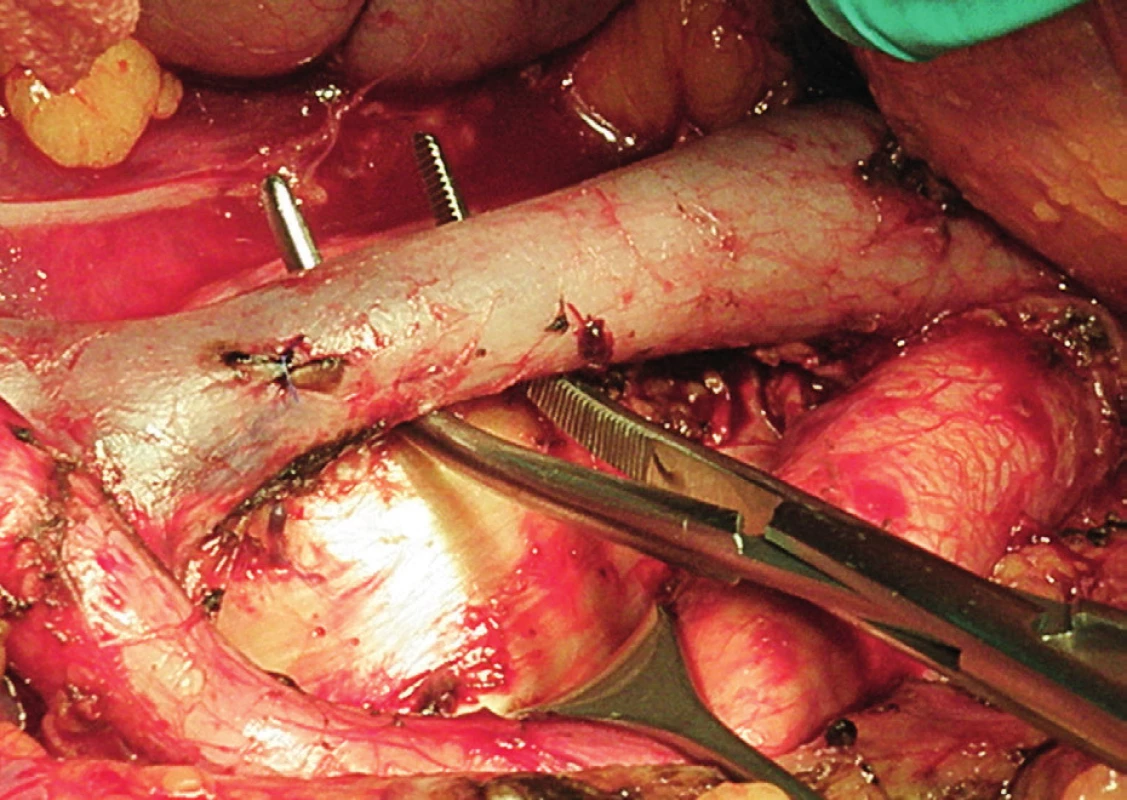
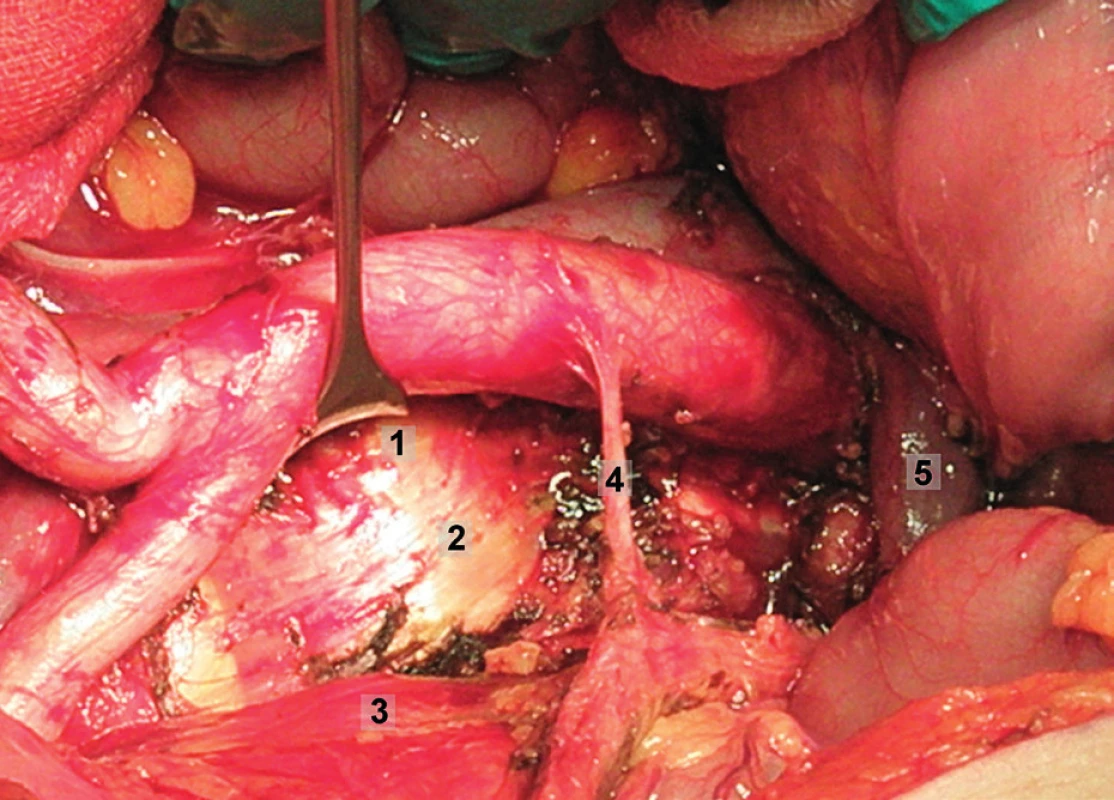
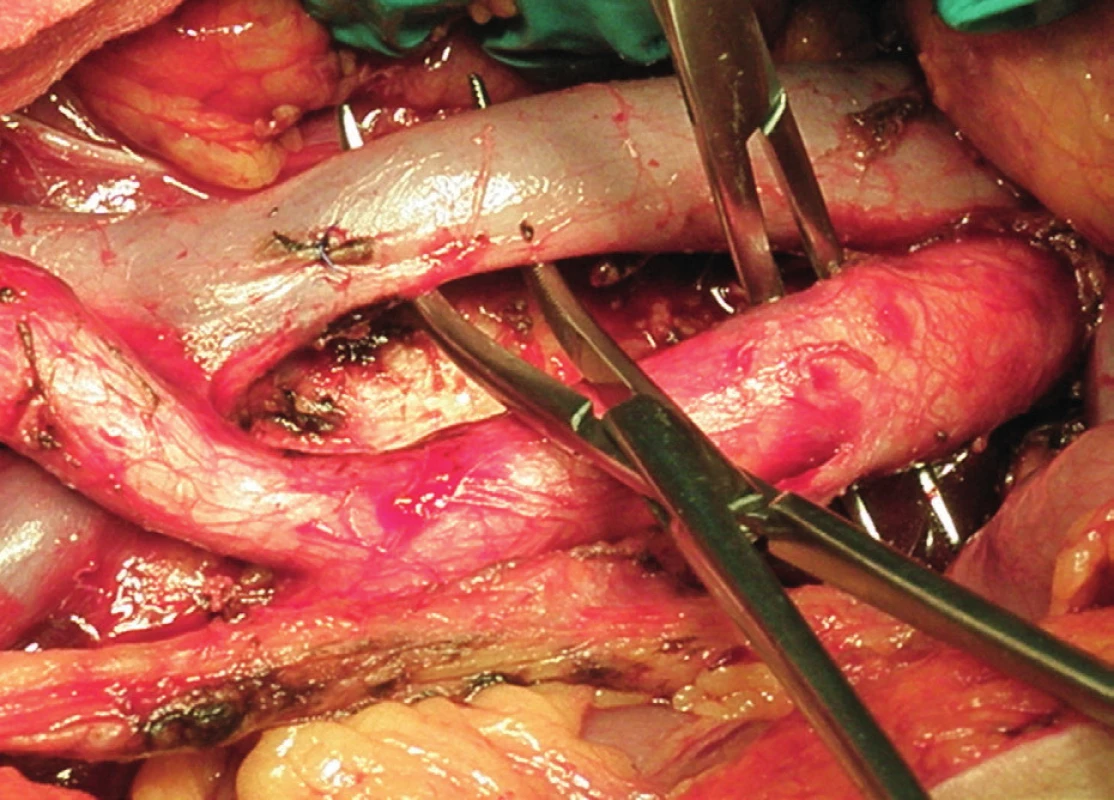
Transperitoneální pánevní lymfadenektomie
Laparotomický přístup vyžaduje dolní střední laparotomii, vhodné je její rozšíření paralelně s pupkem. Dostatečný přístup lze získat i příčným Maylardovým řezem, který je však v našich podmínkách indikován raritně. Minimálně invazivní přístup využívá tradičního umístění portů pro pánevní operativu. Výhodné však může být supraumbilikální umístění kamery zlepšující přehlednost kraniálních hranic operace [3].
Výkon je zahájen přerušením oblých vazů a ostrým otevřením peritonea nad musculus psoas laterálně od externích ilických cév a dále kraniálně směrem do parakolických fos. Rozrušení všech adhezí zde pomůže k dobrému zpřístupnění retroperitonea. Oblé vazy nejsou přerušovány v případě fertilitu záchovných výkonů. V dalším kroku je tupou i ostrou preparací otevřen paravezikální a pararektální prostor. Povrchový lymfatický kmen probíhá laterálně v tukové tkáni retroperitonea a při jeho exstirpaci je třeba zachovat nervus genitofemoralis a aponeurózu musculus psoas. Ve výkonu se postupuje systematicky kraniálně od vstupu externích ilických cév do ingvinálního kanálu. Navzájem od sebe a od musculus psoas jsou separovány externí ilické cévy a jemně odsunuty mediálně. Lymfatika jsou dále exstirpována z oblasti laterodorzální, hranici výkonu zde představuje fascie musculus psoas, v hloubce fascie musculus obturatorius internus a musculus levator ani. Výkon pokračuje v obturatorní fose, kde je nejprve mobilizována povrchová skupina lymfatických uzlin uložená nad průběhem obturatorního nervu, oddělen lymfatický svazek od stydké kosti a tukově lymfatická tkáň vcelku odstraněna i s uzlinami z oblasti interních ilických cév. Mediální hranici výkonu zde tvoří pomyslná rovina procházející paralelně s obliterovanou umbilikální arterií, stěnou močového měchýře a rekta. Obdobně jsou odstraněny hluboké obturatorní uzliny z oblasti pod obturatorním nervem. Odsunutí zevních a společných ilických cév mediálně a současně stěny musculus psoas laterálně umožní odstranit lymfatické uzliny laterálně od ilických cév, kde je patrný průběh vena glutea superior a inferior a nervus ischiadicus. Dalším krokem je exstirpace uzlin z oblasti společných ilických cév. Pánevní lymfadenektomie je ukončena odstraněním tukově lymfatické tkáně z oblasti presakrální. Mobilizací rektosigmoidea, které je odsunuto anteromediálně, se získá přístup k bifurkaci aorty a do oblasti presakrální, mediálně od průběhu vnitřní ilické arterie. Exstirpaci uzlin je vhodné provádět kranio-kaudálním směrem mediálně od společných ilických cév a dále do oblasti vyhloubení křížové kosti (obr. 8–15).
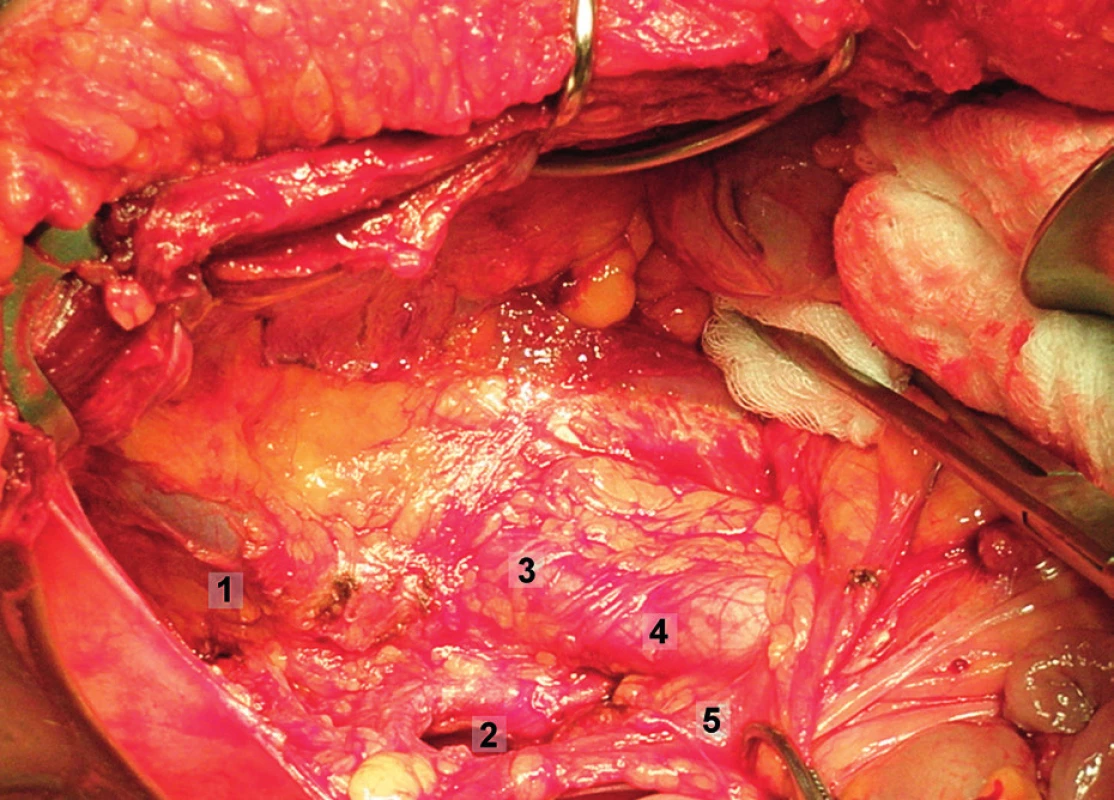
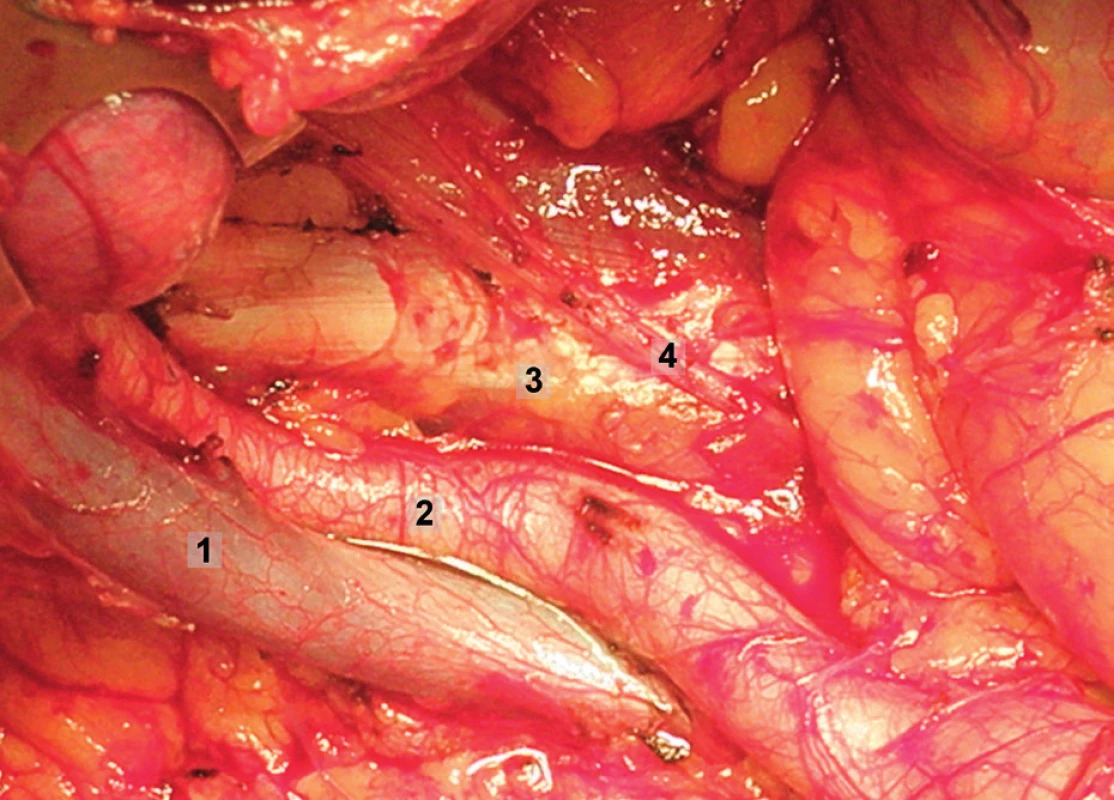
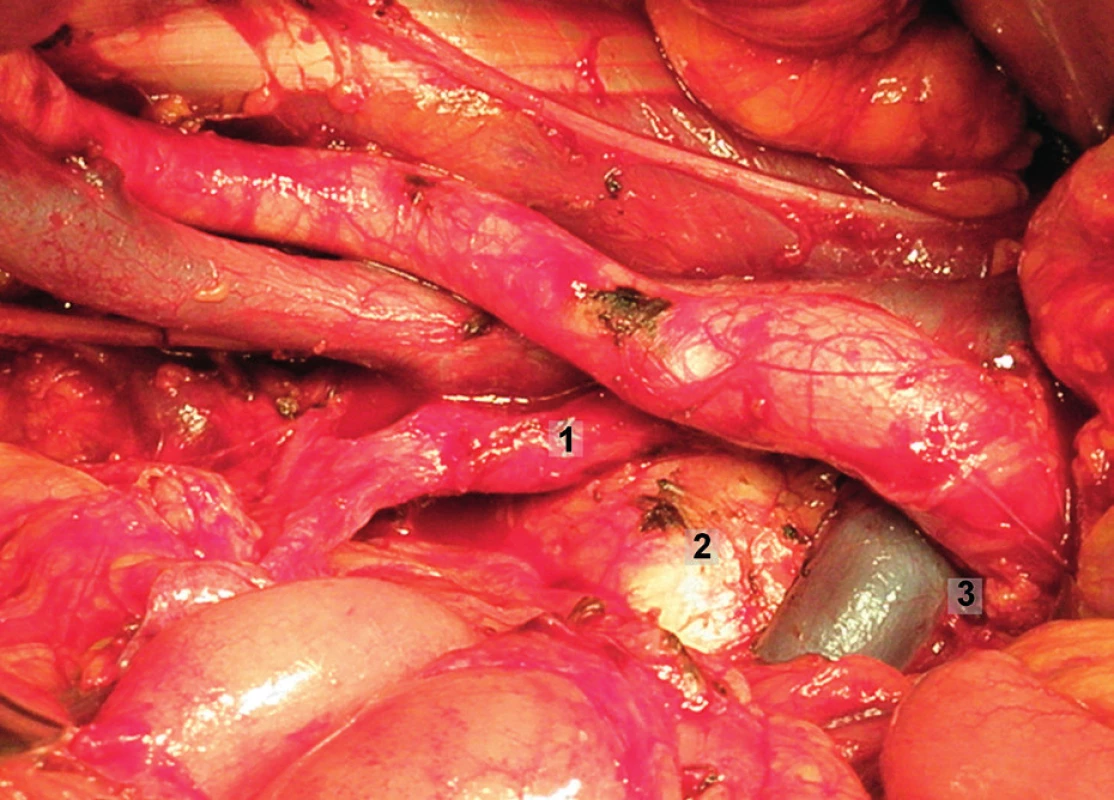
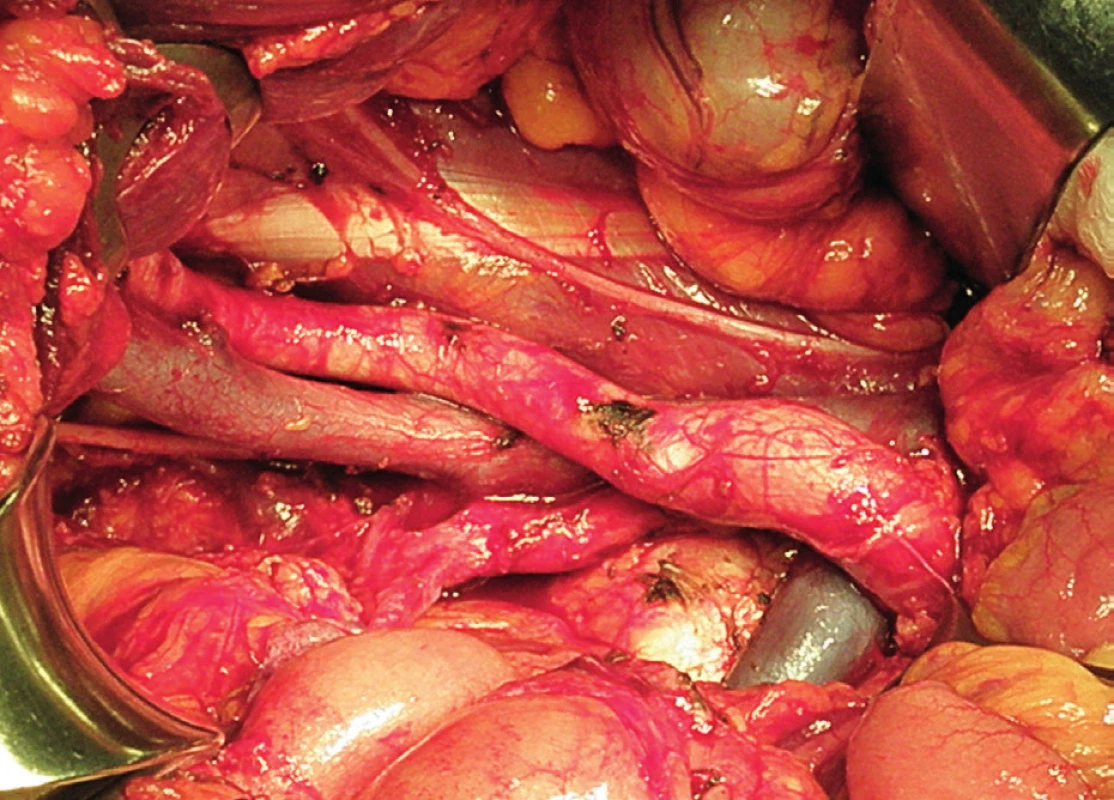
Extraperitoneální paraaortální lymfadenektomie
Extraperitoneální paraaortální lymfadenektomie se provádí miniinvazivně. V našich podmínkách jde stále o raritně prováděný výkon. Hlavní výhodou tohoto přístupu je nižší riziko poranění střeva a vzniku adhezí v břišní dutině. Pozitivní anamnéza předchozích chirurgických výkonů a vyšší BMI navíc nepředstavují limitaci výkonu. Pacientka leží standardně v supinní poloze s připaženými a založenými horními končetinami. Trendelenburgova poloha není zapotřebí. Chirurg stojí na levé straně operačního stolu. Nejprve je transumbilikálním přístupem provedena pečlivá explorace dutiny břišní a pánve k vyloučení nádorového rozsevu intraperitoneálně. Následně je proveden 10–15mm řez 2–4 cm mediálně nad levou spina iliaca anterior superior, jsou odsunuta vlákna šikmého břišního svalu a ostře prostoupeno přes hlubokou fascii přední stěny břišní. Peritoneum musí zůstat neperforováno. Ukazovákem levé ruky je tupě vytvořen prostor v řídké vazivově tukové tkáni pro inzerci trokaru s balonovou manžetou. Následně je insuflován plyn, který otevře a ozřejmí retroperitoneální prostory. Současně je zrušeno kapnoperitoneum. Pod kontrolou kamery jsou zavedeny dva pomocné porty. První, 10–11 mm v průměru, je umístěn kraniálně a dorzálně 3–4 cm od předchozího ve střední axilární linii. Druhý, 5 mm, kraniálně a ventrálně od prvního, přibližně 5 cm pod okrajem žeber [10]. Laparoskopický obraz zde má ve srovnání s transperitoneálním přístupem poněkud odlišnou orientaci anatomického ohraničení výkonu. Mediálně jsou patrny levé společné ilické cévy, inferiorně musculus psoas, superiorně močovod, levá renální véna nadále zůstává kraniální hranicí výkonu.
Po zavedení trokarů jsou systematicky exstirpovány uzliny z oblasti paraaortální, preaortální a retroaortální. Je postupováno kraniálně až po odstup levé renální vény. Dále je identicky odstraněna tukově lymfatická tkáň z oblasti levých společných ilických cév a presakrálně. Pokračuje lymfadenektomie z oblasti interaortokavální, retrokavální, prekavální a parakavální. Výkon je ukončen desuflací extraperitoneálního prostoru a laparoskopickou revizí z transabdominálního přístupu. Pro prevenci vzniku lymfocyst je vhodné protnutí peritonea incizí v délce 2–3 cm.
Extraperitoneální pánevní lymfadenektomie
Extraperitoneální pánevní lymfadenektomie může být výkonem samostatným, stejně tak jako může následovat extraperitoneální paraaortální lymfadenektomii [11]. V druhém případě se pokračuje v exstirpaci tukově lymfatické tkáně dále kaudálně od úrovně společných ilických cév. Nejprve je ozřejměn průběh levé zevní ilické arterie kaudálně až do oblasti femorálního prstence a exstirpovány lymfatické uzliny z laterální strany cév. Levý ureter je pak v pánevním průběhu odsunut mediálně, a díky tomu je získán přístup k lymfatickým uzlinám uloženým mediálně od levých zevních ilických cév. Pro exstirpaci lymfatických uzlin z levé obturatorní fosy je zapotřebí oddělit levé externí ilické cévy od pánevní stěny. Tímto přístupem jsou pak obturatorní uzliny uvolněny od zevní ilické vény a od obturatorního nervu. K systematickému odstranění pánevních uzlin na pravé straně pánve extraperitoneálním přístupem je zapotřebí odsunout mezorektum dostatečně kaudálně, případně vytvořit větší retrorektální prostor. Výkon poté standardně pokračuje kaudálně podél pravých externích a interních ilických cév.
KOMPLIKACE
Komplikace provázející pánevní a paraaortální lymfadenektomii vznikají zejména v souvislosti se systematickým výkonem a cytoredukčním výkonem při nádorem infiltrovaných uzlinách. Systematickou lymfadenektomii provází vznik lymfocyst až ve 20 % a lymfedému v 10–15 % případů [7, 12, 14]. Vzácněji je zaznamenáno poranění nervů a velkých cév (tab. 4). Drobnější krvácení z poranění dolní duté žíly a společných ilických vén je časté, ale dobře zvládnutelné prostou kompresí, naložením svorky nebo suturou monofilamentózním prolenovým stehem. Při včasně a adekvátně ošetřeném poranění proto nebývají závažnější krevní ztráty. Drobnější léze vznikají obvykle lacerací malých žil drénujících tukově lymfatickou tkáň adherující k dolní duté žíle. Závažná venózní krvácení jsou způsobena lacerací lumbálních žil, zejména zcela proximálně v úrovni levého ovariálního svazku, dále pak poraněním interních ilických žil. Arteriální krvácení a poranění externích ilických žil je málo časté. Iatrogenní léze ureteru je nejčastější v místě jeho křížení se společnými ilickými cévami. Z nervů je peroperačně nejčastěji poraněn nebo přerušen n. genitofemoralis při exstirpaci povrchového pánevního lymfatického kmene v jeho laterálním průběhu. Poranění genitofemorálního nervu koagulací nebo jeho přerušení se projeví mírnými paresteziemi až anestezií lokalizovanou do oblasti přední horní části stehna [2].
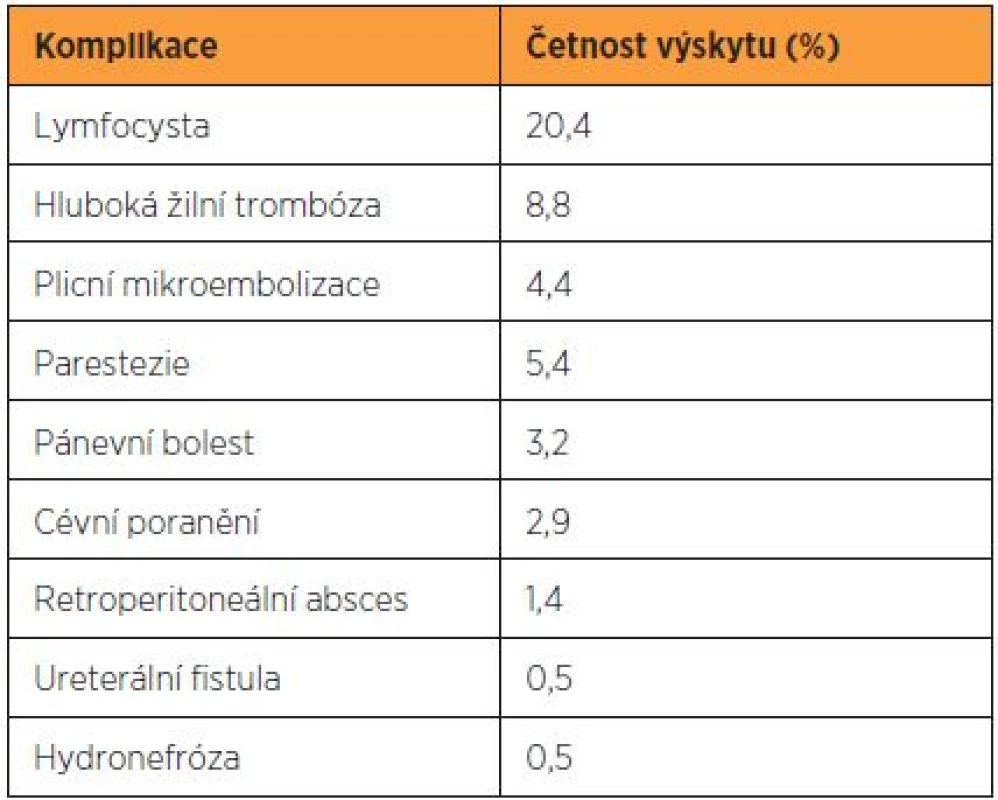
Hlavní pooperační komplikaci představuje tvorba lymfocyst. V dosud nejrozsáhlejším souboru zahrnujícím 800 pacientek po pánevní a paraaortální lymfadenektomii dosahovala incidence lymfocyst 20,2 %, ale pouze v 5,8 % byly přítomny klinické symptomy [14]. V jiné práci sledovali autoři 142 pacientek po systematické pánevní a paraaortální lymfadenektomii a u 29 (20,4 %) z nich diagnostikovali lymfocysty, které vznikly mezi 11–26 dny pooperačně (medián 16 dnů). Polovina z lymfocyst byla asymptomatická a měla objem menší než 50 ml. Ty byly dále sledovány ultrazvukem a spontánně kompletně regredovaly v průměru za 47 dnů [2]. Symptomatické lymfocysty se projevují pánevní bolestí a mechanickým útlakem velkých cév nebo močovodu. Závažnou komplikaci pak představuje tvorba retroperitoneálního abscesu, který z perzistující lymfocysty může vzniknut. Konzervativní postup zahrnující aplikaci širokospektrých antibiotik, punkci a drenáž abscesu pod ultrazvukovou kontrolou je ve většině případů úspěšný. Chirurgická revize je indikována až při selhání konzervativního postupu nebo v případě sepse [14].
ZÁVĚR
Pánevní a paraaortální lymfadenektomie představují základní chirurgickou dovednost v onkogynekologii. Precizní zvládnutí techniky jednotlivých variant obou výkonů je nezbytnou podmínkou pro zajištění adekvátnosti diagnostiky a léčby gynekologických zhoubných nádorů. Součástí edukace je i schopnost řešit možné peroperační a pooperační komplikace spojené s výkony.
Doc. MUDr. Jiří Sláma, Ph.D.
Gynekologicko-porodniká klinika
VFN a 1. LF UK
Apolinářská 18
128 51 Praha 2
e-mail: Jiri.Slama@vfn.cz
Sources
1. Benedetti-Panici, P., Maneschi, F., Scambia, G., et al. Lymphatic spread of cervical cancer: An anatomical and pathological study based on 226 radical hysterectomies with systematic pelvic and aortic lymphadenectomy. Gynecol Oncol, 1996, 62, p. 19–24.
2. Benedetti-Panici, P., Scambia, G., Baiocchi, G., et al. Technique and feasibility of radical para-aortic and pelvic lymphadenectomy for gynecologic malignancies: a prospective study. Int J Gynecol Cancer, 1991, 1, p. 133–140.
3. Cibula, D., Abu-Rustum, NR. Pelvic lymphadenectomy in cervical cancer – surgical anatomy and proposal for a new classification system. Gynecol Oncol, 2010, 116, p. 33–37.
4. Cibula, D., Abu-Rustum, NR., Dusek, L., et al. Bilateral ultrastaging of sentinel lymph node in cervical cancer: Lowering the false-negative rate and improving the detection of micrometastasis. Gynecol Oncol, 2012, 127, p. 462–466.
5. Euscher, ED., Malpica, A., Atkinson, EN., et al. Ultrastaging improves detection of metastases in sentinel lymph nodes of uterine cervix squamous cell carcinoma. Am J Surg Pathol, 2008, 32, p. 1336–1343.
6. Gortzak-Uzan, L., Jimenez, W., Nofech-Mozes, S., et al. Sentinel node biopsy vs. pelvic lymphadenctomy in early stage cervical cancer: Is it time to change the gold standard? Gynecol Oncol, 2010, 116, p. 28–32.
7. Halaska, MJ., Novackova, M., Mala, I., et al. A prospective study of postoperative lymphedema after surgery for cervical cancer. Int J Gynecol Cancer, 2010, 20, p. 900–904.
8. Huang, M., Slomovitz, BM., Ramirez, PT. Transperitoneal versus extraperitoneal para-aortic lymphadenctomy in patients with cervical cancer. Rev Obstet Gynecol, 2009, 2, p. 101–106.
9. Levenback, CF., van der Zee, AGJ., Rob, L., et al. Sentinel lymph node biopsy in patients with gynecologic cancers. Expert panel statement from the International Sentinel Node Meeting, February 21, 2008. Gynecol Oncol, 2009, 114, p. 151–156.
10. Querleu, D., Dargent, D., Ansquer, Y., et al. Extraperitoneal endosurgical aortic and common iliac dissection in the staging of bulky or advanced cervical carcinomas. Cancer, 2000, 88, p. 1883–1891.
11. Querleu, D., Ferron, G., Rafii, A., et al. Pelvic lymph node dissection via a lateral extraperitoneal approach: Description of a technique. Gynecol Oncol, 2008, 109, p. 81–85.
12. Slama, J., Dundr, P., Dusek, L., et al. Sentinel lymph node status in patients with locally advanced cervical cancers and impact of neoadjuvant chemotherapy. Gynecol Oncol, 2012, 125, p. 303–306.
13. Zivanovic, O., Sheinfield, J., Abu-Rustum, NR. Retroperitoneal lymph node dissection (RLND). Gynecol Oncol, 2008, 111, p. S66–S69.
14. Zikan, M., Fischerova, D., Pinkavova, I., et al. A prospective study examining the incidence of asymptomatic and symptomatic lymphoceles following lymphadenectomy in patients with gynecological cancer. Gynecol Oncol, 2015, 137, p. 291–298.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2016 Issue 4
-
All articles in this issue
- Porovnanie perinatálnej mortality v Slovenskej republike v rokoch 2007–2009 a v rokoch 2010–2012
- Technika pánevní a paraaortální lymfadenektomie
- Současné možnosti ultrazvukové diagnostiky v urogynekologii
- Využití poměru koncentrací solubilního receptoru tyrozinkinázového typu 1 a placentárního růstového faktoru pro krátkodobou predikci a diagnostiku preeklampsie
- Závažná imunitní trombocytopenie diagnostikovaná v graviditě
- Infarkt myokardu v graviditě
- Septický šok v těhotenství na podkladě akutní pyelonefritidy
- Bronchopulmonální sekvestrace
- Hemangioblastom mozečku v těhotenství
- Aloimunitní trombocytopenie plodu u těhotné ženy s protilátkami anti-HPA-1a
- Možnosti užití selektivních modulátorů progesteronových receptorů v léčbě děložních myomů
- Praha, místo, kde byl proveden první císařský řez, kdy přežila současně matka i dítě?
- Czech Gynaecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Technika pánevní a paraaortální lymfadenektomie
- Praha, místo, kde byl proveden první císařský řez, kdy přežila současně matka i dítě?
- Současné možnosti ultrazvukové diagnostiky v urogynekologii
- Aloimunitní trombocytopenie plodu u těhotné ženy s protilátkami anti-HPA-1a
