Molekulární testování u karcinomu endometria – společné doporučení ČOS, onkogynekologické sekce ČGPS, SROBF a SČP ČLS JEP
Molecular testing in endometrial carcinoma – joint recommendation of Czech Oncological Society, Oncogynecological Section of the Czech Gynecological and Obstetrical Society, Society of Radiation Oncology, Biology and Physics, and the Society of Czech Pathologists
Molecular classification of endometrial carcinoma is becoming an important part of the diagnostic process with direct therapeutic implications. Recent international guidelines, including the joint recommendation of the European Society of Gynaecological Oncology, the European Society for Radiotherapy and Oncology and the European Society of Pathology include the molecular classification into standard diagnostic algorithms. Molecular testing of endometrial carcinomas is also recommended in the latest (5th edition) of the World Health Organization classification of female genital tumors. Due to the need to implement these recommendations in practice, representatives of four professional societies of the Czech Medical Association of J. E. Purkyně (the Czech Oncological Society, the Oncogynecological Section of the Czech Gynecological and Obstetrical Society, the Society of Radiation Oncology, Biology and Physics, and the Society of Czech Pathologists) organized a meeting focused on this topic. Recommendation for molecular testing of endometrial carcinoma in routine diagnostic practice in the Czech Republic.
Keywords:
Endometrial carcinoma – molecular testing – POLE (DNA polymerase epsilon) – mismatch repair system – p53
Authors:
Dundr P. 1; Cibula D. 2; Doležel M. 3; Fabián P. 4; Fínek J. 5; Jirásek T. 6; Matěj R. 1,7,8; L. Petruželka 9
; Rob L. 10; Ryška A. 11; Švajdler M. 12,13; Weinberger V. 14; Zikán M. 15
Authors‘ workplace:
Ústav patologie, 1. LF UK a VFN v Praze
1; Onkogynekologické centrum, Gynekologicko-porodnická klinika 1. LF UK a VFN v Praze
2; Onkologická klinika LF UP a FN Olomouc
3; Oddělení onkologické patologie, MOÚ Brno
4; Onkologická a radioterapeutická klinika LF UK a FN Plzeň
5; Oddělení patologie, Centrum PATOS, Krajská nemocnice Liberec, a. s.
6; Ústav patologie, 3. LF UK a FN Královské Vinohrady, Praha
7; Ústav patologie a molekulární medicíny, 3. LF UK a FTN Praha
8; Onkologická klinika 1. LF UK a VFN v Praze
9; Gynekologicko-porodnická klinika 3. LF UK a FN Královské Vinohrady, Praha
10; Fingerlandův ústav patologie, LF UK a FN Hradec Králové
11; Šiklův ústav patologie, LF UK a FN Plzeň
12; Bioptická laboratoř, s. r. o., Plzeň
13; Gynekologicko-porodnická klinika LF MU a FN Brno
14; Gynekologicko-porodnická klinika 1. LF UK a FN Bulovka, Praha
15
Published in:
Ceska Gynekol 2021; 86(4): 264-272
Category:
doi:
https://doi.org/10.48095/cccg2021264
Overview
Molekulární klasifikace karcinomu endometria se stává důležitou součástí diagnostického procesu s přímými léčebnými dopady. Recentní mezinárodní doporučené postupy vč. společného doporučení Evropské společnosti gynekologické onkologie, Evropské společnosti pro radioterapii a onkologii a Evropské společnosti pro patologii proto zahrnují molekulární klasifikaci do standardních diagnostických algoritmů, stejně tak je molekulární testování doporučováno i v nejnovější (5. edici) klasifikace nádorů ženského genitálu podle Světové zdravotnické organizace z roku 2020. Vzhledem k potřebě implementace těchto doporučení do diagnostické praxe v ČR proběhlo jednání zástupců čtyř odborných společností České lékařské společnosti J. E. Purkyně (České onkologické společnosti, Onkogynekologické sekce České gynekologické a porodnické společnosti, Společnosti radiační onkologie, biologie a fyziky a Společnosti českých patologů). Výsledkem tohoto jednání je doporučení pro molekulární testování karcinomu endometria v rutinní diagnostické praxi v ČR.
Klíčová slova:
karcinom endometria – molekulární testování – POLE (DNA polymeráza epsilon) – mismatch repair systém – p53
Úvod
Klasifikace karcinomů endometria je tradičně založena na hodnocení definovaných morfologických znaků, často v kombinaci s imunohistochemickým profilem, přesto je však diagnostická shoda zejména u high-grade karcinomů poměrně nízká [1,2]. V poslední 5. edici klasifikace nádorů ženského genitálu podle Světové zdravotnické organizace (WHO – World Health Organization) je uvedeno deset histologických typů karcinomu endometria zahrnujících i nové typy jako je „mesonephric-like“ karcinom a mucinózní karcinom gastrického typu [3]. Zásadní dopad však v posledních letech přináší zejména molekulární klasifikace karcinomů endometria, která se stává důležitou součástí diagnostického procesu [3,4]. To se odrazilo i v tom, že je v nové WHO klasifikaci karcinomů endometria uvedena i molekulární subklasifikace endometroidního karcinomu do čtyř samostatně vyčleněných subtypů [3]. Tato molekulární klasifikace je podle WHO možná a doporučovaná nejen u endometroidního karcinomu, ale i u ostatních histologických typů karcinomu endometria. Bližší indikační kritéria pro molekulární testování jsou řešena na úrovni mezinárodních guidelines, recentně jde např. o společné doporučení Evropské společnosti gynekologické onkologie, Evropské společnosti pro radioterapii a onkologii a Evropské společnosti pro patologii (ESGO-ESTRO-ESP) z roku 2020 [4]. Podle tohoto doporučení je optimální testování všech karcinomů endometria, nicméně testování karcinomů ze skupiny nízkého („low“) a středního („intermediate“) rizika (podle stratifikace do rizikových skupin dle ESGO kritérií) má v současnosti menší význam pro indikaci adjuvantní léčby. Molekulární testování je v obecné úrovni vnímáno jako zásadně důležité a přínosné, nutné je však zohlednit regionální zdroje a dostupnost testování – v některých oblastech světa tak může být jeho implementace do praxe problematická. Na podkladě recentních doporučení na mezinárodní úrovni a potřeby implementace těchto doporučení do diagnostické praxe v ČR proběhlo jednání zástupců čtyř odborných společností České lékařské společnosti J. E. Purkyně (ČOS – České onkologické společnosti, ČGPS – onkologické sekce České gynekologické a porodnické společnosti, SROBF – Společnosti radiační onkologie, biologie a fyziky, SČP – Společnosti českých patologů), jehož výsledkem je toto doporučení pro molekulární testování karcinomu endometria v rutinní diagnostice v ČR.
Doporučený postup pro molekulární testování karcinomu endometria v ČR
Kompletním molekulárním testováním či molekulárním testováním se pro účely tohoto doporučení rozumí vyšetření mutačního stavu genu POLE (DNA polymeráza epsilon), hodnocení defektů mismatch repair systému a p53. Algoritmus stratifikace do jednotlivých molekulárních subtypů je uveden na obr. 1.
Fig. 1. Scheme of addressed donors of frozen embryos in 2013–2017.
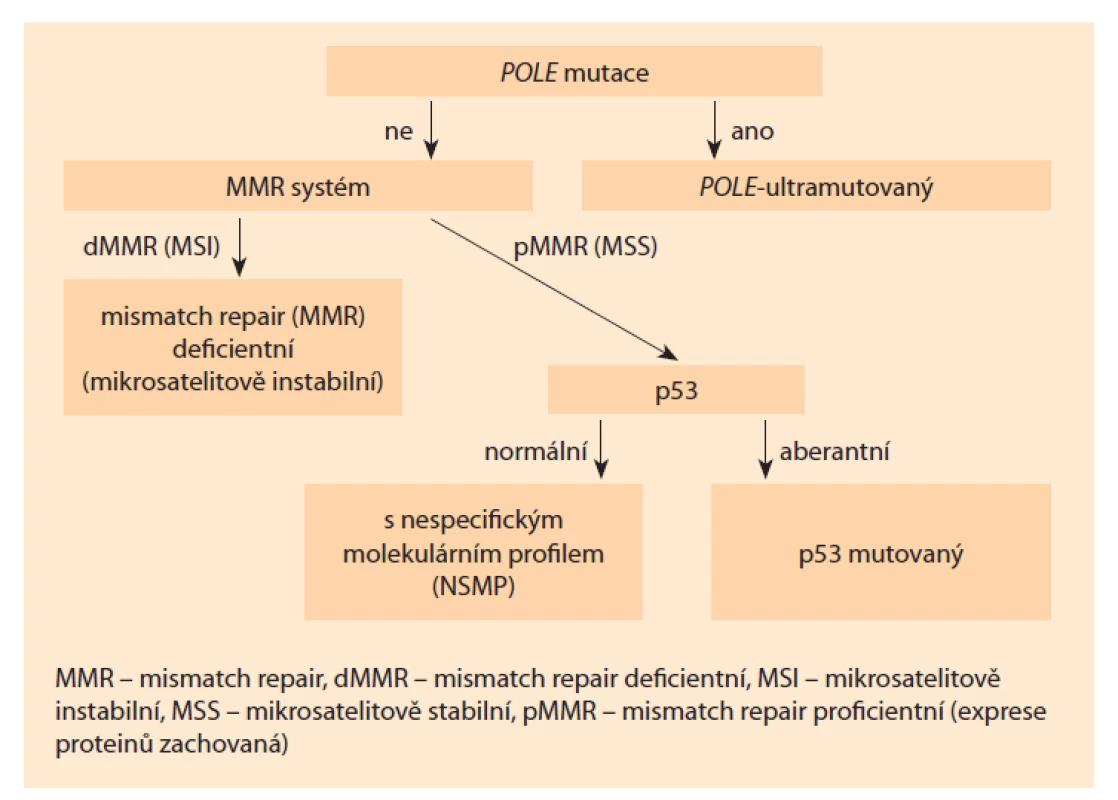
Kdy a koho testovat
Optimální by bylo testování všech karcinomů endometria. V současné době však molekulární testování nemá stejný klinický význam pro všechny rizikové skupiny. Vzhledem k nutnosti zhodnocení všech potřebných klinicko-patologických parametrů důležitých pro indikaci molekulárního testování se doporučuje testování až po vyšetření definitivního resekátu, nikoli hned v rámci diagnostického bioptického odběru (materiál z diagnostického odběru, který je často lépe fixovaný a objemnější, však může být po zhodnocení indikace v návaznosti na definitivní vyšetření resekátu pro vlastní molekulární testování použit). Každý případ je však posuzován individuálně a v případě klinické relevance je možné příslušná vyšetření provést i z diagnostické biopsie. Vyšetření je prováděno vždy na žádost klinika z Komplexního onkologického centra (KOC) či Onkogynekologického centra.
Klasifikace angioinvaze dle ESGO-ESTRO-ESP a WHO doporučení
Hodnocení angioinvaze (LVSI – lymph vascular space invasion) se provádí v okolí nádoru (tedy mimo vlastní karcinom) s dělením do následujících stupňů:
- nepřítomná („absent“)
- fokální („focal“): 1–4 cévních prostor
- podstatná („substantial“): ≥ 5 cévních prostor
Rizikové skupiny dle ESGO kritérií
1. Skupina nízkého rizika (LR – low risk)
- stadium IA endometroidní karcinom, G1–2, LVSI negativní nebo fokální
2. Skupina středního rizika (IR – intermediate risk)
- stadium IB endometroidní karcinom, G1–2, LVSI negativní nebo fokální
- stadium IA endometroidní karcinom, G3, LVSI negativní nebo fokální
- stadium IA, non-endometroidní karcinom, bez invaze do myometria
3. Skupina vysokého/středního rizika (HIR – high-intermediate risk)
- stadium I endometroidní karcinom bez ohledu na stupeň a hloubku invaze s podstatnou („substantial“) LVSI
- stadium IB endometroidní karcinom stupně 3, bez ohledu na LVSI
- stadium II
4. Skupina vysokého rizika (HR – high risk)
- stadium III–IVA bez reziduálního nádoru
- non-endometroidní histologický typ (stadium I–IVA) s invazí do myometria a bez reziduálního nádoru
Současná mezinárodní doporučení vznikala jako konsenzuální dokument mnoha odborníků, zastupujících několik odborností. Jednou z nejdiskutovanějších otázek během jejich přípravy byly indikace pro adjuvantní léčbu po operaci. Odrážejí tak poznatky z dostupných prospektivních studií, současně však i rozdílnou klinickou praxi. V doporučení typu adjuvantního zajištění nejsou zcela striktní, ale nechávají volbu na multidisciplinárním týmu (MDT). Význam molekulárního testování u jednotlivých rizikových skupin se tak může na pracovištích lišit v závislosti na tom, jaká je jejich klinická praxe. Molekulární testování je obecně kliniky velmi vítané i proto, že přináší další argument pro jejich rozhodnutí.
Zjednodušená rozvaha o možném významu molekulárního testování dle rizikové skupiny
1. Nízké riziko (LR)
U této skupiny není doporučeno adjuvantní zajištění. Aberantní typ exprese p53 (mutace TP53) však posouvá pacientky do středního rizika. V případě aberantního typu exprese p53 je však nutné provést kompletní molekulární testování k vyloučení případů, u kterých je aberantní exprese p53 (mutace TP53) sekundárním projevem ultramutovaného stavu při POLE mutaci, a jedná se tedy o nádory, jejichž prognóza se odvíjí od POLE mutace – jde o nádory s výbornou prognózou.
2. Střední riziko (IR)
U této skupiny je ponecháno na volbě multidisciplinárního týmu, zda zajistit pacientku brachyterapií (BRT) s cílem snížit riziko lokálních recidiv, nebo zda ponechat bez zajištění. Při znalosti molekulárního profilu nádoru se nádory ze skupiny P53-mutovaných posouvají do vysokého rizika, zatímco POLE-ultramutované do rizika nízkého. Testování stavu p53, které posouvá pacientku do vysokého rizika, by mělo být provedeno u všech případů. V případě aberantního typu exprese p53 je však nutné provést kompletní molekulární testování k vyloučení případů, u kterých je aberantní exprese p53 (mutace TP53) sekundárním projevem ultramutovaného stavu při POLE mutaci či v rámci mikrosatelitové instability, a jedná se tedy o nádory, jejichž prognóza se odvíjí od POLE mutace (mikrosatelitové instability).
3. Střední/vysoké riziko (HIR)
Stejně jako v předchozí skupině se při znalosti molekulárního subtypu nádory ze skupiny P53-mutovaných posouvají do vysokého rizika, zatímco POLE-ultramutované do rizika nízkého. Testování stavu p53, které posouvá pacientku do vysokého rizika, by mělo být provedeno u všech případů. V případě aberantního typu exprese p53 je však nutné provést kompletní molekulární testování k vyloučení případů, u kterých je aberantní exprese p53 (mutace TP53) sekundárním projevem ultramutovaného stavu při POLE mutaci či v rámci mikrosatelitové instability, a jedná se tedy o nádory, jejichž prognóza se odvíjí od přítomnosti POLE mutace (mikrosatelitové instability).
4. Vysoké riziko (HR)
U této skupiny je indikována adjuvantní radioterapie. Aberantní typ exprese p53 (mutace TP53) nemění zařazení do skupiny, na některých pracovištích je však používáno jako argument pro podání sekvenční chemoterapie po ukončení zevní či kombinované radioterapie. Přítomnost POLE mutace je však velmi významná, protože posunuje pacientku do nízkého rizika bez adjuvantního zajištění. U těchto pacientek je tedy molekulární testování doporučeno vždy.
Na základě uvedené rozvahy je možné dojít k doporučení pro molekulární testování, které zohledňuje strategii pracoviště s ohledem na jeho preference v podání, či nepodání adjuvantní léčby u jednotlivých rizikových skupin:
a) Testování p53 u všech rizikových skupin. V případě aberantního typu exprese p53 (mutace TP53) však musí být provedeno kompletní molekulární testování k vyloučení mutací TP53 sekundárním projevem ultramutovaného stavu při POLE mutaci či v rámci mikrosatelitové instability, a jedná se tedy o nádory, jejichž prognóza se odvíjí od POLE mutace (mikrosatelitové instability).
b) Kompletní molekulární testování se stanovením molekulárního subtypu u všech případů ze skupiny vysokého rizika (HR), středního/vyššího rizika (HIR) a středního rizika (IR), u kterých může vést k deeskalaci adjuvantní léčby; u všech případů s abnormálním typem exprese p53 testovaných dle indikace podle bodu (a).
V jakých laboratořích testovat
Konsenzuální názor pro jednání s plátci je, že by testování měly mít možnost provádět všechny laboratoře patologie, které jsou součástí instituce se statutem komplexního onkologického centra (KOC) či onkogynekologického centra nebo mají na tato centra přímou návaznost (jako je tomu např. u laboratoří zařazených do sítě referenčních laboratoří pro prediktivní diagnostiku) a mají zavedené, validované a akreditované příslušné laboratorní metody umožňující plnou klasifikaci nádorů podle uvedeného algoritmu. Vyšetření pouze části markerů není s ohledem na nastavený algoritmus molekulární klasifikace karcinomů endometria přijatelné.
Testování jednotlivých parametrů
POLE mutace
Vyšetření mutačního stavu POLE může být provedeno jakoukoli molekulární metodou umožňující stanovení mutací v exonukleázové doméně (exon 9–14). Preferováno je jednoznačně vyšetření metodou sekvenování nové generace (NGS – next generation sequencing), které kromě mutačního stavu POLE umožní i vyšetření dalších genů a stanovení komplexního molekulárního profilu nádoru. V případě využití jiné molekulární metody je nutné vzít v potaz případné limitace dané zejména nízkou senzitivitou Sangerova sekvenování (NGS má ve srovnání se Sangerovým sekvenováním asi o třetinu vyšší senzitivitu) a při použití komerčních PCR kitů (polymerase chain reaction/polymerázová řetězová reakce) potřebou pokrytí všech relevantních „hot-spotů“ genu POLE v exonu 9–14.
Zdůvodnění: Preference metody NGS vychází ze skutečnosti, že touto metodou lze současně s mutačním stavem POLE vyšetřit i další geny významné s ohledem na molekulární klasifikaci, tedy TP53 a CTNNB1. Imunohistochemické vyšetření exprese p53 lze podle nastavených algoritmů testování použít, má však oproti vyšetření mutačního stavu genu TP53 metodou NGS nižší senzitivitu (část případů s wild-type typem exprese p53 má mutaci genu TP53, která se však neprojeví abnormální expresí proteinu). Vyhodnocení mutačního stavu genu CTNNB1 potenciálně umožňuje další stratifikaci nádorů ze skupiny nespecifického molekulárního subtypu (NSMP – non-specific molecular profile) do prognosticky příznivé (v případě wild-type CTNNB1) a intermediální (v případě mutace CTNNB1 a ARID1A) kategorie [5]. Aktuálně se však jedná o subklasifikaci s nízkým stupněm evidence, která doposud není všeobecně akceptována. Komplexní molekulární vyšetření nádoru metodou NGS má také diagnostický význam u morfologicky sporných nádorů, z nichž část je možno přesně zařadit právě jen s použitím molekulárního vyšetření. Dále se jedná o vyšetření s potenciálně prediktivním významem u pokročilých nádorů, tedy s možností detekce případných terapeuticky ovlivnitelných molekulárních aberací. V této indikaci je však nutno postupovat podle stávajících algoritmů komplexního molekulárního vyšetření za prediktivním účelem, tak jak je domluveno na úrovni odborných společností (ČOS a SČP) a plátců.
Vyhodnocení POLE mutace: Jako POLE-ultramutované nádory by měly být hodnoceny pouze nádory, které mají některou z definovaných „hot-spotových“ patogenních mutací (variant) v exonukleázové doméně genu POLE v exonu 9–14 uvedených v tab. 1 či u nepopsaných variant klasifikovaných jako patogenní podle tzv. POLE-skóre [6]. Uvedený seznam těchto variant představuje aktuální situaci a může se s rozvojem vědeckých poznatků dále měnit.
Defekt proteinů tzv. mismatch repair systému (MMR)
V souladu s Evropskou společností pro klinickou onkologii (ESMO – European Society for Medical Oncology) doporučením je preferováno testování pomocí imunohistochemické detekce (IHC) exprese MMR proteinů [7]. Optimálně by měla být testována exprese všech čtyř proteinů (MLH1, PMS2, MSH2, MSH6), v praxi lze použít i testování pouze dvou tzv. vedlejších proteinů (PMS2 a MSH6), v případě potřeby doplněných o expresi dvou tzv. hlavních proteinů (MLH1 a MSH2). Pro případ nejednoznačné exprese na IHC úrovni musí laboratoř IHC vyšetření doplnit či upřesnit některou molekulární metodou (zejména PCR s fragmentační analýzou nebo metodu NGS s nastavením příslušného algoritmu umožňujícího detekci mikrosatelitové instability). V případě IHC testování exprese MMR proteinů musí mít laboratoř také zavedenou metodu umožňující stanovení metylačního stavu promotoru MLH1 k rozlišení mezi deficiencí MMR (dMMR) vyskytující se u sporadických nádorů a dMMR s možnou souvislostí s Lynchovým syndromem, kdy je nutné vyšetření klinickým genetikem.
Hodnocení stavu MMR: V případě IHC vyšetření se hodnotí jakákoli jaderná exprese proteinu, která může být vzácně přítomna v < 10 % nádorových buněk (zejména u PMS2 a MSH6) [8]. Sporné nebo neprůkazné výsledky je nutné verifikovat jinou metodou. Nutné je vždy vyhodnocení vnitřní kontroly v nenádorové tkáni (bez této vnitřní kontroly nelze výsledek hodnotit). V případě ztráty exprese některého z MMR proteinů je případ vyhodnocen jako dMMR. V případě zachování exprese všech vyšetřovaných proteinů je případ vyhodnocen jako MMR proficientní (pMMR). Každé pracoviště musí mít nastaven algoritmus jak postupovat u dMMR případů s ohledem na možnou souvislost s Lynchovým syndromem a s formulací doporučení v závěru vyšetření. Doporučení panelu na interpretaci výsledku exprese MMR vycházející ze studií a doporučení zaměřených na problematiku screeningu Lynchova syndromu je uvedeno v tab. 2 [9,10].
Tab. 2. Evaluation of MMR protein expression.

V případě využití metody PCR s fragmentační analýzou se postupuje podle příslušného algoritmu dle použitého spektra a počtu analyzovaných mikrosatelitů. Jako mikrosatelitově instabilní se hodnotí případy v kategorii MSI-H. Kategorie MSI-L je sporná a v souladu s revidovanými Bethesda kritérii a ESMO doporučení jsou tyto případy nahlíženy jako MSS (mikrosatelitově stabilní) [7,11].
Vyšetření P53
Vyšetření se provádí primárně IHC metodou. Zásadní je správné nastavení protokolu tak, aby splňoval kritéria vysoké senzitivity a specificity. V rámci hodnocení je vždy nutné vyhodnocení interní a externí kontroly. V případě absence interní kontroly nelze vyšetření u případů s úplnou ztrátou exprese proteinu vyhodnotit jako validní. IHC vyšetření je v případě NGS testování doplněno i o stanovení mutačního stavu genu TP53. Výsledky vyšetření se uvádí v kategoriích „wild-type“/normální typ exprese a abnormální/aberantní/mutovaný typ exprese. Způsob hodnocení s ohledem na kritéria zařazení do jednotlivých kategorií je uveden v tab. 3.
Tab. 3. Evaluation of p53 expression.

Klasifikace molekulárních kategorií nádorů
Vzhledem k poněkud odlišné terminologii používané v rámci klasifikace TCGA (The Cancer Genome Atlas) a skupin nejvíce se věnujících této problematice PORTEC (Postoperative Radiation Therapy for Endometrial Carcinoma) a ProMisE (Proactive Molecular Risk Classifier For Endometrial Cancer) je doporučeno sjednocené reportování tak, aby pokrývalo všechny alternativy a zachovalo srozumitelnost mezi jednotlivými pracovišti do čtyř molekulárních subtypů následovně (tab. 4):
Tab. 4. Classification of molecular subtypes.

1. POLE-ultramutovaný;
2. mismatch repair (MMR) deficientní (mikrosatelitově instabilní);
3. s nespecifickým molekulárním profilem;
4. p53-mutovaný.
Úhrada testování
Úhrada testování je s výraznými omezeními do určité míry možná i v rámci v současné době nastavených úhradových mechanizmů, tyto mechanizmy jsou však nevyhovující. Konsenzus panelu je, že bude iniciováno jednání mezi odbornými společnostmi a plátci s cílem nového nastavení úhradových mechanizmů a vytvoření specifického kódu či kódů tak, aby umožnily molekulární testování karcinomu endometria v kontextu stávající diagnostiky a následné léčebné péče.
Diskuze
Historicky byly definovány dva základní patogenetické typy karcinomu endometria zahrnující typ I (low-grade estrogen-dependentní nádory, endometrioidní a mucinózní typ, převážně s dobrou prognózou) a typ II (high-grade estrogen-independentní nádory, non-endometroidní typy, převážně se špatnou prognózou) [12]. Tyto dvě skupiny nádorů však vykazovaly značný překryv na úrovni morfologické, klinické i molekulární a s ohledem na prognostický či další dopad neměly praktický význam. Současné znalosti týkající se molekulární klasifikace karcinomů endometria vychází z výsledků studie TCGA, která definovala čtyři molekulární subtypy zahrnující POLE-ultramutovaný (dobrá prognóza), mikrosatelitově instabilní hypermutovaný (intermediální prognóza), „copy-number low“ (intermediální prognóza) a „copy-number high“ (špatná prognóza) [13]. Výsledky této studie prokázaly, že molekulární klasifikace je prognosticky významná a může mít přímé terapeutické dopady. Metodicky byl však jejich přístup poměrně komplikovaný a pro praktické využití nevhodný. Z tohoto důvodu se do praxe prosadil zjednodušený přístup kombinující využití imunohistochemických analýz a molekulárních metod [14–24].
Molekulární klasifikace karcinomů endometria představuje zásadní posun v diagnostice těchto nádorů s přímými dopady na léčbu pacientek [3,4,25]. Nutné je však zdůraznit, že molekulární klasifikace karcinomů endometria je doplněním a nikoli náhradou stávajících diagnostických postupů, a nenahrazuje tedy histopatologické vyšetření, které je nutné pro stanovení stadia onemocnění a vyhodnocení dalších důležitých parametrů, jako je histologický typ nádoru, grading a zhodnocení nádorové angioinvaze (LVSI). Molekulární klasifikace poskytuje nezávislou prognostickou informaci nad rámec stratifikace do prognostických skupin vycházející pouze z hodnocení tradičních klinicko-patologických parametrů, což se odráží i v definici těchto prognostických skupin v recentním doporučení ESGO-ESTRO-ESP [4]. Obecně platí, že POLE-ultramutované nádory mají výbornou prognózu (kategorie „favourable“) a p53-mutované nádory mají nejhorší prognózu (kategorie „unfavourable“). Mezi vysoce rizikovými („high-risk“) nádory definovanými na podkladě tradičních klinicko-patologických parametrů a molekulárně klasifikovanými nádory p53-mutovaného typu je asi 89% překryv [16]. Molekulární klasifikace je však z kategorie vysoce rizikových nádorů schopna vyčlenit nádory s výbornou prognózou (POLE-ultramutované) a nádory s intermediální prognózou (dMMR). Bez molekulární klasifikace by asi 50 % nádorů z kategorie POLE-ultramutovaných a dMMR bylo klasifikováno v kategorii vysoce rizikových („high-risk“).
Molekulární klasifikaci lze použít u všech histologických typů endometriálního karcinomu, vč. karcinosarkomu. U jiných než endometroidních karcinomů má však určitá specifika a nedořešené aspekty, kterých bychom si měli být vědomi. Pro nediferencovaný/dediferencovaný karcinom obecně platí, že i přesto, že asi 50 % případů vykazuje dMMR, se jedná o nádor se špatnou prognózou [26,27]. Nicméně minorita těchto nádorů, které vykazují POLE mutace, se zdá mít prognózu podstatně lepší, data jsou však poměrně limitovaná [28]. Dalším sporným bodem je molekulární klasifikace světlobuněčného karcinomu endometria (ECCC – endometrial clear cell carcinoma) zejména s ohledem na fakt, že samotná existence výskytu POLE mutací a dMMR je u těchto nádorů, pokud jsou diagnostikovány dle striktních kritérií, sporná. V největší studii analyzující 37 případů ECCC nebyl nalezen žádný případ s POLE mutací či dMMR [29]. Podle literárních údajů se sice dMMR vyskytuje u 0–68,8 % případů ECCC, případy vykazující dMMR jsou však nejspíše chybně diagnostikované jiné histologické typy karcinomu endometria [30–32]. Naopak abnormality p53 se u ECCC prokazatelně vyskytují (asi u 50–60 % případů) a nejspíše se jedná o prognosticky nepříznivý faktor [33].
Určitou limitací stávající molekulární klasifikace je poměrně široká skupina nádorů v kategorii nespecifického molekulárního profilu, které jsou řazeny do skupiny nádorů s intermediální prognózou. V této oblasti však probíhá intenzivní výzkum zaměřený na možnou stratifikaci těchto nádorů, který má poměrně nadějné výsledky. Jako slibné se v tomto kontextu jeví hodnocení imunohistochemické exprese L1-CAM a mutačního stavu CTNNB1. Nádory kategorie NSMP vykazující L1-CAM expresi a/nebo mutaci CTNNB1 se zdají mít horší prognózu a podle dosavadních výsledků by zůstávaly v kategorii intermediálního rizika, ostatní nádory z kategorie NSMP mají prognózu výbornou a řadily by se do kategorie „favourable“ [19,20,34–39].
S ohledem na molekulární klasifikaci karcinomu endometria je vhodné zdůraznit, že na rozdíl např. od karcinomu ovaria, u kterého je úzká vazba mezi histologickým typem nádoru a molekulárním profilem, u karcinomu endometria histologický typ s molekulárním subtypem významněji nekoreluje [40]. Bylo prokázáno, že zejména POLE-ultramutované a dMMR nádory vykazují významnou morfologickou variabilitu a jejich morfologické rysy nejsou specifické pro žádnou molekulární kategorii [41,42]. Například POLE-ultramutované nádory jsou často high-grade, vykazují významnou LVSI, a i když jsou převážně endometroidního typu, mohou být i smíšené či mají nejednoznačné rysy s překryvnou endometroidní a serózní diferenciací [42]. Většina low-grade endometroidních karcinomů (G1, G2) spadá do kategorie NSMP, minorita z nich však může patřit do jakékoli jiné molekulární kategorie, tedy vč. POLE-ultramutované, MMR deficientní a p53-mutované. Prognostický význam low-grade endometroidních karcinomů spadajících do kategorie p53-mutovaných není v současné době jednoznačný. Podle jedné recentní studie se však mutace TP53 vyskytuje asi u 10 % low-grade endometroidních karcinomů a jedná se o nádory s více agresivním potenciálem [43]. V této studii však nebyla provedena kompletní molekulární klasifikace nádorů, která je pro správné stanovení molekulárního subtypu nezbytná. Absence znalostí o mutačním stavu genu POLE a stavu exprese MMR proteinů neumožnuje rozlišit mezi „driver“ mutací TP53 a nádory ze skupiny „double“ či „multiple classifiers“, u kterých může být TP53 mutace sekundární při POLE-ultramutačním stavu či dMMR [6,44]. Tyto nádory jsou pak klasifikovány jako POLE-ultramutované či dMMR, a nikoli tedy jako p53-mutované [44]. Případy, u kterých je přítomna současně mutace POLE a dMMR, jsou klasifikovány jako POLE-ultramutované [6].
Závěrem lze shrnout, že molekulární klasifikace karcinomu endometria představuje zásadní posun v problematice těchto nádorů s přímými terapeutickými dopady. Molekulární testování se stává standardní součástí diagnostiky a v podmínkách ČR by mělo být aktuálně prováděno podle výše uvedeného algoritmu. Indikační kritéria v aktuální době nastavená na podkladě jednání odborných společností v ČR představují kompromis mezi optimem, kterým by bylo testování všech karcinomů endometria, a reálnými možnostmi se zohledněním ekonomických aspektů a přímého dopadu na volbu léčby. Tato kritéria však mohou být v budoucnu podle potřeby upravena. V brzké budoucnosti lze také očekávat rozšíření diagnostického algoritmu molekulárního testování o další parametry, které by umožnily další stratifikaci nádorů zejména ze skupiny NSMP. S ohledem na testování dMMR se panel shodl na potřebě zdůraznění faktu, že dMMR sama o sobě představuje u pokročilých nádorů prediktor terapie checkpoint inhibitory [45]. Dále je testování mikrosatelitové instability důležité s ohledem na roli ve screeningu Lynchova syndromu [46–48]. Problematika screeningu Lynchova syndromu v ČR však není řešena tímto doporučením.
Doručeno/Submitted: 11. 6. 2021
Přijato/Accepted: 16. 6. 2021
prof. MUDr. Pavel Dundr, Ph.D.
Ústav patologie
1. LF UK a VFN v Praze
Studničkova 2
128 00 Praha 2
Publikační etika: Redakční rada potvrzuje, že rukopis práce splnil ICMJE kritéria pro publikace zasílané do biomedicínských časopisů.
Publication ethics: The Editorial Board declares that the manuscript met the ICMJE “uniform requirements” for biomedical papers.
Konflikt zájmů: Autoři deklarují, že v souvislosti s předmětem studie/ práce nemají žádný konflikt zájmů.
Conflict of interests: The authors declare they have no potential conflicts of interest concerning the drugs, products or services used in the study.
Sources
1. Thomas S, Hussein Y, Bandyopadhyay S et al. Interobserver variability in the diagnosis of uterine high-grade endometrioid carcinoma. Arch Pathol Lab Med 2016; 140 (8): 836–843. doi: 10.5858/arpa.2015-0220-OA.
2. Gilks CB, Oliva E, Soslow RA. Poor interobserver reproducibility in the diagnosis of high-grade endometrial carcinoma. Am J Surg Pathol 2013; 37 (6): 874–881. doi: 10.1097/PAS.0b013e31827f576a.
3. Board WC. Female genital tumours. In: WHO classification of tumours. 5th ed. Lyon: IARC Press 2020.
4. Concin N, Matias-Guiu X, Vergote I et al. ESGO/ESTRO/ESP guidelines for the management of patients with endometrial carcinoma. Int J Gynecol Cancer 2021; 31 (1): 12–39. doi: 10.1136/ijgc-2020-002230.
5. De Leo A, de Biase D, Lenzi J et al. ARID1A and CTNNB1/beta – catenin molecular status affects the clinicopathologic features and prognosis of endometrial carcinoma: implications for an improved surrogate molecular classification. Cancers (Basel) 2021; 13 (5): 950. doi: 10.3390/cancers13050950.
6. León-Castillo A, Britton H, McConechy MK et al. Interpretation of somatic POLE mutations in endometrial carcinoma. J Pathol 2020; 250 (3): 323–335. doi: 10.1002/path.5372.
7. Luchini C, Bibeau F, Ligtenberg MJ et al. ESMO recommendations on microsatellite instability testing for immunotherapy in cancer, and its relationship with PD-1/PD-L1 expression and tumour mutational burden: a systematic review-based approach. Ann Oncol 2019; 30 (8): 1232–1243. doi: 10.1093/annonc/mdz116.
8. Doghri R, Houcine Y, Boujelbène N et al. Mismatch repair deficiency in endometrial cancer: immunohistochemistry staining and clinical implications. Appl Immunohistochem Mol Morphol 2019; 27 (9): 678–682. doi: 10.1097/PAI.0000000000000641.
9. Chen W, Frankel WL. A practical guide to biomarkers for the evaluation of colorectal cancer. Mod Pathol 2019; 32 (Suppl 1): 1–15. doi: 10.1038/s41379-018-0136-1.
10. Stelloo E, Jansen AM, Osse EM et al. Practical guidance for mismatch repair-deficiency testing in endometrial cancer. Ann Oncol 2017; 28 (1): 96–102. doi: 10.1093/annonc/mdw542.
11. Umar A, Boland CR, Terdiman JP et al. Revised Bethesda guidelines for hereditary nonpolyposis colorectal cancer (Lynch syndrome) and microsatellite instability. J Natl Cancer Inst 2004; 96 (4): 261–268. doi: 10.1093/jnci/djh034.
12. Bokhman JV. Two pathogenetic types of endometrial carcinoma. Gynecol Oncol 1983; 15 (1): 10–17. doi: 10.1016/0090-8258 (83) 90111-7.
13. Kandoth C, Schultz N, Cherniack AD et al. Cancer Genome Atlas Research Network. Integrated genomic characterization of endometrial carcinoma. Nature 2013; 497 (7447): 67–73. doi: 10.1038/nature12113.
14. Talhouk A, McConechy MK, Leung S et al. A clinically applicable molecular-based classification for endometrial cancers. Br J Cancer 2015; 113 (2): 299–310. doi: 10.1038/bjc.2015.190.
15. Talhouk A, Hoang LN, McConechy MK et al. Molecular classification of endometrial carcinoma on diagnostic specimens is highly concordant with final hysterectomy: earlier prognostic information to guide treatment. Gynecol Oncol 2016; 143 (1): 46–53. doi: 10.1016/j.ygyno.2016.07.090.
16. Talhouk A, McConechy MK, Leung S et al. Confirmation of ProMisE: a simple, genomics-based clinical classifier for endometrial cancer. Cancer 2017; 123 (5): 802–813. doi: 10.1002/cncr.30496.
17. Wortman BG, Bosse T, Nout RA et al. Molecular-integrated risk profile to determine adjuvant radiotherapy in endometrial cancer: evaluation of the pilot phase of the PORTEC-4a trial. Gynecol Oncol 2018; 151 (1): 69–75. doi: 10.1016/j.ygyno.2018.07.020.
18. Wortman BG, Creutzberg CL, Putter H et al. Ten-year results of the PORTEC-2 trial for high-intermediate risk endometrial carcinoma: improving patient selection for adjuvant therapy. Br J Cancer 2018; 119 (9): 1067–1074. doi: 10.1038/s41416-018-0310-8.
19. Stelloo E, Nout RA, Osse EM et al., Improved risk assessment by integrating molecular and clinicopathological factors in early-stage endometrial cancer-combined analysis of the PORTEC cohorts. Clin Cancer Res 2016; 22 (16): 4215–4224. doi: 10.1158/1078-0432.CCR-15 - 2878.
20. Stelloo E, Bosse T, Nout RA et al. Refining prognosis and identifying targetable pathways for high-risk endometrial cancer; a TransPORTEC initiative. Mod Pathol 2015; 28 (6): 836–844. doi: 10.1038/modpathol.2015.43.
21. Plotkin A, Kuzeljevic B, De Villa V et al. Interlaboratory concordance of ProMisE molecular classification of endometrial carcinoma based on endometrial biopsy specimens. Int J Gynecol Pathol 2020; 39 (6): 537–545. doi: 10.1097/PGP.0000000000000654.
22. Parra-Herran C, Lerner-Ellis J, Xu B et al. Molecular-based classification algorithm for endometrial carcinoma categorizes ovarian endometrioid carcinoma into prognostically significant groups. Mod Pathol 2017; 30 (12): 1748–1759. doi: 10.1038/modpathol.2017.81.
23. Kommoss S, McConechy MK, Kommoss F et al. Final validation of the ProMisE molecular classifier for endometrial carcinoma in a large population-based case series. Ann Oncol 2018; 29 (5): 1180–1188. doi: 10.1093/annonc/mdy058.
24. Bosse T, Nout RA, McAlpine JN et al. Molecular classification of grade 3 endometrioid endometrial cancers identifies distinct prognostic subgroups. Am J Surg Pathol 2018; 42 (5): 561–568. doi: 10.1097/PAS.0000000000001020.
25. Soslow RA, Tornos C, Park KJ et al. Endometrial carcinoma diagnosis: use of FIGO grading and genomic subcategories in clinical practice: recommendations of the International Society of Gynecological Pathologists. Int J Gynecol Pathol 2019; 38 (Suppl 1): S64–S74. doi: 10.1097/PGP.0000000000000518.
26. Altrabulsi B, Malpica A, Deavers MT et al. Undifferentiated carcinoma of the endometrium. Am J Surg Pathol 2005; 29 (10): 1316–1321. doi: 10.1097/01.pas.0000171003.72352.9a.
27. Silva EG, Deavers MT, Malpica A. Undifferentiated carcinoma of the endometrium: a review. Pathology 2007; 39 (1): 134–138. doi: 10.1080/00313020601159494.
28. Espinosa I, Lee CH, D’Angelo E et al. Undifferentiated and dedifferentiated endometrial carcinomas with POLE exonuclease domain mutations have a favorable prognosis. Am J Surg Pathol 2017; 41 (8): 1121–1128. doi: 10.1097/PAS.000000000000873.
29. Baniak N, Fadare O, Köbel M et al. Targeted molecular and immunohistochemical analyses of endometrial clear cell carcinoma show that POLE mutations and DNA mismatch repair protein deficiencies are uncommon. Am J Surg Pathol 2019; 43 (4): 531–537. doi: 10.1097/PAS.0000000000001209.
30. An HJ, Logani S, Isacson C et al. Molecular characterization of uterine clear cell carcinoma. Mod Pathol 2004; 17 (5): 530–537. doi: 10.1038/modpathol.3800057.
31. DeLair DF, Burke KA, Selenica P et al. The genetic landscape of endometrial clear cell carcinomas. J Pathol 2017; 243 (2): 230–241. doi: 10.1002/path.4947.
32. Bae HS, Kim H, Kwon SY et al. Should endometrial clear cell carcinoma be classified as Type II endometrial carcinoma? Int J Gynecol Pathol 2015; 34 (1): 74–84. doi: 10.1097/PGP.0000000000000111.
33. Fadare O, Gwin K, Desouki MM et al. The clinicopathologic significance of p53 and BAF-250a (ARID1A) expression in clear cell carcinoma of the endometrium. Mod Pathol 2013; 26 (8): 1101–1110. doi: 10.1038/modpathol.2013.35.
34. Kommoss FK, Karnezis AN, Kommoss F et al. L1CAM further stratifies endometrial carcinoma patients with no specific molecular risk profile. Br J Cancer 2018; 119 (4): 480–486. doi: 10.1038/s41416-018-0187-6.
35. Kommoss F, Kommoss F, Grevenkamp F et al. L1CAM: amending the „low-risk“ category in endometrial carcinoma. J Cancer Res Clin Oncol 2017; 143 (2): 255–262. doi: 10.1007/s00432-016-2276-3.
36. Bosse T, Nout RA, Stelloo E et al. L1 cell adhesion molecule is a strong predictor for distant recurrence and overall survival in early stage endometrial cancer: pooled PORTEC trial results. Eur J Cancer 2014; 50 (15): 2602–2610. doi: 10.1016/j.ejca.2014.07.014.
37. Kim G, Kurnit KC, Djordjevic B et al. Nuclear b-catenin localization and mutation of the CTNNB1 gene: a context-dependent association. Mod Pathol 2018; 31 (10): 1553–1559. doi: 10.1038/s41379-018-0080-0.
38. Klat J, Mladenka A, Dvorackova J et al. L1CAM as a negative prognostic factor in endometrioid endometrial adenocarcinoma FIGO stage IA-IB. Anticancer Res 2019; 39 (1): 421–424. doi: 10.21873/anticanres.13128.
39. Smogeli E, Davidson B, Cvancarova M et al. L1CAM as a prognostic marker in stage I endometrial cancer: a validation study. BMC Cancer 2016; 16 : 596. doi: 10.1186/s12885-016-2361-4.
40. Hoang LN, Kinloch MA, Leo JM et al. Interobserver agreement in endometrial carcinoma histotype diagnosis varies depending on the Cancer Genome Atlas (TCGA) -based molecular subgroup. Am J Surg Pathol 2017; 41 (2): 245–252. doi: 10.1097/PAS.0000000000000764.
41. Bakhsh S, Kinloch M, Hoang LN et al. Histopathological features of endometrial carcinomas associated with POLE mutations: implications for decisions about adjuvant therapy. Histopathology 2016; 68 (6): 916–924. doi: 10.1111/his.12878.
42. Hussein YR, Weigelt B, Levine DA et al. Clinicopathological analysis of endometrial carcinomas harboring somatic POLE exonuclease domain mutations. Mod Pathol 2015; 28 (4): 505–514. doi: 10.1038/modpathol.2014.143.
43. Yano M, Ito K, Yabuno A et al. Impact of TP53 immunohistochemistry on the histological grading system for endometrial endometrioid carcinoma. Mod Pathol 2019; 32 (7): 1023–1031. doi: 10.1038/s41379-019-0220-1.
44. León-Castillo A, Gilvazquez E, Nout R et al. Clinicopathological and molecular characterisation of ‚multiple-classifier‘ endometrial carcinomas. J Pathol 2020; 250 (3): 312–322. doi: 10.1002/path.5373.
45. Petrelli F, Ghidini M, Ghidini A et al. Outcomes following immune checkpoint inhibitor treatment of patients with microsatellite instability-high cancers: a systematic review and meta-analysis. JAMA Oncol 2020; 6 (7): 1068–1071. doi: 10.1001/jamaoncol.2020.1046.
46. Snowsill TM, Ryan NA, Crosbie EJ et al. Cost-effectiveness analysis of reflex testing for Lynch syndrome in women with endometrial cancer in the UK setting. PLoS One 2019; 14 (8): e0221419. doi: 10.1371/journal.pone.0221419.
47. Ryan N, Wall J, Crosbie EJ et al. Lynch syndrome screening in gynaecological cancers: results of an international survey with recommendations for uniform reporting terminology for mismatch repair immunohistochemistry results. Histopathology 2019; 75 (6): 813–824. doi: 10.1111/his.13925.
48. Zeimet AG, Mori H, Petru E et al. AGO Austria recommendation on screening and diagnosis of Lynch syndrome (LS). Arch Gynecol Obstet 2017; 296 (1): 123–127. doi: 10.1007/s00404-017-4392-y.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2021 Issue 4
-
All articles in this issue
- HELLP syndrome and HELLP-like syndrome in pregnancies with covid-19 – case reports
- Congenital syphilis as a cause of death in a newborn in 31st week of pregnancy – significance of testing for syphilis during pregnancy
- Treatment options for locally recurrent vulvar cancer
- Recurrence of rare malignant Brenner ovarian tumor
- Molecular classification of endometrial cancers translated into practice
- Molecular testing in endometrial carcinoma – joint recommendation of Czech Oncological Society, Oncogynecological Section of the Czech Gynecological and Obstetrical Society, Society of Radiation Oncology, Biology and Physics, and the Society of Czech Pathologists
- Prevention of de novo adhesion formation in patients with Asherman's syndrome
- Pelvic neuropathic pain (differential diagnosis)
- History and current trends in the treatment of idiopathic overactive bladder
- Matrix metalloproteinases MMP-2 and MMP-9 as markers for the prediction of preeclampsia in the first trimester
- Czech Gynaecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Pelvic neuropathic pain (differential diagnosis)
- HELLP syndrome and HELLP-like syndrome in pregnancies with covid-19 – case reports
- Molecular testing in endometrial carcinoma – joint recommendation of Czech Oncological Society, Oncogynecological Section of the Czech Gynecological and Obstetrical Society, Society of Radiation Oncology, Biology and Physics, and the Society of Czech Pathologists
- Recurrence of rare malignant Brenner ovarian tumor

