Epidurální horečka
Epidural fever
Epidural analgesia (EPA) is the most effective method of intrapartum pain relief and is considered to be very safe. Recently, it has been used in up to 34% of parturients with EPA and is also associated with maternal temperature elevations during labor. The mechanism of this epidural-associated fever remains incompletely understood. The most likely etiology seems to be non-infectious inflammation caused by an epidural catheter. However, some authors deny this association. They theorize it is caused by selection bias only, as EPA is more often required by women with more painful and prolonged or more complicated labor, where temperature elevation is due to other causes. They point out that in some studies, fever was correlated to EPA only with concurrent placental inflammation. Maternal fever, despite the cause, either infectious or non-infectious origin, carries important clinical and public health implications. Further research that evaluates maternal epidural status and its influence on maternal or neonatal fever could improve sepsis evaluation and lead to worldwide decrease of unnecessary antibiotic exposure.
Keywords:
epidural analgesia – epidural fever – thermoregulation
Authors:
Hlinecká Kristýna 1; Bartošová Tereza 2; Bláha Jan 2
Authors‘ workplace:
Gynekologicko-porodnická klinika 1. LF UK a VFN v Praze
1; Klinika anesteziologie, resuscitace a intenzivní medicíny 1. LF UK a VFN v Praze
2
Published in:
Ceska Gynekol 2021; 86(5): 355-361
Category:
Review Article
doi:
https://doi.org/10.48095/cccg2021355
Overview
Epidurální porodnická analgezie (EPA) se řadí k nejúčinnějším a nejbezpečnějším metodám využívaných k tlumení porodních bolestí. V posledních letech je ale spojována s vyšší incidencí horečky matky, tzv. epidurální horečkou, a to až u 34 % rodiček s EPA. Její etiologie není plně objasněna, předpokládá se vliv neinfekčního zánětu vyvolaného zavedeným epidurálním katétrem. Někteří autoři tuto asociaci popírají. Jsou názoru, že jde pouze o výběrové bias v tom smyslu, že EPA požadují více rodičky s déletrvajícím, bolestivějším či komplikovaným porodem, a tudíž je vzestup teploty dán jinými příčinami. Případně poukazují na skutečnost, že horečka byla v některých studiích s EPA vyvolána současně probíhající chorioamniitidou. Maternální horečka, ať už infekčního, nebo neinfekčního původu, má velký klinický dopad na léčbu matky a novorozence. Je s otázkou, zda jí můžeme předcházet, a tím snížit celosvětově se zvyšující nežádoucí spotřebu antibiotik.
Klíčová slova:
epidurální analgezie – epidurální horečka – termoregulace
Úvod
Epidurální porodnická analgezie (EPA) patří k nejefektivnějším porodnickým analgeziím a je obecně považována za velmi bezpečnou. Jen v Česku ji ročně podstoupí více než 10 tis. rodiček [1–3]. V posledních letech je ale EPA spojována s vyšší incidencí horečky matky, a to až u 34 % rodiček, s tzv. epidurální horečkou (LEAF – labour epidural associated fever) [4]. V českých porodnicích nebyla tato asociace nijak pozorována, přestože poprvé byla horečka s epidurální porodní analgezií popsána již v roce 1989 [5]. Mechanizmus vzniku epidurální horečky zůstává stále neobjasněn. Jako nejvíce pravděpodobné vysvětlení je udáván neinfekční zánět vyvolaný přítomností epidurálního katétru, nicméně, někteří autoři tuto asociaci zcela popírají. Jsou názoru, že jde pouze o výběrové bias v tom smyslu, že EPA požadují více rodičky s protrahovaným, bolestivým či komplikovaným porodem, kde již tento stav může vést k fyziologické elevaci teploty rodičky. Další studie zkoumají spíše spojitost s konkomitantně probíhajícím placentárním zánětem (chorioamniitida). Přestože se o epidurální horečce mluví již 20 let, teprve v posledních letech se stala předmětem žhavé odborné diskuze a je dnes asi nejkontroverznějším tématem současné porodnické anestezie. Ani přes roky sledování a výzkumu neexistuje obecný konsenzus stran její existence. Je navíc velmi zajímavé, že tato asociace je popisována pouze v souvislosti s porodem. Přitom důsledky horečky – především na plod, ale také na rodičku – mohou mohou být poměrně závažné. Fyziologická teplota rodičky během porodu obvykle nestoupá na více než 38 °C. Výskyt elevace teploty nad 38 °C během porodu je udáván okolo 2–10 % u termínových gravidit [6,7]. Horečka během porodu je obecně spojena se zvýšeným počtem císařských řezů či operačně vedených vaginálních porodů (AVD – assisted vaginal delivery), jako jsou vakuumextrakce (VEX) či forceps (F) [8–10]. V našem článku se zaměříme na definici teploty, možnosti její monitorace během porodu a také na limitace dosud publikovaných studií zabývajících se problematikou epidurální horečky.
Teplota lidského těla, monitorace
Normální tělesná teplota u lidí osciluje mezi 36,5 a 37,5 °C. Za průměrnou je více než 150 let považována teplota 37 °C. Ta byla stanovena německým lékařem Wunderlichem na základě 25 tis. axilárně provedených měření. Tato hodnota nebyla změněna až do roku 1992, kdy Mackowiak porovnal záznamy 148 žen. Střední hodnota orálně měřené teploty byla pouze 36,8 °C [11,12]. V roce 2017 Obermayer et al zanalyzovali data 35 488 pacientů, kde průměrná hodnota axilárně měřené tělesné teploty byla 36,6 °C (95% range 35,7–37,3 °C; 99% range 35,3–37,7 °C). Celkový pokles teploty jistě také ovlivňuje zvyšující se průměrný věk populace. Tělesná teplota klesá každých 10 let života o 0,021 °C (p < 0,001) [13]. Lidská teplota se snižuje i napříč stoletím. Parsonnet et al prostudovali lékařskou dokumentaci téměř 24 tis. veteránů armády Unie z doby americké občanské války (1861–1865), aby zjistili průměrnou teplotu jejich epochy. Tato data porovnali s 15 tis. záznamy z počátku 70. let 20. století a se 150 tis. záznamy ze stanfordské platformy pro sběr klinických dat 21. století. Ženy narozené v první dekádě 19. století měly teplotu o 0,32 °C vyšší než ženy narozené po roce 1990, u mužů byl rozdíl 0,59 °C. Každých 10 let teplota klesala o 0,03 °C [14].
Tělesná teplota je výsledkem tvorby a výdeje tepla a je ovlivněna řadou faktorů – tělesnou aktivitou, graviditou, věkem, rasou, hormonální produkcí, příjmem potravy a samozřejmě teplotou okolí. Nejnižší teplota je ve spánku a přes den okolo 6 hod ráno, nejvyšší navečer. V těhotenství můžeme zaznamenat teplotu až o 0,5 °C vyšší [15].
Teplota lidského těla se dá měřit pouze nepřímo na základě známých fyzikálních jevů za různých teplot, tzv. termometrií. Rozlišujeme centrální a periferní teplotu lidského těla. Centrální teplota reflektuje teplotu jádra a je měřena intrakavitálně. Jádro tvoří všechny orgány s vysokou látkovou přeměnou, tzn. vnitřní orgány krajiny hrudní, břišní a lebeční. Jádro je největším producentem tepla. Teplotě jádra se nejvíce přibližuje teplota naměřená v rektu, vagině nebo na povrchu bubínku. V klidu a za fyziologického stavu se pohybuje v rozmezí 36,3–37,1 °C. Teplota orální je o 0,3–0,5 °C nižší. Ovlivňuje ji dýchání, žvýkání, příjem potravy a tekutin. Periferní teplotě odpovídá měření axilární či na dorzu nohy [16].
V roce 2009 proběhla studie porovnávající centrální a periferní způsob monitorace teploty. U 30 žen proběhlo kontinuální 24hodinové měření, kde rozdíl tympanálně a axilárně naměřených hodnot byl 0,93 °C (IR 1,57) [17].
V současnosti není pojem „horečka“ jasně definován. Dle mezinárodní klasifikace nemocí, The American College of Critical Care Medicine a dle The Infectious Diseases Society of America je horečka formulována jako zvýšená teplota tělesného jádra na 38,3 °C a více [18]. Patogeneze horečky je velmi komplikovaný proces a je spojen s metabolickými, fyziologickými a imunologickými změnami v lidském těle. Horečka je odrazem a komplexní odpovědí organizmu na různé imunologické procesy, a to jak infekční, tak i neinfekční. Tělesná teplota je neustále regulována a koreluje s ustanovením rovnováhy mezi ztrátami a produkcí tepla. Centrálním orgánem, který reguluje tělesnou teplotu a funguje jako termostat, je přední hypotalamus. Regulace febrilní odpovědi organizmu je závislá na vyrovnanosti hladiny pyrogenů, jež vedou k elevaci teploty, a kryogenů, které naopak zabraňují její excesivní elevaci. Mezi nejznámější endogenní pyrogeny řadíme interleukiny (IL-6), interferon gamma (IFN - g), tumor necrosis factor (TNF-a) a další. TNF-a nejspíše zastává obě funkce, a to jak pyrogenní, tak kryogenní. Mezi kryogeny patří protizánětlivé cytokiny (např. IL-10), neuroendokrinní hormonálně aktivní látky, hormony (např. neuropeptid Y, bombesin) a další. Správné vybalancování těchto substancí určuje délku a trvání horečky [19–21].
Monitorace teploty v souvislosti s EPA
Horečka během porodu je definována jako zvýšení orální teploty ≥ 38 °C [22–24]. Otázkou je přesnost a adekvátnost měření, tedy zda zvolená metodika správně vyhodnocuje výsledek a reflektuje skutečnou teplotu lidského těla. Porovnáme-li různé způsoby měření tělesné teploty, orální měření lépe koreluje s intrauterinní teplotou a teplotou jádra oproti kožnímu způsobu monitorace.
Zaměňování a směšování hodnot centrální a periferní teploty je velmi častým problémem monitorace a sběru dat. Taktéž periferní teplota různých částí těla je odlišná. Orální monitoring může být ovlivněn hyperventilací rodičky během porodu [7], axilární teplota bývá typicky o 1–2 °C nižší než orální [25,26], oproti tomu vaginální teplota je po aplikaci epidurální analgezie většinou zvýšena probíhající vazodilatací v důsledku sympatektomie. Ačkoli se orální měření teploty nejeví jako velmi přesné a je často ovlivněno výše zmíněnou hyperventilací, většina publikovaných studií definuje horečku během porodu právě jako orální teplotu ≥ 38 °C [6,7,22–24]. Zcela zásadním problémem všech studií zabývajících se epidurální horečkou je otázka přesnosti a validity měření teploty. Jako vhodné řešení k vyhodnocení teplot, které se zdá být nejméně ovlivnitelné, a tudíž nejpřesnější, je např. monitorace teploty pomocí 3M Spot On systému, který kontinuálně zaznamenává teplotu pacientky pomocí jednorázového senzoru umístěného na jejím čele (obr. 1). Naměřené hodnoty odpovídají teplotě jádra a jsou srovnatelné s invazivními metodami, jako je detekce teploty plicním Schwan-Ganzovým katétrem. Ve srovnávací studii porovnávající 3M Spot On systém monitorování teploty s měřením provedeným pomocí katétrů zavedených do pulmonální arterie vykazoval systém 3M Spot On odchylku menší než 0,23 °C [27].
Fig. 1. Intrapartum temperature monitoring
via 3M Spot On system (photo
with the patient's consent).
Intrapartální horečka
Etiologie intrapartální horečky je stále neobjasněna, svůj podíl může mít konkomitantně probíhající intraamniální zánět, odtok plodové vody > 12 hod, náročnost probíhajícího porodu, počet vaginálních vyšetření atd. To vše může mít negativní vliv na teplotu rodičky během již tak fyziologicky náročného porodu [28–30]. Některé retrospektivní studie udávají incidenci mateřské horečky až okolo 7 % [31–33]. Towers et al publikovali v roce 2017 prospektivní kohortní studii, v níž analyzovali data 60 587 porodů > 36. gestační týden, kde horečka ≥ 38 °C byla zaznamenána u 412 rodiček (6,8 %; CI 95%; 6,2–7,5 %). Tyto výsledky jsou srovnatelné s dalšími dosud publikovanými studiemi [34]. Pokud je u rodičky zaznamenána orální teplota ≥ 38 °C, je v první řadě většinou pomýšleno na probíhající infekční komplikaci a ve velkém procentu je zahájena antibiotická terapie. Chorioamniitida se klinicky projevuje orální teplotou > 38 °C, tachykardií matky > 100/min, tachykardií plodu > 160/min, leukocytózou > 15 × 109/l, dráždivostí dělohy či zkalenou plodovou vodou [35]. Romero et al publikovali v roce 2015 studii, kde analyzovali plodovou vodu rodící ženy se stanovenou diagnózou chorioamniitidy, přičemž pouze u 61 % z nich byla prokázána mikrobiální příčina. Zbylých 39 % tedy není mikrobiálně podmíněno [36], je tudíž velmi obtížné rozlišit, zda tyto klinické projevy máme přisuzovat probíhajícímu zánětu plodových obalů nebo jen průběhu porodu, jejich kombinaci či jiné příčině [37]. Dle některých zdrojů se histologicky potvrzená chorioamniitida vyskytuje až u 57 % těhotenství, což je procentuálně mnohem více ve srovnání s prevalencí intrapartální horečky [38]. Jiné publikace udávají stejné zastoupení chorioamniitidy a intrapartální horečky, okolo 5–12 % [39–41]. Je známo, že horečka během porodu zvyšuje riziko neonatální encefalopatie, dětské mozkové obrny, nevysvětlitelných křečových stavů novorozenců, zvýšené dráždivosti až kómatu. Hypertermie vyvolává tzv. hypermetabolický stav, který může vést k poškození mozku novorozence, jehož teplota je až o 0,5 °C vyšší než u matky. Plod snižuje teplotu transplacentárně [37,42]. Hypertermie plodu vede ke zvýšené metabolické potřebě, a potažmo k hyperemii mozku, což vede ke zvýšené permeabilitě hematoencefalické bariéry a edému mozku plodu. To může vést k poškození a rozvoji perinatální asfyxie, která se stanovuje na základě čtyř kritérií:
- metabolická acidóza s pH < 7,2 z pupečníkové arterie;
- skóre dle Apgarové < 3 déle než 5 min;
- multiorgánové systémové postižení v časném neonatálním období;
- neurologické příznaky v časném novorozeneckém období.
Důsledkem těžké perinatální asfyxie je hypoxicko-ischemické orgánové poškození (HIE – hypoxic-ischemic encephalopathy). Dlouhodobými následky jsou pak dětská mozková obrna, mentální retardace a epilepsie. Známým rizikovým faktorem pro rozvoj neurobehaviorálních poruch, jako je autizmus, schizofrenie a další, je právě antepartální expozice plodu infekci. Dvě velké studie analyzovaly rizikové faktory s následkem rozvoje neonatální encefalopatie u termínových gravidit. Australian Case Control Study srovnala 164 novorozenců se střední až těžkou formou encefalopatie se 400 zdravými novorozenci, mateřská horečka byla asociována se zjištěnou neonatální encefalopatií (OR 3,82; 95% CI 1,44–10,12) s prevalencí 3,8/1 000 živě narozených dětí [43]. Impey et al publikovali v roce 2003 prospektivní kohortovou studii, kde prevalence vzniku encefalopatie byla 3,25/1 000 živě narozených děti (OR 10,8; 95% CI 4,0–29,3) [44]. Horečka je tedy jasným rizikovým faktorem jak pro matku, tak pro plod.
Epidurální horečka
Kauzálním vztahem mezi epidurální analgezií a intrapartální horečkou se zabývá řada studií. Epidurální analgezie se poprvé stala dostupnou metodou pro nastávající rodičky již v roce 1960 a postupně se dočkala celosvětového rozšíření [45]. První zmínka o existenci epidurální horečky se datuje do roku 1989 [5]. V Česku byla EPA do rutinní porodnické praxe zavedena na počátku 90. let prof. Pařízkem na Gynekologicko-porodnické klinice VFN v Praze (porodnice u Apolináře). Postupnou edukací anesteziologů a rozšířením této metody do většiny porodnic se ve vyspělých zemích zvýšil podíl epidurální analgezie u porodů až k 60 % (USA), v Británii 21 %, u nás pouze k 11 % [2,46]. Existují však velké rozdíly mezi jednotlivými porodnicemi, právě „u Apolináře“ je to např. až 55 %. I přes celosvětové rozšíření této metody je zajímavé, že dle publikace Kamakshiho et al panuje až u 55 % porodníků obava ze zvýšeného rizika císařského řezu, prodlouženého času porodu a vzniku intrapartální horečky po aplikaci epidurální analgezie [47,48]. Podle některých studií je právě až jedna třetina porodů spojena s výskytem epidurální horečky [20,22,49]. Další studie ale ukazují incidenci intrapartální horečky u žen s EPA mezi 11 a 14,5 %, zatímco u žen bez epidurální analgezie pouze 0,6–1 % [29,50]. Zda se EPA podílí na prodloužení 1. a 2. doby porodní, což potenciálně zvyšuje riziko vzniku horečky, je kontroverzní. Retrospektivní analýzy srovnávající délku porodu s/bez EPA se totiž nedokáží vyrovnat se základním faktem, že právě u déle probíhajících a komplikovanějších porodů je EPA daleko častěji aplikována než u rychlých a nekomplikovaných porodů. Proto i hodnocení vlivu EPA na vznik horečky pouze na základě retrospektivních dat je velmi problematické. Zatím ale neexistuje spolehlivá metoda k rozlišení mezi infekčním a neinfekčním původem horečky.
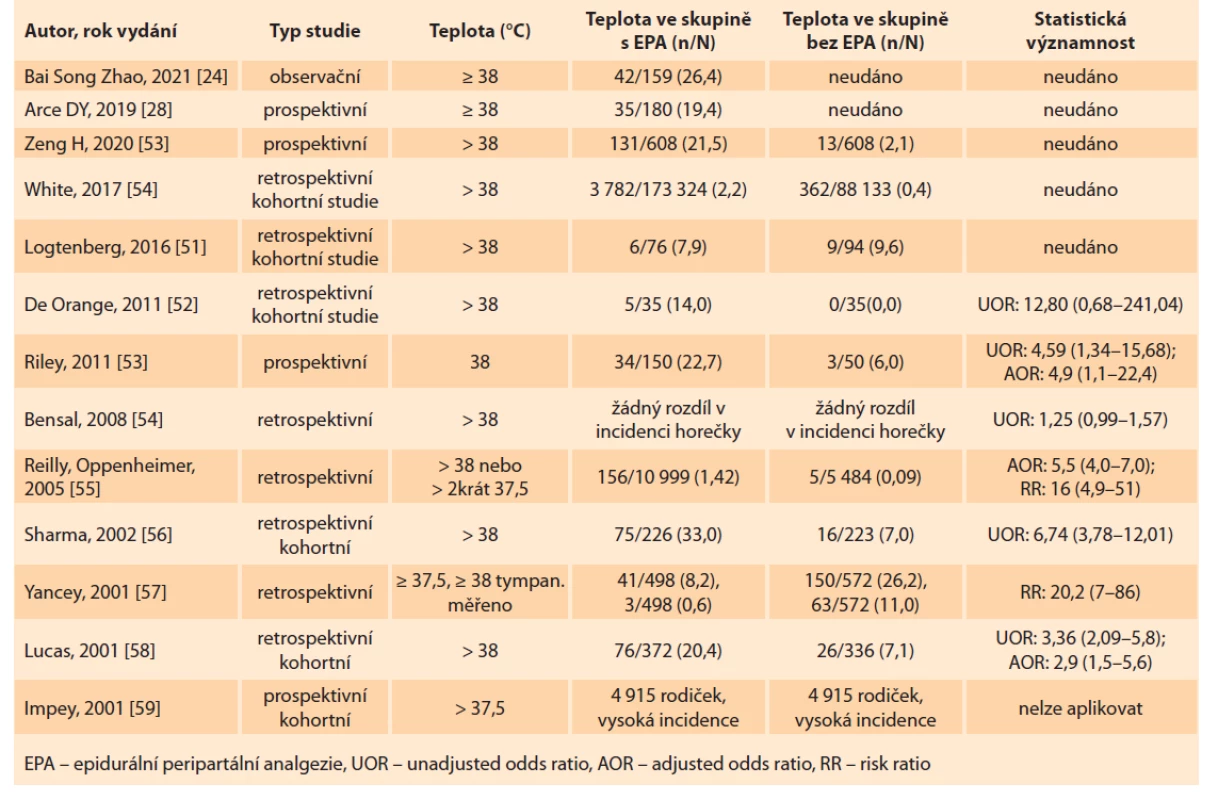
Vědci stále nenašli vysvětlení, proč k intrapartální horečce dochází. Spekuluje se o abnormalitách v termoregulaci či o sklonu některých těhotných žen k přílišné zánětlivé reakci. Také ani není jasné, jak této komplikaci předcházet. Výsledky studií zabývajících se právě touto problematikou jsou sporné, jelikož sběr dat a monitorace rodiček se liší (tab. 1) [24,18,50–59]. V roce 2018 Schmueli et al publikovali studii, kde analyzovali data 15 500 žen a zjistili jasné prodloužení 1. a 2. doby porodní po aplikaci EPA, což může vést k elevaci teploty a vzniku horečky [60]. Oproti této studii mluví Cochranova retrospektivní analýza dat, kde u 11 000 žen nezaznamenali žádný vliv epidurální analgezie na trvání 1. a 2. doby porodní [61]. Zeng et al retrospektivně zhodnotili data 2 310 žen, které rozdělili do epidurální (EA) a non-epidurální skupiny. Trvání 1. a 2. doby porodní bylo signifikantně delší u žen s EA, také vyšší spotřeba uterotonik k podpoře děložních kontrakcí a zastoupení horečky > 38 °C (p < 0,001; OR 12,57) byla právě v této skupině. Ze závěru vyplývá vliv epidurální analgezie na prodloužení trvání porodu. U rodiček s tímto typem analgezie mají novorozenci horší skóre dle Apgarové při narození (pH < 7,2 je signifikantně vyšší u novorozenců matek s EA) [62]. V roce 2019 se Arce et al zabývali možnou souvislostí mezi zvýšenými zánětlivými biomarkery (cytokiny) a epidurální horečkou. Analyzovali cytokiny 180 žen (např. IL-6, IL-10, IL-1B, TNF-a a C-reaktivní protein (CRP)). Předpokládali asociaci mezi výskytem epidurální horečky a vysokými hladinami těchto cytokinů před porodem. Výsledky studie tuto souvislost neprokázaly. Taktéž zaznamenali nižší výskyt pozitivit u streptokoka typu B (GBS) (p = 0,01) a delší dobu zavedení epidurálního katétru (10,1 hod u EA skupiny vs. 7,5 hod u non-EA skupiny; p = 0,01) [28]. Přesný dopad a vliv epidurální horečky na matku a plody je zatím neznámý. Kvalita všech studií a dat není dostatečná, bylo by potřeba větších retrospektivně kontrolovaných studií, které zkoumají spotřebu a užívání antibiotik a jejich vliv na prevenci vzniku mateřské/neonatální bakteriemie či sepse. Roku 2019 analyzovali Jansen a Lopriole 12 randomizovaných kontrolovaných studií (RCT – randomized conrol trial) a 16 observačních kohortních studií. U RCT bylo relativní riziko vzniku intrapartální horečky ve skupině s EPA 3,54 v porovnání se skupinou žen bez epidurální analgezie (95% CI2,61–4,81; p < 0,0001). U observačně kohortních studií bylo RR 5,60 (95% CI 4,50–6,97) [10]. Zatím není zcela objasněn vztah mezi epidurální analgezií, mateřskou horečkou a antibiotickou terapií novorozenců. Velká retrospektivní kohortní studie z roku 2016 ukázala, že matky s epidurální analgezií měly o 26 % vyšší pravděpodobnost podání antibiotické (ATB) terapie. Horečka se vyskytla u 2,2 % rodiček s EPA, zatímco u rodiček bez EPA to bylo pouze u 0,4 %. Ačkoli měly matky s EPA 5krát vyšší pravděpodobnost vzniku horečky, novorozenci byli léčeni ATB bez ohledu na to, zda měla matka EPA. To podporuje teorii, že EPA je rizikovým faktorem pro mateřskou horečku neinfekčního původu [63]. V roce 2001 analyzovali Kaul et al data 1 177 primipar a jejich novorozenců, 78 % (n = 922) žen s EPA a 22 % (n = 255) kontrol s intravenózní analgezií během porodu. U matek s EPA zaznamenali statisticky signifikantní vzestup mateřské teploty > 38 °C a současně 6 hod po porodu nezaznamenali žádný rozdíl teploty u novorozenců obou skupin matek. V této práci vyhodnocovali také procentuální výskyt sepse (sepsis work up rate) u matek s EPA a nebyla nalezena žádná souvislost mezi EPA a vznikem septického stavu matky [64]. Oproti této publikaci naopak vystupuje studie Goetzlové et al z roku 2001, kde ve stejné nemocnici provedli follow-up 1 934 porodů. Zjistili 3krát vyšší riziko vzniku sepse u novorozenců matek s EPA. Tyto různé výstupy dvou studií ze stejného pracoviště jistě svědčí o různém nastavení designu studií a o téměř nemožnosti porovnání těchto dvou prací, ačkoli pocházejí z jedné nemocnice. Taktéž hodnocení sepse není pediatry jasně standardizováno a definováno [65].
Tab. 1. Incidence of intrapartum fever with epidural analgesia.
Epidurální horečka má své značně negativní dopady i na novorozence, konkrétně častější podání ATB matce s horečkou. Celosvětově je dnes zaznamenán trend neustále se zvyšující spotřeby ATB u novorozenců, a to jak prenatálně, tak postnatálně. Novorozenci jsou dnes i více vystaveni invazivním procedurám (lumbální punkce, i.v. katetrizace), toxicitě léků a riziku delší hospitalizace. Alexandr et al uvedli, že užívání ATB déle než 10 dní porušuje střevní mikrobiom a zvyšuje až 3krát riziko vzniku nekrotizující enterokolitidy. Právě narušení střevního mikrobiomu může v pozdějším věku vést k rozvoji chronických atopií [66–68]. Dinsmoor et al uvedli, že kojící matky dlouhodobě vystavené podání ATB mají zvýšené riziko kandidózy prsu (12,7 % u žen s ATB terapií vs. 6,7 % u matek bez terapie; OR 2,1). Novorozenci měli taktéž zvýšený výskyt orální kandidózy, ačkoli u nich nebyl tento rozdíl statisticky významný. Neuvážené, nesprávně indikované a mnohdy zbytečné podání ATB nese jistě svá rizika [69].
Jasno není ani v otázce možné prevence epidurální horečky. Goetzlová et al publikovali dvojitě zaslepenou randomizovanou placebo kontrolovanou studii, kde byl ženám s EPA profylakticky podáván acetaminofen. Nezjistili žádný vliv acetaminofenu na její vznik. Incidence teploty > 38 °C byla téměř stejná u obou skupin (skupina s acetaminofenem vs. placebo skupina, 23,8 vs. 28 %; p = 1,0). Výskyt chorioamniitidy byl identický [70]. V další studii prováděné v USA bylo zkoumáno 200 primipar. Celkem 101 žen dostalo placebo, 50 žen užilo 25 mg metylprednisolonu à 8 hod a 49 žen dostávalo 100 mg metylprednisolonu à 4 hod. Ve skupině s placebem se horečka vyskytla u 21,8 % rodiček, ve skupině s nižší dávkou kortikosteroidů u 34 % a u rodiček s vysokými dávkami kortikosteroidů pouze u 2 %. U 9 % dětí byla po vysokých dávkách metylprednisolonu zjištěna bakteriemie. Po placebu se neobjevila vůbec a po nízkých dávkách jen ve 2 %. Kortikosteroidy tedy sice významně snižují riziko horečky, ale podněcují vznik neonatální asymptomatické bakteriemie [71]. Prevence vzniku horečky matky je jistě otázkou dalších studií.
Závěr
V současnosti je u peripartální horečky přítomnost chorioamniitidy rozhodujícím kritériem ovlivňujícím další postup léčby, což vede k nasazení ATB terapie. Další studie dané problematiky by ale mohly lépe zhodnotit možný vliv EPA na vznik horečky matky a novorozence, což by mohlo vést ke snížení nežádoucího podání ATB novorozencům. Maternální horečka, ať už infekčního, nebo neinfekčního původu, má velký klinický dopad na léčbu matky a novorozence. Je s otázkou, zda můžeme předcházet vzniku horečky, a tím snížit dopady ne vždy správně indikované ATB terapie. Pokud bychom nalezli odpověď na příčinu intrapartální horečky, mohli bychom snížit incidenci febrilií. V současné době probíhá na Gynekologicko-porodnické klinice VFN v Praze studie zaměřená na výskyt epidurální horečky u rodících žen. Tato studie je výjimečná sofistikovanou metodikou měření pomocí 3M Spot On systému. Mohla by přinést výsledky podporující, či vyvracející existenci epidurální horečky. Pokud se opravdu její existence potvrdí, pokusíme se objasnit, zda je tato asociace dána těhotenstvím či porodem. Tento vztah nebyl doposud zkoumán.
Doručeno/ Submitted: 18. 7. 2021
Přijato/ Accepted: 30. 8. 2021
MU Dr. Kristýna Hlinecká
Gynekologicko-porodnická klinika
1. LF UK a VFN v Praze
Apolinářská 18
128 00 Praha 2
Sources
1. Blaha J. Moderní způsoby porodní analgezie. Postgrad Med 2016; 18 (5): 480–486.
2. Blaha J, Stourac P, Grochova M et al. Labor analgesia in Czech Republic and Slovakia: a 2015 national survey. Int J Obstet Anesth 2018; 35 : 42–51. doi: 10.1016/j.ijoa.2018.04.001.
3. Šťourač P, Bláha J, Nosková P et al. Analgezie u porodu v České republice v roce 2011 z pohledu studie OBAAMA-CZ – prospektivní observační studie. Ceska Gynekol 2015; 80 (2): 127–134.
4. Segal S. Labor epidural analgesia and maternal fever. Anesth Analg 2010; 111 (6): 1467–1475. doi: 10.1213/ANE.0b013e3181f713d4.
5. Fusi L, Steer PJ, Maresh MJ et al. Maternal pyrexia associated with the use of epidural analgesia in labour. Lancet 1989; 1 (8649): 1250–1252. doi: 10.1016/s0140-6736 (89) 92341-6.
6. Herbst A, Wølner-Hanssen P, Ingemarsson I. Risk factors for fever in labor. Obstet Gynecol 1995; 86 (5): 790–794. doi: 10.1016/0029-7844 (95) 00254-o.
7. Lieberman E, Lang J, Richardson DK et al. Intrapartum maternal fever and neonatal outcome. Pediatrics 2000; 105 (1 Pt 1): 8–13. doi: 10.1542/peds.105.1.8.
8. Chan JJ, Dabas R, Han RN et al. Fever during labour epidural analgesia. Trends Anaesthesia Critical Care 2018; 20 : 21–25. doi: 10.1016/j.tacc.2018.04.014.
9. Lieberman E, Cohen A, Lang J et al. Maternal intrapartum temperature elevation as a risk factor for cesarean delivery and assisted vaginal delivery. Am J Public Health 1999; 89 (4): 506–510. doi: 10.2105/ajph.89.4.506.
10. Jansen S, Lopriore E, Naaktgeboren C et al. Epidural-related fever and maternal and neonatal morbidity: a systematic review and meta-analysis. Neonatology 2020; 117 (3): 259–270. doi: 10.1159/000504805.
11. Mackowiak PA, Wasserman SS, Levine MM. A critical appraisal of 98.6 degrees F, the upper limit of the normal body temperature, and other legacies of carl reinhold august wunderlich. JAMA 1992; 268 (12): 1578–1580. doi: 10.1001/jama.1992.03490120092034.
12. Wunderlich CA. On the temperature in diseases: a manual of medical thermometry. Oxford: New Sydenham Society 1871.
13. Obermeyer Z, Samra JK, Mullainathan S. Individual differences in normal body temperature: longitudinal big data analysis of patient records. Bmj 2017; 359: j5468. doi: 10.1136/bmj.j5468.
14. Callaway E. Not so hot: US data suggest human bodies are cooling down. Nature 2020; 577 (7790): 306. doi: 10.1038/d41586-020-00 074-9.
15. Ganong W. Přehled lékařské fyziologie. 20. vyd. Praha: Galén 2005 : 495, 890.
16. Javorka K. Lekárska fyziológia: učebnica pre lekárske fakulty. 1. vyd. Martin: Osveta 2001 : 337–346.
17. Varela M, Cuesta D, Madrid JA et al. Holter monitoring of central and peripheral temperature: possible uses and feasibility study in outpatient settings. J Clin Monit Comput 2009; 23 (4): 209–216. doi: 10.1007/s10877-009-9184-x.
18. O‘Grady NP, Barie PS, Bartlett JG et al. Guidelines for evaluation of new fever in critically ill adult patients: 2008 update from the American College of Critical Care Medicine and the Infectious Diseases Society of America. Crit Care Med 2008; 36 (4): 1330–1349. doi: 10.1097/CCM. 0b013e318169eda9.
19. Leon LR. Invited review: cytokine regulation of fever: studies using gene knockout mice. J Appl Physiol (1985) 2002; 92 (6): 2648–2655. doi: 10.1152/japplphysiol.01005.2001.
20. Tatro JB. Endogenous antipyretics. Clin Infect Dis 2000; 31 (Suppl 5): S190–S201. doi: 10.1086/317519.
21. Lim CL, Byrne C, Lee JK. Human thermoregulation and measurement of body temperature in exercise and clinical settings. Ann Acad Med Singap 2008; 37 (4): 347–353.
22. Sultan P, David AL, Fernando R et al. Inflammation and epidural-related maternal fever: proposed mechanisms. Anesth Analg 2016; 122 (5): 1546–1553. doi: 10.1213/ane.00000000000 01195.
23. Higgins RD, Saade G, Polin RA et al. Evaluation and management of women and newborns with a maternal diagnosis of chorioamnionitis: summary of a workshop. Obstet Gynecol 2016; 127 (3): 426–436. doi: 10.1097/aog.0000 000000001246.
24. Zhao BS, Li B, Wang QN et al. Time - and dose-dependent correlations between patient-controlled epidural analgesia and intrapartum maternal fever. BMC Anesthesiol 2021; 21 (1): 31. doi: 10.1186/s12871-021-01249-1.
25. Chan JJ. Fever during labour epidural analgesia. Trends Anaesthesia Critical Care 2018; 20 : 21–25. doi: 10.1016/j.tacc.2018.04.014.
26. Wartzek T, Mühlsteff J, Imhoff M. Temperature measurement. Biomed Tech (Berl) 2011; 56 (5): 241–257. doi: 10.1515/bmt.2011.108.
27. 3M SpotON. 2012 [online]. Available from: https: //multimedia.3m.com/mws/media/878163O/spoton-system-brochure.pdf.
28. Arce DY, Bellavia A, Cantonwine DE et al. Average and time-specific maternal prenatal inflammatory biomarkers and the risk of labor epidural associated fever. PLoS One 2019; 14 (11): e0222958. doi: 10.1371/journal.pone.0222958.
29. Lieberman E, Lang JM, Frigoletto F Jr et al. Epidural analgesia, intrapartum fever, and neonatal sepsis evaluation. Pediatrics 1997; 99 (3): 415–419. doi: 10.1542/peds.99.3.415.
30. Committee opinion no. 712: intrapartum management of intraamniotic infection. Obstet Gynecol 2017; 130 (2): e95–e101. doi: 10.1097/aog.0000000000002236.
31. Li CJ, Xia F, Xu SQ et al. Concerned topics of epidural labor analgesia: labor elongation and maternal pyrexia: a systematic review. Chin Med J (Engl) 2020; 133 (5): 597–605. doi: 10.1097/cm9.0000000000000646.
32. Alexander JM, McIntire DM, Leveno KJ. Chorioamnionitis and the prognosis for term infants. Obstet Gynecol 1999; 94 (2): 274–278. doi: 10.1016/s0029-7844 (99) 00256-2.
33. Wendel GD Jr, Leveno KJ, Sánchez PJ et al. Prevention of neonatal group B streptococcal disease: a combined intrapartum and neonatal protocol. Am J Obstet Gynecol 2002; 186 (4): 618–626. doi: 10.1067/mob.2002.122970.
34. Towers CV, Yates A, Zite N et al. Incidence of fever in labor and risk of neonatal sepsis. Am J Obstet Gynecol 2017; 216 (6): 596.e1–596.e5. doi: 10.1016/j.ajog.2017.02.022.
35. Tita AT, Andrews WW. Diagnosis and management of clinical chorioamnionitis. Clin Perinatol 2010; 37 (2): 339–354. doi: 10.1016/j.clp.2010.02.003.
36. Romero R, Miranda J, Kusanovic JP et al. Clinical chorioamnionitis at term I: microbiology of the amniotic cavity using cultivation and molecular techniques. J Perinat Med 2015; 43 (1): 19–36. doi: 10.1515/jpm-2014-0249.
37. Kasdorf E, Perlman JM. Hyperthermia, inflammation, and perinatal brain injury. Pediatr Neurol 2013; 49 (1): 8–14. doi: 10.1016/j.pediatrneurol.2012.12.026.
38. Curtin WM, Katzman PJ, Florescue H et al. Intrapartum fever, epidural analgesia and histologic chorioamnionitis. J Perinatol 2015; 35 (6): 396–400. doi: 10.1038/jp.2014.235.
39. Newton ER, Prihoda TJ, Gibbs RS. Logistic regression analysis of risk factors for intra-amniotic infection. Obstet Gynecol 1989; 73 (4): 571–575.
40. Sperling RS, Ramamurthy RS, Gibbs RS. A comparison of intrapartum versus immediate postpartum treatment of intra-amniotic infection. Obstet Gynecol 1987; 70 (6): 861–865.
41. Gibbs RS, Dinsmoor MJ, Newton ER et al. A randomized trial of intrapartum versus immediate postpartum treatment of women with intra-amniotic infection. Obstet Gynecol 1988; 72 (6): 823–828. doi: 10.1097/00006250-198812000-00001.
42. Baumgart S. Iatrogenic hyperthermia and hypothermia in the neonate. Clin Perinatol 2008; 35 (1): 183–197. doi: 10.1016/j.clp.2007.11.002.
43. Badawi N, Kurinczuk JJ, Keogh JM et al. Antepartum risk factors for newborn encephalopathy: the Western Australian case-control study. BMJ 1998; 317 (7172): 1549–1553. doi: 10.1136/bmj.317.7172.1549.
44. Impey L, Greenwood C, MacQuillan K et al. Fever in labour and neonatal encephalopathy: a prospective cohort study. BJOG 2001; 108 (6): 594–597. doi: 10.1111/j.1471-0528.2001.00145.x.
45. Kandel PF, Spoerel WE, Kinch RA. Continuous epidural analgesia for labour and delivery: review of 1.000 cases. Can Med Assoc J 1966; 95 (19): 947–953.
46. Department of health 2005 NHS maternity statistics, England: 2003–2004. Statistical bulletin 2005/10. London: Department of Health 2005.
47. Kamakshi G, Anju G, Tania S et al. Epidural analgesia during labor: attitudes among expectant mothers and their care providers. Anesth Essays Res 2018; 12 (2): 501–505. doi: 10.4103/aer.AER_48_18.
48. Gurung P, Malla S, Lama S et al. Caesarean section during second stage of labor in a tertiary centre. J Nepal Health Res Counc 2017; 15 (2): 178–181. doi: 10.3126/jnhrc.v15i2.18210.
49. Greenwell EA, Wyshak G, Ringer SA et al. Intrapartum temperature elevation, epidural use, and adverse outcome in term infants. Pediatrics 2012; 129 (2): e447–e454. doi: 10.1542/peds. 2010-2301.
50. Yancey MK, Zhang J, Schwarz J et al. Labor epidural analgesia and intrapartum maternal hyperthermia. Obstet Gynecol 2001; 98 (5 Pt 1): 763–770. doi: 10.1016/s0029-7844 (01) 01537-x.
51. Logtenberg S, Oude Rengerink K, Verhoe-ven CJ et al. Labour pain with remifentanil patient-controlled analgesia versus epidural analgesia: a randomised equivalence trial. BJOG 2017; 124 (4): 652–660. doi: 10.1111/1471-0528.14181.
52. de Orange FA, Passini R Jr, Amorim MM et al. Combined spinal and epidural anaesthesia and maternal intrapartum temperature during vaginal delivery: a randomized clinical trial. Br J Anaesth 2011; 107 (5): 762–768. doi: 10.1093/bja/aer218.
53. Riley LE, Celi AC, Onderdonk AB et al. Association of epidural-related fever and noninfectious inflammation in term labor. Obstet Gynecol 2011; 117 (3): 588–595. doi: 10.1097/AOG.0b013e31820b0503.
54. Bensal A, Weintraub AY, Levy A et al. The significance of peripartum fever in women undergoing vaginal deliveries. Am J Perinatol 2008; 25 (9): 567–572. doi: 10.1055/s-0028-1085624.
55. Reilly DR, Oppenheimer LW. Fever in term labour. J Obstet Gynaecol Can 2005; 27 (3): 218–223. doi: 10.1016/s1701-2163 (16) 30513-8.
56. Zhang TN, Wu QJ, Liu YS et al. Environmental risk factors and congenital heart disease: an umbrella review of 165 systematic reviews and meta-analyses with more than 120 million participants. Front Cardiovasc Med 2021; 8 : 640729. doi: 10.3389/fcvm.2021.640729.
57. Sharma SK, Alexander JM, Messick G et al. Cesarean delivery: a randomized trial of epidural analgesia versus intravenous meperidine analgesia during labor in nulliparous women. Anesthesiology 2002; 96 (3): 546–551. doi: 10.1097/00000542-200203000-00007.
58. Lucas MJ, Sharma SK, McIntire DD et al. A randomized trial of labor analgesia in women with pregnancy-induced hypertension. Am J Obstet Gynecol 2001; 185 (4): 970–975. doi: 10.1067/mob.2001.117970.
59. Impey LW, Greenwood CE, Black RS et al. The relationship between intrapartum maternal fever and neonatal acidosis as risk factors for neonatal encephalopathy. Am J Obstet Gynecol 2008; 198 (1): 49.e1–49.e6. doi: 10.1016/j.ajog.2007.06.011.
60. Shmueli A, Salman L, Orbach-Zinger S et al. The impact of epidural analgesia on the duration of the second stage of labor. Birth 2018; 45 (4): 377–384. doi: 10.1111/birt.12355.
61. Anim-Somuah M, Smyth RM, Cyna AM et al. Epidural versus non-epidural or no analgesia for pain management in labour. Cochrane Database Syst Rev 2018; 5 (5): CD000331. doi: 10.1002/14651858.CD000331.pub4.
62. Zeng H, Guo F, Lin B et al. The effects of epidural analgesia using low-concentration local anesthetic during the entire labor on maternal and neonatal outcomes: a prospective group study. Arch Gynecol Obstet 2020; 301 (5): 1153–1158. doi: 10.1007/s00404-020-05511-8.
63. White A, Olson D, Messacar K. A state-wide assessment of the association between epidural analgesia, maternal fever and neonatal antibiotics in Colorado, 2007–2012. Arch Dis Child Fetal Neonatal Ed 2017; 102 (2): F120–F125. doi: 10.1136/archdischild-2015-309985.
64. Kaul B, Vallejo M, Ramanathan S et al. Epidural labor analgesia and neonatal sepsis evaluation rate: a quality improvement study. Anesth Analg 2001; 93 (4): 986–990. doi: 10.1097/00000539-200110000-00038.
65. Goetzl L, Cohen A, Frigoletto F Jr et al. Maternal epidural use and neonatal sepsis evaluation in afebrile mothers. Pediatrics 2001; 108 (5): 1099–1102. doi: 10.1542/peds.108.5.1099.
66. Alexander VN, Northrup V, Bizzarro MJ. Antibiotic exposure in the newborn intensive care unit and the risk of necrotizing enterocolitis. J Pediatr 2011; 159 (3): 392–397. doi: 10.1016/j.jpeds.2011.02.035.
67. Penders J, Thijs C, Vink C et al. Factors influencing the composition of the intestinal microbiota in early infancy. Pediatrics 2006; 118 (2): 511–521. doi: 10.1542/peds.2005-2824.
68. Tanaka S, Kobayashi T, Songjinda P et al. Influence of antibiotic exposure in the early postnatal period on the development of intestinal microbiota. FEMS Immunol Med Microbiol 2009; 56 (1): 80–87. doi: 10.1111/j.1574-695X.2009.00553.x.
69. Dinsmoor MJ, Viloria R, Lief L et al. Use of intrapartum antibiotics and the incidence of postnatal maternal and neonatal yeast infections. Obstet Gynecol 2005; 106 (1): 19–22. doi: 10.1097/01.AOG.0000164049.12159.bd.
70. Goetzl L, Rivers J, Evans T et al. Prophylactic acetaminophen does not prevent epidural fever in nulliparous women: a double-blind placebo-controlled trial. J Perinatol 2004; 24 (8): 471–475. doi: 10.1038/sj.jp.7211128.
71. Goetzl L, Zighelboim I, Badell M et al. Maternal corticosteroids to prevent intrauterine exposure to hyperthermia and inflammation: a randomized, double-blind, placebo-controlled trial. Am J Obstet Gynecol 2006; 195 (4) : 1031–1037. doi: 10.1016/ j.ajog.2006.06.012.
Labels
Paediatric gynaecology Gynaecology and obstetrics Reproduction medicineArticle was published in
Czech Gynaecology

2021 Issue 5
-
All articles in this issue
- Udělení čestného členství České gynekologické a porodnické společnosti ČLS JEP
- Perinatologické výsledky u těhotenství komplikovaných eklampsií – analýza případů z let 2008–2018
- Porovnání kvality života žen podstupujících farmakologické a chirurgické ukončení gravidity na vlastní žádost
- Do vody, nebo na souši? Hodnocení porodnických a neonatologických výsledků porodů do vody u nízkorizikových rodiček
- Těhotenství žen s diabetes mellitus 1. typu – vliv prekoncepční přípravy na perinatální výsledky. Deset let zkušeností
- Pigmentované léze vulvy – přehledová práce a kazuistika zaměřená na pigmentovaný bazocelulární karcinom
- Cushingův syndrom vyvolaný adrenálním adenomem v těhotenství
- Mozková žilní trombóza po císařském řezu
- Konzervatívne možnosti ovplyvnenia syndrómu PCOS – význam výživy
- Endokanabinoidy a těhotenství
- Epidurální horečka
- Tržná rána dělohy – vzácný případ poporodní hemoperitonea
- Czech Gynaecology
- Journal archive
- Current issue
- About the journal
Most read in this issue
- Těhotenství žen s diabetes mellitus 1. typu – vliv prekoncepční přípravy na perinatální výsledky. Deset let zkušeností
- Pigmentované léze vulvy – přehledová práce a kazuistika zaměřená na pigmentovaný bazocelulární karcinom
- Do vody, nebo na souši? Hodnocení porodnických a neonatologických výsledků porodů do vody u nízkorizikových rodiček
- Konzervatívne možnosti ovplyvnenia syndrómu PCOS – význam výživy
